Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Institut de chimie des milieux et matériaux de Poitiers - IC2MP (Diplôme National - Arrêté du 25 mai 2016)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Chimie organique, minérale, industrielle
Présentée par :
Céline Tisseraud
Origine et impact de la synergie Cu-ZnO sur l hydrogénation catalytique du CO2 en méthanol
Directeur(s) de Thèse : Yannick Pouilloux, Anthony Le Valant Soutenue le 23 novembre 2016 devant le jury Jury :
Président Florence Epron Directrice de recherche CNRS, Université de Poitiers Rapporteur Marco Daturi Professeur des Universités, Université de Caen Rapporteur Andrei Khodakov Directeur de recherche CNRS, Université de Lille 1 Membre Yannick Pouilloux Professeur des Universités, Université de Poitiers Membre Anthony Le Valant Maître de conférences, Université de Poitiers Membre Sébastien Thomas Maître de conférences, Université de Strasbourg
Pour citer cette thèse :
Céline Tisseraud. Origine et impact de la synergie Cu-ZnO sur l hydrogénation catalytique du CO2 en méthanol [En ligne]. Thèse Chimie organique, minérale, industrielle. Poitiers : Université de Poitiers, 2016. Disponible sur Internet <http://theses.univ-poitiers.fr>
Pour l’obtention du grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
Faculté des Sciences Fondamentales et Appliquées (Diplôme National - Arrêté du 7 août 2006)
Ecole Doctorale : Gay Lussac, Sciences pour l’environnement Secteur de Recherche : Chimie Organique, Minérale, Industrielle
Présentée par :
Céline TISSERAUD
************************Origine et impact de la synergie Cu-
ZnO sur l’hydrogénation catalytique
du CO
2en méthanol
************************ Directeur de Thèse :
Yannick POUILLOUX, Professeur, Université de Poitiers
Co-directeur de Thèse :
Anthony LE VALANT, Maître de conférences, Université de Poitiers
************************
Soutenance prévue le βγ Novembre β016 devant la commission d’examen ************************
JURY
Rapporteurs : Marco Daturi, Professeur, Université de Caen
Andrei Khodakov, Directeur de Recherche CNRS, Université de Lille
Examinateurs : Florence Epron, Directrice de Recherche CNRS, Université de Poitiers
Sébastien Thomas, Maître de conférences-HDR Université de Strasbourg Anthony Le Valant, Maître de conférences, Université de Poitiers
Je tiens tout d’abord à remercier madame Sabine Petit directrice de l’IC2MP de m’avoir accueillie au sein de son laboratoire.
Je tiens à exprimer ma profonde gratitude à messieurs Yannick Pouilloux et Anthony Le Valant pour leur accueil au sein de leur équipe et pour leur encadrement et leurs nombreux conseils lors de cette thèse, je n’oublie pas monsieur Clément Comminges qui a fait partie à part entière de ce travail.
Je remercie particulièrement madame Florence Epron pour son accueil au sein de l’équipe SAMCat et d’avoir acceptéd’être la présidente de mon jury de thèse.
Je tiens à remercier messieurs Marco Daturi et Andrei Khodakov d’avoir accepté d’être
rapporteurs de mon travail de thèse, et monsieur Sébastien Thomas d’avoir été examinateur
de mon travail.
Je tiens également à remercier l’ensemble de l’équipe chimie SFA et plus particulièrement
Sébastien Laforge et Catherine Especel pour leurs conseils et leur disponibilité dans le cadre
de mes charges d’enseignements.
Je tiens à remercier l’ensemble des personnes qui ont contribuées à ce projet : Sandrine Arii-Clacens, Stéphane Pronier, Lilian Elloy, Julien Nicolaï et Christine Canaff pour leurs
compétences scientifiques mais également pour leur sympathie et leur disponibilité. J’associe également Michel Chauveau pour ses compétences techniques et sans qui le travail au hall aurait été bien plus laborieux.
Je tiens aussi à remercier tout spécialement Lilian Olivet pour avoir permis de poursuivre le travail, mais aussi pour sa sympathie et ses encouragements lors de la difficile phase de la
thèse qu’est la rédaction….
J’adresse mes remerciements à toutes les personnes que j’ai pu côtoyer lors de ces trois
années : Jérôme Mijoin, Jean-Dominique Comparot, Ludovic Pinard, Mehrad Tarighi, Corinne Rouil, Emmanuel Beauchene, Thomas Belin, Isabelle Batonneau-Gener et Samuel
Mignard. Et plus généralement, l’ensemble de l’équipe SAMCat. Je n’oublie pas non plus les étudiants que j’ai pu côtoyer pour les discussions scientifiques mais pas que …. Ceux qui m’ont montré la voie : Soumaya Hamieh, Kevin Louis, Joakim Krou, Zeinab Ezzedine, Joseph Bassil, Modibo Mounguengui, Francis N Goye, Amir Astafan et Davina Messou. Mais
également ceux dont la route est encore plus ou moins longue jusqu’à la quête du graal : Mira Raad, Hussein Sammoury, Hussein Issa, Jérémie Huynh. Je remercie également les nombreux stagiaires et post-doc que j’ai pu croiser je pense notamment à Nourrdine, Rima, Leane, Louai, Cristian, Ruben, Fariba… je ne saurais faire une liste exhaustive.
Enfin, je tiens à remercier ma famille qui a toujours été là pour me soutenir et m’encourager depuis de nombreuses années. Je ne saurais oublier Julien, toujours à mes côtés à me
Chapitre I :
Étude Bibliographique ... 7
I-Contexte de l’étude ... 9
I-1 Demande en énergie fossile et renouvelable ... 9
I-β Conséquences de cette consommation d’énergie ... 10
I-3 Origines et conséquences des émissions du CO2 ... 11
I-4 Solution pour limiter les émissions de CO2 ... 12
I-4-1 Solutions préventives ... 13
I-4-2 Solutions curatives ... 13
II-Voies de valorisation du CO2 ... 14
III-Hydrogénation catalytique du CO2 ... 15
III-1 Origine des réactifs utilisés ... 15
III-1-1 L’hydrogène ... 15
III-1-2 Le Dioxyde de Carbone (CO2) ... 16
III-β Produits de l’hydrogénation du CO2 ... 17
IV-Synthèse du méthanol ... 18
IV-1 Intérêt du méthanol ... 18
IV-2 Production du méthanol par hydrogénation du CO2 ... 19
IV-2-1 Réactions mises en jeu dans la synthèse du méthanol ... 19
IV-2-2 Conditions favorables à la formation du méthanol ... 20
V-Catalyseurs utilisés pour la synthèse du méthanol ... 20
V-1 Influence de la préparation des catalyseurs Cu/ZnO ... 21
V-2 Nature du site actif ... 24
V-3 Mécanisme réactionnel ... 29
VI-Dopants améliorant les performances du catalyseur ... 32
VII-Conclusion et objectifs ... 32
Chapitre II :
Partie expérimentale ... 41
I-Préparation des catalyseurs ... 43
I-1 Préparation des oxydes de références pour l’étude des mélanges mécaniques ... 43
I-5 Préparation des nano-cœur-coquilles Cu@ZnOx/ZnO ... 44
II-Caractérisations ... 45
II-1 Analyse par spectrométrie plasma à couplage inductif (ICP-OES) ... 45
II-2 Diffraction de Rayons X in-situ ... 45
II-3 Microscopie Électronique en Transmission (MET) ... 47
II-4 Chimisorption pulsée des réactifs H2 et CO2 ... 48
III-Test catalytique : Hydrogénation du CO2 ... 49
III-1 Conditions standard ... 49
III-2 Appareillage ... 50
III-3 Analyse des réactifs et des produits ... 51
III-4 Exploitation des résultats ... 52
Chapitre III :
Étude de mélanges mécaniques Cu+ZnO sur
l’hydrogénation du CO
2en méthanol ... 55
I-Introduction ... 57
II-Analyse élémentaire ... 58
III-Synthèse du méthanol ... 59
IV-Caractérisation de la structure et de la morphologie des catalyseurs ... 60
IV-1 Tailles des particules, surface métallique et migration des mélanges mécaniques . 60 IV-2 Morphologie du catalyseur et migration ... 67
IV-3 Chimisorption du CO2 et de H2 ... 72
IV-4 Modèle de quantification des sphères en contact ... 74
V-Conclusion ... 81
Chapitre IV :
Étude de catalyseurs coprécipités Cu-ZnO sur
l’hydrogénation du CO
2en méthanol ... 85
I-Introduction ... 87
II-Analyse élémentaire ... 87
IV-2 Morphologie des catalyseurs ... 95
IV-3 Chimisorption du CO2 et de H2 ... 97
V-Modèle de quantification des contacts dans un mélange polydisperse aléatoire. ... 102
V-1 Modèle de Dodds ... 103
V-β Géométrie et statistique d’un milieu granulaire aléatoire polydisperse ... 104
V-3 Description du processus itératif (méthode de Newton-Raphson) ... 109
V-4 Application du modèle sur la série de catalyseurs coprécipités ... 110
VI-Conclusion ... 112
Chapitre V :
Étude de catalyseurs cœur-coquilles Cu@ZnO
xsur
l’hydrogénation du CO
2en méthanol ... 117
I-Introduction ... 119
II-Analyse Élémentaire ... 119
III-Synthèse du méthanol ... 120
IV-Caractérisations structurales et morphologiques ... 121
IV-1 Phénomène de migration ... 121
IV-2 Morphologie des catalyseurs ... 123
IV-3 Chimisorption de CO2 et de H2 ... 125
V-Modèle mathématique (impact de la composition sur la migration du zinc) ... 128
VI-Conclusion ... 132
Chapitre VI :
Du site actif au matériau catalytique ... 135
I- Relation design-activité des catalyseurs pour la production de méthanol ... 137
II-Amélioration des performances catalytiques des systèmes cœur-coquilles ... 140
Conclusion générale et perspectives ... 147
Liste des abréviations
DRX Diffractométrie de Rayons X
EDX Energy Dispersive X-Ray
FID Flame Ionisation Detector
Gtep Gigatonnes équivalent pétrole
HFC HydroFluoroCarbones
ICDD International Center of Diffraction Data
ICP-OES Inductively Coupled Plasma-Optical Emission Spectroscopy
MET Microscopie Électronique en Transmission
MTO Methanol To Olefins
NC Nombre de Contacts
NCmax Nombre de Contacts maximum
PDF Powder Diffraction File
PFC PolyFluoroCarbones
RWGS Reverse Water Gas Shift
TCD Thermal Conductivity Detector
TOF TurnOver Frequency
TPR Temperature Programmed Reduction
u.a unité-arbitraire
1
3
Diminuer les émissions du CO2 anthropique, principal gaz à effet de serre, constitue un
des enjeux majeurs du début de ce siècle. Actuellement, de nombreuses recherches sont consacrées au captage et au stockage du CO2, cependant une question subsiste sur le devenir de
cette nouvelle source de carbone a priori abondante. Parmi les voies de valorisation du CO2,
l’hydrogénation catalytique en molécule facilement valorisable, telle que le méthanol est considérée comme l’une des solutions les plus prometteuses. En effet, cet alcool est une molécule plateforme clé utilisée par les secteurs de la pétrochimie et de la chimie, pour la synthèse de carburants et de composés intermédiaires valorisables. De plus, le recyclage du CO2 et l’utilisation de l’hydrogène issu de l’énergie solaire, de l’hydroélectricité ou de la
biomasse font de l’hydrogénation catalytique du CO2 un procédé vert.
L’hydrogénation du CO2en méthanol nécessite l’utilisation d’un catalyseur, à base de
cuivre, d’oxyde zinc et d’alumine (synthétisé par coprécipitation). La synthèse du méthanol à partir du CO2a fait l’objet de nombreuses études dans la littérature. Les résultats obtenus sur
des catalyseurs de type CuZnO/support ont démontré que cette réaction n’est pas aussi simple qu’elle y paraissait. Il existe encore beaucoup de controverses et d’interrogations sur la nature des sites actifs du catalyseur et sur les différentes étapes réactionnelles mises en jeu lors de la synthèse (la synthèse du méthanol s’accompagne d’une large production de CO). Au début de ce travail, trois hypothèses étaient proposées dans la littérature pour expliquer l’effet de synergie entre le Cu et le ZnO responsable de la formation du méthanol :
i) un effet de mouillage qui favorise l’accès de plans cristallins bien spécifiques du cuivre métallique [1, 2] ;
ii) la formation d’un site actif que ce soit un alliage CuZn, une espèce lacunaire en oxygène ZnOx ou une décoration de zinc autour du cuivre [3–6] ;
iii) la formation d’un réservoir à hydrogène à la surface du ZnO qui permet d’alimenter le Cu0 en hydrogène [7–9].
L’objectif de ce travail est d’apporter des éléments de compréhension sur la nature de l’interaction entre le cuivre et le ZnO qui régit la réaction de synthèse du méthanol. Pour cela, seuls des systèmes binaires modèles Cu-ZnO seront étudiés afin de de mieux comprendre l’effet de synergie entre les deux composants et d’éviter toute perturbation liée à la présence d’un support tel que l’alumine. Ce travail a également pour but de mettre au point un catalyseur qui favorisera la sélectivité en méthanol.
4
Le premier chapitre de ce manuscrit est consacré à la présentation du contexte économique et environnemental de cette étude, ainsi qu’à un bilan des connaissances acquises par la communauté scientifique sur la synthèse du méthanol et la nature de la synergie des catalyseurs à base de cuivre et de ZnO au début de cette étude.
Le deuxième chapitre se consacre aux descriptions des synthèses utilisées pour la préparation des catalyseurs, à la présentation des différentes méthodes de caractérisation utilisées dans ce chapitre. Enfin, une description du montage expérimental permettant de tester les matériaux sur la réaction d’hydrogénation du CO2 en méthanol sera réalisée.
Le troisième chapitre porte sur l’étude de plusieurs catalyseurs modèles préparés par mélange mécanique de type Cu+ZnO. Ces catalyseurs ont été testés sur la réaction d’hydrogénation du CO2 en méthanol, puis caractérisés afin de décrire le site responsable de la
formation du méthanol. Cette étude expérimentale sera accompagnée d’un modèle mathématique qui fait le lien entre les contacts présents au sein des catalyseurs et leur activité.
Ensuite, le quatrième chapitre se focalise sur une série de catalyseurs de type Cu-ZnO préparés par coprécipitation afin de se rapprocher des catalyseurs utilisés dans l’industrie. L’étude suivra la même démarche que celle utilisée dans le chapitre III.
Le cinquième chapitre, présente les résultats obtenus pour des catalyseurs cœur-coquilles (Cu@ZnOx) dont les caractéristiques morphologiques sont favorables à la formation
du méthanol et à l’inhibition des sites responsables de la formation du CO d’après les conclusions obtenues avec les deux chapitres précédents.
Le dernier chapitre fait une comparaison des différents designs de catalyseur étudiés dans ce travail et un bilan des informations obtenues sur les caractéristiques du site responsable de la formation du méthanol. Enfin il présentera un catalyseur permettant d’améliorer les performances catalytiques d’un catalyseur de type cœur-coquille.
Enfin une conclusion présentera les résultats majeurs obtenus lors de ce travail de thèse et sera accompagnée de quelques perspectives qui peuvent être données à ce travail.
5
Références Bibliographiques
[1] P. L. Hansen, J. B. Wagner, S. Helveg, J. R. Rostrup-Nielsen, B. S. Clausen, et H. Topsøe, « Atom-Resolved Imaging of Dynamic Shape Changes in Supported Copper Nanocrystals », Science, vol. 295, no 5562, p. 2053-2055, mars 2002.
[2] J. D. Grunwaldt, A. M. Molenbroek, N. Y. Topsoe, H. Topsoe, et B. S. Clausen, « In Situ Investigations of Structural Changes in Cu/ZnO Catalysts », J. Catal., vol. 194, no 2, p. 452-460, 2000.
[3] I. Kasatkin, P. Kurr, B. Kniep, A. Trunschke, et R. Schlögl, « Role of Lattice Strain and Defects in Copper Particles on the Activity of Cu/ZnO/Al2O3 Catalysts for Methanol Synthesis », Angew. Chem. Int. Ed., vol. 46, no 38, p. 7324-7327, sept. 2007.
[4] Y. Kanai, T. Watanabe, T. Fujitani, T. Uchijima, et J. Nakamura, « The synergy between Cu and ZnO in methanol synthesis catalysts », Catal. Lett., vol. 38, no 3-4, p. 157-163, sept. 1996.
[5] M. Behrens, F. Studt, I. Kasatkin, S. Kühl, M. Hävecker, F. Abild-Pedersen, S. Zander, F. Girgsdies, P. Kurr, B.-L. Kniep, M. Tovar, R. W. Fischer, J. K. Nørskov, et R. Schlögl, « The Active Site of Methanol Synthesis over Cu/ZnO/Al2O3 Industrial Catalysts », Science, vol. 336, no 6083, p. 893-897, mai 2012.
[6] S. Kuld, C. Conradsen, P. G. Moses, I. Chorkendorff, et J. Sehested, « Quantification of Zinc Atoms in a Surface Alloy on Copper in an Industrial-Type Methanol Synthesis Catalyst », Angew. Chem. Int. Ed., vol. 53, no 23, p. 5941-5945, juin 2014.
[7] M. S. Spencer, « The role of zinc oxide in Cu/ZnO catalysts for methanol synthesis and the water-gas shift reaction », Top. Catal., vol. 8, p. 259-266, 1999.
[8] M. S. Spencer, « Gas-phase Transport of Hydrogen Atoms in Methanol Synthesis over Copper/Zinc Oxide Catalysts », J. Chem. Soc. Faraday Trans., vol. 86, p. 3151-3152, 1990. [9] P. R. Dennison, K. J. Packer, et M. . pencer, « 1H and 13C Nuclear Magnetic
Resonance Investigations of the Cu/Zn/Al Oxide Methanol-synthesis Catalyst », J. Chem. Soc. Faraday Trans. 1 Phys. Chem. Condens. Phases, vol. 85, no 10, p. 3537-3560, 1989.
7
Chapitre I :
Étude Bibliographique
Ce chapitre a pour objectif, dans un premier temps, de présenter le contexte économique et les problèmes de pollution liés à la consommation d’énergies fossiles, différentes solutions à ce problème sont également décrites. L’hydrogénation du CO2 en méthanol qui est une des voies
de valorisation de ce principal gaz à effet de serre sera étudiée dans un deuxième temps. Ce chapitre ciblera notamment les connaissances actuelles sur le catalyseur à base de cuivre et
d’oxyde de zinc utilisé lors de cette réaction. La recherche sur ce sujet étant actuellement très
active, c’est de manière volontaire que les données présentées dans ce chapitre proviennent de
8
Table des matières
I-Contexte de l’étude ... 9
I-1 Demande en énergie fossile et renouvelable ... 9
I-β Conséquences de cette consommation d’énergie ... 10
I-3 Origines et conséquences des émissions du CO2 ... 11
I-4 Solution pour limiter les émissions de CO2 ... 12
I-4-1 Solutions préventives ... 13
I-4-2 Solutions curatives ... 13
II-Voies de valorisation du CO2 ... 14
III-Hydrogénation catalytique du CO2 ... 15
III-1 Origine des réactifs utilisés ... 15
III-1-1 L’hydrogène ... 15
III-1-2 Le Dioxyde de Carbone (CO2) ... 16
III-β Produits de l’hydrogénation du CO2 ... 17
IV-Synthèse du méthanol ... 18
IV-1 Intérêt du méthanol ... 18
IV-2 Moyens de production du méthanol ... 19
IV-2-1 Réactions mises en jeu dans la synthèse du méthanol ... 19
IV-2-2 Conditions favorables à la formation du méthanol ... 20
V-Catalyseurs utilisés pour la synthèse du méthanol ... 20
V-1 Influence de la préparation des catalyseurs Cu/ZnO ... 21
V-2 Nature du site actif ... 24
V-3 Mécanisme réactionnel ... 29
VI-Dopants améliorant les performances du catalyseur ... 32
9
I-C
ontexte de l’étude
I-1 Demande en énergie fossile et renouvelable
La demande en énergie à l’échelle planétaire n’a cessé d’augmenter ces dernières décennies. En effet, au moment du premier choc pétrolier en 1973, la consommation mondiale d’énergie s’élevait à 6,1 Gtep (Giga tonnes équivalent pétrole). Quatre décennies plus tard, en 2011, cette consommation avait atteint 13,1 Gtep [1]. Sur la période comprise entre les années 1990 et 2011, cette demande en énergie primaire a augmenté de 1,9% par an. Cette hausse de la demande énergétique n’est pas homogène à la surface du globe. En effet, l’augmentation est plus importante dans les pays en voie de développement (5,5%/an au moyen orient, 4,2%/an en Inde…) que dans l’Union Européenne par exemple où l’augmentation n’est que de 0,1%/an. Cette tendance à l’augmentation devrait se prolonger au moins jusqu’en β0γ0, mais à un rythme moins soutenu [2].
*cette catégorie inclut : la géothermie, l’énergie solaire, l’éolie etc…
Figure I-1 : Évolution de l'approvisionnement mondial en énergie. [1, 2]
La demande en énergie primaire ne peut qu’augmenter dans la mesure où premièrement on note un accroissement de la population mondiale qui devrait atteindre 10 milliards
10
d’individus en β050, et où, deuxièmement, les pays en voie de développement ne peuvent élever leur niveau de vie sans augmenter leur consommation énergétique [2].
La figure I-1 présente l’évolution des sources d’approvisionnement en énergie primaire depuis le premier choc pétrolier en 197γ jusqu’à nos jours, ainsi qu’un scénario envisagé pour les années 2030.
Bien que la tendance soit une augmentation de l’utilisation de sources renouvelables telles que l’éolien ou l’énergie solaire, la consommation actuelle d’énergie reste très majoritairement recouverte par l’utilisation d’énergies fossiles (environ 80%) à savoir le charbon, le gaz naturel et le pétrole [2].
I-2 Conséquences de cette consommation d’énergie
Cette consommation d’énergie expose la planète à deux soucis majeurs : l’épuisement des réserves des ressources fossiles à moyen terme et une augmentation de l’effet de serre à relativement court terme.
Depuis la révolution industrielle, cette consommation de combustibles fossiles a entrainé des modifications dans la composition de la couche atmosphérique. La combustion des énergies fossiles entraine en effet, l’émission de différents types de gaz tels que les oxydes de carbone (COx), les oxydes de soufre (SOx) et les oxydes d’azote (NOx). Ces gaz sont
responsables de la formation des pluies acides, des pollutions photochimiques et de la dégradation de la couche d’ozone… À cet ensemble s’ajoute des conséquences sur la santé, et des changements climatiques qui décuplent la fréquence des catastrophes naturelles (inondations, ouragans…).
Sur la période comprise entre 1901 et 2012, la température globale de la Terre a augmenté de 0,89°C. Depuis 1965, il semble que cette hausse de la température soit principalement due à l’accroissement de la concentration des gaz à effet de serre [3].
Le principal gaz à effet de serre, d’origine naturelle est la vapeur d’eau, elle occupe entre 0,4 et 4% du volume des gaz atmosphériques. Le reste des gaz à effet de serre occupe quant à lui l’équivalent de 0,1% de ce volume
11
Le tableau I.1 présente la concentration des principaux gaz à effet de serre anthropiques, par conséquent liés à l’activité humaine, présents dans l’atmosphère pour les années β005 et 2011 ; les origines de ces émissions sont également présentées dans le tableau I-1.
Tableau I-1 : Gaz à effet de serre anthropiques. [3]
CO2 CH4 N2O HFC* PFC** SF6 NF3 Concentration atmosphérique en 2005 379 ppm 1774 ppb 319 ppb >67 ppt 79 ppt 5,6 ppt < 1ppt Concentration atmosphérique en 2011 391 ppm 1803 ppb 324 ppb >119 ppt 83 ppt 7,3 ppt < 1ppt Origines des émissions anthropiques Combustion d’énergie fossile et déforestation tropicale Décharges, agriculture, élevage et procédés industriels Agriculture, procédés industriels, utilisation d’engrais
Sprays, réfrigération et procédés industriels
Fabrication de composants électroniques ppm=partir par million, ppb= partie par milliard, ppt= partie par trillion
*HFC : hydrofluorocarbones, **PFC : perfluorocarbones
Depuis le développement des activités industrielles, les réservoirs terrestres et océaniques ont pu absorber la moitié des émissions anthropiques. L’autre partie est stockée dans l’atmosphère et contribue à l’accroissement de la concentration des gaz à effet de serre.
Si le CO2 est le gaz qui a le plus petit pouvoir de réchauffement global, il est celui qui a
contribué le plus au réchauffement climatique depuis 1750, du fait de l’augmentation importante de sa concentration [3]. Les émissions des six gaz à effet de serre couverts par le protocole de Kyoto ont connu une hausse de 24% entre 1990 et 2004 [3].
I-3 Origines et conséquences des émissions du CO2
Ces dernières décennies, les conditions de vie humaine ce sont améliorées de manière importante. Cependant, elle a eu pour conséquence d’augmenter la consommation d’énergie fossile et donc d’accroitre la pollution atmosphérique. Le dioxyde de carbone est le principal gaz à effet de serre résultant de cette pollution.
La concentration du CO2 atmosphérique n’a pas cessé d’augmenter depuis le début de la
révolution industrielle. En effet, avant cet événement historique, la quantité de CO2 était de 280
ppm [4] dans l’atmosphère, alors qu’elle était à γ90 ppm en β010 [4]. Cette teneur pourrait atteindre 570 ppm en 2100 [4].
12
Les émissions de CO2 anthropiques mondiales liées à la combustion d’énergie fossile
s’élevait en β010 à γ0,γ Gt [5]. Ces émissions proviennent essentiellement de deux sources : Les sources concentrées, qui correspondent au CO2 rejeté dans l’atmosphère lors
de certaines opérations d’extraction minière et de transformation industrielle (cimenterie, production d’énergie des centrales thermiques, le raffinage, la sidérurgie, …) ainsi que lors des incendies des forêts ou pour défricher les terres [6, 7].
Les sources diffuses, sont essentiellement produites par la combustion de matières
fossiles, dans le but de faire fonctionner des moteurs de véhicules automobiles ou les chaudières de bâtiments résidentiels et commerciaux [6, 7].
La conséquence majeure de ces émissions est le réchauffement climatique déjà perceptible à l’heure actuelle. En effet, le CO2 est impliqué à hauteur de 50% dans l’effet de
serre [8]. Cet effet de serre entraine un réchauffement climatique, à l’échelle planétaire, la température moyenne de l’air a augmenté d’environ 0,8 °C depuis la fin du XIXème siècle.
Suivant un des nombreux scénarii envisagés pour les années à venir, le réchauffement global de la planète serait compris entre 1,4 et 5,8°C pour la période 1990-2100. Cette augmentation de la température devrait être encore plus importante à la surface des continents [9].
Face à l’ensemble de ces constatations et de ces prévisions alarmantes la communauté internationale s’est engagée à limiter les rejets de gaz à effet de serre et notamment ceux du CO2. Différentes réunions internationales ont été organisées. En 1992, à Rio de Janeiro,
l’objectif international était de stabiliser les émissions de gaz à effet de serre [10]. En 1997, au sommet de Kyoto les objectifs se précisent : un protocole est mis au point et il engage les membres signataires à prolonger les efforts entrepris cinq ans auparavant, ainsi qu’à une réduction de 5% des émissions de gaz à effet de serre pour la période 2008-2012 [11]. La conférence sur les changements climatiques de Bali, en 2007, a donné lieu à deux alternatives : une réduction de 10 à 30% pour les pays les moins développés ou bien une baisse de ces émissions de β5 à 40% des émissions par rapport à 1990 pour les pays industrialisés d’ici à 2020 [12].
I-4 Solution pour limiter les émissions de CO2
La croissance de la demande en énergie ne permettant pas, à l’heure actuelle, de s’affranchir des énergies fossiles, l’élimination du CO2, principal gaz à effet de serre
13
anthropique, nécessite une attention particulière et mobilise déjà de nombreux scientifiques. Deux types de solutions peuvent être envisagés : les solutions préventives et les solutions curatives.
I-4-1 Solutions préventives
Cette approche consiste à réduire les rejets de CO2 dans l’atmosphère soit par le
développement des technologies plus efficaces, pour améliorer les rendements énergétiques, soit par l’utilisation d’autres sources énergétiques alternatives aux énergies fossiles telles que les énergies renouvelables (biomasse, solaire…) [6]. À titre d’exemple, depuis 1990 en France l’industrie chimique a diminué de 50% ses émissions de gaz à effet de serre [13].
I-4-2 Solutions curatives
Dans ce cas, il s’agit dans un premier temps de capter le COβ émis au-dessus de la sortie des fumées de combustion. Pour cela, il existe plusieurs méthodes : l’adsorption chimique ou physique par l’intermédiaire d’adsorbants, tels que des zéolithes [8, 14]. Une autre méthode consiste à utiliser des solvants physiques pour des hautes pressions partielles en CO2 ou
chimiques lorsque la pression est plus faible, dans le but d’isoler le CO2 des autres gaz qui
seront quant à eux brulés. Le CO2 est capté au sein du solvant, puis celui-ci est régénéré par
chauffage, le CO2 est alors comprimé et ensuite introduit dans le réseau de transport qui
permettra de l’acheminer jusqu’au lieu de stockage [15, 16] ; l’utilisation d’une membrane peut également permettre son isolement en présence d’une forte pression partielle en CO2 dans le
milieu [15, 16]. La cryogénie (distillation à basse température) [15] permet aussi de capter le CO2. Après avoir condensé les vapeurs d’eau, il s’agit de givrer le CO2 à pression
atmosphérique et à une température aux alentours de -120°C [16].
À la suite de cette étape de captage, il s’agit de stocker ce CO2 de façon permanente et
stable. Ce gaz étant acide et toxique, il est nécessaire pour chaque solution de stockage de connaitre de manière approfondie la sureté à long terme de l’entreposage. Les capacités mondiales de stockage sont assez importantes pour l’envisager comme une solution curative durable. La quantité de CO2 stocké devrait atteindre 4 Gt par an dans les années 2030, ce qui
correspondrait à 13% des émissions de CO2.
Différentes solutions de stockage peuvent être envisagées. Soit le CO2 peut être
emmagasiné au sein des aquifères marins, au niveau du plancher océanique au sein de roches poreuses, ou il peut également être enfoui dans des gisements de gaz ou de pétrole épuisés pour leurs propriétés d’étanchéité.
14
Le CO2 peut aussi être emmagasiné au sein de gisements houillers non exploitables, le
CO2s’adsorbe alors sur le charbon en chassant le méthane, qui peut être récupéré. Cette solution
est d’autant plus intéressante que le charbon adsorbe trois fois plus de CO2 que de méthane.
Une dernière solution consiste à enfouir le gaz directement dans les eaux océaniques à des profondeurs avoisinant 1000 m. Cependant cette technique n’est pas sans conséquence sur l’environnement : cela entrainerait une acidification de l’écosystème marin [6, 15, 17, 18].
II-Voies de valorisation du CO
2Au lieu d’être stocké, le CO2 peut également être utilisé en tant que matière première et
comme source de carbone. L’industrie mondiale consomme environ 15γ,5 Mt de dioxyde de carbone, mais cette quantité ne représente que 0,5% des émissions de CO2 engendrées par
l’activité humaine. Une des perspectives les plus intéressantes serait de réutiliser le CO2 présent
dans l’atmosphère, pour l’obtention de produits chimiques à haute valeur ajoutée. Le CO2 serait
alors considéré comme une nouvelle source de carbone.
Figure I-2 : Détail de la consommation pour les différents secteurs d’utilisant du CO2 au niveau mondial. [6]
Les voies de valorisation étant nombreuses comme le montre la figure I-2, elles ne présentent pas toutes les mêmes caractéristiques sur le plan économique (rentabilité) ou sur le plan technologique : il existe de nombreux verrous liés : à la consommation d’énergie des procédés de valorisation, au volume de CO2 valorisable, à la durée de séquestration du CO2, et
15
aux impacts potentiels de ces procédés sur l'environnement et la santé [6]. Cependant elles peuvent être classées en trois catégories :
-La valorisation sans transformation : le CO2,par ses propriétés physiques, peut être
utilisé comme solvant ou comme réfrigérant, ou bien lors de la récupération assistée d’hydrocarbures. [6, 15]
-La valorisation par transformations biologiques : par l’intermédiaire de la photosynthèse au sein d’organismes biologiques comme les algues, le CO2 peut être utilisé pour
synthétiser des produits d’intérêt (glucose, lipides et composés cellulosiques) [6, 15].
- La valorisation par transformations chimiques : associé à d’autres composés fortement réactifs, le CO2 peut permettre la synthèse de produits chimiques de base (urée, acide
salicylique, carbonates...). Il permet aussi, par l’intermédiaire de réactions comme par exemple l’électrolyse et l’hydrogénation, d’obtenir des produits ayant une valeur énergétique [4, 11, 14].
Il s’avère donc que l’utilisation du CO2 comme matière première et comme source de
carbone pourrait contribuer au basculement de notre société vers un modèle moins dépendant des énergies fossiles. La valorisation du CO2 permettrait alors d’apporter des solutions de
substitution aux produits issus de la pétrochimie, offrant ainsi l’opportunité de développer une «chimie durable» à partir du CO2.
Une des solutions permettant l’obtention de produits énergétiques est l’hydrogénation du CO2.
III-Hydrogénation catalytique du CO
2III-1 Origine des réactifs utilisés
III-1- L’hydrogène
Bien que l’hydrogène soit l’élément le plus présent dans l’univers, il est souvent combiné à d’autres atomes pour former des molécules, comme l’eau et les hydrocarbures. Pour obtenir la molécule de dihydrogène, il faut isoler l’hydrogène de ces molécules. Cette molécule possède la plus grande quantité d’énergie par unité de masse (1β0,7 kJ/g). Différentes sources sont actuellement utilisées pour produire ce vecteur d’énergie telles que : les hydrocarbures, le gaz naturelle, le méthane, etc…[19]. Le procédé majoritairement utilisé est le reformage du gaz
16
naturel à la vapeur d’eau, il correspond à plus de 50% de la production d’hydrogène mondiale. Ce type de procédé reste couteux aussi bien d’un point de vue économique que d’un point de vue énergétique [20]. Dans la mesure où l’objectif actuel est de limiter la consommation des énergies fossiles, il est indispensable de développer des méthodes « vertes » permettant d’obtenir ce réactif indispensable pour toute hydrogénation.
De nombreuses méthodes permettent d’obtenir un hydrogène propre. Ces différentes méthodes sont répertoriées sur la figure I-3 :
Figure I-3 : Principales techniques de production de l'hydrogène utilisant des énergies renouvelables. [18]
Sur l’ensemble de ces solutions, l’électrolyse de l’eau est le procédé le plus fréquemment utilisé pour la production de l’hydrogène, consistant à dissocier l’eau en oxygène et hydrogène [21, 22]. L’hydrogène utilisé peut également provenir de sources renouvelables, telles que la biomasse, l’énergie hydroélectrique ou l’énergie solaire [22, 23].
III-1-2 Le Dioxyde de Carbone (CO2)
Le CO2utilisé dans cette réaction d’hydrogénation, peut tout à fait être celui provenant
des émissions anthropiques, obtenu par captage comme cela a été présenté précédemment (voir le paragraphe I-4-2). En envisageant d’associer cet hydrogène obtenu de manière propre au CO2
17
et il deviendrait alors un procédé vert, permettant d’obtenir des produits présentant des propriétés de vecteur énergétique. Cette synthèse pourrait à l’avenir être une solution alternative et se substituer en partie à l’utilisation des diverses énergies fossiles.
III- Produits de l’hydrogénation du CO2
La réaction d’hydrogénation est souvent utilisée pour réduire ou saturer une molécule organique. Ces réactions sont généralement thermodynamiquement favorables. Cependant, du fait de la grande stabilité du dihydrogène, elle nécessite un fort apport énergétique ou l’utilisation d’un catalyseur.
Comme cela a été montré précédemment, l’hydrogénation du CO2permet d’aboutir à la
formation de produit ayant un intérêt pour la chimie fine ou ayant une valeur énergétique, ce qui est intéressant en vue d’amoindrir les consommations d’énergie fossiles. Un certain nombre de produits qu’il est possible d’obtenir par l’hydrogénation du CO2 sont répertoriés sur la figure
I-4.
Figure I-4 : Produits formés lors de l'hydrogénation du CO2. [4]
Les différents produits qui peuvent être obtenus lors de cette réaction peuvent être classés en deux catégories :
- les hydrocarbures (oléfines, paraffines….)
- des composés intermédiaires facilement valorisables tels que le méthanol, l’acide formique ou le diméthyléther…
18
IV-Synthèse du méthanol
Sur l’ensemble des molécules formées par hydrogénation du CO2 (figure I-4), une est
particulièrement intéressante, il s’agit du méthanol. En effet, cet alcool est ce que l’on appelle une molécule plateforme, qui permet de former ensuite des molécules vecteurs d’énergie comme le diméthyléther et différents hydrocarbures. L’ensemble de ce travail se focalisera donc sur la formation du méthanol par hydrogénation du CO2.
IV-1 Intérêt du méthanol
Le méthanol, alcool le plus léger, est l’un des composés les plus couramment utilisés dans l’industrie chimique. En β011, la production mondiale s’élevait à 55 millions de tonnes avec une tendance à la hausse par rapport aux années précédentes [24]. Le méthanol présente trois grands avantages :
- cette molécule peut permettre de transporter l’hydrogène et donc servir de vecteur énergétique ;
- il peut être utilisé en tant que carburant ;
- c’est une matière première pour la synthèse de nombreux produits organiques. Ce composé possède effectivement des propriétés intéressantes en tant que carburant propre, étant donné que cette molécule possède un fort indice d’octane (Research Octane Number : 107). Le méthanol peut être mélangé à un carburant classique sans aucune modification technique du véhicule. Le carburant contenant du méthanol le plus fréquemment utilisé aux Etats Unis est le M85, il est composé de 85% de méthanol et de 15% d’essence classique. Toujours dans ce type d’application le méthanol permet l’obtention de biodiesel par transestérification d’huiles végétales. Ce biodiesel peut être ajouté au diesel classique toujours sans devoir réaliser de modifications techniques. La combustion du méthanol offre l’avantage de ne pas former de coproduits nocifs comme les NOx ou les SOx.
La grande majorité du méthanol est utilisé dans le domaine de la synthèse organique, cela représente 70% du méthanol produit. Il est utilisé en tant que solvant ou bien comme réactif qui permet la synthèse de produits chimiques tels que l’urée, l’acide acétique, le formaldéhyde… À elle seule la production de formaldéhyde consomme environ 35% de la production mondiale en méthanol [25].
Le méthanol est également utilisé comme matière première pour la production d’hydrocarbures [26-28]. Au moment des chocs pétroliers, dans les années 1970, l’entreprise
19
Mobil Oil a mis au point un premier procédé : le méthanol en essence (Méthanol To Gasoline ou MTG), qui permet d’obtenir une essence avec un indice d’octane élevé. Cette méthode a été exploitée à l’échelle industrielle en Nouvelle Zélande dans les années 1980 [28]. À la suite de cela, un second procédé, le méthanol en oléfine (MTO) a été mis au point par déshydratation du méthanol en diméthyléther qui permet de former diverses oléfines [27, 28].
IV-2 Production du méthanol par hydrogénation du CO2
À l’origine le méthanol était obtenu par distillation du bois. À l’heure actuelle, cette molécule est synthétisée à l’aide d’hydrogène et d’un mélange de gaz de synthèse CO2/CO en
utilisant des pressions comprises entre 50 et 100 bar, à des températures entre 250 et 300°C. Le catalyseur le plus souvent utilisé dans ce processus est un catalyseur à base de cuivre d’oxyde de zinc et d’alumine [29, 30]. Actuellement, de gros efforts sont faits pour obtenir du méthanol directement à partir du CO2 puisqu’il est considéré comme la source directe de carbone pour la
synthèse du méthanol [31]. Cette réaction rentre parfaitement dans la stratégie de valorisation du CO2 et du développement durable et elle est techniquement compétitive avec la production
industrielle du méthanol à partir du gaz de synthèses.
IV-2-1 Réactions mises en jeu dans la synthèse du méthanol
L’hydrogénation du CO2 est en réalité composée de trois réactions parallèles qui sont
présentées ci-dessous. La première est l’hydrogénation du CO2 en méthanol (i) ; les deux autres
entrainent la formation d’un produit secondaire, le monoxyde de carbone. Ces deux réactions sont la réaction de Reverse Water Gas Shift (RWGS) (ii) et la réaction de décomposition du méthanol (iii).
(i)
(ii)
20
IV-2-2 Conditions favorables à la formation du méthanol
La conversion du CO2 nécessite un apport important d’énergie, des conditions
favorables à la réaction et un catalyseur actif. La synthèse en méthanol est quant à elle une réaction exothermique, elle est donc favorisée à température modérée et à haute pression.
- Effet de la température : L’hydrogène seul ne suffit pas à activer la molécule de CO2,
il est nécessaire d’ajouter l’effet d’une température pour obtenir son activation. La conversion du CO2 augmente avec la température, cependant, les données thermodynamiques de la réaction
de synthèse du méthanol (i) mettent en évidence que la température appliquée au système doit rester dans des valeurs intermédiaires puisque des valeurs trop importantes favoriseraient la formation de CO. La température optimale de réaction pour la synthèse du méthanol se situe aux alentours de 250°C. La plupart du temps la synthèse du méthanol est réalisée à des températures comprises entre 220 et 300°C [17], pour des pressions comprises aux alentours de 50 bar.
- Effet de la Pression : Depuis les années 1920 et la mise au point du procédé permettant la synthèse du méthanol par la société BASF, cette réaction est réalisée à des valeurs de pression importantes voire très importantes [32, 33]. Initialement, ces valeurs de pression pouvaient atteindre 200 bar. La thermodynamique montre que la pression présente au sein du système favorise la formation du méthanol [34]. Cependant un système mis sous pression entraine une consommation d’énergie, qui doit être limitée pour que ce procédé qui permet d’obtenir ces molécules reste viable. À la fin des années 1960, le groupe ICI a mis au point des procédés moins énergivores, où la pression appliquée était comprise entre 50 et 100 bar. Par la suite d’autres ont permis de diminuer cette pression jusqu’à des valeurs d’environ β0 bar [33].
V-Catalyseurs utilisés pour la synthèse du méthanol
Étant donnée la très grande stabilité thermodynamique du CO2, il est primordial
d’introduire l’usage d’un catalyseur pour un bon fonctionnement de la réaction d’hydrogénation du CO2. La compréhension du fonctionnement de ce matériau lors de cette réaction est le verrou
à lever pour améliorer son efficacité.
Les premiers catalyseurs hétérogènes utilisés pour la synthèse du méthanol par hydrogénation du CO2dans les années 19β0 par l’entreprise BASF étaient des solides de type
ZnO/Cr2O3. Industriellement, la synthèse était réalisée à partir d’un mélange de gaz H2/CO/CO2
21
Bien plus actif que les précédents, les catalyseurs à base de cuivre ont été étudiés à partir des années 1930. En effet, parmi les différents métaux testés à cette époque, notamment le fer, l’argent, le palladium… [37], c’est le cuivre qui s’est avéré le plus réactif pour la synthèse du méthanol. Cependant, le cuivre seul reste faiblement actif pour cette réaction, de plus sa stabilité est médiocre notamment à cause de l’apparition de phénomènes de frittage due aux conditions de réaction. Par la suite, différents oxydes métalliques tels que MgO, ZnO, SiO2, Al2O3… ont
été associés au Cu0.Il s’est avéré que l’oxyde métallique le plus efficace était le ZnO [38]. Tableau I-2 : Compositions classiques de différents catalyseurs industriels pour la synthèse du méthanol. [39]
Catalyseurs
Teneurs
Cu (% at) Zn (% at) Al (% at)
BASF 65-75 20-30 5-10
Süd chemie 65-75 18-23 5-10
ICI 61 30 9
Actuellement, le catalyseur utilisé industriellement pour produire du méthanol est un catalyseur de type Cu/ZnO/Al2O3.Actuellement le procédé industriel favorise l’utilisation du
CO comme réactif de départ qui dans ce cas permet d’atteindre une sélectivité de l’ordre de 90% en méthanol [40]. Le tableau I-2 rapporte les différentes teneurs des catalyseurs mis au point par différentes industries.
V-1 Influence de la préparation des catalyseurs Cu/ZnO
La méthode et les conditions de préparation des catalyseurs à base de cuivre et de zinc ont une grande influence sur leur structure et donc sur leurs performances catalytiques. Le type de préparation peut varier : ces catalyseurs peuvent être préparés par imprégnation [41], par coprécipitation [42–44] ou par mélange mécanique [45].
La méthode la plus fréquemment utilisée pour préparer les catalyseurs de type Cu/ZnO reste la coprécipitation. Cette méthode consiste à précipiter un mélange de sels métallique (le plus souvent des sels de nitrate) à l’aide d’un agent de coprécipitation tels que des carbonate ou des hydrogénocarbonate (Na2CO3 [44] ou NaHCO3 [46]) à des pH aux alentours de 7. Le
22
Ces dernières années, de nombreuses études ont été menées pour optimiser les conditions de ce type de synthèse.
L’étape de vieillissement de la solution obtenue après l’étape de précipitation, favorise la cristallisation du précipité qui est initialement amorphe. Cette étape affectera la micro-structure du composé en terme de micro-structure et de morphologie (porosité, dispersion…) et donc les propriétés catalytiques du matériau [47]. Selon les conditions de synthèse utilisées et la composition intrinsèque des catalyseurs désirée, différents précurseurs peuvent se former pendant la synthèse. Dans un catalyseur préparé uniquement à base de cuivre, le précurseur formé est la malachite Cu2CO3(OH)2. Dans les mélanges contenant à la fois du cuivre et du
zinc, deux phases peuvent être observées : la zincian malachite également appelée rosacite (CuZn)2(CO3)(OH)2 pour les compositions les plus riche en cuivre et l’aurichalcite
(CuZn)5(CO3)2(OH)6 pour des teneur en zinc plus importantes. Lorsqu’une grande proportion
de zinc est présent dans la composition, l’hydrozincite Zn5(CO3)2(OH)3 peut également
apparaitre. Des mélanges de ces différentes espèces peuvent également être observés. Dans les mélanges contenant assez d’alumine il est également possible de trouver la phase suivante : (Cu,Zn)6Al2(OH)16CO3, 4H2O appelée l’hydrotalcite [47], [48], 48].
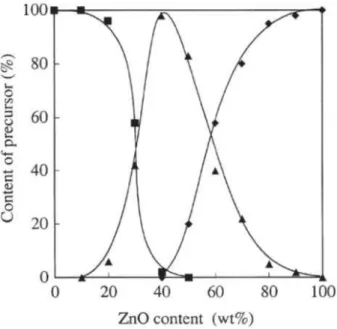
Figure I-5 : Composition des précurseurs du catalyseur déterminée par DRX en fonction de la teneur en ZnO du catalyseur Cu/ZnO. (■) Malachite (Cu2CO3(OH)2) (▲) aurichalcite ((Cu1-yZny)5(CO3)2(OH)6) (♦) hydrozincite (Zn5(CO3)2(OH)3). [49]
23
La figure I-5 présente la teneur en précurseur en fonction de la teneur en zinc du mélange. Cette figure présente les zones de prédominances des intermédiaires en fonction de la teneur en ZnO du catalyseur. Pour des teneurs en ZnO inférieures à γ0%, l’espèce malachite est prédominante dans la composition des précurseurs ; pour les teneurs intermédiaires en ZnO comprisent entre γ0 et 60 % l’aurichalcite devient le composé majoritaire ; enfin pour les teneurs supérieures à 60% en ZnO l’hydrozincite est alors le précurseur majoritaire.
La présence de ces précurseurs est également influencée par les conditions de synthèse du catalyseur et le pH en particulier. Un pH de 7 favorise la présence de phases proches de la malachite. Un pH de 6 est plus favorable à des phases du type hydroxyde de nitrate (NO3OH),
ce qui a pour conséquence de diminuer l’efficacité du catalyseur. La température est un facteur important lors de la précipitation des précurseurs, une température trop importante va favoriser des grosses tailles de cristallites entrainant une diminution des performances catalytiques. La température peut affecter également la cinétique de précipitation [33].
Dans la littérature, il existe une réelle controverse en ce qui concerne le précurseur qui favorise la synthèse du méthanol. Fujitani et al. [49] ont fait une corrélation entre l’activité des catalyseurs pour la synthèse du méthanol et la présence des précurseurs. Il s’est avéré que les catalyseurs les plus actifs contenaient en grande majorité de l’aurichalcite. Cette équipe en a conclu que l’aurichalcite favorise la synthèse du méthanol car ce type de précurseur augmenterait les interactions entre le cuivre et le zinc et que cela faciliterait la formation d’un alliage Cu-Zn lors de l’étape de réduction.
Behrens et al. [50] quant à eux, estiment que les catalyseurs utilisés dans l’industrie ont un rapport Cu/Zn compris entre deux et trois, ce qui permet la formation de zincian malachite. Ce précurseur se forme par substitution d’atome de cuivre par des atomes de zinc ; cela entraine une distorsion de la maille initiale de cuivre. Ce phénomène aurait pour effet d’améliorer la dispersion du cuivre métallique et de favoriser la formation de lacunes en oxygène au niveau de l’interface Cu-ZnO ; deux éléments succeptibles de favoriser l’activité du catalyseur comme cela seront discutés dans le paragraphe V-2.
Les performances catalytiques des matériaux dépendent aussi de la température de calcination et de réduction. La rampe de température de calcination la plus basse possible favorise la formation de petites particules [48, 51]. En effet, Fujita et al. ont observé une augmentation de la taille des particules lorsqu’ils faisaient varier la rampe de température de calcination de β à β0°C/min. Avec une rampe importante, l’oxyde métallique interagit avec
24
l’eau ce qui entraine un phénomène de coalescence et augmente la taille des particules. La calcination du précipité obtenu joue également un rôle important dans l’efficacité du catalyseur. Une température de 300°C est nécessaire et idéale pour décomposer la grande majorité des carbonates présents au sein des précurseurs [52]. Une plus haute température de calcination entrainerait un frittage des particules de CuO, et donc diminuerait les performances catalytiques. La réduction est nécessaire pour obtenir un catalyseur avec les performances optimales, cette étape est exothermique, ce qui peut avoir pour effet d’accélérer l’agglomération des particules au niveau de la surface active, plus particulièrement lorsque la rampe de montée en température est élevée [53]. Fujita et al. rapportent qu’une température de réduction suffisamment basse (aux alentours de 300°C) améliore les performances des catalyseurs pour la synthèse du méthanol car elle ne diminuerait pas ou peu la dispersion du cuivre.
V-2 Nature du site actif
Bien que les catalyseurs à base de cuivre et d’oxyde de zinc soient utilisés depuis des dizaines d’années dans la littérature pour la synthèse du méthanol à partir de gaz de synthèse CO2/CO/H2 ou du mélange CO2/H2, il subsiste des incertitudes en ce qui concerne leur site actif.
En effet, il existe une réelle controverse en ce qui concerne la nature du cuivre, l’impact du contact Cu-ZnO et le site responsable de l’activité catalytique pour la synthèse du méthanol.
Au début des recherches sur les catalyseurs de type Cu/ZnO utilisés dans la synthèse du méthanol, plusieurs équipes ont montré que la surface de cuivre métalliques était active de manière uniforme pour la synthèse du méthanol [54–56]. Pan et al. [57] ont montré que l’activité du catalyseur est directement proportionnelle à la surface du cuivre métallique accessible et que le méthanol se forme sur cette surface polycristalline. Rasmussen et al. [58, 59] ont étudié l’hydrogénation du CO2 en méthanol à la surface du Cu (100) et en ont déduit
que le cuivre métallique était le site actif ; ils excluent le fait que l’espèce Cu+ soit l’espèce active car ils n’observent que du cuivre métallique sur la face Cu (100).
Plus récemment, la communauté scientifique s’est accordée sur le fait qu’un phénomène de synergie entre le cuivre et l’oxyde de zinc est responsable de l’activité catalytique [60–62]. La quantité de méthanol formé par unité de volume sur du cuivre métallique et du ZnO seul est bien plus faible que l’activité observée pour un catalyseur du type Cu/ZnO. Malgré ce constat, il subsiste une grande controverse en ce qui concerne la nature exacte de cette synergie. Trois hypothèses sont généralement admises : (i) la synergie est due à un effet de surface du
25
catalyseur [63–65], (ii) la synergie entre Cu et ZnO permet la formation d’un site actif [66–68], (iii) ou la synergie permet un spillover de l’hydrogène [69–71].
Effet de morphologie, phénomène de surface
L’équipe de Topsøe [63, 64] rapporte que la structure du catalyseur et l’activité catalytique sont grandement influencées par les propriétés oxydo-réductrices des gaz environnants le système catalytique. Toute modification de composition du gaz de synthèse entraine des modifications de morphologie du système Cu/ZnO.
Par exemple, en présence d’hydrogène pur il apparait que les particules de cuivre sont totalement en contact avec le ZnO. Lorsqu’une infime quantité d’eau est ajouté à cet hydrogène, que le milieu est donc plus oxydant, une forme plus sphérique des particules de cuivre est observée. Un milieu réducteur augmente l’interface Cu-ZnO par l’étalement des particules de Cu0. Ce phénomène également appelé effet de mouillage n’est pas observé sur un catalyseur de type Cu/SiO2. Cet effet d’étalement modifie le type de faces cristallines de cuivre métallique
qui est accessible. Dans des conditions réductrices la face (111) du cuivre est celle en contact avec le ZnO. Lorsque le milieu est plus oxydant ce sont les faces (110) et (100) qui sont alors en contact avec le ZnO.
Pour Grundwaldt et al. [65], l’étalement des particules de cuivre dans des conditions réductrices favorise une augmentation du nombre de contacts entre Cu et ZnO, ce qui entraine la formation de lacunes en oxygène au sein du ZnO comme cela est représenté sur la figure I-6b. Ensuite, le ZnO lacunaire en oxygène migre au sein de la particule de cuivre pour former du Zn métallique tout d’abord en surface de la particule (figure I-6c), puis dans des conditions réductrices encore plus importantes sur l’ensemble de la particule (figure I-6d). Ce Zn métallique combiné au cuivre métallique permettrait la formation d’un alliage CuZn de type laiton au sein du catalyseur.
26
Figure I-6 : Schéma des modifications morphologiques des particules en fonction des conditions réductrices des gaz
environnants a) particules de cuivre à l’allure sphérique en milieu oxydant b) particules de forme arrondie dans des
conditions plus réductrices c) formation d’alliage Cu-Zn de surface dans des fortes conditions de réduction d) formation
d’un alliage de type laiton au sein de la structure dans des conditions très réductrices. Ce schéma est proposé par
Grundwaldt et al. [65]
Au niveau de l’activité catalytique, les milieux réducteurs semblent favoriser la synthèse du méthanol, dans la mesure où cela favorise le contact Cu-ZnO. Ce phénomène d’étalement semble toutefois réversible, si le milieu redevient oxydant, les particules de cuivre redeviennent plus sphériques et cela sur plusieurs cycles.
Le CO2 présent dans le gaz de synthèse malgré son caractère oxydant est très favorable
à la synthèse du méthanol. En effet, il entrainerait dans un premier temps l’adsorption d’oxygène à la surface du cuivre métallique. Une fois que suffisamment d’oxygène serait adsorbé en surface, il faciliterait l’adsorption des réactifs, le CO2et l’hydrogène indispensables
à la formation du méthanol [72]. L’adsorption de cet oxygène de surface empêcherait la réduction complète du cuivre métallique et entrainerait la formation d’espèce Cu+ en surface du catalyseur. La présence du ZnO dans la composition du catalyseur stabiliserait les espèces Cu+ actives pour la formation du méthanol selon ces auteurs [73].
Pour d’autres, c’est le ZnO qui a un effet sur la morphologie du catalyseur à base de cuivre. Dans ce cas, le ZnO permet d’améliorer la dispersion du cuivre et de stabiliser la surface du cuivre métallique, en diminuant l’agglomération des particules de cuivre. Le ZnO évite
27
également l’empoisonnement du cuivre par les impuretés, telles que les sulfures présents dans le gaz de synthèse [33, 74].
Formation d’un site actif
Plusieurs équipes expliquent que l’effet de synergie est lié à la formation d’espèces intermédiaires permettant d’aboutir à la formation d’un alliage CuZn [45, 66, 75], laiton de type . Cependant, l’interprétation de cette formation diffère selon les équipes.
Kanai et al. [45], ont montré par l’étude de mélange mécanique Cu/SiO2+ZnO/SiO2 que
l’espèce active se forme lors de la réduction. Cette étape entraine la migration d’une espèce ZnOx lacunaire en oxygène, du ZnO/SiO2 vers le cuivre. Cette migration permet de former une
espèce Cu+-O-Zn, puis à une partie du zinc de se dissoudre dans le cuivre pour former l’alliage
CuZn. L’oxyde de zinc permet de stabiliser l’espèce Cu+ en formant l’espèce Cu+-O-Zn.
L’activité catalytique serait selon leurs travaux, liée au rapport Cu+/Cu au sein du catalyseur.
L’espèce Cu+-O-Zn permettrait principalement de stabiliser le formiate qui est l’espèce
intermédiaire capitale pour la synthèse du méthanol. Le modèle proposé par cette équipe pour la synergie entre le Cu et le ZnO est schématisé sur la figure I-7.
Figure I-7 : Schéma représentant un modèle de la synergie présente à la surface d’un catalyseur Cu/SiO2+ZnO/SiO2.[45] Behrens et al. [66] expliquent que pour qu’un catalyseur soit actif, il est nécessaire que les intermédiaires réactionnels aient une liaison forte avec le catalyseur. Pour cela, la surface du cuivre métallique doit présenter des défauts et des contraintes à proximité desquels une espèce ZnOx doit être présente. Cela est possible grâce à un effet de forte interaction
métal-28
support. Selon leur étude, cet ensemble (défaut-espèce lacunaire) favoriserait l’adsorption des espèces intermédiaires qui se forment lors de la synthèse du méthanol (formiate, formaldéhyde, méthoxy).
D’autres auteurs [60, 76] expliquent l’activité en méthanol des catalyseurs de type Cu-ZnO par la présence d’effets électroniques. Les conditions de réaction de la synthèse du méthanol étant très réductrices, le centre du cuivre métallique sera stable alors que l’oxyde de zinc présentera des lacunes en oxygènes. Les électrons produits par ces lacunes, seront distribués sur la bande de conduction de l’oxyde et sur la bande de valence du métal au niveau de Fermi. Au repos, la bande de conduction de l’oxyde est supérieure au niveau de Fermi du métal, l’enthalpie de formation des lacunes en oxygène permet aux électrons de baisser leur niveau d’énergie et donc de migrer jusqu’au niveau de Fermi du métal. Cette stabilisation de la structure permet l’équilibre des défauts et de favoriser l’augmentation de la concentration des lacunes [60]. La migration des électrons s’explique par la présence d’une hétérojonction métal/semi-conducteur au niveau de l’interface Cu-ZnO des catalyseurs. Il existe une corrélation entre la promotion électronique du ZnO vers le Cu0 du catalyseur et son activité pour la formation du méthanol [76]. Le ZnO en feuillet favorise le contact entre Cu-ZnO et donc le transfert électronique par une jonction de type Schottky-Mott. Le flux d’électrons de la bande de conduction du ZnO vers le niveau de Fermi du cuivre facilite la formation de lacunes en faisant varier leur équilibre, cela favorise l’activité. L’augmentation de la température du milieu réducteur permet de favoriser le transfert d’électrons d’un niveau à l’autre de la barrière de Schottky-Mott et donc la formation plus importante de lacunes. La formation de ces lacunes permet à l’hydrogène de se dissocier et de former des hydrures par récupération des électrons présents sur le solide. La formation de l’association hydrure-lacune perturbe l’équilibre des défauts et peut conduire à une importante incorporation d’hydrogène au sein de l’oxyde. Une fois l’intermédiaire méthoxy formé, son hydrogénation serait alors facilitée [60].
Contrairement aux auteurs précédents, Harikumar et al. [68] estiment que l’alliage se forme par migration du cuivre au sein de la couche de ZnO. La migration du cuivre qui entraine la formation d’un alliage CuZn dépend des conditions dans lesquelles se trouvent le catalyseur que ce soit la quantité respective du cuivre et de l’oxyde de zinc, lorsque la quantité de cuivre est trop importante dans la composition du catalyseur, la migration atteint un état de saturation. La température de réduction favorise la migration de l’épaisse cuivre et la formation de l’alliage CuZn.
29
Le ZnO permet un stockage de l’hydrogène
De manière générale, l’oxyde de zinc est un bon catalyseur pour l’hydrogénation, ses propriétés de semi-conducteur de type n lui confère une propriété de donneur d’électrons. Cet oxyde possède des lacunes en oxygène, ce qui entraine la présence de paires d’électrons au sein de la maille d’oxyde de zinc. Le couple Zn2+-2e- bouge de façon intrinsèque, entrainant la
formation de lacunes anioniques et cationiques, ce qui facilite l’adsorption et la transformation des réactifs [33]. Ces propriétés intrinsèques de cet oxyde permettent une dissociation hétérolytique des molécules de dihydrogène. Cet dissociation entraine la formation des espèces Zn-H et ZnO-H [77, 78]. L’analyse d’un catalyseur commercial Cu-ZnO-Al2O3 par RMN du
solide met en évidence la présence de quatre populations différentes d’hydrogène. Cette analyse confirme qu’une partie de l’hydrogène est adsorbée de deux manières différentes sur le zinc, sous la forme Zn-H et ZnO-H. Elle montre, qu’il est également présent à la surface du cuivre métallique sous la forme Cu-H ainsi que sur le support alumine [69]. Le ZnO agirait comme un réservoir au sein du système catalytique puis par migration vers le cuivre permettrait l’hydrogénation des oxydes de carbone présents à la surface du métal. Le ZnO n’aurait pas de lien direct avec l’activité des catalyseurs Cu-ZnO, il permettrait de stocker l’hydrogène nécessaire à la réaction [61, 70, 71, 79]. Il semble que le cuivre métallique au sein du catalyseur favorise la présence de l’espèce Zn-H et diminue la quantité d’hydrogène en contact avec l’alumine [33, 69]. L’épandage de l’hydrogène est observé à partir du moment où les espèces Cu-ZnO sont en contact. Une surface légèrement oxydée du cuivre favoriserait l’épandage de l’hydrogène du cuivre vers le ZnO par rapport à une surface de cuivre totalement réduite [70]. Les atomes d’hydrogène se fixent majoritairement au niveau des défauts de surface du ZnO et de ses interstices. Cependant, l’hydrogène est assez mobile pour pouvoir entrainer l’hydrogénation des intermédiaires réactionnels adsorbés en surface du cuivre métallique par migration inverse.
V-3 Mécanisme réactionnel
Bien que les catalyseurs à base de cuivre et d’oxyde de zinc soient très largement utilisés dans la littérature pour synthétiser le méthanol à partir du CO2, le mécanisme exact de la
réaction n’est pas encore clairement établi.
Il est admis dans la littérature que la formation du méthanol et du CO se font en parallèle l’une de l’autre [80]. Plusieurs espèces ont été identifiées à la surface du catalyseur, telles que
30
des carbonates, des hydrogénocarbonates, des formiates, des méthoxys… L’ensemble de ces espèces ont été identifiées par différentes techniques telles que la désorption en température programmée (TPD) [81]et l’infrarouge par transformée de Fourier [82].
Différents mécanismes sont proposés dans la littérature, cependant, l’espèce formiate est la majeure partie du temps considérée comme étant l’étape limitante de la réaction de synthèse du méthanol [48, 49, 70, 83, 84]. En effet, cette espèce est très stable à la surface du catalyseur car elle s’adsorbe de manière pontée à la surface du cuivre métallique [70, 81, 85] ou à la surface de l’oxyde de zinc [74, 86].
Initialement et comme cela est encore le cas à l’échelle industrielle, le méthanol est synthétisé à partir d’un mélange de gaz de synthèse CO/CO2/H2. Au début des études menées
sur ces catalyseurs deux hypothèses ont alors été émises : i) soit le méthanol était obtenu à partir du CO ii) soit il l’était à partir du CO2. Pour Klier et al. [87], le méthanol est obtenu à partir du
CO, le CO2a uniquement un rôle de stabilisateur de la surface du catalyseur. Pour l’équipe de
Chinchen [88], c’est le CO2qui est à l’origine de la formation du méthanol, ils ont mis cela en
évidence à l’aide d’un marquage des molécules au carbone 14. À partir des années 1990, l’hypothèse selon laquelle le méthanol provenait en grande partie du CO2 a été largement
admise [89].
Généralement le mécanisme considéré à la surface du catalyseur est le suivant : une fois les deux réactifs (CO2 et H2) s’adsorbés à la surface du catalyseur, le méthanol est obtenue par
hydrogénation successive de plusieurs intermédiaires (formiates, dioxométhylene, méthoxy) [48, 70, 83]. Parmi les différentes variantes présentes dans la littérature le mécanisme proposé par Hu et al. [82] est un mécanisme classique de la synthèse du méthanol, il est représenté sur la figure I-8.



![Figure I-7 : Schéma représentant un modèle de la synergie présente à la surface d’un catalyseur Cu/SiO 2 +ZnO/SiO 2 .[45]](https://thumb-eu.123doks.com/thumbv2/123doknet/7892622.264293/40.892.294.602.653.966/figure-schéma-représentant-modèle-synergie-présente-surface-catalyseur.webp)




