Étude multi échelle des communautés microbiennes
dans l’Océan Arctique
Thèse Nathalie Joli Doctorat en Océanographie Philosophiæ doctor (Ph.D.) Québec, Canada © Nathalie Joli, 2017
Étude multi échelle des communautés microbiennes
dans l’Océan Arctique
Thèse
Nathalie Joli
Sous la direction de:
Connie Lovejoy, directrice de recherche Marcel Babin, codirecteur de recherche
Résumé
L’Océan Arctique (OA) est hétérogène et se compose de plusieurs écorégions influencées par des conditions environnementales saisonnières extrêmes. L’Arctique est particulièrement vul-nérable aux changements climatiques et montre un réchauffement plus rapide que la plupart des régions sur Terre. Cette thèse se concentre sur l’étude de deux régions (golfe d’Amundsen et baie de Baffin (BB)) à différentes échelles spatiales et temporelles. D’abord, nous utilisons des approches moléculaires, incluant la métagénomique et le séquençage à haut débit d’un marqueur taxonomique pour examiner la diversité microbienne eucaryote, puis nous appli-quons des approches basées sur l’assemblage de pigments et les paramètres photosynthétiques afin de mieux définir les communautés. Sur la base d’échantillons prélevés durant 8 mois dans le golfe d’Amundsen (novembre 2007 à juillet 2008), nous documentons la saisonnalité d’espèces microbiennes eucaryotes clé dans l’Arctique. Nous montrons que les prasinophytes survivent pendant la Nuit Polaire et que Micromonas était probablement sujet à une lyse virale en hiver. Deuxièmement, nous décrivons une variabilité spatiale importante dans la BB à la mi-août 2013 et montrons qu’il ne s’agit pas d’une seule écorégion. L’absence de maximum de chlorophylle sous-surface (SCM) du côté canadien était contrastée avec la présence d’un SCM marqué du côté Groenland. Les différences océanographiques physiques de chaque côté semblent également influencer la composition en espèces, avec des communautés de diatomées dominées par Chaetoceros aff. gelidus du côté du Canada, tandis que du côté du Groenland, ce sont les diatomées potentiellement nocives pour les vertébrés marins Pseudo-nitzschia spp., qui étaient les plus abondantes. Enfin, nous montrons que les capacités photosynthétiques et les teneurs en pigments présentent une variabilité verticale, spatiale et temporelle dans le Nord de la Baie de Baffin. Nous décrivons la forte variabilité apparente de la communauté photosyn-thétique du côté du Canada, comparé à des changements plus progressifs de l’autre côté. Du côté Groenlandais, la dominance des communautés alternent entre les diatomées et les algues vertes, avec un retour aux conditions initiales après 24 h reflétant bien les patrons de signatures pigmentaires. Le remplacement rapide des groupes photosynthétiques du côté du Canada est associé à un manque d’accumulation de biomasse à court terme, suggérant un équilibre entre croissance et processus de perte au cours des 24 h. À long terme, les différences entre les deux parties pourraient se refléter dans les transferts d’énergie aux réseaux alimentaires pélagiques par rapport à l’exportation de carbone vers le benthos. Par l’utilisation d’échelles spatiales
et temporelles variées, cette thèse se concentre sur deux régions historiquement productives de l’Arctique et les résultats obtenus ont contribué à l’avancement des connaissances dans le domaine de l’écologie microbienne arctique, en mettant particulièrement l’accent sur la survie pendant la nuit polaire et sur les effets potentiels du changement climatique sur l’accumulation de biomasse photosynthétique et les capacités photo physiologiques associées.
Abstract
The Arctic Ocean (OA) is heterogeneous and composed of multiple eco-regions that are in-fluenced by extreme seasonal environmental conditions. The Arctic is particularly vulnerable to climate change and warms faster than most regions on Earth. This thesis focuses on two regions of the Arctic (Amundsen Gulf and Baffin Bay (BB)) at different spatial and tempo-ral scales. First, we used molecular approaches including metagenomics and high-throughput sequencing of a taxonomic marker to examine eukaryotic microbial diversity, and then we applied pigment assemblage-based approaches and examined photosynthetic parameters to further define communities. Based on samples collected over 8 months in the Amundsen Gulf (November 2007 - July 2008), we document the seasonality of key microbial eukaryote species in Arctic. We show that prasinophytes survive during the Polar Night and that Micromonas was likely subject to viral lysis in winter. Second, we describe high spatial variability in BB in mid-August 2013 and show the presence of several regions. The absence of a subsurface chlorophyll maximum (SCM) on the Canadian side was in contrast with a marked SCM on the Greenland side. Physical oceanographic differences on each side also influenced the species composition, with diatom communities dominated by Chaetoceros aff. gelidus on the Cana-dian side, while on the Greenland side, Pseudo-nitzschia spp., which are potentially harmful to marine vertebrates, were the most abundant diatoms. Finally, we highlighted a vertical, spatial and temporal variability of the photosynthetic capacities and the pigment contents in Northern Baffin Bay. We describe the apparent high variability of the photosynthetic commu-nity on the Canadian side, which was in contrast with more gradual changes on the Greenland side, where communities switched from diatoms to green algae and back over 24 h reflecting photoprotection and light capture pigment signatures. The rapid species replacement of pho-tosynthetic groups on the Canadian side was in conjunction with a lack of short term biomass accumulation, suggesting balanced growth and loss processes over the 24 h. In the long term, differences on the two sides would be reflected in the energy transfers to pelagic food webs versus export of carbon toward the benthos. Focusing on two contrasting but historically productive regions of the Arctic over different spatial and temporal scales, results produced within this doctoral project contributed to the advancement of knowledge in the field of arc-tic microbial ecology, with pararc-ticular emphasis on the survival during the Polar Night, and potential consequences of climate change on the accumulation of photosynthetic biomass and
Table des matières
Résumé iii
Abstract v
Table des matières vii
Liste des tableaux x
Liste des figures xiv
Liste des abréviations et symboles xviii
Remerciements xxi
Avant-propos xxiii
1 Introduction générale 1
1.1 L’Océan Arctique . . . 1
1.1.1 Complexité de la structure hydrographique . . . 1
1.1.2 Sites d’étude . . . 2
1.1.3 Successions saisonnières . . . 4
1.2 Les écosystèmes planctoniques. . . 6
1.2.1 Diversité taxonomique des protistes . . . 6
1.2.2 Diversité trophique des protistes . . . 6
1.2.3 Complexité des écosystèmes microbiens . . . 7
1.3 Les outils dérivés de la biologie moléculaire et leurs applications . . . 9
1.3.1 Séquençage de l’ARNr 18S . . . 10
1.3.2 Métagénomique . . . 10
1.4 Organisation de la thèse et objectifs . . . 11
2 Seasonal patterns in Arctic prasinophytes and inferred ecology of Ba-thycoccus unveiled in an Arctic winter metagenome 14 2.1 Résumé . . . 14
2.2 Abstract . . . 14
2.3 Introduction. . . 15
2.4 Material and Methods . . . 17
2.4.1 Field sampling . . . 17
2.4.2 Extraction, library preparation and sequencing . . . 17
2.4.4 Gene Phylogenies. . . 19
2.4.5 Viruses in the metagenome . . . 20
2.5 Results. . . 21
2.5.1 Environmental conditions and temporal patterns . . . 21
2.5.2 Winter Metagenome . . . 21
2.5.3 Bathycoccus genes . . . 22
2.5.4 Bathycoccus variants . . . 23
2.5.5 Viral diversity in the Arctic Metagenome . . . 23
2.6 Discussion . . . 25
2.6.1 Bathycoccus and Micromonas . . . 25
2.6.2 Arctic-Boreal prasinophytes and polB diversity . . . 29
2.6.3 Seasonal recovery of the status quo . . . 29
2.6.4 Ecotypes and phylogenetic placement of Bathycoccus from the Arctic 29 2.7 Acknowledgement. . . 30
3 Northern Baffin Bay as a Janus gateway 31 3.1 Résumé . . . 31
3.2 Abstract . . . 31
3.3 Introduction. . . 32
3.4 Methods . . . 34
3.4.1 Field sampling and laboratory analysis . . . 34
3.4.2 Oceanographic data . . . 36
3.4.3 Satellite-derived products . . . 36
3.4.4 RNA and DNA extraction, library preparation and sequencing . . . 37
3.4.5 Phylogenic diversity, statistics, network analysis. . . 38
3.5 Results. . . 38
3.5.1 Environmental conditions . . . 38
3.5.2 Microbial eukaryotes . . . 42
Major Groups. . . 42
Identification and geographical distribution of OTUs . . . 42
Diatom taxonomy . . . 48
3.5.3 Environmental factors and Network analysis. . . 48
3.6 Discussion . . . 49
3.6.1 Physical oceanography across BB . . . 49
3.6.2 Overall Community Differences . . . 52
3.6.3 Species implications . . . 52
3.6.4 Implications for the Arctic ecosystem and potential for harmful algal blooms (HAB) . . . 54
3.7 Acknowledgement. . . 55
4 Photosynthetic microbial communities and photophysiology in Nor-thern BB 57 4.1 Résumé . . . 57
4.2 Abstract . . . 57
4.3 Introduction. . . 58
4.4 Material and Methods . . . 60
4.4.1 Field sampling and analysis . . . 60
4.4.3 Statistical analyses . . . 63
4.5 Results. . . 64
4.5.1 Photosynthetic capacity . . . 66
4.5.2 Pigments over time and depths . . . 66
4.5.3 Temporal variation of the photosynthetic community at 20 m.. . . . 71
4.5.4 Pigments, taxa, photophysiology, and FCM . . . 71
4.6 Discussion . . . 75
4.6.1 Photoacclimation . . . 75
4.6.2 Inferred community . . . 76
4.7 Acknowledgement. . . 78
5 Conclusions générales 79 5.1 Survie des prasinophytes pendant la nuit polaire . . . 80
5.2 Les différentes masses d’eau de la baie de BB sélectionnent des communautés distinctes . . . 81
5.3 Capacité photophysiologique. . . 82
5.4 Implications pour l’Océan Arctique et perspectives . . . 82
B Annexe Chapitre II 87
C Annexe Chapitre III 98
D Annexe Chapitre IV 114
Liste des tableaux
2.1 Metagenomic contigs taxonomically binned using a BLAST and contig fragmen-tation approach in Metawatt. Mb refers to the combined length of all contigs
that were taxonomically classified to the corresponding species. . . 23 2.2 Assignment of the Arctic metagenomic reads to individual chromosomes of B.
prasinos Ban7 and associated statistics : reference names (Ref Names) lists the individual chromosomes (1 to 19), the mitochondria (Mito) and chloroplast (Chloro) ; reference length (Ref Length) is the length of the reference sequences for the chromosomes in base pair (bp) ; number of reads (Nb Reads) mapped to the reference sequence ; Alignment is the percentage of the chromosome length with aligned reads ; depth of coverage (Depth Cover) is average number of reads aligning to a given position of the reference chromosome ; percent identity (%ID) is average pairwise identity over the alignment and the percent GC (%GC) is
GC content of mapped Arctic reads. . . 24 2.3 Summary of the substitution rate per 100 bp of the 129 coding genes common to
the five datasets. The Atlantic refers to Bathycoccus metagenomic contigs from the South East (SE) Atlantic (Monier et al., 2013a). Pacific 1 and 2 refer to the two metagenomes from the upwelling zone of Pacific water off the Chilean coast (Vaulot et al., 2012). Mediterranean refers to the reference genome of Bathycoccus Ban7 (Moreau et al., 2012) and Arctic refers to Bathycoccus-like
contigs from the metagenomic sample from the present study. . . 24 3.1 Samples characteristics and environmental parameters with temperature (T)
in degrees C, salinity (S, dissolved oxygen (O2) in mL L−1, photosynthetically active radiation (PAR) in µmol de photons s−1 m−2, nitrite (NO−
2), nitrate (NO−
3), silicate (SiO −
4) and phosphate (PO3−4 ) in µM. Extracted chlorophyll in µg L−1with small fraction corresponding to cells between 0.7 to 5 µm and large
for cells >5 µm.. . . 39 3.2 Statistics results of ANOVA repeated-measures test (parametric) and
Kruskal-Wallis (non-parametric) on environmental parameters comparing paired samples with a number (Nb) of 5 replicates (T1, T2, T4, T5 and T7) collected 20 m samples from Stn 101 and 115. Variable tested : Temperature °C (T), Sali-nity (S), dissolved oxygen (O2), fluorescent colored dissolved organic material (f CDOM) Silicate (SiO−
4) and phosphate (PO3−4 ), Values are given in Table 3.1. 41 3.3 Average of relative abundance and standard deviations (σ) of the more abundant
taxa from rRNA (>1% of the total reads) from small and large fraction at Stn
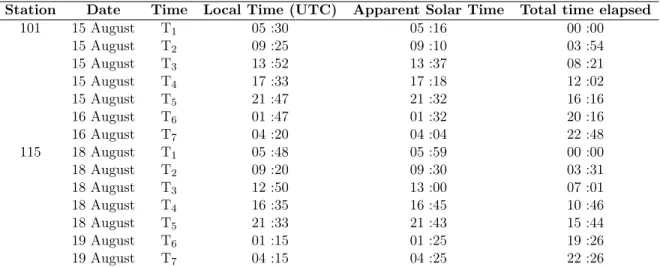
4.1 Correspondences between the sampling time T1 to T7, local time and apparent
solar time from the Lagrangian study. . . 60 4.2 Abiotic parameters including temperature (T) in degrees C, salinity (S) and
photosynthetically active radiation (PAR) in µmol photon m−2 s−1 and bio-tic parameters including Chl a concentration from HPLC in µg L−1, light-saturation parameter (Ek), maximum photosynthetic rate normalized by Chl a (PB
max) and maximum quantum yield of fluorescence (FV/FM) with standard
deviation (σ) (only measured in 20 m depth). . . 65 B.1 Sample characteristics and environmental parameters. Station name (STN) ;
la-titude (Lat) ; longitude (Long) ; sample water mass origin (WM), Polar Mixed Layer (PML), halocline (HC) ; sample collection depth (Z) in meters (m) ; percent (%) of regional ice (Ice) cover ; day length (DL) in hours (h) when the sun was above the horizon ; temperature (T) ; salinity (S) ; chlorophyll a (Chl a) from calibrated relative fluorescence units ; nitrate + nitrite (N) ; and phosphate (P) ; data not available (NA). November and December samples were
collected in 2007 and January to July samples in 2008. . . 89 B.2 Proportion of each size fraction that was pooled for amplicon sequencing.
No-vember and December samples collected in 2007 and January to July samples
collected in 2008. . . 90 B.3 Arctic metagenome coverage by contigs and reads of reference genomes :
Ba-thycoccus Ban7 (RCC1105, isolated from Mediterranean, Genbank FO082278), Micromonas RCC299 (isolated from Equatorial Pacific, GCF_000090985.2), Micromonas CCMP1545 (isolated from English Channel, GCA_000151265.1). Also shown is the Arctic metagenome coverage by contigs of transcriptomes avai-lable from the MMETSP (see Keeling et al., 2014) : Bathycoccus RCC716 (iso-lated from Indian Ocean ; CAM_SMPL_003310) and Micromonas CCMP2099 (isolated from Arctic Ocean ; CAM_SMPL_003148 and CAM_SMPL_002821). Note that genome size of Micromonas RCC299 is 20 Mb and Bathycoccus Ban7
is 15Mb. . . 91 B.4 Original source and sizes in megabases (Mb) of the Bathycoccus reference Ban7
genome and metagenome assembled genomes (MAGs) referred to in the main
text . . . 92 B.5ARelative abundance of the total chlorophytes reads as a percentage of microbial
eukaryote reads (excluding Fungi and Metazoa) in the separate samples. The proportions of chlorophyte reads among Eukaryote detected over the study are given in Table S5B. Sample water mass origin (WM), Polar Mixed Layer (PML),
halocline (HC) as defined in the main text. . . 93 B.5BProportion of individual chlorophytes taxa (all prasinophytes) out of total
eu-karyotic reads from DNA or RNA templates in percentage (%). Water mass
(WM), Polar Mixed Layer (PML), halocline (HC). . . 94 B.6 Assembly statistics of the Arctic metagenome from metaQUAST (http://
B.7 Meiosis related genes targeted by BLASTn against the Bathycoccus-like contigs from the metagenomic data. References genes based on Derelle et al. (2006) and Worden et al. (2009). Function are genes or gene families ; Query column lists Genbank gi numbers. Meiotic recombination protein (DMC1), DNA mismatch repair and recombination (MLH1), DNA repair/recombination protein (Mre11), DNA repair/recombination protein (RAD), DNA recombinase (RECA), DNA topoisomerase VI, subunit A (SPO11), chloroplast envelope protein translocase
family (TOC) and DNA topoisomerase VI (TOP). . . 96 B.8 List of Bathycoccus-specifid KEGG pathways, genes affected and type of variant
for candidates, which had been classified as having a high effect on the final putative protein. Search had been made against Bathycoccus prasinos pathways
implemented in KEGG. . . 97 C.1 List of the sequenced samples. Surface and SCM had been sampled at time T1
for Stn 101 and T2 for Stn 115 . . . 108 C.2 Taxonomy of most abundant OTUs (>100 occurrences) that are co-occuring
(spearman’s correlation >0.8) from the ecological network. The « Unique »
co-lumn correspond to unique to a given side.. . . 109 C.3 Bray curtis distances (%) between surface, 20m and SCM samples (small
frac-tion only). . . 110 C.4 Bray-Curtis distances (%) between 20m samples (small and large fractions). . . 111 C.5 Identity of OTUs with Chaetoceros gelidus as percentage of base per residues
which are identical. . . 112 C.6 Identity of OTUs with Pseudo-nitzschia arctica as percentage of base per
resi-dues which are identical. . . 113 D.1 Statistics of the comparison of the Chl a content and photophysiological
para-meters (Ek and PBmax) between surface and 20 m samples. . . 118 D.2 Statistics comparing results between Stn 101 and Stn 115, including the
to-tal number of phytoplanktonic cells and the various flow cytometry categories
(Figure B.1) of cells collected at 20m from time T1 to T7. . . 119 D.3 Pigments content normalized by Chl a concentration for each time, depths and
stations sampled. . . 120 D.4 Bray-Curtis similarity distances based on UPGMA clustering of pigments
as-sembly (normalized by Chl a) at each time, depth and station sampled. . . 121 D.5 Bray Curtis similarity index (%) of the photosynthetic community from
sequen-cing compared between samples within each station and fraction. . . 122 D.6 Relative abundance (%) of the photosynthetic taxa sequenced from samples
collected at 20m at time T1, T2, T4, T5 and T7 . . . 123 D.7ASpearman’s rank correlation coefficients of Chl b and Fx content with the others
pigments for Stn 101. Only positive correlation results including p-values <0.05
are presented. . . 124 D.7BSpearman’s rank correlation coefficients of Chl b and Fx content with the others
pigments and with photosynthetic taxa for Stn 115. Only positive correlation
results including p-values <0.05 are presented. . . 125 D.8ASpearman’s rank correlation coefficients of groups of cytometry with the
D.8BSpearman"s rank correlation coefficients of groups of cytometry with the pig-ments and photosynthetic taxa for Stn 115. Only positive correlation results
Liste des figures
1.1 Les courants de surface principaux dans l’OA. L’eau issue du Pacifique est illustrée en bleu et celle issue de l’Atlantique en rouge. Source : Figure extraite
depuis Wassmann et al. (2015). . . 2 1.2 Cartes montrant a) la bathymétrie de l’OA à partir de « l’International
Bathy-metric Chart » (Jakobsson et al., 2012) et b) les noms des principaux bassins, des dorsales océaniques, des régions continentales et des détroits. Source : Figure
extraite depuis Carmack et al. (2016). . . 3 1.3 Saisonnalité du développement de la floraison algale et exportation de carbone.
Le gradient de couleur des flèches verticales depuis le vert vers le rouge indique la biomasse suspendue, depuis les sources autotrophes vers les sources hétéro-trophes. La largeur des flèches est proportionnelle à la quantité moyenne et les couleurs illustrent la nature de la composition de la matière organique qui est exportée verticalement. Vert foncé = carbone dérivé des algues de glace. Vert clair = carbone dérivé du phytoplancton. Orange et rouge = degré croissant de détritus (matière organique particulaire non vivante). Source : Figure extraite
depuis Wassmann and Reigstad (2011). . . 5 2.1 Map of the sampling sites of the overwinting campaign. Samples were collected
from surface waters and halocline from 11 November to 21 July. The meta-genomic sample was collected 13 December. All stations were located in the main basin of Amundsen Gulf with the exception of samples from 14 June from
Darnley Bay and 24 June in Franklin Bay. . . 18 2.2 Relative rRNA and rDNA sequence abundances as proportions of all microbial
eukaryotic amplicons from surface water. . . 22 2.3 Proportion of chlorophytes taxa out of total chlorophytes reads from DNA (left)
and RNA (right) templates. . . 22 2.4 Phylogenetic tree of PRP8 protein. Maximum likelihood reconstruction based
on 6504 sites using 100 non-parametric bootstrap and gtr+cat model. . . 25 2.5 Phylogenetic tree of viral DNA polymerase B. Maximum likelihood
reconstruc-tion based on 889 sites using model GTR+G based on a multiple sequence alignment of nucleotides. (Boobstrap replicate=100). Only nodes with
boots-trap values >50% are displayed.. . . 26 3.1 Locations sampled during the west to east transect in Northern BB.Map of the
drifting stations is given on the left with Stn 101 in black and Stn 115 in red. Each dot corresponds to samples taken every 4 h beginning at 5am at each side
3.2 Sea ice cover, Chl a concentration and particulate back-scattering coefficient at 443 nm estimated from satellite data with A) Stn 101 (Canada) and B) Stn 115 (Greenland). Vertical dashed lines represent the date of sampling ; 15 August
2013 for Stn 101 and 18 August 2013 for Stn 115. . . 40 3.3 Vertical profiles of potential density, relative fluorescence and penetration of
light of A) Stn 101 and B) Stn 115. Figure made using SigmaPlot (version 11.0). 41 3.4 Relative abundance of the small fraction major taxa (>1% of total reads) from
surface, 20 m and SCM samples from profiles T1 at Stn 101 (left panel) and T2
for Stn 115 (right panel). . . 42 3.5 Major groups from the putative active (rRNA) community at station 101 (left
panels) and station 115 (right panels). Major groups are color coded with pre-dominantly photosynthetic groups in greens, heterotrophic groups in browns and red, parasitic taxa are in light brown and uncertain or mixotrophic groups in purple, including chrysophytes. A) small fraction (3–0.2 µm) and B) large
fractions (50–3 µm). . . 43 3.6 Pictures from epifluorecence microscopy on DAPI slides under blue (a,c,e,g,i,k)
and UV (b,d,f,h,j,l) light excitation. Pictures from samples collected at Stn 101 with Chaetoceros gelidus (a,b), Torodinium robustum (c,d) and Dinobryon balticum (e,f). Pictures from samples collected at Stn 115 with Pseudo-nitzschia
spp. (g,h), Pyramimonas (i,j) and Dinobryon belgica (k,l). . . 45 3.7 Redundancy analysis of samples of rRNA from stations 101 (black dots) and
115 (red dots) based on unweighted UNIFRAC values based on the analysis of
the entire microbial eukaryote community in each sample. . . 46 3.8 Ecological network analysis with focused on interactions with diatoms. Each
node represents a single OTU, with labels for the highlighted OTUs. All edges represent high correlation with Spearman’s rank correlation <-0.8 and >0.8 between two given OTU. Red edges for positive correlations, black edges for negative. Only abundant OTU (>100) had been kept for Stn 101 (above) and Stn 115 (below). Legend is shown on the right. Network visualised in Cytoscape
(version 3.4.0). . . 50 4.1 Locations sampled during the west to east transect in Northern BB.Map of the
drifting stations is given on the left with Stn 101 in black and Stn 115 in red. Each dot corresponds to samples taken every 4 h beginning at 5am at each side
(T1, T2, T3, T4, T5, T6, T7). Maps created with Ocean data View (version 4.7.8). 61 4.2 Flow cytometry results from 20 m samples collected from time T1 to T7 for
the temporal series. Y axis represents cell concentrations. Total phytoplankton detected (Total Phyto) and the five categories separated by fluorescence and side scatter (see text and Figure D.2) for A) Stn 101 and B) Stn 115. Results
are expressed in number of cells per mL and represented on a logarithmic scale. 67 4.3A Accessory pigment concentrations from HPLC normalized to Chl a. Stn 101
(left panels) and Stn 115 (right panels). a) carotenoids ; b) xanthophylls ; c)
chlorophylls from surface. . . 68 4.3B Accessory pigment concentrations from HPLC normalized to Chl a. Stn 101
(left panels) and Stn 115 (right panels). d) carotenoids ; e) xanthophylls ; f)
4.4 Temporal series of selected pigments on the two sides of BB Station 101, right panel, Station 115, left panel, a) in situ PAR at 20 m, b) Fx and Chl c3, which are diatom associated, c) Chl b and unkCar prasino-like pigments, which are
prasinophyte associated. . . 70 4.5 Relative abundance of photosynthetic groups out of the total eukaryotic
com-munity based on 18S rRNA reads. Only the major taxa of the photosynthetic community (relative abundance > 1% in at least on one of the samples) from
20 m samples from time T1 , T2, T4, T5, and T7 . . . 71 4.6 Canonical correlation analysis (CCA) based on Chl a normalized
concentra-tions of ancillary pigments and selected taxa (small and large fracconcentra-tions) from sequencing for A) Stn 101 and B) Stn 115 (panel B). Arrows amplitude were increased to 1.5 of their original size for clarity. Pigments and taxa shown were selected from those with the highest non-redundant explanatory power (see
Supplementary Figure D.2) . . . 73 4.7 UPGMA dendrograms based on Bray-Curtis distances between samples
pig-ments assembly (normalized by Chl a) at each time, depth and station sampled, numbers at the nodes indicate boot strap support out of 100 runs. Ek values are represented by gradient of blue (see Table 4.2 for actual values) with lower
Ek values light blue and higher values in darker blue. . . 74 B.1 Bathycoccus phylogeny based on ITS2 rRNA genes. ML reconstruction using
model GTR+G based on multiple sequence alignment of 221 nucleotide posi-tions. (Boostrap replicate = 100). Sequence from B. prasinos_Atlantic
corres-ponds to a sorted population collected in the SE Atlantic open ocean (AFUW00000000.1) ; B. prasinos_Pacific_X and Y from a sorted population collected in Pacific
coastal Chilean upwelling zone (CAFX01000001.1, CAFY01000001.1) ; B. pra-sinos_Ban7 from a cultured strain originally isolated from near Banyules, Me-diterranean ; B. prasinos_Arctic from this study ; B. prasinos_SCCAPK0417 and B. prasinos_CC1898 was isolated from Italian Mediterranean coast (FN562453.1, FN562453.1). All 18S rRNA genes had ca. 100% similarity . . . 88 C.1 Vertical sections from Stn 101 (Canada) to Stn 115 (Greenland) of temperature
and salinity from CTD data, and nitrate and phosphate concentrations from discrete samples. Figures made using Ocean Data View (ODV version 4.7.8,
Schlitzer, 2012).. . . 99 C.2 Vertical profile of nitrite (NO−
2), nitrate (NO −
3), and phosphate (PO3−4 ) in µM from the first 60 meters of the water column at Stn 101 (A) and 115 (B). Figures
made using SigmaPlot (version 11.0).. . . 100 C.3 Vertical profiles of extracted Chlorophyll a collected from the upper 100 m of
the water column at Stn 101 (left) and Stn 115 (right). Small fraction represents the amount of chlorophyll a within 5–0.8 µm while large fraction corresponds
to the amount of chlorophyll a of community >5 µm.. . . 101 C.4 Major groups from the DNA community at Stn101 (left panels) and Stn 115
C.5 Alignment view of reference sequences and OTU from this study of A) Chaeto-ceros and B) Pseudo-nitszchia sp.. The mention GREENLAND and CANADA (or BOTH) correspond to the side where those OTUs had been retrieved. Align-ment of sequences using the automatic algorithm (scoring matrix 200PAM) of MAFFT v.7, phylogeny made using Randomized Axelerated Maximum Likeli-hood (RAxML) GTRGAMMA model, run 100 times and figures extracted from Geneious (version 8.1.7). Identical bases between sequences have been masked
for visualisation. . . 103 C.6 Number of unique OTUs and major groups they belong to from Stn 101 (left)
and Stn 115 (right). . . 104 C.7 Heatmap from the raw occurrence of sub selected OTUs from the ecological
networks. The hierarchical clustering methods UPGMA were used to generate dendograms. OTUs are represented in columns, while samples are in lines with samples from Stn 101 represented by the black box and those from Stn 115 by the red box. The colors code on the top of the graph represent the taxonomy of OTUs with legend given on the upper right corner of the figure (dark brown for ciliates, MALVs in grey, MASTs in light brown, Picozoa in red, Dinoflagellates in dark purple, Chrysophyceae in light purple, Diatoms in dark green, Chlorophyta
in green and Phaeocystales and Prymnesiales together in light green). . . 105 C.9 A Maximum Likelihood Ciliates tree generated using RAxML based on nearly
full length 18S rRNA gene sequences, which was used for the final EPA-RAxML placement of the short HTS-derived OTUs. Target OTUs are represented by their most similar sequences (in red), with accession numbers preceding their identities and strain/clone numbers. Taxonomic assignment was based on the nearest identified/annotated sequences, following Lynn (2001). Taxonomic ran-kings include Class : Order : Family. Bootstrap supports are represented by numbers in the nodes based on a final dataset of 1249 parsimonious base
posi-tions. . . 106 C.8 A Maximum Likelihood Dinoflagellates tree generated using RAxML based on
nearly full length 18S rRNA gene sequences, which was used for the final EPA-RAxML placement of the short HTS-derived OTUs. Target OTUs are represen-ted by their most similar sequences (in red), with accession numbers preceding their identities and strain/clone numbers. Taxonomic assignment was based on the nearest identified/annotated sequences, following Lynn (2001) . Taxonomic rankings include Class : Order : Family. Bootstrap supports are represented by numbers in the nodes based on a final dataset of 720 parsimonious base
positions. . . 107 D.1ACanonical correlation analysis (CCA) based on Chl a normalized concentrations
of all ancillary pigments (see Table S3) and taxa from sequencing (see Table
S6) for Stn 101 . . . 115 D.1BCanonical correlation analysis (CCA) based on Chl a normalized concentrations
of all ancillary pigments (see Table S3) and taxa from sequencing (see Table
S6) for Stn 115 . . . 116 D.2 Flow cytometric signature of the photosynthetic cells from 20 m samples of Stn
101, panel above, and Stn 115, panel below. The different colors represent the 5 categories of cells selected by forward scatter (size) (X axis) and fluorescence
Liste des abréviations et symboles
Abréviation Définition
ADN / DNA Acide désoxyribonucléique / Deoxyribonucleic acid
ADNr / rDNA ADNr 18S / rDNA 18S
ANOVA Analysis of variance
ARN / RNA Acide ribonucléique / Ribonucleic acid
ARNr / rRNA ARNr 18S / rRNA 18S
BB Baie de Baffin / Baffin Bay
CCA Canonical Correlation Analysis
CDOM Colored Dissolved Organic Matter
CDS Coding DNA Sequence
CFL Circumpolar Flaw Lead System Study
Chl a Chlorophyll a
Chl b Chlorophyll b
Chl c1 Chlorophyll c1
Chl c2 Chlorophyll c2
Chl c3 Chlorophyll c3
CTD Conductivity, Temperature, Depth
DA Domoic Acid / acide domoïque
Ddx Diadoxanthin
DGGE Denaturing Gradient Gel Electrophoresis / électrophorèse sur gel en gra-dient dénaturant
Dtx Diatoxanthin
Ek light-saturation parameter
FCM Cytométrie en flux / flow cytometry
FV/FM ratio of variable to maximum fluorescence
Fx Fucoxanthin
GIS Greenland Ice Sheet
h Hours / heures
HPLC High Pressure Liquid Chromatography / chromatographie en phase liquide à haute performance
HTS High Throughput Sequencing / séquençage haut débit
ICM Institut de Ciències del Mar
ITS2 Internal Transcribed Spacer region 2 / région de l’espaceur interne transcrite 2
lat Latitude
LHC Light Harvesting Complex
long Longitude
MAG Metagenome Assembled Genome
micromonol micromonol-like + unkChl
NCBI National Center for Biotechnology Information
OA Océan Arctique / Arctic Ocean
OTU Operational Taxonomic Unit / unité opérationnelle taxonomique
PAR Photosynthetically Active Radiation
PBmax normalized maximum photosynthetic rate
PCR Polymerase Chain Reaction
PE Photosynthesis vs Irradiance
PML Couche de mélange de surface / polar mixed layer
polB DNA polymerase B
PPE Picophytoeukaryote
RDA Redundancy analysis
SCM Chlorophylle maximum sous la surface / surface chlorophyll maximum SE Atlantic South-East Atlantic
Stn station
unkCar Unknown Caroten
unkChl Unknown Chlorophyll
Remerciements
La première personne que j’aimerais remercier est ma directrice de thèse Connie Lovejoy sans qui cette aventure n’aurait pas été possible. Scientifiques comme personnels, j’ai d’innom-brables souvenirs partagés avec toi qui me resteront gravés. Je ne te remercierai jamais assez pour tout le savoir que tu m’as transmis. Depuis notre premier road trip aux États-Unis jusque nos rencontres dans ton bureau sans fin en passant par notre séjour sur le terrain, j’ai toujours suivi tes bons conseils à la lettre tellement je te respecte et t’admire. Tu es une chercheuse exceptionnelle, toujours pleine de ressources et avec le cœur sur la main. Je serai éternellement reconnaissante pour ta patience, ta pédagogie, mais surtout pour la confiance que tu as pu m’accorder lorsque moi-même je n’y croyais pas. Je n’aurais pu imaginer meilleure directrice de thèse, merci infiniment pour tout.
Je tiens également à remercier mon codirecteur de thèse Marcel Babin qui a aussi grandement participé à rendre mon expérience doctorale enrichissante. La dynamique de Takuvik a été un moteur tout au long de mon parcours, me stimulant toujours à évaluer mes résultats dans un contexte pluridisciplinaire et océanographique. Je remercie également Maurice Levasseur, toujours de bon conseil et rassurant, tu as participé à me faire prendre confiance en ma science. Merci aussi à Frédéric Maps pour nos interactions bénéfiques tout au long de mon parcours. Je remercie également Virginia Edgcomb pour avoir accepté de faire partie de mon jury de thèse et pour son accueil chaleureux en 2013.
Un grand merci est attribué aux membres de l’équipe Lovejoy qui ont tous participé d’une façon ou d’une autre à ma réussite. Un remerciement tout particulier pour Marianne Potvin qui m’a guidée dans beaucoup d’étapes de mon doctorat, Mary Thaler toujours disponible pour discuter et partager son expertise, Sophie Crevecoeur pour toutes ces années passées à se supporter professionnellement et personnellement dans notre bureau commun, Dimitri toujours prêt à partager son savoir et à me donner des conseils divers et variés. Merci également à Adrian pour ses corrections. Merci à Vani, Loïc et Nastasia pour leur support. Finalement, mention spéciale pour Deo Florence Onda, sans qui je n’aurais jamais été capable de tenir la cadence, tu m’as aidée à me relever à chaque fois que je perdais espoir. Merci de m’avoir tant inspirée.
des données du terrain, je voudrais chaleureusement remercier les équipes Babin, Tremblay, Gosselin, Levasseur, Fortier et Vincent, rien ne serait arrivé sans un travail d’équipe. Un merci particulier à Flavienne Bruyant, Joannie Ferland, Jonathan Gagnon, Gabrielle Deslongchamps, Jade Larivière, Thomas Lacour, Sarah-Jeanne Royer, Marie-Josée Martineau et Marjolaine Blais qui ont personnellement participé à la collecte et à la compréhension des données. Merci à Marie-Hélène, Debbie et Julie pour leur accueil et leur serviabilité. J’aimerai aussi remercier Ramiro Logares pour m’avoir accueillie dans son laboratoire à l’ICM en 2015 (Barcelone) et pour avoir participé à ma formation bio-informatique. Je remercie également Adam Monier et Mathieu Ardyna, votre collaboration a beaucoup aidé à valoriser mes articles.
Je remercie tous mes proches pour leur soutien inconditionnel, je me suis sentie épaulée à distance par chacun d’entre vous. Même si mon départ de France il y a 5 ans a été un dé-chirement, je sais aujourd’hui que c’était pour la bonne cause. Un merci particulier pour ma maman d’amour qui trouve toujours les bons mots pour me donner du courage. Je remercie également mon p’tit bout de famille québécoise, la famille Lebel indispensable à mon bien-être tout au long de ces années. Une rencontre inoubliable qui restera gravée dans mon coeur. Un merci particulier à ma dreamteam pour tous nos bons moments Lucie, Karine, Maya, Candice et Laurent, notre amitié solide a été mon pilier et je vous serai éternellement reconnaissante pour m’avoir soutenue dans les bons comme dans les mauvais moments. Je terminerai ces re-merciements par une personne qui, en plus d’avoir passé approximativement 172h à formater ma thèse, a été mon binôme, mon frère de cœur et mon colocataire durant toutes ces années, mon Nico, je t’aime !
Avant-propos
Cette thèse de doctorat en océanographie comporte cinq chapitres incluant une introduction et une conclusion générale. Le cœur de la thèse est constitué de trois articles de recherche, identifiés I, II et III et correspondant aux chapitres 2, 3 et 4 dans la table des matières. Les trois articles sont rédigés en anglais dans le but d’être publiés dans des revues scientifiques avec pour thème général, l’étude multi échelle des communautés microbiennes dans l’Océan Arctique (OA). Le 2ème chapitre a fait l’objet d’une publication scientifique dans le Journal de l’ISME et présente la succession des prasinophytes en surface sur une période de 8 mois (novembre 2007 à juillet 2008) incluant la Nuit Polaire dans le golfe d’Amundsen. Ce chapitre a été conduit dans le cadre du programme Circumpolar Flaw Lead System Study (CFL) sous la direction scientifique du Pr David Barber. Le 3ème et le 4ème chapitre sont en préparation pour soumission sous peu et présentent des résultats issus d’échantillons collectés en surface, à 20 m et à la SCM à l’est et à l’ouest de la BB. Ces chapitres ont été réalisés dans le cadre de la campagne océanographique du Réseau de centres d’excellence du Canada ArcticNet 2013. Dans le cas du 3ème chapitre, nous présentons la diversité spatiale des communautés microbiennes et des conditions environnementales observées de chacun des côtés de la BB. Le 4ème chapitre s’intéresse à la variation spatiale et temporelle des communautés microbiennes et des paramètres photo physiologiques de chacun des côtés de la BB. Pour chacun des chapitres de thèse, j’ai contribué à la conception et la planification des problématiques ciblées avec l’aide de Connie Lovejoy. Alors que la prise d’échantillons sur le terrain a été assurée en partie par Ramon Terrado et Emmanuelle Medrinal pour le 2ème chapitre, j’ai moi-même effectué la prise d’échantillons sur le terrain pour les chapitres 3 et 4 avec l’aide de David Colatriano. Certains échantillons pour ces chapitres ont aussi été collectés par Marjolaine Blais, Thomas Lacour, Jade Larivière, Joannie Ferland, Gabrièle Deslongchamps, Jonathan Gagnon et Sarah-Jeanne Royer. J’ai procédé aux analyses en laboratoire avec l’aide de Marianne Potvin et analyses bio-informatiques avec l’aide de Jerôme Laroche, Ramiro Logares, Adam Monier, Deo Florence Onda et Laura Benestan. Enfin, j’ai procédé à la rédaction de tous les chapitres de thèse en prenant en compte les corrections et commentaires des coauteurs pour le premier article, et ceux de Connie Lovejoy pour tous les chapitres. Les détails des articles scientifiques de thèse destinés à la publication se trouvent ci-dessous :
Bathy-coccus unveiled in an Arctic winter metagenome
Auteurs : Nathalie Joli, Adam Monier, Ramiro Logares et Connie Lovejoy Publié le 7 mars 2017 dans ISME Journal, 2017.
Article II. Baffin Bay as a Janus gateway
Auteurs : Nathalie Joli, Marcel Babin, Mathieu Ardyna, Deo Florence Onda, Jean-Éric Trem-blay, Michel Gosselin et Connie Lovejoy
En préparation, destiné à être soumis à un journal scientifique.
Article III. Photosynthetic microbial communities and photophysiology in Northern Baffin Bay
Auteurs : Nathalie Joli, Marcel Babin, Connie Lovejoy
En préparation, destiné à être soumis à un journal scientifique.
Par ailleurs, les travaux de recherche de la thèse ont été présentés sous la forme de présentations orales et affiches à des réunions scientifiques générales de l’Institut des Sciences Marines (ICM, Barcelone, Espagne), de l’Institut de Biologie Intégrative et des Systèmes (IBIS, Québec, Canada), du Réseau ArcticNet, du Chantier Arctique 2013 (Paris) et du regroupement Québec-Océan (Québec, Canada). De plus, des résultats préliminaires de l’article I ont été présentés sous la forme d’une affiche à la conférence Gordon (Massachusetts, États-Unis, juin 2014) et sous la forme d’une présentation orale à la conférence ASLO (Grenade, Espagne, février 2015). J’ai personnellement conçu et communiqué chacun de ces présentations et posters (à l’exception de l’affiche « Aquatic protist communities in the midst of environmental change : using 18S rRNA gene surveys to identify diversity over time and space » produite par Mary Thaler) dont les détails sont donnés ci-dessous :
Nathalie Joli, Deo Florence Onda, Robyn Edgar, Connie Lovejoy. 2012. Omics in the Arctic. Affiche présentée à l’AGA Québec-Océan 2012, Montréal, Canada.
Nathalie Joli, Marcel Babin, Connie Lovejoy. 2013. Metagenomics and metatranscriptomics of Arctic microbial plankton. Affiche présentée à l’AGA Québec-Océan 2013 (Rivière-du-Loup, Canada), au Chantier arctique 2013 (Paris, France) et au meeting scientifique annuel d’Arc-ticnet 2013 (Halifax, Canada).
Nathalie Joli, Marcel Babin, Connie Lovejoy. 2014. Bathycoccus and Micromonas in a winter Arctic metagenome. Affiche présentée à la Gordon Research Conference « Marine Microbes », Université de Bentley, Massachusetts, États-Unis ainsi qu’à l’AGA de 2015 de Québec-Océan, Rivière-du-Loup, Québec, Canada.
Mary Thaler, Sophie Crevecoeur, Nathalie Joli, Deo Florence Onda, Bérangère Péquin, Anna Przytulska-Bartosiewicz, Warwick Vincent, Connie Lovejoy. 2015. Aquatic protist communities in the midst of environmental change : using 18S rRNA gene surveys to identify diversity over time and space. Affiche présentée à la journée étudiante de l’IBIS, Université Laval, Québec,
Canada.
Nathalie Joli, Ramiro Logares, Marcel Babin, Connie Lovejoy. 2015. Bathycoccus and Micromonas in a winter Arctic metagenome. Présentation orale à l’ASLO dans la session « Protistomics », Grenade, Espagne.
Nathalie Joli, Ramiro Logares, Connie Lovejoy. 2015. Metagenomic analysis of a winter Arctic sample. Présentation orale à l’ICM, Barcelone, Espagne.
Nathalie Joli, Adam Monier, Ramiro Logares et Connie Lovejoy. 2016. Seasonal patterns in Arctic prasinophytes and inferred ecology of Bathycoccus unveiled in an Arctic winter me-tagenome. Affichée présentée à l’ISME 16th International Symposium on Microbial Ecology, Montréal, Canada, ainsi qu’à l’AGA de Québec-Océan 2016, Rimouski, Canada.
Mes recherches ont été possibles en partie grâce à l’appui financier de la chaire d’excellence du Canada et de l’unité mixte internationale Takuvik. J’ai également eu la chance d’être la récipiendaire d’une bourse de « Leadership et développement durable » (Université Laval) pour ma première année de recherche de 2012 à 2013. En parallèle, j’ai aussi obtenu une bourse de stage de courte durée à l’international (2 mois) délivrée par Québec-Océan qui m’a permis d’assurer mon déplacement à Grenade pour une conférence internationale et à Barcelone pour un stage à l’Institut des Sciences de la Mer (ICM) sous la supervision de Ramiro Logares de mars à mai 2015.
Dans un volet social, j’ai aussi eu la chance d’apporter ma contribution au sein du regroupe-ment Québec-Océan puisque je suis l’une des deux représentants étudiants de l’Université Laval au sein du Conseil Administratif et du Comité de Concertation et diffusion de la recherche depuis 2015. Ce poste m’a permis d’apprendre beaucoup de choses sur le fonctionnement d’une institution comme celle de Québec-Océan, me préparant ainsi à toutes les sortes de défis aux-quels les chercheurs et institutions de cette envergure sont confrontés de nos jours. Également, mon implication au sein de ce poste m’a permis de participer à l’organisation d’activités so-ciales dans le but ultime de rassembler un maximum de chercheurs et d’étudiants afin de leur faire partager leur savoir et leur science.
Chapitre 1
Introduction générale
1.1
L’Océan Arctique
Les océans couvrent environ 70% de la surface terrestre et jouent un rôle fondamental dans les processus ayant des impacts écologiques et socioéconomiques à l’échelle mondiale (Bigg et al., 2003). Ils sont une composante essentielle du système climatique et atténuent partiellement le changement global dû aux activités anthropiques. Malgré sa faible superficie, les altérations climatiques de l’environnement en réponse aux pressions anthropogènes, sont connues pour être plus intenses dans l’OA (Stocker, 2014) comparé aux autres endroits de notre planète. Face aux effets du changement climatique, l’OA est considéré comme un carrefour important où se disputent plusieurs enjeux majeurs, d’intérêts économiques, sociaux, météorologiques comme écologiques (Jeffries et al.,2013).
1.1.1 Complexité de la structure hydrographique
Entouré de terre, l’OA peut être considéré comme un double estuaire (Carmack and Wass-mann,2006;McClelland et al.,2012), composé d’une grande région de plateaux continentaux et de deux bassins profonds : le bassin Canadien et le bassin de Nansen. Cet océan est égale-ment étroiteégale-ment lié aux océans Pacifique et Atlantique puisqu’il reçoit d’une part des masses d’eau atlantiques à travers la mer de Barents et le détroit de Fram et d’autre part des eaux pacifiques à travers le détroit de Béring (Figure 1.1).
En pénétrant dans l’OA, les eaux chaudes et salées originaires de l’Atlantique Nord se pro-pagent dans le bassin à des profondeurs comprises entre 200 et 800 m (Aagaard and Carmack, 1989;McLaughlin et al.,2009) avec une partie de cette chaleur qui s’échappe vers le sud au niveau du détroit de Fram. La branche dérivée de la mer de Barents refroidit rapidement et délivre des masses d’eaux aux bassins arctiques profonds (Lien and Trofimov,2013). En pa-rallèle, les apports d’eau pacifique dans l’OA varient de façon saisonnière avec des intrusions de masses d’eau plus chaude et moins saline au cours de l’été (Pacific Summer Water (PSW)
Figure 1.1 – Les courants de surface principaux dans l’OA. L’eau issue du Pacifique est illus-trée en bleu et celle issue de l’Atlantique en rouge. Source : Figure extraite depuisWassmann et al. (2015).
– 40 à 80 m de profondeur) et des masses d’eau plus froide et plus saline lors des périodes hivernales (Pacific Winter Water (PWW) – 80 à 200 m de profondeur). Ces apports variés ad-ditionnés aux apports d’eau douce provenant des rivières engendrent une circulation océanique dynamique et complexe dans cette région. De plus, la topographie particulière des bassins du Canada et de Nansen participe au caractère hétérogène de cet océan à travers l’existence de différentes écorégions caractérisées par des conditions physico-chimiques diverses et variées (Williams and Carmack,2015) (Figure 1.2).
Certains auteurs considèrent que l’OA est composé de cinq écosystèmes qui contribuent de façon différente à la productivité et aux cycles biogéochimiques de l’océan (Carmack and Wassmann, 2006). Les deux bassins séparés par la dorsale de Lomonosov constituent deux écosystèmes et les régions des plateaux continentaux, incluant les régions de flux entrant (mer de Barents et de Bering), les régions de flux sortant (détroit de Fram et archipel canadien) et les flux internes (mer de Sibérie et de Beaufort) constituent trois autres écosystèmes parti-culiers. Également, ces différents écosystèmes sont caractérisés par la présence d’associations d’espèces marines dominantes de zooplancton, de poissons marins, d’oiseaux et de mammifères contrastées (Wassmann et al.,2015;Wong et al.,2014).
1.1.2 Sites d’étude
Entre le Groenland et l’île d’Ellesmere, le nord de la BB est un système océanique productif où l’on observe la présence d’une grande étendue d’eau ouverte et libre de glace persistante. Cette étendue d’eau libre, plus communément nommée polynie, présente des caractéristiques phy-siques particulières permettant d’offrir des conditions favorables aux producteurs primaires.
Figure 1.2 – Cartes montrant a) la bathymétrie de l’OA à partir de « l’International Bathy-metric Chart » (Jakobsson et al., 2012) et b) les noms des principaux bassins, des dorsales océaniques, des régions continentales et des détroits. Source : Figure extraite depuisCarmack et al. (2016).
En effet, les eaux de surface de la polynie sont exposées aux rayonnements solaires beaucoup plus tôt dans l’année comparée aux eaux adjacentes encore couvertes de glace (Tremblay et al., 2002). Ainsi, on observe le développement d’une floraison printanière plus précoce par rapport aux nombreuses autres régions arctiques (Melling et al., 2001;Bâcle et al.,2002). La polynie des eaux du Nord est historiquement l’une des zones marines les plus productives de l’OA. Elle est également considérée comme un habitat clé pour les prédateurs des niveaux trophiques supérieurs de l’Arctique tels que les grands oiseaux et les mammifères marins (Stirling and Cleator,1981;Heide-Jørgensen et al.,2013). De nombreux facteurs participent à la formation et à la maintien de cette polynie. Dans le nord de la BB, la formation annuelle d’un pont de glace à l’extrémité sud du détroit de Nares empêche la glace de mer de dériver vers le sud et permet aux vents forts du nord ainsi qu’au flux de chaleur sensible de favoriser les conditions d’eau libre de glace (Tremblay et al.,2006). Sa formation est généralement observée autour du détroit de Smith à la fin du mois de mars ou au début du mois d’avril et atteint généra-lement son étendue maximale à la fin juillet (Tremblay et al.,2002). En parallèle, on observe une augmentation de la température des eaux le long des côtes du Groenland en raison du courant Ouest du Groenland qui franchit le détroit de Davis pour s’unir au courant de la mer de Baffin amenant des eaux plus chaudes et plus salées en surface suite à des remontées d’eau profonde. Par la suite, ces eaux rejoignent la circulation cyclonique du nord de la BB. Du côté ouest de la baie, des eaux issues du Pacifique pénètrent principalement via le détroit de Nares amenant, depuis l’Arctique, des eaux moins salines, plus froides et riches en nutriments le long des côtes du Canada. Ainsi, la BB présente deux côtés hydrologiquement hétérogènes,
pouvant avoir des répercussions sur les communautés s’y développant. Dans le 3ème chapitre de thèse, nous nous intéresserons à l’influence des courants océaniques aux diverses origines sur les communautés microbiennes eucaryotes.
Le golfe d’Amundsen est un grand canal d’environ 400 km de long et 170 km de large qui relie le sud-est de la mer de Beaufort à l’archipel canadien. La couverture saisonnière de glace de mer commence à se former en octobre près de la côte et est généralement consolidée sur la région à la fin du mois de décembre (Galley et al.,2008). Au début du mois d’avril, un pont de glace se forme (60% du temps entre 1980 et 2007) au sud de l’île Banks jusqu’à la côte et la glace de mer disparaît progressivement à partir du moins de juin lorsque les vents et/ou la circulation de surface poussent la glace de mer loin du golfe, générant ainsi l’ouverture d’une polynie. Une vision simplifiée de l’organisation verticale des masses d’eau dans cette région comprend la couche de mélange de surface (PML), relativement fraîche et retrouvée jusque 50 m de profondeur, l’halocline du Pacifique et ses composantes hiver-été dérivées des eaux de la mer de Béring (50–200 m), et les eaux profondes d’origine Atlantique (>220 m). Alors que la circulation océanique dans la région est variable et pas complètement résolue à ce jour, les eaux de surface sont généralement influencées par le gyre anticyclonique de Beaufort et pénètrent dans le golfe d’Amundsen près de l’île de Banks pour ressortir au niveau du cap Bathurst (Lanos, 2009). En dessous de la surface (>50 m), la circulation est habituellement dominée par le courant est de Beaufort qui amène les eaux du Pacifique et de l’Atlantique dans le golfe d’Amundsen (Barber et al.,2010).
1.1.3 Successions saisonnières
Du fait de sa localisation polaire, l’Arctique présente une forte saisonnalité avec des conditions environnementales contrastées en termes de lumière, température, concentration en glace de mer, couvert de neige et disponibilité en éléments nutritifs. La présence d’une nuit polaire, la hauteur du soleil et l’épaisseur changeante de la neige jouent également un rôle dans le développement annuel de l’écosystème pélagique de l’OA comme illustré dans la Figure 1.3. En effet, l’hiver en Arctique est caractérisé par une période dite de nuit polaire, lors de laquelle l’angle du soleil avec la Terre est tel qu’il entraîne la présence de cycles de 24 h d’obscurité accompagnée d’un couvert de glace maximal. Lors de cette période, les nutriments sont abon-dants dans la colonne d’eau, provenant des remontées d’eaux profondes riches en nutriments qui diffusent dans la couche de surface. Cependant, les conditions de faible disponibilité en lumière limitent l’activité biologique. Dans les zones de glace saisonnière, on observe ensuite une période de transition lors de laquelle les cycles lumineux changent avec l’augmentation progressive de la quantité lumière reçue. L’amincissement de la couche de glace, relativement épaisse au printemps, crée une stratification des couches de surface et la disparition du cou-vert de neige permet à la lumière de traverser peu à peu le coucou-vert de glace en cours de fonte. Toutes ces conditions permettent le développement d’une floraison brève mais intense
Figure 1.3 – Saisonnalité du développement de la floraison algale et exportation de carbone. Le gradient de couleur des flèches verticales depuis le vert vers le rouge indique la biomasse suspendue, depuis les sources autotrophes vers les sources hétérotrophes. La largeur des flèches est proportionnelle à la quantité moyenne et les couleurs illustrent la nature de la composi-tion de la matière organique qui est exportée verticalement. Vert foncé = carbone dérivé des algues de glace. Vert clair = carbone dérivé du phytoplancton. Orange et rouge = degré crois-sant de détritus (matière organique particulaire non vivante). Source : Figure extraite depuis Wassmann and Reigstad (2011).
du phytoplancton. La couche d’eau au sein de laquelle les nutriments sont épuisés s’appro-fondit continuellement pendant cette période de production. Au printemps, la croissance des algues dépasse sa dégradation et la biomasse autotrophe devient dominante. Par la suite, les processus hétérotrophes (flèches rouges) prennent progressivement le dessus (représentés par des flèches vertes sur la Figure 1.3). Ce déclin progressif de la concentration en algues s’ac-compagne d’une exportation verticale de la matière organique. À la fin du printemps et au début de l’été, une nouvelle période s’installe, la période dite post-floraison, lors de laquelle les nutriments provenant des eaux de surface sont épuisés. La disponibilité en lumière per-met tout de même à la prolifération des espèces photosynthétiques. Cependant, cette floraison printanière se poursuit généralement plus en profondeur, là où les nutriments sont encore dis-ponibles, formant ainsi ce qu’on appelle un SCM. À la fin de cette période, les conditions hivernales reprennent le dessus et le cycle recommence. Cette saisonnalité particulière sera le tronc commun de ma thèse, avec un intérêt particulier pour les organismes survivant pendant la nuit polaire dans le 2ème chapitre et l’adaptation des communautés photosynthétiques aux cycles de lumière de fin d’été en Arctique dans le 4ème chapitre.
1.2
Les écosystèmes planctoniques
1.2.1 Diversité taxonomique des protistes
Il existe un paradigme largement reconnu en océanographie, reposant sur le fait que les cyano-bactéries picoplanctoniques photosynthétiques, telles que Synechococcus ou Prochlorococcus, sont abondantes dans tous les mers et océans (Scanlan and West,2002). En plus de la présence ubiquitaire de ces petits phototrophes, de plus larges eucaryotes photosynthétiques, tels que les diatomées, les prymnésiophytes ou encore les dinoflagellés, sont connus pour leurs contri-butions notables à la production primaire lors des floraisons printanières (Smetacek et al., 1990). Cependant, l’une des caractéristiques des écosystèmes marins arctiques est l’absence de population de picocyanobactéries (Li,1998), pouvant traduire l’existence de filtres écologiques ou de barrières géographiques empêchant leur distribution mondiale. À la place de celles-ci, on reporte de fortes concentrations de cellules appartenant au plancton microbien eucaryote. Depuis plus de 20 ans, plusieurs auteurs soupçonnent une présence en abondance des petits prasinophytes de type Micromonas pusilla dans les eaux arctiques européennes (Throndsen and Kristiansen, 1991) et de récentes études ont pu confirmer leur dominance à la fin de l’été, accompagnés d’un second prasinophyte, Bathycoccus prasinos (Lovejoy et al., 2002a; Not et al., 2005). Ces résultats suggèrent que les espèces de picoprasinophytes peuvent per-sister au travers des saisons et pourraient être considérés comme des espèces alternatives des picocyanobactéries. Cependant, ce que l’on regroupe sous le terme de plancton microbien eu-caryote correspond en fait à un ensemble d’organismes divers et complexes. En effet, ce terme inclut aussi bien des espèces de chlorophytes appartenant au super groupe des Archaeplas-tida, que des alvéolés tels les dinoflagellés et ciliés, des straménopiles comme les diatomées, des chrysophyceae ou encore des straménopiles marins (MASTs). Parmi les objectifs fonda-mentaux pour les biologistes de nos jours, on retrouve souvent cette volonté et nécessité de comprendre l’ampleur de la diversité biologique, comment les processus évolutifs donnent nais-sance à cette diversité et également comment ces communautés se créent et maintiennent leurs différentes fonctions au sein des écosystèmes et cycles biogéochimiques. De par leur abondance et leur présence ubiquitaire, les protistes sont des candidats idéaux pour tenter de répondre à certaines de ces questions.
1.2.2 Diversité trophique des protistes
Les protistes sont caractérisés par des taux métaboliques rapides, soutenant les pêcheries les plus importantes au monde. Ils jouent un rôle essentiel en tant que producteurs primaires et consommateurs à la base des réseaux alimentaires marins. Alors qu’environ la moitié de la productivité primaire mondiale se produit dans les océans, une grande partie est produite par des protistes photosynthétiques (Field et al., 1998). En raison de leur panoplie de taille, la production primaire assurée par les protistes peut engendrer des entrées de matière organique au travers d’herbivores ayant des gammes de taille variées. Non seulement ces protistes ont une
diversité phylogénétique et morphologique importante, mais ces organismes présentent aussi de nombreux modes de nutrition, allant de l’hétérotrophie à l’autotrophie en passant par la mixotrophie. L’hétérotrophie désigne la nécessité d’une cellule ou un organisme d’avoir recours à des sources de matières organiques exogènes afin de produire sa propre matière organique. L’autotrophie désigne la capacité d’un organisme à produire de la matière organique par réduc-tion de matière inorganique ou minérale. Le concept de mixotrophie est en fait un mélange de ces deux stratégies nutritives. Les protistes hétérotrophes peuvent être consommateurs de bac-téries, tel que les cyanobacbac-téries, d’autres protistes, de virus et de certains métazoaires, ainsi ils contribuent de façon significative à plusieurs niveaux de la chaîne alimentaire. L’importance des protistes phagotrophes en tant que consommateurs de certains producteurs primaires dans l’océan a été reconnue depuis plusieurs décennies (Sherr and Sherr,1994), mais ce fait reste encore sous-estimé. En effet, en gardant une vision plus classique de la chaîne alimentaire (phytoplancton-copépode), l’interprétation du flux d’énergie et de carbone dans les océans est nettement biaisée. Dans de nombreuses situations, la prédation du phytoplancton par les dinoflagellés et les ciliés hétérotrophes constitue un lien trophique plus important que le lien phytoplancton-copépode (Calbet and Saiz,2005). De plus, certains protistes, notamment des dinoflagellés hétérotrophes et les ciliés, sont capables de phagotrophie et possèdent des struc-tures spécialisées (tentacules, pédoncules) leur permettant de consommer des proies de grande taille (Caron,1990;Jacobson, 1999). À titre d’exemple, on soupçonne que la consommation des longues chaînes de diatomées par des petits dinoflagellés hétérotrophes est largement sous-évaluée (Sherr and Sherr,2007). Parallèlement, il existe des organismes mixotrophes, capables de combiner une nutrition photosynthétique et hétérotrophe au sein de la même cellule. Ce comportement mixotrophique complique la structure de la chaîne alimentaire puisque pen-dant longtemps les modèles de flux de carbone et d’énergie décrivaient les organismes comme purement phototrophes ou hétérotrophes. Cependant, le terme mixotrophie regroupe de nom-breuses variantes puisque certains organismes sont photosynthétiques mais peuvent phagocyter leur proie, alors que d’autres sont hétérotrophes mais peuvent maintenir des chloroplastes vo-lés (kleptoplastidie). Tous les arguments discutés ci-dessus témoignent du rôle essentiel joué par les protistes, un rôle pivot dans les écosystèmes et les chaînes alimentaires marines. Ces organismes sont d’autant plus importants puisqu’ils jouent un rôle dans les cycles biogéochi-miques océaniques. En effet, des études récentes se focalisent sur l’identification des espèces et de leur potentiel génétique en lien avec leur implication dans les cycles des éléments mais aussi en lien avec la production ainsi que l’utilisation de l’énergie dans les océans (Gilbert and Dupont,2011;Massana,2011).
1.2.3 Complexité des écosystèmes microbiens
Dans les milieux pélagiques naturels, les conditions de température, de lumière ou encore de disponibilité en nutriments peuvent être très dynamiques avec des conditions environne-mentales variant selon différentes échelles spatiales et temporelles. À la vue de la diversité
taxonomique et trophique des microorganismes, on peut facilement imaginer que ces derniers sont capables de s’adapter à de très grandes variations environnementales. Cette adaptation est d’autant plus critique lorsqu’il s’agit d’organismes planctoniques photosynthétiques, puisque la majorité d’entre eux sont passivement transportés et ne sont pas en mesure d’échapper à des conditions défavorables (à l’exception des espèces pouvant former des kystes). Alors que les grands changements de conditions nutritives peuvent se produire sur des échelles de temps de l’ordre du jour ou de la saison, la variation des conditions lumineuses peut se produire sur des périodes beaucoup plus courtes, de l’ordre de quelques secondes à quelques heures ou jours (Klausmeier and Litchman, 2001). Ainsi, les organismes photosynthétiques marins doivent trouver le bon compromis entre une efficacité de l’absorption lumineuse d’une part, et une réponse photoprotectrice rapide d’autre part, afin de pouvoir assurer une bonne croissance. La photoprotection est indispensable à l’efficacité de la photosynthèse puisqu’elle vise à limiter l’exposition des cellules au rayonnement solaire, lorsque celui-ci est trop intenses. Par exemple, les auteurs Falkowski and Knoll (2007), soupçonnent que le succès écologique des diatomées est lié à l’existence de pigments photoprotecteurs spécifiques impliqués en partie dans le cycle des xanthophylles leur permettant indirectement de récolter la lumière plus efficacement que les algues vertes (Nicklisch, 1998). Ainsi, les niches écologiques de ces microorganismes sont fatalement associées à leur capacité à s’adapter aux conditions de lumière environnantes. Ces notions seront abordées dans le chapitre 4 dans lequel nous nous intéresserons particulièrement à l’effet du cycle de 24 h de lumière sur les communautés photosynthétiques.
Les conditions environnementales sont un élément critique pour le succès écologique des es-pèces photosynthétiques, cependant le lien prédateur-proie est lui aussi un paramètre essentiel pour le contrôle de la production primaire. Malgré les multiples débats à ce sujet (Dolan and McKeon,2005), la prédation du microzooplancton (ciliés et dinoflagellés) sur le phytoplanc-ton est généralement considérée comme la principale pression prédatrice sur la production primaire planctonique, réduisant de 60 à 70% ses effectifs (Calbet and Landry, 2004). Le mésozooplancton (copépodes), consomme généralement 10 à 40% de la production primaire (Calbet,2001). La prédation par le microzooplancton entraîne une régénération et un recyclage rapide des éléments nutritifs, plus communément connu sous le nom de boucle microbienne. Cette dernière aide à maintenir un taux de nutriments élevé, les rendant disponibles pour les communautés phototrophes et favorisant leur croissance (Flynn and Fielder,1989). De ce fait, la production primaire semble être limitée lorsque la régénération des nutriments est insuffi-sante (Flynn,1989) ou lorsque la pression prédatrice est trop forte. À l’inverse, les floraisons printanières peuvent être perçues comme des événements générés par l’échec des brouteurs à contenir la production primaire. Ainsi, les floraisons algales peuvent se traduire par une per-turbation environnementale qui déstabilise les liaisons trophiques établies dans un écosystème en équilibre, permettant à une espèce opportuniste de s ?emparer de la ressource limitante. En rompant cet équilibre, on peut observer une modification de la composition en espèces, ces dernières ayant divers rôles écologiques. On peut citer par exemple, le cas des floraisons
prin-tanières dominées par des diatomées qui contribuent largement aux cycles biogéochimiques de par leur croissance rapide (Smetacek,1999), alors que des floraisons printanières dominées par des espèces de dinoflagellés peuvent former des proliférations d’algues nuisibles (Hallegraeff, 1993). En conclusion, les composantes biotiques et abiotiques des écosystèmes microbiens sont toutes intimement liées et peuvent être vues comme des vases communicants qui dépendent indéfiniment des uns des autres, ainsi la moindre perturbation peut mener à une cascade de conséquences. Ce lien fragile entre paramètres abiotiques et biotiques sera abordé dans le chapitre 3 au sein duquel nous chercherons d’une part à mettre en évidence les paramètres en-vironnementaux qui influencent les communautés et d’autre part à étudier les liens écologiques entre espèces qui résident au sein de chaque écosystème.
1.3
Les outils dérivés de la biologie moléculaire et leurs
applications
Traditionnellement, les méthodes pour déterminer les abondances et activités écologiques des protistes dans les écosystèmes marins impliquent le plus souvent l’utilisation d’outils de visua-lisation, de mise en culture ou encore d’expérimentation en laboratoire avec pour but ultime de vérifier les informations observées sur le terrain. Ces approches ont permis d’établir de bonnes bases pour la compréhension d’un bon nombre des rôles écologiques des protistes dans les communautés naturelles et ont également permis de développer des modèles décrivant ces activités. Néanmoins, la documentation précise de toute la diversité des protistes dans un échantillon provenant d’une communauté naturelle est une lourde tâche, d’une part à cause de la richesse de cette diversité, d’autre part à cause de la complexité de leur taxonomie. Par ailleurs, certaines de ces techniques traditionnelles peuvent devenir limitantes lorsqu’il s’agit par exemple d’identifier rapidement et facilement des petits protistes ayant la même morpho-logie. Finalement, la compréhension des phénomènes écologiques exige de plus en plus une collecte et un traitement d’un grand nombre d’échantillons, rendant ces approches coûteuses et peu pratiques. Depuis plusieurs décennies, les approches basées sur l’analyse des séquences d’acides nucléiques (ADN) ont révolutionné l’écologie microbienne et notamment notre capa-cité à identifier et quantifier les protistes dans leur environnement. Ces approches moléculaires ont permis de développer des analyses taxonomiques applicables aux diverses technologies de séquençage en constante évolution (Caron et al.,2009). Cependant, l’utilisation de l’ADN n’est pas universellement acceptée, et ce pour de multiples raisons. Parmi celles-ci, on retrouve le cas du séquençage par amplicon des gènes ribosomaux qui nécessite une étape d’amplification par PCR au préalable lors de laquelle une affinité préférentielle des amorces pour certains groupes a été observée (Potvin and Lovejoy, 2009). Une seconde contrainte de cette métho-dologie est le nombre de copies du gène ribosomique présent dans les génomes pouvant être variable chez différents taxons, ainsi certaines espèces peuvent être favorisées lors de l’am-plification par PCR. Malgré le fait que ces critiques doivent être considérées, les approches