© Valerica Pandarus, 2019
Une nouvelle classe de catalyseurs hétérogènes au
palladium et au platine pour la chimie organique de
synthèse
Thèse
Valerica Pandarus
Doctorat en génie chimique
Philosophiæ doctor (Ph. D.)
UNE NOUVELLE CLASSE DE CATALYSEURS
HÉTÉROGÈNES AU PALLADIUM ET AU PLATINE
POUR LA CHIMIE ORGANIQUE DE SYNTHÈSE
Thèse
Valerica Pandarus
Sous la direction de :
Serge Kaliaguine, directeur de recherche
François Béland, codirecteur de recherche
iii
Résumé
Les catalyseurs à base de palladium/platine (Pd/Pt) étudiés font partie d'une nouvelle gamme de catalyseurs hétérogènes développée chez SiliCycle pour la chimie fine et la chimie pharmaceutique. Ces catalyseurs sont des nanoparticules (NPs) de Pd/Pt séquestrées dans les cages mésoporeuses d’un support organosilicique MeSiO1,5. Le caractère hydrophobe des
catalyseurs est généré par la présence des groupes méthyle du silane méthyltriétoxysilane (MTES) utilisé comme monomère dans la synthèse du support. Ces catalyseurs hétérogènes, stables à l’air et à l’humidité, se sont révélés hautement réactifs dans de nombreuses réactions chimiques, notamment dans des conditions douces de température et de pression, comme par exemple dans des réactions de couplages carbone-carbone, d’hydrogénation ou d’hydrosilylation. La problématique est que ces catalyseurs se sont révélés réactifs seulement pour des faibles teneurs en métal (0,5 % massique de Pd et 2,0 % massique de Pt) et que leur activité catalytique diminue considérablement lors des essais de réutilisation à température et pression éllevées. Dans ces conditions, les catalyseurs ne sont plus réutilisables.
L’objectif principal de cette thèse est d’apporter des améliorations à cette classe de catalyseurs hydrophobes afin d’augmenter d’avantage leur activité catalytique et leur sélectivité. Ainsi, des nouveaux matériaux catalytiques hétérogènes, caractérisés par une meilleure résistance mécanique et une meilleure stabilité de NPs métalliques de Pd/Pt au frittage avec une capacité de réutilisation élevée dans des conditions douces, mais également à des températures et des pressions élevées, ont été développés. Leur activité catalytique a été évaluée dans des applications vertes à fort impact industriel. L’activité catalytique des catalyseurs au Pd a été évaluée dans l’hydrogénation du squalène en squalane, un hydrocarbure entièrement saturé, facilement adopté par les formulateurs en cosmétique pour ses excellentes propriétés, comme par exemple sa grande stabilité à l’oxydation, au rancissement et à la chaleur. L’activité catalytique des catalyseurs au Pt a été évaluée dans la réaction d’hydrosilylation, l’une des méthodes les plus importantes pour la synthèse des composés organosiliciés et en particulier, pour la production des organosilanes par l’addition des liaisons Si-H aux doubles liaisons à l’échelle industrielle.
iv
Tout d’abord, le support organosilicique a été dopé avec des unités Al2O3. Les nouveaux
catalyseurs à base de NPs de Pd/Pt sur un support organosilicique dopé avec des unités Al2O3,
Pd0/MeSiO1,5-Al2O3 et Pt0/MeSiO1,5-Al2O3, se sont démarqués par une stabilité élevée à l'air et
à l'humidité. L’ajout de 2 % massique d’Al2O3 a permis d’augmenter la teneur en Pd de 0,5 à
2,0 % massique et la teneur en Pt de 2,0 à 5,0 % massique tout en maintenant une très grande dispersion du métal (NPs de Pd/Pt d’environ 2-4 nm). L’ajout d’Al2O3 a également augmenté
leur activité catalytique autant dans des conditions douces qu’à température et pression élevées, en raison de la présence des sites acides. Cependant, les deux catalyseurs de morphologie irrégulière, synthétisés par une méthode sol-gel in-situ, ont échoué dans les essais de réutilisation. Cela est expliqué par la faible résistance mécanique du support en favorisant le frittage des NPs métalliques.
Afin d’augmenter la résistance mécanique du support et d’améliorer l’activité catalytique des catalyseurs hétérogènes au Pd/Pt, le procédé de synthèse sol-gel in-situ générant des matériaux de morphologie incontrôlable a été remplacé par un procédé de précipitation dans lequel des NPs métalliques ont été séquestrées dans les cages mésoporeuses d’une matrice 100 % organosilicique de morphologie sphérique. La synthèse des particules sphériques a été réalisée par un procédé d’émulsion huile-dans-eau en utilisant seulement du MTES comme précurseur de silice. Ce type de synthèse a permis de faire une condensation à une température de 90 °C pendant 24 h, ce qui a fortement augmenté la robustesse du support. L’activité catalytique du catalyseur de morphologie sphérique Pd0/MeSiO1,5, avec une teneur en Pd de 2,5 % massique
(NPs de Pd de 2-3 nm), a été évaluée dans l’hydrogénation catalytique du squalène végétal en l’absence de solvant, dans des conditions douces mais également dans des conditions plus sévères de température et de pression. Le catalyseur s’est avéré actif à des températures supérieures à 70 °C et à des pressions d’H2 de 3 à 20 atm, pour des pourcentages molaires de
Pd par rapport au squalène de 0,50 à 0,05 mol %. Le catalyseur a été facilement récupéré et réutilisé dans huit réactions consécutives avec de très petites quantités de Pd lessivé dans le produit brut de réaction (inférieure à 1 mg kg-1), ouvrant ainsi la voie à une hydrogénation écologique et moins coûteuse du squalène végétale. L’activité catalytique du catalyseur de morphologie sphérique Pt0/MeSiO
1,5 avec une teneur en Pt de 5 % massique (NPs de Pt de 4-7
v
catalyseur s’est avéré actif pour des pourcentages molaires de Pt par rapport à l’oléfine de 0,100 à 0,005 mol %. Le catalyseur a été facilement récupéré et réutilisé dans trois réactions consécutives avec de très faibles quantités de Pt lessivé dans le produit brut de réaction (inférieures à 5 mg kg-1). Ce type de synthèse a permis de développer des catalyseurs plus actifs (conversion et sélectivité supérieures à 90 %), stables et réutilisables, ouvrant la voie à des applications vertes et moins coûteuses, d’une importance primordiale pour la chimie fine et pour l’industrie pharmaceutique.
Ce projet se démarque par son originalité dans le type unique des supports développés pour séquestrer les NPs de Pd/Pt. Le caractère hydrophobe des supports synthétisés exclusivement à partir du silane hybride protège les NPs métalliques de l'oxydation. Nous avons montré que le xérogel de silice modifiée organiquement (100 % MTES) de morphologie sphérique et fonctionnalisée avec des NPs de Pd ou de Pt, Pd0/MeSiO1,5 et Pt0/MeSiO1,5, conduit à des
catalyseurs robustes, stables à l’air et à l’humidité, hautement actifs et sélectifs. Des essais catalytiques réalisés sur une période de deux ans avec les deux catalyseurs, conservés dans des conditions innertes ou à l’air, à 4 °C et à 22 °C, ont montré une activité catalytique inchangée. Les analyses d’adsorption d’N2 et les analyses de difusion de la lumière ont montré des
caractéristiques physiques similaires, même après deux ans. Comparés à d’autres catalyseurs commerciaux utilisés dans l’industrie, les catalyseurs hydrophobes de morphologie sphérique Pd0/MeSiO1,5 et Pt0/MeSiO1,5, commercialisés par SiliCycle Inc comme SiliaCat Pd0 et SiliaCat
Pt0, ont montré les meilleures performances catalytiques. Ils peuvent facilement être manipulés à l'air, ne montrant aucune tendance à s'enflammer. Les catalyseurs développés sont disponibles pour effectuer des réactions en présence ou en l’absence de solvant, dans des conditions douces,
mais également à des températures et à des pressions élevées. Ceci permert d’offrir des méthodes économiques appropriées pour fabriquer des produits à moindre coût, en utilisant des procédés totalement écologiques.
Mots-clés : ORMOSIL, palladium, platine, nanoparticules, hydrogénation, squalène, hydrosilylation, oléfines, silanes, SiliaCat
vi
Abstract
The heterogeneous palladium/platinum (Pd/Pt) catalysts studied are part of a new range of heterogeneous catalysts developed at SiliCycle Inc for fine chemicals and pharmaceutical chemistry. These catalysts are synthesized from Pd/Pt nanoparticles (NPs) sequestered in the mesoporous cages of hydrophobic organosilicon support MeSiO1.5. The hydrophobic nature of
the catalysts is generated by the presence of the methyl groups of the methyltriethoxysilane silane (MTES) used as a monomer in the synthesis of the support. These heterogeneous catalysts, stable in air and moisture, have been found to be very reactive in many chemical reactions, especially under mild conditions of temperature and pressure, for example in carbon-carbon coupling reactions, in hydrogenation reactions or in hydrosilylation reactions. The problem is that these catalysts proved to be reactive only for low metal contents (0.5 wt% Pd and 2.0 wt% Pt) and that their catalytic activity decreases considerably in the reusability test at high temperature and high pressure. Under these conditions the catalysts are no longer reusable.
The main objective of this thesis is to make improvements to this class of hydrophobic catalysts in order to further increase their catalytic activity and their selectivity. Thus, novel heterogeneous catalytic materials stable to air and moisture have been developed. These catalysts are characterized by better mechanical resistence and stability of Pd/Pt NPs to sintering with high reuse capability under mild conditions, but also at high temperatures and pressures. Their catalytic activity has been evaluated in green applications with high industrial impact. The catalytic activity of Pd catalysts was evaluated in the hydrogenation of squalene to squalane, a fully saturated hydrocarbon, easily adopted by cosmetic formulators for its remarkable properties such as its high stability to oxidation, rancidity and heat. The catalytic activity of the Pt catalysts was evaluated in the hydrosilylation reaction, one of the most important methods for the synthesis of organosilicon compounds and particularly for the industrial scale production of organosilanes by addition of Si-H bonds to double bonds.
First, the organosilicon support was doped with Al2O3 units. The new catalyst with Pd/Pt NPs
encapsulated in the mesoporous cages of an organosilicic support doped with Al2O3 units,
vii
The addition to 2 wt% of Al2O3 made it possible to increase the Pd content from 0.5 to 2.0 wt%
and the Pt content from 2.0 to 5.0 wt% while keeping a very high metal dispersion (Pd/Pt NPs of size 2-4 nm). The addition of Al2O3 also made it possible to increase their catalytic activity
under mild conditions as well as at high temperature and pressure, due to the presence of acidic sites. However, both catalysts, synthesized by an in-situ sol-gel method, failed in the reuse tests. This is explained by the low mechanical resistance of the support favoring the sintering of metal NPs.
To increase the mechanical resistance of the support and to improve the catalytic activity of Pd/Pt heterogeneous catalysts, the in-situ sol-gel synthesis process was replaced by a precipitation process where the metal NPs were sequestered in the mesoporous cages of a 100% hydrophobic organosilica support of spherical morphology. The synthesis of the spherical particles was carried out by an oil-in-water emulsion process using only MTES as a source of silica. This type of synthesis allowed extensive condensation at 90 °C for 24 h, which greatly increased the robustness of the support. The catalytic activity of the Pd0/MeSiO1.5 spherical
morphology catalyst, with a Pd content of 2.5 wt% (Pd NPs of size 2-3 nm) was evaluated in the catalytic hydrogenation of vegetable squalene in the absence of solvent, in mild conditions but also under more severe conditions of temperature and pressure. The catalyst was found to be active at temperatures above 70 °C and at H2 pressures of 3 to 20 atm, for molar percentage
of Pd relative to squalene of 0.50 to 0.05 mol %. The catalyst was easily recovered and reused in eight consecutive reactions with very small amounts of leached Pd in the reaction crude product (less than 1 mg kg -1) paving the way for environmentally friendly and less expensive vegetable squalene hydrogenation. The catalytic activity of the Pt0/MeSiO1.5 spherical
morphology catalyst with a Pt content of 5 wt% (Pt NPs of size 4-7 nm) was evaluated in the hydrosilylation of olefins in the absence of solvent and in the air. The catalyst was found to be active at molar percentage of Pt relative to the olefin of 0.100 to 0.005 mol%. The catalyst was easily recovered and reused in three consecutive reactions with very small amounts of leached Pt in the silylated reaction crude product (less than 5 mg kg -1). This type of synthesis has made it possible to develop catalysts that are more active (conversion and selectivity greater than 90%), stable and reusable, paving the way for green and less expensive applications, of paramount importance for fine chemistry and for pharmaceutical industry.
viii
The originality of this project consists of the unique type of supports developed to encapsulate Pd/Pt NPs. The hydrophobicity of the supports synthesized exclusively from the organosilanes protects the metal NPs against oxidation. We have shown that the organically modified (100% MTES) spherical silica xerogel functionalized with NPs of Pd or Pt, Pd0/MeSiO1.5 and
Pt0/MeSiO1.5, leads to highly active and selective, stables to air and moisture, robust catalysts.
The catalytic test, carried out during a periode of two years with the two Pd/Pt catalysts stored under inert conditions or in air at 4 °C and 22 °C, showed unchanged catalytic activity. N2
-adsorption and light scattering analyzes showed similar physical characteristics even after two years. Compared with other commercial catalysts used in industry, the spherical hydrophobic catalysts Pd0/MeSiO1.5 and Pt0/MeSiO1.5, marketed by Silicycle Inc. as SiliaCat Pd0 and
SiliaCat Pt0, showed the best catalytic performance. They can be easily handled in the air
showing no tendency to ignite. The catalysts developed are available for carrying out reactions in the presence or absence of solvent, under mild conditions, but also at high temperature and pressure, thus offering economical methods suitable for making low-cost products, using a completely ecological process.
Key words: ORMOSIL, palladium, platine, nanoparticles, hydrogenation, squalene, hydrosilylation, olefins, silanes, SiliaCat
ix
Table des matières
Résumé ... iii
Abstract ... vi
Table des matières ... ix
Liste des tableaux ... xii
Liste des figures ... xiv
Liste des abréviations, sigles, acronymes ... xvii
Remerciements ... xxi Avant-propos ... xxiii Introduction ... 1 • Mise en contexte ... 1 • Objectifs ... 6 • Structure de la thèse ... 8 Chapitre 1 : Théorie ... 9
1.1 Catalyseurs hétérogènes à base de nanoparticules métalliques supportées ... 9
1.1.1 Phase active ... 9
1.1.2 Rôle du promoteur ... 15
1.1.3 Influence du support ... 15
1.2 Nanoparticules métalliques et nanoparticules métalliques encapsulées ... 18
1.3 Nanoparticules métalliques et leurs applications en chimie de produits fins ... 26
1.3.1 Hydrogénation du squalène en squalane catalysée par les nanoparticules métalliques ... 27
1.3.1.1 Squalène et son importance industrielle ... 27
1.3.1.2 Hydrogenation catalytique du squalène en squalane ... 32
1.3.1.2.1 Catalyseurs au Pt ... 33
1.3.1.2.2 Catalyseurs au Ni ... 33
1.3.1.2.3 Catalyseurs au Pd ... 37
1.3.2 Hydrosilylation des oléfines ... 42
Chapitre 2 : Méthodologie ... 49
2.1 Préparation des catalyseurs hétérogènes ... 50
2.1.1 Nanoparticules de Pd et de Pt sur un support organosilicique irrégulier dopé avec des unités Al2O3 : Pd0/MeSiO1,5-Al2O3 et Pt0/MeSiO1,5-Al2O3 ... 50
x
2.2 Techniques de charactérisation ... 53
2.2.1 Physisorption d’azote ... 54
2.2.2 Microscopie électronique à balayage (SEM, abréviation de l'anglais « Scanning Electron Microscopy ») ... 58
2.2.3 Diffraction des rayons X (DRX ou XRD, abréviation de l'anglais « X-ray diffraction ») ... 59
2.2.4 Microscopie électronique à transmission (MET ou TEM, abréviation de l'anglais « Transmission Electron Microscopy ») ... 60
2.2.5 Chimisorption d’hydrogène ... 61
2.2.6 Résonance magnétique nucléaire de 29Si et 27Al ... 64
2.2.7 Spectroscopie d’émission optique couplée à un plasma inductif (ICP-OES) ... 66
2.2.8 Chromatographie gazeuse couplée à un spectromètre de masse (GC-MS) ... 67
Chapitre 3 : Catalyseurs Organosiliciques au Pd/Pt Dopés avec Al2O3 ... 68
3.1 Introduction ... 68
3.2 Résultats et discussion ... 70
3.3 Performances catalytiques ... 88
3.3.1 Activité catalytique du Pd0/MeSiO 1,5-Al2O3 dans l’hydrogénation du squalène ... 88
3.3.2 Activité catalytique du Pt0/MeSiO 1,5-Al2O3 dans l’hydrosilylation d’oléfines ... 94
3.4 Conclusion ... 100
Chapitre 4 - Article 1: Heterogeneously Catalyzed Hydrogenation of Squalene to Squalane under Mild Conditions ... 102
4.1 Résumé ... 103 4.2 Abstract... 103 4.3 Introduction ... 104 4.4 Experimental ... 108 4.4.1 Materials ... 108 4.4.2 Hydrogenation reaction ... 108 4.4.3 Reusability test ... 109
4.5 Results and discussion ... 110
4.5.1 Effects of squalene purity ... 112
4.5.2 Reproducibility of the heterogeneous reaction ... 114
4.5.3 Leaching and catalyst stability ... 115
4.5.4 Reusability of the solid catalyst ... 117
4.6 Conclusion ... 119
Chapitre 5 - Article 2: Solvent-Free Chemoselectve Hydrogenation of Squalene to Squalane ... 120
5.1 Résumé ... 121
xi
5.3 Introduction ... 122
5.4 Materials and methodes ... 125
5.5 Results and discussion ... 127
5.5.1 Effect of reaction temperature ... 131
5.5.2 Effect of H2 pressure ... 133
5.5.3 Effect of catalyst loading ... 135
5.5.4 Catalyst stability ... 138
5.6 Conclusion ... 141
Chapitre 6 - Article 3: Waste-Free and Efficient Hydrosilylation of Olefins ... 142
6.1 Résumé... 143 6.2 Abstract ... 143 6.3 Introduction ... 144 6.4 Experimental ... 146 6.4.1 Materials ... 146 6.4.2 Sample characterization ... 146
6.5 Results and discussion ... 149
6.5.1 Reaction conditions optimization ... 152
6.5.2 Effect of catalyst loading ... 154
6.5.3 Reaction scope ... 157
6.5.3.1 SiliaCat Pt0 catalysed the hydrosilylation of differents olefines with TES ... 157
6.5.3.2 SiliaCat Pt0 catalysed the hydrosilylation of differents olefines with DMCS ... 159
6.5.3.3 SiliaCat Pt0 catalysed hydrosilylation of 1-octadecene with other related hydrosilanes .... 161
6.5.4 Catalyst stability ... 163
6.6 Conclusion ... 170
Conclusion et perspectives ... 171
xii
Liste des tableaux
Tableau 1.1 Pourcentage d’atomes à la surface en fonction de la taille des clusters (structure
cubo-octaédrique). ... 11
Tableau 1.2 Composition du squalane dérivé de la canne à sucre. Adapté d’Amyris Inc. ... 30 Tableau 1.3 Comparaison du squalane obtenu de différentes sources. Adapté d’Amyris Inc. ... 31 Tableau 2.1 Déplacements chimiques caractéristiques du 29Si RMN solide, selon le nombre de voisins
silicium. ... 65
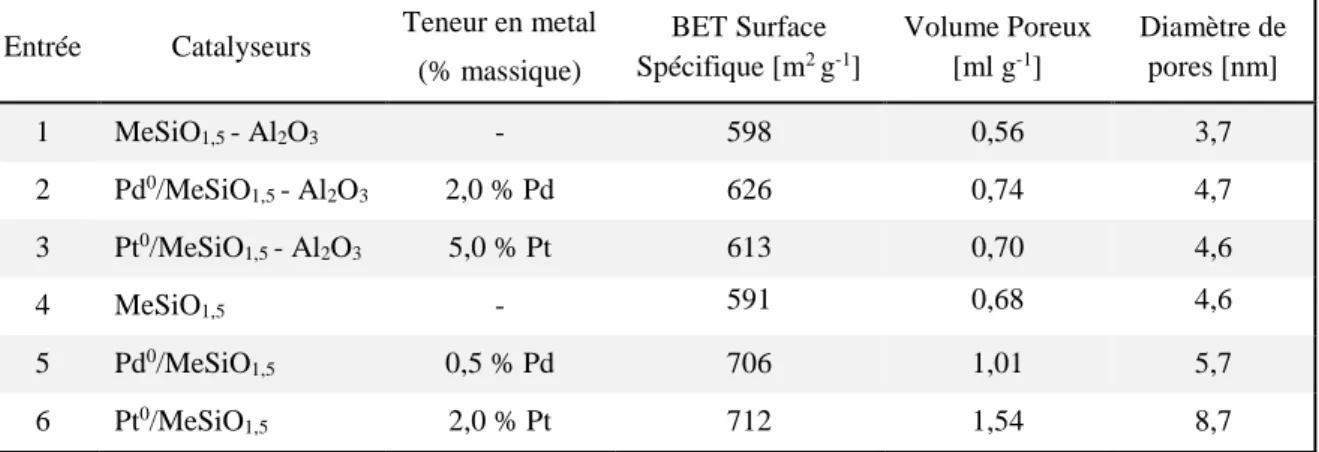
Tableau 3.1 Caractérisation des propriétés texturales des catalyseurs hétérogènes au Pd/Pt. ... 73 Tableau 3.2 Taille moyenne de NPs de Pd ou de Pt determinée par MET et par chimisorption d’H2. 76
Tableau 3.3 Hydrogénation du squalène catalysée par Pd0/MeSiO
1,5 (0,5 % massique de Pd) et
Pd0/MeSiO
1,5-Al2O3 (2 % massique de Pd, 2 % massique d’Al). ... 90
Tableau 3.4 Hydrosilylation du 1-octène avec TES silane catalysée par Pd0/MeSiO
1,5 et Pd0/MeSiO1,5
-Al2O3. ... 96
Table 4.1 Effect of solvent on squalene hydrogenation over 0.5 mol % SiliaCat Pd0. ... .111
Table 4.2 Pd and Si leaching from SiliaCat Pd0 in squalene hydrogenation under different conditions.
... 116
Table 5.1 Advantages and disadvantages of industrial squalene hydrogenation over commonly used
supported metal catalysts ... 123
Table 5.2 Load and Pd NPs size of the spherical SiliaCat Pd0. ... 128
Table 5.3 Textural properties of spherical SiliaCat Pd0 and blank support. ... 129
Table 5.4 Conversion, selectivity, and metal leaching values in the solvent-free hydrogenation of
squalene of different purities over SiliaCat Pd0 ... 131
Table 5.5 Conversion and selectivity of squalane in the solvent-free hydrogenation of olive squalene
over SiliaCat Pd0 under different hydrogen pressure ... 133
Table 5.6 Conversion of squalene and squalane selectivity in the solvent-free hydrogenation of olive oil
squalene over different amounts of SiliaCat Pd0 ... 136
Table 5.7 Conversion and squalane selectivity in the hydrogenation of squalene with different purities
under optimized reaction conditions over different catalysts under solvent-free conditions or carried out with the substrate dissolved in solvent ... 140
Table 6.1 Textural properties of the SiliaCat Pt0 catalyst and blank support MeSiO
1.5. ... 150
Table 6.2 Hydrosilylation reaction of 1-octene with TES in solvent-free conditions at different
xiii
Table 6.3 Hydrosilylation reaction of 1-octene with TES in solvent-free conditions over different
reaction Pt loading ...155
Table 6.4 Effects of temperature and stirring on masse transfer in hydrosilylation reaction of 1-octene with TES in solvent-free conditions over 0.005 mol% Pt of SiliaCat Pt0 ...156
Table 6.5 Hydrosilylation of different olefins with TES over SiliaCat Pt0 ...158
Table 6.6 Hydrosilylation of different olefins with chlorodimethylsilane over SiliaCat Pt0 ...160
Table 6.7 Hydrosilylation of different olefins with TES over SiliaCat Pt0 ...162
Table 6.8 Reusability of SiliaCat Pt0 in the hydrosilylation of 1-octadecene with chlorodimethylsilane over 0.025 mol% Pt of SiliaCat Pt0 ...164
xiv
Liste des figures
Figure 1 NPs de Pd/Pt séquestrées dans les cages mésoporeuses d’une silice hydrophobe modifiée
organiquement. ... 7
Figure 1.1 Modèle de surface imparfaite d’une cristallite métallique qui présente des atomes métalliques
ayant différents nombres de coordination. ... 12
Figure 1.2 Incorporation des NPs métalliques dans des matériaux sol-gel. Adapté de Reetz.82 ... 21
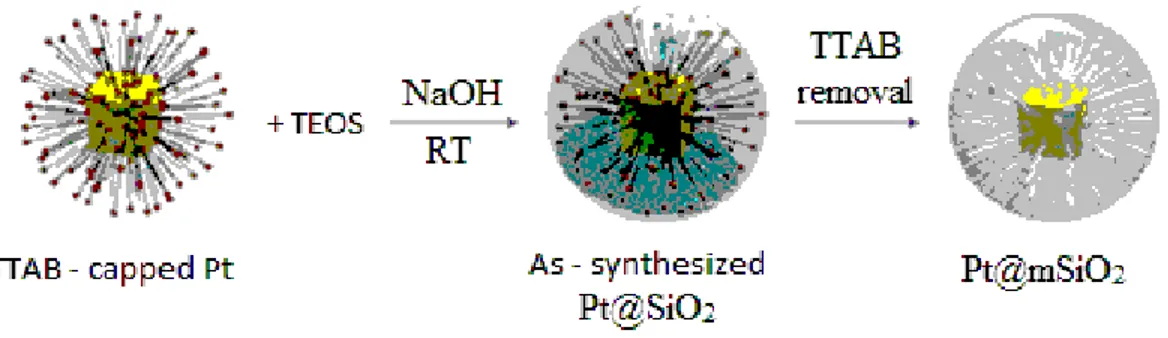
Figure 1.3 Représentation schématique de la synthèse de NPs de Pt encapsulées Pt@mSiO2. Adapté de
Somorjai.83 ... 22
Figure 1.4 Hydrogénation catalytique du squalène en squalane. ... 27 Figure 1.5 Réaction d’hydrosilylation catalytique. Addition de la liaison Si-H à une double liaison. . 42 Figure 1.6 Mécanisme proposé pour l’hydrosilylation d’oléfines catalysée par Pt. ... 44 Figure 1.7 Catalyseur de Karstedt et catalyseur modifié de Karstedt ... 45 Figure 2.1 Différents types d’isothermes de physisorption d’azote à 77 K (I à VI). Classification selon
les isothermes IUPAC.185... 55
Figure 2.2 Boucles d’hystérèses de H1 à H4 correspondant aux isothermes IV et V. Classification des
isothermes selon IUPAC.185... 56
Figure 3.1 Illustration schématique de la méthode de séquestration de NPs de Pd/Pt dans un support
aluminosilicate modifié organiquement. ... 71
Figure 3.2 Image SEM du catalyseur à base des NPs de Pd séquestrées dans un support aluminosilicate
modifié organiquement : Pd0/MeSiO
1.5-Al2O3 (2 % massique de Pd, 2 % massique d’Al). ... 72
Figure 3.3 A) N2 - isothermes d’adsorption-désorption des catalyseurs Pd0/MeSiO1.5-Al2O3, (2 %
massique de Pd, 2 % massique d’Al, ligne noire) et de Pt0/MeSiO
1.5-Al2O3 (5 % massique de Pt, 2 %
massique d’Al, ligne rouge). B) BJH distribution de la taille de pores (branche de désorption). ... 74
Figure 3.4 A) N2 - isothermes d’adsorption-désorption des catalyseurs : Pd0/MeSiO1.5 (0,5 % massique
de Pd, ligne noire) et Pt0/MeSiO
1.5 (2 % massique de Pt, ligne rouge). B) BJH distribution de la taille de
pores (branche de désorption). ... 75
Figure 3.5 Images MET du catalyseur Pd0/MeSiO
1.5-Al2O3 (2 % massique de Pd, 2 % massique d’Al)
(A) et du catalyseur Pt0/MeSiO
1.5-Al2O3 (5 % massique de Pt, 2 % massique d’Al) (B). ... 77
Figure 3.6 Images MET (A) et histogrammes de distribution de NPs de Pd (B) du catalyseur
Pd0/MeSiO
1.5-Al2O3 (2 % massique de Pd, 2 % massique d’Al). a) Matériaux obtenus à une échelle de
50 g. b) Matériaux obtenus à une échelle de 500 g. ... 78
Figure 3.7 Images MET (A) et histogramme de distribution de NPs de Pt (B) du catalyseur Pt0/MeSiO 1.5
-Al2O3 (5 % massique de Pt, 2 % massique d’Al). a) Matériaux obtenus à une échelle de 50 g. b)
xv
Figure 3.8 Images MET (A) et histogrammes de distribution de NPs de Pd (B) du catalyseur
Pd0/MeSiO
1.5 (0,5 % massique de Pd). a) Matériaux obtenus à une échelle de 50 g. b) Matériaux obtenus
à une échelle de 500 g. ...80
Figure 3.9 Images MET (A) et histogrammes de distribution de NPs de Pt (B) du catalyseur
Pt0/MeSiO
1.5 (2,0 % massique de Pt). a) Matériaux obtenus à une échelle de 50 g. b) Matériaux obtenus
à une échelle de 500 g. ...81
Figure 3.10 Spectres de diffraction des rayons X (DRX) du support organosilicique dopé avec 2 %
massique d’Al, MeSiO1.5-Al2O3, et des catalyseurs Pd0/MeSiO1.5-Al2O3 (2 % massique de Pd, 2 %
massique d’Al) et Pt0/MeSiO
1.5-Al2O3 (5 % massique de Pt, 2 % massique d’Al). ...82
Figure 3.11 Spectres de diffraction des rayons X (DRX) du support organosilicique MeSiO1.5 et des
catalyseurs Pd0/MeSiO
1.5 (0,5 % massique de Pd)et Pt0/MeSiO1.5 (2 % massique de Pt). a) Matériaux
obtenus à une échelle de 50 g. b) Matériaux obtenus à une échelle de 500 g. ...83
Figure 3.12 Spectres RMN 29Si MAS du support organosilicique dopé avec 2 % massique d’Al,
MeSiO1.5-Al2O3 et des catalyseurs Pd0/MeSiO1.5-Al2O3 (2 % massique de Pd, 2 % massique d’Al).et
Pt0/MeSiO
1.5-Al2O3(5 % massique de Pt, 2 % massique d’Al).. ...85
Figure 3.13 Spectres RMN 29Si MAS du support MeSiO
1.5 et des catalyseurs Pd0/MeSiO1.5 (0,5 %
massique de Pd) et Pt0/MeSiO
1.5 (2 % massique de Pt). ...85
Figure 3.14 Spectres 29Al RMN MAS du support organosilicique dopé avec Al
2O3, MeSiO1,5-Al2O3 (2
% massique d’Al) et des catalyseurs Pd0/MeSiO
1,5-Al2O3 (2 % massique de Pd, 2 % massique d’Al) et
Pt0/MeSiO
1,5-Al2O3 (5 % massique de Pd, 2 % massique d’Al). ...86
Figure 3.15 Images MET du catalyseur Pd0/MeSiO
1.5-Al2O3 (2 % massique de Pd, 2 % massique d’Al)
A) Avant la réaction d’hydrogénation du squalène végétal; B) Après la réaction d’hydrogénation
d’hydrogénation du squalène végétal. ...93
Figure 3.16 Images MET du catalyseur Pt0/MeSiO
1.5 (2 % massique de Pt). A) Avant la réaction
d’hydrosilylation, matériau obtenu à petite échelle; B) Avant la réaction d’hydrosilylation, matériau obtenu à grande échelle; C) Après la réaction d’hydrosilylation. ...97
Figure 3.17 Images MET du catalyseur Pt0/MeSiO
1,5-Al2O3 (5,0 % massique de Pt, 2,0 % massique
d’Al). A) Avant la réaction d’hydrosilylation. B) Après la réaction d’hydrosilylation. ...99
Figure 4.1 Chemical structure of squalene. ...104 Figure 4.2 Effect of squalene purity on the conversion to squalane over 0.5 mol % SiliaCat Pd0, 1 atm
H2, 50 °C, 0.50 M squalene in ethanol. ...112
Figure 4.3 Influence of the amount of SiliaCat Pd0 on the rate of squalene hydrogenation (92 wt%
purity), for : a) 0.33 and b) 0.50 M (molar concentration of squalene ethanol solution). ...113
Figure 4.4 Performance of SiliaCat Pd0 in the scale-up squalene hydrogenation reaction from 5 to 20
xvi
Figure 4.5 Reproducibility of yield upon scale-up of squalene hydrogenation reaction after 5 h reaction,
over 1 mol% SiliaCat Pd0 : a) 10 mmol squalene; b) 25 mmol squalene; c) 50 mmol squalene in EtOH,
for 0.33 M (35% flask volume capacity). ... 115
Figure 4.6 Reusability of the SiliaCat Pd0 catalyst in squalene hydrogenation. ... 117
Figure 5.1 Squalene purity and composition issues depending on its origin. ... 122
Figure 5.2 Solvent-free hydrogenation of squalene over SiliaCat Pd0 under optimized reaction conditions. ... 124
Figure 5.3 Scanning electron microscopy (left) and transmission electron microscopy (TEM) (right) images of SiliaCat Pd0 spherical Pd catalyst used throughout this study. ... 127
Figure 5.4 Powder XRD patterns of MeSiO1,5 blank material (left) and the Pd/MeSiO1.5 NPs organosilica catalyst SiliaCat Pd0 (right). ... 128
Figure 5.5 N2-adsorption and desorption isotherms and BJH desorption pore size distribution of MeSiO1.5 blank support (left) and spherical SiliaCat Pd0 (right). ... 129
Figure 5.6 29Si MAS NMR spectra of MeSiO 1.5 blank support (left) and spherical SiliaCat Pd0 (right). ... 130
Figure 5.7 Effect of temperature in hydrogenation of olive oil squalene (82 wt% purity). ... 132
Figure 5.8 Effect of hydrogen pressure on hydrogenation of 82% olive oil squalene. ... 134
Figure 5.9 Molecular structure of the SiliaCat Pd0 catalyst. ... 137
Figure 5.10 Reusability of SiliaCat Pd0 in squalene hydrogenation. ... 138
Figure 6.1 SEM images at 100 and 250 x magnification of SiliaCat Pt0, taille moyenne autour de 100 µm. ... 149
Figure 6.2 TEM images and platinum particle size distribution histogram of SiliaCat Pt0 catalyst. . 150
Figure 6.3 N2-adsorption and desorption isotherms and BJH desorption pore size distribution of the amorphous MeSiO1.5 support (left) and of the Pt0/MeSiO1.5 nanoparticle organosilica catalyst SiliaCat Pt0 (right). ... 151
Figure 6.4 29Si MAS NMR spectra of the blank support MeSiO 1.5 (left) and of SiliaCat Pt0 (right). 151 Figure 6.5 Time evolution in hydrosilylation reaction of 1-octene with TES over 0.100 mol% Pt, 0.050 mol% Pt, 0.025 mol% Pt, 0.010 mol% and 0.005 mol% Pt of 5wt% SiliaCat Pt0 heterogeneous catalyst for reaction up to 240 min (left) and up to 60 min (right). ... 155
Figure 6.6 Reusability of SiliaCat Pt0 in the hydrosilylation of 1-octadecene ... 164
xvii
Liste des abréviations, sigles, acronymes
AOT Sodium bis(2-ethylhexyl) sulfosuccinate
BET Brunauer-Emmett-Teller theory
BJH Barrett-Joyner-Halenda theory
DRX Diffraction des rayons X
CTAB Cetyltrimethylammonium bromide
CTAC Cetyltrimethylammonium chloride
DMCS Chlorodimethylsilane
DMPS Dimethylphenylsilane
ICP-OES Inductively Coupled Plasma-Optical Emission Spectroscopy/Spectrométrie de masse couplée à un plasma inductif
MAS Magic Angle Spinning
MET Microscopie Electronique en Transmission
MTES Methyltriéthoxysilane
NPs Nanoparticules
NMR Nuclear Magnetic Resonance
ORMOSIL ORganically MOdified SILica Gel
P Pression
PdNPs Nanoparticules de Palladium
PtNPs Nanoparticules de Pt
RMN Résonance magnétique nucléaire
RMN 29Al MAS RMN du solide de l’aluminium
RMN 29Si MAS RMN du solide du silicium
SAC Single-Atom Catalyst
SEM Scanning Electron Microscopy
T Température
TEM Transmission Electron Microscopy
TES Triéthoxysilane
TCS Trichlorosilane
TGA Thermogravimetric Analysis
xviii
TON Nombres de rotations (Turn Over Number)
Vpore Pore volume total
xix
À mon cher époux et à mes adorables enfants,
À mes parents,
Urmeaza-ti pasiunea si ai incredere in visul tau! Realizarea lui depinde de suma eforturilor depuse zilnic, de determinarea, de perseverenta, de rabdarea, de dorinta si de atitudinea ta pozitiva. Nu renunta!
Suivez votre passion et faites confiance à votre rêve! Son accomplissement dépend de la quantité d’efforts quotidiens, de la détermination, de la persévérance, de la patience, du désir et de votre attitude positive. Ne pas abandonner!
xx
"Start by doing what is necessary. Then do what's possible. Then you will realize that you already do what you thought was impossible. " Francis of Assisi
xxi
Remerciements
Je souhaite remercier mon directeur de recherche, le professeur Serge Kaliaguine, qui m’a accueilli dans son groupe et m’a permis d’entreprendre des études graduées dans son laboratoire de recherche. Je tiens à le remercier pour le temps qu’il m’a accordé tout au long de mes études. C’est toujours agréable et très enrichissent de discuter avec vous et ce fut un honneur pour moi de travailler avec vous.
Je remercie sincèrement mon codirecteur de recherche et mon employeur, le Dr François Béland, qui m’a permis de poursuivre des études graduées dans son laboratoire de recherche, un rêve devenu réalité grâce à lui. Je tiens à le remercier de m’avoir conseillée, encouragée, soutenue avec une disponibilité de tous les instants. Je tiens également à le remercier pour la confiance et de la grande liberté de penser qu’il sait donner à ses chercheurs.
Je souhaite exprimer ma sincère gratitude à la Dre Rosaria Cirimina et au professeur Mario Pagliaro pour une collaboration extraordinaire et leur expertise de laquelle ils m’ont fait bénéficier.
Un merci tout particulier à la Dre Delphine Desplantier-Giscard pour les discussions, les conseils et les encouragements ainsi que son écoute toujours précieuse. Je tiens également à remercier tous mes collègues de SiliCycle Inc, Mme Géneviève Gingras, Dre Lilit Aboshyan Sorgho, Dr David Dubé, M. Steeves Potvin, M. Michel Morin. Je remercie aussi la Dre Meryem Bouchoucha pour les nombreuses discussions, M. Alexis Gourmaud pour son excellent travail en production, M. Vincent Bédard pour les analyses HPLC, M. Simon Bédard et Mme. Louise-Josée Lamothe pour les analyses élémentaires, BET, Malvern et GS-MS. Merci pour la bonne ambiance, la chaleur, le respect et la convivialité que vous apportez au laboratoire ainsi que pour votre soutien. Je suis très heureuse et honorée de travailler avec vous.
Je voudrais également remercier le support financier du Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG), les Fonds de recherche du Québec-Nature et
xxii
technologies (FRQNT), l’Université Laval et Silicycle Inc qui m’ont permis de réaliser ces travaux.
Je remercie mes parents, Ioana et George Pandarus, qui m’ont inculqué des valeurs essentielles. Merci maman! Toi qui pries sans cesse pour moi à l’autre bout de la terre. Merci papa! Toi qui as cru en moi, j’espère que là, au ciel, tu es fier de moi.
Merci à mes adorables enfants, Corina et Andrei. Être étudiante à l'université en même temps que vous était un honneur pour moi. Cela prouve qu'il n'y a pas d'âge pour réaliser son rêve. Je vous aime du tout mon cœur.
Je ne saurais comment remercier à mon époux, Tudor, avec mon sincère amour. Je n’aurais jamais pu accomplir ce travail sans ta patience, ton support et ta compréhension me permettant de persévérer dans les moments difficiles. C’est en grande partie grâce à toi.
Merci encore à tous! Valerica Pandarus Québec. 2019
xxiii
Avant-propos
La présente thèse de doctorat a été rédigée en utilisant le modèle d’insertion d’articles à raison d’un article par chapitre (les chapitres 4, 5, et 6). Les travaux présentés dans cette thèse de doctorat ont été effectués dans les laboratoires de catalyse industrielle et de procédés catalytiques sous la direction du professeur Serge Kaliaguine du Departement de génie chimique de l’université Laval et dans les laboratoires de recherche et développement sous la direction du Dr François Béland de SiliCycle Inc., en collaboration avec les professeurs Rosaria Cirimina et Mario Pagliaro de l’Institut pour matériaux nanostructurés (CNR) de Palermo, Italie.
Cette thèse de doctorat comporte quatre sections : (1) L’introduction, consistant en une mise en contexte et la présentation de la problématique de la recherche suivie des objectifs du projet de recherche ainsi qu’une revue de la littérature portant sur les généralités et l’importance des catalyseurs hétérogènes à base de NPs métalliques supportées et leur utilisation dans des applications à fort impact industriel (chapitre 1); (2) La méthodologie portant sur les procédures expérimentales et les techniques physico-chimiques employées pour caractériser les matériaux synthétisés (chapitre 2); (3) La section des résultats est composée de deux parties : une partie portant sur la synthèse et la caractérisation des catalyseurs hétérogènes Pd0/MeSiO1,5-Al2O3 et
Pt0/MeSiO
1,5-Al2O3, une nouvelle classe de catalyseurs hétérogènes à base de NPs de Pd/Pt et
leurs utilisations dans des applications à fort impact industriel, notamment dans l’hydrogénation catalytique du squalène en squalane et dans l’hydrosilylation d’oléfines. Cette classe de catalyseurs hétérogènes de morphologie irrégulière a été synthétisée par la méthode sol-gel in
situ avec les nanoparticules séquéstrées dans les cages mésoporeuses d’une silice modifiée
organiquement, dopée avec des unités Al2O3 (chapitre 3).
Ensuite, on retrouve le manuscrit du premier article, présenté au chapitre 4 et intitulé « Heterogeneously Catalyzed Hydrogenation of Squalene to Squalane under Mild Conditions », publié en 2015 dans le journal scientifique ChemCatChem. Le travail présenté dans cet article porte sur l’évaluation de l’activité catalytique du catalyseur hétérogène au Pd de morphologie irrégulière Pd0/MeSiO1,5-Al2O3 dans l’hydrogénation du squalène en squalane dans des
xxiv
conditions de pression et température douces, notamment 50 °C et 1 atm H2 en présence
d’éthanol. Dans ces conditions le catalyseur s’est révélé actif (conversions en squalane supérieures à 95 %) et réutilisable pour des pourcentages molaires de Pd de 0,5 à 1,0 mol % Pd. Cependant, le catalyseur était inactif en l’absence de solvant à 50 °C et 1 atm H2.
V. Pandarus, R. Ciriminna, S. Kaliaguine, F. Béland, M. Pagliaro, ChemCatChem, 17 (2015) 2071-2076.
On retrouve ensuite, dans la deuxième partie de la section de résultats, les manuscrits de deux articles publiés dans des journaux scientifiques et présentés aux chapitres 5 et 6.
Le manuscrit du deuxième article, présenté au chapitre 5 et intitulé « Solvent-Free Chemoselective Hydrogenation of Squalene to Squalane », a été publié en 2017 dans le journal scientifique ACS Omega. Le travail présenté dans cet article porte sur la caractérisation du catalyseur hétérogène au Pd de morphologie sphérique Pd0/MeSiO
1,5,ainsi que sur l’évaluation
de son activité catalytique dans l’hydrogénation catalytique du squalène en squalane en l’absence de solvant, autant dans des conditions de pression et de température douces (1 atm H2 et 50-70 °C) que dans des conditions plus sévères. Ce catalyseur s’est avéré stable et
réutilisable à des pressions d’H2 de 3 à 20 atm et à des températures supérieures à 100 °C.
V. Pandarus, R. Ciriminna, F. Béland, M. Pagliaro, S. Kaliaguine, ACS Omega, 2 (2017) 3989-3996.
Le manuscrit du troisième article, présenté au chapitre 6 et intitulé « Waste-Free and Efficient Hydrosilylation of Olefins », a été publié en 2018 dans le journal scientifique Green Chemistry. Le travail présenté dans cet article porte sur la caractérisation du catalyseur hétérogène au Pt de morphologie sphérique Pt0/MeSiO1,5 ainsi que l’évaluation de son activité catalytique dans
l’hydrosilylation d’oléfines en l’absence de solvant. Le catalyseur a montré une activité catalytique élevée de l’ordre de 104 TONs. Il est réutilisable et conserve sa morphologie sphérique, offrant ainsi une méthode économique appropriée pour fabriquer des produits à moindre coût en utilisant un procédé totalement écologique.
V. Pandarus, R. Ciriminna, G. Gingras, F. Béland, S. Kaliaguine, M. Pagliaro, Green
xxv
La dernière section de la thèse présente la conclusion générale et les perspectives. J'ai effectué l'ensemble des travaux expérimentaux et l’interprétation des résultats sous la supervision de mes directeurs de recherche. J'ai rédigé les trois articles en tenant compte des suggestions et corrections des coauteurs ainsi que des réviseurs et j’ai rédigé l’ensemble du présent manuscrit.
En plus des travaux qui ont mené aux articles de cette thèse, j’ai contribué à d’autres travaux qui ont également mené à des articles scientifiques déjà publiés ou en cours de réalisation, ainsi:
• Comparing the Pyrophoricity of Palladium Catalysts for Heterogeneous
Hydrogenation. C. R. Côté, R. Ciriminna, V. Pandarus, F. Béland, M. Pagliaro, Org. Process Res. Dev., 22 (2018) 1852-1855.
• Hydrogenolysis of C−O Chemical Bonds of Broad Scope Mediated by a New Spherical
Sol-Gel Catalyst. V. Pandarus, R. Ciriminna, G. Gingras, F. Béland, S. Kaliaguine, M.
Pagliaro, ChemistryOpen, 7 (2018) 80-91.
• Sol-Gel Entrapped Nitroxyl Radicals: Catalysts of Broad Scope. R. Ciriminna, V. Pandarus, F. Béland, M. Pagliaro, ChemCatChem, 10 (2018) 1731-1738
• Towards Broad Utilization of Gold Nanoparticles Entrapped in Organosilica. R. Ciriminna, G. Scandura, V. Pandarus, R. Delisi, A. Scurria, F. Béland, M. Pagliaro,
ChemCatChem, 7 (2017) 1322-1328.
• Fine Chemical Syntheses Under Flow using the SiliaCat Catalysts. R. Ciriminna, V. Pandarus, F. Béland, M. Pagliaro, Catal. Sci. Technol., 6 (2016) 4678-4685.
• Heterogeneously Catalyzed Alcohol Oxidation for the Fine Chemical Industry. R. Ciriminna, V. Pandarus, F. Béland, Yi-Jun Xu, M. Pagliaro, Org. Process Res. Dev., 19 (2015) 1554-1558.
• New Catalyst Series from the Sol-Gel-Entrapment of Gold Nanoparticles in Organically
xxvi
Ciriminna, A. Fidalgo, V. Pandarus, F. Béland, M. Pagliaro, ChemCatChem, 7 (2015) 254-260.
• Catalytic Hydrogenation of Squalene to Squalane. R. Ciriminna, V. Pandarus, F. Béland, M. Pagliaro, Org. Process Res. Dev., 18 (2014) 1110-1115.
Bourse d’étude : Bourse de doctorat en milieu de pratique, BMP Innovation, offert conjointement par des Fonds québécois de la recherche sur la nature et les technologies (FRQNT) et le Conseil de recherche en sciences naturelles et en génie (CRSNG) (septembre 2015 - avril 2018).
1
Introduction
• Mise en contexte
Les systèmes catalytiques développés sont des matériaux de plus en plus complexes basés sur plus d'un siècle de recherche et de développement. Ces matériaux de haute technologie ont révolutionné la fabrication de carburants et de produits chimiques. Des réactions chimiques, dont les temps de demi-vie atteignent parfois plusieurs siècles, peuvent être accomplies en quelques minutes ou en quelques heures en abaissant l'énergie d'activation en présence des catalyseurs. La plupart de nos combustibles liquides et 80 % de nos produits chimiques sont fabriqués à l'aide de transformations catalytiques. Le rendement de plus en plus élevé du carburant à partir d'un baril de pétrole brut, le développement des catalyseurs utilisés pour contrôler les émissions des gaz d'échappement d’automobiles et pour le reformage catalytique des hydrocarbures, la diminution constante du coût de production pour les produits chimiques en vrac et pour la chimie fine et pharmaceutique peuvent être attribués, dans une large mesure, à l'amélioration des systèmes catalytiques basée sur plus d’un siècle d’art catalytique, de technologie et de science.
Pour répondre à cette demande, de nouveaux catalyseurs plus complexes d’un point de vue chimique et physique ont été développés. En raison de cette complexité, la recherche et le développement de catalyseurs nécessitent de grands efforts multidisciplinaires exigeant des connaissances de chimie, de physique, de génie chimique, de la science des matériaux et plus particulièrement, des connaissances sur l'art et la science de la synthèse des matériaux catalytiques.
Selon la nature des catalyseurs, trois types de catalyses peuvent être distingués : (1) la catalyse homogène, lorsque le catalyseur et les réactifs forment une seule phase, souvent liquide; (2) la catalyse hétérogène, lorsque le catalyseur et les réactifs forment plusieurs phases, mais généralement il s'agit d'un catalyseur solide pour des réactions en phase gazeuse ou liquide; (3) la catalyse enzymatique, lorsque le catalyseur est une enzyme, c'est-à-dire une protéine.
2
Les catalyseurs homogènes sont généralement des molécules relativement petites qui sont dissoutes dans la même solution que les réactifs et les produits. Les catalyseurs moléculaires sont souvent plus faciles à étudier, car les sites actifs des molécules catalytiques peuvent être synthétisés avec une précision à l'échelle atomique, ce qui permet une compréhension très détaillée de nombreux processus catalytiques homogènes. Les catalyseurs homogènes se différencient des catalyseurs hétérogènes principalement par leur nature moléculaire. Plus précisément, chaque entité catalytique peut fonctionner indépendamment, comme un seul site actif. Celui-ci rend les catalyseurs homogènes intrinsèquement plus actifs et sélectifs par rapport aux catalyseurs hétérogènes.
Dans le cas des catalyseurs hétérogènes, les réactions chimiques se produisent à la surface d’un matériau. Pour cette raison, les catalyseurs hétérogènes sont typiquement des matériaux hautement poreux car la superficie de la surface est importante. Dans certains cas, le matériau catalytique lui-même peut être synthétisé avec une grande surface spécifique. Dans d’autres cas, un matériau relativement inerte est utilisé comme support pour stabiliser des NPs métalliques de 2 à 20 nm, dont les propriétés catalytiques sont influencées non seulement par leur composition chimique, mais également par la dimension et la forme des particules métalliques. De plus, la présence de particules métalliques joue un rôle important pour déterminer le nombre relatif et le type d’atomes de métal exposés à la surface des cristallites métalliques.
L’inconvénient majeur des catalyseurs homogènes est la récupération du mélange réactionnel. La réutilisation des catalyseurs homogènes nécessite généralement soit une précipitation du mélange réactionnel, suivie d’une récupération ultérieure du catalyseur, soit une distillation des produits de la réaction, un processus nécessitant une consommation d’énergie importante/excessive. Par exemple, les catalyseurs homogènes de rhodium (Rh) à base de phosphines sont utilisés à l'échelle industrielle (environ 5x1012 g/an) dans la réaction d’hydroformylation catalytique du propène en butanal, un produit plus volatil distillé continuellement à partir du mélange réactionnel. Toutefois, quand le propène est remplacé par d’autres alcènes à longue chaine, les complexes de Rh se décomposent en raison de la température de distillation trop élevée.1
3
La reconnaissance de cette limitation inhérente aux catalyseurs homogènes a conduit à une activité soutenue pour leur hétérogénéisation. L’objectif est de combiner les avantages des catalyseurs homogènes (activité catalytique et sélectivité) avec la facilité des systèmes hétérogènes à réutiliser les catalyseurs. Un catalyseur se trouvant dans une phase différente du milieu réactionnel, est un avantage majeur pour les catalyseurs hétérogènes par rapport aux catalyseurs homogènes. Bien que leur réactivation puisse être nécessaire, cet avantage se concrétise par la simplicité de leur séparation et de leur réutilisation. En conséquence, moins de déchets sont générés. De plus, des produits coûteux et difficiles à obtenir, tels que des ligands ou des métaux rares, peuvent être récupérés efficacement et réutilisés. Cela permet également d'isoler et de purifier les produits synthétisés plus facilement, car le résidu catalytique est facilement éliminé. En raison de leur facilité de séparation après la réaction chimique, les catalyseurs solides sont de plus en plus préférés dans les procédés chimiques et ils dominent actuellement l’industrie chimique. Il est estimé que 80-85 % des procédés chimiques utilisent des catalyseurs solides.2
Les catalyseurs désactivés par dimérisation ou par agglomération peuvent être efficacement isolés sur une surface en conservant leur activité pendant plus longtemps. Plusieurs catalyseurs peuvent être présents simultanément dans le mélange réactionnel, ce qui permet de réaliser des réactions à plusieurs étapes dans un seul pot, ce qui simplifie encore les synthèses. Ces catalyseurs peuvent se trouver sur le même support solide ou sur des supports différents.
Un autre avantage majeur des catalyseurs hétérogènes par rapport aux catalyseurs homogènes est la possibilité de réaliser une réaction chimique sur une phase solide fixée dans un réacteur, tels que des réacteurs à lit fixe ou à lit fluidisé, pouvant fonctionner en continu dans des conditions automatisées.3 Ainsi, les réactifs s’écoulent en continu sur ou à travers un lit ou un film de catalyseur et la réaction chimique en même temps avec la séparation du produit final est réalisée simultanément. Cette technologie offre de nombreux avantages en termes de fabrication, tels que le développement de procédés plus efficaces, économiques, sécuritaires et respectueux de l’environnement.
4
Les catalyseurs solides résistants à la lixiviation et caractérisés par des grandes surfaces spécifiques sont hautement souhaitables dans la chimie en continu. Le fait qu’un petit volume de réactifs (de µL à mL) s'écoule en flux continu dans un petit réacteur rempli de catalyseur hétérogène solide conduit à un rapport catalyseur/réactif important et donc à des taux de conversion plus élevés. De plus, l’étape de purification pour éliminer le métal du produit final n’est plus nécessaire.
Il y a aussi d’autres avantages pour lesquels la chimie en continu, pratiquée à grande échelle par les industries chimiques et pétrochimiques modernes trouvant ses racines dans les innovations scientifiques qui ont débuté il y a près de cent ans,4 est une technique récemment redécouverte par les fabricants d'ingrédients pharmaceutiques actifs et leurs intermédiaires.5
L’intérêt renouvelé pour cette technologie6 découle non seulement des avantages
économiques escomptés (économie de la chaîne d'approvisionnement et de la pression réglementaire), mais aussi de la possibilité d'améliorer le contrôle, notamment le transfert de chaleur et de masse,7 d’obtenir une plus grande sélectivité et de meilleurs rendements grâce à un contact efficace des réactifs avec la surface catalytique des catalyseurs solides utilisés,8 une sécurité inhérente à la manipulation de réactifs dangereux et accès aux conditions de haute pression et de haute température.9
Aujourd’hui, des réacteurs à flux continu de différentes échelles permettent à l'industrie pharmaceutique d'utiliser des synthèses considérées depuis longtemps comme trop difficiles ou peu sûres pour une mise à l'échelle fiable à des fins de commercialisation. Ainsi, un certain nombre d'applications de la chimie en continu réalisées avec succès dans l'industrieont été rapportées.10 Le processus en continu peut être accompli à des échelles de milligrammes, grammes et kilogrammes, le tout sur le même instrument. Le même composé peut alors être produit à une échelle commerciale en transférant le procédé chimique à écoulement continu avec des modifications mineures à une usine de fabrication continue. Les réactions traditionnelles peuvent avoir besoin d'être adaptées pour travailler en continu, mais les résultats valent souvent le temps passé, car la chimie à écoulement continu apporte des avantages supplémentaires aux transformations existantes. Par exemple, une synthèse difficile en batch, nécessitant plusieurs étapes réparties sur plusieurs jours, peut être réalisée
5
dans un processus en continu en quelques minutes.11 Aujourd'hui, des synthèses commerciales en continu se déroulent à grande échelle. Des exemples seraient l'hydrogénation asymétrique12 et de nombreuses synthèses d'ingrédients pharmaceutiques actifs.13 Le développement de nouveaux catalyseurs hétérogènes solides pour des synthèses à multiples étapes, effectuées dans des systèmes en continu, fait parti intégrante de l'avenir des synthèses en continu.
6
• Objectifs
Le frittage, principale cause de désactivation des catalyseurs hétérogènes à base de NPs métalliques, est provoqué par la mobilité des particules métalliques à la surface du support solide. Pour résoudre le problème de frittage, la séquestration des NPs métalliques dans différents supports d’oxydes métalliques permet de minimiser l’agrégation et d’assurer la réutilisation des catalyseurs. La validité de cette approche a été démontrée en 2008 par Park
et coll. Ils ont comparé les performances catalytiques d’un catalyseur traditionnel à base de
NPs de Pd déposées sur un support de silice par imprégnation (Pd/SiO2) avec celles d’un
catalyseur à base de NPs de Pd emprisonnées au cœur de capsules de silice (Pd@SiO2).14
Dans ce contexte, la compagnie SiliCycle Inc a rapporté la synthèse d’une nouvelle gamme de catalyseurs hétérogènes solides au Pd et au Pt destinés à la chimie fine et plus particulièrement à la chimie pharmaceutique. Ces catalyseurs sont synthétisés par une synthèse sol-gel avec le précurseur de sel Pd2+/Pt2+ dispersé de manière homogène dans le prépolymère de silice avant la gélification.
Les NPs de Pd/Pt sont synthétisées dans des conditions douces par la voie in situ, directement dans les cages mésoporeuses d’une silice hydrophobe modifiée organiquement. La réduction a été réalisée en solution avec des agents réducteurs tels que le tétrahydruroborate de sodium, NaBH4 ou le triacétoxyborohydrure de sodium, Na(AcO)3BH. Par cette méthode, la fonction
catalytique est intégrée de manière homogène à la structure accessible d'un xérogel hybride à 100 % (Figure 1).15 Ces catalyseurs se sont avérés réactifs dans de nombreuses réactions chimiques, telles que les réactions de couplage carbone-carbone : le couplage de Suzuki et le couplage de Sonogashira;16 les réactions d’hydrogénation d’oléfines,17 d’huiles végétales;18 les réactions de réduction de nitrodérivés aromatiques;19,20 de débenzylation;21
7
Figure 1 NPs de Pd/Pt séquestrées dans les cages mésoporeuses d’une silice hydrophobe
modifiée organiquement.
En particulier, les catalyseurs solides au Pd/Pt développés chez SiliCycle Inc. se sont démarqués par leur activité élevée dans des conditions douces et par leur stabilité à l'oxygène et l'humidité. Ils peuvent être réutilisés, manipulés et stockés dans l'air sans réduire leur réactivité. Toutefois, ces catalyseurs se sont révélés réactifs que pour des faibles teneurs en métal (0,5 % de Pd et 2,0 % de Pt, pourcentages massiques). Les matériaux obtenus après la mise à l’échelle sont friables et leur activité catalytique diminue dans les essais à température et pression élevées, ce qui est dû à la faible résistance des NPs de Pd/Pt au frittage et à la diminution des propriétés mécaniques du support (robustesse, attrition). De plus, la synthèse sol-gel développée nécessite beaucoup de temps et n’est pas économique.
Les principaux objectifs de ce projet sont de développer une synthèse qui permettra de : • maintenir la stabilité élevée à l’air et à l’humidité en conservant toujours le caractère
hydrophobe du support;
• améliorer les propriétés catalytiques des catalyseurs au Pd et au Pt en augmentant la stabilité des cristallites métalliques au frittage non seulement dans des conditions douces, mais également à des température et pression élevées;
8
• améliorer les propriétés mécaniques du support (robustesse, attrition);
• étudier leurs performances catalytiques dans des applications durables à fort impact industriel. Afin de réduire les coûts de production et dans le même temps d’obtenir des produits de haute pureté, des outils de chimie verte tels que des solvants verts ou des conditions sans solvant, des pressions et des températures plus basses ou des expériences à l’air seraient dévéloppées.
• Structure de la thèse
Cette thèse est composée de 8 parties : (1) une introduction consistant en une mise en contexte et en la présentation de la problématique de la recherche, suivie des objectifs du projet de recherche; (2) un premier chapitre portant sur les différents aspects théoriques nécessaires à la compréhension du projet de recherche ainsi qu’une revue de la littérature portant sur les généralités et l’importance des catalyseurs hétérogènes à base de NPs métalliques supportées et leurs utilisations dans des applications à fort impact industriel; (3) un deuxième chapitre présentant la méthodologie portant sur les procédures expérimentales et les techniques physico-chimiques employées pour caractériser les matériaux synthétisés; (4) un troisième chapitre présentant la synthèse des catalyseurs organosiliciques au Pd/Pt dopés avec des unités Al2O3 et leur caractérisation; (5) un quatrième chapitre présentant le premier article
publié dans le journal scientifique « ChemCatChem » et intitulé « Heterogeneously Catalyzed Hydrogenation of Squalene to Squalane under Mild Conditions »; (6) un cinquième chapitre présentant le deuxième article publié dans le journal scientifique « ACS
Omega » et intitulé «Solvent-Free Chemoselective Hydrogenation of Squalene to
Squalane »; (7) un sixième chapitre présentant le troisième article publié dans le journal scientifique « Green Chemistry » et intitulé « Waste-Free and Efficient Hydrosilylation of Olefins » et (8) la conclusion générale et les perspectives.
9
Chapitre 1 : Théorie
1.1 Catalyseurs hétérogènes à base de nanoparticules
métalliques supportées
Les catalyseurs hétérogènes sont de plus en plus préférés dans les procédés chimiques industriels en raison de leur facilité de séparation après la réaction chimique. Entre 80 % et 85 % des procédés chimiques utilisent des catalyseurs solides.2
La conception d’un catalyseur hétérogène est une optimisation des propriétés mécaniques, physico-chimiques et dynamiques nécessitant un choix judicieux des matériaux composants.23 Ainsi, un catalyseur hétérogène typique présente trois caractéristiques : (1) une phase catalytique active, (2) un support solide poreux caractérisé par une surface spécifique élevée sur laquelle la phase active finement dispersée présente une grande stabilité, et (3) un promoteur dont le rôle est d’augmenter l’activité catalytique et/ou d’améliorer ou de préserver la surface catalytique.
1.1.1 Phase active
La phase active est généralement dispersée dans les pores d’un support solide sous forme de particules ou clusters à l’échelle nanométrique. La surface de ces NPs contient des sites avec différentes coordinations ou des ensembles de sites catalytiques capables de catalyser différentes réactions chimiques en raison des leurs propriétés électroniques de surface. Ces propriétés sont caractérisées par des énergies suffisamment élevées pour permettre l’activation de sites catalytiques, mais suffisamment faibles pour la désorption de produits.24
10 Une phase catalytique active peut-être constituée :
• de métaux de transition, y compris les métaux nobles (Pd, Pt, Rh, Ru, Ir, Ag, Au) ou les métaux de base (Fe, Ni, Cu, Co, etc.)25 utilisés généralement dans les réactions d’hydrogénation, de déshydrogénation, de vaporeformage, de reformage catalytique des hydrocarbures, ou pour les réactions d’oxydation;26
• d’oxydes métalliques y compris les oxydes des métaux de transition (oxydes de V, Mn, Fe, Cu, Mo, W), les oxydes des métaux des terres rares (Sc, Y, La, Ac) et aussi les oxydes de Si, Al, Sn, Pb, Bi, utilisés dans les réactions d’oxydation, de craquage, d’isomérisation, d’alkylation;
• de sulfures métalliques, par exemple les sulfures des métaux de transition : sulfures de Os, Ru, Ir, Rh, Co, Mo, W, Ni, utilisés dans les réactions d’hydrodésulfurisation, d’hydrodéoxygénation et d’hydrogénation;27
• de carbures et de nitrures des métaux de transition (Mo, W, les métaux du Groupe 8) utilisés dans les synthèses Ficher-Tropsch et dans les réactions d’hydrogénation.28
Les NPs métalliques supportées à base des métaux de transition sont constituées de plusieurs atomes métalliques. Elles sont de dimension nanométrique et leur diamètre peut varier de 1 à 50 nm. Le terme de cluster est souvent rapporté dans la littérature. Elles se caractérisent, à l’état solide, par une étroite distribution de taille de 1 à 10 nm.29
Au cours des dernières deux décennies, la communauté scientifique s’est beaucoup intéressée à ces espèces nanométriques en raison de leurs propriétés physiques et chimiques situées à la frontière entre l’état moléculaire et l’état massif.30 Selon Schmid, lorsqu’une particule
métallique ayant des propriétés de métal massif, est réduite à la taille nanométrique de quelques dizaines ou même de quelques centaines d’atomes, la densité électronique des états dans les bandes de valence et de conductivité diminue. En conséquence, lorsque la taille du matériel diminue, les propriétés électroniques sont considérablement modifiées et la séparation entre les bandes augmente.31 La densité quasi continue des états électroniques, qui
caractérise le métal à l’état massif, est remplacée par un niveau d’énergie discret au sein des NPs.
11
D’un point de vue structural, les nanoclusters métalliques présentent une géométrie régulière qui donne naissance à des polyèdres (connus sous le nom de clusters à «magic number»).29 Ils sont formés d’un empilement compact de couches successives d’atomes de métal autour d’un seul atome. Le Tableau 1.1 présente une représentation idéalisée de clusters possédant une géométrie cubooctaédrique. Il donne le nombre de couches, le nombre total d’atomes, le nombre d’atomes par couche (calculé à l’aide de l’équation 10n2+2, où n représente la énième
couche (n > 0)) et le pourcentage d’atomes à la surface. Il est intéressant de noter que lorsque le nombre d’atomes métalliques dans le cluster métallique augmente, le pourcentage d’atomes à la surface (la dispersion) diminue.30
Tableau 1.1 Pourcentage d’atomes à la surface en fonction de la taille des clusters (structure
cubo-octaédrique). Nombre de
couches
Nombre total d’atomes
Nombre d’atomes dans la couche externe
Pourcentage d’atomes en surface (dispersion) 1 13 12 92 2 55 42 76 3 147 92 63 4 309 162 52 5 561 252 45
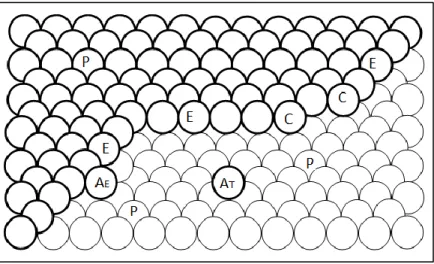
La structure de la surface des clusters est définie par la distribution géométrique des "centres" ou "sites" actifs, considérés comme le résultat de défauts dans la structure du métal (lacunes ou dislocations) ou d'arrangements particuliers d'atomes de coins, de surface ou de bords.
Selon Bartholomew et Farrauto,32 l’hétérogénéité de la surface catalytique peut être illustrée par la Figure 1.1. Ainsi, les atomes exposés à la surface peuvent présenter des nombres de coordination différents (Ci, i représente le nombre d’atomes voisins). Différents types de coordination peuvent être envisagés : les atomes exposés sur une surface plane ont une coordination planaire (P) avec un nombre de coordination neuf (C9) si le plan est (111) ou un nombre de coordination huit (C8) si le plan est (100); les atomes exposés sur un bord ou
12
une arête (E, "edge" en anglais) ont le nombre de coordination sept (C7); les atomes qui se trouvent dans les coins (C, "corner" en anglais) ont le nombre de coordination six (C6); un atome qui se trouve à côté d’un bord (AE, "edge-adatoms" en anglais) a le nombre de
coordination cinq (C5); un seul atome exposé sur une surface plane (AT, "terrace-adatoms"
en anglais) a un nombre de coordination trois (C3).
Figure 1.1 Modèle de surface imparfaite d’une cristallite métallique qui présente des atomes
métalliques avec différents nombres de coordination.
Théoriquement, les atomes métalliques exposés en surface avec des nombres de coordination inférieurs et implicitement une capacité de liaison insatisfaite devraient présenter des propriétés d’absorption supérieures à celles des atomes métalliques exposés en surface avec des nombres de coordination élevés. Cette hypothèse a fortement été appuyée par certains travaux sur des cristaux uniques. Ainsi, Martin et coll.33 ont montré que, dans de nombreuses réactions la face cristalline la plus dense (111) de coordination C9 est nettement moins active que les faces moins denses. Ainsi, les atomes métalliques avec les nombres de coordination 3 et 5 ainsi que les nombres de coordination 6 et 7 sont supposés être les sites catalytiques les plus réactifs, au moins au debut. Ce sont également, les sites catalytiques les plus susceptibles d’être empoisonnés.