© Francis Dufour, 2019
Sources et distribution du sélénium et de la sélénonéine
au sein des écosystèmes arctiques
Mémoire
Francis Dufour
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
Sources et distribution du sélénium et de la sélénonéine au sein
des écosystèmes arctiques
Mémoire
Francis Dufour
Sous la direction de :
Guillaume Massé, directeur de recherche Pierre Ayotte, co-directeur de recherche Mélanie Lemire, co-directrice de recherche
ii
Résumé
Les aliments traditionnels provenant de la mer constituent un élément important du régime alimentaire des Inuits de l’Arctique canadien. Ils présentent plusieurs avantages nutritionnels, notamment des niveaux élevés d'acides gras énergétiques et de microéléments tels que le sélénium (Se). Le Se est essentiel à la santé humaine et les populations inuites affichent une concentration sanguine en Se parmi les plus élevées au monde. Contrairement à d'autres populations, le Se est principalement présent sous forme de sélénonéine, une forme organique de Se récemment identifiée. Des études suggèrent que la sélénonéine participerait à la détoxification du méthylmercure. Les animaux ne peuvent pas synthétiser la sélénonéine et nos connaissances sur l’origine et la distribution du Se et de la sélénonéine dans l’environnement marin arctique sont limitées. L’objectif de cette étude était donc de mesurer les concentrations totales de Se, de sélénonéine et de multiples biomarqueurs écologiques dans une vaste gamme d’organismes marins.
Deux chaînes alimentaires (pélagiques et pélago-benthiques) ont été étudiées dans le cadre des projets Green Edge et BriGHT. Composition isotopique (δ15N, δ13C), abondance de biomarqueurs lipidiques (HBIs et acides gras) et concentration en Se et sélénonéine ont été déterminées au sein de tissus provenant d'espèces représentatives. Nos analyses ont révélé des concentrations élevées de Se chez plusieurs espèces de la chaine benthique, en particulier dans les tissus de bivalves et de morse. Chez le morse, la sélénonéine peut représenter jusqu'à 45% du Se total. Bien que l'origine de la sélénonéine reste incertaine, ces résultats, combinés avec ceux des analyses isotopiques et de biomarqueurs, suggèrent que la banquise constitue une source de Se pour les écosystèmes arctiques. La sélénonéine étant synthétisée par des bactéries et des champignons, il est probable que ces organismes, retrouvés dans les sédiments ou sur la peau des mammifères marins, en soit aussi la source en Arctique.
iii
Abstract
Traditional foods from the sea have always been an important component of the diet of Inuit of the Canadian Arctic. These organisms provide several nutritional benefits, including high levels of energetic fatty acids and microelements such as selenium (Se). Se is essential to human health and Inuit populations exhibit among the highest blood levels of Se worldwide. In contrast to other populations, Se is mainly present in Inuit blood as selenoneine, a recently identified organic form of Se. Recent studies suggest that selenoneine may participate in methylmercury (MeHg) detoxification mechanisms. Animals cannot synthesize selenoneine and our knowledge about the origin and the distribution of Se and selenoneine in the Arctic marine environment is scarce. The main aim of this study was to determine total Se, selenoneine and multiple biomarker concentrations in a broad range of marine organisms.
Two food chains (pelagic and pelago-benthic) were studied in the context of the Green
Edge and BriGHT projects. Isotopic composition (δ15N, δ13C), abundance of lipid
biomarkers (HBIs and fatty acids) and selenium and selenoneine concentrations were determined in tissues from representative species. Our analyses revealed high concentrations of Se in several species of the benthic food chain, particularly in bivalve and walrus tissues. In walrus, selenoneine accounted for up to 45% of total Se. Although the origin of selenoneine remains uncertain, these results, combined with isotopic and biomarker analyses, suggest that sea ice is a source of Se for Arctic ecosystems. Since selenoneine is synthesized by bacteria and fungi, it is likely that these organisms, found in the sediments or on the skin of marine mammals, are also the source in the Arctic.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... ix
Liste des annexes ... x
Remerciements ... xi
Introduction ... 1
Le sélénium : contexte et importance en Arctique... 1
La sélénonéine : découverte et interaction avec le MeHg ... 4
Origine de la sélénonéine dans l’environnement ... 5
D’où provient donc le Se et la sélénonéine chez les Inuits? ... 7
Origine du sélénium : environnement marin de l’Arctique ... 8
Caractéristiques du réseau trophique de l’Arctique ... 12
Composition isotopique ... 12
Isoprénoïdes hautement branchés ... 13
Acides gras spécifiques ... 14
Chapitre 1. Objectifs ... 16
Chapitre 2. Matériel et méthodes ... 18
2.1. Récolte d’échantillons ... 18
2.1.1. Collecte d’algues de glace & de phytoplancton ... 18
2.1.2. Collecte de zooplancton ... 19
2.1.3. Collecte du benthos ... 19
2.1.4. Récolte de poissons et mammifères marins ... 19
2.2. Analyses en laboratoire ... 20
2.2.1. Isotopes stables ... 20
2.2.2. Lipides ... 20
2.2.3. Se total et sélénonéine ... 21
v
2.3.1. Analyses statistiques ... 22
Chapitre 3. Résultats ... 23
3.1. Caractéristiques écologiques du réseau sélectionné représentatif d’un environnement Arctique ... 23
3.1.1. Isotopes stables ... 25
3.1.2. HBIs ... 26
Évolution des concentrations en HBIs au sein des communautés sympagiques au cours de la saison. ... 26
Évolution des concentrations en HBIs au sein de deux espèces de bivalves durant le printemps en 2014, 2015 et 2016... 29
Concentrations en HBIs au sein du réseau trophique ... 33
3.2. Caractéristiques du réseau sélectionné comportant un intérêt pour la santé et l’alimentation des Inuits ... 35
3.2.1. Acides gras ... 37
3.2.2. Sélénium et sélénonéine ... 38
Se chez les producteurs primaires ... 38
Se et sélénonéine chez les consommateurs ... 38
Pourcentage de Se sous forme de sélénonéine ... 40
Chapitre 4. Discussion ... 41
4.1. Structure du réseau trophique et relations inter-espèces ... 41
4.1.1. Utilisation des isotopes stables en écologie ... 41
Provenance géographique des échantillons ... 43
Utilisation du modèle de mélange isotopique Stable Isotope Analysis in R (SIAR) . 44 4.1.2. Dynamique des HBIs au sein du réseau ... 45
Accessibilité du carbone « sympagique » pour le benthos ... 48
Importance du tissu utilisé pour l’analyse de HBIs ... 50
4.1.3. Le H-Print, est-il réellement un marqueur d'utilisation de la banquise pour des études écologiques? ... 51
4.2. Utilisations des acides gras ... 54
4.2.1. DHA et EPA en tant que marqueurs écologiques ... 54
4.2.2. EPA et DHA dans l’alimentation des Inuits... 58
vi
4.3.1. Comparaison avec la littérature ... 59
4.3.2. Intérêt pour l’alimentation des Inuits ... 62
4.4. Relations entre les composés séléniés et les variables environnementales... 63
Conclusion ... 67
Bibliographie ... 69
vii
Liste des tableaux
Tableau 1. Exemples de l’utilisation des HBIs en écologie chez des espèces arctiques. ... 14 Tableau 2 Composition isotopique (15N, 13C) et concentrations en HBIs au sein d'espèces clés de l'environnement Arctique (n représente le nombre d'individus analysés pour chaque espèce, maximums et minimums sont indiqués entre parenthèse). ... 23 Tableau 3. Évolution de la concentration de certains isomères d’HBIs au sein de carottes de glace (0-10cm de l'interface eau-glace) et dans la colonne d'eau durant le printemps 2014. Entre le 26 mai et le 9 juin, les prélèvements ont été réalisés deux fois par semaine. ... 26 Tableau 4. Évolution de la concentration de certains isomères d’HBIs au sein de carottes de glace (0-3 cm de l'interface eau-glace) et dans la colonne d'eau durant le printemps 2015. Entre le 01 et le 15 juin, les prélèvements ont été réalisés deux fois par semaine. ... 27 Tableau 5. Évolution de la concentration de certains isomères d’HBIs au sein de carottes de glace (0-3 cm de l'interface eau-glace) et dans la colonne d'eau durant le printemps 2016. Entre le 30 mai et le 27 juin, les prélèvements ont été réalisés deux fois par semaine. ... 28 Tableau 6. Évolution de la concentration de certains isomères d’HBIs chez deux espèces de bivalves (Serripes groenlandicus et Mya truncata) en 2014. Les concentrations en IP25,
diène et triène sont exprimées en ng g-1 et en ng d’équivalent standard g-1 respectivement. 30 Tableau 7. Évolution de la concentration de certains isomères d’HBIs chez deux espèces de bivalves (Serripes groenlandicus et Mya truncata) en 2015. Les concentrations en IP25,
diène et triène sont exprimées en ng g-1 et en ng d’équivalent standard g-1 respectivement. 31 Tableau 8. Évolution de la concentration de certains isomères d’HBIs chez deux espèces de bivalves (Serripes groenlandicus et Mya truncata) en 2016. Les concentrations en IP25,
diène et triène sont exprimées en ng g-1 et en ng d’équivalent standard g-1 respectivement. 32 Tableau 9. Concentrations en acide gras oméga-3 (EPA, DHA), en Se total et en sélénonéine au sein d'espèces clés de l'environnement Arctique (n représente le nombre d'individus analysés pour chaque espèce, maximums et minimums sont indiqués entre parenthèse). ... 35 Tableau 10. Composition de l’alimentation des consommateurs primaires à l’étude selon SIAR. Les moyennes ainsi que les intervalles de confiance à 95% sont présentés pour les sources (4 et 2) de carbone primaire pour les espèces de bivalves et de zooplancton, respectivement. ... 44 Tableau 11. Signature H-Print au sein des espèces sélectionnées de l’environnement Arctique. Les moyennes géométriques ainsi que les gammes de valeurs atteintes sont présentés. ... 53 Tableau 12. Contenus en Se total et en sélénonéine chez des espèces marines rapportés dans la littérature. Les moyennes (µg g-1 humide) ainsi que les écarts-types ou la gamme de valeur atteinte sont présentés pour les études ayant analysé des échantillons pour la présence de sélénonéine. Les tissus les plus concentrés analysés dans cette étude sont présentés à titre de comparaison. ... 61
viii
Liste des figures
Figure 1. Contenu en Se dans le plasma et le sang chez des communautés inuites du (A) Groenland ainsi que du (B) Nunavik. Les concentrations dans le sang complet et dans le plasma sont présentées pour les deux régions. Figures adaptées de Hansen et al. 2004 et de Achouba et al. 2016. ... 3 Figure 2. Voie métabolique de la production de sélénonéine et d’ergothionéine chez la levure Schizosaccharomyces pombe (Pluskal et al. 2014). ... 6 Figure 3. Représentation schématique du réseau trophique arctique en baie de Baffin (Darnis et al. 2012). ... 9 Figure 4. Concentrations moyennes en Se total et en sélénonéine chez les espèces sélectionnées représentatives d’un réseau de l’Arctique. Les barres représentent la moyenne géométrique (µg/g de carbone) et les barres d’erreurs l’écart-type géométrique. ... 38 Figure 5. Composition isotopique des espèces sélectionnées représentant un réseau trophique arctique. Le ratio en 𝛅 15N indique la position trophique et le ratio en 𝛅 13C indique la source de carbone alimentaire. Les points représentent les moyennes et les barres d’erreurs ± écart-type. Les couleurs représentent la provenance géographique, avec en noir les échantillons du Nunavut et en gris, ceux du Nunavik. ... 41 Figure 6. Saisonnalité des HBIs contenus dans la glace de mer et la colonne d’eau. Les deux milieux de développement, soient la glace de mer et la colonne d’eau, sont représentées respectivement dans la première et la seconde ligne. Les cadrans A, B & C présentent les trois années d’analyse (2014, 2015 & 2016). ... 46 Figure 7. Évolution saisonnière de la concentration en IP25 au sein de la glace de mer et
dans les tissus de deux espèces de bivalves. En bleu : glace de mer. En noir : bivalves. Les cadrans A, B & C présentent les trois années d’échantillonnage (2014, 2015 & 2016). Les concentrations sont normalisées pour chaque échantillon. ... 48 Figure 8. Signature H-Print des échantillons de glace de mer en 2014, 2015 et 2016. Les valeurs du H-Print dans les carottes de glace des trois années sont représentées au cours de la saison de croissance. ... 52 Figure 9. Saisonnalité du rapport DHA/EPA et des concentrations en IP25 dans la glace de
mer. Le rapport en DHA/EPA et la concentration en IP25 normalisés des deux années de
récoltes (2015 & 2016) sont présentés dans les cadrans A & B. ... 55 Figure 10. Rapport DHA/EPA dans les deux différents tissus de phoque annelé du Nunavik. Les boxplots présentent les valeurs dans le foie (n = 10) et le muscle (n = 10) des échantillons récoltés. ... 57
ix
Liste des abréviations
ADN Acide désoxyribonucléique
BriGHT Bridging Global change, Inuit Health and the Transforming
Arctic Ocean
DHA Acide docosahexaénoïque
EPA Acide eïcosapentaénoïque
FFQ Questionnaire de fréquence alimentaire
GC-MS Chromatographie en phase gazeuse couplée à la spectrométrie
de masse
HBI Isoprénoïdes hautement branchés
HCl Acide chlorhydrique
HPLC Chromatographie en phase liquide à haute performance
H-Print HBI fingerprint
Hg Mercure
HgSe Séléniure mercurique
IHg Mercure inorganique
ID-ICP-MS Spectrométrie de masse avec plasma à couplage inductif avec
dilution d’isotopes
INSPQ Institut national de santé publique du Québec
IP25 Ice Proxy à 25 carbones
MeHg Méthylmercure
Se Sélénium
SeMet Sélénométhionine
SIAR Stable Isotope Analysis in R
x
Liste des annexes
Annexe 1. Calendrier des plongées 2014 ... 82 Annexe 2. Calendrier des plongées 2015 ... 83 Annexe 3. Calendrier des plongées 2016 ... 84
xi
Remerciements
Mes premiers remerciements iront à mon directeur de recherche, Guillaume Massé, non seulement pour ses multiples conseils et son support lors des différentes étapes de mon cheminement, mais également pour son attitude détendue et sa capacité à créer une ambiance de travail stimulante. Merci à Pierre Ayotte et Mélanie Lemire, mes co-directeurs, qui ont réussi à faire fonctionner avec brio ce trio de direction sans embûche. Merci de votre présence et de votre appui pendant ces quelques années. Grâce à vous trois, j’ai pu vivre des expériences uniques et inoubliables pendant les missions scientifiques sur le terrain.
Un merci particulier aux communautés inuites locales pour leur assistance dans les projets de recherche se déroulant sur leur territoire. Merci aux membres des projets Green
Edge et BriGHT, sans qui cette maîtrise n’aurait pas été possible. Merci à Joannie Ferland,
Marie-Hélène Forget, Julie Sansoulet et Debra Christiansen-Stowe. Merci à Gabrielle Fortin pour avoir rendu agréable un séjour nordique un peu plus long que prévu! Un merci spécial à tous ceux qui ont été présents pour me former et m’appuyer pendant les nombreuses heures en laboratoire, notamment Caroline Guilmette, Jonathan Gagnon et Catherine Lalande à l’Université Laval ainsi que Nathalie Ouellet et Adel Achouba à l’INSPQ.
Merci également à tous mes collèges étudiants et amis, pour les discussions autour d’un café ou d’une bière : Fanny Cusset, Dany Croteau, Rémi Amiraux, Nicolas Schiffrine, Vincent Villeneuve, Kasey Cameron, Guillaume Cinq-Mars et plusieurs autres.
Pour terminer, j’aimerais remercier Miriam, mes amis hors du laboratoire et ma famille pour leur support et leurs encouragements quand j’en avais besoin, tout comme leur présence quand j’avais envie de me changer les idées!
1
Introduction
Dans de nombreuses régions du globe, la subsistance des populations locales dépend des relations qu’elles entretiennent avec l’environnement marin. Que ce soit pour leur alimentation, en tant que source de revenu (pêche, chasse, aquaculture, écotourisme), les écosystèmes aquatiques représentent un apport important pour les sociétés vivant à proximité de la mer. Les communautés humaines vivant dans l’Arctique canadien sont particulièrement dépendantes des environnements marins (Hovelsrud et al. 2008). Ces populations ont de multiples interactions avec la faune unique de leur environnement qui leur fournit traditionnellement fourrures, matériaux pour la confection d’outils et de sculptures, inspiration artistique, revenus touristiques en plus d’être source de cohésion et de transmission intergénérationnelle par l’enseignement des arts de la chasse, de la pêche et de la trappe (Hovelsrud et al. 2008).
L’uns des déterminants les plus importants des écosystèmes arctiques réside toutefois dans l’apport alimentaire que ceux-ci fournissent. La consommation d’aliments obtenus par la trappe, la chasse, la pêche et la cueillette fait partie intégrante du mode de vie des populations arctiques depuis des générations (Condon et al. 1995, Sharma et al. 2010). Ce mode d’alimentation comporte de nombreux avantages nutritionnels puisqu’il contient, entre autres, de fortes teneurs en acides gras de type oméga-3 ainsi que plusieurs vitamines et antioxydants, dont le sélénium (Se) (Sheehy et al. 2015).
Le sélénium : contexte et importance en Arctique
Le Se est essentiel à la survie de l’humain, ainsi qu’à celle d’innombrables organismes vivants (Mertz 1981). C’est tout du moins ce que semble indiquer les résultats d’une recherche australienne s’intéressant à la concentration en Se dans des schistes marins de pyrite au fond des océans (Long et al. 2016). Des abondances extrêmement faibles en Se coïncident avec plusieurs extinctions massives à la fin des périodes géologiques de l’Ordovicien, du Dévonien, ainsi que du Trias, ce qui laisse sous-entendre qu’un simple débalancement du contenu de cet élément pourrait être partiellement à l’origine de quelques une des plus importantes extinctions de l’histoire. Mais qu’est-ce que le Se exactement? Il s’agit d’un élément du tableau périodique appartenant à la famille des chalcogènes
2
(éléments du groupe 16), qui fût découvert en 1817 par le suédois Jöns Jacob Berzelius (Barceloux 1999). Depuis le milieu du 20e siècle, les conséquences nocives d’une carence en Se sur les tissus hépatiques du rat ont démontré l’importance du Se pour la survie animale (Schwarz et Foltz 1957).
Chez l’humain, cet élément est également nécessaire au bon fonctionnement de plusieurs mécanismes cellulaires importants. Tout d’abord, son rôle le plus important consiste en l’incorporation d’un atome de Se dans l’un des 22 acides aminés à l’origine de la formation des protéines, la sélénocystéine (Papp et al. 2007). Les protéines qui contiennent cet acide aminé se nomment sélénoprotéines. Par l’action de certaines de celles-ci, notamment les différentes glutathion peroxydases et la sélénoprotéine P, le Se occupe une fonction générale dans le corps humain : la réduction du stress oxydatif (Rayman 2000, Papp et al. 2007). Ce stress est induit par les dérivés réactifs de l’oxygène (radicaux libres, ions oxygénés, peroxydes) et peut causer des mutations à l’ADN ainsi que des dommages oxydatifs aux lipides et aux protéines (Buonocore et al. 2010).
Plusieurs formes de Se ont également une importance capitale en raison de leurs interactions avec le mercure (Hg), pour lesquelles les mécanismes exacts sont encore incertains. Certaines études montrent que chez certaines espèces de poisson, lorsque l’alimentation est supplémentée en sélénite, l’élimination du Hg organique est facilitée (Bjerregaard et al. 2011). Cette élimination n’est pas observée pour le Hg inorganique (IHg) et est non spécifique à certains organes, mais dépendante de la dose en sélénite. Une étude chez l’esturgeon blanc a révélé que l’administration de Se sous forme de sélénométhionine (SeMet) pourrait également diminuer l’absorption de méthylmercure (MeHg) en plus de provoquer sa redistribution dans les différents organes (Huang et al. 2013). Plusieurs auteurs suggèrent également que l’interaction entre les deux éléments formerait le séléniure mercurique (HgSe), un complexe biologiquement inerte s’accumulant dans les organes de mammifères et d’oiseaux marins qui serait responsable de la diminution de la toxicité mercurique (Yang et al. 2008). Finalement, le Se est également positivement corrélé avec le IHg à des niveaux élevés en Se, ce qui suggère qu’il serait à l’origine de la déméthylation du MeHg en IHg, une forme beaucoup moins toxique de Hg (Eagles‐Smith et al. 2009, Khan et Wang 2009, Wang et Wang 2017).
3
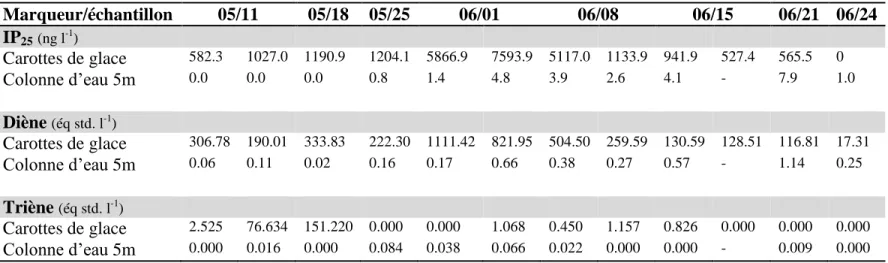
L’étude du Se et de ses propriétés est d’autant plus indispensable en Arctique en raison des concentrations très élevées de Se qui ont été retrouvées dans le sang des Inuits au Groenland (Hansen et al. 2004), au Nunavut (Laird et al. 2013) ainsi qu’au Nunavik (Lemire et al. 2015, Achouba et al. 2016). Les concentrations sanguines atteignent des valeurs extrêmes de plusieurs milliers de µg Se L-1 et des moyennes selon les régions allant jusqu’à deux fois supérieures à la moyenne canadienne de 202 µg Se L-1
(Health Canada 2010).
Figure 1. Contenu en Se dans le plasma et le sang chez des communautés inuites du (A) Groenland ainsi que du (B) Nunavik. Les concentrations dans le sang complet et dans le plasma sont présentées pour les deux
régions. Figures adaptées de Hansen et al. 2004 et de Achouba et al. 2016.
Les concentrations de Se dans le sang et dans le plasma chez les communautés inuites présentent un plateau de Se dans le plasma autour de 160 µg Se L-1 pour le Groenland et 200 µg Se L-1 pour le Nunavik, alors que des concentrations sanguines extrêmes sont retrouvées (Figure 1). Cette relation diffère de celle retrouvée chez d’autres populations démontrant un contenu sanguin élevé en Se, notamment chez des populations brésiliennes situées dans l’état du Pará (Lemire et al. 2012). Chez cette population, les contenus sanguin et plasmatique possèdent plutôt une relation positive linéaire, suggérant une distribution différente du Se dans différentes fractions du sang.
En 2016, Achouba et collaborateurs ont proposé que la distribution particulière du Se parmi les différentes fractions sanguines pourrait être expliquée par une espèce particulière de Se dans l’alimentation des Inuits (Achouba et al. 2016). En effet, chez les communautés
4
du Brésil, la principale source de Se provient de la noix du Brésil (Bertholletia excelsa), dans laquelle le Se est principalement retrouvé sous forme de SeMet (Dumont et al. 2006). Par contre, l’analyse des globules rouges des Inuits du Nunavik a permis de déterminer la principale forme de Se comme étant la sélénonéine (Achouba et al. 2019). Avec une valeur médiane de 54% du Se total, la sélénonéine représente la forme majeure de Se dans les globules rouges des résidents des communautés inuites côtières du détroit d’Hudson, là où la chasse au béluga est principalement pratiquée. La sélénonéine est activement transportée dans les globules rouges via le transporteur OCTN1 (Yamashita et al. 2013), ce qui expliquerait son accumulation préférentielle dans cette fraction sanguine comparativement au plasma chez les Inuits.
La sélénonéine : découverte et interaction avec le MeHg
Identifiée pour la première fois chez le thon rouge (Thunnus orientalis) (Yamashita et al. 2010), la sélénonéine est un analogue sélénié de l’ergothionéine, où le soufre est remplacé par le Se à l’intérieur du cycle imidazole (Yamashita et Yamashita 2010). Quelques études ont montré que cette forme organique particulière du Se serait à l’origine de la déméthylation du MeHg chez les embryons de poisson zèbre conduisant à la formation d’un complexe HgSe (Yamashita et al. 2013). Chez d’autres espèces marines, la présence de granules de HgSe a été mise en évidence dans les cellules hépatiques, suggérant qu’il s’agit effectivement du produit final du processus de détoxification du MeHg (Lailson-Brito et al. 2012). La présence de ce processus de détoxication chez l’humain n’a toutefois pas encore été démontrée.
L’étude de la sélénonéine est cruciale dans le Nord du Canada puisque le MeHg se retrouve en concentrations très importantes dans le sang des Inuits (Lemire et al. 2015). Au Nunavik, la concentration moyenne de MeHg sanguin est de 10.7 µg l-1, une valeur bien au-delà de celle rapportée dans les populations du Sud du Canada (0.69 µg l-1) (Lye et al. 2013). À l’origine, le Hg élémentaire ou inorganique est transporté en grande quantité dans l’atmosphère et entre dans les écosystèmes aquatiques de l’Arctique, où il est transformé par l’activité microbienne en MeHg (Braune et al. 2015). Il est ensuite rapidement bioaccumulé dans certains organismes et bioamplifié dans les chaînes trophiques majeures (Lavoie et al. 2013). La bioamplification du MeHg est en moyenne 1.5 fois supérieure à
5
celle du Hg total et positivement corrélée à la latitude, ce qui positionne l’environnement de l’Arctique comme un milieu fortement impacté par le MeHg. Les propriétés toxicocinétiques particulières du MeHg sont à l’origine de ses effets toxiques chez l’humain. Environ 95% du MeHg ingéré est absorbé par le tractus gastro-intestinal humain (Clarkson 2002). Sa capacité à être transporté à travers les barrières placenta et sang-cerveau permet au MeHg d’étendre sa distribution au corps en entier, en plus d’être transmis au fœtus. Ces propriétés associent le MeHg à plusieurs problèmes de neurodéveloppement qui découlent de l’exposition prénatale à cet agent neurotoxique (Pirkle et al. 2016). Une étude mère-enfant au Nunavik a d’ailleurs mis en évidence que les effets sont nombreux et observés plus tard durant l’enfance, notamment des dysfonctionnements de la mémoire (Boucher et al. 2011), une augmentation de la prévalence de déficit d’attention (Boucher et al. 2012) ainsi qu’une diminution du quotient intellectuel (Jacobson et al. 2015). L’hypothèse voulant que la sélénonéine puisse mitiger les effets toxiques du MeHg chez ces populations à risque mérite d’être investiguée. Certains résultats préliminaires indiquent que ceci serait effectivement le cas pour ce qui est de l’exposition prénatale au MeHg et de ses effets néfastes sur le développement neurologique de l’enfant (Lemire et al, en préparation).
Origine de la sélénonéine dans l’environnement
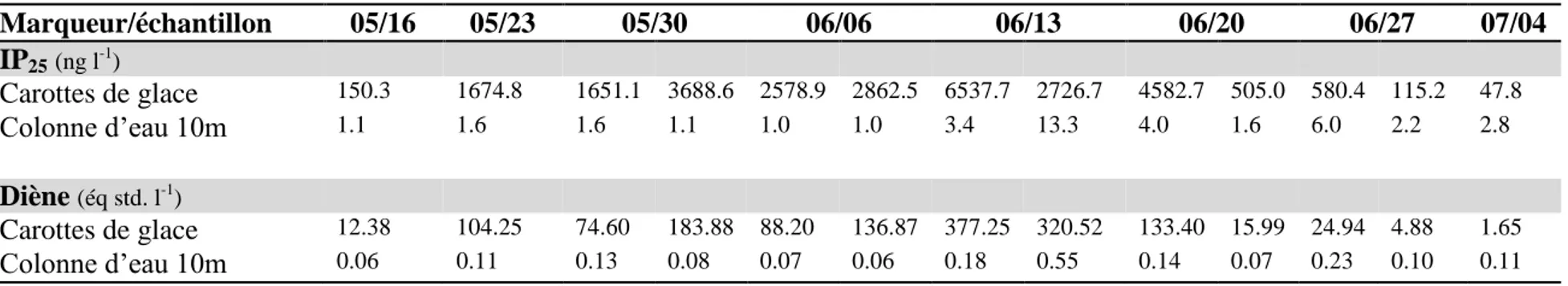
Les plantes et les animaux ne peuvent synthétiser l’ergothionéine et la sélénonéine. Seules certaines espèces de bactéries et champignons possèdent les gènes impliqués dans la biosynthèse de ces composés (Jones et al. 2014). La voie métabolique menant à la production de sélénonéine a récemment été identifié grâce à l’étude de la biosynthèse de l’ergothionéine chez la levure Schizosaccharomyces pombe (Pluskal et al. 2014). Étant donné leur proximité structurale, il a récemment été démontré que la synthèse de la sélénonéine était possible grâce à l’activation du gène Egt-1, qui est également à l’origine de la production d’ergothionéine (Figure 2) (Pluskal et al. 2014). Une conversion directe de l’ergothionéine en sélénonéine est toutefois impossible in vivo.
6
Figure 2. Voie métabolique de la production de sélénonéine et d’ergothionéine chez la levure
Schizosaccharomyces pombe (Pluskal et al. 2014).
Les gènes impliqués dans la production d’ergothionéine ont d’abord été découverts chez la bactérie Mycobacterium smegmatis, appartenant au phylum Actinobacteria (Seebeck 2010). Un groupe de 5 gènes, nommés egtA, B, C, D et E, sont responsables des différentes étapes intermédiaires à la production d’ergothionéine. Les gènes egtB et egtD sont les deux seuls nécessaires aux réactions clés du processus, alors qu’il a été démontré que le rôle des autres gènes pouvait être comblé par l’organisme (Pfeiffer et al. 2011). En 2012, le premier gène (Egt-1) de biosynthèse de l’ergothionéine a été identifié chez un champignon (Neurospora crassa) appartenant au phylum Ascomycota (Bello et al. 2012). Ce gène possède des domaines semblables à ceux retrouvés dans les gènes egtB et egtD et résultent probablement d’une fusion évolutive de ces deux gènes bactériens chez un champignon ancestral. Une étude de l’histoire évolutive de ce groupe de cinq gènes chez les procaryotes et de Egt-1 dans le règne des Fungi démontre que l’on retrouve le groupe complet seulement chez les actinobactéries (Jones et al. 2014). Certaines espèces de cyanobactéries et protéobactéries peuvent par contre également produire l’ergothionéine puisqu’elles contiennent les deux gènes nécessaires (egtB et egtD). L’étude de Egt-1 chez une centaine de génomes d’espèces de champignons a permis de repérer le gène à travers le règne, à l’exception des espèces appartenant à la sous-division des saccharomycotina (Jones et al. 2014).
7
La sélénonéine est donc produite par des organismes de bas niveau trophique, comme les bactéries et les champignons, lorsque leur milieu est riche en Se. Après avoir isolé le composé à partir du sang de thon rouge, le groupe de Yamashita a mis en évidence des concentrations élevées de sélénonéine dans les cellules sanguines de résidents de communautés insulaires au Japon dont l’alimentation repose sur les produits de la pêche (Yamashita et al. 2013). Il y a donc fort à parier que la source alimentaire de sélénonéine chez les Inuits provienne du milieu marin.
D’où provient donc le Se et la sélénonéine chez les Inuits?
Les concentrations élevées de Se dans le sang proviennent de l’alimentation traditionnelle des Inuits. Plusieurs aliments du Nunavik étudiés dans la littérature ont été rapportés comme fortement concentrés en Se, comme le mattaaq de béluga (Delphinapterus leucas (Pallas, 1776)) – soit la peau de béluga et une portion de gras sous-cutané – (3.52 µg g-1 humide), le foie de phoque annelé (2.08 µg g-1 humide), la chair de morse (1.53 µg g-1 humide) ainsi que les morues arctiques et atlantiques (0.70 µg g-1 humide) (Lemire et al. 2015). En comparaison, les aliments retrouvés dans les marchés canadiens, tels que les fruits (0.006 µg g-1 humide), les légumes (0.010 µg g-1 humide), les viandes (0.224 µg g-1 humide) et les produits céréaliers (0.387 µg g-1 humide) contiennent des concentrations de Se beaucoup plus faibles (Morris et Levander 1970). Les données issues des questionnaires de fréquence alimentaire (FFQ) chez les Inuits du Nunavik indiquent que le mattaaq de béluga est également responsable du plus grand apport en Se dans l’alimentation, suivi de différents aliments de la mer, comme les organes de mammifères marins, certains poissons, la viande de morse ainsi que les moules bleues (Lemire et al. 2015). Le béluga est par contre beaucoup moins important dans l’alimentation des Inuits de la baie de Baffin, partiellement remplacé par le narval (Monodon monoceros (Linnaeus, 1758)), mais les autres sources alimentaires de Se restent relativement semblables (Laird et al. 2013). La sélénonéine a récemment été identifiée comme la principale forme de Se dans le mattaaq de béluga au Nunavik et au Nunavut, avec une médiane de Se sous forme de sélénonéine de 54 % (Achouba et al. 2019). Les concentrations de Se et de sélénonéine élevés dans le sang des communautés nordiques proviennent donc d’une alimentation étroitement liée à l’environnement marin, entre autre en raison de la consommation de mattaaq de béluga (Little et al. 2019).
8
Origine du sélénium : environnement marin de l’Arctique
Le Se est retrouvé dans la nature sous plusieurs états d’oxydation et isotopiques différents dans de nombreux réservoirs de l’environnement. On le retrouve dans l’atmosphère, où ses principales sources anthropiques et naturelles sont l’utilisation des combustibles fossiles et le rejet de gaz volcaniques, ainsi que dans les sols sous forme de sélénides et sélénites associés à des métaux sulfureux (Barceloux 1999). Il est également présent dans l’eau, résultat de la déposition sèche et humide de particules atmosphériques et du lessivage de la surface terrestre. Le Se intègre la chaîne alimentaire marine grâce à l’assimilation des quantités présentes dans l’eau, principalement par les producteurs primaires (Bowie et al. 1996, DeForest et al. 2016).
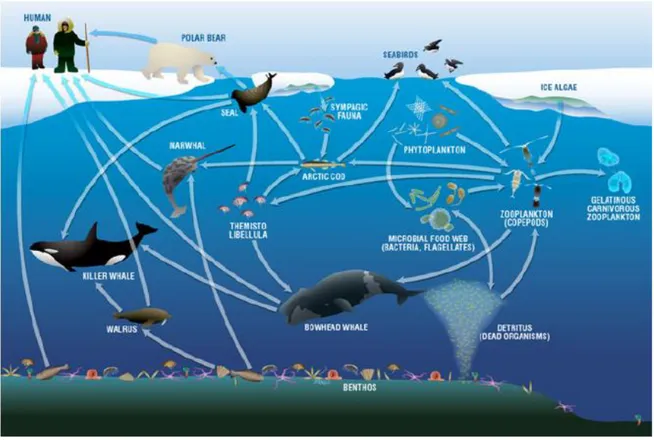
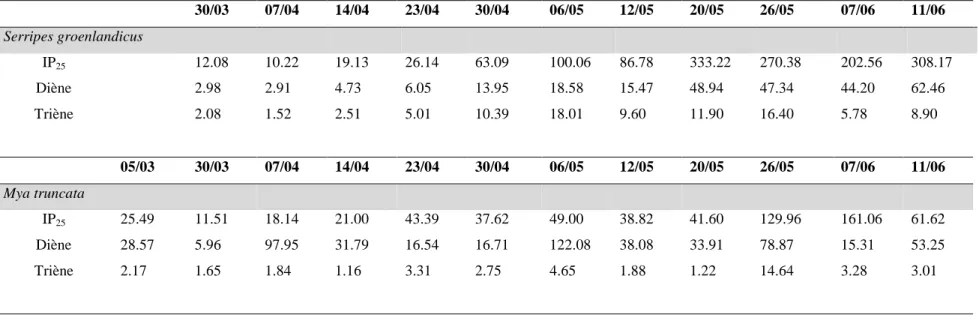
L’environnement de l’Arctique est caractérisé par des conditions extrêmes, comme l’alternance de nuits polaires et du soleil de minuit, un couvert de glace saisonnier ou encore une limitation forte en nutriments, qui se succèdent au fil des saisons (Darnis et al. 2012). Ces caractéristiques uniques ont engendré des relations spécifiques entre les différentes espèces adaptées à ce milieu. Ces interactions, schématisées dans la Figure 3, sont à la base de l’écosystème arctique et de la compréhension des transferts de Se dans cet environnement. Quelques espèces et communautés sélectionnées dans le cadre de ce projet seront présentées dans cette section.
9
Figure 3. Représentation schématique du réseau trophique arctique en baie de Baffin (Darnis et al. 2012).
La production primaire de l’Océan Arctique est régulée par deux principaux facteurs, tous les deux fortement liés au couvert de glace : la disponibilité en nutriment et l’accessibilité à la lumière (Popova et al. 2012). Lors de la fonte de la glace et du couvert de neige, des mares d’eau se créent sur la banquise. Cette modification de la banquise, associé à la réduction de son épaisseur, permettent à une quantité plus élevée de lumière d’atteindre la base de la glace, près de l’interface avec la colonne d’eau. Ce changement des paramètres physiques à l’intérieur de la glace de mer est ce qui permet à des communautés composées de multiples organismes, d’origine animale et végétale, de se développer dans les canaux de saumures de cet environnement unique. En Arctique, ces assemblages sont dominés par des diatomées pennées, mais peuvent également contenir des dinoflagellés, des rotifères, des nématodes et plusieurs autres espèces dans des proportions plus faibles (Horner et al. 1992, Poulin et al. 2011). Ces communautés sont d’une importance capitale pour l’écosystème puisque les algues de ce milieu peuvent contribuer jusqu’à 26% de la production primaire totale dans des eaux caractérisées par un couvert de glace saisonnier (Gradinger 2009). La débâcle de la glace de mer est par la suite à la source du
10
déclenchement de la floraison printanière de phytoplancton dans la colonne d’eau (Wassmann 2011, Popova et al. 2012). Le phytoplancton, en terme de biomasse, est le producteur primaire le plus important pour l’écosystème arctique, contribuant jusqu’à 90% de la production primaire dans certains environnements (Welch et al. 1992). Ces deux bassins de production primaires sont historiquement considérés comme étant la base du réseau trophique de l’Arctique.
Jusqu’à récemment, les macroalgues situées sur le benthos ont été peu intégrées dans les études s’intéressant aux réseaux trophiques de l'Arctique. Cependant, il a été démontré qu'ils peuvent fortement contribuer à la production primaire totale à des profondeurs plus faibles (Glud et Rysgaard 2007, Krause-Jensen et Duarte 2014). Cette production primaire de macroalgues peut intégrer les chaînes alimentaires de plusieurs façons, notamment par broutage direct ou sous forme de détritus, et pourrait être particulièrement bénéfique pour la croissance des organismes benthiques se nourrissant par microphagie suspensivore (Wessels et al. 2012, Perez et al. 2013).
Le zooplancton, tout comme le phytoplancton, est composé de multiples organismes en suspension dans la colonne d’eau. Trois espèces de copépodes dominent généralement la biomasse des assemblages zooplanctoniques de l’Océan arctique : Calanus glacialis (Jaschnov, 1955), Calanus hyperboreus (Kroyer, 1838) et Calanus finmarchicus (Gunnerus, 1770) (Auel et Hagen 2002). Ils se nourrissent principalement de cellules phytoplanctoniques de grande taille (diatomées, dinoflagellés) et se construisent d’importantes réserves de lipides qui, avec quelques espèces du genre Pseudocalanus et
Metridia longa (Lubbock, 1854), représentent la quasi-totalité de l’énergie relayée aux
niveaux supérieurs du réseau trophique pélagique (Welch et al. 1992, Falk-Petersen et al. 2009). Également dans la chaîne marine pélagique se trouve la morue arctique, Boreogadus
saida (Lepechin, 1774), qui est l’un des consommateurs primaires des copépodes arctiques
(Rand et al. 2013). Cette espèce est l’une des plus abondantes dans l’Arctique (Falk-Petersen et al. 1986, Harter et al. 2013). Il s’agit également de la denrée de base des phoques annelés et de certaines baleines, allant jusqu’à représenter 75% du transfert d’énergie du zooplancton vers les prédateurs vertébrés (Welch et al. 1992).
11
Les chaboisseaux (Cottidae spp.) sont une grande famille d’espèces de poissons benthiques largement distribuées dans l’Atlantique nord et l’Arctique (Johannesen et al. 2012). Parmi ces espèces se trouve le chaboisseau arctique, Myoxocephalus scorpioides (Fabricius, 1780), un poisson d’eau salée présent dans l’Océan Arctique (Mecklenburg et al. 2011). Ce poisson est adapté à une vie active près des fonds marins et possède une alimentation diversifiée associée à la disponibilité des proies sur le benthos (Landry et al. 2018). Malgré leur présence en profondeur, il est généralement accepté qu’une portion majeure de l’alimentation des chaboisseaux pouvant atteindre 50 % provienne du carbone produit de façon pélagique (McMeans et al. 2013). Le chaboisseau n’est pas représenté sur la Figure 3, mais est important dans le cadre de ce projet puisqu’il est présent en grande quantité le long des côtes entourant les villages inuits au Nunavik et dans la baie de Baffin et donc consommé par ces populations (Chan et al. 1995, Wein et al. 1996, Lemire et al. 2015). Également présent sur le fond de l’océan en très grande densité se trouvent deux espèces de bivalves, Mya truncata (Linnaeus, 1758) et Serripes groenlandicus (Mohr, 1786), dont l’abondance peut aller jusqu’à plus de 100 individus par mètre carré à 15 mètres de profondeur dans le cas de M. truncata (Welch et al. 1992). Ces bivalves se nourrissent par microphagie suspensivore, c’est-à-dire qu’elles filtrent les particules en suspension dans leur environnement (Fisk et al. 2003). Ils sont endobenthiques, ou encore sur la surface du fond marin. Ces bivalves sont d’une importance capitale dans le transfert d’énergie vers certains poissons et mammifères marins (Hoover et al. 2013). De plus, plusieurs espèces de bivalves sont également consommées régulièrement par les communautés inuites (Chan et al. 1995, Wein et al. 1996, Gagné et al. 2012).
Plus haut dans la chaîne alimentaire se retrouvent plusieurs espèces de mammifères marins (Figure 3). Deux espèces en particulier seront abordées dans le cadre de ce projet, soit le morse (Odobenus rosmarus (Linnaeus, 1758)) et le phoque annelé (Pusa hispida (Schreber, 1775)). Le morse est le lien terminal de la chaîne marine benthique. Il se nourrit de plusieurs invertébrés benthiques, parmi lesquels se retrouve en grande proportion M.
truncata et quelques autres bivalves (Fay 1982, Welch et al. 1992). Le morse possède une
large distribution dans l’hémisphère nord et est reconnu pour effectuer de longues migrations -vers le nord au printemps et vers le sud à l’automne- pour se maintenir en périphérie de la banquise dans des régions où se trouvent des chenaux libres de glace (Fay
12
1982). Cet animal est historiquement présent dans l’alimentation inuite au Groenland et en Amérique, malgré une diminution de son importance depuis le début des années 1990 (Garlich‐Miller et al. 2006). Le phoque annelé possède une alimentation très différente de celle du morse. Il s’agit du plus grand consommateur de morue arctique (Welch et al. 1992), mais son alimentation comprend également le capelan et quelques espèces de crustacés pélagiques (Parathemisto spp., Themisto libellula) (Siegstad et al. 1998, Holst et al. 2001). Le phoque annelé est encore aujourd’hui activement chassé et consommé par les Inuits et contribue à diminuer l’insécurité alimentaire dans de nombreuses communautés (Lysenko et Schott 2019).
Caractéristiques du réseau trophique de l’Arctique
Plusieurs caractéristiques du réseau trophique à l’étude ont été sélectionnées pour définir les interactions entre les espèces. Ces marqueurs seront définis et présentés dans cette section.
Composition isotopique
De nombreux éléments se retrouvent naturellement sous plusieurs formes isotopiques soit stables ou radioactives. Les isotopes d’un élément se distinguent entre eux par leurs masses légèrement différentes. La différence de masse de ces isotopes engendre des comportements spécifiques dans l’environnement, causant des variations naturelles dans leur abondances relatives (Crawford et al. 2008). La composition relative en isotope stables du carbone (13C) et de l’azote (15N) sont des techniques régulièrement utilisées pour l'étude de réseaux trophiques et l'écologie alimentaires de nombreuses espèces (Peterson et Fry 1987, Boecklen et al. 2011).
La composition isotopique en carbone des organismes est utilisée au sein d'études s’intéressant au milieu aquatique pélagique (Forest et al. 2011, Kohlbach et al. 2017) ou benthique (Mäkelä et al. 2017). Celle-ci reflète avec précision la signature des organismes à la base du régime alimentaire étudié, avec toutefois un léger enrichissement d’environ 1 ‰ en 13C (Michener et al. 2007) à chaque niveau trophique. Cet enrichissement s’explique potentiellement par une perte préférentielle du 12C pendant la respiration, un fractionnement métabolique pendant la synthèse de certains tissus, ou encore par une absorption préférentielle de composés riches en 13C lors de l’assimilation (Michener et al. 2007). En
13
conséquent, si les sources de carbone d’un consommateur sont suffisamment distinctes en terme de signature en 13C, il est possible d’obtenir de l’information sur un régime alimentaire à l’aide des isotopes de carbone. Les algues de glace et le phytoplancton ont des valeurs de 13C distinctes, les algues de glace étant de 2 à 10 ‰ plus riches en 13C que le phytoplancton (Hobson et Welch 1992, Hobson et al. 1995, Søreide et al. 2006). Cette différence en 13C a donc été utilisée pour distinguer l’origine du carbone dans les consommateurs primaires et secondaires de l’environnement marin arctique à l’étude.
La caractéristique la plus régulièrement utilisée du 15N en écologie est l’augmentation prévisible, généralement entre 2 ‰ à 4 ‰, de son contenu à chaque niveau trophique (Crawford et al. 2008). La quantification de cet isotope permet donc d’obtenir des informations sur la structure des communautés, tels que le positionnement trophique d’une espèce, la longueur des chaînes trophiques ou encore le partage des ressources (Hobson et al. 2002, Post 2002). Ces outils sont utilisés fréquemment en Arctique, où les réseaux trophiques sont régulièrement longs et complexes (Pomerleau et al. 2016, Mäkelä et al. 2017). Le 15N est également utilisé pour déterminer les niveaux de biomagnification de certains éléments et contaminants dans l’environnement Arctique (Okelsrud et al. 2017, Brown et al. 2018).
Isoprénoïdes hautement branchés
Certains composés organiques appartenant à la classe des isoprénoïdes sont également utilisés pour obtenir des informations sur l’écologie des espèces marines en zone polaire. Ces lipides, appelés isoprénoïdes hautement branchés (HBI), présentent des caractéristiques et des sources spécifiques. L’IP25 (Ice Proxy à 25 carbones) est synthétisé uniquement par
certaines diatomées se développant exclusivement dans la glace de mer (Belt et al. 2007). Seul un nombre réduit d’espèces ont été identifiées comme productrices d’IP25 dans la
littérature (Pleurosigma stuxbergii var. rhomboides (Cleve), Haslea kjellmanii (Cleve),
Haslea crucigeroides (Hustedt) et/ou Haslea spicula (Hickie)), alors que quelques espèces
très abondantes ne synthétisent pas ce lipide (Navicula pelagica (Cleve) et Nitzschia frigida (Grunow)) (Brown et al. 2014). La spécificité de l’IP25 permet donc de montrer une
inféodation à la glace; si l’on retrouve de l’IP25 dans le tissu d’un individu, cela signifie
qu’il s’est alimenté sur des algues produites dans la banquise ou, lorsqu’il s’agit d’un consommateur secondaire, qu’une de ses proies s’y est alimentée. Outre IP25, un isomère
14
di-insaturé (diène), a été aussi identifié dans la banquise et au sein des espèces produisant l'IP25 (Brown et al. 2014). En revanche, certains isomères d’HBIs sont généralement
associés à une production de carbone pélagique et absent des communautés d’algues de glace (Brown et Belt 2017). C’est notamment le cas d’un HBI tri-insaturé (triène), qu’on retrouve dans les échantillons pélagiques d’études autant en Arctique que dans des régions tempérées (He et al. 2016, Kaiser et al. 2016, Brown et al. 2017). Le contenu relatif de ces différents HBIs permet d’identifier la source du carbone dans l’alimentation de certaines espèces.
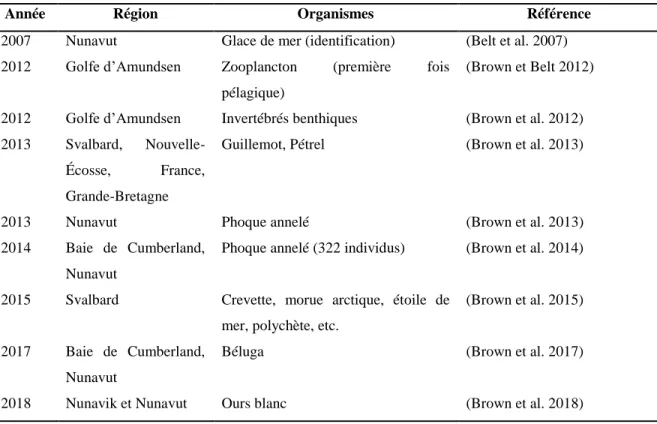
Tableau 1. Exemples de l’utilisation des HBIs en écologie chez des espèces arctiques.
Année Région Organismes Référence
2007 Nunavut Glace de mer (identification) (Belt et al. 2007) 2012 Golfe d’Amundsen Zooplancton (première fois
pélagique)
(Brown et Belt 2012)
2012 Golfe d’Amundsen Invertébrés benthiques (Brown et al. 2012) 2013 Svalbard,
Nouvelle-Écosse, France, Grande-Bretagne
Guillemot, Pétrel (Brown et al. 2013)
2013 Nunavut Phoque annelé (Brown et al. 2013) 2014 Baie de Cumberland,
Nunavut
Phoque annelé (322 individus) (Brown et al. 2014)
2015 Svalbard Crevette, morue arctique, étoile de mer, polychète, etc.
(Brown et al. 2015)
2017 Baie de Cumberland, Nunavut
Béluga (Brown et al. 2017)
2018 Nunavik et Nunavut Ours blanc (Brown et al. 2018)
Acides gras spécifiques
Les acides gras sont également utilisés pour décrire les réseaux trophiques pélagiques (Dalsgaard et al. 2003, Søreide et al. 2008) et benthiques (Graeve et al. 1997, Kelly et Scheibling 2012). Les diatomées sont caractérisées par une concentration élevée de plusieurs acides gras, dont l’acide eïcosapentaénoïque (EPA), alors que les dinoflagellés sont plutôt associés à l’acide docosahexaénoïque (DHA) (Budge et Parrish 1998). Comme les communautés vivant à l’intérieur de la glace sont majoritairement dominées par les
15
diatomées (Poulin et al. 2011), le rapport de ces acides gras devrait permettre d’obtenir de l’information au sujet de la source de carbone dans l’écosystème.
Ces deux acides gras sont également considérés comme ayant des effets bénéfiques pour la santé. Chez les Inuits, EPA et DHA sont associés à une diminution des facteurs de risque des maladies cardiovasculaires chez les adultes (Dewailly et al. 2001). Par ailleurs un apport alimentaire élevé en oméga-3 pendant la grossesse est bien connu pour ses effets bénéfiques sur le développement cérébral, notamment quant à la mémoire plus tard chez les jeunes Inuit (Boucher et al. 2011). Au Nunavik, ces acides gras sont retrouvés en concentrations exceptionnelles dans les aliments provenant de la mer, tels que le gras de mammifères marins (EPA + DHA; 56.00 – 185.62 mg g-1 humide) ainsi que la chair de plusieurs espèces de poisson (EPA + DHA; 2.00 – 14.70 mg g-1 humide) (Lemire et al. 2015). La présence de ces acides gras en quantité importante constitue donc un facteur bénéfique pour la santé humaine.
16
Chapitre 1. Objectifs
La présente étude a comme objectif général d’approfondir nos connaissances sur la distribution du Se et de la sélénonéine au sein de l’écosystème arctique. Nos travaux ont été structurés autour de deux objectifs précis, sélectionnés en raison de leur pertinence d’un point de vue écologique ou de la santé des Inuits. Pour y parvenir, des analyses de Se et de sélénonéine ont été effectuées, jumelées à des analyses de contenu lipidique et d’isotopes stables. Ces méthodes ont été utilisées dans le but d’obtenir une approche multi-marqueurs, pertinents dans chacun des deux domaines scientifiques impliqués. Pour chacun de ces deux objectifs, quelques sous-objectifs ont été établis.
1. Caractériser les interactions trophiques entre les espèces représentatives de deux chaînes trophiques importantes en Arctique, soit une chaîne pélagique et une chaîne associée au benthos.
i. Quantifier la présence de plusieurs composés utilisés comme marqueurs écologiques (isotopes stables, isoprénoïdes hautement branchés, acides gras) au sein des espèces sélectionnées.
ii. Évaluer l’importance relative des deux bassins de production primaire dans le développement des espèces à l’étude à l’aide des contenus lipidiques. iii. Caractériser l’évolution temporelle de l’association entre la production
primaire dans la banquise et son utilisation par les espèces benthiques.
2. Caractériser la distribution et l’origine du Se et de la sélénonéine chez les espèces représentatives de deux chaînes trophiques importantes en Arctique, soit une chaîne pélagique et une chaîne associée au benthos.
i. Mesurer les concentrations de Se et de sélénonéine chez les espèces à l’étude.
ii. Évaluer les associations entre les contenus en Se et en sélénonéine avec les différents marqueurs écologiques utilisés.
iii. Évaluer la possibilité que certains producteurs primaires soient à l’origine de la production de la sélénonéine.
17
iv. Améliorer la compréhension quant aux sources de Se et de sélénonéine dans l’alimentation des communautés inuites.
18
Chapitre 2. Matériel et méthodes
2.1. Récolte d’échantillons
Ce projet s’insère dans les objectifs du programme Green Edge, qui consiste en une étude multidisciplinaire de l’écosystème de l’Arctique ayant comme objectif de mieux comprendre les facteurs contrôlant la production primaire des communautés sympagiques -associées à la glace- et du phytoplancton en Arctique et son rôle au sein des géosystèmes arctiques. Une composante du projet s'intéresse à mieux comprendre les impacts potentiels de variations de la productivité primaire en lien avec les changements climatiques sur les populations humaines. Mon projet s'insère au sein de cette thématique. L'échantillonnage a été réalisé à bord du brise-glace NGCC Amundsen et à partir d'un camp de glace temporaire établi pendant les périodes d’avril à juillet 2015 et 2016. À environ 25 km de ces installations se trouve le village de Qikiqtarjuaq, situé dans la région de Qikiqtaaluk, à l’est de l’île de Baffin au Nunavut (67°33′29″ N, 64°01′29″ W) où une équipe a réalisé des entretiens avec les habitants afin de mieux cerner leurs habitudes alimentaires.
Notre échantillonnage a pu être complété via des collaborations avec des chercheurs du Centre de recherche du Nunavik et du projet BriGHT (Bridging Global change, Inuit
Health and the Transforming Arctic Ocean) financé par Sentinelle Nord. Tous les
échantillons récupérés ont été maintenu congelé à -20 °C jusqu’à leur analyse en laboratoire.
2.1.1. Collecte d’algues de glace & de phytoplancton
Les peuplements d'algues de glace ont été prélevés par de multiples carottages de banquise effectués autour du camp de glace du projet Green Edge à raison de deux carottages par semaine au cours de la saison de croissance des algues. Les 3 centimètres situés proches de l’interface entre la glace et l’eau ont été sectionnés et fondus à basse température dans un récipient thermostatique. La biomasse algale a ensuite été récupérée par centrifugation dans des tubes de type Falcon de 50ml.
Le phytoplancton des 50 premiers mètres de la colonne d’eau a été prélevé à l’aide d’un filet à plancton (25 m) déployé via une ouverture pratiquée à la tarière sur la banquise à proximité du camp de glace à sept reprises pendant la floraison printanière de
19
phytoplancton dans la colonne d’eau. La biomasse ainsi récoltée a été récupérée par centrifugation dans des tubes de type Falcon de 50 ml.
2.1.2. Collecte de zooplancton
Le zooplancton a également été récupéré à l'aide d'un filet (200 m) déployé jusqu’à 350 m, ce qui représente la quasi-totalité de la colonne d’eau. Les sept échantillons récupérés ont ensuite été filtrés sur une maille de 1000 m, puis séparés en deux échantillons (200-1000m; 1000m et plus). Pour deux échantillons, 100 individus du genre Calanus ont également été isolés pour des analyses spécifiques.
2.1.3. Collecte du benthos
Deux espèces de bivalves (M. truncata & S. groenlandicus) ont été prélevées sur le fond marin entre février 2014 et juin 2016 par des plongeurs. Plusieurs échantillons de macroalgues ont également été collectées, dont certains ont été sélectionnés en raison du nombre d’échantillons disponibles plus élevé pour des analyse complémentaires (voir annexes 1, 2 & 3 pour une liste complète des échantillons récoltés).
2.1.4. Récolte de poissons et mammifères marins
Des spécimens de morues arctiques (Boreogadus saida) ont été pêchées en baie de Baffin à l'aide d'un chalut pélagique de type IKMT à bord du NGCC Amundsen pendant les campagnes ArcticNet 2015 et 2016. À ces échantillons s’ajoutent trois individus récoltés sur le camp de glace Green Edge avec l’aide des pêcheurs Inuits locaux.
Dix échantillons de muscle de chaboisseau arctique (M. scorpioides), onze échantillons de muscle et de foie de phoque (P. hispida) ainsi que seize échantillons de muscle provenant de la langue de morse (O. rosmarus) ont été récoltés dans plusieurs villages au Nunavik dans le cadre des activités de pêche et de chasse à des fins de subsistances des communautés inuites locales en collaboration avec le Centre de recherche du Nunavik et le projet BriGHT. Un séjour au Nunavik en novembre 2017 a également permis de récolter un échantillon de peau de morse, chassé aux abords du village de Quaqtaq, qui a été analysé de façon complémentaire.
20
2.2. Analyses en laboratoire
Les échantillons ont été préservés congelés, lyophilisés et broyés à l’aide d’un mortier et d’un pilon avant analyse. Pour chaque échantillon, la masse humide, la masse sèche, le pourcentage d'eau et de carbone ont été déterminés afin de pouvoir exprimer chaque résultat en rapport à la masse sèche ou humide ou par gramme de carbone. Comme ce projet se situe à l'interface entre deux disciplines scientifiques, soit la nutrition et santé humaine et les sciences de l'environnement, utilisant des unités différentes, la nécessité de pouvoir exprimer les résultats de façon cohérente avec la littérature était primordiale.
2.2.1. Isotopes stables
Les analyses d’isotopes ont été réalisées au Laboratoire d’Océanographie de l’Université Laval, à Québec. Pour chaque échantillon, un aliquote de quelques milligrammes a été encapsulé dans des capsules en étain. Les teneurs en carbones et azote ainsi que la composition isotopique en carbone et en azote de chaque échantillon ont été déterminées par spectrométrie de masse suivant le protocole décrit par Robillard et collaborateurs (2017). Deux standards, USGS40 et USGS41 (Qi et al. 2003), ont été utilisés afin de déterminer précision et erreurs analytiques. Les teneurs en carbone et azote sont exprimées en mg g-1 et les ratios isotopiques sont exprimés en notation ẟ, correspondant à la déviation en pour mille (‰) par rapport aux standards de référence internationaux (Robillard et al. 2017).
2.2.2. Lipides
Les contenus en lipides polaires et apolaires de chaque échantillon ont été analysés au laboratoire de géochimie organique de l’Université Laval. Trois standards internes (10 µl 7-hexylnonadécane, 100 µl androstanol, 500 µl 5beta-Cholanic acid) ont été ajoutés aux échantillons (0.25 à 0.5g de masse sèche) avant extraction pour permettre la quantification des marqueurs lipidiques. Les lipides totaux ont d'abord été extrait par la méthode de Bligh & Dyer (1959) puis saponifiés (KOH 5%, MeOH/H2O 80/20; 90°C, 1h). La fraction
contenant les lipides insaponifiables a été obtenue par extraction liquide (Hexane, 3*2ml) et purifiée suivant le protocole décrit dans Belt et al. (2007). Les acide gras ont ensuite été extrait après acidification du mélange de saponification (HCl 37%, 1ml) et extraction
21
liquide (Hexane, 3*2ml). Chaque fraction a ensuite été analysée par chromatographie en phase gazeuse couplée à la spectrométrie de masse (GC-MS) (Belt et al. 2007). Les biomarqueurs ont été identifiés par leur temps d'élution en comparaison du spectre de masse avec celui obtenu de standards purs. La quantification des lipides a été possible grâce aux standards internes et la détermination systématique de facteurs de réponse pour chaque standard. Pour quantification de l’IP25 : un facteur de réponse moyen de 9.8 a été obtenu par
l'analyse de standards au début de chaque série analytique. Pour les lipides dont le laboratoire ne possédait pas de standard pur de ces molécules, les résultats sont exprimés en ng d'équivalent du standard interne (7-hexylnonadécane). Pour la quantification des acides gras, les facteurs de réponses ont été calculés suivant le même mode opératoire à partir d’un standard connu (Supelco® 37 Component FAME Mix, Supelco).
2.2.3. Se total et sélénonéine
Les analyses de Se et de sélénonéine ont été réalisées par ICP-MS/MS au laboratoire de recherche du Centre de toxicologie de l’Institut national de santé publique du Québec (INSPQ).
Pour le contenu en Se total, les échantillons sont digérés en présence d'acide nitrique concentré et le produit de la digestion est ensuite dilué et analysé par spectrométrie de masse avec plasma à couplage inductif avec dilution d’isotopes (ID-ICP-MS/MS) en utilisant un système Triple Quad (ICP-QQQ - Agilent Technologies). La méthode analytique est entièrement développée et validée à des fins de surveillance, conformément aux directives ISO 17025. Le contrôle de la qualité est assuré par l'analyse de deux matériaux de référence certifiés, SRM-1577C et Dolt-4 du National Institute for Standards
and Technology et du National Research Council of Canada, respectivement.
Pour le contenu en sélénonéine, 50 mg de chaque échantillon homogénéisé a été extrait en phase aqueuse par ultrasons (2 min, 20%) en présence de dithiothréitol (DTT, 50 mM) puis séparé par centrifugation à travers des filtres de 10 kDa (15 mL). Le filtrat a été concentré par évaporation et ensuite analysé par HPLC-ICP-MS/MS (100 µL échantillon, 390 µL phase mobile, 10 µL standard interne). Pour le détail complet de la méthode analytique, se référer à l’article d’Achouba et. al (2019).
22
2.3. Analyse de données
2.3.1. Analyses statistiques
Les analyses statistiques ont été réalisées à l’aide de la version 3.4.3 du logiciel R. Le seuil du niveau de signification α a été défini à 5%, ou 0.05. Avant chaque test statistique, chaque ensemble de données a été testé pour vérifier l’homogénéité des variances ainsi que la normalité des résidus. Lorsque nécessaire, les différences significatives entre les moyennes des différents marqueurs selon les espèces ou les tissus ont été testées à l’aide du test de Student (t-test). Les corrélations entre les paramètres écologiques et les contenus en acides gras, en Se total ou en sélénonéine ont été effectués à l’aide du test de corrélation non-paramétrique de Spearman (rho).
Afin de déterminer la composition de l’alimentation des consommateurs primaires, le modèle de mélange isotopique Stable Isotope Analysis in R (SIAR; version 4.2), développé par Andrew Parnell et Andrew Jackson, a été utilisé (Parnell et al. 2013).
23
Chapitre 3. Résultats
3.1. Caractéristiques écologiques du réseau sélectionné représentatif d’un environnement Arctique
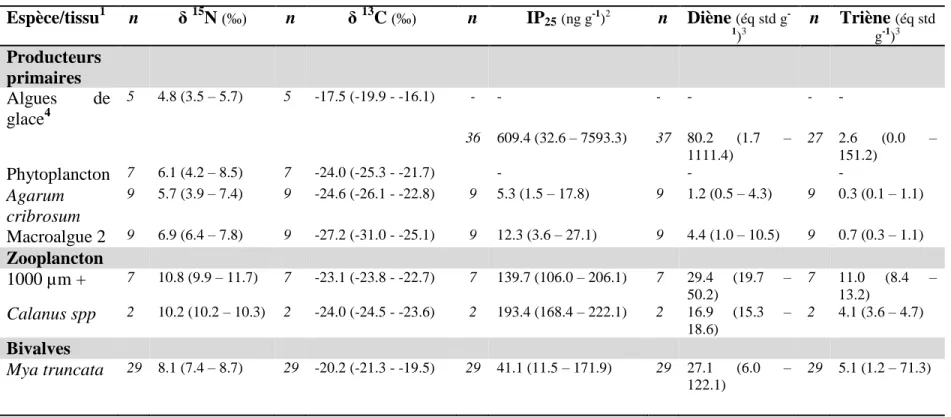
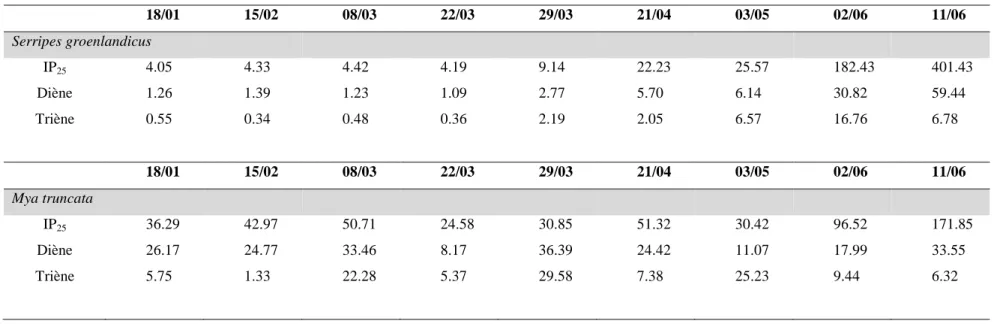
Le tableau 2 présente les résultats des paramètres écologiques étudiés pour chaque tissu sélectionné. Moyenne géométrique et gamme de valeur sont présentées.
Tableau 2 Composition isotopique (15N, 13C) et concentrations en HBIs au sein d'espèces clés de l'environnement Arctique (n représente le nombre
d'individus analysés pour chaqueespèce, maximums et minimums sont indiqués entre parenthèse).
Espèce/tissu1 n δ 15N (‰) n δ 13C (‰) n IP25 (ng g-1)2 n Diène (éq std g
-1)3 n Triène (éq std g-1)3 Producteurs primaires Algues de glace4 5 4.8 (3.5 – 5.7) 5 -17.5 (-19.9 - -16.1) - - - - - - 36 609.4 (32.6 – 7593.3) 37 80.2 (1.7 – 1111.4) 27 2.6 (0.0 – 151.2) Phytoplancton 7 6.1 (4.2 – 8.5) 7 -24.0 (-25.3 - -21.7) - - - Agarum cribrosum 9 5.7 (3.9 – 7.4) 9 -24.6 (-26.1 - -22.8) 9 5.3 (1.5 – 17.8) 9 1.2 (0.5 – 4.3) 9 0.3 (0.1 – 1.1) Macroalgue 2 9 6.9 (6.4 – 7.8) 9 -27.2 (-31.0 - -25.1) 9 12.3 (3.6 – 27.1) 9 4.4 (1.0 – 10.5) 9 0.7 (0.3 – 1.1) Zooplancton 1000 µm + 7 10.8 (9.9 – 11.7) 7 -23.1 (-23.8 - -22.7) 7 139.7 (106.0 – 206.1) 7 29.4 (19.7 – 50.2) 7 11.0 (8.4 – 13.2) Calanus spp 2 10.2 (10.2 – 10.3) 2 -24.0 (-24.5 - -23.6) 2 193.4 (168.4 – 222.1) 2 16.9 (15.3 – 18.6) 2 4.1 (3.6 – 4.7) Bivalves Mya truncata 29 8.1 (7.4 – 8.7) 29 -20.2 (-21.3 - -19.5) 29 41.1 (11.5 – 171.9) 29 27.1 (6.0 – 122.1) 29 5.1 (1.2 – 71.3)
24 Espèce/tissu1 n δ 15N (‰) n δ 13C (‰) n IP25(ng g-1)2 n Diène (éq std g -1)3 n Triène (éq std g-1)3 Serripes groenlandicus 28 7.6 (6.9 – 8.5) 28 -21.4 (-22.5 - -20.3) 28 32.5 (4.1 – 401.4) 28 7.7 (1.1 – 71.1) 28 3.2 (0.3 – 18.0) Chaboisseau Nunavik Muscle 10 14.0 (12.6 – 15.9) 10 -18.1 (-18.7 - -17.5) 10 38.1 (27.5 – 56.6) 10 0.9 (0.6 – 1.2) 10 0.1* (0.0 – 0.1) Nunavut Muscle 1 14.7 1 -20.0 1 26.7 1 0.7 1 0.1 Morue arctique Muscle 18 13.2 (12.9 – 15.1) 18 -21.5 (-21.9 - -20.9) 9 1.0 (0.5 – 2.2) 9 0.2 (0.1 – 0.4) 9 0.2 (0.1 – 0.8) Phoque annelé Nunavik Foie 11 13.8 (13.1 – 17.0) 11 -18.0 (-18.2 - -17.7) 11 38.8 (4.5 – 218.6) 11 15.0 (3.6 – 76.3) 11 1.8 (0.2 – 8.1) Muscle 11 14.2 (13.2 – 16.9) 11 -17.6 (-17.9 - -17.0) 11 1.0 (0 – 1.5) 11 0.2 (0.1 – 0.5) 11 0.1 (0.1 – 0.2) Nunavut Foie 1 18.2 1 -20.0 1 229.3 1 48.1 1 7.3 Muscle 1 18.1 1 -20.1 1 2.23 1 0.3 1 0.1 Morse Muscle 16 12.8 (10.9 – 15.0) 16 -17.9 (-18.4 - -16.0) 16 1.6 (0.4 – 4.3) 16 0.3 (0.1 – 1.4) 16 0.3 (0.1 – 1.0) Peau 1 13.6 1 -17.2 1 1.6 1 0.3 1 0.2
1 Individus complets utilisés, excepté lorsqu’indiqué différemment 2 Concentrations présentées en ng d’IP
25 par g de poids sec d’échantillon analysé, excepté pour les algues de glace (ng d’IP25 par litre) 3 Équivalent de standard interne (7-hexylnonadécane)
4
La première ligne pour les algues de glace correspond aux échantillons récoltés par centrifugation, la seconde à ceux récoltés par filtration et dont la concentration est calculée en ng l-1