Pr. Jean-philippe Ranjeva, Rapporteur et pr
sident
Pr. Nidhal Carla Bouaynaya, Rapporteure
Dr. Christian Barillot, Examinateur
Pr. Isabelle Berry, Directrice de th
se
Pr. Daniel Delahaye, Directeur
de th se
Pr. Pierre M
aréchal, Co-directeur de th se
Je commence par remercier Pr. Jean-Philippe Ranjeva, Pr. Nidhal Bouaynaya et Dr. Christian Barillot d’avoir accept´e de faire partie de mon jury de th`ese. J’ai beaucoup appr´eci´e notre ´echange lors de la soutenance.
Merci au Pr. Isabelle Berry `a qui je tiens `a exprimer ma profonde gratitude, pour avoir encadr´e et dirig´e mes recherches. Je vous remercie pour votre soutien et votre appui tout au long de cette th`ese. Je m’estime honor´ee et chanceuse de vous avoir eue comme directrice de th`ese. Merci aussi au Pr. Daniel Delahaye et Pr. Pierre Mar´echal pour leur co-encadrement. Merci `a toi Daniel pour ta constante bonne humeur et tes pr´ecieux conseils (et d´esol´ee pour les footing !). Merci `a vous aussi Pr. Mar´echal, nos ´echanges ont toujours ´et´e int´eressants.
Un particulier (et tr`es grand) merci `a St´ephane Puechmorel et Florence Nicol, chercheurs `a l’ENAC, sans qui cette th`ese aurait ´et´e bien diff´erente. Merci St´ephane d’avoir ´et´e l`a du d´ebut jusqu’`a la fin, d’avoir partag´e ton temps et tes id´ees avec moi, mais aussi d’avoir particip´e `a la r´edaction de la partie sur la g´eom´etrie de l’information. Merci Florence pour ton soutien, ta disponibilit´e, tes corrections et tes mots d’encouragement dans les moments les plus d´elicats.
Cette th`ese a ´et´e effectu´ee entre INSERM ToNIC et ENAC, je voudrais donc remercier Pr. Pierre Payoux et Pr. Patrick S´enac d’avoir accept´e de m’accueillir dans ces unit´es de recherche.
Je remercie tous mes amis de l’ENAC. Tout d’abord, `a Sana(2) pour les nombreuses et longues discussions. Cette derni`ere ann´ee aurait ´et´e bien triste sans toi. Merci `a mes amis de Chine : Maji, Shangrong, Ying, Victor et Bug ; grˆace `
a vous j’ai appris deux mots en chinois : xi´e xi´e et Wo ai ni, ce qui est parfait car c’est exactement ce que j’ai envie de vous dire. Je pense aussi `a Alex, Serge, Thuhuyen, Evgenii, Micha, Moctar, Alice, Isa, Vincent, Florian... Sans oublier Philippe et Gaby, je vous dois une fin de th`ese plus d´econtract´ee `a base de ”courtes” pauses et de blind-test. Merci `a vous tous, je vous souhaite le meilleur pour la suite !
Mes remerciements s’adressent ´egalement `a toute l’unit´e ToNIC. Merci pour les sourires et les encouragements. Une pens´ee `a Florent Aubry et Nicolas Chauveau, mes anciens encadrants de stage qui n’ont jamais h´esit´e `a m’aider durant la th`ese. Je tiens ´egalement `a remercier toutes les personnes qui ont contribu´e, d’une fac¸on ou d’une autre, `a la r´eussite de cette th`ese et `a rendre ce passage agr´eable.
Enfin, je remercie encore une fois le soutien inconditionnel de ma famille, plus particuli`erement ma m`ere, mon fr`ere Habib et ma meilleure amie Kana durant ces trois derni`eres ann´ees, mais aussi tout au long de mes ´etudes.
Introduction
13
I
Etat de l’art
´
17
1 Neuroimagerie : analyse d’images quantitatives 19
1.1 IRM et maladies neurod´eg´en´eratives . . . 19
1.1.1 Les modalit´es d’IRM . . . 20
1.1.2 L’IRM et la maladie d’Alzheimer. . . 27
1.1.3 L’IRM et la Scl´erose en plaques . . . 31
1.2 Les diff´erentes approches d’analyse d’images . . . 40
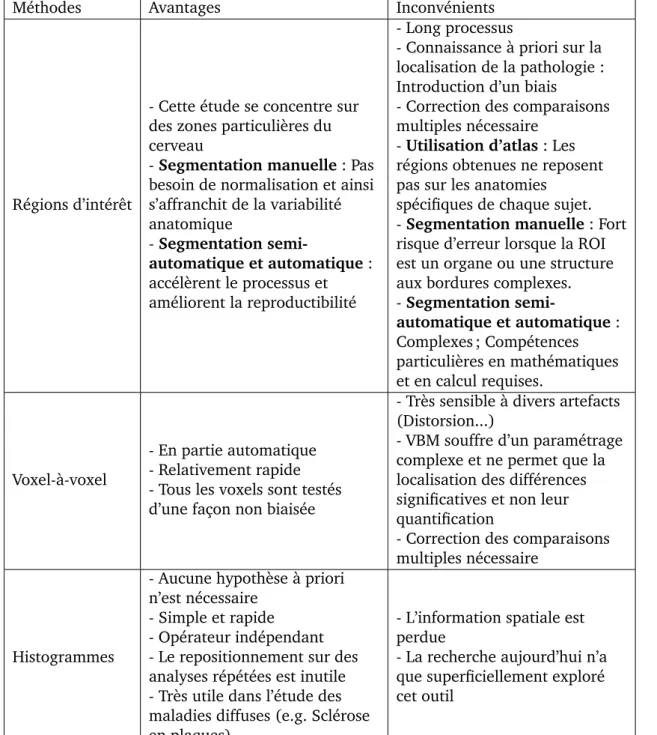
1.2.1 Analyse par r´egions d’int´erˆet . . . 40
1.2.2 Analyse voxel `a voxel . . . 42
1.2.3 Analyse d’histogrammes . . . 43
1.3 Analyse d’histogrammes en imagerie c´er´ebrale . . . 45
1.3.1 Production et analyse d’histogrammes . . . 45
1.3.2 Les applications cliniques . . . 49
2 A´eronautique : les retards dans le transport a´erien 55 2.1 D´efinition des retards : types et causes . . . 55
2.1.1 Notion de retard . . . 55
2.1.2 Les causes des retards . . . 56
2.2 Mesure et caract´erisation des retards . . . 57
2.2.1 Les retards moyens . . . 58
2.2.2 Mod´elisation des retards par des distributions . . . 58
II
Partie exp´
erimentale
61
3 Les m´etriques d’histogrammes 63 3.1 Description de l’approche . . . 633.1.1 Production d’histogrammes . . . 64
3.1.2 D´efinition des m´etriques d’histogrammes . . . 64
3.1.3 Classification bas´ee sur les m´etriques d’histogrammes . . . . 66
3.2 Application 1 : classification des populations de la maladie d’Alzheimer . . . 68
3.2.1 Mat´eriels et m´ethodes . . . 69
3.2.2 R´esultats . . . 81
3.2.3 Discussion . . . 84
3.3.1 Mat´eriels . . . 89
3.3.2 M´ethodes . . . 93
3.3.3 R´esultats . . . 96
3.3.4 Discussion et limites . . . 101
4 Distance entre histogrammes 103 4.1 Description de l’approche . . . 103
4.1.1 Contexte . . . 103
4.1.2 Notion de distance . . . 104
4.2 Application : classification de la population de Scl´erose en plaques 107 4.2.1 Mat´eriels et m´ethodes . . . 108
4.2.2 R´esultats . . . 111
4.2.3 Discussion . . . 112
5 Distribution de probabilit´e et g´eom´etrie de l’information 115 5.1 ´Etat de l’art sur la g´eom´etrie de l’information . . . 116
5.1.1 Contexte : Comparer deux distributions . . . 116
5.1.2 G´eom´etrie diff´erentielle . . . 121
5.2 Application 1 : classification de la population de la maladie d’Alzheimer . . . 127
5.2.1 Conception math´ematique . . . 127
5.2.2 Application aux donn´ees de la maladie d’Alzheimer . . . 134
5.3 Application 2 : caract´erisation des retards dans le transport a´erien . 141 5.3.1 Contexte . . . 141
5.3.2 Conception math´ematique . . . 142
5.3.3 Application : clustering des retards a´eroportuaires . . . 148
III
Discussion g´
en´
erale
153
R´
ef´
erences
157
Annexes
181
Contributions scientifiques
191
1.1 IRM pond´er´ees en T1 (avec ou sans gadolinium), T2 et FLAIR . . . 21
1.2 Imagerie de diffusion : DWI, ADC et FA . . . 23
1.3 Repr´esentation du tenseur de diffusion . . . 23
1.4 Principe du transfert d’aimantation . . . 25
1.5 Imagerie de transfert d’aimantation : La carte MTR . . . 25
1.6 La spectroscopie par r´esonance magn´etique - Spectre RMN . . . 26
1.7 Physiopathologie de la SEP . . . 32
1.8 Les diff´erentes formes cliniques de la SEP . . . 33
1.9 IRM conventionnelle en SEP (T1 avec et sans Gd, T1, T2 et FLAIR . 36 1.10 Spectroscopie par r´esonance magn´etique et scl´erose en plaques . . 39
1.11 Repr´esentation des diff´erentes approches d’analyses d’images quantitatives . . . 40
1.12 Histogramme MTR de la SGAN partiellement et totalement normalis´e 48 1.13 Histogrammes MTR des diff´erentes formes de la SEP . . . 51
1.14 Histogrammes de l’imagerie de diffusion (DM et FA) des patients atteints de SEP . . . 52
2.1 Les causes des retards par an, en pourcentage du nombre total de minutes de retard . . . 57
2.2 Mod´elisation des retards de d´epart en utilisant un mod`ele log-normal, gamma et Rayleigh (d’apr`es Novianingsih and Hadianti(2014)) . . . 59
3.1 Sch´ema r´esum´e de l’approche bas´ee sur les m´etriques d’histogrammes 64 3.2 Sch´ema repr´esentant les diff´erentes ´etape de pr´etraitement des volumes IRM . . . 72
3.3 Trois g´eom´etries possibles pour le ruban de substance grise dans le cerveau . . . 73
3.4 Surfaces ´equipotentielles entre S et S’. . . 74
3.5 Cartes d’´epaisseur corticale . . . 75
3.6 Anatomie des surfaces corticales : Gyri et sillons . . . 75
3.7 Surface corticale interne et externe . . . 76
3.8 Carte des courbures corticales . . . 77
3.9 Sch´ema des support vector machines . . . 79
3.10 Histogramme extraits des images param´etriques d’EC et de courbure corticale . . . 82
3.11 Plan d’exp´erience de l’´etude IRM ancillaire `a l’essai MS-SPI . . . 89
3.12 Les diff´erents biomarqueurs IRM utilis´es dans l’essai clinique MS-SPI 91 3.13 Boxplot `a M00, M12 et M24 de l’EC (mm), ADC, FA et MTR. . . 97
3.14 Le pourcentage de variance expliqu´ee pour chaque dimension . . . 98
3.15 Repr´esentation des individus - AFM . . . 99
3.16 Repr´esentation des groupes - AFM . . . 99
3.17 Dendrogramme clustering HCPC . . . 100
3.18 ´Evaluation du clustering HCPC . . . 100
4.1 Sch´ema r´esum´e de l’approche bas´ee sur les distances entre histogrammes. . . 108
4.2 Illustration de l’algorithme des k plus proches voisins . . . 110
4.3 Illustration de l’algorithme des k plus proches voisins bas´e sur les histogrammes . . . 110
5.1 Moyenne de gaussiennes : Comparaison de la distance euclidienne et la distance de Wasserstein . . . 117
5.2 Chemin de distributions : Comparaison de la distance euclidienne et la distance de Wasserstein . . . 118
5.3 L’exemple de la sph`ere. . . 119
5.4 Distributions normales univari´ees et leurs repr´esentations dans le demi-plan (µ; σ). . . 120
5.5 Surface plong´ee de dimension 2 . . . 121
5.6 Approche bas´ee sur la g´eom´etrie de l’information dans le cadre de la classification de la population Alzheimer. . . 134
5.7 Estimation de l’´epaisseur corticale moyenne par ROI . . . 138
5.8 Distribution des retards de d´epart d’un a´eroport selon trois mod`eles : Gamma, Weibull et exponentiel . . . 150
1.1 Description des s´equences IRM conventionnelles . . . 21
1.2 Les crit`eres 2017 de McDonald pour le diagnostic de la SEP . . . . 34
1.3 Les trois principales m´ethodes d’analyse d’images quantitatives . . 44
3.1 Comparaison des m´ethodes d’extraction de caract´eristiques et de s´election de caract´eristiques . . . 68
3.2 La population ADNI ´etudi´ee . . . 70
3.3 Les param`etres de l’acquisition MPRAGE . . . 71
3.4 Matrice de confusion . . . 81
3.5 R´esultats du test MANOVA sur les m´etriques des histogrammes . . 83
3.6 Les param`etres du noyau RBF pour chaque groupe de classification SVM . . . 84
3.7 R´esultats de la classification SVM de la population ADNI . . . 84
3.8 Performances de classification AD/HC de notre approche avec d’autres approches . . . 86
3.9 Performances de classification sMCI/pMCI de notre approche avec d’autres approches . . . 87
3.10 Performances de classification HC/pMCI de notre approche avec d’autres approches . . . 87
3.11 Performances de classification HC/sMCI de notre approche avec d’autres approches . . . 87
3.12 Performances de classification AD/pMCI de notre approche avec d’autres approches . . . 87
3.13 Performances de classification AD/sMCI de notre approche avec d’autres approches . . . 87
3.14 Information d´emographique de la population de notre ´etude . . . . 90
3.15 Param`etres d’acquisition des diff´erentes s´equences utilis´ees dans notre ´etude . . . 91
3.16 Les diff´erentes s´equences IRM utilis´ees dans notre ´etude et les biomarqueurs extraits . . . 91
3.17 Tableau repr´esentatif des donn´ees de notre ´etude sur l’essai MS-SPI 94 3.18 R´esultats de l’´evolution des biomarqueurs (%), en un an (M00→M12). . . 96
3.19 R´esultats de l’´evolution des biomarqueurs (%), en deux ans (M00→M24). . . 96
3.20 Coefficients RV entre les groupes et l’AFM . . . 100
4.1 Information d´emographique de la population de notre ´etude (approche 2) . . . 108
4.2 R´esultat de la classification des kNN bas´e sur les histogrammes . . 112 5.1 Caract´eristiques d´emographiques et cliniques de la population ´etudi´ee135 5.2 R´esultat du clustering k-m´edoides AD/HC suivant 4 sc´enarios
classiques. . . 141 5.3 R´esultat du clustering k-medoids bas´e sur les distributions suivant
diff´erents mod`eles et mesures de dissimilarit´e . . . 141 5.4 Premier r´esultat du clustering k-m´edoides des a´eroports . . . 151 5.5 Second r´esultat du clustering k-m´edoides des a´eroports . . . 151 5.6 Les variables optimales, s´electionner `a l’aide du gain d’information 183 5.7 Les formules de 45 diff´erentes mesures de dissimilarit´e . . . 186 5.8 D´efinition des 22 r´egions d’int´erˆet du cortex. Ces 22 ROI
correspondent `a 11 zones de l’h´emisph`ere droit (”R”) et les 11 zones correspondantes de l’h´emisph`ere gauche (”L”). . . 187 5.9 Les variables les plus discriminantes pour la classification AD/HC . 188
10CV 10-fold cross-validation
ACP Analyse en Composantes Principales
ADC Apparent Diffusion Coefficient
AD Alzheimer’s disease
BTS Bureau of Transportation Statistics
CIS Clinically isolated syndrome
DKL Divergence de Kullback-Leibler
DM Diffusivit´e moyenne
DWI Diffusion Weighted Imaging
EC Epaisseur corticale´
EVP Effet de Volume Partiel
FAA Federal Aviation Administration
FA Fraction d’Anisotropie
FLAIR Fluid Attenuated Inversion Recovery
Gd Gadolinium
GI Gain d’information
Gyrext Courbure corticale externe au niveau des gyri
GyrInt Courbure corticale interne au niveau des gyri
H-kNN K-plus proches voisins bas´e sur les histogrammes
IRMq Imagerie par R´esonance Magn´etique quantitative
IRM Imagerie par R´esonance Magn´etique
kNN K plus proches voisins
MA Maladie d’Alzheimer
MCI Mild Cognitive Impairment
MRS Magnetic Resonance Spectroscopy
MTI Magnetization Transfer Imaging
MTR Ratio de transfert d’aimantation
NABT Normal Appearing Brain Tissue
PD Densit´e de Protons
pMCI Progressive Mild Cognitive Impairment
RBF Radial basis function
ROI R´egion d’int´erˆet
SBAN Substance Blanche d’Apparence Normale
SB Substance Blanche
SCI Syndrome cliniquement isol´e
SEP-PP Scl´erose en plaques progressive primaire
SEP-RR Scl´erose en plaques r´emittente-r´ecurrente
SEP-SP Scl´erose en plaques secondairement progressive
SEP Scl´erose en plaques
SGAN Substance Grise d’Apparence Normale
SG Substance Grise
SilExt Courbure corticale externe au niveau des sillons
SilInt Courbure corticale interne au niveau des sillons
sMCI Stable Mild Cognitive Impairment
sMRI Structural Magnetic Resonance Imaging
SNC Syst`eme nerveux central
SPP Scl´erose en plaques progressive
TEP Tomographie par ´emission de positons
TE Temps d’´echo
Contexte
En neuroimagerie, l’IRM est un des outils les plus informatifs concernant la prise en charge de patients atteints de troubles neurologiques telles que la maladie d’Alzheimer et la scl´erose en plaques, tant pour le diagnostic, le pronostic, le suivi et l’´evaluation de la r´eponse `a un traitement. Afin d’exploiter les images provenant d’IRM et d’en extraire de pr´ecieuses informations, plusieurs m´ethodes d’analyse d’images quantitatives ont ´et´e d´evelopp´ees. Parmi ces derni`eres, on retrouve l’analyse par r´egions d’int´erˆet et l’analyse voxel `a voxel. Le principe est de mesurer un param`etre IRM dans une zone sp´ecifique du cerveau ou dans la plus petite entit´e de l’image, le voxel, puis d’effectuer des tests statistiques entre deux groupes de sujets distincts. La statistique utilis´ee pour d´ecrire le param`etre IRM est majoritairement la moyenne. Toutefois, d’autres ´etudes ont constat´e la limite de cette statistique et ont propos´e une autre approche d’analyse d’images, l’analyse d’histogrammes, qui est tout particuli`erement utilis´ee dans l’´etude de maladies marqu´ees par des modifications diffuses, telle que la scl´erose en plaques. Apr`es avoir extrait les histogrammes des images quantitatives, des mesures locales sont d´eriv´ees de ces histogrammes telles que la moyenne, la m´ediane, les quantiles, skewness... Mais, il s’agit encore de r´esum´es et toute l’information incluse dans le biomarqueur n’est pas exploit´ee.
De plus, nous faisons l’analogie avec l’a´eronautique dans le cadre de l’´etude des retards. Les retards des vols sur les plates-formes a´eroportuaires repr´esentent un indicateur de performance particuli`erement important et contribuent de mani`ere significative `a la perception du fonctionnement de l’ensemble du syst`eme par les voyageurs. L’analyse actuellement r´ealis´ee se situe au niveau macroscopique et fournit un indicateur de retard moyen, sans tenir compte des m´ecanismes interm´ediaires pouvant conduire au retard final. De plus, les retards observ´es sont souvent la cons´equence d’un retard de vols pr´ec´edents, qui a conduit `a d´efinir la notion de multiplicateur de retard, indicateur de la tendance `
a la propagation des retards. Aucun de ces outils d’analyse n’est pleinement satisfaisant et n´ecessite d’ˆetre plus pr´ecis pour permettre une r´eelle orientation sur les moyens de r´eduire ces retards. Ainsi, dans cette th`ese, l’id´ee est de remplacer les statistiques agr´eg´ees telle que la moyenne par un mod`ele statistique param´etrique plus complet : les distributions de probabilit´e. Ainsi, que cela soit dans le contexte de neuroimagerie ou pour ´etudier des retards de vol, l’utilisation d’estimateur comme la moyenne et l’´ecart type pour r´esumer les distributions ne parviendra pas `a caract´eriser le degr´e d’interd´ependance des retards de vol ou l’´etendue des dommages sous-jacents dans le cadre des maladies neurologiques.
Contributions
Dans ce travail de th`ese nous proposons diff´erentes mani`eres de prendre en compte toute l’information incluse dans un marqueur `a travers sa distribution et non uniquement une mesure de tendance centrale. Ainsi, les principales contributions de cette th`ese sont :
— Mettre en avant l’utilisation des distributions `a travers deux approches non-param´etriques et une approche param´etrique.
— Proposer, d´evelopper et appliquer les outils de la g´eom´etrie de l’information dans le cadre de l’imagerie m´edicale et de l’a´eronautique.
Ce travail a ainsi permis de :
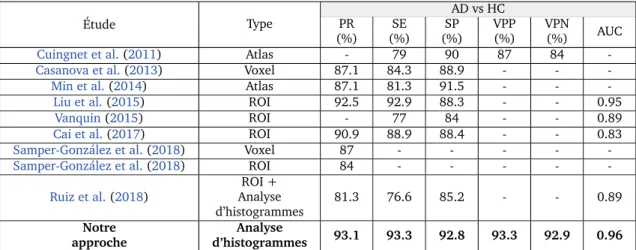
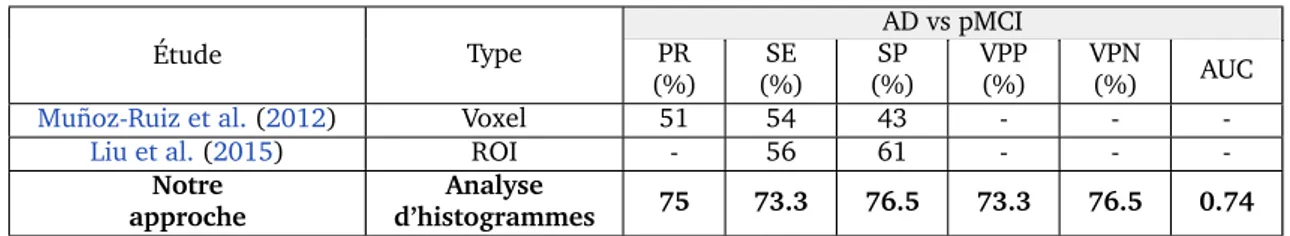
→ Classer les populations de la maladie d’Alzheimer d’une fac¸on plus pr´ecise, obtenant une pr´ecision de 93.1%, en se basant sur l’utilisation les r´esum´es des histogrammes de param`etres IRM (Rebbah et al.,2018b).
→ Am´eliorer la classification des populations de scl´erose en plaques suite `a l’utilisation de diverses mesures de dissimilarit´e entre les histogrammes dans leur globalit´e et non entre les m´etriques de ces derniers (Rebbah et al.,
2019a).
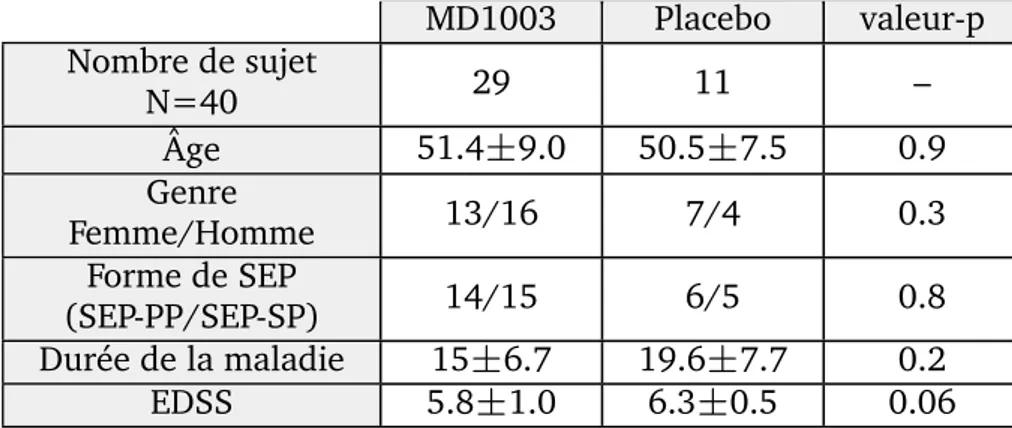
→ Mettre en avant la possibilit´e de s’affranchir de toutes les variations individuelles des sujets et de d´eceler l’effet (ou l’absence d’effet) d’un m´edicament dans un essai th´erapeutique (Rebbah et al.,2018a).
→ Proposer et d´evelopper les outils de la g´eom´etrie diff´erentielle qui sont plus naturels dans le cadre de l’utilisation des distributions de probabilit´e. En effet, l’histogramme n’est qu’une estimation trop grossi`ere d’une distribution de probabilit´e. Ces outils ont permis de :
⇒ Am´eliorer les performances de classification des populations de la maladie d’Alzheimer en mod´elisant les distributions d’´epaisseur corticale par des lois gamma g´en´eralis´ees et en mesurant des distances g´eod´esiques entre elles (Rebbah et al.,2019b).
⇒ Mieux caract´eriser les retards a´eroportuaires en les mod´elisant par des loi gamma et en mesurant des distances g´eod´esiques entre elles.
Plan
Ce manuscrit s’organise en trois grandes parties qui pr´esentent respectivement un ´etat de l’art, nos contributions dans ce domaine et enfin une partie discussion. - La premi`ere grande partie regroupe deux chapitres qui ont pour rˆole d’introduire le travail de th`ese dans le contexte scientifique international. ´Etant donn´e que la th`ese a ´et´e effectu´ee entre l’INSERM et l’´Ecole Nationale de l’Aviation Civile, nous proposons un chapitre pour chaque domaine : la neuroimagerie et l’a´eronautique. Le premier chapitre pr´esente un ´etat de l’art sur les diff´erentes analyses d’images quantitatives utilis´ees, avec les d´etails de l’analyse d’histogrammes en imagerie c´er´ebrale, tout en reprenant les notions concernant l’IRM et les maladies neurod´eg´eratives. Le second chapitre a pour objectif d’exposer un bref ´etat de l’art des retards dans le transport a´erien. Nous pr´esentons les causes de ces retards et la mani`ere dans laquelle ces derniers sont repr´esent´es et mesur´es dans la litt´erature.
- La deuxi`eme partie est consacr´ee aux travaux r´ealis´es au cours de cette th`ese. On y retrouve trois chapitres : Les deux premiers proposent une approche
non-param´etrique et le troisi`eme une approche param´etrique.
Le premier chapitre propose d’extraire des m´etriques des histogrammes des images param´etriques et de les int´egrer dans des classifieurs afin de d’identifier diff´erents groupes de patients. Deux applications sont propos´ees. La premi`ere porte sur la classification des patients atteints de troubles cognitifs l´egers et les patients atteints de la maladie d’Alzheimer. La deuxi`eme sur un essai clinique de scl´erose en plaques utilisant diff´erentes modalit´es IRM.
Le second chapitre propose d’utiliser la totalit´e de l’information incluse dans les histogrammes en mesurant diff´erentes distances entre ces derniers dans le cadre de la classification de la population de scl´erose en plaques.
Le dernier chapitre pr´esente l’approche param´etrique qui consiste `a prendre en compte la distribution de probabilit´e et non une estimation tel que l’histogramme et cela en utilisant les outils de la g´eom´etrie de l’information. Nous exposons tout d’abord un ´etat de l’art sur la g´eom´etrie non-euclidienne. Puis, nous proposons deux applications : la classification de la population Alzheimer et la caract´erisation des retards dans le transport a´erien.
- La derni`ere partie correspond `a la discussion g´en´erale qui rappelle les principaux r´esultats apport´es par ce travail de th`ese, en pr´esentant les limites et les perspectives associ´ees.
´
Neuroimagerie : analyse d’images
quantitatives
Sommaire
1.1 IRM et maladies neurod´eg´en´eratives . . . . 19
1.1.1 Les modalit´es d’IRM . . . 20
1.1.2 L’IRM et la maladie d’Alzheimer. . . 27
1.1.3 L’IRM et la Scl´erose en plaques . . . 31
1.2 Les diff´erentes approches d’analyse d’images . . . . 40
1.2.1 Analyse par r´egions d’int´erˆet . . . 40
1.2.2 Analyse voxel `a voxel . . . 42
1.2.3 Analyse d’histogrammes . . . 43
1.3 Analyse d’histogrammes en imagerie c´er´ebrale . . . . 45
1.3.1 Production et analyse d’histogrammes . . . 45
1.3.2 Les applications cliniques . . . 49
1.1
IRM et maladies neurod´
eg´
en´
eratives
L’imagerie par r´esonance magn´etique (IRM) est devenue l’une des techniques d’imagerie les plus utilis´ees en recherche et en clinique. Elle est le premier choix pour imager morphologiquement le cerveau humain car elle est non-invasive et offre des images d’une r´esolution spatiale et temporelle relativement ´elev´ee. Le principal avantage de l’IRM par rapport `a d’autres techniques d’imagerie telle que la tomographie par ´emission de positons (TEP) est sa tr`es haute r´esolution spatiale in vivo, qui permet d’obtenir des informations anatomiques pr´ecises et claires. D’autre part, les champs magn´etiques et les ondes ´electromagn´etiques de basse ´energie sont utilis´es `a la place des rayonnements ionisants, ainsi aucun dommage biologique n’est caus´e. Un autre avantage important est que l’IRM permet des ´etudes longitudinales, car elle ne repose pas sur l’utilisation d’isotopes radioactifs, ni de rayons X.
La pr´evalence des maladies neurod´eg´en´eratives augmente du fait de l’augmentation du vieillissement de la population (Brayne and Miller, 2017), toutefois les m´ecanismes physiopathologiques `a l’origine de ces maladies restent
obscurs. D’autres atteintes c´er´ebrales telles que la scl´erose en plaques surviennent plus pr´ecocement mais pr´esentent des similarit´es morphologiques permettant d’en ´etudier le retentissement anatomique par les mˆemes techniques
Cette partie r´esume la traduction sur l’imagerie de signes de neurod´eg´en´erescence communs ou sp´ecifiques `a la scl´erose en plaques et `a la maladie d’Alzheimer, et fournit un bref aperc¸u des techniques d’IRM utilis´ees pour ´etudier et suivre ces modifications morphologiques.
1.1.1
Les modalit´
es d’IRM
Cette section pr´esente bri`evement les plus importantes modalit´es d’IRM, conventionnelles et non conventionnelles, appliqu´ees dans le domaine de l’imagerie c´er´ebrale.
1.1.1.1 IRM conventionnelle : T1, T2 et FLAIR
`
A ce jour, la majorit´e des images en clinique repose sur l’acquisition et l’interpr´etation du temps de relaxation (T1 et T2), dont le contraste d´epend des propri´et´es intrins`eques du tissu ; sur le type d’acquisition (s´equence d’imagerie et param`etres d’acquisition) et sur des facteurs mat´eriels (g´eom´etrie de la bobine du r´ecepteur radiofr´equence (RF), sensibilit´e, positionnement du patient, chargement et gains de l’amplificateur de signal ´electronique).
Les images pond´er´ees en T1 sont produites en utilisant des temps TE (temps d’´echo) et TR (temps de r´ep´etition) courts en s´equence d’´echo de spin. Le contraste de l’image est principalement d´etermin´e par les propri´et´es T1 du tissu. Inversement, les images pond´er´ees en T2 sont produites en utilisant des temps TE et TR plus longs. Dans ces images, le contraste est principalement d´etermin´e par les propri´et´es T2 du tissu. En g´en´eral, les images pond´er´ees en T1 et en T2 peuvent ˆetre facilement diff´erenci´ees en regardant le liquide c´er´ebro-spinal (LCS). Le LCS est sombre (hyposignal) pour les images pond´er´ees en T1 et clair (hypersignal) pour les images pond´er´ees en T2 (figure 1.1).
L’IRM pond´er´ee en T1 peut ´egalement ˆetre r´ealis´ee en injectant du gadolinium (Gd) (figure 1.1). Le Gd est un agent de contraste paramagn´etique non toxique. Lorsqu’il est inject´e, il modifie l’intensit´e du signal en raccourcissant le temps de relaxation longitudinal T1 et transversal T2. Ainsi, le Gd produit un hypersignal sur les images pond´er´ees en T1. Les images am´elior´ees par le Gd sont particuli`erement utiles pour examiner les structures vasculaires et la d´egradation de la barri`ere h´emato-enc´ephalique (e.g. tumeurs, abc`es, inflammation en scl´erose en plaques...).
Une troisi`eme s´equence couramment utilis´ee est la s´equence FLAIR (Fluid Attenuated Inversion Recovery). La s´equence FLAIR (figure 1.1) est bas´ee sur la technique d’inversion-r´ecup´eration. Elle est similaire `a une image pond´er´ee en T2, `a la diff´erence que l’on introduit un temps d’inversion TI annulant le signal du fait de son long T1. Ainsi, les anomalies restent en hypersignal mais le LCS est att´enu´e et apparaˆıt sombre sur l’image (hyposignal). Cette s´equence est tr`es sensible `a la pathologie et facilite la diff´erenciation entre le LCS et les anomalies (e.g. les l´esions de la scl´erose en plaques).
FIGURE1.1 – Des IRM pond´er´ees en T1 (avec et sans gadolinium), T2 et FLAIR (d’apr`esPreston(2011), modifi´e)
S´equences IRM Temps de r´ep´etition (TR en ms) Temps d’´echo (TE en ms) Description T1 500 14 SB : clair SG : gris LCS : sombre Graisse : tr`es clair L´esions : sombre T2 4000 90 SB : gris fonc´e SG : gris clair LCS : tr`es clair Graisse : clair L´esions : tr`es clair
FLAIR 9000 114
SB : gris fonc´e SG : gris clair LCS : sombre Graisse : clair L´esions : tr`es clair
Tableau 1.1 – Les s´equences d’IRM les plus courantes, leurs temps TR et TE approximatives et description de l’image
1.1.1.2 IRM non conventionnelle
Ces vingt derni`eres ann´ees, diff´erentes techniques d’imagerie en IRM ont ´et´e d´evelopp´ees et appliqu´ees pour trouver de nouveaux marqueurs IRM, qui seraient plus proches des ph´enom`enes physiopathologiques de la maladie et cela soit en s’int´eressant aux mouvements des mol´ecules d’eau (imagerie de diffusion), soit `a l’organisation architecturale mol´eculaire (imagerie de transfert d’aimantation), soit par les modifications biochimiques (imagerie spectroscopique). Toutefois, ces m´ethodes ne sont pas recommand´ees en pratique clinique courante car elles n´ecessitent des protocoles d’acquisition IRM plus complexes et plus longs en termes de temps machine, et des proc´edures de post-traitements d´edi´es.
1.1.1.2.1 Imagerie de diffusion
La premi`ere image de diffusion chez l’homme a ´et´e r´ealis´ee par Le Bihan and Breton en 1985. Cette s´equence apporte des information non disponibles avec les s´equences d’IRM traditionnelles ou morphologiques. Elle permet d’´evaluer le mouvement des mol´ecules d’eau qui peut ˆetre modifi´e en cas de processus pathologique.
Le ph´enom`ene de diffusion refl`ete le mouvement al´eatoire des mol´ecules d’eau, appel´e mouvement brownien. Au sein des tissus biologiques, le mouvement de l’eau est dirig´e suivant l’architecture tissulaire qui l’entoure. En effet, au niveau du LCS, la diffusion est importante et isotrope (i.e. identique
dans toutes les directions), alors qu’au niveau de la substance blanche (SB) elle est faible et anisotrope (i.e. pr´ef´erentielle dans une direction donn´ee). La diffusion de l’eau dans les fibres de la SB est privil´egi´ee parall`element aux fibres (D//) et restreinte perpendiculairement aux fibres (D⊥).
— DWI et ADC
L’acquisition d’une image pond´er´ee en diffusion (DWI1) se fait `a l’aide d’une
image sans gradient (b2=0), c’est `a dire pond´er´ee en T2, not´ee S
0 et d’autant
d’images de gradient de diffusion (b>0, not´ees Si) que de directions
d’acquisition. Le premier gradient introduit le d´ephasage des protons en fonction de leur position, tandis que le second gradient inverse les modifications apport´ees par le premier gradient. S’il y a des mouvements de protons, le second gradient ne pourra pas annuler compl`etement les changements induits par le premier gradient. En cons´equence, il y aura une att´enuation du signal. Cette perte de signal due au mouvement des particules est donn´ee par l’´equation deStejskal and Tanner:
Si = S0e−b.ADCi (1.1)
o`u b repr´esente le facteur de pond´eration en diffusion (sec/mm2). La pond´eration en diffusion de la s´equence utilis´ee d´epend de la performance des gradients. Plus b est ´elev´e, plus la s´equence est pond´er´ee en diffusion, mais plus le rapport signal sur bruit sera faible,
ADCi est le coefficient de diffusion apparent suivant la direction i. Il
repr´esente le degr´e de mobilit´e des mol´ecules d’eau. Ainsi : ADCi = 1 b log S0 Si (1.2)
Les cartes3 ADC (figure 1.2-b) sont d´eriv´ees d’au moins deux images DWI en
utilisant l’´equation de Stejskal-Tanner. Si la mobilit´e des mol´ecules d’eau dans un tissu est faible, l’ADC diminue ce qui est repr´esent´e en hypersignal sur DWI et en hyposignal sur la carte ADC (figure 1.2 a et b) et au contraire si l’ADC augmente cela signifie qu’il y a une forte mobilit´e des mol´ecules d’eau dans le tissu (hyposignal sur DWI et hypersignal sur la carte ADC).
— Tenseur de diffusion `
A partir des cartes ADC, un tenseur de diffusion DTI (Diffusion Tensor Imaging) peut ˆetre calcul´e pour chaque voxel de l’image. Il est repr´esent´e graphiquement par une ellipso¨ıde (figure 1.3). Il correspond `a une matrice D sym´etrique (3x3) : D = Dxx Dxy Dxz Dyx Dyy Dyz Dzx Dzy Dzz (1.3)
1. DWI signifie ”Diffusion Weighted Imaging”
2. b est le facteur de pond´eration en diffusion. Il d´epend de l’amplitude du gradient, de la dur´ee d’application et du temps entre les deux impulsions de gradient.
FIGURE1.2 – Imagerie de diffusion. (a) IRM de diffusion DWI, (b) carte du coefficient apparent de diffusion (ADC), Carte de la fraction d’anisotropie (FA), d’apr`esMRIMASTER
Les trois ´el´ements diagonaux (Dxx, Dyy, Dzz) repr´esentent les coefficients de diffusion mesur´es le long de chacun des principaux axes (x, y et z). Les six termes non diagonaux (Dxy, Dyz, etc.) refl`etent la corr´elation des mouvements al´eatoires entre chaque paire de directions principales.
La technique consiste `a appliquer successivement des gradients de diffusion dans au moins six directions non-colin´eaires, pour calculer les coefficients de diffusion correspondants `a chacune de ces directions. La matrice du tenseur de diffusion est diagonalisable puisqu’elle est sym´etrique et d´efinie positive :
D = Dxx Dxy Dxz . Dyy Dyz . . Dzz = ǫ1x ǫ2x ǫ3x ǫ1y ǫ2y ǫ3y ǫ1z ǫ2z ǫ3z T λ1 0 0 0 λ2 0 0 0 λ3 ǫ1x ǫ1y ǫ1z ǫ2x ǫ2y ǫ2z ǫ3x ǫ3y ǫ3z (1.4) Le tenseur est d´ecompos´e en valeurs propres λ1, λ2 et λ3 et en vecteurs
propres ǫ1, ǫ2 et ǫ3. Les valeurs propres sont class´ees dans l’ordre d´ecroissant
(λ1>λ2>λ3) et donc ǫ1est repr´esentatif de la direction principale de diffusion
(i.e. la direction des fibres).
FIGURE1.3 – Repr´esentation du tenseur de diffusion (d’apr`es (Poupon,1999), modifi´e
— Les indices du tenseur de diffusion `
A partir des donn´ees obtenues, on peut calculer et visualiser les diff´erents indices refl´etant l’amplitude moyenne de la diffusion (DM), le degr´e d’anisotropie (FA), ou encore la direction de la diffusion maximale au sein de
chaque voxel (tractographie).
-La diffusivit´e moyenne : La DM permet de quantifier l’amplitude moyenne des mouvements de diffusion. Elle indique si la diffusion est globalement (suivant toutes les directions d’acquisition) importante (DM ´elev´ee) ou restreinte (DM proche de 0)
DM = λ1+ λ2+ λ3
3 (1.5)
-Fraction d’anisotropie : La FA caract´erise le manque d’uniformit´e du ph´enom`ene de diffusion dans les diff´erentes directions de l’espace. Une anisotropie proche de 1 signifie que la diffusion est privil´egi´ee dans une direction et une anisotropie proche de 0 signifie que la diffusion est la mˆeme dans toutes les directions (i.e. un manque total d’orientation). Les faisceaux de fibres de substance blanche apparaissent ainsi en hypersignal sur la carte FA (figure1.2-c). F A = s (λ1− λ2)2+ (λ1− λ3)2+ (λ3− λ2)2 2(λ2 1+ λ22+ λ23) (1.6) - Diffusion axiale : D// repr´esente la diffusion suivant l’axe principal de
diffusion. D// = λ1
- Diffusion radiale : D⊥ repr´esente la diffusion perpendiculaire `a l’axe principal de diffusion. D⊥ = λ2+λ3
2
1.1.1.2.2 Imagerie de transfert d’aimantation
L’imagerie de transfert d’aimantation (MTI4), initialement propos´ee parWolff
and Balaban en 1989, a ´et´e largement utilis´ee pour ´etudier la microstructure tissulaire dans le cerveau. Le transfert d’aimantation offre des avantages qui se sont r´ev´el´es utiles dans l’´etude des troubles de la substance blanche, le d´eveloppement du cerveau, le vieillissement et les maladies neurod´eg´en´eratives.
Le signal IRM provient pour la plus grande part des protons des mol´ecules d’eau libre. Il existe ´egalement de l’eau li´ee aux macromol´ecules (prot´eines, membranes, my´eline) mais le signal de leurs protons n’est pas significatif car leur T2 est tr`es court. La technique de transfert d’aimantation est bas´ee sur la
quantification indirecte de changement d’´etats entre ces protons (Hoa,2007). Une onde de radiofr´equence s´elective (MT-pulse) est appliqu´ee5 afin de saturer
les protons li´es. Les ´echanges permanents entre eau libre et eau li´ee aux macromol´ecules, entraˆınent un transfert de la saturation des protons li´es vers les protons libres. On observe donc une r´eduction du signal IRM (figure 1.4). Cette baisse relative du signal IRM est quantifi´ee par le taux de transfert d’aimantation MTR6(figure1.5) :
M T R = M0− MS
M0 × 100
(1.7)
4. ”Magnetization Transfer Imaging” en anglais
5. L’onde RF est d´ecal´ee par rapport `a la fr´equence de r´esonance des protons libres. Environ
1500 Hz (1 `a 2 kilohertz)
avec M0 repr´esente, pour chaque voxel, l’intensit´e du signal sans MT-pulse, Ms
avec MT-pulse.
FIGURE1.4 – Principe du transfert d’aimantation, d’apr`esPinson(2015).
FIGURE1.5 – Exemple d’application de l’imagerie de transfert d’aimantation, avant l’application de l’impulsion de saturation (M0) et apr`es impulsion (Ms). La cartographie du ratio de transfert d’aimantation (MTR) correspondante est
alors calcul´ee (image de droite), d’apr`esFilippi et al.(2017), modifi´e.
en raison d’une capacit´e r´eduite des macromol´ecules `a ´echanger une aimantation avec les mol´ecules d’eau environnantes. En cons´equence, cet indice fournit une estimation de l’´etendue de la perturbation tissulaire de la SEP, et le MTR est modifi´e lorsque la my´eline ou d’autres structures cellulaires (par exemple, les neurones) sont endommag´ees. La my´eline influe fortement sur la MTR, mais elle peut ´egalement ˆetre influenc´ee par l’inflammation et la densit´e axonale.
Le MTR est consid´er´e comme un marqueur de l’abondance de la my´eline dans le cerveau. Des augmentations ou diminutions significatives du transfert d’aimantation au cours du temps peut donc ˆetre utilis´e pour mesurer les processus de remy´elinisation et de d´emy´elinisation (Chen et al.,2008).
1.1.1.2.3 La spectroscopie par r´esonance magn´etique
La spectroscopie par r´esonance magn´etique (MRS7) est une technique
d’imagerie permettant une ´etude du m´etabolisme c´er´ebral. Son concept repose sur la d´etection de m´etabolites c´er´ebraux, et l’´etude des variations de leur concentration pour caract´eriser diff´erentes pathologies. En pathologie c´er´ebrale, on utilise essentiellement la spectroscopie du proton car on le retrouve en concentration importante dans le cerveau. Le signal RMN des protons alors obtenu fourni des renseignements sur les concentrations d’un certain nombre de m´etabolites ˙Les principaux m´etabolites d´etectables sont :
FIGURE1.6 – Informations m´etaboliques obtenues `a partir d’un spectre RMN du proton c´er´ebral in vivo (source :
http://hirnforschung.kyb.mpg.de/en/methods/mrs.html)
- Le N-Ac´etyl-Aspartate (NAA), marqueur de l’int´egrit´e ou du fonctionnement axonal. Il diminue en cas de mort neuronales ;
- La Choline (Cho), marqueur du m´etabolisme phospholipidique et de la densit´e cellulaire. Elle augmente en cas d’inflammation ;
- La Cr´eatine (Cr), marqueur du m´etabolisme ´energique cellulaire ; - Le Myoinositol (Ins), marqueur de l’inflammation et de la gliose ; - Le Glutamate (Glu), neurotransmetteur, indicateur de neurotoxicit´e ;
- Le Lactate (Lac), indicateur de souffrance cellulaire li´ee `a une isch´emie, une hypoxie ou une r´eaction inflammatoire.
Pour plus de d´etails concernant les diff´erentes modalit´es d’IRM, voir les ouvrages deHoa(2007) et Filippi(2015).
1.1.2
L’IRM et la maladie d’Alzheimer
1.1.2.1 G´en´eralit´es sur la maladie d’Alzheimer
La maladie d’Alzheimer (MA), initialement d´ecrite parAlzheimeren 1906, est une maladie neurod´eg´en´erative qui est la cause la plus commune de d´emence chez les personnes ˆag´ees. Elle affecte le fonctionnement du syst`eme nerveux central par des dysfonctionnements g´en´etiques ou m´etaboliques conduisant notamment `a la mort de neurones. Cette d´eg´en´erescence du cortex c´er´ebral s’aggrave au cours du temps entraˆınant une alt´eration progressive des capacit´es cognitives. Au d´epart, la MA se manifeste par un d´eficit de la m´emoire ´episodique indiquant une atteinte des structures temporales internes (Hodges, 2006), particuli`erement dans la r´egion du cerveau correspondant au si`ege de la m´emoire `
a court terme, l’hippocampe. L’´evolution de la maladie voit le processus neurod´eg´en´eratif s’´etendre `a d’autres aires corticales entraˆınant secondairement une atteinte du langage et des fonctions instrumentales, des fonctions ex´ecutives et des fonctions visio-spatiales, allant jusqu’`a la perte d’autonomie qui signe le stade de la d´emence (Ballard et al.,2011).
1.1.2.1.1 Les diff´erents stades d’´evolution de la maladie
La MA est caract´eris´ee par une alt´eration progressive des capacit´es cognitives au cours de laquelle l’individu passe de sujet sain (vieillissement normal) vers la forme d´ementielle de la MA (MA probable) en passant par une phase de transition incluant des troubles cognitifs l´egers (stade MCI pour Mild Cognitive Imparaiment) :
- Stade MCI (trouble cognitif l´eger) : La notion de MCI a ´et´e introduite en 1999 parPetersen et al.. Elle correspond `a la phase de transition entre le vieillissement normal et la d´emence car ces troubles sont suffisamment limit´es pour ne pas impacter de fac¸on significative la vie quotidienne des sujets. Tous les patients MCI ne convertissent pas vers la MA. Selon les cas, ils ´evoluent vers d’autres maladies ou restent stables.
- Stade MA probable : Pour qu’un patient soit d´eclar´e atteint d’une d´emence de type Alzheimer, ou MA probable, il faut qu’il pr´esente un d´eclin progressif et continu de ses capacit´es cognitives et qu’il pr´esente des d´eficits dans au moins deux de ces domaines : alt´eration de la m´emoire, aphasie, apraxie, agnosie, alt´eration des fonctions ex´ecutives.
1.1.2.1.2 Diagnostic et biomarqueurs
Les ´etudes post-mortem (Alzheimer,1906;Grignon et al.,1998) sur des sujets Alzheimer ont mis en ´evidence les deux types de l´esions c´er´ebrales causant la perte neuronale et la d´egradation des facult´es cognitives : la d´eg´en´erescence neurofibrillaire (DNF) et les amas anormaux de fibrilles dans les neurones (plaques amylo¨ıdes). Le diagnostic certain de la maladie d’Alzheimer ne peut ˆetre pos´e que post-mortem `a partir d’une analyse histopathologique du cerveau r´ev´elant les deux types de l´esions caract´eristiques de la MA.
— Les crit`eres du NINCDS-ADRDA8
Ces crit`eres (McKhann et al., 1984, 2011) permettent de poser un diagnostic probable de la maladie. Ils s’appuient sur des tests cliniques et neuropsychologiques. Toutefois, ces crit`eres poss`edent des limites, en effet le ph´enom`ene de ”r´eserve cognitive” (Stern, 2002) vient perturber le lien entre perte neuronale et alt´eration cognitive car le cerveau de certains sujets, g´en´eralement ceux qui ont le plus haut niveau socioculturel, a la capacit´e de maintenir un fonctionnement normal malgr´e un certain nombre de d´eficits structurels.
— Les biomarqueurs de la MA
On distingue, parmi les principaux biomarqueurs de la maladie (d’apr`esVanquin,
2015) :
- Les biomarqueurs biologiques : d´etect´es notamment dans le LCS, ils sont principalement les concentrations en prot´eines A42 et prot´eines Tau (Strozyk et al.,2003).
- Les biomarqueurs de l’imagerie :
-Les biomarqueurs des plaques amylo¨ıdes, en imagerie TEP ;
-Les biomarqueurs anatomiques et microstructurels : principalement des biomarqueurs issus de l’IRM pond´er´ee en T1, en T2 et en diffusion. Les biomarqueurs anatomiques donnent des informations quantitatives sur le volume des r´egions, leur ´epaisseur, leurs caract´eristiques morphologiques ou leur composition ou, dans le cas du biomarqueur microstructurel, des informations quantitatives sur l’architecture fine du tissu neuronal ou sur l’int´egrit´e du tissu `a une ´echelle microscopique ;
-Les biomarqueurs fonctionnels ; li´es `a l’activit´e c´er´ebrale, ils sont notamment bas´es sur des variations de flux sanguin ; ce sont principalement des biomarqueurs issus de la TEP et de l’IRM fonctionnelle et de perfusion.
1.1.2.1.3 IRM structurelle et la maladie d’Alzheimer
La MA entraˆıne une perte neuronale que la neuroimagerie anatomique par IRM est capable de d´eceler et de mesurer indirectement en estimant l’atrophie induite par la MA (Juottonen et al., 1999; Bobinski et al., 2000). Ainsi, la mesure de l’atrophie c´er´ebrale serait un marqueur potentiel d’´evolution depuis le stade MCI vers une MA. De plus, d’apr`es Smith (2002) les d´eficits cognitifs sont plus li´es `a
8. Les crit`eres du ”National Institute of Neurological and Communicative Diseases and
la perte de neurones qu’`a la formation de DNF ou au d´epˆot de plaques amylo¨ıdes. En effet, il semblerait que le nombre de neurones morts est bien plus ´elev´e que le nombre de ceux qui contiennent des DNF (Killiany et al., 2002). De ce fait, la perte neuronale serait un meilleur marqueur de la pathologie que les techniques de mesure directe des DNF, par ailleurs plus coˆuteuses et moins accessibles (Mueller et al.,2006).
L’IRM structurelle (sMRI9) est importante pour le diagnostic diff´erentiel de la
MA en raison de sa capacit´e `a visualiser des profils d’atrophie sp´ecifiques dans le cerveau. Nous consid´erons ainsi que les biomarqueurs tels que, l’´epaisseur corticale et la courbure corticale pr´esenteraient un bon reflet des d´eficits cognitifs. L’application de sMRI a r´ev´el´e un sch´ema sp´ecifique d’amincissement cortical chez les adultes plus ˆag´es qui semble ˆetre associ´e `a la MA. Ce mod`ele, connu sous le nom de ”signature” corticale de la MA (Dickerson et al., 2009a), comprend les r´egions m´ediales, inf´erieures et les zones du lobe temporal ; le gyrus angulaire ; le lobe frontal sup´erieur et inf´erieur ; le lobule pari´etal sup´erieur ; le gyrus supramarginal ; et le precuneus. Dans ces zones, l’amincissement est important chez les patients MA (Braak and Braak, 1991;
Lerch and Evans, 2005) et chez les sujets pr´esentant un risque de MA, les MCI (Bakkour et al.,2009;Morris,2009;Dickerson et al.,2009b). Les individus ayant des signes de formes fibrillaires de l’amylo¨ıde pr´esentent un amincissement cortical dans ces r´egions par rapport aux individus ne pr´esentant pas de signe amylo¨ıde (Dickerson et al.,2009a,2011). Pris ensemble, ces r´esultats ont conduit les chercheurs `a conclure que cette signature corticale est un marqueur biologique valide et fiable de la MA (Bakkour et al., 2009, 2013; Dickerson and Wolk,2013).
Pour plus de d´etails sur sMRI, notamment la mesure de l’´epaisseur et la courbure corticale, voir les th`eses deQuerbes(2009) et deVanquin(2015).
1.1.2.1.4 Imagerie de diffusion et la maladie d’Alzheimer
De nombreuses ´etudes DTI sur la MA ont r´ev´el´e une augmentation de la diffusivit´e moyenne (DM) et une diminution de la fraction d’anisotropie (FA) dans la substance blanche, qui sont des indicateurs prometteurs de la MA (Amlien and Fjell, 2014). ´Etant donn´e que DM et FA sont influenc´es par la diffusion de l’eau dans les plans radial et axial, les diffusivit´es radiale D⊥ et axiale D// pourraient elles-mˆemes donner une repr´esentation plus pr´ecise des
l´esions tissulaires de la substance blanche en MA (Song et al., 2002, 2004) et peuvent ˆetre utiles pour la d´etermination des stades de la maladie en d´ecrivant diff´erentes pathologies de la substance blanche (Acosta-Cabronero et al., 2012). Cependant, la nature pr´ecise des dommages caus´es par la substance blanche dans la maladie d’Alzheimer n’a pas ´et´e caract´eris´ee et on ignore si elle survient avant ou apr`es les dommages dans la substance grise (Nir et al.,2013). Les corr´elations entre les changements de DTI dans la SG et les pathologies des tissus restent a ´etudier, mais il a ´et´e d´emontr´e que la diffusivit´e de la SG avait un pouvoir pr´edictif sup´erieur par rapport `a la volum´etrie (Weston et al.,2015).
1.1.2.1.5 Imagerie de transfert d’aimantation et la maladie d’Alzheimer
Un nombre croissant de publications ont utilis´e avec succ`es MTI pour caract´eriser des troubles neurod´eg´en´eratifs, y compris la MA (Tambasco et al.,
2015). Ropele et al. (2012) montre que MTI permet l’´evaluation des l´esions c´er´ebrales en cours, ind´ependamment de l’atrophie, et apparaˆıt donc comme un marqueur pr´ecieux des modifications tissulaires li´ees `a la maladie. Plusieurs ´etudes ont examin´e le ratio de transfert d’aimantation (MTR) et ont constat´e qu’il diminuait dans le cerveau entier (Ridha et al., 2007; Es et al., 2010), zones corticales, lobes temporaux (Bozzali et al., 2001) et dans l’hippocampe (Hanyu et al., 2000). van der Flier et al. (2002) ont trouv´e des amplitudes de pics r´eduites dans les histogrammes MTR chez les MCI et AD par rapport aux sujets sains, refl´etant des dommages structurels au cerveau. Mascalchi et al.(2013) ont soulign´e une diminution significative du MTR dans l’hippocampe gauche, l’amygdale et le cortex temporal m´edial post´erieur gauche de patients atteints de MA, mais aucune diff´erence n’a ´et´e observ´ee entre le MCI et les t´emoins.
1.1.2.1.6 Spectroscopie par r´esonance magn´etique et la maladie d’Alzheimer
Trois d´ecennies de recherche indiquent que la MRS est un marqueur d’imagerie biochimique potentiel dans la maladie d’Alzheimer. Elle permet une mesure r´egionale des m´etabolites, notamment le myo-inositol(mI), la choline(Cho), le N-ac´etyl aspartate(NAA) et la cr´eatine(Cr).
En 1992, Klunk et al.ont d´emontr´e une diminution du m´etabolite neuronal NAA des patients atteints de MA par rapport aux t´emoins. Le NAA est consid´er´e comme un marqueur de l’int´egrit´e neuronale. Plusieurs ´etudes ont examin´e la capacit´e de la MRS `a distinguer les patients AD des t´emoins, avec des r´esultats variables en fonction de la r´egion anatomique analys´ee et des param`etres d’acquisition. La sensibilit´e ´etait de 90% dans la r´egion temporo-pari´etale et inf´erieure `a 57% dans SG du lobe pari´etal. La sp´ecificit´e atteint 95% dans le lobe occipital m´edial et 73% dans le cingulaire post´erieur (Shonk et al., 1995; Zhu et al.,2006;Fernando et al.,2005;Mart´ınez-Bisbal et al.,2004). En outre, l’ajout du volume de l’hippocampe au MRS am´eliore la capacit´e de distinguer la MA (Kantarci et al.,2002;Schuff et al.,2002). Les taux de NAA/Cr dans le MCI sont l´eg`erement r´eduits mais diminuent `a mesure que les patients MCI progressent vers la MA. De plus, une diminution du NAA/Cr chez les patients MCI pr´edit la progression vers la MA (Kantarci et al.,2007;Chao et al.,2005;Metastasio et al.,
2006). Le rapport Cho/Cr est ´egalement utile pour d´eterminer la progression de MCI vers AD. Chez les patients MCI, une baisse de Cho/Cr pr´edit la stabilit´e alors qu’une augmentation pr´edit la conversion vers MA.
Voir la revue de Graff-Radford and Kantarci (2013) pour plus de d´etails concernant MRS et l’Alzheimer et pour plus de d´etails sur l’IRM en g´en´eral et la maladie d’Alzheimer, voir la revue dePromteangtrong et al.(2015).
1.1.3
L’IRM et la Scl´
erose en plaques
La scl´erose en plaques (SEP) est une maladie neurod´eg´en´erative, inflammatoire et d´emy´elinisante du syst`eme nerveux central. Elle a ´et´e d´ecrite pour la premi`ere fois en 1868 par le neurologue franc¸ais . La maladie affecte principalement le sexe f´eminin (3 femme pour un 1 homme) et le jeune adulte (20 ans `a 40 ans). Actuellement, elle touche plus de 110.000 cas en France et 2.3 millions dans le monde (d’apr`es l’ARSEP). L’origine exacte de la SEP n’est pas encore confirm´ee, il s’agit d’une maladie multifactorielle, elle peut ˆetre due `a des facteurs propres `a l’individu (facteurs g´en´etiques) mais aussi `a des facteurs environnementaux (e.g. les sujets d’origine nord-europ´eenne sont plus fr´equemment touch´es).
L’IRM est l’examen compl´ementaire le plus fr´equemment utilis´e, donnant une indication sur la nature des tissus et faisant notamment apparaˆıtre les plaques de d´emy´elinisation, ´evocatrices de la SEP. Ainsi, l’IRM a un rˆole pr´epond´erant dans le diagnostic (van Walderveen et al.,1995;Tourbah and Berry,2000), le suivi des patients (Filippi et al.,2002), mais aussi l’´evaluation des nouvelles th´erapeutiques (McFarland et al.,2002;R´ıo et al.,2017).
1.1.3.1 G´en´eralit´es sur la scl´erose en plaques 1.1.3.1.1 Physiopathologie
La SEP est une maladie du syst`eme nerveux central. le SNC comprend la moelle spinale et l’enc´ephale, ce dernier est constitu´e de trois r´egions : le cerveau, le tronc c´er´ebral et le cervelet. Le cerveau constitue la plus grande partie du SNC. Il renferme des cellules nerveuses responsables de la r´eception et la transmission de l’influx nerveux : Les neurones. Ils sont form´es d’un corps cellulaire et d’un prolongement d’axone. L’axone est entour´e d’une gaine : La my´eline. Elle assure la protection et la nutrition de l’axone. Sa fonction principale est d’acc´el´erer la conduction de l’influx nerveux.
La SEP est une maladie auto-immune : le syst`eme immunitaire reconnaˆıt la my´eline comme un agent ´etranger et l’attaque. Ce ph´enom`ene entraˆıne des l´esions dispers´ees dans le syst`eme nerveux central. Ces l´esions sont appel´ees plaques de d´emy´elinisation. Ces plaques sont responsables d’une alt´eration de la conduction nerveuse entraˆınant ainsi un handicap en fonction de la localisation des plaques, qui peut ˆetre suivi d’une d´eg´en´erescence axonale
Dans un premier temps, l’atteinte de la gaine de my´eline est l´eg`ere (les axones ne sont pas touch´es) ce qui cause un ralentissement de l’influx nerveux. Suite `a ces perturbations, deux possibilit´es, soit une remy´elinisation plus ou moins compl`ete, qui s’accompagne d’une cicatrisation, soit au contraire une aggravation de la d´emy´elinisation, ce qui au fil du temps causera une destruction axonale (figure1.7).
1.1.3.1.2 Clinique
La SEP est une maladie impr´evisible dont l’´evolution, polymorphe, est le reflet de l’interaction entre les pouss´ees et la progression du handicap.
FIGURE1.7 – L’atteinte de la gaine de my´eline dans le cadre de la SEP
durent au moins 24heures, suivis souvent d’une phase de plateau puis une r´ecup´eration qui peut ˆetre compl`ete.
- La progression : Une aggravation continue des signes cliniques du patient, ind´ependamment des pouss´ees, sur une p´eriode d’au moins six mois. La progression de la maladie est mesur´ee `a l’aide d’une ´echelle : l’Expanded Disability Status Scale (EDSS) qui a ´et´e propos´ee par Kurtzke en 1983. Elle permet de d´ecrire les d´eficits li´es `a la maladie et d’´evaluer l’´evolution du handicap. Elle repose sur un examen neurologique standardis´e ou plusieurs param`etres sont ´evalu´es.
L’´evolution de la maladie est tr`es variable selon les personnes. Elle est class´ee selon trois formes ´evolutives principales (Weill and Batteux,2003) figure1.8: — La SEP R´emittente-R´ecurrente (SEP-RR): Cette ´evolution est caract´eris´ee par
l’apparition de pouss´ees suivies d’une phase de r´etablissement (avec ou sans s´equelles). Absence de progression entre les pouss´ees. Cette forme concerne la plupart des patients SEP, environ 85% (Magy,2009).
— La SEP secondairement progressive (SEP-SP) : ´Evolution naturelle de la forme SEP-RR. Apr`es une phase initialement r´emittente de 15 ann´ees en moyenne, la phase de pouss´ees est suivie d’une phase d’accumulation progressive du handicap, `a laquelle peuvent se surajouter des pouss´ees.
— La SEP progressive primaire (SEP-PP) : Les patients font leur entr´ee dans la maladie par une progression continue du handicap, avec ou sans pouss´ees ajout´ee. Cette forme est plus grave et plus rare et touche 15% des patients. En ce qui concerne les symptˆomes de la SEP, dˆu au polymorphisme clinique
de la maladie, aucun symptˆome n’est sp´ecifique de la SEP. Ils sont extrˆemement variables d’un patient `a l’autre : fatigue, douleurs musculaires, troubles oculaires, troubles moteur. . .
FIGURE1.8 – Les trois formes cliniques de la SEP (source :https://cnfs.ca/pathologies/sclerose-en-plaques)
1.1.3.1.3 Diagnostic
A ce jour, il n’existe pas de test diagnostique sp´ecifique `a la SEP, ainsi le diagnostic repose sur un faisceau d’arguments cliniques, biologiques et radiologique. Il suppose aussi l’absence de toute autre affection susceptible d’expliquer les signes observ´es. Le diagnostic de la SEP repose sur les caract´eristiques suivantes :
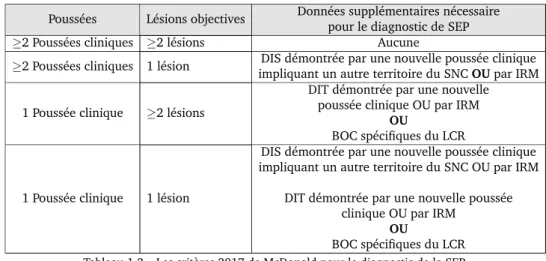
— La diss´emination dans le temps (DIT10), soit l’´evolution de la maladie sous la forme de pouss´ees et r´emissions ou en imagerie, la d´emonstration de coexistence de plaques d’ˆages diff´erents (apparition entre deux examen successifs et/ou prises de contraste limit´ees `a certaines plaques).
— La diss´emination dans l’espace (DIS11) correspond `a l’atteinte de plusieurs
zones du SNC, de mani`ere simultan´ee ou successive, soit d´emontr´ee cliniquement soit par imagerie ce qui revient `a compter et localiser les plaques de d´emy´elinisation
Cette notion de diss´emination dans le temps et l ’espace peut faire d´efaut au d´ebut de la maladie et dans les formes progressives. Ainsi, il est indispensable de passer des examens compl´ementaires :
— Examen clinique
La SEP ´etant une maladie polymorphe l’examen clinique est important. Il permet de mettre en ´evidence certains signes ´evocateurs tels que les ant´ec´edents personnels et familiaux du patient, la nature des signes cliniques
10. ”dissemination in time” en anglais 11. ”dissemination in space” en anglais
et leur ´evolution dans le temps.
— L’imagerie par r´esonance magn´etique
L’IRM est l’examen compl´ementaire le plus appropri´e ; il occupe donc une place fondamentale dans le diagnostic. Il est d’ailleurs effectu´e d`es le premier ´ev`enement clinique. Les crit`eres diagnostiques de la diss´emination dans le temps et dans l’espace ont beaucoup ´evolu´e depuis Mcdonald (McDonald et al., 2001; Polman et al., 2005, 2011; Thompson et al., 2018). Sur le tableau 1.2 nous pr´esentons les r´evisions 2017 de ces crit`eres (Thompson et al.,2018).
Pouss´ees L´esions objectives Donn´ees suppl´ementaires n´ecessaire pour le diagnostic de SEP ≥2 Pouss´ees cliniques ≥2 l´esions Aucune
≥2 Pouss´ees cliniques 1 l´esion impliquant un autre territoire du SNC OU par IRMDIS d´emontr´ee par une nouvelle pouss´ee clinique
1 Pouss´ee clinique ≥2 l´esions
DIT d´emontr´ee par une nouvelle pouss´ee clinique OU par IRM
OU
BOC sp´ecifiques du LCR
1 Pouss´ee clinique 1 l´esion
DIS d´emontr´ee par une nouvelle pouss´ee clinique impliquant un autre territoire du SNC OU par IRM
DIT d´emontr´ee par une nouvelle pouss´ee clinique OU par IRM
OU
BOC sp´ecifiques du LCR
Tableau 1.2 – Les crit`eres 2017 de McDonald pour le diagnostic de la SEP.
BOC : Bandes Oligoclonales, DIS : Diss´emination dans l’espace, DIT : Diss´emination dans le temps
— L’inflammation au niveau du SNC (Examen du liquide c´ephalo-rachidien LCS) : Lors d’un m´ecanisme inflammatoire, le LCS, pr´elev´e par ponction lombaire, montre le plus souvent un syndrome inflammatoire : on retrouvera ainsi une augmentation du nombre de lymphocytes et une hyperprot´einorchie de profil assez sp´ecifique.
1.1.3.1.4 Traitement
Aujourd’hui les m´edicaments permettent globalement de freiner la maladie mais pas de la gu´erir. L’efficacit´e th´erapeutique se juge sur la fr´equence des pouss´ees et sur l’´evolution du handicap neurologique.
— Le traitement des pouss´ees :Combattre l’inflammation et raccourcir la dur´ee des pouss´ees (les cortico¨ıdes).
— Les traitements de fond : Espacer les pouss´ees, diminuer leur intensit´e et `a plus long terme, ralentir la progression du handicap (immunomodulateurs et les immunosuppresseurs).
— Le traitement des symptˆomes :Diminuer l’intensit´e des symptˆomes ressentis par les patients.
1.1.3.1.5 Les essais cliniques en scl´erose en plaques
Un essai clinique est une ´etude scientifique r´ealis´ee en th´erapeutique m´edicale humaine pour ´evaluer l’efficacit´e et la tol´erance d’une m´ethode diagnostique ou
d’un traitement. Pour garantir la s´ecurit´e des sujets et la rigueur scientifique, les essais cliniques comprennent quatre phases qui sont chacune destin´ees `a recueillir des informations sp´ecifiques sur le nouveau traitement.
Pour les patients atteints de la forme SEP-PP ou SEP-SP de la scl´erose en plaques, malgr´e des diff´erents ph´enotypes cliniques initiaux, la dur´ee des p´eriodes observ´ees avant le franchissement de certaines ´etapes importantes du handicap, ainsi que l’ˆage auquel ces ´etapes sont atteintes, sont similaires. En cons´equence, des directives r´ecentes ont propos´e de les regrouper en une seule entit´e d´enomm´ee ”maladie progressive” (SPP). On estime que le taux de pr´evalence globale des patients atteints d’une maladie progressive correspond `a au moins 40% de tous les patients atteints de scl´erose en plaques.
La scl´erose en plaques progressive (SPP) est d´ecrite comme l’accumulation graduelle de l´esions nerveuses et d’incapacit´es cliniques. A ce jour, contrairement `
a la forme r´emittente-r´ecurrente (SEP-RR)(Miller and Rhoades, 2012), aucun traitement efficace sur la SPP n’a ´et´e identifi´e et les r´esultats des essais cliniques restent majoritairement d´ecevants (Miler AE et al., 2012 ; Wiendl H et al., 2009). Cela est dˆu au fait que les processus pathologiques sous-jacents qui la d´efinissent restent flous et aucun biomarqueur n’a ´et´e totalement valid´es comme ´etant suffisamment sensible dans la forme SPP.
— La probl´ematique de la SEP progressive dans les essais cliniques
Les patients qui ont rec¸u un diagnostic de SPP sont souvent frustr´es par le nombre relativement bas d’essais cliniques sur la SPP (sp´ecialement la primaire-progressive) par rapport au nombre important sur la SEP-RR. Les cliniciens et les chercheurs de la SEP partagent cette frustration et recherchent activement des moyens d’augmenter le nombre d’essais de traitements pour les SPP, en s’attaquant `a plusieurs obstacles :
- Les m´edicaments actuellement utilis´es pour traiter les formes r´ecurrentes de la SEP (SEP-RR) ciblent principalement une inflammation dans le syst`eme nerveux central (SNC). Sachant que l’inflammation joue un rˆole moins important dans la SPP que dans les formes r´ecurrentes de la SEP, ces m´edicaments ne semblent pas ˆetre aussi efficaces dans la SPP, ce qui signifie que de nouvelles cibles de traitement doivent ˆetre identifi´ees.
-Dans la SPP, il y a un manque de marqueurs facilement identifiables qui puissent ˆetre mesur´es dans les essais. Dans les essais concluants, les chercheurs ont examin´e les marqueurs tels que le nombre de pouss´ees et le nombre de nouvelles l´esions `a l’aide de l’IRM afin de d´eterminer si les personnes ayant rec¸u le traitement avaient un nombre inf´erieur de pouss´ees et de nouvelles l´esions par rapport `a ceux qui ont rec¸u un placebo, mais dans le groupe SPP, ces mesures ne quantifient pas vraiment la progression du handicap.
-La progression du handicap dans les SPP peut ˆetre assez lente, ce qui rend difficile l’identification d’un effet du m´edicament sur la progression dans un essai de deux ou trois ans.
— Bilan sur les essais cliniques de la SEP progressive
Les ´etudes cliniques ont impliqu´e plus de 8500 sujets. Diff´erentes cat´egories de traitement ont ´et´e ´etudi´es, y compris les immunosuppresseurs classiques, les interf´erons bˆeta et les nouveaux immunomodulateurs. Malgr´e de grands espoirs,
les r´esultats des essais de phase III sont essentiellement n´egatifs. Cependant, on s’aperc¸oit que la m´ethodologie d’essai clinique moderne a tir´e des lec¸ons des 20 derniers ann´ees, on constate : un plus grand nombre de sujet, l’utilisation de biomarqueurs plus pertinents et des dur´ees d’essai de phase III plus r´ealistes. Les th´erapies r´ecentes de la SEP sont pr´esent´es dans les revues de Coclitu et al.
(2016), Correale et al.(2017) etDe Angelis et al.(2018).
1.1.3.2 IRM conventionnelle et scl´erose en plaques
L’IRM conventionnelle est un outil tr`es sensible pour d´etecter l’inflammation et pour visualiser les l´esions et cela de fac¸on tr`es pr´ecoce. Elle consiste en l’utilisation de s´equences en pond´eration T2, T1, FLAIR et s´equences pond´er´ees T1 apr`es injection de Gadolinium.
FIGURE1.9 – IRM conventionnelle en SEP
(A) IRM pond´er´ee en T1 sans injection Gd, l´esions en iso- ou hypo-signaux ; (B) IRM pond´er´ee en T1 apr`es injection Gd, l´esions en hyper-signaux ; (C) IRM pond´er´ee en T2, l´esions en hyper-signaux ; (D) S´equence FLAIR, l´esions en hyper-signaux (acquisitions effectu´ees au sein du plateau IRM de l’INSERM ToNIC U1214, d’apr`esDutilleul(2015))
— IRM pond´er´ee en T1
L’IRM pond´er´ee en T1 permet de mettre en ´evidence les l´esions anciennes et chroniques, qu’on appelle les ”trous noirs” car elles apparaissent en hyposignal sur l’IRM pond´er´ee en T1 (figure 1.9-A). Ces plaques repr´esentent une destruction tissulaire s´ev`ere (l´esions de d´emy´elinisation et perte axonale). Ainsi l’IRM pond´er´ee en T1 permet d’´etudier l’ampleur des processus de r´eparation
tissulaire via l’´etude de la persistance ou l’att´enuation de ces hypo-intensit´es en T1.
la s´equence pond´er´ee en T1 avec injection de Gadolinium (figure 1.9-B) est une acquisition pond´er´ee en T1 effectu´ee apr`es l’injection par voie intraveineuse d’un produit de contraste qui est les ch´elates de Gadolinium (Gd). Les l´esions rehauss´ees `a l’injection du Gd repr´esentent les l´esions r´ecentes et actives (inflammatoires). Ainsi cette s´equence apporte une information sur l’activit´e inflammatoire et le caract`ere ´evolutif de la maladie.
D’autre part, l’IRM pond´er´ee en T1 nous permet de mettre en ´evidence l’atrophie c´er´ebrale. L’atrophie c´er´ebrale est devenue un ph´enom`ene reconnu en SEP (Chard et al.,2004;Azevedo and Pelletier, 2016; Zivadinov et al., 2016). Elle est caract´eris´ee par l’´elargissement ventriculaire, la diminution du volume du corps calleux et par l’amincissement du ruban cortical.
C’est l’atrophie c´er´ebrale qui est la plus fortement corr´el´ee `a l’´evolution clinique de la SEP et permettrait de pr´edire la d´et´erioration de la fonction motrice et cognitive. On sait que l’atrophie c´er´ebrale se produit lors du vieillissement normal, avec une perte annuelle du volume c´er´ebral d’environ 0.2 `
a 0.5% (Fjell et al., 2009) alors que chez les patients atteints de SEP, le taux d’atrophie est estim´e entre 0,5 et 1,3% par an (V˚agberg et al., 2013), probablement en raison d’une perte du volume de la SG. G´en´eralement, l’atrophie c´er´ebrale semble ˆetre plus importante chez les patients atteints de SEP progressive que chez ceux atteints de SEP r´emittente-r´ecurrente. Pourtant, plusieurs ´etudes ont montr´e qu’une perte importante de volume peut d´ej`a se produire chez les patients atteints d’une SEP-RR r´ecente (De Stefano et al.,2002;
Chard et al.,2004) et chez les patients atteints de syndrome cliniquement isol´e12
(CIS). Plus r´ecemment, une perte de volume du parenchyme c´er´ebral de 0,4% par an a ´et´e propos´ee comme ”le taux d’atrophie pathologique” pour d´efinir les patients atteints de SEP (De Stefano et al., 2016) et pr´esentait une forte corr´elation avec l’EDSS. Compte tenu de sa corr´elation avec le handicap, l’utilisation plus syst´ematique des mesures d’atrophie c´er´ebrale a ´et´e sugg´er´ee comme param`etre des ´etudes cliniques.
— IRM pond´er´ee en T2 et s´equence FLAIR
Ces s´equences ont une grande sensibilit´e pour la d´etection des l´esions de la SEP. Les plaques apparaissent en hypersignal et repr´esentent soit des l´esions ´evolutives inflammatoires et oed´emateuses, soit des l´esions anciennes et non actives (non-inflammatoires) qui t´emoignent d’une d´emy´elinisation suivie d’une ´eventuelle perte axonale. Les hypo-intensit´es observ´ees sur les s´equences pond´er´ees en T1 apparaissent sur les images pond´er´ees en T2 (figure 1.9-C) ou en FLAIR en hyper-intensit´es (figure1.9-D).
La s´equence pond´er´ee en T2 repr´esente mal les l´esions p´eri-ventriculaires et juxta-corticale qui ont souvent un signal similaire au liquide c´er´ebrospinal (LCS) adjacent, d’o`u l’int´erˆet d’utiliser la s´equence FLAIR, qui est une s´equence pond´er´ee en T2 mais sans la contribution du signal du LCS, ainsi les l´esions sont
12. CIS est un premier ´episode de d´emy´elinisation d’origine inflammatoire, i.e. une pouss´ee que l’on observe pour la premi`ere fois et qui repr´esente pour la personne atteinte un risque accru que
sa SEP se manifeste cliniquement compl`etement, c’est-`a-dire selon les crit`eres de diss´emination