HAL Id: dumas-01695877
https://dumas.ccsd.cnrs.fr/dumas-01695877
Submitted on 29 Jan 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Place thérapeutique et biosynthèse de deux
immunosuppresseurs d’origine fongique, la ciclosporine
A et l’acide mycophénolique
Frédéric Perriot, Maud Vessiller
To cite this version:
Frédéric Perriot, Maud Vessiller. Place thérapeutique et biosynthèse de deux immunosuppresseurs d’origine fongique, la ciclosporine A et l’acide mycophénolique. Sciences pharmaceutiques. 2017. �dumas-01695877�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur
UNIVERSITÉ GRENOBLE ALPES UFR DE PHARMACIE DE GRENOBLE
Année 2017
PLACE THÉRAPEUTIQUE ET BIOSYNTHÈSE DE DEUX
IMMUNOSUPPRESSEURS D’ORIGINE FONGIQUE, LA
CICLOSPORINE A ET L’ACIDE MYCOPHÉNOLIQUE
THÈSE
PRÉSENTÉE POUR L’OBTENTION DU TITRE DE DOCTEUR EN PHARMACIE DIPLÔME D’ÉTAT
Frédéric PERRIOT et Maud VESSILLER
THÈSE SOUTENUE PUBLIQUEMENT À LA FACULTÉ DE PHARMACIE DE GRENOBLE
Le 19/12/2017
DEVANT LE JURY COMPOSÉ DE
Président du jury :
Docteur Lucile SAGE, Docteur en Pharmacie, HDR, Université Grenoble Alpes
Directeur de thèse :
Docteur Bello MOUHAMADOU, HDR, Maître de Conférences, Université Grenoble Alpes
Membres :
Docteur Marie-Noëlle BINET, Maître de Conférences, Université de Bourgogne Docteur Bernard CHAMPON, Docteur en Pharmacie
L’UFR de Pharmacie de Grenoble n’entend donner aucune approbation ni improbation aux opinions émises dans les thèses ; ces opinions sont considérées comme propres à leurs auteurs.
1
LISTE DES ENSEIGNANTS A L’UFR DE PHARMACIE DE
GRENOBLE
4
REMERCIEMENTS
Nous tenons tout d’abord à remercier le Dr. Bello Mouhamadou pour son encadrement, sa patience et son expertise qui nous ont fortement aidés dans la réussite de cette thèse d’exercice. Nous vous remercions particulièrement pour vos conseils et votre soutien indéfectible durant toute la préparation de cette thèse d’exercice.
Nous tenons également à remercier chaleureusement le Dr. Lucile Sage pour avoir accepté de présider le jury de notre thèse d’exercice.
Nous remercions également les Dr. Marie-Noëlle Binet et Bernard Champon pour avoir accepté d’évaluer notre travail et de constituer notre jury de thèse d’exercice.
Nos remerciements vont aussi aux Dr. Paolo Malvezzi et Virginie Lloyd qui nous ont été d’une grande aide en acceptant de prendre de leur temps pour partager leur expertise avec nous et répondre à nos questions.
Nous exprimons notre gratitude à tous les enseignants et au personnel de l’université qui nous ont accompagnés et ont rendu possible nos études de pharmacie dans les meilleures conditions.
Enfin, nous remercions nos familles respectives pour leurs soutiens et leurs encouragements tout au long de ces années d'études, ainsi que nos amis avec lesquels nous avons partagé de très bons moments sur les bancs de l’université.
5
TABLE DES MATIÈRES
LISTE DES ENSEIGNANTS A L’UFR DE PHARMACIE DE GRENOBLE ... 1
REMERCIEMENTS ... 4
TABLE DES MATIÈRES ... 5
TABLE DES ILLUSTRATIONS ... 8
LISTE DES ABBRÉVIATIONS ... 11
INTRODUCTION ... 13
PARTIE 1 : GÉNÉRALITÉS SUR LES CHAMPIGNONS ... 15
1. Définition ... 15
2. Classification ... 16
2.1. Phylum des Microsporidia ... 17
2.2. Phylum des Chytridiomycota ... 18
2.3. Phyla des Blastocladiomycota et Neocallimastigomycota ... 18
2.4. Sous Phyla des Mucoromycotina, Entomophthoromycotina, Kickxellomycotina et Zoopagomycotina ... 18
2.5. Phyla des Glomeromycota ... 18
2.6. Sous règne des Dikarya ... 19
2.6.1. Phylum des Ascomycota ... 19
2.6.2. Phylum des Basidiomycota ... 20
3. Les métabolites ... 21
3.1. Les alcaloïdes ... 23
3.2. Les terpènes et les terpénoïdes ... 24
3.3. Les polycétides ... 26
3.4. Les peptides non ribosomiques ... 28
PARTIE 2 : L’ACIDE MYCOPHENOLIQUE ... 30
1. Mécanismes d’action du MPA ... 30
1.1. Voies de biosynthèse des purines ... 30
1.2. Voies d’action du MPA ... 32
1.2.1. Les effets sur la voie de novo ... 32
1.2.1.1. Inhibition de l’IMPDH ... 32
1.2.1.2. Les isoformes de l’IMPDH ... 34
6 1.2.3. Inhibition de la glycosylation et de l’expression des molécules d’adhésion35
1.2.4. Inhibition sélective de l’Oxyde Nitrique Synthase (NOS) ... 37
1.2.5. Effet sur les cellules dendritiques ... 39
2. Effets pharmacologiques du MPA ... 40
2.1. Propriétés immunosuppressives du MPA ... 40
2.1.1. Utilisation du MPA ... 45
2.1.2. Posologies ... 45
2.1.2.1. Transplantation rénale ... 45
2.1.2.2. Transplantation cardiaque ... 46
2.1.2.3. Transplantation hépatique ... 46
2.2. Indications hors AMM ... 46
2.2.1. Lupus systémique ... 46
2.2.2. Les anémies hémolytiques auto-immunes (AHAI) ... 48
2.2.3. Myasthénie auto-immune ... 50
2.2.4. Vascularites nécrosantes systémiques ... 51
2.2.5. Syndrome néphrotique idiopathique ... 52
2.2.6. Les dermatoses bulleuses auto-immunes ... 54
2.3. Effets indésirables ... 56
2.3.1. Effets indésirables importants ... 56
2.3.2. Liste exhaustive des effets indésirables recensés par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) ... 57
2.4. Contre-indications et interactions médicamenteuses ... 58
3. Production de MPA par les souches fongiques ... 59
3.1. Voies de biosynthèse du MPA ... 59
3.2. Souches productrices ... 61
3.3. Optimisation de la production du MPA par des techniques biotechnologiques 64 3.3.1. Méthodes agissant sur les souches fongiques ... 64
3.3.2. Méthodes agissant sur les conditions de culture ... 65
3.3.2.1. Types de culture ... 65
3.3.2.2. Milieu de culture ... 69
3.3.2.3. Facteurs physico-chimiques d’optimisation de la production ... 72
3.3.3. Conclusions sur l’optimisation de la production de MPA ... 72
PARTIE 3 : LA CICLOSPORINE A ... 74
7
1.1. Voie d’activation antigénique des lymphocytes T ... 75
1.1.1. La calcineurine ... 75
1.1.2. La transduction du signal ... 76
1.2. Mécanismes d’inhibition des lymphocytes T par la ciclosporine A ... 77
2. Effets de la ciclosporine A... 79
2.1. Prévention du rejet de greffon ... 79
2.1.1. Formes pharmaceutiques ... 82
2.1.2. Posologie ... 83
2.2. Indications hors AMM ... 84
2.2.1. Pathologies communes à la CsA et au MPA ... 85
2.2.2. Arthrite Juvénile Idiopathique ... 86
2.2.3. Purpura Thrombopénique Immunologique ... 87
2.2.4. Rectocolite Hémorragique (RCH) ... 87
2.2.5. Dermatomyosite de l’enfant et de l’adulte ... 88
2.3. Effets indésirables ... 89
2.3.1. Effets indésirables importants ... 89
2.3.2. Liste exhaustive des effets indésirables recensés par l’ANSM ... 89
2.3.3. Contre-indications et interactions médicamenteuses ... 91
3. Souches productrices de la ciclosporine A et optimisation de la biosynthèse... 92
3.1. Biosynthèse de la ciclosporine A ... 92
3.2. Souches productrices et optimisation de la production ... 93
3.2.1. Souches productrices ... 93 3.2.2. Système de fermentation ... 101 3.2.2.1. Types de culture ... 101 3.2.2.2. Composition du milieu ... 102 3.2.2.3. pH du milieu ... 102 3.2.2.4. Facteurs physiques ... 102
3.2.3. Production de ciclosporine A à grande échelle ... 103
PARTIE 4 : DISCUSSION GENERALE ... 105
CONCLUSION ... 110
ANNEXES ... 112
8
TABLE DES ILLUSTRATIONS
Liste des Figures :
Figure 1: Activation des lymphocytes T lors d’une alloréactivité ... 14
Figure 2: Evolution du monde vivant ... 15
Figure 3: Classification phylogénétique du règne Fungi ... 16
Figure 4: Cycle de vie de la microsporidie Trachipleis tophorahominis ... 17
Figure 5: Cycle de reproduction des Ascomycota ... 20
Figure 6: Cycle biologique d’Agrocybe aegerita ... 21
Figure 7: Classe de métabolites secondaires chez les champignons ... 22
Figure 8: Exemple de biosynthèse d’un alcaloïde indolique : l’acide lysergique ... 24
Figure 9: Voie de synthèse des terpènes chez Saccharomyces cerevisiae ... 25
Figure 10: Fonctionnement des polycétides synthases ... 27
Figure 11: Schéma d'une enzyme de synthèse de peptide non ribosomique (NRPS = Non-Ribosomal Peptide Synthetase) ... 28
Figure 12: Répartition des peptides non ribosomiques selon leurs activités biologiques ... 29
Figure 13: Synthèse de l’AMP et du GMP à partir de l’inosinate monophosphate ... 31
Figure 14: Voie de biosynthèse des purines montrant la position centrale de l’Inosine Monophosphate ... 33
Figure 15: Effet antiprolifératif du MPA sur différents types cellulaires ... 33
Figure 16: Mécanisme de la diapédèse leucocytaire ... 36
Figure 17: Effet du mycophénolate mofétil (MMF) (= MPA) sur la pénétration des lymphocytes T à travers la barrière endothéliale ... 37
Figure 18: Effet du MPA sur la production induite de NO par des cellules endothéliales activées en culture ... 38
Figure 19: Les mécanismes d’action du MPA ... 39
Figure 20: Structure des molécules d’acide mycophénolique, de mycophénolate mofétil et de mycophénolate sodique. ... 41
Figure 21: Voies de métabolisation du mycophénolate sodique et du mycophénolate mofétil en acide mycophénolique ... 41
Figure 22: Symptômes les plus courants du lupus systémique ... 47
Figure 23: Arbre décisionnel de traitement d’une AHAI à anticorps « chauds » chez l’adulte .... 49
9
Figure 25: Classification des vascularites selon le type de vaisseaux atteints ... 52
Figure 26: Pourcentage de SNI pédiatriques corticosensibles, corticodépendants et corticorésistants dans une cohorte de 40 patients ... 53
Figure 27: Pemphigoïde bulleuse affectant la main et l’avant-bras d’une patiente ... 55
Figure 28: Cas sévère de pemphigus vulgaris avec des lésions dorsales importantes ... 56
Figure 29: ŖClusterŗ de gènes impliqués dans la biosynthèse du MPA ... 60
Figure 30: Voie de biosynthèse du MPA ... 60
Figure 31: Structure de P. brevicompactum ... 61
Figure 32: Production de MPA dans des souches d’Aspergillus (A) et niveau d’expression du gène MapC (B) ... 63
Figure 33: Cinétique de production de MPA en culture solide ... 66
Figure 34: Types de supports solides disponibles pour l'immobilisation des souches fongiques en culture submergée ... 69
Figure 35: Production de MPA selon la nature de la source d'azote à 3 g/L ... 70
Figure 36: Production de MPA selon la nature de la source de carbone à 3 g/L ... 71
Figure 37: Production de MPA selon la nature de la source de phosphate ... 71
Figure 38: Bioréacteurs de 5 L ... 73
Figure 39: Structure chimique de la CsA ... 74
Figure 40: Représentation schématique de la structure de la calcineurine ... 76
Figure 41: Voie d’activation du NF-AT d’un lymphocyte T ... 77
Figure 42: Effet de la CsA sur la voie du NT-AF ... 78
Figure 43: Patient atteint de psoriasis sévère juste avant l’instauration d’un traitement à la CsA 80 Figure 44: Pourcentage de patients sous CsA versus MTX développant une GVHD aigüe suite à une transplantation de MO ... 81
Figure 45: Histoire de l’utilisation des CNI dans les maladies autoimmunes ... 84
Figure 46: Arthrite juvénile idiopathique ... 86
Figure 47: Dermatomyosite de l’adulte avec atteinte cutanée (gauche) et pulmonaire (droite) .. 88
Figure 48: T. inflatum au microscope électronique à balayage ... 93
Figure 49: Cibles d’action des principaux IS sur l’activation des lymphocytes ... 106
Figure 50: Protocole de traitement dans le cas d’une transplantation rénale au CHU de Grenoble ... 107
10
Liste des Tableaux :
Tableau I : Classification des terpènes selon le nombre d’unité isoprène. ... 26
Tableau II: Molécules d’adhésion des leucocytes et leurs ligands endothéliaux correspondants ... 35
Tableau III : Efficacité du Cellcept® pour la prévention du rejet de greffon après transplantation rénale chez l’adulte. Données de l’HAS. ... 43
Tableau IV: Efficacité du Cellcept® pour la prévention du rejet de greffon après transplantation rénale chez l’enfant. Données de l’HAS. ... 43
Tableau V: Efficacité du Cellcept® pour la prévention du rejet de greffon après transplantation cardiaque chez l’enfant. Données de l’HAS. ... 43
Tableau VI: Survie des patients adultes à trois ans après transplantation cardiaque et traités par Cellcept®. Données de l’HAS. ... 44
Tableau VII: Efficacité du Cellcept® pour la prévention du rejet de greffon après transplantation hépatique chez l’adulte. Données de l’HAS. ... 44
Tableau VIII: Espèces et souches de Penicillium produisant le MPA ... 61
Tableau IX: Exemple de production de MPA chez Penicillium en culture immergées ... 67
Tableau X: Tableau des posologies du Néoral®selon les RCP ... 83
Tableau XI : Liste des effets indésirables recensés par l’ANSM pour le Sandimmun® ... 89
Tableau XII : Exemples de souches et de milieux de culture optimisés pour la production de CsA ... 94
Tableau XIII: Résultats issus de l’étude de El Enshasy et al. (2008) sur une culture à l’échelle d’un bioréacteur ... 104
Liste des Annexes : Annexe 1: Protocole classique d’immunosuppression en transplantation hépatique ... 112
11
LISTE DES ABBRÉVIATIONS
acétylCoA : acétyl-coenzyme A
ACP : acyl carrier protein
ADN : acide désoxyribonucléique
AHAI : anémies hémolytiques auto- immune
AINS : anti-inflammatoires non stéroïdiens
AJI : arthrite juvénile idiopathique
AMM : autorisation de mise sur le marché
AMP : adénosine monophosphate
ANSM : agence nationale de sécurité du médicament et des produits de santé
ARNm : acide ribonucléique messager
ASMR : amélioration nette du service médical rendu
AT : acyltransférase
ATG : anticorps anti-thymocyte
AZA : azathioprine
BH4 : tétrahydrobioptérine
CMH : complexe majeur d’histocompatibilité
CNI : inhibiteur de la calcineurine
cNOS : constitutive oxyde nitrique synthase
CsA : ciclosporine A
CYC : cyclase
DBAI : dermatoses bulleuses auto-immunes
DH : déshydratase
DIGAL : dermatose à IgA linéaire
DM : dermatomyosite
DMAPP : diméthylallyldiphosphate
ER : énoylréductase
ERK: extracellular signal-regulated kinase
GEM : glomérulopathie extra-membraneuse
GMP : guanosine monophosphate
GVHD : graft versus host disease
HAS : haute autorité de santé
HATP : hypertension artérielle pulmonaire
HMG-CoA : β-Hydroxy-β-methylglutaryl-CoA
HSF : hyalinose segmentaire et focale
IL-2 : interleukine 2
IMP : inosine monophosphate
IMPDH : inosine-5′-monophosphate déshydrogénase
12 iNOS : inductible oxyde nitrique
synthétase
IPP : isopentenyldiphosphate
IS : immunosuppresseur
JNK : c-Jun N-terminal kinase
kDa : kiloDalton
KR : kétoreductase
KS : kétosynthase
LS : lupus systémique
MAPK : mitogen-activated protein kinase
MMF : mycophénolate mofetil
MO : moëlle osseuse
MPA : acide mycophénolique
MPS : mycophénolate sodique
MT : méthyltransférase
MTE : marge thérapeutique étroite
MTX : méthotrexate
NF-AT : nuclear factor of activated T-cells
NO : oxyde nitrique
NOS : oxyde nitrique synthétase
NRP : peptide non ribosomique
NRPS : non ribosomal peptide synthétase PB : pemphigoïde bulleuse PC : pemphigoïde cicatricielle PKS : polycétides synthétase PPi : pyrophosphate PR : polyarthrites rhumatoïdes PRPP : 5-phosphoribosyl-1-pyrophosphate
PTI : purpura thrombopénique immunologique
RCH : rectocolite hémorragique
SMR : service médical rendu
SNI : syndrome néphrotique idiopathique
SNLGM : syndrome néphrotique à lésions glomérulaires minimes
TCR : T-cell receptor
TE : thioestérase
TGF-β : transforming growth factor-β
UV : ultraviolet
VNS : vascularites nécrosantes systémiques
13
INTRODUCTION
La transplantation hétérologue, soit la greffe d’un organe d’un individu donneur à un individu receveur, constitue la seule alternative thérapeutique dans plusieurs maladies graves. Selon l’agence de la biomédecine, 5 891 greffes ont été réalisées en 2016, avec 22 617 patients en attente d’organes (1). Cependant, une greffe pose un problème de compatibilité entre donneur et receveur. En effet, l’organe greffé peut être reconnu comme étranger par le système immunitaire du receveur, c'est-à-dire que des réactions immunitaires humorales et cellulaires dénommées alloréactivité se développent contre l’organe greffé, aboutissant à son rejet. L’alloréactivité est due à des différences antigéniques entre les cellules du donneur et celles du receveur. Ces différences sont le résultat du polymorphisme des gènes codant pour les antigènes du complexe majeur d’histocompatibilité (CMH) présents à la surface des cellules (2).
Les lymphocytes T sont les principaux acteurs impliqués dans l’alloréactivité. Ils reconnaissent les antigènes du CMH du donneur. Cette reconnaissance conduit à leur activation qui requiert trois signaux (Figure 1). Le signal 1 est induit par la stimulation des récepteurs TCR (T cell receptor) des lymphocytes T via leur interaction avec les CMH allogéniques. Il dépend du calcium et aboutit à la synthèse de cytokines, notamment l’interleukine 2 (IL-2). Le signal 2, signal de co-stimulation, nécessaire pour maintenir et renforcer le signal 1, fait suite à la liaison entre les cellules présentatrices d’antigènes et les lymphocytes T via les interactions entre les molécules qu’ils produisent (CD28, CD154 par les lymphocytes T ; CD80, CD86 et CD40 par les cellules présentatrices d’antigène). Le signal 3 résulte de la fixation de ces cytokines (IL-2 synthétisées) à la suite des signaux 1 et 2 sur leurs récepteurs de haute affinité présents sur la membrane lymphocytaire. Cette fixation permet le passage du cycle cellulaire des lymphocytes T de la phase G1 à la phase S (synthèse d’ADN) conduisant à leur prolifération (3).
Pour empêcher le développement d’une alloréactivité, la transplantation d’organe doit se faire entre des individus ayant des systèmes CMH proches et doit être accompagnée par un traitement à base d’immunosuppresseurs (IS) (4).
Les IS constituent une classe médicamenteuse destinée à prévenir ou à traiter le rejet d'allogreffe ou la maladie du greffon contre l'hôte ainsi que les maladies auto-immunes. Parmi ces IS, deux sont d’origine fongique, la ciclosporine A (CsA) et l’acide mycophénolique (MPA). Ce sont des métabolites secondaires synthétisés par des champignons appartenant à la classe des
14 Ascomycètes. Cette classe regroupe la plupart des espèces produisant des métabolites d’intérêt thérapeutique.
Figure 1: Activation des lymphocytes T lors d’une alloréactivité (3)
La CsA et le MPA ont été couramment utilisés ces dernières années dans la plupart des protocoles thérapeutiques de transplantation d’organes malgré la découverte de nouvelles molécules à propriétés immunosuppressives. En raison de leur synthèse réalisée essentiellement par voie chimique, pour le MPA, ou limitée à quelques souches fongiques, pour la CsA, ils font l’objet de nombreuses études pour développer les processus de fermentation pour leur biosynthèse.
L’objectif de cette thèse est d’étudier ces IS fongiques à la fois pour mieux cerner leurs places dans les thérapies anti-rejet d’organes et les maladies auto-immunes et leurs productions par des souches fongiques. Nous avons réalisé une synthèse bibliographique sur ces deux molécules et complété notre étude par des données recueillies auprès du CHU de Grenoble pour tenir compte des dernières évolutions.
Notre travail est organisé en quatre parties. La première partie se focalise sur la biologie générale des champignons. Les seconde et troisième parties décrivent les mécanismes d’action, la pharmacologie, les souches productrices et l’optimisation de la production du MPA et de la CsA respectivement. Enfin, une discussion générale comparant les deux molécules est abordée dans la dernière partie de cette thèse.
15
PARTIE 1 : GÉNÉRALITÉS SUR LES CHAMPIGNONS
1. Définition
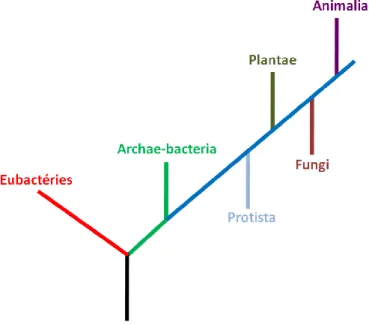
Les champignons (ou Fungi) représentent un règne à part entière dans la classification des êtres vivants. Ce sont des microorganismes extrêmement diversifiés et ubiquistes, présents dans tous les milieux. Le nombre exact d’espèces fongiques est inconnu, il est estimé entre 3,5 à 5,1 millions d’espèces (5). Environ seulement 2,5% des espèces ont été décrites, soit près de 100 000 espèces. Le règne Fungi est le règne le plus proche de celui des animaux, apparu il y a environ 400 millions d’années (6), après celui des Eubactéries, des Archaebactéries, des Protistes et des Plantes (Figure 2).
Figure 2: Evolution du monde vivant
Les champignons sont des organismes hétérotrophes, ils ont un appareil végétatif simple, le thalle, qui ne porte pas de cellules différenciées et ils possèdent une paroi composée principalement de chitine et de β-glucane. Ces caractéristiques les ont amenés à développer quatre modes de vie : le saprophytisme (développement au dépend de la matière organique en décomposition), le parasitisme (développement au détriment d’un organisme hôte), la symbiose (association entre deux organismes à bénéfice réciproque) et l’endophytisme (association asymptomatique entre deux organismes) (7).
16
2. Classification
Avec les progrès de la biologie moléculaire et les approches multigéniques, les analyses phylogénétiques ont permis de définir sept phyla (Figure 3) : Microsporidia, Chytridiomycota, Blastocladiomycota, Neocallimastigomycota, Glomeromycota, Ascomycota et Basidiomycota. Les taxons classiquement placés dans le phylum des Zygomycota sont maintenant répartis entre plusieurs « incertae sedis » sous phyla non encore totalement définis, notamment les sous phyla Mucoromycotina, Entomophthoromycotina, Kickxellomycotina et Zoopagomycotina (8).
17
2.1. Phylum des Microsporidia
Avec environ 1300 espèces décrites, ce phylum est caractérisé par des organismes unicellulaires, parasites intracellulaires obligatoires d’hôtes vertébrés ou invertébrés (9). Certaines espèces comme Enterocytozoon bieneusi ou Encephalotizoon intestinalis peuvent être responsables de troubles digestifs, rénaux et pulmonaires chez l’homme (10). Les microsporidies infectent les cellules hôtes par l’émission d’un tube polaire (11) (Figure 4). Elles ont un cycle de développement constitué d’une phase proliférative, avec formation des mérontes (cellules initiales issues de la division du cytoplasme de microsporidies = sporoplasme) qui se multiplient dans le cytoplasme de la cellule hôte, et d’une phase de différentiation qui se caractérise par le développement d’un système d’extrusion (tube polaire, polaroplaste et vacuole proliférative), la formation de la paroi, la lyse des cellules hôtes et le relargage des spores.
Figure 4: Cycle de vie de la microsporidie Trachipleis tophorahominis (12)
1: Infestation de la cellule hôte par la microsporidie grâce à son tube polaire; 2 à 4: Multiplication et production des mérontes; 5: Différenciation des mérontes en microsporidies;
18
2.2. Phylum des Chytridiomycota
Ce phylum est composé d’environ 1000 espèces de champignons primitifs dépourvus d’un appareil végétatif différencié (13). Le thalle est soit unicellulaire chez certaines espèces et se transforme entièrement en sporocystes, soit filamenteux siphonné chez d’autres espèces et développe un ou plusieurs sporocystes. Ces sporocystes à maturité produisent des zoospores flagellées mobiles (14). La classification actuelle fait de ce phylum un phylum polyphylétique (regroupement des espèces non héritées d’un ancêtre commun) (8).
2.3. Phyla des Blastocladiomycota et Neocallimastigomycota
Regroupés initialement dans le phylum de Chytridiomycota, ces deux phyla sont caractérisés exclusivement par des champignons possédant un thalle filamenteux siphonné produisant de nombreux sporocystes (8).
2.4. Sous Phyla des Mucoromycotina, Entomophthoromycotina, Kickxellomycotina et Zoopagomycotina
Ces quatre sous phyla regroupent des champignons anciennement classés dans le phylum des Zygomycota. Ils sont caractérisés par des thalles filamenteux sans cloisons transversales et possèdent des spores dépourvues de flagelles (8).
2.5. Phyla des Glomeromycota
Ce phylum est constitué d’environ 200 espèces présentant un mode de vie symbiotique, établissant une mycorhize arbusculaire avec la plante hôte. Ne représentant qu’une faible proportion des espèces fongiques, ce phylum joue pourtant un rôle écologique important dans le fonctionnement des écosystèmes (15). Le seul ordre des Glomérales est constitué d’espèces établissant des relations symbiotiques par endomycorhize avec plus de 90% des plantes (14,16).
19 Les espèces de ce phylum sont décrites comme capables de se reproduire uniquement par multiplication végétative. Cependant, des gènes impliqués dans la méiose ont été identifiés dans leur génome. Ces gènes conservés suggèrent une reproduction sexuée cryptique (17).
2.6. Sous règne des Dikarya
Ce sous règne est constitué des phyla des Ascomycota et des Basidiomycota et représente environ 98% des champignons décrits. Les deux modes de reproduction, asexuée et sexuée, coexistent chez ces champignons. Lors de la reproduction sexuée, ces champignons sont caractérisés par une phase dicaryotique longue par rapport aux autres phyla fongiques, résultant d’un décalage important entre la plasmogamie (fusion des cytoplasmes) et la caryogamie (fusion des noyaux) (14).
2.6.1. Phylum des Ascomycota
Les Ascomycota, constitués d’environ 64 000 espèces décrites, sont caractérisés par des thalles levuriformes ou filamenteux septés (7). La reproduction asexuée produit des spores asexuées ou conidies génétiquement identiques, alors que la reproduction sexuée produit des ascospores formées à l’intérieur de la cellule mère de spores appelée asque (Figure 5). Les asques sont libres chez certaines espèces ou intégrées à une structure : cléistothèce, périthèce, apothécie, chez d’autres espèces (18). Ce phylum regroupe de nombreuses espèces d’intérêt pharmaceutique (espèces des genres Penicillium, Aspergillus, Tolypocladium…), des espèces pathogènes (espèces des genres Candida, Aspergillus…), des espèces d’intérêt biotechnologique (espèces des genres
Saccharomyces, Pichia…) ou encore des espèces macromycètes comestibles (espèces des genres Tuber, Morchella…).
20
Figure 5: Cycle de reproduction des Ascomycota (19)
2.6.2. Phylum des Basidiomycota
Ce phylum regroupe environ 31 500 espèces dont la plupart des champignons macroscopiques à carpophore, partie visible des champignons appelée « champignon » dans le langage courant (12). Les Basidiomycota possèdent des thalles levuriformes ou pluricellulaires filamenteux septés. Ils produisent, lors de la reproduction sexuée, des spores situées à l’extérieur de la cellule mère des spores ou baside (20) (Figure 6). Ce phylum regroupe par exemple des champignons pathogènes de l’homme (Cryptococcus neoformans, Phellinustropicalis), des champignons phytopathogènes (Puccinia striiformis, Coleosporium ipomoeae, Phellinus
sulphurascens), la plupart des champignons macroscopiques comestibles ou toxiques (Craterellus cornucopioides, Amanita phalloides).
21
Figure 6: Cycle biologique d’Agrocybe aegerita (21)
3. Les métabolites
La grande diversité des champignons se reflète par la diversité des métabolites qu’ils produisent. Ces métabolites sont les produits du métabolisme primaire et secondaire. La plupart de ces métabolites ont des activités biologiques qui peuvent être nocives (mycotoxines) ou bénéfiques (produits d’intérêt pharmaceutique) (22).
Les métabolites primaires sont indispensables à la survie d’un organisme et nécessaires aux fonctions essentielles de celui-ci, comme la croissance ou la reproduction. On trouve parmi ces métabolites les acides aminés, les acides nucléiques, les acides gras, etc.
Les métabolites secondaires ne sont pas indispensables aux fonctions physiologiques fondamentales de l’organisme mais lui procurent un avantage écologique. Les métabolites secondaires produits par les champignons sont variés, allant de molécules utilisées en thérapeutique comme les immunosuppresseurs, aux phytohormones servant de « moyen de communication » entre organismes. Ces métabolites secondaires appartiennent majoritairement
22 aux classes chimiques suivantes : les alcaloïdes, les peptides non ribosomiques, les polycétides et les terpènes (23,24) (Figure 7).
23
3.1. Les alcaloïdes
Les alcaloïdes sont des molécules principalement dérivées des acides aminés comme par exemple la lysine, la tyrosine ou encore l’arginine (22). Du fait de leur origine variée et des différentes enzymes impliquées dans leur production, les alcaloïdes forment une classe très hétérogène, dont la caractéristique commune est la présence d’une fonction basique azotée souvent incluse dans un hétérocycle (25). Cet hétérocycle provient de l’acide aminé précurseur de la synthèse.
Parmi les différentes classes d’alcaloïdes, les alcaloïdes indoliques (possédant un noyau indole, c'est-à-dire un cycle aromatique accolé à un cycle de 4 atomes de carbone et 1 d’azote) représentent une grande partie des métabolites secondaires chez les champignons. Ils sont généralement dérivés du tryptophane et du diméthylallyl-pyrophosphate. L’acide lysergique est un exemple d’alcaloïde indolique. Sa voie de biosynthèse est maintenant bien établie et commence par la prénylation (transfert d’un isoprénoïde, le diméthylallyl-pyrophosphate ici) du tryptophane
via la diméthylallyl-tryptophane synthétase (DMATS) (Figure 8). Après la méthylation du produit
formé, plusieurs étapes d’oxydation vont permettre la formation de l’acide lysergique précurseur de nombreux métabolites secondaires fongiques : l’ergotamine et tous ses dérivés (ergoblastine, ergocryptinine, ergométrine, etc) (26).
24
Figure 8: Exemple de biosynthèse d’un alcaloïde indolique : l’acide lysergique (26)
DMATS = diméthylallyl-tryptophane synthétase
3.2. Les terpènes et les terpénoïdes
Les terpènes sont une famille d’hydrocarbures dérivés de l'isoprène. On les trouve essentiellement chez des plantes à résine. Les champignons sont également capables d’en produire comme par exemple les caroténoïdes, les gibbérellines, les indole-diterpènes ou les trichothécènes (27).
La voie de biosynthèse des terpènes chez les champignons commence par la condensation de trois molécules d’acétyl-coenzyme A (acétyl-CoA) pour former le mévalonate. Une série de réactions de phosphorylation et de carboxylation sur le mévanolate va aboutir à la formation de deux isomères : le diméthylallyl-pyrophosphate (DMAPP) et l’isopentényl-pyrophosphate (IPP). La synthèse des précurseurs à l’origine des terpènes se réalise par condensation d’une molécule d’IPP sur le DMAPP (monoterpènes), de 2 molécules d’IPP sur le DMAPP (sesquiterpènes) ou de 3 molécules d’IPP sur le DMAPP (diterpènes) (28) (Figure 9).
25
26 Les terpènes sont ainsi constitués de plusieurs unités isoprènes formant une molécule linéaire ou cyclique. Ils sont classés selon le nombre d’unités isoprènes les constituant (Tableau I). Les terpènes de plus de huit unités isoprènes sont appelés polyterpènes. Les terpénoïdes ont des structures analogues aux terpènes, mais possèdent en plus des atomes d’oxygène. Les terpénoïdes présentent des groupements alcools, aldéhydes, cétones ou acides carboxyliques à l’origine d’une plus grande diversité structurale et fonctionnelle par rapport aux terpènes (29).
Tableau I : Classification des terpènes selon le nombre d’unité isoprène.
Par leurs diversités, les terpènes et les terpénoïdes ont des propriétés variées : olfactives et gustatives (limonène, menthol, isobornéol), nutritives (vitamine A ou acide rétinoïque) ou encore thérapeutiques (composants principaux des huiles essentielles, l’artémisinine contre le paludisme (30), l’isotrétinoïne dans le traitement de l’acné (31)). De plus, les terpènes ou leurs dérivés sont étudiés pour des traitements anticancéreux (acide oléanique) (32) ou antidiabétiques (acide ursolique) (33).
3.3. Les polycétides
Les polycétides sont les métabolites secondaires fongiques les plus abondants. Ils sont produits par des polycétides synthétases (PKS) et constituent une famille de molécules très diverses. Les polycétides sont également produits par les plantes et les bactéries. Un grand nombre de ces molécules possèdent des activités pharmacologiques et sont à la base de près d’un tiers des
Nombre d’unités isoprènes Nombre d’atomes de carbone Classification Unité isoprène (2-méthylbut-1,3-diène) 1 5 Hémiterpène 2 10 Monoterpène 3 15 Sesquiterpène 4 20 Diterpène 5 25 Sesterterpène 6 30 Triterpène 8 40 Tetraterpène > 8 > 40 Polyterpène
27 médicaments actuels (22,34); comme par exemple la lovastatine (hypocholestérolémiant) (35), les avermectines (antiparasitaire) (36) ou encore l’acide mycophénolique (immunosuppresseur) (37).
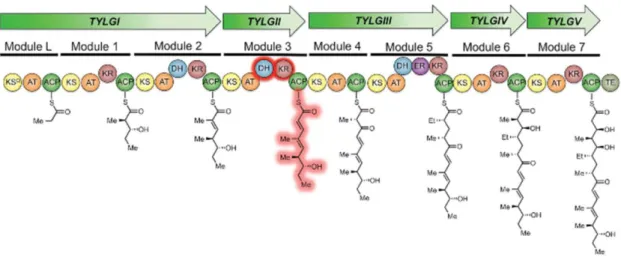
Les PKS constituent une famille enzymatique possédant plusieurs modules, eux-mêmes constitués de plusieurs domaines. Certains domaines sont retrouvés dans toutes les PKS comme : l’acyltransférase (AT), la kétosynthase (KS) et l’acyl carrier protein (ACP). D’autres domaines sont facultatifs : la déshydratase (DH), l’énoylréductase (ER), la thioestérase (TE), la cyclase (CYC), la méthyltransférase (MT) et la kétoréductase (KR) (38,39) (Figure 10).
Figure 10: Fonctionnement des polycétides synthases (40)
La biosynthèse des polycétides ressemble à celle des acides gras et consiste généralement en la condensation d’acétyl-CoA (unité d’initiation) avec des acyl-CoA (unité d’élongation, souvent le malonyl-CoA). La synthèse commence au niveau du domaine ACP sur lequel est greffé l’acétyl-CoA d’initiation. Le domaine AT apporte les unités acyl-CoA d’élongation. Ensuite, agissent les modules complémentaires KR, DH et ER pour réduire le groupement cétone à différents niveaux. Ainsi, à l’inverse des acides gras, les β-cétones des polycétides ne sont pas forcément totalement réduites. Le polycétide en formation est alors transféré sur l’ACP du deuxième module grâce au domaine KS et la synthèse continue avec la condensation d’un nouvel acyl-CoA. Le passage de module en module permet l’élongation séquentielle de la chaîne carbonée. De plus, à certains moments de la synthèse, peuvent intervenir les domaines CYC ou MT pour apporter une modification à la molécule. Enfin, à la fin de la synthèse, le dernier module libère le polycétide de la PKS par l’action de son domaine TE. Le nombre de modules, leurs ordres dans la synthèse et leurs compositions permettent d’obtenir des polycétides différents.
28
3.4. Les peptides non ribosomiques
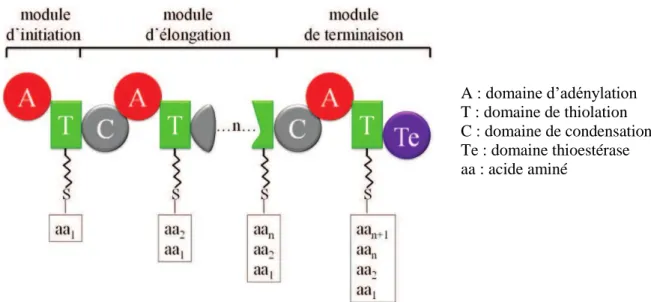
Les peptides non ribosomiques (NRP) sont produits par les « non ribosomal peptide synthetases » (NRPS) et sont retrouvés aussi bien chez les bactéries que les champignons, mais pas chez les plantes. La biosynthèse des NRP repose sur l’ajout d’acides aminés protéinogènes (acides aminés pouvant être incorporés dans la protéine lors de la traduction de l’ARNm), et non protéinogènes. Les « non ribosomal peptide synthetases » sont composées de différents modules, de deux à une vingtaine, dont chacun permet l’incorporation d’un acide aminé ciblé dans le peptide en formation. Les modules sont composés de domaines catalytiques ayant chacun une fonction précise et séquentielle pour la production du peptide : activation de l’acide aminé à incorporer (par le domaine d’adénylation), élongation de la molécule peptidique (par le domaine de thiolation), formation d’une liaison peptidique (par le domaine de condensation). Le module de terminaison possède en plus des trois domaines catalytiques, le domaine thioestérase qui permet la libération du peptide formé (41) (Figure 11).
Figure 11: Schéma d'une enzyme de synthèse de peptide non ribosomique (NRPS = Non-Ribosomal Peptide Synthetase) (41)
Les modules composés chacun des domaines catalytiques A, T et C permettent la synthèse du NRP jusqu’à sa libération par le domaine Te.
A : domaine d’adénylation T : domaine de thiolation C : domaine de condensation Te : domaine thioestérase aa : acide aminé
29 Les NRP possèdent diverses activités biologiques et pharmacologiques (Figure 12). Parmi les NRP utilisés en thérapeutique, on trouve la vancomycine (42) ou la gramicidine S (43) (antibiotiques), la bléomycine A2 (44) (traitement des cancers d’organes génitaux) ou encore la ciclosporine A (45) (immunosuppresseur).
30
PARTIE 2 : L’ACIDE MYCOPHENOLIQUE
L’acide mycophénolique a été découvert en 1893 par Bartolomeo Gosio, scientifique italien. Au fil des années, cette molécule a occupé une place importante dans le groupe des immunosuppresseurs grâce notamment à son mécanisme d’action. Nous traiterons dans cette partie les mécanismes d’action du MPA, ses effets pharmacologiques et sa production par les souches fongiques.
1. Mécanismes d’action du MPA
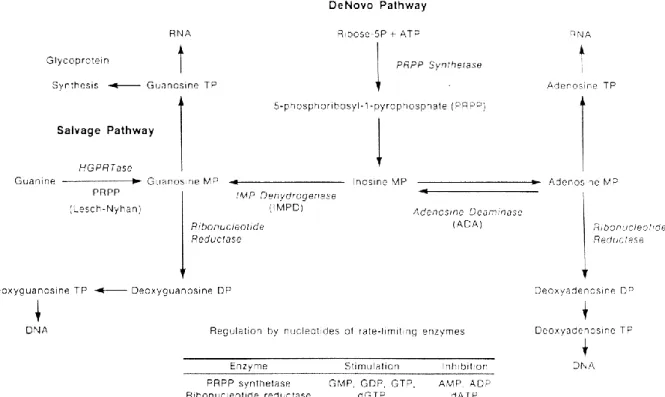
1.1. Voies de biosynthèse des purines
En 1968, pour la première fois, une hypothèse est faite concernant le mode d’action du MPA : il inhiberait l’inosine-5′-monophosphate déshydrogénase (IMPDH), enzyme catabolisant la transformation d’un nucléotide, l’inosine monophosphate (IMP) en guanosine monophosphate (GMP) (46). Cette hypothèse sera par la suite confirmée (37).
Le MPA agit au niveau de la voie de biosynthèse des purines, molécules hétérocycliques comprenant les bases nucléiques adénine et guanine, qui entrent dans la composition des acides nucléiques. Cette voie de biosynthèse se décompose en deux branches principales : la voie de novo et la voie de secours.
La voie de novo utilise des métabolites primaires, comme les acides aminés ou les sucres, pour la synthèse des nucléotides puriques. Cette voie fait intervenir plusieurs séries de réactions. La première série aboutit à la formation du 5-phosphoribosyl-1-pyrophosphate (PRPP) à partir d’un ribose grâce à la PRPP synthétase. La deuxième série de réactions permet d’obtenir l’IMP à partir du PRPP.
L’IMP est le précurseur de l’AMP (adénosine monophosphate) et du GMP (guanosine monophosphate) (Figure 13). L’AMP est formée par l’addition d’une molécule d’aspartate sur l’IMP suivie de la libération d’un groupement fumarate, réaction faisant intervenir l’adénosine désaminase. Pour le GMP, il y a oxydation de l’IMP aboutissant à la formation du xanthylate (XMP), suivie de l’incorporation d’un groupement amine dérivé de l’hydrolyse d’une glutamine
31 (47). C’est au niveau de cette voie de formation du GMP qu’on retrouve l’IMPDH qui catalyse l’oxydation de l’IMP en XMP. L’IMPDH représente l’enzyme limitante de la synthèse des nucléotides guanosidiques (46).
Figure 13: Synthèse de l’AMP et du GMP à partir de l’inosinate monophosphate (47)
La voie de secours, quant à elle, recycle des bases puriques provenant de la dégradation d’acides nucléiques et de nucléotides. Pour cela, deux enzymes aux spécificités différentes sont nécessaires. Chacune catalyse la liaison d’un nucléoside purique (l’une l’adénosine et l’autre la guanosine ou l’inosine) au PRPP, pour former le nucléotide purique monophosphate correspondant avec relargage d’un pyrophosphate (PPi) (47).
Adénosine + PRPP AMP + PPi Adénine phosphoribosyltransférase Guanosine + PRPP GMP + PPi Hypoxanthine-guanine phosphoribosyltransférase (HGPRT) Inosine + PRPP IMP + PPi HGPRT
32 La plupart des cellules de l’organisme utilisent ces deux voies de biosynthèse, contrairement aux lymphocytes B et T qui sont fortement dépendants de la voie de novo. Nous verrons par la suite les bénéfices que peut apporter cette caractéristique des lymphocytes quant à l’utilisation du MPA en thérapeutique.
1.2. Voies d’action du MPA
Le MPA possède un effet immunosuppresseur principalement par son action sur les lymphocytes B et T, mais également par son action sur d’autres types cellulaires. Le MPA possède également un effet anti-inflammatoire. Des mécanismes différents sous-tendent ces deux types d’effets du MPA dans l’organisme.
1.2.1. Les effets sur la voie de novo 1.2.1.1. Inhibition de l’IMPDH
L’inhibition de l’IMPDH par le MPA engendre une diminution de la formation de GMP ainsi que de ses dérivés, et par conséquent une réduction de la synthèse d’ADN (Figure 14). Dans les cellules dépendantes uniquement de la voie de novo pour la synthèse de purines monophosphates, le déficit en purines ne pourra pas être compensé, entraînant ainsi l’inhibition de la prolifération cellulaire. Cette situation se retrouve chez les lymphocytes T et B. En effet, ces derniers sont davantage dépendants de cette voie par rapport à d’autres types cellulaires (Figure 15). Néanmoins, à certaines concentrations qui peuvent être atteintes dans la pratique clinique (1000-10000 nM) (46), le MPA inhibe aussi la multiplication des cellules musculaires lisses artérielles et des fibroblastes ; ceci peut avoir un intérêt dans la prévention du rejet chronique après une greffe. En effet, le rejet chronique peut être associé à une artériopathie proliférative et oblitérante du greffon ainsi qu’à une fibrose interstitielle (46).
33
Figure 14: Voie de biosynthèse des purines montrant la position centrale de l’Inosine Monophosphate (48)
Figure 15: Effet antiprolifératif du MPA sur différents types cellulaires (46)
PBL = lymphocytes T et B périphériques humains ; FIB = fibroblastes dermiques humains ; EC = cellules endothéliales de veine ombilicale humaines ; PHA=phytohémagglutinine;
34 La diminution de la formation de GMP a également d’autres effets au niveau de l’organisme. En effet, le GMP agit comme régulateur de diverses réactions (glycosylation de protéines, synthèse de l’oxyde nitrique, etc), et intervient dans la transduction des signaux cellulaires.
1.2.1.2. Les isoformes de l’IMPDH
Il existe deux isoformes de l’IMPDH, l’IMPDH-I et l’IMPDH-II, chez l’homme et chez d’autres espèces (souris, hamster et levure Saccharomyces cerevisiae) (37). Ce sont toutes les deux des protéines de 514 acides aminés possédant 84% de similarité. Elles sont tétramériques, constituées de 4 sous-unités identiques de 56 kDa (37). Cependant, elles se distinguent par :
- leur localisation cellulaire : la plupart des cellules expriment l’isoforme I alors que l’isoforme II est exprimée chez les lymphocytes T et B activés ;
- leur sensibilité au MPA : l’isoforme II est environ cinq fois plus sensible que l’isoforme I. Ces caractéristiques expliquent l’effet inhibiteur du MPA principalement sur les lymphocytes B et T.
1.2.2. Induction de l’apoptose
Le MPA induit l’apoptose des lymphocytes T activés. En effet, lorsqu’on cultive des leucocytes humains activés, on observe 24% de cellules apoptotiques après 72 heures de culture. Ce taux augmente et atteint 67% en présence de 0,5 μM de MPA, alors qu’il reste stable à 25% en présence de 0,5μM de MPA associé à 20μM de guanosine (46). Ainsi, puisque le MPA entraîne l’apoptose des cellules T répondant à une activation de leurs récepteurs, des mécanismes comparables se produisent lors d’une stimulation antigénique des cellules T. Ces mécanismes sont à l’origine de la tolérance, envers les allo-antigènes, des patients allogreffés et traités avec du MPA.
35
1.2.3. Inhibition de la glycosylation et de l’expression des molécules d’adhésion
Au cours d’une réaction inflammatoire, les cellules immunitaires circulant dans le sang doivent traverser la barrière endothéliale pour atteindre les sites inflammatoires. Ce processus est appelé diapédèse. La qualité et la rapidité de ce recrutement sont essentielles pour l’efficacité de la réponse immunitaire (49). La diapédèse se déroule en plusieurs étapes distinctes faisant intervenir des molécules d’adhésion :
Etape 1 : expression des molécules d’adhésion dans les cellules leucocytaires et endothéliales.
Après leur synthèse dans le cytoplasme des leucocytes et des cellules endothéliales, les protéines d’adhésion (Tableau II) spécifiques à chaque type de cellules subissent une glycosylation dans le réticulum endoplasmique et dans l’appareil de Golgi. Puis, elles sont transloquées pour se localiser sur la membrane plasmique des cellules correspondantes.
Tableau II: Molécules d’adhésion des leucocytes et leurs ligands endothéliaux correspondants (46)
Etape 2 : interaction entre leucocytes et cellules endothéliales.
Les leucocytes circulant dans les vaisseaux se fixent aux cellules endothéliales par liaisons entre leurs molécules d’adhésion et celles des cellules endothéliales. Après fixation, les leucocytes traversent l’endothélium (Figure 16).
36
Figure 16: Mécanisme de la diapédèse leucocytaire (50)
Le trafic intracytoplasmique des molécules d’adhésion et leur glycosylation sont régulés par des enzymes dépendantes du GTP. La glycosylation des protéines d’adhésion passe par l’intermédiaire de nucléotides. Plus précisément, le glucose et le galactose utilisent un dérivé diphospho-uridine pour leur transfert sur ces protéines tandis que le fucose et le mannose utilisent un dérivé diphospho-guanosine dont la synthèse dépend de l’IMPDH.
L’effet inhibiteur du MPA sur l’IMPDH se traduit par une diminution du GTP et des dérivés diphospho-guanosines conduisant à la diminution du recrutement des leucocytes sur les sites inflammatoires par baisse d’expression des molécules d’adhésion (Figure 17). Par ce biais, le MPA possède un effet anti-inflammatoire contribuant à éviter le rejet du greffon.
37
Figure 17: Effet du mycophénolate mofétil (MMF) (= MPA) sur la pénétration des lymphocytes T (CD4 ou CD8) à travers la barrière endothéliale (48)
1.2.4. Inhibition sélective de l’Oxyde Nitrique Synthase (NOS)
L’oxyde nitrique synthase est une enzyme qui existe sous trois formes dans l’organisme : les formes neuronale et endothéliale qui sont produites de façon constitutive (cNOS), et la forme inductible (iNOS) qui se trouve dans les macrophages et les cellules endothéliales activées (48).
C’est une enzyme qui permet la synthèse de l’oxyde nitrique (NO), ou monoxyde d’azote, à partir de la L-arginine. Le NO est un médiateur important dans de multiples réactions de l’organisme. Il agit comme vasodilatateur ou neurotransmetteur lorsqu’il est produit par la cNOS. Produit par l’iNOS, situation retrouvée sur les sites inflammatoires, le NO favorise l’apoptose en modulant les facteurs régulateurs apoptotiques (augmentation de p53 et Bax ; diminution de Bcl-2 et Bcl-X1). En parallèle, les macrophages activés sur le site inflammatoire augmentent leur production d’ion superoxyde (O2-), capable de se complexer au NO pour former du péroxynitrite, molécule provoquant des dommages intracellulaires (cytotoxicité, nitration des protéines) pouvant conduire à l’apoptose (46).
La régulation de la NOS est variable selon sa nature. La production des formes constitutives cNOS est régulée par l’ion Ca2+
et la calmoduline, engendrant une faible production de NO durant une petite période seulement. En ce qui concerne l’iNOS, sa transcription est induite
38 par des cytokines (INF-γ, TNF-α) et son activité est positivement contrôlée par la concentration d’un cofacteur, la tétrahydrobioptérine (BH4), qui dérive du GTP. En présence de ces molécules, le NO est produit en grande quantité pendant un plus grand laps de temps (46), (48).
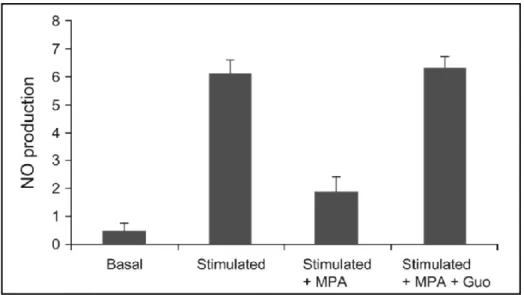
Le MPA agit sur l’iNOS (Figure 18) par deux biais. D’une part, il stoppe la sécrétion de cytokines par les lymphocytes et les monocytes résultant en une diminution des taux d’INF-γ et de TNF-α et par conséquent de la transcription de l’iNOS. D’autre part, la déplétion en GTP provoquée par le MPA entraîne une diminution de l’activité de l’iNOS par la diminution de la concentration de son co-facteur, le BH4 (46), (48).
Figure 18: Effet du MPA sur la production induite de NO par des cellules endothéliales activées en culture (48)
Guo = guanosine
Cette action du MPA est retrouvée en thérapeutique humaine puisque la concentration inhibitrice 50 (CI50) du MPA se situe entre 0,5 et 1 mM, taux rapidement atteint en pratique clinique. Néanmoins, les mécanismes ci dessus n’affectent pas la forme constitutive de l’oxyde nitrique synthase donc le MPA n’aura pas d’effet sur la production basale de monoxyde d’azote.
39
1.2.5. Effet sur les cellules dendritiques
Les cellules dendritiques sont les principales cellules présentant des antigènes aux lymphocytes T, particulièrement lors de la réponse immunitaire primaire. Pour une présentation antigénique efficace, les cellules dendritiques doivent être matures, cela se traduit par une augmentation de l’expression de molécules du complexe majeur d’histocompatibilité (CMH) et de molécules de co-stimulation (CD40, CD86). Le MPA inhibe la capacité des cellules dendritiques à présenter les antigènes en supprimant leur processus de maturation et leurs fonctions d’allo-stimulation (48).
Pour conclure, le MPA agit sur différents processus de l’organisme (Figure 19). Il possède deux propriétés : immunosuppressive et anti-inflammatoire lui conférant une place importante dans la stratégie thérapeutique anti-rejet.
Figure 19: Les mécanismes d’action du MPA
MPA
Inhibition de l'IMPDH Induction d'apoptose des lymphocytes T Diminution du recrutement lymphocytaire Inhibition de l'iNOS Inhibition du rôle des cellules dendritiques40
2. Effets pharmacologiques du MPA
Le MPA est une molécule capable d’inhiber l’IMPDH, enzyme impliquée dans la synthèse
de novo des guanines. La prolifération des lymphocytes dépend essentiellement de cette voie de novo, alors que les autres cellules de l’organisme peuvent utiliser la voie de secours et proliférer
en présence du MPA (46). Il existe dans la littérature une autre molécule, l’azathioprine (AZA), capable d’inhiber l’IMPDH ; mais contrairement au MPA, l’AZA et ses métabolites agissent également sur d’autres voies de biosynthèse (48). Ainsi, le MPA a un effet cytostatique spécifique sur les lymphocytes. Cet effet lui confère des propriétés immunosuppressives intéressantes car spécifiques aux lymphocytes.
2.1. Propriétés immunosuppressives du MPA
L’acide mycophénolique est à l’heure actuelle commercialisé sous deux molécules (pro-drogues) différentes : le mycophénolate mofétil (MMF) sous le nom de Cellcept® par les laboratoires Roche ; et le mycophénolate sodique (MPS) sous le nom de Myfortic® par l’entreprise pharmaceutique Novartis. Ces deux molécules sont équivalentes sur le plan thérapeutique (51Ŕ53) et sont métabolisées en acide mycophénolique dans le foie (Figure 20 et Figure 21). Il existe également différentes formes pharmaceutiques : gélules, comprimés, suspension buvable et solution pour perfusion (MMF chlorhydrate).
41
Figure 20: Structure des molécules d’acide mycophénolique, de mycophénolate mofétil et de mycophénolate sodique.
Figure adaptée depuis Allison et al. 2000 (46) et du site de l’Académie nationale de Pharmacie (54)
Figure 21: Voies de métabolisation du mycophénolate sodique et du mycophénolate mofétil en acide mycophénolique (55)
42 L’autorisation de mise sur le marché (AMM) pour ces deux médicaments stipule une indication dans le cadre de la prévention du rejet du greffon dans les allogreffes rénales en association avec la ciclosporine et les corticoïdes. Le Cellcept® est également indiqué dans les allogreffes cardiaques et hépatiques. La Haute Autorité de Santé (HAS) considère que ces deux molécules, le MMF et le MPS, apportent un important service médical rendu (SMR) ainsi qu’une amélioration nette du service médical rendu (ASMR) par rapport à l’azathioprine. Le MPA est une molécule de première intention dans la prévention du rejet d’allogreffes cardiaque, hépatique et rénale. Ces molécules sont toutefois soumises à une prescription initiale hospitalière de 6 mois.
La justification de l’utilisation de MPA dans la prévention du rejet de greffe est liée aux résultats des essais cliniques obtenus avec le MMF et le MPS. Ils montrent une amélioration significative de la survie des patients et une baisse significative du rejet du greffon par rapport à l’association médicamenteuse en vigueur : la ciclosporine + les corticoïdes + l’AZA (56Ŕ58). Par exemple, les études réalisées par l’« European Mycophenolate Mofetil Cooperative Study Group » (56) ont montré que sur 491 patients ayant subi une transplantation rénale et sous traitement par la ciclosporine et les corticostéroïdes, seulement 17% ou 13,8% des patients qui ont reçu respectivement 2g ou 3g de MMF présentaient un rejet de greffe contre 46,8% des patients sous placebo. De la même façon, le «The Tricontinental Mycophenolate Mofetil Renal Transplantation Study Group » (57) a réalisé une étude sur 503 patients ayant reçu une allogreffe rénale. Tous les patients étaient traités par l’association ciclosporine et corticostéroïdes. Les patients ont reçu en plus, 3g de MMF (164 patients), 2g de MMF (173 patients) ou 100-150 mg d’AZA (166 patients). Les résultats après 12 mois de traitement ont montré des taux de rejet de greffe significativement inférieurs, 15.9% et 19.7% pour les patients qui ont été traités respectivement par 3 et 2 g de MMF, en comparaison à ceux observés chez les patients traités par l’AZA (35,5%).
De nombreuses études ont été menées ultérieurement pour valider l’efficacité du MMF (59,60), dont certaines sont reprises par la commission de transparence de la HAS dans sa délibération du 18 décembre 2002 (voir Tableaux III à VII). Ces études montrent une diminution du rejet aigu (31% à 38% vs 51% à 58%) et à long terme (14,4% vs 18,1%) du greffon rénal lorsque le MMF remplace l’AZA dans l’association inhibiteur de la calcineurine (CNI) + corticoïdes + MMF ou AZA. Les résultats chez les enfants sont comparables à ceux des adultes. Les mêmes résultats ont été observés lors des greffes hépatiques. Pour la greffe cardiaque, la survie trois ans après la greffe est augmentée par le remplacement de l’AZA par le MMF (86% vs 91%). La HAS réaffirme la place du MMF dans la prévention du rejet du greffon. Ainsi, le MMF reçoit sa première AMM en 1996 pour la prévention du rejet de l’allogreffe rénale chez l’adulte, et
43 en 2001 chez les enfants de plus de deux ans et les adolescents. L’AMM est étendue respectivement en 1998 et 2000 pour les allogreffes cardiaques et hépatiques (61).
Tableau III : Efficacité du Cellcept® pour la prévention du rejet de greffon après transplantation rénale chez l’adulte. Données de l’HAS.
Tableau IV: Efficacité du Cellcept® pour la prévention du rejet de greffon après transplantation rénale chez l’enfant. Données de l’HAS.
Tableau V: Efficacité du Cellcept® pour la prévention du rejet de greffon après transplantation cardiaque chez l’enfant. Données de l’HAS.
44
Tableau VI: Survie des patients adultes à trois ans après transplantation cardiaque et traités par Cellcept®. Données de l’HAS.
Tableau VII: Efficacité du Cellcept® pour la prévention du rejet de greffon après transplantation hépatique chez l’adulte. Données de l’HAS.
Les études réalisées par la suite sur le MPS (Myfortic®) ont montré des résultats similaires à ceux obtenus avec le MMF (Cellcept®) lors de greffes rénales (62), (63). Par exemple, Salvatori et al.(52) ont montré que l’efficacité du MMF et du MPS, objectivée par le taux de rejet du greffon ou de mort des patients, est statistiquement non différente pour les deux molécules (26,2% vs 25,8%). De même, la tolérance au traitement est similaire (98,1% d’effets indésirables dans les deux cas, avec 41% vs 38% d’effets indésirables graves). La nature des effets indésirables (infections, gastro-intestinaux, hématologiques, etc) est également similaire. L’AMM dans la transplantation rénale est donnée en 2003 pour le Myfortic® (MPS). Bien que des études montrent une équivalence thérapeutique entre le MPS et le MMF dans le cas des transplantations cardiaques (63) et hépatiques (64), le Myfortic® n’a pas d’AMM pour ces deux indications.
Des études plus récentes réalisées par Maripuri et al. (2014) ont remis en question la prévalence de l’efficacité du MPA sur l’AZA. Il n’y aurait pas de différence sur le taux de survie à long terme (65). Cependant, dans ces études, seules les données de la transplantation rénale ont été prises en considération.
45
2.1.1. Utilisation du MPA
Le Cellcept® existe sous forme de comprimés de à 250 mg et 500 mg, de poudre pour suspension buvable et de poudre pour solution de perfusion. Des laboratoires génériques (EG, Biogaran, Accord Healthcare, Mylan, Sandoz et Téva) ont développé des comprimés de MMF aux deux dosages. Le Myfortic® existe sous la forme de comprimés à deux dosages : 180 mg et 360 mg. Le MPS étant encore protégé par un brevet, aucun générique n’existe pour le moment pour cette molécule.
2.1.2. Posologies
2.1.2.1. Transplantation rénale
La posologie habituelle, chez l’adulte, du MMF (Cellcept®
) est de 2 g/j répartis en deux prises. Cette posologie correspond à la prévention du risque aigu de rejet du greffon et est adaptée selon la réponse des patients au traitement (augmentation possible ou diminution si trop d’effets indésirables). Un changement de traitement pour le MPS ou l’azathioprine est possible en cas de non tolérance au MMF.
La posologie chez les enfants est de 600 mg/m2 de surface corporelle, avec un maximum de 2 g/j et une prise bi-quotidienne. Le MMF n’est pas recommandé chez les patients de moins de 1,25 m2 de surface corporelle.
Le MPS (Myfortic®) est administré à la dose de 1440 mg/j en deux prises correspondant à une prise de 2 g/j de MMF en équivalent de MPA disponible. Le MPS n’est pas recommandé chez les enfants.
Une diminution progressive des doses est effectuée après 6 mois à un an de traitement mais compte tenu du caractère très particulier de ce type de traitement, les ajustements de dose sont patient-dépendants.
46
2.1.2.2. Transplantation cardiaque
La dose recommandée de MMF (Cellcept®) dans les cas de transplantation cardiaque est de 3 g/j prise en deux fois. Il n’existe pas de recommandation pour les enfants. Les doses sont à diminuer au cours du temps selon un protocole patient-dépendant.
2.1.2.3. Transplantation hépatique
La dose recommandée de MMF dans les cas de transplantation hépatique est de 3 g/j per os prise en deux fois. Il n’existe pas de recommandation pour les enfants. Les doses sont à diminuer au cours du temps selon un protocole patient-dépendant.
2.2. Indications hors AMM
Le MPA a montré également une efficacité intéressante dans des maladies auto-immunes ou apparentées, notamment dermiques (66). Nous avons choisi de ne pas traiter dans cette thèse :
les maladies dont les essais cliniques ne sont pas encore validés par la HAS ;
la dermatomyosite, l’épidermolyse bulleuse acquise et la sclérodermie généralisée évolutive au vue du faible niveau de données solides et d’apports thérapeutiques du MPA dans ces maladies ;
le purpura thrombopénique immunologique car le MPA n’offre pas d’alternatives intéressantes par rapport aux nombreux autres traitements disponibles.
2.2.1. Lupus systémique
Le lupus systémique (LS), encore appelé lupus érythémateux disséminé, est une maladie auto-immune capable d’affecter plusieurs organes (poumons, reins, etc). Les symptômes sont divers et généralement aspécifiques (Figure 22). C’est une pathologie encore mal comprise, caractérisée par la production excessive d’anticorps spécifiques ou auto-anticorps dirigés contre
47 les cellules de l’organisme qui les produit. Cette production excessive d’auto-anticorps génère des réactions inflammatoires et des lésions des tissus. Les symptômes les plus communs du LS sont les manifestations cutanées, particulièrement des rougeurs au niveau des yeux, des pommettes et du nez donnant un aspect de « masque en forme de papillon ». Selon les organes atteints, une multitude d’autres symptômes peuvent apparaître dans le cadre du LS. Le LS toucherait entre 25 000 à 30 000 patients en France, avec une prédominance chez les femmes.
Figure 22: Symptômes les plus courants du lupus systémique (67)
Le traitement du LS repose essentiellement sur l’hydroxychloroquine ou la chloroquine, associée à des corticoïdes ou des AINS (anti-inflammatoires non stéroïdiens). Si le MPA n’est pas indiqué comme traitement de fond pour cette maladie, il est toutefois utile dans certaines atteintes spécifiques : la pneumopathie interstitielle chronique (en association avec des corticoïdes), la glomérulonéphrite lupique (en association avec des corticoïdes), l’hypertension artérielle pulmonaire (HTAP) (en association avec des corticoïdes et un vasodilatateur spécifique de l’HTAP), les anémies hémolytiques auto-immune (AHAI) (voir paragraphe 2.2.2) et le syndrome des poumons rétractés (en association avec de la kinésithérapie et si un traitement à base de corticoïdes a échoué) (68).
48
2.2.2. Les anémies hémolytiques auto-immunes (AHAI)
Les AHAI sont des maladies auto-immunes majoritairement chronique dont la cause peut être multiple : lupus, médicaments (fludarabine), infections, leucémie, etc. Elles sont caractérisées par la destruction accélérée des érythrocytes (hémolyse) par des anticorps dirigés contre des éléments de leur membrane. Cette hémolyse conduit à une anémie sévère. Il existe deux types principaux d’AHAI, celles à anticorps « chauds », dont l’activité hémolytique des anticorps est maximale à 37°C, et celles à anticorps « froids », car plus actifs à basse température, autour de 30°C. Les deux formes d’AHAI répondent à deux traitements différents. Le MMF n’est actif que sur les AHAI à anticorps « chauds » et indiqué seulement en dernière ligne (Figure 23) ou avant dernière ligne chez l’enfant (Figure 24). Le MMF permet d’obtenir une réponse dans les 3 à 4 mois de traitement chez 50 à 60% des enfants (69).
49
Figure 23: Arbre décisionnel de traitement d’une AHAI à anticorps « chauds » chez l’adulte (69)
*réponse au moins partielle ; ** non réponse ; ***RC = rémission complète ; MMF = mycophénolate mofétil ; S4 = 4ème semaine
Le rituximab peut être prescrit en 1ère ligne en association aux corticoïdes chez le patient âgé souffrant de comorbidités (diabète, etc).
Si pas de splénectomie (refus ou contre-indication), les immunosuppresseurs sont prescrits en 3ème ligne.