THÈSE DE DOCTORAT
Présentée par
Larbi EL HAMMARI
Discipline : Chimie
Spécialité : Chimie Physique et Environnement
SYNTHESE ET ETUDES PHYSICO-CHIMIQUES DES PHOSPHATES DE CALCIUM POREUX GREFFES PAR DES MOLECULES ORGANIQUES : STRUCTURE ET
PROCESSUS D’ADSORPTION
Soutenue le 19 Juillet 2007
Devant le jury :
Président :
A. SAOIABI
:
Professeur à la Faculté des Sciences de RabatExaminateurs :
A. ZRINEH
:
Professeur à la Faculté des Sciences de RabatA. EL YAHYAOUI EL IDRISSI : Professeur à la Faculté des Sciences de Rabat
J. NAJA
:
Professeur à la Faculté des Sciences et Techniques de SettatA. LAGHZIZIL : Professeur à la Faculté des Sciences de Rabat
A. ZERIOUH : Professeur, Chef du Département de la Recherche Scientifique et Technique de l’Ecole Royale Navale-Casablanca
Invités :
M. FERHAT :Ancien Professeur à la Faculté des Sciences de Rabat
A. ALAOUI BENZAKROUM : Maître de recherche au CERPHOS-Casablanca
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tel +212 (0) 37 77 18 34/35/38, Fax : +212 (0) 37 77 42 61, http://www.fsr.ac.ma
UNIVERSITE MOHAMMED V- AGDAL
LA FACULTE DES SCIENCES DE RABAT
Dédicace
!
"
!
#
$% &
"
A mes
parents
'
(
A mes frères
et sœurs
A tous ceux qui me sont chers
A toute ma famille et mes ami(e)s
AVANT PROPOS
Le travail que nous présentons dans ce document a été mené au sein du laboratoire de Chimie Physique Générale à la Faculté des Sciences de Rabat, sous la direction des Messieurs les professeurs Ahmed SAOIABI et Abdelaziz LAGHZIZIL.
Au terme de ce travail, je tiens à remercier toutes celles et tous ceux qui ont participé à sa réalisation. Je remercie tout d'abord mes directeurs de thèse, les professeurs Ahmed SAOIABI et Abdelaziz LAGHZIZIL, qui ont encadré ce travail avec beaucoup d'intérêt et d'optimisme. Je les remercie également pour la patience dont ils ont fait preuve lors des multiples discussions et pour l’intérêt constant qu’ils ont manifesté pour mes recherches et leurs conseils éclairés au cours du développement de ce travail.
Ce travail a été réalisé en collaboration avec trois laboratoires Français, le Laboratoire d’Ingénierie Moléculaire pour la Séparation et les Applications des Gaz (LIMSAG), Université de Bourgogne, Dijon, France, Laboratoire de Physique de la Matière Condensée (PMC), Ecole Polytechnique, France et le Laboratoire de Chimie de la Matière Condensée (LCMC), Université Pierre et Marie Curie, Paris 6, Jussieu, France.
Je suis particulièrement reconnaissant à Messieurs les Professeur le Professeur Roger GUILARD (LIMSAG-Dijon), Jaques LIVAGE de LCMC (Paris VI), Philippe BARBOUX de PMC, et les auteurs Thibaud CORADIN de LCMC et Khalid LAHLIL de PMC, pour leurs collaborations et l’accueil chaleureux qu’ils m’ont réservé durant mes stages à Paris. Qu’ils trouvent ici l’expression de ma respectueuse gratitude pour leurs précieux conseils et leurs discussions fructueuses pendant mes séjours en France.
Je remercie profondément Monsieur A. SAOIABI, pour l’intérêt constant qu’il a porté à ce travail, Qu’il soit également très vivement remercié d’avoir accepté de présider le jury de cette thèse.
Je tiens à remercier Monsieur M. FERHAT, Ancien Professeur à la Faculté des Sciences de Rabat pour le grand honneur qu’il m’a fait en acceptant d’être membre du jury de cette thèse.
Je suis honoré que Monsieur A. EL YAHYAOUI EL IDRISSI, chef du Département de Chimie de la Faculté des Sciences de Rabat ait accepté d’être membre du jury de ce travail. Qu’il trouve ici l’expression de ma respectueuse gratitude.
Mes remerciements s’adressent à Monsieur A. ZRINEH, Professeur à la Faculté des Sciences de Rabat, autant que rapporteur de cette thèse et pour sa présence parmi les membres du jury, afin de juger le contenu de cette thèse.
des Sciences et Techniques de Settat (FSTS), en acceptant de faire partie du jury et d’être rapporteur de ce travail. Qu’il trouve ici l’expression de ma respectueuse gratitude.
Je voudrais remercier sincèrement A. ZERIOUH pour avoir contribué à l’examen de cette thèse et pour l’intérêt qu’il a porté à ce travail.
Mes remerciement vont également à Monsieur A. ALAOUI BENZAKROUM, maître de recherche et responsable du laboratoire de recherche ''structure et caractérisation physique'' au CERPHOS (OCP), Casablanca, pour l’honneur qu’il me fait en acceptant de se joindre aux membres du jury.
Mes remerciements s’adressent à Monsieur A. Laghzizil pour l’attention constante avec laquelle il a suivi mes travaux de recherche et pour ses précieuses discussions scientifiques.
Mes meilleurs sentiments d’amitié s’adressent à tous les membres du Laboratoire de Chimie de la Matière Condensée (LCMC), Paris 6, Jussieu qui m’ont toujours réservé un accueil chaleureux pendant mon séjour à Pais et en particulier, Mme S. Cassaignon, C. Roux, S. Masse, G. Laurent, J. Allouche, S. Pega et L. G. Patrick, qui ont toujours été là pour m'aider au cours de mes stages à l’Université Pierre et Marie Curie, Paris 6.
Je tiens également à remercier, Messieurs M. Meyer, S. Brandez, J. M. Barbe et C. Suspène de LIMSAG pour le soutien qu’ils m’ont réservé au cours de mes stages à Dijon et Mademoiselle L. Pautrot-d'Alençon pour son aide au cours de la réalisation de quelques expériences au PMC.
Tous les stages que j’ai effectués au cours de la préparation de cette thèse étaient financés par l’Agence Universitaire de la Francophonie (AUF) dans le cadre d’une Bourse de Formation à la Recherche, d’une durée de 3 ans. Cette Bourse m’a été attribuée dans le cadre d’une collaboration cosignée par Monsieur le Professeur Roger GUILARD, Directeur du Laboratoire d’Ingénierie Moléculaire pour la Séparation et les Applications des Gaz (LIMSAG), Université de Bourgogne, (Dijon), du coté français et Monsieur le Professeur A. SAOIABI, Codirecteur du Laboratoire de Chimie Physique Générale de la Faculté des Sciences de Rabat, du coté marocain.
Je tiens à exprimer toute ma reconnaissance à l’agence universitaire de la francophonie (AUF) pour le financement des stages effectués dans le cadre de la préparation de cette thèse.
Enfin, je souhaite associer à ces remerciements tous ceux qui ont contribué à la réalisation de ce travail, et tous les ami(e)s et les collègues du département de chimie de la
ABREVIATIONS
Dans ce manuscrit nous avons utilisé les abréviations suivantes :Matériaux et acides
p-HAp : Hydroxyapatite poreuse
c-HAp : Hydroxyapatite bien cristallisée HAp : Hydroxyapatite de référence CAp : Hydroxyapatite commerciale c-FAp : Fluoroapatite bien cristallisée p-FHAp : Fluorohydroxyapatite
-TCP : Phosphate tricalcique -TCP: Phosphate tricalcique
PPOH : Acide phénylphosphonique C6H5PO(OH)2
PPH : Acide phénylphosphinique C6H5PO(OH)H
MPOH : Acide méthylphosphonique CH3PO(OH)2
TPOH : Acide tert-butylpohosphonique (CH3)3CPO(OH)2
HAp-PPOH : Hydroxyapatite greffée par l’acide phénylphosphonique HAp-PPH : Hydroxyapatite greffée par l’acide phénylphosphinique HAp-MPOH : Hydroxyapatite greffée par l’acide méthylphosphonique HAp-TPOH : Hydroxyapatite greffée par l’acide tert-butylphosphonique HAp %acide : Hydroxyapatite greffée par différent % d’acide
Techniques et méthodes de caractérisation
DRX : Diffraction des rayons X
IR-TF: Spectroscopie d’absorption infrarouge
à Transformée de Fourrier
MEB : Microscopie électronique à balayage
BET : Méthode Brunauer, Emmett et Teller
BJH : Méthode Barrett, Joyner et Halenda SS : Surface spécifique
UV-Visible : Spectroscopie UV-Visible
ATG : Analyse thermogravimétrique ATD : Analyse thermique différentielle RMN : Résonance magnétique nucléaire CHN : Analyse chimique élémentaire
AES-ICP : Spectrométrie d’émission atomique (AES) par couplage enplasma induit (ICP)
SOMMAIRE
INTRODUCTION GENERALE……….…1
CHAPITRE I Rappels sur les propriétés cristallographiques des apatites Introduction………..……...…………7
I. Structures des apatites……….7
II. Substitution dans les apatites……….11
II.1. Substitution du fluor……….11
II.2. Substitution du calcium………....12
II.3. Substitution du phosphore………... 13
III. Stabilité des apatites et processus de diffusion………....14
III.1. Stabilité des apatites………...14
III.2. Processus de diffusion………....15
IV. Modification de la surface des apatites et leur réactivité……….15
IV.1. Modification de la surface des apatites par action de l’hexamethyldisilane (HMDS)………...17
IV.2. Modification de la surface des apatites par action des composés organophosphoriques………...………. 17
IV.2.1. Action de l’acide pyrophosphorique………18
IV.2.2. Action de l’alkyle phosphate………18
IV.2.3. Action des acides alkylphosphoniques………. ………...19 PARTIE I
Rappels sur les méthodes de synthèse et les propriétés physico-chimiques des apatites
Introduction……… 21
I. Méthodes de préparation des apatites………..21
I.1. Méthode par voie aqueuse………... ..21
I.1.1. Méthode par voie humide………... .22
I.1.2. Méthode de neutralisation……….………...22
I.1.3. Méthode par voie sol-gel………..23
I. 2. Méthode par voie sèche……….23
II. Propriétés physico-chimiques des apatites……….23
II.1. Propriétés biologiques………. .23
II.2. Propriétés électriques ………...25
II.2.1. Cas des hydroxyapatites………...…..26
II.2.1.1. Hydroxyapatite non substituée Ca10(PO4)6(OH)2………...…..26
II.2.1.2. Hydroxyapatite substituée……….. ………. 26
II.2.2.Cas des fluorohydroxyapatites Ca10(PO4)6(OH)2-xFx………..27
II.3. Propriétés d’adsorption des apatites……….28
II.3.1. Adsorption de quelques ions et métaux lourds…………..…… …………....28
II.3.1.1. Cas des apatites phosphocalciques………28
II.3.1.1.1. Adsorption des métaux lourds……….29
a) Adsorption du plomb……….29
b) Adsorption du cadmium………32
c) Adsorption du zinc……….33
II.3.1.1.2. Adsorption des ions et échange ionique………..33
II.3.1.2. Cas des autres types d’apatites………..33
II.3.2. Adsorption des macromolécules sur les apatites………34
II.3.2.1. Adsorption des protéines………...35
II.3.2.2. Adsorption des porphyrines………..36
II.3.2.3. Adsorption des colorants………...36
II.3.2.4. Adsorption des pesticides………...37
CHAPITRE III
Synthèse et caractérisation des apatites phosphocalciques poreuses
Introduction……….41
I.Synthèse des apatites en milieu eau-éthanol………. .41
I.1. Mode opératoire ………42
I.2. Caractérisation des matériaux préparés………..…………...42
I.2.1. Examen par diffraction des rayons X……….…..42
I.2.2. Examen par spectroscopie d’absorption infrarouge à transformée de Fourrier (IR-TF)………....46
I.2.3. Analyse thermique (ATG/ATD)………… ………...…..48
I.2.4. Analyse chimique…..……….……….….50
I.2.5. Analyse par microscopie électronique à balayage (MEB)… ………..…51
II. Mesure de la surface spécifique des apatites préparées selon la méthode BET ……...52
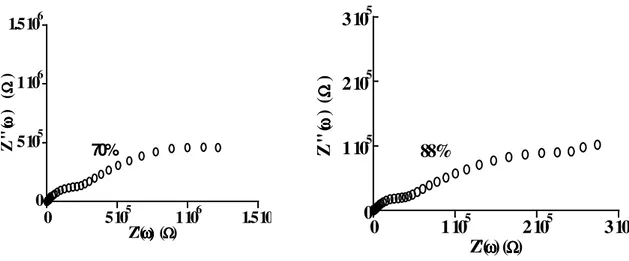
III. Propriétés électriques de l’apatite poreuse p-HAp………....………. 57
III.1. Techniques expérimentales et principe de mesure de la conductivité ionique …. 57 III.1.1. Préparation des pastilles………..……….….. 57
III.1.2. Techniques et appareillages ………..57
III.1.3. Electrodes : réalisation de dépôt………...……….58
III.2. Résultats expérimentaux et discussions………..……...58
III.2.1. Description des diagrammes d’impédance complexe de p-HAp en fonction de l’humidité relative ……….………58
III.2.2. Evolution de la conductivité de p-HAp en fonction de l’humidité relative………...59
Conclusion ……….………61 PARTIE II
ELABORATION ET CARACTERISATION STRUCTURALE ET TEXTURALE DES NANOPARTICULES DE L’APATITE
CHAPITRE IV
Modification de la surface des apatites phosphocalciques en milieu aqueux par greffage des phénylphosphonates : acides phénylphosphonique et
phénylphosphinique
Introduction……….………...……63
I. Procédure expérimentale……….………....64
II. Caractérisation structurale des produits préparés …...……….. 65
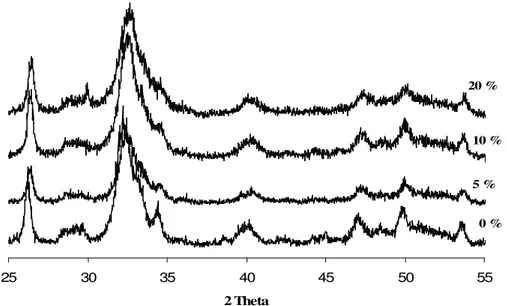
II.1. Examen par diffraction des rayons X ………..65
II.2. Examen par spectroscopie d'absorption infrarouge à transformée de Fourrier (IR-TF) ……….……….69
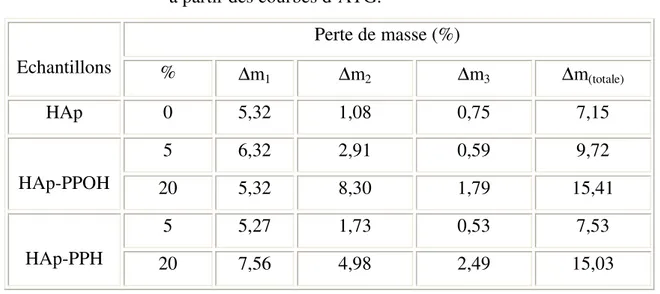
II.3. Analyses thermogravimetriques et différentielles couplées (ATG/ATD)…………72
II.4. Analyse chimique ..………....…...76
II.5. Analyse des apatites greffées par spectroscopie UV- visible à l’état solide.………78
II.6. Analyse des matériaux greffés par spectroscopie de résonance magnétique nucléaire du phosphore (RMN-MAS31P) à l’état solide ………80
II.7. Analyse des apatites greffées par microscopie électronique à balayage (MEB).... .83
III. Caractérisation de la texture des apatites greffées………...…...85
III.1. Description des isothermes d’adsorption………....85
III.2. Détermination de la surface spécifique, du volume poreux et du diamètre des pores………...…..….88
III.2.1. Mesure de la surface spécifique des apatites greffées selon la méthode BET ………...88
III.2.2. Détermination de la porosité des échantillons modifiés selon la méthode Barrett, Joyner et Halenda (BJH)………...……....89
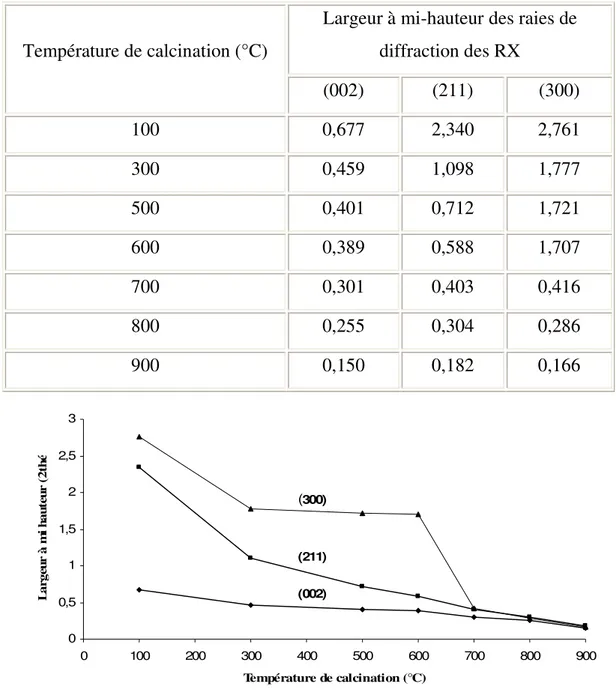
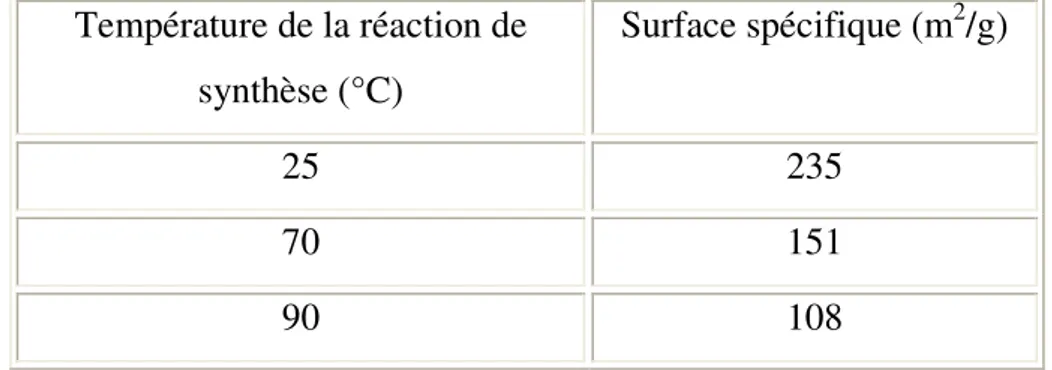
IV. Effet de la température de synthèse sur les propriétés structurales et texturales des apatites greffées……….90
IV.1. Examen par diffraction des rayons X………..………91
IV.2. Mesure de la surface spécifique. ……….……….…..92
IV.2.1. Effet de la température de la réaction de synthèse sur la texture des composés préparés…………...………..………...………..92
IV.2.2. Effet de la température de calcination sur la texture des matériaux préparés……….……….…...…..93
CHAPITRE V
Modification de la surface des apatites phosphocalciques en milieu aqueux par greffage des alkylphosphonates : acides méthylphosphonique et
tert-butylphosphonique
Introduction………....96
I. Procédure expérimentale……….96
II. Caractérisation des précipités préparés………..97
II.1. Examen par diffraction des rayons X………... 97
II.2. Examen par spectroscopie d'absorption infrarouge IR……… .….100
II.3. Analyses thermogravimetriques et différentielles couplées (ATG/ATD)………...102
II.4. Analyses chimiques des composés greffés……….…..105
II.5. Analyse par spectroscopie RMN-MAS à l’état solide de 31P et 13C des composés greffés………..106
II.5.1. RMN du phosphore 31P……….….106
II.5.2. RMN du carbone 13C .……….… …...108
II.6. Analyse par microscopie électronique à balayage ………..………….….. 109
II.7. Analyse volumétrique des apatites greffées………...111
II.7.1. Description des isothermes……….111
II.7.2. Mesure de la surface spécifique des apatites greffées et détermination de leur porosité……….……...……….113
Conclusion……….……...117
PARTIE III
PROPRIETES PHYSICO-CHIMIQUES DES APATITES POREUSES : CORRELATION ENTRE LES PROPRIETES
CHAPITRE VI
Fluoruration des hydroxyapatites poreuses : Corrélation entre les propriétés structurales, d’adsorption et de conduction
Introduction………121
I. Protocole expérimental………...121
II. Résultats expérimentaux et discussions……….121
II.1. Etude du suivi de pH du mélange réactionnel durant le processus d’adsorption ....122
II.2. Effet de la concentration initiale des ions fluorures sur la capacité de rétention des hydroxyapatites ………...………...123
II.3. Caractérisation des solides fluorés……….………..124
II.3.1. Examen par diffraction des rayons X……….124
II.3.2. Examen par spectroscopie d'absorption infrarouge (IR) .………...…....…...127
II.3.3. Analyse chimique des solides……… ..……...128
II.4. Effet de la fluoruration sur la conductivité ionique de l’apatite poreuse………….129
Conclusion………..………...132
CHAPITRE VII Processus d’adsorption des ions Pb2+ sur les apatites synthétique et commerciale Introduction………134
I. Procédure expérimentale du processus d’adsorption………..134
II. Suivi du pH du mélange réactionnel durant le processus d’adsorption ….………...135
III. Cinétique d’adsorption ………136
IV. Etablissement des isothermes d’adsorption……….140
IV.1. Modèle de Langmuir………..….…....142
IV.2. Modèle de Freundlich………..…………...143
VI. Simulation des isothermes d’adsorption………..……146
VII. Mécanisme d’adsorption……… 148
Conclusion ……….150
CONCLUSION GENERALE……….….…………151
ANNEXE 1……….…….….….. 155
ANNEXE 2……….161
INTRODUCTION GENERALE
La famille de phosphates de calcium est importante par le grand nombre de composés qu’elle comporte et par leur influence dans la nature et dans le milieu vivant. L’apatite est la forme la plus stable et la plus insoluble de tous les phosphates de calcium, c’est d’ailleurs celle qui subsiste dans la nature que ce soit dans les phosphates sédimentaires ou biologiques (os et dents).
Les phosphates de calcium suscitent un vif intérêt en tant que substituts osseux grâce à sa composition chimique voisine de celle de la phase inorganique. Ils forment une famille de composés chimiques de structures et de compositions variables. Ils peuvent apparaître sous différentes formes : hydrates, hydroxydes ou anhydres.
Il est donc nécessaire de développer des recherches scientifiques sur des apatites phosphocalciques afin de contribuer à la valorisation des phosphates qui représentent pour le Maroc une source de richesse naturelle d’une grande importance d’une part et de chercher à préparer des matériaux poreux capables d’éliminer efficacement des polluants inorganiques (métaux lourds, ions fluorures…) d’autre part. Pour ce faire, la recherche et le développement d’un mode de synthèse dans notre laboratoire afin de synthétiser et élaborer des matrices apatitiques solides capables de piéger ces polluants s’avèrent nécessaires et constituent notre souci principal pendant la démarche de nos travaux de recherche dans notre laboratoire.
C’est pourquoi, nous avons entrepris un travail consistant à préparer un matériau poreux de surface spécifique élevée. Nous essayerons ainsi d’apporter une contribution à l’étude des propriétés physico-chimiques des apatites poreuses.
Cette étude est placée dans une approche globale de l'élaboration de matériaux apatitiques à porosité contrôlée par greffage ou non, en milieu aqueux, de groupements phosphonates à différents taux selon la méthode de neutralisation, suivie de leur caractérisation et la détermination de leurs propriétés physico-chimiques. La démarche suivie est la synthèse de poudres d’hydroxyapatite poreuse dont la texture est modifiée au
leur comportement thermique et structural, et la caractérisation morphologique des matériaux modifiés sont ensuite effectuées.
La plupart des études réalisées sur les métaux lourds (Pb2+, Hg2+, Cd2+…) ont montré qu’ils sont parmi les éléments les plus toxique, dont les effets de leur toxicité concernent les systèmes nerveux, le sang ou la moelle osseuse, et sont aussi généralement cancérigènes pour les êtres vivants. En effet, dans le but d’éviter ce fléau, il y a un effort considérable qui se fait pour développer des technologies efficaces pour éliminer ces métaux lourds ou au moins atteindre des concentrations très faibles dans les effluents industriels ou dans les eaux destinées à la consommation des êtres vivants. Dans ce cadre, un grand projet européen, et plus particulièrement en France, a été lancé dernièrement dans le but d’atteindre de très faibles concentrations de métaux lourds dans les eaux destinées à la consommation.
Au cours de ces dernières années, les besoins se sont aussi faits ressentir au niveau des techniques de séparation et d’immobilisation des polluants que ce soient organiques (colorants, pesticides, phénol et ses dérivés…) ou inorganiques (métaux lourds, fluorures...). Divers procédés ont été utilisés pour l’élimination des différents polluants souvent rencontrés dans les eaux naturelles ou usées. Citons par exemple, la précipitation chimique, l’extraction liquide-liquide, l’échange ionique et l’adsorption sur des supports synthétiques ou naturels. Plusieurs matériaux ont été déjà utilisés pour la sorption de ces entités polluantes. De nombreux travaux sur d’autres matériaux comme les zéolites, le charbon actif et la silice ont, en effet, révélé leurs aptitudes à éliminer des métaux lourds en solution aqueuse. Le phénomène d’adsorption des métaux lourds par différents matériaux a été développé, et notamment le plomb, le cobalt, le cadmium et le cuivre. Dans notre cas, l’étude réalisée est portée sur les ions F- et Pb2+.
Généralement, les apatites possèdent des tunnels et des surfaces actives responsables de ce phénomène d’adsorption. En effet, les recherches relatives aux propriétés d’adsorption des apatites se sont considérablement développées ces dernières années. La plupart de ces études concernent l’adsorption des composés organiques et inorganiques sur des apatites bien cristallisées. En revanche, les recherches engagées sur les propriétés d’adsorption des apatites poreuses et mal cristallisées sont rares, ce qui nous
a incité à les tester comme adsorbants, ce qui fera l'objet de la troisième partie de notre travail.
Ainsi, le travail que nous presentons est composé de trois grandes parties :
L’étude bibliographique, qui constitue la première partie de ce manuscrit, donne une synthèse des informations publiées jusqu’à présent sur les propriétés cristallographiques, électriques et d’adsorption des apatites et leurs applications. Dans le premier chapitre de cette partie, nous rappelons les caractéristiques structurales des apatites et les différentes possibilités de substitution de leurs ions. Le second chapitre contient un rappel détaillé sur les méthodes de synthèse et les mesures électriques réalisées sur les apatites. Les propriétés d’adsorption des ions et des molécules organiques sur les apatites sont aussi brièvement décrites.
La deuxième partie de ce manuscrit, qui constitue la première partie expérimentale de ce travail, est scindée en trois chapitres. Le chapitre III est consacré à la description des méthodes d’élaboration d’une apatite poreuse de basse cristallinité à différentes températures de la réaction et leur caractérisation par des techniques variées et cohérentes pour mieux comprendre les propriétés structurales et morphologiques des matériaux préparés. L’évaluation des propriétés électriques de l’apatite poreuse préparée à 25 °C a été aussi entamée dans ce chapitre.
La modification de la surface spécifique de l’apatite par l’addition des molécules organiques à base de phosphore au cours de la réaction fait l’objet du quatrième chapitre de ce mémoire. Nous avons essayé de préparer les apatites par neutralisation en présence de différents taux d’acides phénylphosphonique C6H5PO(OH)2 et phénylphosphinique C6H5PO(OH)H possédant deux groupements de phosphonates différentes. Les matériaux hybrides synthétisés ont été caractérisés par différentes techniques physico-chimiques adéquates à savoir, la diffraction des rayons X, l’infrarouge, l’analyse thermique (ATG et ATD), l’analyse chimique et élémentaire, la mesure de la surface spécifique (BET), la microscopie électronique à balayage (MEB), la RMN de 31P et 13C et la spectroscopie UV-Visible. La modification de la surface des apatites poreuses suite à l’action des acides méthylphosphonique CH3PO(OH)2 et tert-butylpohosphonique (CH3)3CPO(OH)2 est
Nous avons ensuite cherché à déterminer le pouvoir adsorbant de l’apatite poreuse. En effet, la troisième partie de ce travail est consacrée d’une part à la défluoruration des solutions aqueuses contenant des ions fluorures et d’autre part à l’étude de l’immobilisation des ions Pb2+ par l’apatite poreuse p-HAp préparée à 25 °C et l’apatite commerciale CAp. L’étude relative à l’élimination des ions fluorures par l’hydroxypatite poreuse (p-HAp) et l’hydroxyapatite bien cristallisée (c-HAp) fait l’objet du sixième chapitre. Les propriétés d’adsorption des ions Pb2+ sur les apatites poreuse et commerciale en milieu aqueux et l’étude de leurs isothermes d’adsorption sont décrites dans le septième chapitre de ce manuscrit. La comparaison entre les propriétés d’adsorption des ions Pb2+ sur l’apatite commerciale et sur l’apatite poreuse synthétique est aussi exposée dans ce septième chapitre.
Enfin, notre mémoire se termine par une conclusion générale dans laquelle nous soulignons l’importance des propriétes électriques et d’adsorption des apatites poreuses synthétisées dont les surfaces sont modifiées ce qui les rendent aptes à piéger des ions fluorures F- et immobiliser des ions Pb2+ des effluents industriels.
Ces différentes études s’inscrivent dans le cadre des axes de recherche traités au sein de l’UFR «Valorisation des ressources naturelles et protection de l’environnement » domiciliée dans notre laboratoire « Laboratoire de Chimie Physique Générale ».
PARTIE I
SYNTHESE BIBLIOGRAPHIQUE
CHAPITRE I
Introduction
Dans ce chapitre nous allons présenter les données et résultats majeurs de la littérature disponibles sur les propriétés cristallographiques des apatites. D'autre part, cette revue permet de situer notre travail dans un contexte plus général.
Les apatites constituent une importante famille de composés solides isomorphes de la fluorapatite phosphocalcique de formule Ca10(PO4)6F2[1].
I. Structure des apatites
En 1771, quand Schele nota que le phosphate de calcium était présent dans l’os, la plupart des chimistes ont pensé connaître la structure minérale des os et des dents. Cependant, au XIXème siècle, des études de diffraction des rayons X ont montré que le constituant majoritaire des tissus osseux minéralisés était sous forme d’hydroxyapatite Ca10(PO4)6(OH)2, utilisée par ailleurs comme matériau de comblement et de revêtement [2]. Cette découverte a permis de mettre au point de nouvelles possibilités pour le revêtement des implants.
En 1930, Nàray – Szabo [3] et Mehmel [4] déterminèrent le groupe de symétrie de la fluoroapatite comme étant un système hexagonal de groupe d’espace P63/m [5-9]. Cependant, vu l’importance de la structure dans beaucoup de domaines d’applications, d’autres études structurales ont été effectuées et ont mis en évidence la structure de l’hydroxyapatite synthétique.
La fluoroapatite de formule Ca10(PO4)6F2, l’apatite la plus simple, de paramètres cristallographiques a = 9,375 Å et c = 6,875 Å, est souvent reconnue comme référence [9]. La projection de la structure l’hydroxapatitique Ca10(PO4)6(OH)2 sur le plan (001) est représentée par la figure 1.
La stabilité du réseau apatitique est assurée par l’assemblage des ions métalliques et les ions PO43- indépendamment des ions localisés dans les canaux. L’arrangement compact des groupements PO43- fait apparaître deux types de tunnels [10].
Le premier, situé à la position 4f, coïncide avec l’axe ternaire de la maille hexagonale, est occupé par 4 ions du métal (CaI) en position z = 0 et z = 1/2 (Figure 2).
Figure 2: Positions des atomes CaI dans la pseudo maille de la fluoroapatite (1) et sa projection sur le plan (001) (2).
Ces atomes CaI sont entourés de 9 atomes d’oxygène qui forment dans le cas de l’apatite phosphocalcique un tunnel dont le diamètre est d’environ 2,5 Å (Figure 3).
Figure 3 : Environnement de CaI dans la maille de la fluorapatite phosphocalcique. Le second tunnel, situé sur la position (6h), coïncide avec l’axe sénaire hélicoïdal du réseau, est occupé par les ions F- dans le cas de la fluorapatite (ou OH- dans le cas de l’hydroxyapatite).
Ce type de tunnel est bordé par les oxygènes du tétraèdre PO43- et 6 ions du métal (CaII) qui se positionnent à z = 1/4 et z = 3/4 en formant deux triangles équilatéraux alternés autour de l’axe sénaire. Ce tunnel est de diamètre 3 à 4,5 Å dans l’apatite phosphocalcique. Ces deux tunnels dans la structure apatitique donnent à ces matériaux des propriétés physico-chimiques importantes.
En tenant compte de ces deux sites cristallographiques, on peut donc représenter l’hydroxyapatite par la formule suivante :
[CaI]4[CaII]6(PO4)6(OH)2
Dans le réseau complexe de ces apatites, il y a plusieurs types de liaisons entre les ions Ca2+ et PO43- (Figure 4), qui sont considérées comme purement ioniques.
Figure 4 : Liaisons entre les groupements PO43- et les ions Ca2+.
Par contre, les liaisons P-O ont un caractère nettement covalent, et celles de Ca-F sont partiellement covalentes comme il a été montré par L.O. Kislovskij et coll. [7]. L’ensemble est particulièrement stable comme en témoigne leur point de fusion très élevé ( 1600 °C).
II. Substitution dans les apatites
Le réseau apatitique est très flexible, il peut admettre à la fois des substitutions anioniques et cationiques. Les ions constituant les fluoroapatites Ca10(PO4)6F2 peuvent être remplacés, totalement ou partiellement, par certains ions [9].
A l'échelle atomique, que ce soit par la création de lacunes et / ou pour des raisons d'encombrement stérique, les substitutions ioniques modifient les paramètres de la maille
de la structure apatitique. A plus grande échelle, les substitutions engendrent, de manière générale, une baisse de cristallinité, une diminution de la stabilité thermique, ainsi qu'une augmentation de la solubilité.
II.1. Substitution du fluor
Le fluor peut être remplacé par d’autres ions halogénures (Cl-, Br-, I-), par le groupement hydroxyle OH-, par des groupements bivalents O2-, S2-, CO32- ou par des lacunes [7-9,11]. Lorsque le substituant du fluor possède un rayon plus important comme OH-, Cl-, I-, Br-, il n’occupe plus forcément la même position (Figure 4).
Figure 4 : Les tunnels et l’environnement de l’axe sénaire hélicoïdal du réseau des apatites de OH-, Cl-, et F-.
Plusieurs séries d’apatites ont été préparées en particulier les composés de Ca10(PO4)6(OH)2-xFx [12,13], Ca10(PO4)6S [10], Ca10(PO4)6O [14], Pb8Na2(PO4)6 [15].
Les apatites lacunaires sont bien connues, particulièrement celles où les lacunes concernent essentiellement la position du fluor. La formation de ces lacunes peut être plus au moins importante surtout dans les propriétés électriques, catalytiques et d’adsorption. II.2. Substitution du calcium
La présence de deux tunnels offre à l’apatite d’autres possibilités de substitution tout en gardant sa structure. L’ion Me2+ peut être facilement échangé par d’autres cations
ionique 0,99 Å peut être remplacé totalement par les ions Sr2+, Ba2+, Pb2+, Cd2+, Mn2+… [15-18] ou partiellement par des ions comme Mg2+, Zn2+, Cu2+, K+, Na+ [13,14] ou des ions trivalents comme Eu3+, La3+, Sm3+, Nd3+…[19,20]. L’introduction des ions monovalents en substitution d’ion calcium nécessite une compensation de charges. Celle-ci peut être réalisée de diverses façons :
- On peut remplacer un cation Ca2+ par des cations monovalents comme Na+, K+, Ag+, avec possibilité de compensation de charge en diminuant les charges négatives des groupements XO43-. Par exemple, on substitue les ions PO43- par des ions SO42- pour obtenir Ca10-x Nax(PO4)6-x(SO4)xF2 .
- Une autre compensation de charge est possible en augmentant les charges négatives des groupements XO43- constituant le squelette du réseau apatitique. Par exemple, on remplace les ions PO43- par des ions SiO44-.
- On peut substituer deux cations Ca2+ par un couple d’ions l’un trivalent et l’autre monovalent ; c’est le cas extrême de Na5La5 (PO4)6F2 [8].
- Enfin, une autre possibilité consiste à introduire des anions bivalents dans les tunnels de l’axe sénaire où l’on peut substituer les ions F-, OH- par les ions O2- et S 2-[10,19].
Les substitutions cationiques ont été largement étudiées grâce à des investigations systématiques dont la mise au point a été donnée dans ce rappel bibliographique. Cependant, ces substitutions sont totales ou partielles. Les travaux relatifs à cette étude ont bien précisé la distribution des cations sur chacun des deux sites possibles puisque les deux positions ne sont pas équivalentes. Le remplacement pourrait se faire sur les 4 sites CaI (4f) ou sur les 6 sites CaII (6h), ce qui permettrait d’expliquer facilement les formulations en Ca4M6 ou Ca6M4 [9].
Lorsque les ions Y- et les ions Me2+ sont substitués respectivement par des anions bivalents et des cations monovalents, un site anionique sur deux reste vacant, ce qui provoque la création de lacune dans les tunnels. Dans ce sens nous citons par exemple l’apatite calcique carbonatée de type A : Ca10(PO4)6CO3 et l’apatite phosphoplombeuse au sodium Pb8Na2(PO4)6 2 qui peut admettre deux lacunes.
II.3. Substitution du phosphore
Le phosphore P5+ de rayon ionique 0,31 Å peut être aussi remplacé par des cations de rayon compris entre 0,26 et 0,53 Å. Il est évident que les ions PO43- constituent le squelette de base du réseau ce qui exige que le nombre de sites cristallographiques soit limité, et l’absence des lacunes dans les sites de ces groupements PO43-, contrairement aux autres sites de la structure apatitique. Les sites PO43- sont toujours saturés au nombre de six par maille quelques soient les écarts à la stoechiométrie engendrés par les multiples substitutions.
Les ions PO43- peuvent être substitués partiellement ou totalement par des groupements divalents comme HPO42-, CO32- et SO42- [21,22], par des ions trivalents (AsO43-, VO43-,…) [20] ou par des ions tétravalents comme SiO44- et GeO44- [23]. Toutes ces substitutions peuvent aboutir à la formation de solutions solides en combinant différents couples d’éléments avec le phosphore du degré (+V). Nous rassemblons dans le tableau 1 les principaux cas de substitution connus jusqu’à présent.
Tableau 1 : Principales substitutions possibles de Me2+, XO43- et Y- dans le réseau apatitique Me10(XO4)Y2. Me2+ XO43- Y -Ca2+ Sr2+ Ba2+ PO43- F -Cd2+ Pb2+ Mn2+ AsO43- Cl -Eu2+ Ed4+ Mg2+ VO43- OH -Cu2+ Al3+ La3+ SO42- Br -Nd3+ Na+ Li+ CO32- I -K+ U4+ Th4+ HPO42- CO3 2-lacune GeO44- O 2-SiO44- S 2-CrO43- lacune
Il découle d'après la formule théorique de l'apatite que le rapport idéal Me2+/XO4 3-vaut 1,667. En chimie du solide, ce rapport permet de définir la famille des apatites. La valeur des paramètres de maille, la position des ions, en particulier dans les tunnels, leur
des longueurs de liaisons sont bien évidemment liées à la nature des ions substituants (rayon ionique, charge, polarisabilité, électronégativité, etc...). Les grandeurs thermodynamiques comme la solubilité, l'enthalpie de formation dépendent aussi de ces substitutions.
III. Stabilité des apatites et processus de diffusion III.1. Stabilité des apatites
Parmi les facteurs qui influent sur la stabilité des apatites, nous citons en particulier la température, la pression et la composition chimique. Il est possible de réaliser une réaction solide-gaz, dans des conditions favorables, en agissant sur la température et la pression de traitement. Nous citons à titre d’exemple le processus de l’extraction des ions fluorures à partir des phosphates naturels ou des fluoroapatites synthétiques [24].
Par ailleurs, pour montrer l’effet de la composition, certains auteurs ont mesuré la chaleur de dissociation des apatites synthétiques de formule M10(PO4)6Y2 (Y= F-, OH-) [25]. Ils ont constaté que la dimension du cation joue un rôle important sur la formation et la dissociation de ces apatites. Les résultats obtenus par calorimétrie montrent donc que les fluorapatites sont en général stables.
III.2. Processus de diffusion
Le processus de diffusion dépend généralement de plusieurs paramètres, en particulier de l’existence de tunnels et de l’encombrement stérique dans la structure.
En effet, l’existence de deux tunnels dans la structure de l’apatite donne à cette dernière une mobilité importante des ions. Des travaux relatifs aux échanges ioniques, montrent que les ions occupant les tunnels apatitiques sont mobiles mais sans donner les mécanismes de leur migration [1,25]. En suite, d’autres études se sont intéressées à la mobilité ionique dans les hydroxyapatites. Le mécanisme de diffusion établi lors de ces études indique que les ions H+ et O2- sont les espèces responsables de ce phénomène de diffusion [25-27].
IV. Modification de la surface des apatites et leur réactivité
La plupart des travaux antérieurs sur la modification de la surface des matériaux par des groupements phosphonates et phosphates alkyliques ont été effectués sur des métaux et des oxydes de métaux [28-38]. En revanche, très peu d’études ont été portées au sujet de la modification des surfaces des matériaux non-oxydes, de type de phosphates inorganiques, comme l’hydroxyapatite par exemple. La modification des surfaces extérieures de l’hydroxyapatite de calcium a un grand intérêt dans le domaine du développement de matériaux de propriétés d'adhérence et d'adsorption contrôlables.
La grande réactivité des apatites biologiques réside dans leur pouvoir extrême d’échange des groupements HPO42- superficiels dans des environnements labiles par des ions carbonates ou des groupements anioniques de macromolécules organiques (RPO2-, RSO42-, RCOO-) [39].
La double compatibilité des ions phosphates avec les phases minérales et organiques ainsi que la forte réactivité des ions HPO42- ont été à l’origine de l’avancement des études sur les apatites à la frontière du minéral et de l’organique. Des recherches récentes visant à précipiter ces solides dans un milieu mixte eau-solvant organique, ont cependant permis l’obtention de nouveaux matériaux [40].
En effet, plusieurs travaux se sont axés sur la préparation d’apatites minérales-organiques. Dans ce sens, une étude s’intéressant à la précipitation d’un phosphate minéral et d’un phosphate organique, l’amino-2 éthyl-phosphate H2PO4CH2CH2NH2 par le nitrate de calcium a été réalisée [41]. On a ainsi obtenu un composé minéral-organique mal cristallisé de rapport Ca/P = 1,33. Le phosphate organique qui présente une insaturation facilement polymérisable a été greffé sur le minéral apatitique, ce qui a permis l’obtention de composites ayant des applications biomédicales [42,43].
En outre, Kandori et coll. [44] ont réussi à greffer les molécules d’oleyphosphonate (OP) à la surface de l’hydroxyapatite par précipitation avec Ca(OH)2-H3PO4 en présence du dissodium oleyphosphate (DSOP). Ils ont montré, par le biais des isothermes d’adsorption de H2O, que la surface de l’hydroxyapatite greffée par (DSOP) devient plus hydrophobe que l’hydroxyapatite non traitée. L’augmentation de la surface spécifique
d’oleyphosphonate (OP) de la surface de l’apatite. Une modification des tailles des particules de l’hydroxyapatite traitée a été aussi observée par l’utilisation de la microscopie électronique à transmission (MET).
Par ailleurs, Tanaka et coll. [45-47] ont montré que les molécules CH3I, CH3OH, H2O et CO2 s’adsorbent d’une façon irréversible sur la surface de l’apatite par l’intermédiaire des groupes P-OH. De même, ils ont montré aussi que la pyridine, la n-butylamine et l’acide acétique sont adsorbés sur l’hydroxyapatite HAp par la formation de liaisons hydrogènes avec les groupements P-OH de la surface de cette apatite.
Récemment, plusieurs études ont porté sur la modification de la surface de l’hydroxyapatite par des molécules organiques phosphatées. Lebugle et coll. [48] ont montré la possibilité de greffer un polymère organique à la surface de l’hydroxyapatite par précipitation, et conclu que les ions OH- de la surface de l’hydroxyapatite sont échangés avec les ions de phosphates alkyliques.
Dans ce paragraphe, nous allons signaler quelques exemples relatifs à la modification de la surface des apatites par des molécules organiques et inorganiques. IV.1. Modification de la surface des apatites par action de l’hexamethyldisilane (HMDS)
Tanaka et coll. [49] ont pu modifier la surface d’une hydroxyapatite non stœchiométrique (Ca/P = 1,62) par action de l’hexamethyldisilane [(CH3)3Si]2NH.
En effet, la surface de HAp a été modifiée par l’action de HMDS sans aucune influence sur sa cristallinité. Les groupements -Si(CH)3 observés à la surface de l’apatite ont été formés par la réaction des groupements P-OH de cette surface avec HMDS, de telle sorte qu’elle devienne hydrophobe. Quand on chauffe à l’air ces matériaux modifiés à température de 500 °C, on constate la disparition des groupements -CH3 et la formation de groupements Si-OH à leur surface.
L’HMDS réagit non seulement avec le groupement P-OH mais également avec les groupements extérieurs Si-OH formés à la surface. Ainsi, la surface spécifique de ces matériauxdiminue en fonction de la quantité de HMDS greffée.
IV.2. Modification de la surface des apatites par action des composés organophosphoriques
Au cours des 10 dernières années, les composés organophosphorés tels que les phosphonates [36, 50-56], les phosphinates [57] et les alkylphosphates [58-60] ont attiré l'intérêt croissant dû à leur affinité élevée vis à vis des surfaces d'oxydes de métaux. Dans ce paragraphe, nous allons citer quelques exemples indiquant la modification des surfaces des apatites par action des composés organophosphorés.
IV.2.1. Action de l’acide pyrophosphorique
Tanaka et coll. [61] ont étudié aussi la modification de la surface de l’hydroxyapatite suite à l’action de l’acide pyrophosphorique H4P2O7 (noté PP) en milieu organique. Ils ont montré que la surface apatitique peut être modifiée par action de cet acide sans que la structure cristalline de l’apatite et la morphologie des particules soient affectées. Ils ont montré que la teneur des ions PO43- dans l’apatite augmente avec l’augmentation de la concentration de PP, ce qui se traduit par la diminution du rapport molaire Ca/P de 1,52 à 1,35. Les surfaces spécifiques des apatites modifiées diminuent en fonction de l’augmentation de la concentration de PP.
En effet, un mécanisme de la réaction de l’acide PP avec le groupement P-OH de l’hydroxyapatite par addition d’un autre groupement P-OH à la surface apatitique a été proposé selon le schéma suivant :
Surface -P-OH + H4P2O7 Surface -P-O-PO(OH)2 + H3PO4 Le traitement à haute température (T = 850 °C) de l’hydroxyapatite traitée par l’acide pyrophosphorique conduit à la formation d’une autre phase β-Ca3(PO4)2.
IV.2.2. Action de l’alkyle phosphate
En milieu organique, Tanaka et coll. [62] ont étudié la possibilité de modifier les propriétés structurales et texturales de l’hydroxyapatite par action de deux types d’alkylphosphate; hexyl et decyl phosphate. L’analyse par microscopie électronique à balayage des échantillons traités montre qu’aucune modification de la morphologie des
particules n’a été observée après le traitement de l’apatite par les deux types de phosphate.
Plusieurs autres travaux récents se sont axés sur la modification de la surface de l’hydroxyapatite par action de certaines substances organiques telles que les acides hexanoïque et décanoïque [63] où des molécules organiques phosphatées comme
l’ hydroxyéthylphosphate méthacrylate [59] et le phosphate alkylique [64,65].
La modification de la surface de l’hydroxyapatite ne se limite pas au greffage des molécules organiques phosphatées, mais d’autres modificateurs ont été aussi utilisés dans le même but. Ainsi, Nichola et Wilson ont tenté l’estérification de la surface apatitique par action de l’alcool dodécylique [66]et par la silice [67]. Il s’est avéré que l’introduction de ce dernier dans la structure de l’apatite a une influence importante sur sa stabilité et sa surface spécifique.
IV.2.3. Action des acides alkylphosphoniques
Les études relatives à la modification de la surface des apatites par des alkylphosphonates restent très rares. Une des très récentes études est celle réalisée par D’Andrea et ses collaborateurs [68] sur la modification de la surface de deux hydroxyapatites différentes par leurs surfaces spécifiques suite à l’action des acides n-alkyl et n-fluoron-alkylphosphoniques RP(O)(OH)2 (R = n-C8H17, n-C18H37, et n-C8F17 -(CH2)2). Cette étude a montré que la concentration de RP(O)(OH)2 utilisé a un grand effet sur la modification de la surface des matériaux modifiés. L’établissement des liaisons (Ps-O-P) entre la surface de l’apatite PsO et le groupement RP(O)(OH)2 a été aussi confirmé dans cette étude. Le mécanisme proposé pour expliquer l’éventuelle interaction entre les groupements organiques et inorganiques est celui du schéma ci-dessous.
Schéma 1 : Mécanisme proposé pour expliquer les interactions des groupements RP(O)(OH) avec la surface de l’apatite
CHAPITRE II
Rappels sur les méthodes de synthèse et les propriétés
physico-chimiques des apatites
Introduction
La maîtrise des conditions de synthèse des apatites par différentes méthodes apparaît très utile afin d’étudier leurs propriétés physico-chimiques. La méthode de préparation dépend essentiellement de la nature des ions constitutifs de l’apatite. Les propriétés structurales des apatites sont nécessaires comme données de base pour interpréter et commenter les principaux résultats obtenus sur leurs propriétés physico-chimiques, en particulier celles du processus d’adsorption.
Ce chapitre propose, dans le premier volet, la description des différentes méthodes de synthèse citées dans la littérature relatives à la préparation des apatites. Les propriétés électriques et d’adsorption des matériaux apatitiques vis-à-vis des métaux lourds et des molécules organiques (protéines, pesticides, porphyrines…) sont regroupées dans le deuxième volet de ce chapitre.
I. Méthodes de préparation des apatites
Plusieurs grandes voies de synthèse sont proposées pour la préparation des apatites, mais les quatre méthodes les plus utilisées sont :
Méthode par voie humide. Méthode de neutralisation. Méthode par sol-gel. Méthode par voie sèche.
I. 1. Méthode par voie aqueuse
Les synthèses des apatites en phase aqueuse se font selon deux procédés différents : la méthode par double décomposition et la méthode par neutralisation. Ces deux procédés sont actuellement utilisés pour la production industrielle d’apatites.
I.1.1. Méthode par voie humide
La méthode par double décomposition [10,69] consiste à ajouter de façon contrôlée une solution du sel de cation Me2+ dans une solution du sel de l’anion XO43- à une température de 80 °C de telle façon que le pH du mélange reste entre 9 et 10. Le précipité est ensuite lavé et séché. Cette technique permet également d’obtenir des apatites mixtes (contenant deux cations différents) avec une maîtrise du rapport Me1/Me2. Les sels des deux cations sont introduits simultanément dans le réacteur avec le rapport atomique Me1/Me2 désiré.
♦ ♦♦
♦ Cas des apatites M10(PO4)6X2 (M = Ca2+, Sr2+, Pb2+ et X = OH-, F-)
Les apatites au calcium, strontium et au plomb ont été synthétisées par voie humide [70]. Cette méthode consiste à verser une solution du cation divalent sous forme de nitrate M(NO3)2 sur une solution de phosphates solubles (NH4)2HPO4 additionnée d’un excès de fluorure d’ammonium (dans le cas de la fluorapatite) en milieu ammoniacal de telle façon que le pH du mélange soit toujours entre 9 et 10. Dans le cas de la fluoroapatite, les quantités des réactifs sont prises en proportions stoechiométriques selon l’équation de la réaction :
10 M(NO3)2 + 6(NH4)2HPO4 + 2NH4F + 6NH4OH M10(PO4)6F2 + 20 NH4NO3 + 6 H2O
Le mélange est ensuite chauffé sous agitation magnétique à une température voisine de 80 °C pendant 2 heures de précipitation. Après l’avoir laissé mûrir, pendant une durée optimale, le précipité obtenu est filtré à chaud sur Büchner, puis séché à l’étuve pendant une nuit.
I.1.2. Méthode de neutralisation
Elle consiste à neutraliser une solution de lait de chaux Ca(OH)2 en y ajoutant une solution d’acide phosphorique. Cette réaction permet d’obtenir rapidement de grandes quantités d’hydroxyapatite phosphocalcique [11]. Dans le cas de la préparation des apatites, en particulier celle au baryum Ba10(PO4)6X2 (X = OH-, F-) [71], la méthode de neutralisation de Ba(OH)2 par l’acide phosphorique H3PO4, en présence ou non de NH4F,
Cette neutralisation est réalisée sous atmosphère d’azote à la température ambiante. Le mélange est laissé sous agitation magnétique pendant environ 24 heures puis le précipité obtenu est étuvé à 80 °C pendant une nuit.
I.1.3. Méthode par sol-gel
Au cours de cette synthèse on utilise des alkoxydes de phosphore et de calcium dans des conditions de pH et de température adéquates. Cependant, ces réactifs ne sont pas souvent disponibles et donne lieu parfois un mélange de phases après le traitement thermique du précipité à 900 °C [72,73].
I.2. Méthode par voie sèche
Classiquement, les apatites phosphatées sont obtenues par voie sèche à des températures comprises entre 700 et 1000 °C. Par cette voie, les méthodes de préparation font généralement appel au chauffage.
Dans le cas de la fluorapatite phosphocalcique Ca10(PO4)6F2, la préparation est réalisée à partir d’un mélange de réactifs Ca3(PO4)2 et CaF2 en proportions stœchiométriques selon le schéma réactionnel suivant [74] :
3 Ca3(PO4)2 + CaF2 Ca10(PO4)6F2
Les traitements thermiques sont effectués d’une manière progressive par palier de 100 °C jusqu’à 900 °C et moyennant des broyages intermédiaires dans un mortier d’agate. La substitution du calcium par des ions monovalents est soigneusement réalisée par cette méthode [71].
II. Propriétés physico-chimiques des apatites II.1. Propriétés biologiques
Le tissu osseux naturel est assimilable à un matériau « composite » constitué de fibres organiques (le collagène) inscrites dans une matrice minérale qui a été identifiée comme étant un phosphate de calcium apatitique polysubstitué. La répartition massique des deux phases dans le tissu est variable suivant la partie du corps considérée et a ainsi amené à distinguer deux types de tissus osseux.
La reproductibilité, la biocompatibilité et l’absence de toxicité constituent les principaux points du cahier de charges que doit remplir un substitut osseux de synthèse. Plusieurs types de biomatériaux répondent à ces contraintes (polymères, métaux, bioverres, céramiques...) et sont aujourd’hui utilisés sous différentes formes en fonction de l’application visée (granules, pièces massives ou ciment pour le comblement osseux, dépôts denses ou poreux pour le scellement de prothèses...).
Les céramiques en phosphate de calcium représentent une famille de biomatériaux de substitution osseuse grâce à leurs caractéristiques physico-chimiques spécifiques (biocompatibilité, mécanique, échange ionique, …) [75]. Les principaux composés phosphocalciques retenus en chirurgie orthopédique humaine sont en particulier l’hydroxyapatite (HAp) et le phosphate tricalcique bêta ( -TCP) ainsi que leur mélange en proportions variables [76]. En effet, les phosphates de calcium constituent la phase minérale majeure des tissus durs des vertébrés. Les propriétés de dissolution de ces phosphates de calcium dépendent de leurs caractéristiques physico-chimiques, en particulier le rapport molaire Ca/P, de la structure cristallographique et de la surface spécifique. Legeros [75], par des analyses structurales et chimiques de la phase minérale de l'os périostique animal (comparable à l'os cortical) a pu décrire ce dernier par la formule chimique suivante :
Site Me Site XO4 Site Y
Ca8,3(PO4)4,3(CO3)1(HPO4)0,7 (CO3,OH) 0,3 1,7
Cette formule correspond à celle d’une apatite phosphocalcique polysubstituée dans laquelle le calcium s’inscrit dans les sites Me de la structure. La non-stœchiométrie, illustrée par la présence de lacunes sur les sites Me et Y, est engendrée par la polysubstitution des sites XO43- par des espèces de valences différentes.
Parmi les caractéristiques physico-chimiques, la nature de la porosité des composites est généralement la plus prononcée que d’autres caractéristiques. La porosité est caractérisée par plusieurs paramètres [77], à savoir le type de porosité, la taille et la
de préparation, deux types de porosité coexistant au sein de la céramique, la microporosité et la macroporosité.
Contrairement aux micropores, qui ne peuvent être colonisés par les cellules, seuls les fluides biologiques y diffusent, les macropores qui permettent leur colonisation par des cellules. En augmentant la surface d’échange entre la céramique et le milieu biologique, une porosité globale élevée améliore l’activité biologique [78]. Toutefois, une porosité élevée altère les propriétés mécaniques de la céramique [79]. Pour cela, une porosité optimale conserve un envahissement cellulaire et tissulaire suffisant et donc une bonne colonisation osseuse, tout en maintenant une résistance mécanique compatible pour une utilisation en chirurgie orthopédique.
Les caractéristiques physico-chimiques des céramiques sont essentielles à leur activité biologique. Elles conditionnent leur solubilité et donc leurs interactions avec le milieu biologique, à la base de leurs principales propriétés biologiques. D’où l’importance d’une caractérisation complète des céramiques phosphocalciques avant implantation. II.2. Propriétés électriques
La conduction ionique est liée à la nature de la structure, aux ions constitutifs de la charpente et à la dimensionnalité réduite de la maille cristalline de l’apatite. En effet, la présence des canaux dans le réseau apatitique et le faible indice de coordination des ions dans la structure permettent d’obtenir une meilleure conduction [71].
Les apatites sont considérées généralement, comme des électrolytes conducteurs ioniques. En effet, les ions OH- et F- présents dans les tunnels de la structure apatitique sont responsables de cette conduction ionique de l’apatite.
Dans les hydroxyapatites, les ions OH- sont les porteurs de charges, et la conduction de ces ions est assimilée à une diffusion par des liaisons hydrogènes établies entre ces ions comme dans le cas des hydroxydes de magnésium Mg(OH)2 ou de calcium Ca(OH)2 [80].
La conductivité dans l’hydroxyapatite est thermiquement activée et dépend autant de la nature du cation Me2+ (Me2+ = Ca2+, Ba2+, Pb2+ et Sr2+) que du taux d’insertion des cations plus ou moins chargés [81]. Le comportement électrique de quelques types d’apatites a été étudié [27].
II.2.1. Cas des hydroxyapatites
II.2.1.1. Hydroxyapatite non substituée Ca10(PO4)6(OH)2
Yamashita et coll. [27,81-83] ont étudié la conductivité ionique de l’hydroxyapatite pure et ont évalué ses grandeurs électriques (conductivité et énergie de conduction). Ils ont montré que sa conductivité évolue en fonction du temps et de la température de mesure. De ces travaux, il en ressort que les matériaux traités sous vapeur d’eau à 1200 °C sont nettement plus conducteurs que ceux traités à l’air. Ces résultats ont été expliqués par le nombre de porteurs de charges dans le réseau, du fait que le courant de la vapeur d’eau bloque relativement le phénomène de déshydratation durant le frittage et améliore donc la conductivité de ce matériau.
II.2.1.2. Hydroxyapatite substituée
La conductivité ionique d’un matériau conducteur dépend, généralement, de sa composition chimique. Des mesures de la conductivité ionique ont été réalisées par la méthode des thermopotentiels et d’hydrolyse en courant continu, sur des hydroxyapatites d’alcalino-terreux de formule M10(PO4)6(OH)2 (M2+ = Ca2+, Cd2+, Pb2+) [84]. Cette conductivité est thermiquement activée et dépend du cation substitué. Ainsi, l’apatite Pb10(PO4)6(OH)2 présente une meilleure conductivité. Ces travaux montrent que l’amélioration des propriétés électriques de cette dernière apatite est probablement due à la présence des ions Pb2+ dans la structure de ce matériau. D’où, la contribution d’une conductivité électronique qui s’ajoute à la conduction ionique liée aux ions OH- présents dans les tunnels de la structure apatitique.
D’autres travaux ont abordé l’effet des cations trivalents sur la variation de la conductivité. L’étude a été réalisée par la même méthode des diagrammes d’impédances complexes. Ces essais ont été effectués pour des séries d’oxyhydroxyapatites phosphocalciques au lanthane et yttrium Ca10-xLax(PO4)6(OH)2-xOx et
Ca10-xYx(PO4)6(OH)2-xOx, dont le taux de substitution x est compris entre 0 et 2 [27,82-84]. Une meilleure conductivité a été obtenue pour le cas de l’apatite d’yttrium pour x = 0,65 où les porteurs de charges sont principalement les protons H+. D’autre coté, l’étude de l’évolution de la conductivité du matériau Ba (PO ) (OH) à différentes températures a
l’ordre de 2.10-6 S/cm avec une énergie d’activation de 0,43 eV, et elle est liée aux conductions des ions OH- présents dans les tunnels de la structure apatitique [85].
Une étude de la conductivité ionique d’apatites de plomb mixtes d'argent et de sodium de formule générale Pb8Na2-xAgx(PO4)6 (0 x 2), en se basant sur la technique d'impédance complexe dans l'intervalle de température 200-530 °C, a été aussi entreprise. De cette étude, on a pu mettre en évidence que l’augmentation de la conductivité ionique est proportionnelle à la teneur en argent. Au sein de ces matériaux, au fur et à mesure que la teneur en argent augmente, la conduction devient mixte : ionique et électronique [86]. II.2.2. Cas des fluorohydroxyapatites Ca10(PO4)6(OH)2-xFx
Le comportement électrique des matériaux de cette solution solide a été étudié par Maiti et coll. [12]. La conductivité ionique dépend du taux de fluor introduit et elle est meilleure pour une valeur de x = 1, lorsque les protons H+ diffusent entre les ions O2- et F -le long de l’axe (oz) du réseau apatitique. Dans -le cas où x> 1, -les ions H+ et F- sont les porteurs de charges et dans le cas extrême, les ions fluorures assurent la conduction ionique.
Comme nous l’avons vu, la plupart des études sur les mesures électriques sont consacrées à la mobilité des ions H+ et O2- dans le réseau de l’apatite. Cependant, les ions fluorures sont mobiles dans la plupart des structures et en particulier dans la structure fluorine MF2, ils donnent une bonne conduction [87].
Les propriétés électriques des fluoroapatites ont été largement étudiées dans notre laboratoire par Laghzizil et coll. [88-90]. Ces auteurs ont montré que les propriétés conductrices de ces matériaux dépendent surtout de la nature des ions constitutifs de la charpente, du nombre de porteurs de charges et de leur localisation dans les sites cristallographiques.
Par ailleurs, Hartog a évalué la mobilité des cations Ca2+ dans le réseau de l’apatite, dont la conductivité est très faible [91]. En effet, le calcium est un élément divalent qui possède un rayon ionique important. Pour cela, la diffusion de cet élément est difficile. Par contre, les ions monovalents comme Na+, K+, Li+, Ag+ pourraient être plus
mobiles que les ions Ca2+. Ils sont souvent conducteurs dans la plupart des matériaux tels que les Nasicons [92], LiCo2O4 [93], NaMnO4 [94],…).
II.3. Propriétés d’adsorption des apatites
L’intérêt porté à la contamination des eaux souterraines, des nappes phréatiques et des sols par les métaux lourds et les molécules nocives provenant des déchets industriels est de plus en plus accru, à cause de l’effet indésirable de ces entités chimiques sur la santé des êtres vivants, et sur le déséquilibre des écosystèmes. C’est pourquoi leur élimination s’avère de plus en plus primordiale afin de préserver notre environnement.
L’apatite a été largement utilisée, grâce à sa grande capacité d’adsorption et d’échange, comme matériau capable d’immobiliser différents métaux lourds tels que, Cd2+, Cu2+, Fe2+, Zn2+, Pb2+,U4+ [95-97], et divers molécules organiques toxiques comme les colorants [98] et les pesticides [99-101]. Sa capacité d’adsorption a été aussi exploitée dans des réactions de catalyse [102].
II.3.1. Adsorption de quelques ions et métaux lourds II.3.1.1. Cas des apatites phosphocalciques
Comme il est connu, le phénomène d’adsorption groupant plusieurs mécanismes tels que la complexation à la surface, la diffusion, l’échange ionique… etc. Quelques exemples cités dans la littérature, concernant en particulier les propriétés d’adsorption des métaux lourds et des macromolécules par l’apatite, sont discutés dans ce paragraphe consacré exclusivement aux rappels des différentes études d’adsorption en solution. Nous nous intéressons seulement aux travaux réalisés sur des apatites avec différents adsorbats, en particulier l’adsorption de quelques métaux lourds, principalement l’ion Pb2+, par différents supports. Nous mettrons l’accent sur les différents autres adsorbants, utilisés pour l’élimination des métaux lourds.
II.3.1.1.1. Adsorption des métaux lourds
grand intérêt dans de nombreux domaines d’applications, en particulier dans les domaines des biomatériaux et la protection de l’environnement.
Des mécanismes ont été avancés pour expliquer la bonne affinité des apatites vis-à-vis des métaux lourds liée à la fois à la nature du métal et celle de l’apatite. Nous nous limitons notre rappel aux trois types de métaux toxiques largement utilisés dans l’industrie, à savoir le plomb le cadmium et le zinc. La détermination du mécanisme d’adsorption de ces métaux lourds sur l’hydroxyapatite a suscité un grand intérêt [103]. a) Adsorption du plomb
Le plomb est parmi les éléments les plus toxiques. Il en existe plusieurs isotopes stables dans la nature dont 208Pb est le plus abondant d’entre eux. Pour cela, plusieurs études ont été consacrées à l’immobilisation des ions Pb2+ des solutions aqueuses et des sols contaminés par différents adsorbants (charbon actif, argile, silice) afin de déterminer leur capacité d’adsorption vis-à-vis de cet élément [104-106]. Cependant, l’élimination des ions Pb2+ par les apatites a reçu une attention particulière par rapport aux autres métaux lourds à cause de leur toxicité d’une part et de la nature du précipité formé à la fin de la réaction entre le solide apatitique et les ions Pb2+ en solution d’autre part [107,108].
Plusieurs études ont été menées pour déterminer les mécanismes d’adsorption des ions Pb2+ sur les apatites, en particulier l’hydroxyapatite qui est analogue au composé minéral osseux [99,109-120] et dont les propriétés physico-chimiques sont importantes. En outre, un filtre à base d’apatite a été aussi utilisé pour l’immobilisation des ions Pb2+ avec d’autres ions tels que Zn2+ et Co2+ [121].
Dans ce sens, plusieurs travaux ont été réalisés sur l’utilisation des hydroxyapatites bien cristallisées pour l’élimination des ions Pb2+ des solutions aqueuses et des sols contaminés par ces éléments [107-109]. Ces études ont évoqué le mécanisme de l’élimination de Pb2+ selon deux processus : la dissolution de l’hydroxyapatite suivie de la précipitation d’un phosphate de plomb (hydroxypyromorphyte) Pb10(PO4)6(OH)2 suivant les deux équations ci-après: