© Aicha Melouane, 2020
Rôle du gène induit par l'exercice, SPARC, contre la
sarcopénie: lien possible entre la matrice extracellulaire
et la fonction mitochondriale
Thèse
Aicha Melouane
Doctorat en médecine moléculaire
Philosophiæ doctor (Ph. D.)
RÔLE DU GÈNE INDUIT PAR L’EXERCICE, SPARC, CONTRE LA
SARCOPÉNIE : LIEN POSSIBLE ENTRE LA MATRICE EXTRACELLULAIRE ET LA FONCTION MITOCHONDRIALE.
Thèse
Aicha Melouane
Sous la direction de :
ii
Résumé
Le vieillissement est un concept complexe. De nombreuses théories ont été proposées dans le but d’expliquer le processus du vieillissement. La théorie mitochondriale du vieillissement est devenue l’une des théories les plus testées et les plus connues dans la recherche sur le vieillissement. Sa principale conclusion est que le vieillissement résulte de l’accumulation de dommages oxydatifs qui sont étroitement liés à la libération d’espèces réactives de l’oxygène (ROS) des mitochondries. Le vieillissement musculaire est habituellement associé à une diminution de la masse, de la force et de la vitesse de contraction. L’un des effets les plus marquants du vieillissement sur les muscles est la sarcopénie (sarco = chair et pénie = perte). Il a été suggéré que la sarcopénie peut être déclenchée par les ROS qui se sont accumulées tout au long de la vie. Le mode de vie sédentaire et la malnutrition représentent des facteurs de risques majeurs pour ce syndrome. Bien qu’il n’existait pas de définition opérationnelle universellement acceptable, les chercheurs conviennent que l’incidence de la sarcopénie augmente avec l’âge adulte avancé. Ainsi, comprendre la sarcopénie et développer des interventions thérapeutiques et de réadaptation pour ralentir ses progrès ou inverser partiellement ses effets est un enjeu scientifique très important. Dans ce contexte, notre équipe a identifié les gènes modulés dans le muscle squelettique après un exercice d’endurance chez les personnes âgées et a mis en évidence l’importance du remodelage de la matrice extracellulaire (MEC) et de la fonction mitochondriale dans l’adaptation du muscle squelettique en utilisant une technique de génomique fonctionnelle. L’un des gènes induit par l’exercice d’endurance code pour une protéine sécrétée acide et riche en cystéine (SPARC), qui contrôle le remodelage de la MEC et joue un rôle clé dans la différenciation des myoblastes.
Le travail présenté dans cette thèse consiste à analyser les données bibliographiques indiquant l’importance de la génomique fonctionnelle dans la compréhension de la sarcopénie et à démontrer les rôles de SPARC dans le lien possible entre le remodelage de la MEC et la fonction mitochondriale.
iii
Le premier objectif de cette thèse était de décrire les stratégies de génomique fonctionnelle, principalement les techniques de l’expression différentielle : puces à ADN, analyse en série de l’expression des gènes (SAGE), L'ordonnancement parallèle massif de signature (MPSS), séquençage de l’ARN (RNAseq), l’analyse différentielle représentationnelle (RDA) et l’hybridation suppressive soustractive (SSH). De plus, nous avons démontré l’importance de ces techniques pour découvrir de nouvelles cibles thérapeutiques pour certaines maladies complexes ainsi que l’application de ces outils pour étudier la modulation du transcriptome du muscle squelettique.
Notre deuxième objectif était de démontrer l’implication de différentes techniques de génomique fonctionnelle telles que l’interférence ARN, protéomique, souris transgéniques, métabolomique, génomique et épigénomique dans la compréhension de la sarcopénie. De plus, nous avons signalé la progression des nouvelles découvertes et des nouvelles applications de ces méthodes dans le domaine de la sarcopénie.
Notre troisième objectif était de montrer l’implication de SPARC dans la modulation de la MEC et de la fonction mitochondriale des cellules musculaires murines C2C12. Nous avons étudié l’effet exogène de l’inhibition ou l’induction de SPARC sur la différenciation des cellules C2C12, l’expression des protéines structurelles de la MEC et les protéines mitochondriales durant la prolifération, la différenciation et après la formation des myotubes. Nos résultats indiquent que SPARC joue un rôle crucial dans la différenciation des cellules musculaires, dans le remodelage de la MEC, et pourrait être impliquée dans le lien possible entre la MEC et la fonction mitochondriale.
Finalement, nous avons étudié le mécanisme par lequel SPARC pourrait moduler la MEC et la fonction mitochondriale dans les cellules musculaires et nous avons utilisé la technique de la stimulation électrique, in vitro, qui a révélé une induction remarquable de l’expression génique de Sparc.
Les résultats de cette étude nous ont permis de démontrer que SPARC joue un rôle important dans le remodelage du MEC ainsi que dans la modulation de la fonction mitochondriale des cellules musculaires. Le lien possible entre la MEC et la mitochondrie pourrait constituer une cible thérapeutique prometteuse pour le traitement des maladies ou les syndromes liés à un dysfonctionnement de la MEC/mitochondrie. Enfin, on croit
iv
aussi que cette voie ouvrira les portes à de nouvelles découvertes dans le domaine de la sarcopénie.
v
Abstract
The definition of aging is complicated by the appearance of various diseases that alter body functions and tissue structures. Many theories have been proposed to explain the process of aging. The mitochondrial theory of aging has become one of the most tested and well-known theories in aging research. Its main conclusion is that aging results from the accumulation of oxidative damage which is closely related to the release of reactive oxygen species (ROS). On the other hand, aging in the muscle is usually associated with a decrease in mass, strength, and rate of contraction. One of the most striking effects of aging on muscles is sarcopenia, (sarco = flesh and penia = loss). It has been suggested that sarcopenia can be triggered by ROS which are accumulated over a lifetime. Sedentary lifestyle and malnutrition represent major risk factors for this syndrome. Although there is no operational definition which is universally acceptable, researchers agree that the incidence of sarcopenia increases with advancing adulthood. Thus, understanding sarcopenia and developing therapeutic and rehabilitative interventions to slow its progress or partially reverse its effects is a very important scientific issue. In this context, our team identified modulated genes in skeletal muscle after endurance exercise in the elderly and highlighted the importance of extracellular matrix remodeling (ECM) and mitochondrial function using a functional genomic technique. One of the genes induced by endurance exercise codes for a secreted acid-rich cysteine protein (SPARC), which controls the remodeling of the ECM and plays a key role in the differentiation of myoblasts.
The work presented in this thesis consists of analyzing bibliographic data indicating the importance of functional genomics in understanding sarcopenia and to demonstrate the roles of SPARC in the possible link between ECM remodeling and mitochondrial function.
The first objective of this thesis was to describe functional genomic strategies, mainly the techniques of differential expression: DNA chips, serial analysis of gene expression (SAGE), massively parallel signature sequencing (MPSS), RNA sequencing (RNAseq), representational differential analysis (RDA), and subtractive suppression hybridization (SSH). In addition, we have demonstrated the importance of these techniques to discover new therapeutic targets for certain complex diseases as well as the application of these tools to study the modulation of the skeletal muscle transcriptome.
vi
Our second objective was to demonstrate the involvement of different functional genomic techniques such as RNA interference, proteomics, transgenic mice, metabolomics, genomics and epigenomics in the understanding of sarcopenia. In addition, we have reported the progress of new discoveries and applications of these methods in the field of sarcopenia.
Our third objective was to show the involvement of SPARC in the modulation of ECM and the mitochondrial function of C2C12 murine muscle cells. We investigated the exogenous effect of SPARC (inhibition and or induction) on C2C12 cell differentiation, expression of ECM structural proteins, and mitochondrial proteins during proliferation, differentiation, and after the formation of myotubes. Our results indicate that SPARC plays a crucial role in muscle cell differentiation, remodeling of ECM and may be involved in the possible link between ECM and mitochondrial function.
Finally, we investigated the mechanism by which SPARC could modulate ECM and mitochondrial in muscle cells and we used the technique of electrical stimulation, in
vitro, which revealed a remarkable induction of Sparc gene expression.
The results of this study allowed us to demonstrate that SPARC plays an important role in the remodeling of ECM as well as in modulating the mitochondrial function of muscle cells. The possible link between ECM and mitochondria may be a promising therapeutic target for the treatment of ECM/mitochondria dysfunction-related diseases. It is also believed that this pathway will open the doors to new discoveries in the field of sarcopenia.
vii
Table des matières
Résumé ... ii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xii
Listes des abréviations ... xiii
Remerciements ... xvi
Avant-propos ... xix
Introduction ... 1
Chapitre 1 : Vieillissement et la sarcopénie ... 2
1. Phénomène du vieillissement ... 2
1.1 Théories biologiques modernes du vieillissement ... 2
1.2 Mitochondries et vieillissement ... 3
1.3 Vieillissement musculaire ... 8
1.4 Conclusion ... 9
2. La sarcopénie : un syndrome gériatrique avec de nombreux enjeux ... 10
2.1 Pourquoi s’intéresser à la sarcopénie ? ... 10
2.2 Notion de la sarcopénie ... 10
2.3 Plusieurs définitions ... 11
2.4 Prévalence de la sarcopénie et nécessité d’une définition opérationnelle ... 14
2.5 Outils de dépistages de la sarcopénie ... 15
2.6 Étiologie et mécanismes ... 21
2.7 Sarcopénie et autres conditions ... 34
2.8 Interventions pour lutter contre la sarcopénie ... 40
2.9 La prévention est la clé... 51
2.10 Défis dans la prévention de la sarcopénie ... 51
2.11 Conclusion ... 53
II. Le muscle squelettique et la matrice extracellulaire ... 56
1. Muscle squelettique ... 56
2. Matrice extracellulaire ... 67
2.1 Vue d’ensemble ... 67
2.2 MEC de muscle squelettique ... 78
2.2.1 Structure ... 80
2.2.2 Composition ... 81
2.2.3 MEC dans la régulation de la niche des cellules souches musculaires ... 83
viii
2.2.5 MEC et la fonction motrice du muscle squelettique ... 86
2.2.6 MEC et la fonction métabolique du muscle squelettique ... 87
2.2.7 Modifications pathologiques de la MEC ... 88
2.2.8 Le vieillissement et la MEC ... 89
2.2.9 Conclusion ... 89
3. SPARC (ostéonectine), une glycoprotéine matricellulaire avec des fonctions biologiques importantes ... 91 3.1 Découverte ... 91 3.2 Gène SPARC ... 91 3.3 L’expression de SPARC ... 92 3.4 Récepteurs putatifs ... 93 3.5 Structure protéique ... 94
3.6 La famille de protéines SPARC ... 95
3.7 Diverses fonctions ... 98
3.8 SPARC et le remodelage osseux ... 99
3.9 Modèles animaux ... 100
3.10 SPARC dans le muscle squelettique ... 101
3.11 SPARC et la mitochondrie du muscle squelettique ... 103
3.12 SPARC, gène induit par l’exercice ... 103
3.13 SPARC et le vieillissement musculaire ... 104
3.14 SPARC et la sarcopénie ... 104
3.15 SPARC dans différentes maladies ... 106
3.16 Conclusion ... 110
Hypothèses et objectifs de recherche... 111
Chapitre 2 - Differential gene expression analysis in ageing muscle and drug discovery perspectives ... 113
Résumé ... 114
Abstract ... 116
1. Introduction ... 117
2. Differential gene expression ... 119
2.1 DNA microarrays ... 119 2.2 SAGE ... 123 2.3 RNA seq ... 126 2.4 MPSS ... 130 2.5 SSH... 132 2.6 RDA ... 134 2.7 ESTs ... 136 3. Conclusion ... 139 References ... 141
ix
Chapitre 3 - Functional genomics applications and therapeutic implications in
sarcopenia ... 154
Résumé ... 155
1. Introduction ... 158
2. Genetic manipulations ... 162
2.1 RNAi ... 162
2.2 Genetically modified mice ... 166
2.3 Transcriptomics ... 170
3. Proteomics ... 171
3.2 Proteomics technologies and age-associated changes in muscle ... 172
3.3 Challenges ... 173
4. Metabolomics ... 174
4.1 Metabolomics and sarcopenia ... 174
4.2 Limits ... 175
5. Genomics ... 175
5.1 Single nucleotide polymorphism (SNPs) ... 175
5.2 Copy number variation (CNV) ... 176
6. Epigenomics ... 177
6.1 Epigenetics and sarcopenia ... 177
6.2 Limitations ... 178
7. Conclusion ... 178
References ... 183
Chapitre 4 - Implication of SPARC in the modulation of the extracellular matrix and mitochondrial function in muscle cells ... 190
Résumé ... 191
Abstract ... 193
Introduction ... 194
Materials and Methods ... 196
Results ... 200
Discussion ... 214
Conclusion ... 218
References ... 223
Chapitre 5 - Sparc, an EPS-induced gene, modulates the extracellular matrix and mitochondrial function via ILK/AMPK pathways in C2C12 cells ... 229
Résumé ... 230
Abstract ... 232
Introduction ... 234
Materials and methods ... 236
Results ... 240
Discussion ... 249
Conclusion ... 254
Appendix ... 258
References ... 259
Chapitre 6 - Extracellular matrix/mitochondria pathway: a novel potential target for sarcopenia ... 264
x
Résumé ... 265
Abstract ... 267
Introduction ... 268
Mitochondria and sarcopenia... 271
ECM remodeling in sarcopenia ... 277
Conclusion ... 281
References ... 284
Conclusion ... 297
xi
Liste des tableaux
Tableau 1 : Quelques troubles mitochondriaux causés par des mutations/délétions de
l’ADNmt ... 6
Tableau 2 : Principaux changements musculaires liés à l’âge... 9
Tableau 3 : Degrés conceptuels de la sarcopénie selon EWGSOP ... 13
Tableau 4 : Suggestions de catégorisation de la sarcopénie par l’EWGSOP ... 13
Tableau 5 : Comparaison des définitions de la sarcopénie ... 14
Tableau 6 : Techniques de mesure de la masse musculaire squelettique ... 17
Tableau 7 : Évaluation des performances physiques ... 19
Tableau 8 : Questionnaire SARC-F ... 20
Tableau 9 : Cytokines inflammatoires liées à l’âge ... 28
Tableau 10 : Les signes cliniques et les symptômes du syndrome de malnutrition-sarcopénie ... 30
Tableau 11 : Différentes définitions des conditions caractérisées par la perte de la masse, de la force et/ou de la fonction musculaire ... 34
Tableau 12 : Comparaison des conséquences métaboliques de la sarcopénie à celles de la cachexie ... 36
Tableau 13 : Critères de classification des fibres musculaires ... 57
xii
Liste des figures
Figure 1 : Théories biologiques modernes du vieillissement. ... 2
Figure 2 : Représentation d’une mitochondrie animale... 4
Figure 3 : Algorithme de dépistage de la sarcopénie proposé par le groupe de travail EWGSOP. ... 16
Figure 4 : L’origine multifactorielle de la sarcopénie. ... 22
Figure 5 : Rôle de la diminution du nombre de copies de l’ADNmt dans le vieillissement musculaire. ... 31
Figure 6 : Changements liés à l’âge de la fonction mitochondriale dans le muscle squelettique. ... 33
Figure 7 : Mécanismes et conséquences de la sarcopénie et de l’obésité... 38
Figure 8 : Approche complète de la sarcopénie. ... 51
Figure 9 : Anatomie du muscle squelettique. ... 57
Figure 10 : Le muscle squelettique est un organe sécréteur. ... 63
Figure 11 : Composition moléculaire de la MEC. ... 68
Figure 12 : Le complexe PINCH-ILK-parvin. ... 73
Figure 13 : Présentation schématique des différentes couches de la MEC du muscle squelettique. ... 79
Figure 14 : Localisation cytogénétique du gène SPARC. (Genome Decoration Page/NCBI) ... 92
Figure 15 : Facteurs qui régulent l’expression du SPARC ... 93
Figure 17 : La famille de protéines SPARC. ... 96
Figure 18 : Protocole expérimental. ... 293
Figure 19 : Certains effets de l’âge et de l’exercice d’endurance sur les souris sauvages et transgéniques (Sparc KO) ... 295
xiii
Listes des abréviations
ADN acide désoxyribonucléique ADNmt ADN mitochondrial
AMPK adenosine monophosphate-activated protein kinase
AMS ARD
masse musculaire squelettique appendiculaire domaines à répétition ankyrine
ARN acide ribonucléique
ARNm ARN messager
ARNr ARN ribosomal
ARNt ARN de transfert ATP adénosine triphosphate BDNF
BMP-2
facteur neurotrophique dérivé du cerveau protéine morphogénétique osseuse 2 BIA bio-impédancemétrie bp CH paires de bases calponin homology CHI3L1 chitinase-3-Like-1 COL collagène CR restriction calorique CRP protéine C-réactive CVD maladies cardiovasculaires.
DEXA absorptiométrie biphotonique à rayon X DHEA déhydroépiandrostérone
DMD EGF
dystrophie musculaire de Duchenne facteur de croissance épidermique
ESPEN European Society of Clinical Nutrition and Metabolism
ETC chaîne de transport des électrons
EWGSOP European Working Group on Sarcopenia in Older People
FAK kinase d’adhésion focale
FF fast and fatigue
FGF-21 facteur de croissance des fibroblastes-21
FN fibronectine
FNIH foundation for the National Institutes of Health
FP force de préhension
FR fast and resistance
FSTL-1 follistatin-like-1
g gramme
GH hormone de croissance GLUT-4 transporteur de glucose 4
HMB Bêta -hydroxy-bêta-méthylbutyrate HSP protéine de choc thermique
IANA International Academy on Nutrition and Aging
IGF-1 facteur de croissance 1 ressemblant à l’insuline
IL Interleukine
ILK Integrin-linked kinase
IMC indice de masse corporelle
xiv
IRM imagerie par résonance magnétique IWGS
KD
International working group on sarcopenia kinase-like domain kg kilogramme KO Knock-out LIF LPS LOX
facteur inhibiteur de la leucémie
protéine de liaison de lipopolysaccharides lysyl oxydase
m2 mètre carré
MAPK mitogen-activated protein kinase
MEC matrice extracellulaire MMP
mg
métalloprotéinases matricielles milligrammes
MRF facteur de transcription myogénique MSS malnutrition-sarcopenia syndrome
mTORC1 mammalian target of rapamycin complex 1
MuRF1 MyHC
protéine de muscle à motif en doigt chaînes lourdes de myosine
Myf5 myogenic factor 5
MyoD myogenic differentiation
NF-κB O
nuclear factor-kappa B
souris âgées
OXPHOS phosphorylation oxydative PAX
Pb2+
Paired box ion plomb
PDGF platelet-derived growth factor
PGC-1α PMA KO
peroxisome proliferator-activated receptor gamma coactivator 1 alpha
phorbol 12-myristate 13-acétate souris knock-out
ROS espèces réactives de l’oxygène
S slow
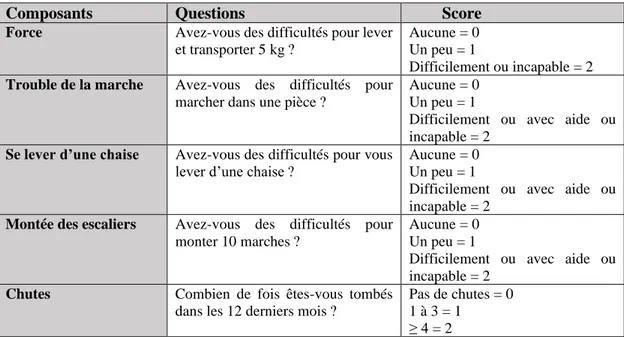
SARC-F force, troubles de marche, lever d’une chaise, montée des escaliers et les chutes
Sed souris sédentaire SCPT stair climb power test
SIRT1 silent mating type information regulation 2 homolog sirtuin 1
SCP -1 protéine semblable à SPARC
SPARC protéine sécrétée acide et riche en cystéine SPPB short physical performance battery
SSCWD Society of Sarcopenia, Cachexia and Wasting Disorders
TGF- β facteur de croissance transformant bêta TGUG timed get up and go test
TIMP inhibiteurs tissulaires des métalloprotéases matricielles TNF-α facteur de nécrose tumorale alpha
VO2max capacité aérobie maximale
VEGF WT Y
vascular endothelial growth factor
souris sauvages souris jeunes
xv
« Existe-t-il en nous un gène de l’enfance, celui qui nous préserverait à travers nos âges ? Fasse le destin que jamais aucun biologiste ne le découvre. Il serait capable de le détruire et serait l’assassin de l’espérance. »
xvi
Remerciements
En préambule à ce mémoire, je remercie ALLAH pour m’avoir donné la force et la patience nécessaires pour terminer ma thèse, après tous les défis et les difficultés.
Mes remerciements vont tout d’abord au corps professoral et administratif de la Faculté de la Médecine, représenté par docteure Francine DUROCHER, pour la qualité, la diversité et la richesse de leur enseignement pour assurer une formation moderne et actualisée.
À mon directeur de thèse, docteur Jonny ST-AMAND, mon Monitor :
Vous me faites l’honneur de diriger cette thèse. Merci de m’avoir accordé ce projet et d’avoir eu confiance en moi. Merci pour vos précieux conseils et votre investissement sans faille dans l’élaboration de ce travail. Un grand merci pour votre aide, votre inspiration et votre temps. Que vous trouverez dans ce travail un hommage vivant à votre haute personnalité !
À ma coordinatrice de recherche, docteure Mayumi YOSHIOKA, la femme exemplaire :
Je tiens à vous remercier très chaleureusement pour l’orientation, la confiance et la patience qui ont constitué une base très solide pour mener ce projet au bon port. Votre présence quotidienne, votre professionnalisme et votre incroyable intelligence ont marqué mon parcours professionnel et personnel. La patience que vous m’avez témoignée ainsi que les conseils que vous m’avez prodigués ont été déterminants dans la réalisation de notre travail de recherche. Merci également de votre passion envers mes questions. Vos talents et votre amitié se sont manifestés jusqu’aux derniers instants. Merci !
À notre collaborateur/membre de jury, docteur Jack PUYMIRAT, source de professionnalisme :
Ce mémoire n’aurait pas été possible sans l’intervention et la consciente du Dr Puymirat. Vous me faites l’honneur de figurer comme membre du jury de ma thèse. Je vous réitère tous mes remerciements pour votre collaboration. Trouvez ici le témoignage de ma
xvii
profonde gratitude. Un grand merci pour vos impulsions, vos suggestions, votre regard critique et votre lecture attentive.
À notre membre de jury, docteur Denis JOANISSE, source de la connaissance scientifique très pointue :
Je tiens à exprimer toute ma gratitude au Dr Joanisse. Le regard critique et pertinent que vous avez porté sur l’ensemble de mon travail, durant mon examen ainsi que mon séminaire de doctorat m’a apporté un éclairage enrichissant et m’a permis d’engager ma réflexion pour choisir une bonne orientation scientifique.
À notre membre de jury, docteure Isabelle DIONNE :
Mes vifs remerciements vont certainement au Dr Dionne pour l’intérêt qu’elle a porté à notre travail en acceptant d’examiner cette thèse et de l’enrichir par ses précieuses propositions. C’est un grand honneur et un grand plaisir d’avoir communiqué avec vous.
À mes chers parents, mon Trésor :
Être parents est une grande science dont vous êtes les savants, les prophètes et les artistes. Par amour, vous avez fait de moi la plus heureuse chouette. Papa & maman, vous êtes mon précieux trésor et mes plus beaux cadeaux de vie. Mes sincères remerciements pour votre soutien moral et financier. On a 26 lettres de l’alphabet pour composer mille mots, mais je ne trouve pas ces mots pour m’exprimer.
À mon futur mari, mon amour, Mon Âme :
Mon bébé d’amour, merci pour tout ce que t’as fait, tu le fais et tu le feras pour moi : tu m’écoutes quand je te raconte mes soucis et tu me remontes le moral. Tu m’encourages, tu me consoles, tu me rassures et tu me pousses à aller de l’avant quand je perds confiance en moi. Tu as fait de ma vie un beau rêve rose et je ne pourrais jamais assez te remercier pour ça ! Bref, je ne sais pas ce que je ferais sans toi dans ma vie !
À ma grande sœur Québécoise, Marie-Claude BOULIENNE DORÉE, source d’espoir :
Un grand merci pour ta présence réconfortante et ton soutien dans les périodes de doute. Ta présence à ces moments si particuliers de ma vie est un précieux cadeau. J’ai vécu des périodes si difficiles plus d’une fois et j’ai pensé que je ne pourrai jamais voir le bout du tunnel. À chacune de ces périodes, tu étais là pour m’aider à avancer, me rassurer et me
xviii
réconforter. Mes remerciements ne pourront jamais égaler ton beau cœur qui m’a apporté du soutien, de l’amour et de l’espoir au moment où j’avais vraiment besoin. Tu es mon ange gardien ! Merci encore !
À toute ma famille/amis, point de force :
Mes frères, mes sœurs, mes neveux, mes nièces, mes amis et mes collègues : un grand merci pour votre présence réconfortante et votre soutien dans les moments de doute.
J’adresse enfin des remerciements spéciaux à toutes les personnes qui ont participé de près ou de loin à la réalisation de ce travail.
xix
Avant-propos
En 2012, j’ai décidé de venir à Québec, cette belle ville accueillante, et de commencer mon aventure à l’Université Laval. Je me suis inscrite en médecine moléculaire parce que je voulais découvrir la recherche dans le domaine de la gériatrie. Joindre le laboratoire de « Génomique fonctionnelle », du Dr Jonny St-Amand, au Centre de Recherche du CHU de Québec-Université Laval m’a offert beaucoup d’opportunités et a représenté pour moi un enjeu très personnel et professionnel, car j’ai vécu six ans de ma vie dans un endroit marqué par la découverte scientifique. Au début, j’ai commencé à apprendre quelques techniques de laboratoire telles que : l’extraction d’ARN et des protéines, l’électrophorèse par gel d’agarose, l’amplification en chaîne par polymérase (ou PCR pour polymerase chain reaction) et le Western blot. Notre collaboration avec l’équipe du Dr Jack Puymirat, m’a aidé à la mise au point de culture cellulaire pour commencer mon projet de recherche. L’article illustrant ce travail a été publié en 2018, dans PLOS ONE.
J’ai eu la chance d’aller au Japon pour découvrir ce monde scientifique grâce à notre collaboration avec Dr Makoto Kanzaki. Cette nouvelle aventure qui a duré trois mois dans le laboratoire de recherche en nanoscience biomédicale, Université de Tohoku, Sendai, m’a mené à la mise au point de la technique de stimulation d’impulsions électriques et à l’utilisation de la technique PCR en temps réel « Q-RT-PCR ».
Pendant mes années d’études, j’ai rédigé/participé à la rédaction des articles scientifiques qui sont rapportés dans les chapitres :
Le chapitre 2 contient l’article « Differential gene expression analysis in ageing
muscle and drug discovery perspectives » qui a été publié en 2018 dans Ageing Research Reviews (IF : 10,39). Cette revue était supervisée par Dr Jonny St-Amand et
Dr Mayumi Yoshioka avec la participation de mes collègues : Abdelaziz Ghanemi et Simon Aubé. J’ai collecté, analysé et rédigé le contenu de cette publication.
Le chapitre 3 contient l’article « Functional genomics applications and
xx
Research Reviews (IF : 6,08). Cette revue était supervisée par Dr Jonny St-Amand et Dr
Mayumi Yoshioka avec la participation de mon collègue : Abdelaziz Ghanemi. J’ai collecté, analysé et rédigé le contenu de cette revue.
Le chapitre 4 contient l’article « Implication of SPARC in the modulation of
the extracellular matrix and mitochondrial function in muscle cells ». Cet article a été
publié en 2018 dans PLOS ONE (IF : 2,77). Ce travail a été supervisé par Dr Jonny St-Amand, Dr Jack Puymirat et Dr Mayumi Yoshioka avec la participation de l’étudiant Antoine Carbonell. Pour ce projet, j’étais responsable de la conception des expériences, de leur réalisation, de la conception des méthodes d’analyse, de l’analyse des résultats, et de la rédaction du manuscrit.
Le chapitre 5 contient l’article « Sparc, an EPS-induced gene, modulates the
extracellular matrix and mitochondrial function via ILK/AMPK pathways in C2C12 cells ». Cet article a été publié en mai 2019 dans Life Sciences (IF : 3,44). Ce
travail a été supervisé par Dr Jonny St-Amand, Dr Makoto Kanzaki et Dr Mayumi Yoshioka. Pour cet objectif, j’étais responsable de la conception des expériences, de leur réalisation, de la conception des méthodes d’analyse, de l’analyse des résultats, et de la rédaction du manuscrit.
Enfin, ces éléments nous ont conduits à suggérer que la voie MEC/mitochondrie pourrait constituer une nouvelle cible thérapeutique pour le traitement de la sarcopénie. Cet article est présenté dans le chapitre 6 « Extracellular matrix/mitochondria pathway : a novel
potential target for sarcopenia » a été publié en octobre 2019 dans Mitochondrion (IF : 3,44). Ce travail a été supervisé par Dr Jonny St-Amand et Dr Mayumi Yoshioka. J’étais
responsable de la collection, l’analyse et la rédaction de ce manuscrit.
J’ai participé aux expériences qui ont mené à :
1) La publication de :
* « Identification of the principal transcriptional regulators for low-fat and high-fat
meal responsive genes in small intestine », article publié en 2017 dans Nutrition & Metabolism (je suis le deuxième auteur cet article qui a été supervisé par Dr Jonny
St-xxi
Amand Dr Mayumi Yoshioka avec la participation de : Octave Mucunguzi, Abdelaziz Ghanemi, André Boivin et Ezequiel-Luis Calvo).
** « Energy and metabolic pathways in trefoil factor family member (Tff2) KO mice
beyond the protection from high-fat diet induced obesity », article publié en 2018 dans Life Sciences (je suis le deuxième auteur de cet article qui a été supervisé par Dr Jonny
St-Amand Dr Mayumi Yoshioka avec la participation de : Abdelaziz Ghanemi et Octave Mucunguzi).
*** « Secreted protein acidic and rich in cysteine and bioenergetics : Extracellular
matrix, adipocytes remodeling and skeletal muscle metabolism », article publié en
octobre 2019 dans The International Journal of Biochemistry & Cell Biology, (je suis le deuxième auteur de cet article qui a été supervisé par Dr Jonny St-Amand Dr Mayumi Yoshioka avec la participation de : Abdelaziz Ghanemi).
2) La soumission de :
* « Functional genomics and obesity : Elucidating molecular mechanisms toward
discovering novel therapeutic targets », article soumis en septembre 2019 dans Obesity Research & Clinical Practice, (je suis le deuxième auteur de cet article qui a été supervisé
par Dr Jonny St-Amand Dr Mayumi Yoshioka avec la participation de : Abdelaziz Ghanemi).
Enfin, j’ai pris ma place dans notre laboratoire et j’ai même aidé mes collègues : Octave Mucunguzi (M.Sc.), Nesrine Nachi (M.Sc.) et Abdelaziz Ghanemi (étudiant au doctorat) ainsi que quelques stagiaires (Olivier Royer, Timothty Santos, Simon Aubé et Masahiro Hosoya) dans leurs travaux et leurs expériences pour leur faciliter la familiarisation avec les techniques utilisées.
1
Introduction
Le vieillissement est un déclin progressif de la fonction physiologique intrinsèque, entraînant une augmentation de taux de mortalité et une diminution de la reproduction liée à l’âge1. Bowen et Atwood ont défini ce phénomène comme étant « tout changement
dans un organisme au fil du temps » 2. Cette définition inclut les changements liés à la
perte (sénescence) et au gain de fonction (la croissance et le développement) 2. En tant
que tel, « le vieillissement correspond à l’ensemble des processus physiologiques et
psychologiques qui modifient la structure et les fonctions de l’organisme à partir de l’âge mûr, résultant de l’interaction de facteurs génétiques et environnementaux auxquels est soumis l’organisme tout au long de sa vie » 3. La population mondiale continue de vieillir
rapidement, les indices de fécondité sont tombés en dessous du taux requis pour le renouvellement des générations dans la plupart des régions du monde et les gens ont tendance à vivre plus longtemps4. De 2025 à 2050, la population âgée devrait presque doubler à 1,6 milliard dans le monde, alors que la population totale ne progressera que de 34 % au cours de la même période4. Au Québec, le vieillissement de la population s’avère encore. Selon l’institut national de santé publique du Québec (INSPQ), d’ici une dizaine d’années, la société québécoise sera l’une des plus vieilles en occident (l’espérance de vie des Québécois dépassera 80 ans) et environ 1 personne sur 4 sera âgée de 65 ans et plus (https://www.inspq.qc.ca/le-vieillissement-au-quebec). De plus, l’INSPQ annonce que la proportion d’aînés âgés de 85 ans et plus frôlera les 25 % en 2061 et que 57 % des personnes âgées sont atteintes d’incapacité physique (lien avec la mobilité et l’agilité des mains). Face à ce choc démographique et les conséquences économiques et sociales du vieillissement de la population, une bonne distinction du vieillissement normal et pathologique ainsi qu’une meilleure connaissance des mécanismes impliqués dans ce processus nous permettent d’envisager des stratégies susceptibles de prévenir certains effets du vieillissement.
2
Chapitre 1 : Vieillissement et la sarcopénie
1. Phénomène du vieillissement
1.1 Théories biologiques modernes du vieillissement
Le processus du vieillissement est complexe et multifactoriel. Plusieurs questions se posent : pourquoi vieillissons-nous ? Y a-t-il une limite à notre âge ? Quel est le marqueur du vieillissement ? Quand commençons-nous à vieillir ?
De nombreuses théories ont été proposées pour tenter d’expliquer le processus de vieillissement. Les théories biologiques modernes du vieillissement humain se divisent en deux catégories5 : les théories du vieillissement programmé et les théories du vieillissement variable. La figure 1 résume les théories biologiques modernes du vieillissement.
Figure 1 : Théories biologiques modernes du vieillissement.
Toutefois, on comprend maintenant que le vieillissement est une interaction complexe de la régulation génétique et de l’accumulation des dommages. De plus, ces théories n’ont pas expliqué certains phénotypes de vieillissement comme la fibrose et le vieillissement prématuré. De ce fait, une nouvelle théorie a été proposée pour comprendre les rôles des dommages environnementaux, de la réparation, de la régulation génique et de la structure multicellulaire dans le processus de vieillissement (the
Misrepair-accumulation theory) 6. Le concept de cette théorie a été défini comme la reconstruction incorrecte d’une structure, après la réparation des dommages d’origine, peut entraîner un changement de structure (molécule/cellule/tissu) et une réduction de la fonction6.
3
L’augmentation de l’insertion de fragments d’ADN mitochondrial (ADNmt) dans l’ADN nucléaire au cours du vieillissement, la peroxydation accrue des lipides dans les membranes cellulaires et la diminution de l’autophagie sont les trois mécanismes selon lesquels des dommages cellulaires irréversibles peuvent être causés. Ces dommages peuvent avoir trois destins cellulaires : 1) mort cellulaire par apoptose ou nécrose, 2) sénescence cellulaire et dysfonctionnement dans les tissus post-mitotiques et 3) cellules défectueuses dans les tissus mitotiques pouvant conduire au cancer7.
En fait, de nombreuses théories sur les mécanismes des changements liés à l’âge ont été rapportées. Cependant, aucune théorie n’est suffisamment capable d’expliquer le processus de vieillissement. Ces théories se contredisent souvent entre elles8.
1.2 Mitochondries et vieillissement
La théorie radicalaire repose sur l’accumulation d’agressions oxydantes provoquées par les radicaux libres provenant principalement du métabolisme de l’oxygène et de l’azote9. Depuis que cette hypothèse a été élaborée, plusieurs études ont mis l’accent sur
la mitochondrie, organelle productrice des espèces réactives de l’oxygène (ROS) 10, et son génome.
1.2.1 Généralités
Il a été rapporté que la mitochondrie est née depuis deux milliards d’années suite à l’engloutissement d’une α-protéobactérie par un précurseur de la cellule Eucaryotique moderne11. Ces organelles cellulaires sont entourées de deux membranes : une membrane interne entourant la matrice mitochondriale et formant de nombreux plis (crêtes) qui s’étendent à l’intérieur (ou à la matrice) de l’organelle et une membrane
externe délimitant l’espace intermembranaire
4
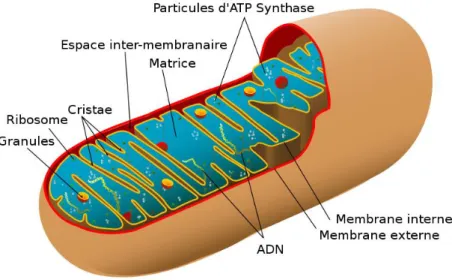
Figure 2 : Représentation d’une mitochondrie animale. Source de l’image : Mariana Ruiz Villarreal LadyofHats, Wikipédia.
Chacun de ces composants joue des rôles fonctionnels distincts : la matrice et la membrane interne représentent les principaux compartiments des mitochondries. La matrice contient le système génétique mitochondrial ainsi que les enzymes responsables des réactions centrales du métabolisme oxydatif, la membrane interne représente le site principal de la génération d’ATP et contient plus de 70 % des protéines impliquées dans la phosphorylation oxydative ainsi que dans le transport des métabolites (par exemple pyruvate et acides gras) entre le cytosol et les mitochondries. La membrane externe est librement perméable aux petites molécules à cause des protéines appelées porines, qui forment des canaux qui permettent la diffusion libre de molécules inférieures à environ 6000 daltons. Grâce à leur capacité à produire de l’ATP, les mitochondries sont devenues une force motrice de l’évolution12.
1.2.2 Génome mitochondrial
Bien que les mitochondries aient conservé le caractère de double membrane de leurs ancêtres, leur forme et leur composition globales ont été radicalement modifiées et elles ont acquis une myriade de fonctions supplémentaires dans la cellule12. En 1961, une découverte a été faite concernant la structure mitochondriale quand Mitchell a mis en évidence les principes fondamentaux de la fonction mitochondriale13. La découverte était
5
que les mitochondries contiennent leur propre système génétique, qui est séparé et distinct du génome nucléaire de la cellule13. Les génomes mitochondriaux sont généralement des molécules d’ADN circulaires, comme celles des bactéries, présentes en plusieurs copies par organite. Ils varient considérablement en taille entre les différentes espèces12. Le génome mitochondrial humain par exemple, code pour 13 protéines qui sont impliquées dans le transport d’électrons et la phosphorylation oxydative (7 pour le complexe I, 1 pour le complexe III, 3 pour le complexe IV et 2 pour le complexe V). Ainsi, les 22 ARN de transfert (ARNt) et les 2 ARN ribosomaux (ARNr) qui sont (16S et 12S) nécessaires à la synthèse de ces polypeptides dans la mitochondrie12.
1.2.3 Maladies mitochondriales
L’ADNmt peut être altéré par des mutations qui sont souvent délétères pour l’organite. Ces altérations ont été décrites depuis 198814,15 et pouvaient être acquises ou
transmises. Elles sont à l’origine des maladies nommées cytopathies mitochondriales dont le dénominateur commun est un déclin dans la chaîne respiratoire mitochondriale 16,17. Certains troubles mitochondriaux pourraient affecter un seul organe
comme pour la neuropathie optique héréditaire de Leber, maladie héréditaire qui se manifeste par une baisse brutale de la vision et peut être causée par des mutations dans les gènes mitochondriaux qui codent pour des composants de la chaîne de transport d’électrons, alors que de nombreuses autres maladies mitochondriales pourraient impliquer plusieurs organes et présenteraient souvent des caractéristiques neurogéniques et myopathiques importantes (https://www.ncbi.nlm.nih.gov/books/NBK1422/). Les troubles mitochondriaux peuvent survenir à tout âge18 et prédisposer aux maladies communes telles que : maladie d’Alzheimer, maladie de Parkinson et diabète19. Le tableau 1 résume quelques maladies mitochondriales causées par des mutations de l’ADNmt.
6
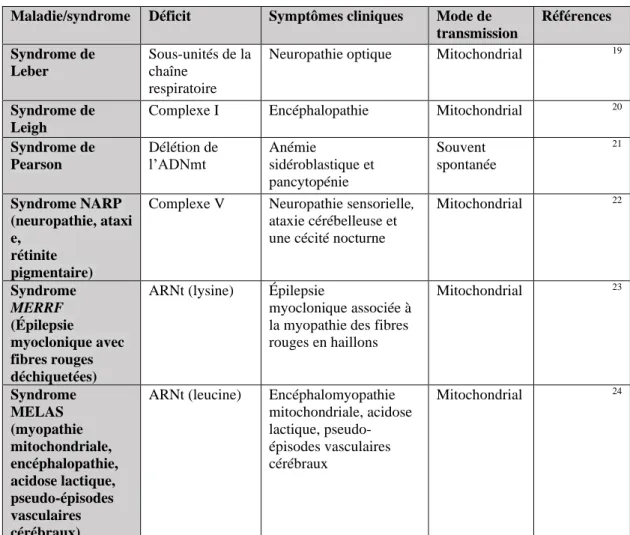
Tableau 1 : Quelques troubles mitochondriaux causés par des mutations/délétions de l’ADNmt
Maladie/syndrome Déficit Symptômes cliniques Mode de transmission Références Syndrome de Leber Sous-unités de la chaîne respiratoire
Neuropathie optique Mitochondrial 19
Syndrome de Leigh
Complexe I Encéphalopathie Mitochondrial 20
Syndrome de Pearson Délétion de l’ADNmt Anémie sidéroblastique et pancytopénie Souvent spontanée 21 Syndrome NARP (neuropathie, ataxi e, rétinite pigmentaire)
Complexe V Neuropathie sensorielle, ataxie cérébelleuse et une cécité nocturne
Mitochondrial 22 Syndrome MERRF (Épilepsie myoclonique avec fibres rouges déchiquetées)
ARNt (lysine) Épilepsie
myoclonique associée à la myopathie des fibres rouges en haillons Mitochondrial 23 Syndrome MELAS (myopathie mitochondriale, encéphalopathie, acidose lactique, pseudo-épisodes vasculaires cérébraux)
ARNt (leucine) Encéphalomyopathie mitochondriale, acidose lactique, pseudo-épisodes vasculaires cérébraux
Mitochondrial 24
Comme l’ADNmt, l’ADN des génomes nucléaires peut être aussi altéré. Chez les enfants, la plupart des cytopathies mitochondriales sont causées par des mutations dans les gènes nucléaires qui sont impliqués dans l’assemblage des complexes de la chaîne respiratoire, la réplication de l’ADNmt, la fusion et la fission du réseau mitochondrial25.
Par exemple, la frataxine est une protéine de la matrice mitochondriale codée par le noyau dont la déficience cause l’ataxie de Friedrich, maladie neuromusculaire génétique caractérisée par la dégénérescence spinocérébelleuse26. Durant plusieurs décennies, les vitamines et les suppléments nutritionnels ont été utilisés comme traitement des maladies mitochondriales, mais sans aucun bénéfice prouvé27. De nouvelles approches
moléculaires ciblées (acides nucléiques, nucléases mitochondriales et acides nucléiques peptidiques) ont été proposées, cependant, la polyploïdisation du génome mitochondrial, le phénomène de l’hétéroplasmie et la difficulté de créer des modèles animaux présenteraient de vrais défis pour le développement de thérapies pour les maladies mitochondriales28.
7
1.2.4 Implication de la mitochondrie dans le processus du vieillissement
Le processus de vieillissement est caractérisé par des déclins progressifs et irréversibles des réserves physiologiques de l’organisme, ce phénomène est encore mal compris. Selon la théorie radicalaire du vieillissement, sous l’effet des radicaux libres et des ROS, une accumulation progressive des mutations dans l’ADNmt conduisait à un déclin inévitable de la fonction mitochondriale9. Ces mutations pourraient entraîner un dysfonctionnement de la chaîne respiratoire mitochondriale ce qui conduit à une augmentation de la production des ROS et à une accumulation subséquente des mutations29. D’autres arguments ont soutenu cette théorie :
▪ La détection des cellules musculaires cardiaques déficientes en cytochrome-c-oxydase, l’enzyme terminale de la chaîne respiratoire, dans des tissus post-mitotiques vieillissants30.
▪ L’existence d’une corrélation inversée entre la production des ROS, l’activité métabolique et la longévité chez certaines espèces animales31.
▪ L’implication du superoxyde dismutase et la catalase dans la longévité et les maladies dégénératives32.
▪ Rôle de la restriction calorique (CR) dans la diminution de l’accumulation des délétions de l’ADNmt33.
En effet, il a été suggéré que durant le vieillissement, la mitochondrie est la source majeure des ROS et elle-même constitue la première cible de ces espèces29. Des études
sur des modèles animaux âgés ont montré une corrélation positive entre le vieillissement et la présence des mutations dans l’ADNmt34. De plus, une sensibilité particulière du
stress oxydant de l’ADNmt ainsi que sa transcription altérée durant la sénescence ont été rapportées. En outre, des altérations structurales et fonctionnelles des mitochondries liées au vieillissement ont été rapportées34. De ce fait, les nouvelles perspectives de recherche pour les thérapies des pathologies liées au vieillissement se focalisent sur les mitochondries. Mais la question qui se pose est : comment une mutation dans un génome individuel pourrait se développer au niveau clonal dans des cellules ?
8
Autres théories ont été encore proposées, telles que : la réplication sélective de l’ADNmt, la longévité des mitochondries qui contenaient de l’ADNmt muté et l’hypothèse de la mitochondrie malade35.
Le génome mitochondrial humain a été séquencé depuis 198136 et des progrès significatifs dans le domaine mitochondrial continuent d’être faits, toutefois, l’implication des mutations de l’ADNmt dans le vieillissement et les maladies neurodégénératives fait toujours l’objet de débats.
1.3 Vieillissement musculaire
Des changements liés à l’âge dans la composition et la structure du muscle squelettique ont été observés37. Parmi ces changements, une infiltration de tissu adipeux et conjonctif et une réduction de la masse musculaire (responsable de 30 % de la dépense énergétique au repos et du renouvellement des protéines ainsi que 70 % de la masse cellulaire corporelle) qui diminuent d’environ 3-8 % par décennie après l’âge de 30 ans et ce taux de déclin est encore plus élevé après l’âge de 60 ans38. L’un des effets les plus frappants de l’âge est donc la perte involontaire de la masse, de la force et de la fonction musculaire39. Cette perte involontaire est la cause fondamentale du handicap chez les personnes âgées. De plus, la diminution de la masse musculaire (qui est impliquée dans le métabolisme et l’activité physique) s’accompagne également d’une augmentation progressive de la masse grasse et par conséquent des modifications de la composition corporelle qui sont des éléments clés de processus du vieillissement et de la physiopathologie des maladies chroniques38. La diminution de la masse osseuse,
l’augmentation de la raideur articulaire et l’apparition de la cyphose pourraient avoir des implications probables dans certaines conditions, y compris le diabète type 2, l’obésité, les maladies cardiaques et l’ostéoporose40. Le tableau 2 présente les principaux
9
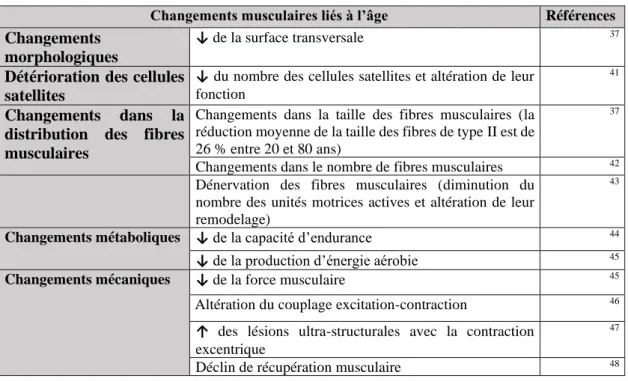
Tableau 2 : Principaux changements musculaires liés à l’âge
Changements musculaires liés à l’âge Références
Changements morphologiques
↓ de la surface transversale 37
Détérioration des cellules satellites
↓ du nombre des cellules satellites et altération de leur
fonction
41
Changements dans la
distribution des fibres musculaires
Changements dans la taille des fibres musculaires (la réduction moyenne de la taille des fibres de type II est de 26 % entre 20 et 80 ans)
37
Changements dans le nombre de fibres musculaires 42
Dénervation des fibres musculaires (diminution du nombre des unités motrices actives et altération de leur remodelage)
43
Changements métaboliques ↓ de la capacité d’endurance 44
↓ de la production d’énergie aérobie 45
Changements mécaniques ↓ de la force musculaire 45
Altération du couplage excitation-contraction 46
↑ des lésions ultra-structurales avec la contraction
excentrique
47
Déclin de récupération musculaire 48
1.4 Conclusion
Le vieillissement est un processus complexe qui est habituellement associé à une diminution de la masse, de la force et de la vitesse de contraction. De nombreuses théories ont été proposées pour expliquer le processus de vieillissement, mais aucune d’entre elles ne semble pleinement satisfaisante. Au niveau cellulaire, le vieillissement est causé par un déclin progressif de la fonction mitochondriale.
Des recherches supplémentaires sont nécessaires pour démêler la complexité des voies cellulaires régies par les mitochondries, identifier le rôle joué par chacun de ces processus dans le vieillissement et établir dans quelle mesure le dysfonctionnement mitochondrial est impliqué dans les pathologies ou syndromes liés à l’âge.
L’élucidation de ces cruciaux problèmes pourrait fournir probablement aux cliniciens des traitements novateurs et plus efficaces pour contrer le vieillissement musculaire.
10
2. La sarcopénie : un syndrome gériatrique avec de nombreux enjeux
La deuxième partie de ce premier chapitre nous permet de mieux comprendre les changements musculaires liés à l’âge, en particulier la perte involontaire de la masse, de la force et de la fonction musculaire, on parle de la sarcopénie.
2.1 Pourquoi s’intéresser à la sarcopénie ?
Pendant des années, le muscle squelettique était le parent pauvre des recherches, toutefois, les maladies neurologiques, l’ostéoporose et les maladies cardiovasculaires ont fait l’objet de plusieurs réunions et des travaux scientifiques. Le vieillissement est le plus important facteur de risque des maladies humaines49 et sur environ 150 000 personnes qui décèdent chaque jour à travers le monde, les deux tiers meurent de causes liées à l’âge50. De ce fait, développer des recherches dans ce domaine devient une nécessité urgente surtout si on sait qu’une réduction d’environ 0,23 kg de masse musculaire par an est attendue entre 30 et 60 ans et que 30 % de la population âgée de plus de 65 ans est concernée par cette fonte musculaire.
De plus, il a été rapporté que la diminution de la masse musculaire est associée à une augmentation des coûts d’hospitalisation51. La sarcopénie augmente les risques de
décès, des chutes et d’ostéoporose52, 53. En conséquence, ce syndrome gériatrique
augmente de 30 à 50 % les coûts d’hospitalisation, il s’agit donc d’un véritable défi socio-économique54. Par exemple, les coûts directs des soins de santé imputables à la sarcopénie
étaient de 8,5 milliards de dollars (10,8 milliards de dollars chez les hommes et 7,7 milliards chez les femmes) aux États-Unis55.
2.2 Notion de la sarcopénie
La diminution de la masse maigre corporelle et l’augmentation de la masse grasse liée à l’âge est l’un des changements les plus constants et continuels qui ont des conséquences fonctionnelles et métaboliques très importantes.
Les muscles squelettiques et la masse osseuse sont les principaux composants de la masse maigre qui diminue avec l’âge56. C’est en 1931 que la perte de la masse
musculaire avec l’avancée en âge a été observée pour la première fois dans les muscles intrinsèques des mains et des pieds57. Des années après, les premières données
11
prospectives sur la diminution de la masse musculaire liée à l’âge ont été rapportées58. En 1988, Irwin Rosenberg a constaté que « aucun déclin lié l’âge n’est plus dramatique ou
potentiellement plus significatif que le déclin de la masse musculaire » et a proposé plus
tard le terme sarcopénie, ayant pour origine deux racines grecques (sarcos = chair et
penia = pauvreté, manque), pour décrire cette diminution de la masse musculaire liée à
l’âge59.
2.3 Plusieurs définitions
2.3.1 Sarcopénie comme un syndrome gériatrique
Les syndromes gériatriques sont des états communs, complexes et coûteux d’altération de la santé chez les personnes âgées qui résultent des interactions incomplètement comprises entre la maladie et l’âge, produisant une constellation de signes et de symptômes60. Ces syndromes partagent de nombreuses caractéristiques communes : très répandues chez les personnes âgées, ont un impact très important sur la qualité de vie et peuvent impliquer plusieurs systèmes d’organes61. En effet, la sarcopénie : 1) est très répandue chez les personnes âgées62, 2) a de multiples facteurs contributifs63 et 3) représente un état de santé détérioré avec un lourd tribut personnel64. De ce fait, la sarcopénie a été considérée comme un syndrome gériatrique.
2.3.2 Définition basée sur la masse musculaire
La sarcopénie a été définie comme un déclin progressif de la masse musculaire lié à l’âge65. Dans ce contexte, certaines études ont suggéré des critères basés sur l’utilisation
de certaines méthodes comme l’absorptiométrie biphotonique à rayon X (DEXA) pour quantifier la masse musculaire. Par exemple, Baumgartner et al., ont résumé la masse musculaire des quatre membres en tant que masse musculaire squelettique appendiculaire (AMS) et ont exprimé la masse musculaire comme AMS/taille2 (kg/m2). Les individus ayant une AMS inférieure à au moins deux écarts-types par rapport à celui d’une population de référence plus jeune sont atteints de sarcopénie66. D’autres auteurs ont utilisé l’indice de la masse musculaire squelettique (IMS) basé sur la masse musculaire squelettique totale divisée par le poids corporel et le résultat multiplié par 100. Ces
12
chercheurs ont considéré deux stades de la sarcopénie : 1) stade 1 lorsque l’indice est compris entre 1 et 2 par rapport à une population de référence plus jeune et 2) stade 2 lorsque l’indice est inférieur à 267. En 2003, une autre méthode basée sur la AMS ajustée pour la taille et la masse grasse corporelle a été proposée pour suggérer la nécessité de l’implication de la masse grasse pour l’estimation de la prévalence de la sarcopénie chez les femmes et chez les personnes obèses68.
2.3.3 Définition consensuelle de la sarcopénie
Quatre groupes de travail sur la sarcopénie ont proposé des définitions consensuelles de la sarcopénie. Ils sont présentés par un ordre chronologique de leur publication :
▪ The European Society of Clinical Nutrition and Metabolism (ESPEN) : a défini la
sarcopénie comme « une condition caractérisée par la perte de la masse et de la force
musculaire » 69. Ce groupe a alors considéré la sarcopénie comme une maladie des
personnes âgées, mais a stipulé que son développement peut être associé à d’autres conditions qui ne sont pas exclusivement observées chez les personnes âgées, telles que : la malnutrition, l’alitement, l’immobilité, l’inactivité physique, les maladies neurodégénératives et la cachexie69.
▪ The European Working Group on Sarcopenia in Older People (EWGSOP) : a
introduit la sarcopénie comme « un syndrome caractérisé par une perte progressive et
généralisée de la masse musculaire squelettique et de la force avec un risque d’effets indésirables tels qu’un handicap physique, une mauvaise qualité de vie et la mort » 70. Ce groupe a recommandé d’utiliser la masse musculaire et la fonction musculaire (force ou performance) pour le diagnostic de la sarcopénie. Il a justifié l’utilisation de deux critères par le fait que la force musculaire ne dépend pas uniquement de la masse musculaire et que la relation entre la force et la masse n’est pas linéaire70. Ainsi, définir la sarcopénie uniquement en termes de masse musculaire est trop étroit et peut avoir une valeur clinique limitée. Certains auteurs ont soutenu que le terme dynapénie est mieux adapté pour décrire la perte de la force et de la fonction musculaire liée à l’âge71.
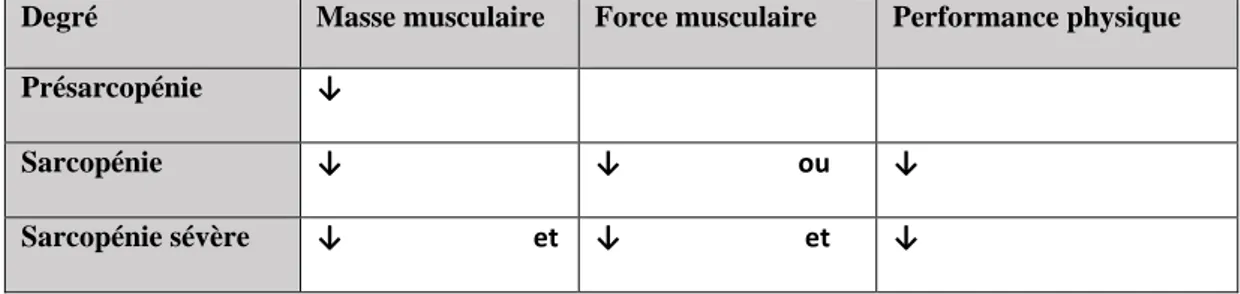
Cependant, la sarcopénie est déjà un terme largement reconnu et donc le remplacer pourrait conduire à plus de confusion70. EWGSOP a suggéré d’utiliser 3 degrés
conceptuels : la présarcopénie, la sarcopénie et la sarcopénie sévère70. Le tableau 3
13
Tableau 3 : Degrés conceptuels de la sarcopénie selon EWGSOP
Degré Masse musculaire Force musculaire Performance physique
Présarcopénie ↓
Sarcopénie ↓ ↓ ou ↓ Sarcopénie sévère ↓ et ↓ et ↓
En outre, deux catégories de la sarcopénie ont été proposées par le EWGSOP :
sarcopénie primaire (aucune cause évidente hormis l’âge ne peut être incriminée) et sarcopénie secondaire (plusieurs facteurs de risques qui sont impliqués) 70. Le tableau 4 présente les différentes catégories de la sarcopénie proposées par le EWGSOP.
Tableau 4 : Suggestions de catégorisation de la sarcopénie par l’EWGSOP
Sarcopénie primaire
Sarcopénie liée au vieillissement Aucune cause évidente hormis le vieillissement
Sarcopénie secondaire
Sarcopénie liée à l’inactivité Sarcopénie liée à une maladie chronique
Sarcopénie liée à la nutrition
Sédentarité, immobilisation et déconditionnement.
Maladie endocrinienne, cancer, défaillance avancée d’un organe ou une maladie inflammatoire.
Rapport inapproprié d’énergie et/ou de protéine lié à une mauvaise absorption, des désordres gastro-intestinaux ou l’usage de substances médicamenteuses.
i. The International Working Group on Sarcopenia (IWGS)
Selon ce groupe, la sarcopénie est « la perte de la masse et de la fonction du
muscle squelettique liée à l’âge » 72. Les causes de la sarcopénie sont multifactorielles et
peuvent inclure la désuétude, l’altération de la fonction endocrinienne, les maladies chroniques, l’inflammation, la résistance à l’insuline et les carences nutritionnelles72.
ii. The Society of Sarcopenia, Cachexia and Wasting Disorders (SSCWD)
On parle de la « sarcopénie à mobilité réduite » qui serait un terme acceptable pour définir les personnes ayant besoin d’une intervention thérapeutique. Selon ces auteurs, la sarcopénie est « un syndrome, non pas une maladie, défini comme une
personne avec une perte musculaire dont la vitesse de marche est inférieure ou égale à 1 m/s ou qui marche moins de 400 m lors d’un test de marche de 6 minutes » 73.
14
En plus de EWGSOP70 et SSCWD73, d’autres organisations, International
Academy on Nutrition and Aging (IANA), Asian Working Group for Sarcopenia (AWGS)
74 et Foundation for the National Institutes of Health (FNIH) 75, ont redéfini la sarcopénie
comme étant une fonction musculaire limitée (vitesse de marche ou distance ou force de préhension) associée à une masse musculaire faible. Le tableau 5 résume les différentes définitions de la sarcopénie.
Tableau 5 : Comparaison des définitions de la sarcopénie
Définition Fonction Masse musculaire
EWGSOP Vitesse de marche Force de préhension
Masse musculaire faible
IANA Vitesse de marche Masse maigre appendiculaire faible/taille2
SSCWD 6 min de marche Vitesse de marche
Masse maigre appendiculaire faible/taille2
AWGS Vitesse de marche Force de préhension
Masse maigre appendiculaire faible/taille2
FNIH Vitesse de marche Force de préhension
Masse maigre appendiculaire faible/indice de masse corporelle
2.4 Prévalence de la sarcopénie et nécessité d’une définition opérationnelle
La prévalence de la sarcopénie varie selon : la définition appliquée, méthode et instrument de mesure, la race, le sexe des échantillons étudiés et la population de référence utilisée. Dans ce contexte, les études qui ont appliqué la définition basée uniquement sur la masse musculaire66, 76 ont montré une prévalence plus élevée (de 9,4 %
à 18,8 %) que celles qui ont pris en considération la masse musculaire, la force musculaire et les performances physiques70, 73 (de 3,3 % à 14,2 %). De plus, une étude a comparé les
caractéristiques cliniques de la sarcopénie définies par EWGSOP et IWGS et a montré que la prévalence de la sarcopénie était de 5,8 % à 14,9 % chez les hommes et de 4,1 % à 16,6 % chez les femmes et que les valeurs obtenues avec la définition EWGSOP sont plus élevées que celles obtenues par la définition de IWGS indépendamment de l’indice de la masse musculaire utilisé77. En effet, la méthode utilisée pour mesurer la masse musculaire a aussi influencé les résultats obtenus. En 1998, Baumgartner a montré que la sarcopénie était de 20 % chez les hommes âgés de 70 et 75 ans et de 40 % chez les femmes du même groupe d’âge en utilisant la technique de l’impédancemétrie66. Deux ans plus tard, le même auteur a publié des données sur la même population en utilisant la DEXA
15
et il a montré que la sarcopénie était de 8,8 % chez les femmes et 13,5 % chez les hommes âgés de 60-69 ans et 16 % chez les femmes et 29 % chez les hommes de plus de 80 ans78.
D’un autre côté, des études ont montré que la sarcopénie touchait 40 % des personnes âgées hospitalisées en soin de suite et réadaptation et que sa prévalence est associée à une perte de mobilité52. Une récente publication effectuée sur 778 personnes âgées hospitalisées a montré qu’un patient dénutri est forcément sarcopénique, mais le vice versa n’est pas obligatoirement correct (80 % de patients sarcopéniques contre 37,4 % de patients dénutris) 79.
Donc, la sarcopénie devrait être diagnostiquée chez les patients dénutris ou non dénutris79.
2.5 Outils de dépistages de la sarcopénie
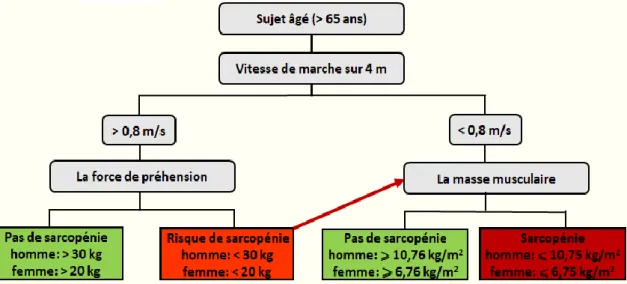
En 2045, de 19 à 32 millions de personnes de plus de 65 ans seront sarcopéniques80. Au regard de son impact, il est impératif de la diagnostiquer et de la prendre en charge. Le diagnostic devrait s’appuyer sur des indicateurs spécifiques de la masse musculaire, de la force ainsi que des performances physiques. De ce fait, le EWGSOP a établi un algorithme de diagnostic intégrant les trois paramètres de sa définition70. Bref, cet algorithme est basé sur la vitesse de marche et sa valeur limite a été fixée à 0,8 m/s. Si la vitesse de marche est inférieure de 0,8 m/s, on mesure la masse
Depuis que Rosenberg a inventé la notion de sarcopénie en 1989, un grand nombre d’études ont été publiées pour aborder le rôle de la sarcopénie chez les personnes âgées vivant dans la communauté et dans divers contextes cliniques. En 2010, EWGSOP a recommandé d’utiliser la masse et la fonction musculaire (force ou performance) pour définir la sarcopénie. En effet, définir la sarcopénie
uniquement en termes de masse musculaire ne tiendrait pas compte d’autres modifications musculaires importantes liées à l’âge qui affectent fortement la qualité, la force et la puissance musculaire. Actuellement, la définition
suggérée par EWGSOP est la plus utilisée. Toutefois, la grande variabilité de résultats entre les différentes études confirme la nécessité d’une définition opérationnelle qui nous permet de différencier les sujets sarcopéniques et non sarcopéniques et de définir les normes applicables qui seront utiles pour facilement caractériser la sarcopénie dans les différentes populations.
16
musculaire et/ou force musculaire70. La figure 3 présente l’algorithme de dépistage de la sarcopénie proposé par le EWGSOP.
Figure 3 : Algorithme de dépistage de la sarcopénie proposé par le groupe de travail EWGSOP.
i. Évaluation de la masse musculaire : plusieurs techniques ont été utilisées pour mesurer
la masse musculaire squelettique81. Le coût, la disponibilité et la facilité d’utilisation peuvent déterminer les techniques qui sont mieux adaptées à la pratique clinique ou à la recherche. Le tableau 6 présente les différentes techniques de mesure de la masse musculaire.