Impacts des rayons ultraviolets (UV) sur la capacité
de migration de trois lignées de mélanome humain
primaire
Mémoire
Maude Vaillancourt-Audet
Maîtrise en biologie cellulaire et moléculaire - avec mémoire
Maître ès sciences (M. Sc.)
Impacts des rayons ultraviolets (UV) sur la capacité de
migration de trois lignées de mélanome humain primaire
Mémoire
Maude Vaillancourt-Audet
Sous la direction de :
Véronique Moulin
François A. Auger
Résumé
Le mélanome est le cancer de la peau le plus mortel et l’exposition solaire est le facteur étiologique ayant la plus grande incidence sur son initiation. Cependant, l’influence des rayons UV sur la progression du mélanome primaire vers un état métastatique reste inconnue. Notre hypothèse est que les rayons UV peuvent, en plus d’initier la tumeur, stimuler la progression de la maladie vers un état métastatique. L’objectif de cette étude était donc de déterminer les conditions d’irradiation à utiliser, puis d’évaluer les effets directs et indirects des rayons UV sur la migration du mélanome.
Les lignées A375, WM983a et SK-MEL-28 ont été cultivés sous forme de sphéroïdes et traitées chroniquement aux rayons UV directement ou indirectement. Puis, leur migration a été évaluée dans deux modèles 3D, soit en gel de collagène I ou en chambre de Boyden inversée. L’exposition directe des sphéroïdes était constituée de 5 minutes d’irradiation (570J/m2) au simulateur solaire tous les 12h pendant 7 jours. Aucune différence
significative de migration des cellules cancéreuses n’a pu être observée dans cette condition. Pour l’exposition indirecte, les sphéroïdes ont été mis en contact avec un milieu de culture de kératinocytes immortalisés (HaCaT) ayant été préalablement irradiés de façon chronique aux UVB avec une dose de 75J/m2 tous les 12h pour un
total de quinze irradiations (CLUV). Une augmentation significative de la migration des cellules cancéreuses dans le milieu CLUV a été observée pour les sphéroïdes de WM983a et SK-MEL-28. Le profilage des cytokines présentes dans le milieu CLUV a révélé un enrichissement de nombreuses cytokines tel que PDGFaa. En conclusion, le milieu CLUV augmente le potentiel de migration des trois lignées de mélanome primaire. Ainsi, l’exposition chronique aux rayons UV pourrait donc indirectement induire un plus grand pouvoir métastatique via notamment l’action de cytokines surexprimées.
Table des matières
Résumé ... ii
Table des matières ... iii
Liste des Figures ... vi
Liste des tableaux ... viii
Liste des abréviations, sigles, acronymes ... ix
Remerciements ... xiii Introduction ... 1 1 La peau humaine ... 1 1.1 Structure de la peau ... 1 1.2 Les mélanocytes ... 3 1.3 La production de mélamine ... 3 1.4 La pigmentation cutanée ... 5 2 Le spectre solaire ... 6
2.1 Les rayons ultraviolets ... 7
2.2 Les chromophores dans la peau ... 8
2.3 Les systèmes de protection de la peau ... 8
2.4 L’exposition aux rayons UV et ses conséquences ... 10
2.4.1
Production de vitamine D3 ... 10
2.4.2
Espèces réactives à l’oxygène (ROS) ... 11
2.4.3
Dommages à l’ADN ... 11
2.4.4
Mutations et apoptose ... 16
2.4.5
Immunosuppression ... 17
2.4.6
Changement du phénotype des kératinocytes ... 18
2.5 Pathologies cutanées associées ... 20
2.5.1
Érythème cutané ... 20
2.5.2
Photo vieillissement ... 20
2.5.3
Cancers cutanés ... 21
3 Le mélanome cutané ... 24 3.1 Étiologie ... 243.1.1
Historique ... 24
3.1.2
Facteurs de risque ... 24
3.2 Caractérisation ... 263.2.1
Initiation ... 26
3.2.2
Mutations ... 26
3.2.3
Développement ... 28
3.2.4
Implication du microenvironnement tumorale ... 30
3.3 Modèles d’études ... 31
3.3.1
Modélisation du cancer ... 31
3.3.2
Migration des cellules cancéreuses ... 32
4 Problématique de recherche ... 33
4.1 Objectifs ... 34
Chapitre 1 : Matériel et méthodes ... 35
5 Culture ... 35
5.1 Provenance des cellules ... 35
5.2 Culture cellulaire ... 36 5.3 Formation de sphéroïdes ... 36 6 Irradiation ... 37 6.1 Test de sensibilité ... 37 6.2 Ponctuelle et chronique ... 37 7 Migration ... 37 7.1 2D ... 37 7.2 3D ... 38
7.2.1
Migration en chambre de Boyden inversé ... 38
7.2.2
3D- Migration en gel de collagène ... 38
8 Analyse ... 39
8.1 Immunohistochimie ... 39
8.2 Profil de cytokines ... 39
Chapitre 2 : Résultats ... 40
9 Choix des conditions d’irradiation ... 40
9.1 Test de sensibilité ... 40
9.2 Irradiation ponctuelle ... 41
9.3 Irradiations chronique ... 42
10 Impacts directs des rayons UV sur la migration du mélanome primaire ... 43
10.1 Migration en 2D ... 43
11 Impacts indirects des rayons UV sur la migration du mélanome primaire ... 47
11.1 Migration en 2D ... 47
11.2 Migration en 3D ... 48
11.3 Analyse du milieu CLUV ... 50
Discussion ... 53
11.4 L’irradiation chronique est plus représentative de la réalité ... 53
11.5 Les irradiations aux rayons UV n’ont pas d’effet direct sur la migration du mélanome primaire ... 54
11.6 Les rayons UVB ont un effet indirect sur la migration du mélanome primaire ... 55
Conclusion et perspective ... 58
Annexe A : Figures supplémentaires ... 59
Liste des Figures
Figure 1. La peau humaine.
Figure 2. Interaction entre les kératinocytes et les mélanocytes suite à une exposition solaire. Figure 3. Les phototypes cutanés.
Figure 4. Le spectre solaire.
Figure 5. Irradiance des rayons UV, à l’extérieur de l’atmosphère et au niveau de la mer. Figure 6 : Système de protection de la peau face aux rayons UV.
Figure 7 : Types de dommages à l’ADN causés par les rayons UV. Figure 8. Photo-produits de type CPD produits par les rayons UVB. Figure 9. Dommages indirects produits par les rayons UVA.
Figure 10. Chemins de signalisation activés lors de l’exposition solaire.
Figure 11 : Processus inflammatoire des kératinocytes après une exposition aux rayons UV. Figure 12. Les chemins signalétiques altérés dans le mélanome.
Figure 13. Évolution du mélanome cutané.
Figure 14 : Plaque de formation des sphéroïdes de mélanome. Figure 15 : Analyse de la migration des cellules cancéreuses en 3D. Figure 16 : Test de sensibilité des lignées de mélanome aux rayons UV.
Figure 17 : Analyse des cellules cancéreuses suite à différents traitements ponctuels au SSL.
Figure 18 : Profilage des cytokines (cytokine array®) présentent dans le surnageant de cellules cancéreuses irradiées de manière chronique au SSL.
Figure 19. Migration en 2D de cellules cancéreuses primaires suivant une irradiation chronique.
Figure 20 : Formation de sphéroïdes de mélanome primaire, analyse macroscopique et en immunohistochimie. Figure 21 : Immunofluorescence des cellules cancéreuses primaire WM983a irradiées de manière chronique sous forme de sphéroïde 24h après la dernière irradiation.
Figure 22 : Migration des cellules cancéreuses du sphéroïdes de WM983a irradiées de manière chronique. Figure 23 : Migration en 2D des lignées de mélanome primaire dans le milieu conditionné des kératinocytes aux rayons UVB (CLUV).
Figure 24 : Migration dans un gel de collagène I des lignées de mélanome primaire sous forme de sphéroïdes dans le milieu conditionné des kératinocytes aux rayons UVB (CLUV)
Figure 25 : Migration des cellules cancéreuses de sphéroïdes primaire en présence de milieu CLUV ou non Figure 26 : Profilage des cytokines (cytokine array®) présentent dans le surnageant de cellules HaCaT irradiées de manière chronique (CLUV).
Figure 27 : Migration en 2D de la lignée de mélanome primaire WM983a sur 24h dans un milieu minimum (DME) supplémenté en cytokines.
Figure 28 : Migration dans un gel de collagène I du mélanome primaire WM9983a sous forme de sphéroïdes dans le milieu conditionné des kératinocytes aux rayons UVB (CLUV) ainsi que dans un milieu supplémenté avec 10ng/ml de PDGFaa.
Figure 29 : Modèle théorique de progression du mélanome suivant une exposition chronique aux rayons. Figure 30 : Les mutations causé par les rayons UV dans les cancers de type non-mélanome.
Figure 31 : Risque de développer un mélanome selon l’âge et on fonction de l’exposition solaire et des mutations présentes.
Liste des tableaux
Liste des abréviations, sigles, acronymes
6-4P : Photo-produits de pyrimidine de type 6-4 8-oxodG : 8-oxo-2’-déoxyguanosine
8-OHdG: 8-hydroxydésoxyguanosine ADN : Acide désoxyribonucléotiques
AMPc : «Cyclic adenosine monophosphate» ou adénosine monophosphate cyclique AP-1 : «Activator protein 1» ou protéine activatrice 1
CAFs : «Cancer associated fribroblats» ou Fibroblastes associés à la tumeur CCL2 : «Chemokine (C-C motif) ligand 2» ou chemokine ligand 2
CDKN2A : «Cyclin-dependent kinase Inhibitor 2A» ou kinase cycline-dépendantes inhibitrice de 2A CHI3L1 : «Chitinase-3-like protein 1» ou protéine 1 de type chitinase 3
CPD : «Cyclobutane pyrimidine dimer» ou dimère cyclobutanique de pyrimidine CXCL1 : «Chemokine (C-X-C motif) ligand 1» ou chemokine CXCL1
DMEM : «Culbecco-Vogt modification of Eagle’s medium» FBS : «Fetal bovin serum» ou sérum fétal bovin
FGF : «Fibroblast growth factor» ou facteur de croissance de fibroblaste GDF-15 : «Growth differentiation factor 15» ou facteur de différenciation 15
GG-NER : «Global genome nucleotide excision repair» ou réparation du génome par excision de nucléotides GM-CSF : «Granulocyte-macrophage colony-stimulating factor» ou facteur stimulant les colonies de granulocytes de type macrophage
HaCaT : Lignées de kératinocytes immortalisés
HGF : «Hepatocyte growth factor» ou facteur de croissance des hépatocytes
ICAM-1 : «Intercellular adhesion molecule 1» ou molécule d’adhésion intercellulaire 1 IL-1, 4, 6, 10 : Interleukine 1, 4, 6 et 10
INCAM-110 : «Inducible cell adhesion molecule 110» ou molécule d’adhésion cellulaire inductible 110 L-DOPA : Levodopa ou I-3-4-dihydroxyphenylalanine
MAPK : «Mitogen-activated protein kinase» ou protéine kinase active par mitogène MCR1 : «Melanocortin 1 receptor» ou récepteur de la mélanocortine-1
MDM2 : «Mouse double minute 2» ou protéine E3 ubiquitine-ligase MEC : Matrice extracellulaire
MIF : «Macrophage migration inhibitory factor» ou facteur inhibiteur de la migration des macrophages MMP : «Matrix metalloproteinase» ou Métallo-protéase matricielle
MSHa: «Melanocyte-stimulating hormone» ou hormone stimulant les mélanocytes
NRAS : «Neuroblastoma RAS viral oncogene homolog» ou neuroblastome RAS homologue d’oncogène viral NF-KB: «Nuclear factor light-chain-enhancer of activated B cells» ou facteur nucléaire kappa-amplificateur de chaîne légère de cellules B activées
NK : «Natural Killer» ou tueur naturel
Notch3 : «Notch Receptor 3» ou récepteur Notch 3
NRF2: «Nuclear factor erythroid 2-related factor 2» ou facteur nucléaire lié au facteur 2 érythroïde 2 OCT : «Optimal Cutting Temperature» ou température de coupe optimale
PAF : «Platelet-activating factor» ou facteur d'activation plaquettaire
PBS : «Phosphate-buffered saline» ou solution saline tamponnée au phosphate PGE2 : «Prostaglandin E2» ou prostaglandin E2
ROS : «Reactive oxygen species» ou espèces oxydatives SCF : «Stem cell factor» ou facteur de cellules souches
SDF-1a : «Stromal cell-derived factor 1» ou facteur dérivé des cellules stromales 1 SSL : Simulateur solaire lumière visible
TAM : «Tumor associated macrophages» ou macrophage associé à la tumeur
TC-NER : «Transcription-coupled nucleotide excision repair» ou Réparation d'excision nucléotidique couplée à la transcription
TGFb : «Transforming growth factor beta» ou facteur de croissance bêta TIL : «Tumor infiltrating lymphocytes» ou lymphocyte T associé à la tumeur TME : «Tumor microenvironment» ou microenvironnement tumoral
TNFa : «Tumor necrosis factor» ou facteur de nécrose tumorale TYR : Tyrosinase
UCA : Acide urocanique UV : Ultraviolets UVB : Ultraviolets B UVA : Ultraviolets A
« Vous laisserez-vous abattre dans l’adversité ? Elle devrait plutôt ranimer vos forces. »
Proverbe chinois ; Le livre de la sagesse chinoise (1876)
Remerciements
Pour commencer, je remercie ma directrice Dre Véronique Moulin ainsi que mon co-directeur Dr François A. Auger pour m’avoir soutenu tout au long de ma maitrise. Particulièrement, Dr Auger pour le soutien financier durant mon parcours et Dre Moulin pour m’avoir accueillie au sein de son laboratoire. Grâce à vous, j’ai eu la chance de participer à nombre de rassemblements scientifiques d’ordre provincial, national et même international. À travers ces évènements, j’ai eu l’occasion de présenter mes travaux de recherche en plus d’échanger avec d’autres experts dans le domaine. J’ai ainsi pu me bâtir un réseau de contacts solide qui me sera utile tout au long de ma carrière et pour cela je vous remercie grandement.
Je tiens aussi à remercier le Dr Patrick J. Rochette ainsi que toute son équipe. Vous avez été d’une aide inestimable dans le cadre de la portion de mon travail sur les rayons solaires. Vos conseils ont été précieux. De plus, je vous remercie de m’avoir permis d’utiliser vos installations pour réaliser mes protocoles d’irradiations. Vous m’avez reçu dans votre laboratoire comme un membre à part entière de votre équipe et cela m’a considérablement touché. Je ne l’oublierai pas.
De plus, j’aimerais souligner le support moral que mes collègues de bureau, Vincent, Geneviève et Syrine, m’ont offert durant ces deux dernières années. Vous étiez toujours d’une oreille attentive et vous aviez toujours des suggestions pertinentes à partager lorsque j’étais bloqué. Pour ces raisons, je vous remercie profondément. Aussi, ma famille et mon copain, Jean-Christophe, vous avez été l’ancre qui m’a permis de ne pas me perdre ou de me laisser abattre dans ce parcours. Vous étiez toujours là pour me remettre à l’ordre, afin que je me concentre sur la solution et non sur les problèmes rencontrés. Merci de m’avoir écouté, supporté et encouragé dans ce projet qui, parfois, devait vous apparaitre plutôt flou.
Finalement, mon cheminement à la maitrise aura nécessité beaucoup de persévérance, mais il m’aura aussi permis de développer mes aptitudes d’organisation, d’écriture et surtout mon esprit critique. J’en ai aussi appris énormément sur moi-même, je me suis découverte des forces qui m’étaient jusqu’alors inconnues, c’est pourquoi cette réalisation représente ma plus grande fierté jusqu’à maintenant.
Merci à tous les gens qui, de près ou de loin, ont aidé à la réalisation de ce projet et, surtout, à m’épauler dans ce cheminement à dimension tout autant introspective que formative.
Introduction
1 La peau humaine
La peau est le plus grand organe du corps humain. En effet, le tégument occupe environ 16 % de la masse d’un individu (D'Orazio et al. 2013). Il s’agit d’un organe hétérogène et complexe exerçant différents rôles, soit le maintien de l’homéostasie thermique, le maintien de l’hydratation, la défense contre les pathogènes et la protection contre les agents extérieurs tel que les rayons ultraviolets (UV) (Grice and Segre 2011; Bangert, Brunner, and Stingl 2011). En effet, la peau est l’interface qui sépare le corps de l’environnement extérieur; elle assume donc un rôle de bouclier crucial contre les attaques physiques, chimiques et biologiques (Maddodi, Jayanthy, and Setaluri 2012). Cette fonction barrière est accomplie via différentes caractéristiques uniques à la peau au niveau de sa structure et de sa composition.
1.1 Structure de la peau
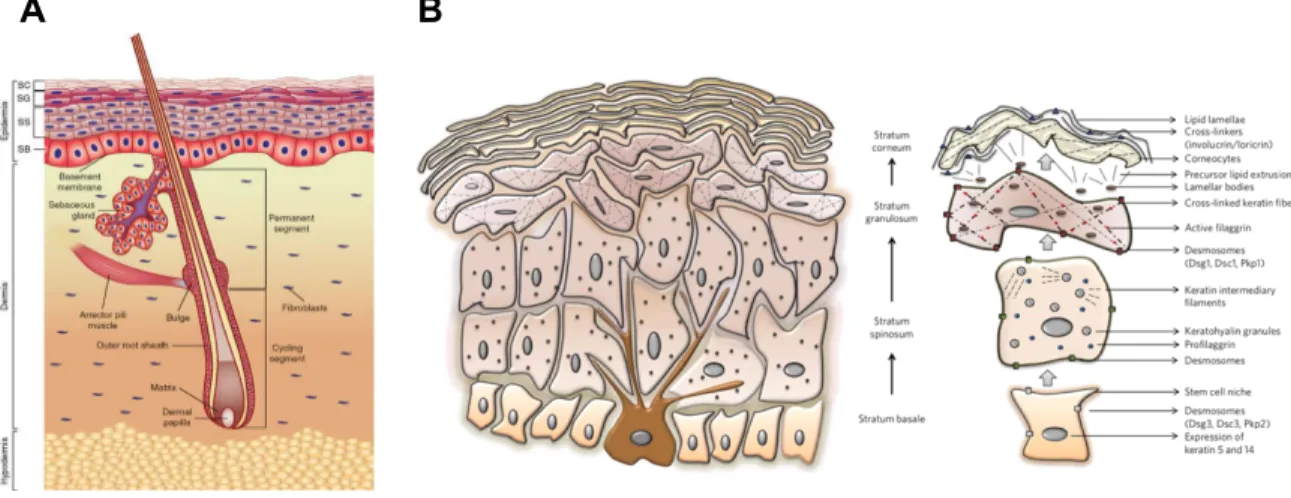
La peau est stratifiée en trois couches cellulaires distinctes, soit l’épiderme, le derme et l’hypoderme (Yousef, Alhajj, and Sharma 2019) (Figure 1A). L’épiderme, faisant face à l’environnement extérieur, provient du neuroectoderme (Fuchs 2007). Il est composé à 90% de kératinocytes qui sont caractérisés par l’expression de cytokératines formant la kératine, la protéine de structure majeure de l’épiderme. L’intégrité de la barrière physico-chimique est assurée par les desmosomes et les jonctions serrées présents aux niveaux des kératinocytes (Proksch, Brandner, and Jensen 2008; D'Orazio et al. 2013). Dans l’épiderme, les kératinocytes se retrouvent à différents niveaux de différenciation ce qui permet de les subdiviser en quatre couches cellulaires : la couche cornée, la couche granuleuse, la couche épineuse et la couche basale (D'Orazio et al. 2013).
Les différentes stratifications se distinguent, entre autres, par le type de jonction, le type de kératine exprimée, la présence ou l’absence d’un noyau ainsi que par la forme et la grosseur des cellules (Figure 1B). Ainsi, étant donné les agressions constantes de la peau, l’épiderme a développé un renouvellement optimal des kératinocytes à partir de la couche basale en plus d’apporter une étanchéité maximale au niveau de la couche cornée. Malgré leur importance capitale, les kératinocytes ne sont pas les seuls résidents de l’épiderme : les cellules immunitaires de type Langerhans (LC) associées à la réponse inflammatoire et les cellules de Merkel engagées dans la réponse tactile sont également présentes (Severson et al. 2017). Enfin, les mélanocytes, responsables de la pigmentation de la peau, sont présents dans les premières couches de l’épiderme, soit au niveau de la couche basale. Ces derniers sont d’un intérêt particulier dans ce travail; ils seront donc définis plus en détail dans la section subséquente.
Entre le derme et l’épiderme, se retrouve la lame basale qui se distingue par la présence, entre autres, de laminine et de collagène IV/VII apportant une adhérence optimale entre les deux couches cutanés (Aumailley and Smyth 1998; Ricard-Blum and Ruggiero 2005). Le derme est la couche intermédiaire de la peau. Celui-ci tire son origine embryonnaire du mésoderme. Il est principalement constitué de fibroblastes et de matrice extracellulaire (MEC) (D'Orazio et al. 2013). Cette couche joue un rôle important de soutien et de structure pour la peau. Elle y arrive via la formation de deux couches dermiques : le derme papillaire et le derme réticulaire.
Le premier se retrouve directement en dessous de l’épiderme, il se compose d’environ 70% de fibres de collagène produites directement par les fibroblastes. Le deuxième se retrouve au-dessus de l’hypoderme, il est beaucoup plus épais, mais possède une densité cellulaire bien plus faible. En effet, il est majoritairement composé de collagène et d’élastine qui forment, avec d’autres protéines de structure, la MEC. Celle-ci apporte la résistance et l’élasticité au derme (Ricard-Blum and Ruggiero 2005; Oikarinen 1994). Outre les fibroblastes, le derme est une couche diversifiée composée de follicules pileux, de vaisseaux sanguins, de glandes sudoripares et d’un réseaux de cellules immunitaires (Figure 1A) (Czyz 2019). Finalement, la dernière couche de la peau, l’hypoderme, est composée majoritairement d’adipocytes. Celle-ci possède plutôt un rôle de réserve lipidique et de support en plus de permettre une thermorégulation via son réseau vasculaire (Anderson 1999).
Figure 1. La peau humaine. A La peau est divisée en trois grande couches, soit l’épithélium, le derme et
l’hypoderme en les nommant de l’extérieur vers l’intérieur B L’épiderme est, lui-même, divisé en quatre stratifications principales, soient : la couche cornée, la couche granuleuse, la couche épineuse et la couche basale en les nommant de l’extérieur vers l’intérieur. Figure tirée de l’article (Natarajan et al. 2014).
1.2 Les mélanocytes
Comme il a été mentionné précédemment, le rôle barrière de la peau ne s’arrête pas à ses propriétés d’imperméabilité; la pigmentation en fait aussi partie. Cette fonction de protection est orchestrée par les mélanocytes; elle permet de limiter l’apoptose des cellules et d’induire une réponse de détoxification robuste dans la peau suite à une exposition aux rayons solaires (Natarajan et al. 2014). Les mélanocytes se retrouvent dans le bulbe papillaire et même parfois dans le derme, mais principalement au niveau de la jonction dermo-épidermique (Figure 1B) (D'Orazio et al. 2013). Dans les faits, les mélanocytes sont des cellules de type dendritiques qui possèdent un faible taux de réplication et représentent seulement 8 à 10% des cellules épidermiques (Kadekaro et al. 2003).
En effet, les mélanocytes sont très rarement en mitose, sauf durant l’extension de la peau pour causes de croissance, de réparation d’une plaie ou lors de la stimulation aux rayons UV. L’entrée en mitose nécessite que les mélanocytes se détachent des kératinocytes et de la membrane basale. Puis, après la mitose, ceux-ci doivent migrer sur la membrane basale pour faire de nouveaux attachements avec des kératinocytes adjacents (Czyz 2019). Chaque mélanocyte est connecté à environ une trentaine de kératinocytes entrainant une relation bilatérale entre ces deux types cellulaires (Czyz 2019). Ces derniers régissant, entre autres, la fonction et la différenciation des mélanocytes (Young 2006). La prolifération et la survie des mélanocytes est contrôlée de manière paracrine par les fibroblastes et les kératinocytes adjacents via différentes molécules tel que le « fibroblast growth factor » (FGF) (Czyz 2019; Young 1997; Kadekaro et al. 2003).
1.3 La production de mélamine
Les mélanocytes protègent la peau des effets directs et indirects des rayons UV en produisant de la mélamine qui sera transférée aux kératinocytes voisins. Ce processus appelé mélanogénèse a lieu par l’intermédiaire des mélanosomes, une organelle retrouvée spécialement dans les mélanocytes (Natarajan et al. 2014). Les mélanosomes sont dérivés du processus de formation des lysosomes. Ils renferment les pigments de mélamine permettant leur transport dans le mélanocyte (Raposo and Marks 2007). Globalement, la production et la distribution de la mélanine dans l’épiderme requiert plusieurs étapes successives qui sont finement régulées par un éventail de voies autocrines et paracrines en réponse à des stimuli endogènes ou exogènes dont, notamment, les rayons UV (Figure 2) (Park et al. 2009). La mélamine se retrouve sous la forme de deux types de pigments, soit la eumélamine et la phéomélamine ayant chacun des interactions spécifiques avec les rayons UV (Young 2006; Natarajan et al. 2014).
Les rayons UV induisent une accumulation de mélanosomes dans les mélanocytes tandis que la présence de « melanocyte-stimulating hormone » (a-MSH) stimule l’exocytose de ceux-ci (Virador et al. 2002). Ainsi, suite à une exposition aux rayons UV, les kératinocytes vont exprimer a-MSH qui agit de façon paracrine au niveau du
Cette photo par Auteur inconnu est soumise à la licence CC BY
récepteur «melanocortin 1 receptor» (MCR1) retrouvé à la membrane des mélanocytes pour stimuler la production de mélanosomes. La signalisation engendrée par MCR1 va aussi diminuer l’activité mutagénique des rayons UV en stimulant les voies de signalisations associées au maintien de l’intégrité du génome dans les mélanocytes (D'Orazio et al. 2013). Au niveau des mélanosomes, la synthèse des deux types de mélamine a lieu via l’oxydation de la tyrosine en levodopa (L-DOPA) catalysée par l’enzyme tyrosinase (TYR); il s’agit de l’étape limitante dans la production de mélanine et, donc, de la plus importante (Urabe et al. 1994).
En présence de kératinocytes, les mélanocytes synthétisent beaucoup plus efficacement la mélamine suite à une stimulation par de faibles doses d’ultraviolet B (UVB) que lorsque les kératinocytes sont absents (Duval, Regnier, and Schmidt 2001). Ainsi, les kératinocytes permettent une meilleure sensibilité face aux rayons UV pour améliorer le système de protection de la peau. Les mélanosomes vont finalement être transférés aux kératinocytes par un transport bidirectionnel lié aux microtubules et par la capture de filaments d’actine au niveau des extrémités dendritiques des mélanocytes (Raposo and Marks 2007). Les kératinocytes vont aussi participer activement au transport des mélanosomes en stimulant l’élongation des dendrites des mélanocytes par un contrôle paracrine (Virador et al. 2002). En résumé, les kératinocytes et les mélanocytes sont en relation étroite, lors de la production de mélamine, c’est pourquoi ils sont parfois appelés «the epidermal melanin unit» par certains auteurs (Virador et al. 2002; Maddodi, Jayanthy, and Setaluri 2012).
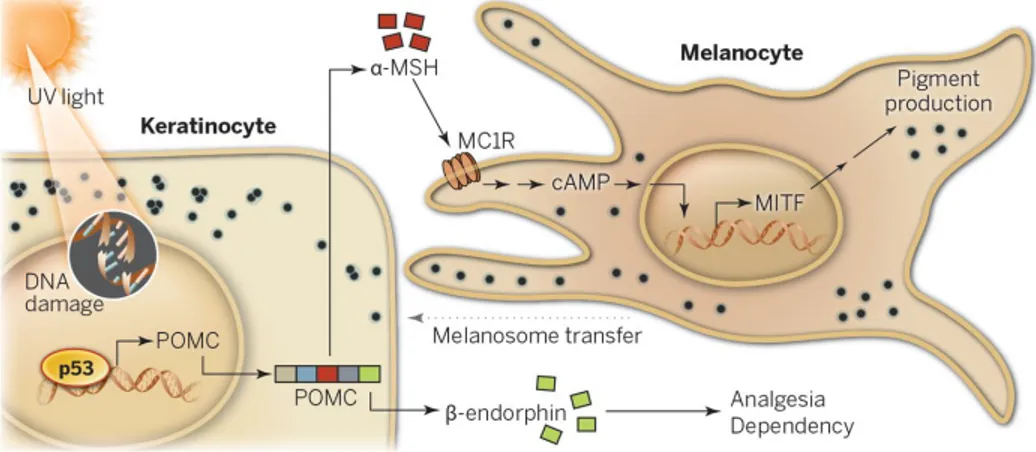
Figure 2. Interaction entre les kératinocytes et les mélanocytes suite à une exposition solaire.
L’exposition solaire entraine la production de dommages à l’ADN des kératinocytes. Ceux-ci vont causer l’activation du suppresseur de tumeur p53 entrainant la sécrétion de a-MSH et de b-endorphine. Plus particulièrement, le premier facteur va pouvoir se lier au récepteur MCR1 se retrouvant à la membrane cytoplasmique des mélanocytes. Cette liaison va provoquer la production de la protéine régulatrice AMPc. Étant un second messager, celle-ci va activer le facteur de transcription MITF permettant la production et le transfert des mélanosomes vers les kératinocytes adjacents. Figure tirée de (Park et al. 2009)
1.4 La pigmentation cutanée
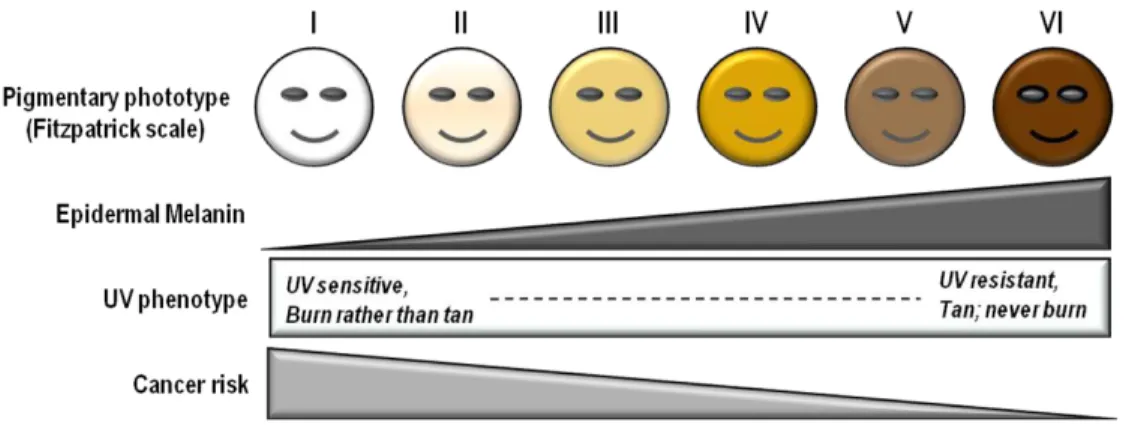
Il existe une forte diversité au niveau de la pigmentation chez les humains, c’est pourquoi la carnation cutanée a été classé sous différents phototypes allant de I à VI (Figure 3). Une personne du phototype I produit le moins de mélamine. Elle est ainsi plus sensible aux rayons du soleil et elle a aussi plus à risque de développer un cancer cutané. Le phototype VI est, par contre, beaucoup plus tolérant aux rayons UV, car il possède une quantité plus importante de mélamine dans la peau. Il est donc moins susceptible de développer un cancer de la peau (Kadekaro et al. 2003). In vitro, la quantité de mélanine produite par des mélanocytes provenant de différents phototypes corrèle avec l’activité des protéines reliées à la TYR responsable de la production de la mélamine (Kadekaro et al. 2003).
Cependant, la quantité de mélanine totale n’est pas le seul élément à prendre en compte, la proportion de eumélamine et de phéomélamine a aussi un impact important sur la tolérance de la peau au soleil et sur sa complexion (D'Orazio et al. 2013; Kadekaro et al. 2003). En effet, la eumélanime est un pigment plutôt jaunâtre tandis que la phéomélamine se rapproche du brun foncé (Natarajan et al. 2014). Cette différence de couleur va avoir un impact sur la capacité de la mélanine à accomplir sa fonction protectrice face aux dommages causés par les rayons du soleil. Par ailleurs, le taux de transfert des mélanosomes en provenance des mélanocytes vers les kératinocytes va aussi moduler la pigmentation cutanée (Kadekaro et al. 2003). L’hyperpigmentation de la peau aux régions exposées fréquemment au soleil constitue une accumulation locale de mélanosomes et non une augmentation du transfert de la mélanine vers les kératinocytes (Natarajan et al. 2014). Pour conclure, la pigmentation cutanée est une caractéristique adaptative qui définit la race humaine. Elle est intimement reliée à la quantité des rayons solaires atteignant le tégument. Il est ainsi possible de prédire le phototype cutané d’un individu selon l’indice UVMED de la région où il habite (Jablonski and Chaplin 2000).
Figure 3. Les phototypes cutanés. Les phototypes cutanés sont divisés en six classes, soit de I à VI où I est
une personne avec une faible proportion de mélanine et IV inversement. Le phototype cutané va déterminer la sensibilité d’une personne aux rayons solaire en plus de définir son risque de développer un cancer cutané. Ainsi, plus le phototype est haut moins le risque de cancer est élevé et plus la sensibilité cutanée est élevée. (D'Orazio et al. 2013)
2 Le spectre solaire
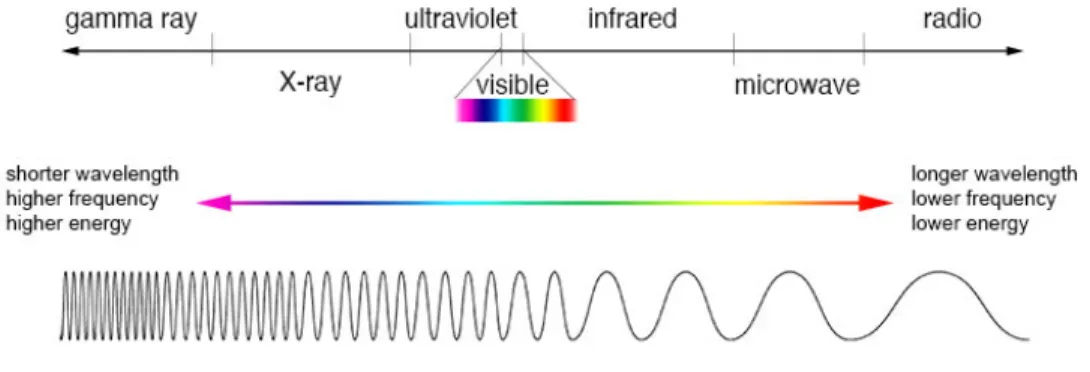
Le soleil émet un spectre électromagnétique constitué d’une variété de rayonnements associés à un intervalle de longueurs d’onde bien précis (Figure 4). Les rayonnements, en partant des plus énergétiques jusqu’au moins énergétiques selon les longueurs d’onde correspondantes, sont nommés comme suit : les rayons gamma (moins de 0,01nm), les rayons X ( 0,01 à 10nm), les ultraviolets (10 à 400nm), la lumière visible (400 à 700nm), les infrarouges (700nm à 1mm), les micro-ondes (1à 30mm) et finalement les ondes radios (plus de 30mm)(Chang et al. 2009). Parmi les rayons qui parviennent à la surface de la Terre, les rayons UV, les rayons infrarouges et, bien sûr, la lumière visible traversent notre atmosphère avec une proportion respective de 6,8%, 54,3% et 38,9% (Lo and Fisher 2014). Cependant, la couche d’ozone bloque tous les rayons ayant une longueur d’onde inférieur à environ 295nm (Maddodi, Jayanthy, and Setaluri 2012). La diversité des organismes vivants retrouvés sur terre est en grande partie redevable aux rayons du spectre solaire atteignant la Terre. Effectivement, les rayons infrarouges permettent de maintenir une température propice à la vie et la lumière visible permet aux plantes d’effectuer de la photosynthèse produisant l’oxygène nécessaire à la respiration aérobie.
Figure 4. Le spectre solaire. Il se divise en sept types de rayons ayant un intervalle d’émission précis. En allant
du plus au moins énergétique, on retrouve les rayons gamma (moins de 0,01nm), les rayons X ( 0,01 à 10nm), les ultraviolets (10 à 400nm), la lumière visible (400 à 700nm), les infrarouges (700nm à 1mm), les micro-ondes (1à 30mm) et finalement les ondes radios (plus de 30mm). Figure tirée de NASA's Imagine the Universe ; https://imagine.gsfc.nasa.gov/science/toolbox/emspectrum1.html.
2.1 Les rayons ultraviolets
Les rayons UV se divisent en trois catégories : les rayons UVA (315-400nm), les rayons UVB (280nm-315nm) et les rayons UVC (200-280nm). Ces derniers sont bloqués en totalité par la couche d’ozone (Budden and Bowden 2013; Maddodi, Jayanthy, and Setaluri 2012). Ainsi, les deux premiers atteignent la peau avec un proportion drastiquement différentes, soit entre 90-95% d’UVA pour seulement 5-10% d’UVB (Figure 5) (Maddodi, Jayanthy, and Setaluri 2012). Il s’agit de données approximatives étant donné que la fraction d’UVB atteignant la peau dépend de nombreux facteurs tels que la latitude, l’élévation par rapport à la mer, le moment de la journée, l’épaisseur de la couche d’ozone etc. (D'Orazio et al. 2013; Young 2006). De plus, les rayons UVB, plus énergétiques que les rayons UVA, n’atteignent que l’épiderme et le derme papillaire. Au contraire, les rayons UVA sont en mesure de traverser le derme dans toute son épaisseur (Anderson and Parrish 1981). Ainsi, 9 à 15% des rayons UVB sont absorbés au niveau de l’épiderme et 50% des rayons UVA sont en mesure de se rendre aux mélanocytes situé sur la membrane basale (Maddodi, Jayanthy, and Setaluri 2012). Les deux types de rayons peuvent avoir des effets négatifs sur l’intégrité de la peau que ce soit directement ou indirectement, mais les effets directs sont généralement amplifiés par la production de photo-produits au niveau de l’ADN (Kadekaro et al. 2003). Les mécanismes de dommages induits par les rayons UVA et les rayons UVB seront détaillés plus en détail en aval de ce texte, mais, règle générale, les UVA génèrent principalement des espèces réactives à l’oxygène (ROS) dans la peau et les UVB causent des dommages à l’ADN par l’intermédiaire de photo-lésions.
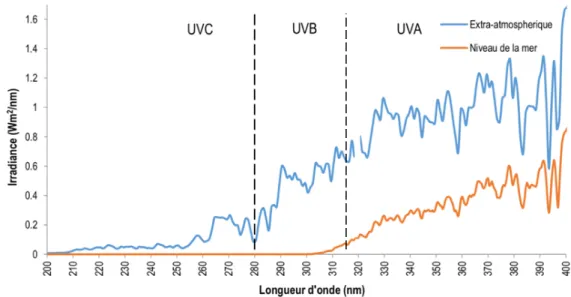
Figure 5. Irradiance des rayons UV, à l’extérieur de l’atmosphère et au niveau de la mer. Les rayons UVC
sont entièrement bloqués par la couche d’ozone au même titre que la majorité des rayons UVB. Les rayons UVA, quant à eux, traversent notre atmosphère en totalité. Données tirées de : http://lasp.colorado.edu/lisird/data/sorce_ssi_l3/
2.2 Les chromophores dans la peau
Les rayons ultraviolets sont dommageables pour la peau car ils peuvent interagir avec certaines molécules de la peau appelées chromophores. Il s’agit de molécules possédant un lien covalent conjugué qui leurs octroi des propriétés d’absorption de la lumière (Young 1997). Parmi les chromophores les plus couramment retrouvés dans la peau, il y a : les acides nucléiques composant l’ADN, l’acide urocanique (UCA), les acides aminés aromatiques, la mélamine et ses précurseurs (Young 1997, 2006). Il peut paraitre étonnant de retrouver ces deux derniers éléments dans cette catégorie, c’est pourquoi la dualité du rôle de la mélamine sera abordée dans la section 2.4.3 du texte traitant des dommages causés par les rayons UV. Ainsi, les chromophores ont un spectre d’absorption défini et ils peuvent, lorsqu’excités, interagir avec eux-mêmes ou d’autres molécules environnantes (Anderson and Parrish 1981). Par exemple, l’ADN absorbe quatre fois plus les rayons UVB que les rayons UVA causant de nombreux photo-dommages entrainant des mutations. Au contraire, la mélanine absorbe les rayons UV pour réduire les dommages causés aux mélanocytes et aux kératinocytes (Maddodi, Jayanthy, and Setaluri 2012).
2.3 Les systèmes de protection de la peau
Les rayons UV peuvent causer une panoplie de dommages dans le tégument, c’est pourquoi cet organe a développé trois systèmes de protection complémentaires, soit l’épithélium stratifié, la réponse antioxydante ainsi que la pigmentation (Natarajan et al. 2014). Ceux-ci sont tous modulés selon leur degré d’interaction avec les rayons UV. En effet, ces systèmes de défense vont être initiés au niveau génique par l’expression de suppresseur de tumeur tel que p53, p16 et p14 dans les cellules directement irradiées ou dans les cellules environnantes. Ces dernières peuvent être stimulées par des facteurs paracrines associés à l’exposition aux rayons UV (Maddodi, Jayanthy, and Setaluri 2012; Kadekaro et al. 2003; de Gruijl, van Kranen, and Mullenders 2001).
Le premier mécanisme, la stratification épidermique, constitue une barrière physique contre les rayons UV. En effet, l’hyperkératose permet de limiter la pénétrance des rayons UV dans la peau et ainsi protéger celle-ci de leurs effets néfastes (Kadekaro et al. 2003). À noter que les rayons UVA et UVB peuvent stimuler l’augmentation de l’épaisseur de l’épiderme et la prolifération des kératinocytes in vitro (Dissanayake, Greenoak, and Mason 1993). Le second mécanisme de défense, soit la réponse oxydante, permet de contrôler la quantité de molécules dommageables présentent dans la peau suite à une exposition solaire. Cette réponse va, globalement, diminuer la synthèse de collagène et augmenter la dégradation du nouveau collagène en plus d’induire une réponse antioxydante en deux étapes. La première va engager la transcription de certaines d’enzymes pour éliminer les espèces oxydatives via l’activation de la voie « mitogen-activated protein kinase » (MAPK) associée à p38 afin de former la protéine active «activator protein 1» (AP-1) (Natarajan et al. 2014). En parallèle, l’activation de la voie p38 par les rayons UVA induit aussi une réponse pro inflammatoire de la voie «
nuclear factor kappa-light-chain-enhancer of activated B cells » (NF-kB) (Natarajan et al. 2014). La seconde étape va plutôt produire des enzymes détoxifiantes via l’activation de la protéine « nuclear factor erythroid 2-related factor 2 » (NRF2) (Figure 6).
Le dernier mécanisme, certainement le plus connu, est la pigmentation cutanée qui est visiblement modulée en réponse à l’exposition solaire (Maddodi, Jayanthy, and Setaluri 2012). Il est intéressant de mentionner que les rayons UVA et UVB sont indépendamment capables de déclencher la pigmentation, et ce, chacun avec un mécanisme qui lui est propre (Natarajan et al. 2014). En effet, le tégument va brunir via un processus en deux étapes. Une réponse immédiate est enclenchée par les rayons UVA qui vont photo-oxyder la mélanine présente dans la peau. Cette réponse est suivie d’une réponse tardive induite par les rayons UVA et UVB via leur interaction avec les mélanocytes et les kératinocytes (Natarajan et al. 2014). Les modifications opérées sur ces deux types cellulaires vont stimuler l’augmentation de la quantité de mélanocytes fonctionnels, la mélanogénèse, l’augmentation du nombre de dendrites des mélanocytes et du transfert des mélanosomes vers les kératinocytes (Kadekaro et al. 2003). En final, la quantité de mélanine totale sera augmentée dans la peau.
Les pigments de mélamine vont accomplir leur fonction protectrice selon deux mécanismes. Premièrement, ils peuvent limiter l’absorption des rayons UV dans la peau afin de protéger les cellules épidermiques des dommages directs du soleil. Deuxièmement, ils sont en mesure de réagir avec les ROS produits lorsque les rayons UV entrent en contact avec des chromophores dans la peau. Dans le cadre de leurs fonctions, les deux types de mélamines ne sont pas équivalentes. En effet, il a été démontré que l’eumélamine remplie ses fonctions plus efficacement et qu’elle induit donc un mécanisme de photo-protection plus important (Kadekaro et al. 2003).
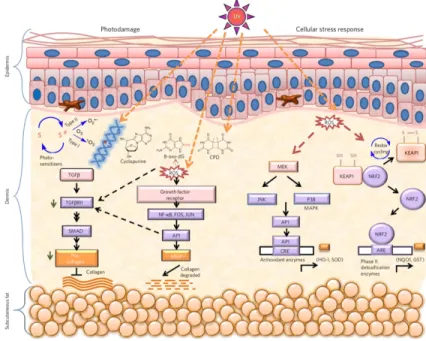
Figure 6 : Système de protection de la peau face aux rayons UV. L’épithélium stratifié et la pigmentation
permettent de filtrer les rayons UV. Cependant, certains rayons réussissent à outrepasser ces barrières causant ainsi des dommages à l’ADN des cellules et du stress oxydatif dans la peau. Ces réactions initient une réponse antioxydante complète se déroulant en deux étapes. Une première réponse rapide stimulée par le surpresseur de tumeur p38 à travers la protéine AP1 va activer la transcription d’enzyme antioxydantes. En parallèle, une réponse inflammatoire aura aussi lieu à travers la même protéine entrainant la dégradation et l’inhibition de la production du collagène. La seconde réponse, plus tardive, activée par le cycle d’oxydoréduction, via la protéine NRF2, va stimuler la transcription d’enzymes détoxifiantes. Figure tirée de (Natarajan et al. 2014)
2.4 L’exposition aux rayons UV et ses conséquences
L’exposition aux rayons du soleil est un aspect intrinsèque à la vie humaine. Celle-ci peut avoir un impact positif tel que la production de vitamine D, mais a majoritairement des conséquences négatives sur la peau et le reste du corps humain (Neer 1975; Rigel 2008).La majorité de ces effets sont inter-reliés et les conséquences les plus importantes seront exposées dans cette section.
2.4.1 Production de vitamine D3
La vitamine D est essentielle à la croissance normale, car elle permet l’absorption optimale du calcium et, ainsi, le développement du squelette, entre autres choses (Neer 1975). Cette hormone se retrouve chez l’humain sous deux formes, la vitamine D3 qui est synthétisée suite à l’exposition solaire et la vitamine D2 qui se retrouve en très petite proportion dans l’alimentation. Plus précisément, la vitamine D3 est synthétisée à partir du 7-déhydrocholestérol, un dérivé du cholestérol, et grâce aux rayons UVB qui entrainent une cassure dans la molécule. Généralement, la quantité de vitamine D retrouvée chez une personne va être étroitement reliée à la quantité de rayons solaires absorbés dans l’année (Neer 1975). L’exposition solaire est donc responsable en grande partie de la vitamine D retrouvé chez
l’humain. Il n’est donc pas étonnant de retrouver des récepteurs à la vitamine D sur les kératinocytes et les LC vue leur emplacement stratégique face aux rayons solaires (Norval 2006). En effet, la conversion de la vitamine D3 peut se fait intégralement dans la peau (Lehmann et al. 2001).
2.4.2 Espèces réactives à l’oxygène (ROS)
La génération d’espèces réactives à l’oxygène suite à l’exposition aux rayons UV est unique à la peau (Natarajan et al. 2014). Celles-ci sont largement impliquées dans l’initiation et la progression d’un état cancéreux. En effet, des souris déficientes dans les systèmes de réparation des stress oxydatifs sont plus susceptibles de développer un cancer suite à une exposition aux rayons UV (Mullenders 2018). Les rayons UVA sont connus pour être la classe de rayons ultraviolets ayant le plus grand pouvoir oxydatif suite à l’activation de nombreux mécanismes de photo-oxydation (Cadet et al. 2012). Ainsi, la production d’espèces oxydatives dans la peau va généralement avoir lieu suite à l’interaction entre les rayons UVA et les principaux photo-senseurs contenus dans celle-ci (Cadet et al. 2009).
Les trois principaux ROS générés sont l’anion superoxyde (O2-), l’hydroxyle (OH-) et le peroxyde
d’hydrogène (H2O2). Ceux-ci peuvent provenir de l’oxydation de dérivés de flavine, des porphyrines,
de vitamines et autres chromophores de la peau. Ils peuvent, ensuite, interférer avec l’ADN ou d’autres molécules et ainsi créer de nombreux dommages, et ce, de manière exponentielle (Cadet et al. 2012). L’oxygène a, notamment, deux mécanismes d’action, soit une photo-sensibilisation de type I ou de type II (Figure 6). S’ajoutant à cela, la synthèse de mélanine est un processus nécessitant une quantité importante d’énergie qui est, lui-même, pro oxydatif (Urabe et al. 1994). La présence de lésions de type 8-oxoguanine (8-oxoGua) est le marqueur ubiquitaire du stress oxydatif exercé sur l’ADN des cellules de la peau suivant une exposition aux rayons UV in vitro et in vivo (Cadet et al. 2012).
2.4.3 Dommages à l’ADN
La signature des rayons UV a longtemps été principalement associée aux photo-dommages directement causé à l’ADN. Ceux-ci furent considérés comme les plus dommageables pour la peau, car il s’agit de l’effet le plus intuitif et observable suite à une exposition aux rayons UV. En effet, les trois types de rayons UV sont en mesure d’induire des dommages directs à l’ADN suite à l’exposition solaire selon trois mécanismes distincts. Les rayons UVC produisent des dommages via un mécanisme d’excitation simple au même titre que les rayons UVB. Par contre, ces derniers peuvent aussi utiliser un processus de photosensibilisation triple. Les rayons UVA, quant à eux, y parviennent en passant par un état de type « triplet-like » (Premi and Brash 2016). Les rayons UV peuvent également induire des dommages indirects à l’ADN. Ceux-ci sont, cependant, beaucoup plus diversifiés et difficile à
anticiper. Les dommages non réparés, qu’ils soient directs, indirects ou mixtes, entraineront par la suite une séquence d’évènements dans la cellule aboutissant généralement à la production de mutations (Figure 7). L’accumulation de celles-ci peut ensuite, induire l’apoptose ou entrainer une transition cellulaire vers un état cancéreux.
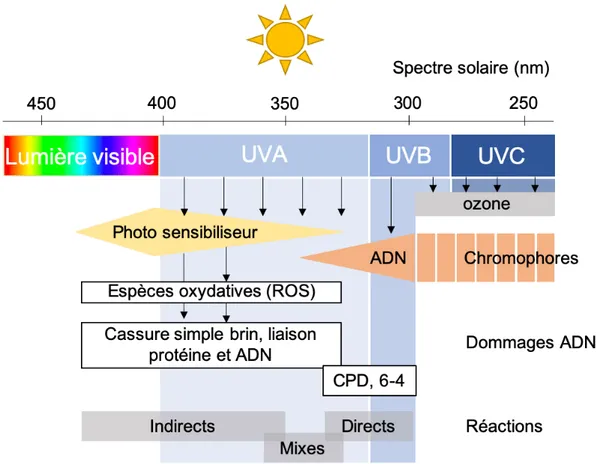
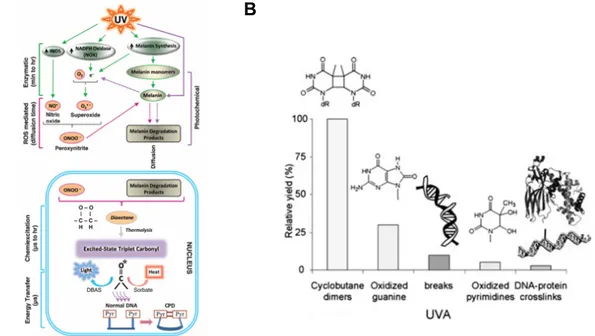
Figure 7 : Types de dommages à l’ADN causés par les rayons UV. Les rayons UVA, UVB et UVC sont tous
aptes à produite des dommages à l’ADN. Les UVC sont les plus dommageable, mais bloqués par la couche d’ozone. Les rayons UVB sont en mesure de causer des cassures double brin notamment via la production de dimère cyclobutanique de pyrimidine (CPD). Les rayons UVA causent des dommages à l’ADN variés tels que des cassures simple brin via la génération d’espèces oxydatives. Mis ensemble, tous ces types de rayons causent des dommages à l’ADN de manière indirecte, mixte ou directe. Figure inspirée de (Rass and Reichrath 2008)
2.4.3.1 Dommages directs
Les rayons UV, particulièrement les UVB, produisent deux types de dommages directs à l’ADN des cellules, soit la formation de dimères cyclobutaniques de pyrimidine (CPD) et la production de photo-produits de pyrimidine de type 6-4 (6-4P) (Figure 8) (Young 2006; Natarajan et al. 2014; Ikehata and Ono 2011; Cadet et al. 2012). Les rayons UVB induisent ces photo-lésions dans le squelette d’ADN via une réaction nécessitant une excitation simple ou triple et formant une liaison entre deux pyrimidines adjacentes, soient entre les bases nucléotidiques de type C-C, C-T, T-C ou T-T (Premi and Brash 2016). Une distorsion dans l’hélice d’ADN est ainsi créée. S’en suit une déamination de la base cytosine associée à une transition de la base C vers la base T lors de la réplication. Ainsi, les différents types de signatures UV dans l’ADN des cellules sont produites (Figure 8)(Taylor 2015). L’accumulation de ces mutations, induites par les rayons UV au cours du temps, peut causer l’activation d’oncogène ou l’inactivation de suppresseur de tumeur entrainant l’apparition d’un état cancéreux (Hanahan and Weinberg 2000).
Le potentiel mutagène des dommages est limité par la réparation efficace des photo-dimères produits avant leur substitution. Deux systèmes de réparation accomplissent cette tâche, le « global genome nucleotide excision repair (GG-NER) » et le «transcription-coupled nucleotide excision repair (TC-NER)». Le premier agit à n’importe quel moment dans le noyau, tandis que le second est seulement actif durant la transcription active de gènes (Mullenders 2018). Les patients atteints de la maladie Xeroderma pigmentosum (XP) sont extrêmement sensibles aux rayons du soleil car leur système de réparation NER est défectueux ou inactif (Pleasance et al. 2010; de Gruijl, van Kranen, and Mullenders 2001). Malgré tout, le système NER n’est pas à toute épreuve et la persistance des photo-dommages, induits par une exposition chronique aux rayons UVB, a pu être observé dans des fibroblastes après plusieurs cycles de division (Berube et al. 2018). Néanmoins, les cellules ne réparent pas seulement les dommages causés à leur ADN, l’irradiation des cellules induit aussi une réponse complète pour la protection de l’intégrité du génome dont un remodelage de la chromatine et un contrôle au niveau du cycle cellulaire (Mullenders 2018).
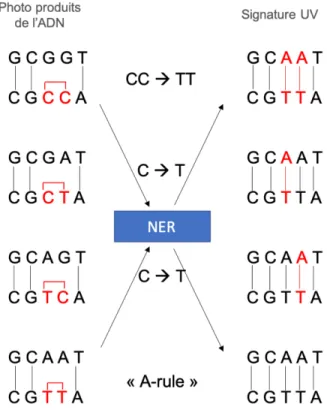
Figure 8. Photo-produits de type CPD induits par les rayons UVB. Les rayons UVB peuvent introduire des
dimères de pyrimidine entre les bases C-C, C-T, T-C et TT. La réparation de type NER peut entrainer la transition de la base C pour la base T causant une mutation de type signature UV. Figure inspirée de (Rass and Reichrath 2008; Ikehata and Ono 2011)
2.4.3.2 Dommages indirects
Lorsque le rayonnement UV comprend des rayons UVA et UVB, cela engendre une quantité plus importante de CPD dans l’ADN des kératinocytes que la somme des CPD générés par les UVA et les UVB de manière individuelle (Courdavault et al. 2005). En effet, les rayons UVA sont en mesure de produire des CPD, majoritairement de type T-T par photosensibilisation ou aussi par une absorption directe (Douki et al. 2003; Rochette et al. 2003). Heureusement, ce type de dommages (T-T) est beaucoup moins mutagène que les trois autres mentionnés précédemment (C-C, C-T ou T-C) (Figure 8).
Cependant, un nouveau mécanisme de dommages indirects à l’ADN exclusif aux rayons UVA a été décelé dernièrement. Celui-ci fait intervenir les pigments de mélanine via un processus de chimio-excitation observé pour la première fois chez les mammifères et entrainant la production de CPD supplémentaires, et ce, même trois heures après la fin de l’exposition solaire (Figure 9A) (Premi et al. 2015; Abdel-Malek and Cassidy 2015; Brash 2016). Ceux-ci ont donc été nommé les « dark CPD » étant donné leur habilité à être formé même à la noirceur.
De plus, les rayons UVA peuvent générer d’autres types de dommages à l’ADN via les espèces oxydatives générées discutées préalablement (Cadet et al. 2012). En effets, ces espèces oxydatives peuvent causer des cassures simple brin de l’ADN aux sites sensibles à l’oxydation ainsi que des liaisons entre des protéines et l’ADN (Figure 9B) (de Gruijl, van Kranen, and Mullenders 2001). Plus particulièrement, les ROS induisent des modifications à l’ADN de types 8,5,-cyclo-2’-deoxyadenosine, 8,5’-cyclo-2’-deoxyguanosine et majoritairement de type 8-oxo-7,8-dihydroguanine(Natarajan et al. 2014). Ces dommages peuvent être causés par les mécanismes d’oxydation de type I ou II. Par exemple, l’anion superoxyde (O2-) est reconnu pour produire des
8-oxoGua spécifiquement via le mécanisme de type II (Figure 6) (Cadet et al. 2012).
Il faut aussi mentionner, qu’inversement, les rayons UVB sont, eux-aussi, capables de produire des dommages de manière indirecte malgré leur plus faible proportion. En effet, les rayons UVB sont en mesure d’oxyder les résidus de guanine générant ainsi des photo-produits de purines de type 8-hydroxy-2-deoxyguanosines (8-OHdG). Ceux-ci induisent ensuite la transversion GàT causant des mutations dans l’ADN. Ils peuvent aussi former des liaisons entre l’ADN et certaines protéines ainsi que des bris d’ADN simple brin (Liu-Smith, Jia, and Zheng 2017)
Figure 9. Dommages indirects produits par les rayons UVA. A Les rayons UVA peuvent produire des CPD
supplémentaires dans l’ADN des cellules plus de trois heures après exposition grâce à un mécanisme de chimio-excitation via les dérivés de la mélanine B Distribution relative des différents types de dommages causés indirectement sur l’ADN des cellules, soit en majorité les CPD, suivi de 8-oxoGua, des bris simple brin, des pyrimidines oxydées et finalement, en plus petite proportion, des liaisons entre l’ADN et des protéines. Figures tirées de (Premi et al. 2015; Rass and Reichrath 2008).
2.4.4 Mutations et apoptose
Une des premières réponses de la cellule suite à la production de photo-lésions à l’ADN est l’activation des voies MAPK-p38 et JNK-SAPK par phosphorylation. Une fois activées, ces voies sont en mesure d’activer le sentier de p53 et d’autres inducteurs d’apoptose (Kadekaro et al. 2003). Ces derniers vont être en mesure d’activer des chemins de signalisation pour stimuler la survie cellulaire tout en induisant l’apoptose de la cellule si les dommages à l’ADN sont trop importants, afin d’éviter d’introduire des mutations irréparables à l’ADN (Figure 10). Il s’agit donc d’un système de protection pour inhiber le potentiel photo-carcinogénique des rayons UV. En parallèle, la cellule va aussi activer différents chemins de réparation de l’ADN pour se défendre contre les dommages directs et indirects causés à l’information génétique (Runger, Epe, and Moller 1995).
Les photo-produits n’ayant pas été réparés avant la réplication de la cellule vont, plus souvent qu’autrement, produire des mutations dans l’ADN des cellules. L’accumulation de celles-ci, suite à des défauts dans les voies de réparation cellulaire, est l’élément initiateur de nombreux désordres génétiques de la peau tel que XP qui est caractérisé par un défaut dans la voie de réparation NER et le Cockayne syndrome (CS) (Pfeifer, You, and Besaratinia 2005; Cleaver 2000). De plus, un autre élément à prendre à considération lors de la réparation de l’ADN est le type de dommage qui a été induit. En effet, la nature des deux bases de pyrimidine produisant un CPD affecte grandement la vitesse de réparation du dommage. Il s’agit d’un effet qui a été confirmé in vitro au niveau de l’efficacité de la réparation des dommages dans les fibroblastes et les kératinocytes (Mouret et al. 2008).
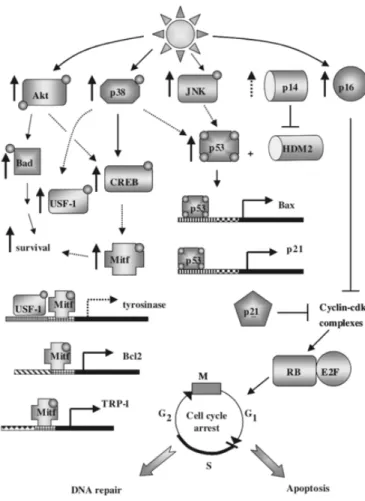
Figure 10. Chemins de signalisation activés lors de l’exposition solaire. Les rayons UV stimulent de
nombreuses voies signalétiques dans les cellules via la phosphorylation de Akt, p38 et JNK ainsi que par l’activation des suppresseurs de tumeur p14 et p16. Ces facteurs vont interagir avec une série d’autre molécules pour aboutir à l’induction d’un patron de survie cellulaire via l’activateur du facteur de transcription MITF. En parallèle, les cellules exposées aux rayons UV vont aussi activer p53 par phosphorylation pour contrôler le cycle cellulaire afin d’enclencher un processus de réparation de l’ADN ou d’apoptose si les dommages à l’intégrité génomique sont trop importants. Figure tirée de : (Kadekaro et al. 2003)
2.4.5 Immunosuppression
L’exposition de la peau aux rayons UV peut avoir de nombreux impacts sur son système immunitaire à plus ou moins long terme. C’est pourquoi le domaine de la photo-immunologie a été développé (Fisher and Kripke 2002). Premièrement, les rayons UV peuvent directement diminuer la quantité, altérer la morphologie et la fonction des LC. Ils peuvent aussi interférer au niveau de la migration, de la différenciation et de la maturation des LC vers les nodules (Nishisgori 2015). De surcroit, les rayons UV peuvent induire un processus d’immunosuppression indirectement via, entre autres, les différents dommages à l’ADN préalablement produits, l’isomérisation de l’UCA ainsi que des changements dans la membrane des cellules au niveau des lipides (Liu-Smith, Jia, and Zheng 2017; Norval 2006).
Ces différents éléments initiateurs vont causer un changement dans le profil de cytokines exprimées par les kératinocytes dont « platelet-activating factor » (PAF), « Prostaglandin E2 » (PGE2) , l’interleukine 4 (IL-4) et interleukine 10 (IL-10). Celles-ci vont agir de manière paracrine pour diminuer le nombre de LC dans l’épiderme (Kadekaro et al. 2003; Norval 2006). Il s’agit donc d’un processus complexe pouvant avoir de grandes répercussions localement ou de façon généralisée. Plus précisément, les évènements d’immunosuppression locaux sont généralement causés par l’altération des LC ainsi qu’une modification de l’expression de l’IL-10, de l’UCA et des prostaglandines par les kératinocytes et les mastocytes (Muller and Woods 2013; Walterscheid et al. 2006). De plus, l’exposition solaire augmente la quantité de TNF-a, IL-6 et IL-10 dans les cellules de l’épiderme diminuant l’activité des LC, ce qui inhibe la réponse immunitaire dans les régions de la peau exposées au soleil (Liu-Smith, Jia, and Zheng 2017; Young 2006). Finalement, à long terme, les rayons UV peuvent diminuer le nombre de cellules « natural killer » (NK) ainsi que leur activité (Liu-Smith, Jia, and Zheng 2017).
2.4.6 Changement du phénotype des kératinocytes
Le stress oxydatif associé aux dommages à l’ADN et à l’immunosuppression vont induire un changement de phénotype notamment chez les kératinocytes; les cellules les plus fortement touchées par les rayons UV. Ce changement va être déclenché au niveau génique par, entre autres, des mutations au niveau de p53, p21 et MDM2 qui sont induites par l’exposition solaire (Marrot et al. 2010). Des altérations au niveau de ces gènes suppresseur de tumeur va donc se refléter au niveau du phénotype des cellules touchées. Par exemple, une exposition répétée aux rayons UVB induit la différenciation au lieu de la senescences des cellules épidermiques ayant une altération au niveau du gène p16 via une augmentation de la production d’involucrine et de différentes cytokératines (K6, K16, K17) (Figure 1B)(Bertrand-Vallery et al. 2010).
Majoritairement, suite à un traitement aux rayons UVB, les kératinocytes vont augmenter la production de TNF-a, d’interleukine 1 (IL-1), d’interleukine-6 (IL-6), IL-8 et de «Transforming growth factor beta» (TGFb) dans le cadre d’un processus inflammatoire (Figure 11) (Pillai, Oresajo, and Hayward 2005; Fisher and Kripke 2002; McKenzie et al. 1994; Kondo et al. 1994). De plus, les molécules sécrétées par les kératinocytes, suites à un traitement aux rayons UV, peuvent avoir une influence sur d’autres types cellulaires tel qu’au niveau des LC dans le processus d’immunosuppression. Par contre, leur impact ne s’arrête pas aux cellules immunitaires. Les cytokines sécrétées par les kératinocytes suite à une irradiation peuvent aussi avoir comme cibles les fibroblastes. En effet, il a été constaté que les kératinocytes, suivant un traitement aux rayons UV, sécrètent du FGF2 agissant spécifiquement sur le métabolisme des fibroblastes pour stimuler leur
croissance (Maddodi, Jayanthy, and Setaluri 2012). Il a aussi été noté que les kératinocytes sont en mesure de sécréter des métalloprotéinases de type 1 (MMP-1) dans l’environnement extracellulaire. Celles-ci peuvent aussi être exprimée indirectement par les fibroblastes lorsqu’ils sont exposés au milieu de culture des kératinocytes irradiés aux rayons UVB (Fagot, Asselineau, and Bernerd 2002). De plus, les mélanocytes et les macrophages peuvent être influencés par les kératinocytes irradiés via la sécrétion de aMSH qui a préalablement été associé à la production et l’exocytose de mélanosomes (Figure 2) (Pillai, Oresajo, and Hayward 2005). Le facteur « macrophage migration inhibitory factor » (MIF) augmenté suite à l’exposition aux rayons UVB a aussi été associé, bien qu’indirectement, à la pigmentation, mais cette cytokine stimule aussi la sécrétion du facteur « stem cell factor » (SCF). Ce dernier est un important facteur dérivé des kératinocytes associé à la survie des mélanocytes. De surcroit, le facteur « hepatocyte growth factor» (HGF) est d’un intérêt tout particulier étant donné qu’il est exprimé suite à un traitement aux rayons UVB, mais surtout étant donné qu’il peut interagir avec différents types cellulaires. En fait, HGF est sécrété par les fibroblastes seulement lorsque des kératinocytes adjacents sont exposés aux rayons UV. Ainsi, il s’agit d’une stimulation paracrine ayant comme élément déclencheur les rayons UV. Ensuite, cette cytokine promeut la motilité et la prolifération des kératinocytes et des mélanocytes (Maddodi, Jayanthy, and Setaluri 2012).
Ainsi, les rayons UV peuvent influencer différents types cellulaires à travers les kératinocytes et leur patron d’expression de cytokines. Cependant, ce n’est pas seulement le patron de sécrétion des kératinocytes qui est modulé, les rayons UV ont aussi un impact sur le protéome des cellules de la peau et particulièrement celui des kératinocytes (Muller and Woods 2013).
Figure 11 : Processus inflammatoire des kératinocytes après une exposition aux rayons UV. Les rayons
UVA et UVB, produisent de nombreuses espèces réactives à l’oxygène dans la peau causant l’activation des chemins de signalisation associés à p38-MAPK. Ceux-ci entrainent la sécrétion de différentes cytokines tels que IL-1b, TNFa, IL-6, IL-8 créant un état inflammatoire dans la peau. Les ROS vont aussi moduler la composition des lipides de la membrane des cellules. Figure tirée de (Norval 2006)
2.5 Pathologies cutanées associées
L’exposition solaire de manière ponctuelle et/ou chronique est associée à l’initiation de nombreuses pathologies cutanées telles que le photo vieillissement, l’érythème cutané et le cancer (Young 1997). En effet, le soleil est le carcinogène numéro un de la peau par sa capacité à produire des dommages à l’ADN ainsi que du stress oxydatif dans les cellules cutanées (Mullenders 2018).
2.5.1 Érythème cutané
Une exposition solaire accrue et ponctuelle de la peau se transcrit par un état inflammatoire de la peau plus communément appelé un « coup de soleil ». Les différentes couches de la peau ne vont pas réagir de la même manière suite à ce type d’exposition. Le derme va immédiatement entrer dans une phase inflammatoire. Particulièrement, les rayons UVB vont induire une cascade de cytokines pro-inflammatoires, ainsi que la sécrétion de médiateurs vasoactifs et neuroactifs qui vont induire la sensation de brûlure (D'Orazio et al. 2013). La peau va rougir à cause de cette réponse. Les cellules de l’épiderme vont répondre à ce stimuli externe environ 24h plus tard par une augmentation de l’apoptose via, entre autres, une activation de la voie de p53 (Young 2006). C’est pourquoi une forte exposition solaire est généralement associée dans les jours suivant par une desquamation de la peau aux endroits touchés.
2.5.2 Photo vieillissement
Le photo vieillissement est une conséquence d’une exposition chronique de la peau au soleil. La vitesse de renouvellement des kératinocytes permet à l’épiderme d’être moins touché par ce phénomène (Natarajan et al. 2014). Il s’agit donc d’une pathologie qui affecte majoritairement le derme. Elle est causée par l’accumulation d’inflammation via les rayons UVB et par la production de ROS via les rayons UVA (Pillai, Oresajo, and Hayward 2005). Malgré tout, le derme étant le support de l’épiderme, l’intégralité de la peau est affectée par le photo vieillissement. Celui-ci se transcrit au niveau macroscopique par une peau d’apparence relâchée ainsi que par l’apparition de rides et de taches de rousseur (Liu-Smith, Jia, and Zheng 2017).
Les rayons UVA et UVB contribuent tous les deux au processus de photo vieillissement (Pillai, Oresajo, and Hayward 2005). Cependant, le vieillissement extrinsèque est majoritairement induit par la production d’espèces oxydatives qui, elles-mêmes, sont générées en majorité par les rayons UVA. Il s’agit d’un état qui se caractérise par la diminution dramatique de différents types de collagènes et par la présence de fibres élastiques anormales dans le derme entrainant une diminution de l’épaisseur de la peau (Pillai, Oresajo, and Hayward 2005).
Les fibroblastes contribuent à la dégradation de la matrice extracellulaire via la production de MMP suivant l’exposition aux UVB et indirectement par les kératinocytes (Pillai, Oresajo, and Hayward 2005; Fagot, Asselineau, and Bernerd 2002). De plus, les rayons UV stimulent la production de cytokines immuno-modulatrices qui peuvent altérer le microenvironnement des cellules mésenchymateuses de la peau causant de l’inflammation et la production de ROS (Natarajan et al. 2014). Les rayons UVB réduisent spécifiquement la production de TGFb , diminuant le signal requis pour la formation de pro-collagène (Figure 6) (Natarajan et al. 2014). Normalement, la peau exprime trois types de collagénases (MMP-1, -8 et -13). Suite à l’exposition solaire, la production de ces collagénase est augmentée, dont notamment MMP-1 et -13 par les rayons UVB (Pillai, Oresajo, and Hayward 2005). L’effet net de toute ces réactions dans la peau est la production de radicaux libres. 2.5.3 Cancers cutanés
L’impact mutagénique des rayons UV sur la peau a été démontré par différents mécanismes dont, particulièrement, la production de ROS et de dommages à l’ADN et n’est donc plus à débattre. Ainsi, les rayons UV sont classifiés comme des carcinogènes complets, car ils sont en mesure d’induire des mutations de façon directe et indirecte en plus d’induire l’immunosuppression; ils peuvent donc initier et alimenter la progression d’un état cancéreux (Figure 11) (D'Orazio et al. 2013; Rass and Reichrath 2008). Les trois cancers de la peau les plus communément retrouvés sont le « Basal cell carcinoma» (BCC), le « Squamous cell carcinoma » (SCC) et le mélanome cutané. Ceux-ci sont tous liés de manières épidémiologique et moléculaire aux rayons UV (D'Orazio et al. 2013). Notamment, les sentiers régulant la différenciation, le cycle cellulaire et l’apoptose des cellules sont court-circuités par les rayons UV dans ces cancers (de Gruijl, van Kranen, and Mullenders 2001).
2.5.3.1 Non-mélanome
L’exposition solaire est la plus importante prédisposition à l’apparition de cancers de la peau de type non-mélanome, soit jusqu’à 90% de ceux-ci (Rigel 2008; Liu-Smith, Jia, and Zheng 2017; Rass and Reichrath 2008). De surcroit, un lien de causalité a été établi entre l’exposition accumulée aux rayons UVB et l’incidence des cancers de la peau (Cadet et al. 2009; Rigel 2008). Les deux types les plus communs sont le BCC et le SCC qui sont tous les deux initiés au niveau de l’épiderme dans les kératinocytes (Rigel 2008). Les cancers de type non-mélanome sont les plus souvent diagnostiqués aux États-Unis, et ce, surtout chez la population âgée. Ils se retrouvent généralement au niveau des zones exposés à répétition au soleil, soit la tête et le cou (Kumar, Deep, and Agarwal 2015). Malgré leur grande prépondérance, ceux-ci ont l’avantage d’être peu mortel étant donné qu’ils n’ont pas tendance à se métastaser. Ils restent donc confinés dans leur
espace d’initiation et ils sont facilement traitable par ablation (D'Orazio et al. 2013; Budden and Bowden 2013).
Ainsi, les cancers BCC et SCC vont tous les deux présenter un haut taux de mutations de types signature UV, et ce, particulièrement au niveau des gènes p53 et « guanosine-nucleotide-binding protein » une petite GTPase (RAS) (Park et al. 2009). Plus spécifiquement, le gène p53 possède une mutation ponctuelle causée généralement par une transition de type CàT; elle-même causée par la présence de CPD associés aux rayons UVB (de Gruijl, van Kranen, and Mullenders 2001). Des mutations dans les gènes PTCH ou SMO semblent être les anomalies initiatrices dans plus de 70% des BCC (Annexe : Figure 30) (Budden and Bowden 2013). Au niveau du SCC, il s’agirait plutôt d’une activation de la voie RTK/RAS en combinaison avec un disfonctionnement de p53 en plus d’une possible contribution de HPV qui serait à l’origine de l’état cancéreux (Annexe : Figure 30) (de Gruijl, van Kranen, and Mullenders 2001). Ainsi, ces deux types de cancer sont éthologiquement différents, mais partagent le facteur initiateur majeur, soit l’exposition aux rayons UV.
2.5.3.2 Mélanome
Il est estimé que l’exposition aux rayons UV est responsable d’environ 65% des mélanomes (Lo and Fisher 2014). Le risque de développer ce type de cancer est fortement lié à la quantité et aux habitudes d’exposition de la zone affectée par le soleil. L’exposition récréative et l’accumulation d’érythèmes cutanés sont associées au développement du mélanome (Chang et al. 2009). En effet, il y a présence dans la moitié des mélanomes de mutations de type CàT et GàA, caractéristiques des mutations dues aux rayons UV (Berger et al. 2012; Pleasance et al. 2010; Budden and Bowden 2013). Il est aussi intéressant de mentionner que la corrélation entre l’incidence du mélanome et l’exposition solaire est plus forte lorsque les rayons UVA sont aussi inclus dans le calcul (Rigel 2008).
Malgré une place prédominante des dommages de type direct dans l’ADN du mélanome, les ROS ont aussi un impact mutagénique important en induisant des transversion GàT (Pleasance et al. 2010; Fruehauf and Trapp 2008). Ainsi, le spectre des mutations associées démontre, sans l’ombre d’un doute, que la majorité des mutations somatiques retrouvées dans le mélanome résultent de dommages à l’ADN causés par les rayons UV (Budden and Bowden 2013). Plus particulièrement, les gènes affectés par ce type de photo-lésion tel que BRAF ou NRAS vont généralement être associés à un sentier induisant la survie et la prolifération de la cellule.
En plus d’induire de nombreuses mutations ponctuelles dans les mélanocytes, il est connu que les rayons UV induisent l’inflammation et l’immunosuppression dans la peau ce qui favorise la croissance et, possiblement, le développement du mélanome (Emri et al. 2018; Garibyan and Fisher 2010). En effet, l’apparition de ce type de cancer a été observé suite à la surexpression de FGF2 en combinaison à un traitement aux rayons UVB (Czyz 2019). De plus, un facteur de risque important au développement du mélanome chez les phototypes I et II est le dysfonctionnement de MCR1 dont l’expression est étroitement associée à l’exposition solaire (D'Orazio et al. 2013). Cependant, le rôle des mutations induites par les rayons UV au niveau du développement de la maladie reste à déterminer (Budden and Bowden 2013).