Caractérisation biochimique et écologique
des corps multilamellaires produits chez
Dictyostelium discoideum
Mémoire
Alix Denoncourt
Maîtrise en microbiologie
Maître ès sciences (M. Sc.)
Québec, Canada
Résumé
Plusieurs protozoaires se nourrissant de bactéries peuvent sécréter des corps multilamellaires (CML) dans lesquels se retrouvent certaines bactéries pathogènes ayant résisté à la digestion par la cellule hôte. Ces bactéries enrobées dans des CML bénéficient de protections supplémentaires contre divers stress et sont susceptibles d’être aérosolisées et inhalées par l’humain. La présente étude visait à élucider le rôle physiologique des CML et les mécanismes de leur formation chez l’amibe modèle Dictyostelium discoideum. L’analyse en spectrométrie de masse du contenu protéique des CML a révélé la présence de quatre protéines majeures, incluant SctA communément associée aux pycnosomes. La fonction biologique des CML reste inconnue, mais il a été déterminé que les amibes et autres protozoaires pouvaient réinternaliser les CML sécrétés. Ces résultats permettent d’orienter les recherches afin d’élucider le véritable rôle des CML et ainsi mieux comprendre leur implication dans la transmission de bactéries pathogènes d’origine environnementale.
Abstract
Many protozoa that feed on bacteria secrete multilamellar bodies (MLBs). MLBs have been found to harbour pathogenic bacteria that are resistant to degradation by the host cell. MLBs serve to protect these bacteria from various external stresses and could be aerosolized and subsequently inhaled by humans. The aim of this study was to elucidate the physiological role of MLBs and the mechanisms governing their formation in the model amoeba Dictyostelium discoideum. Mass spectrometric analyses of purified MLBs revealed the presence of four major proteins, including SctA, a protein generally associated with pycnosomes. The biological function of MLBs remains unclear, but we demonstrated that the amoeba and another protozoan can reinternalize secreted MLBs. These results provide new insight into the role of MLBs in the cell and deepen our understanding of the involvement of MLBs in the transmission of environmental pathogenic bacteria.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations ... xiii
Remerciements ... xvii
Avant-propos ... xix
Chapitre 1 ... 1
Introduction ... 1
1.1 Les protozoaires ... 1
1.2 L’amibe Dictyostelium discoideum ... 2
1.3 La voie phago-endocytique ... 4
1.4 Les corps multilamellaires ... 6
1.5 Relation hôte-bactéries ... 9
1.5.1 L’enrobage de bactéries ... 12
1.6 Problématique ... 16
1.7 Objectifs spécifiques ... 18
Chapitre 2 ... 19
Identification de protéines retrouvées sur les corps multilamellaires produits par Dictyostelium discoideum ... 19
2.1 Résumé ... 19
Identification of proteins associated with multilamellar bodies produced by Dictyostelium discoideum ... 20
2.2 Abstract ... 21
2.3 Introduction ... 21
2.4 Material and methods ... 23
2.4.1 Amoeba, bacteria, and antibodies ... 23
2.4.2 Bacteria/amoebae co-cultures and purification of MLBs ... 24
2.4.3 Protein extraction from purified MLBs ... 24
2.4.4 SDS-PAGE and Western blot analyses ... 25
2.4.5 Immunofluorescence ... 26
2.4.6 Immunoprecipitation using the H36 antibody... 26
2.4.7 Protein identification by mass spectrometry ... 27
2.5 Results ... 27
2.5.1 Identification of proteins associated with MLBs ... 27
2.5.2 Confirmation of the presence of SctA on MLBs ... 30
2.5.3 The H36 antibody recognizes many proteins, including one on MLBs ... 33
2.5.4 Comparison of the anti-SctA and H36 antibodies as MLB markers ... 35
2.6 Discussion ... 37
2.7 Acknowledgements ... 41
2.8 Supporting information ... 42
Chapitre 3 ... 45
Caractérisation écologique des CML ... 45
3.1 Mise en contexte ... 45
3.2.2 Production et purification de CML et de billes enrobées ... 46
3.2.3 Test de phagocytose par D. discoideum ... 48
3.2.4 Test de phagocytose par T. pyriformis ... 49
3.2.5 Immunofluorescence ... 49
3.2.6 Microscopie électronique à transmission (MET) ... 50
3.3 Résultats ... 51
3.3.1 Production et purification de billes enrobées ... 51
3.3.2 Test de phagocytose par D. discoideum ... 54
3.3.3 Test de phagocytose par T. pyriformis ... 55
Chapitre 4 ... 63
Discussion générale ... 63
4. 1 Rôles possibles des CML ... 66
4.1.1 Communication intercellulaire ... 66
4.1.2 Cargo ... 67
4.1.3 Source de nutriments ... 68
4.1.4 Déchets métaboliques ... 69
4.1.5 Influence écologique sur d’autres micro-organismes ... 69
4.2 Conclusion et perspectives ... 70
Liste des tableaux
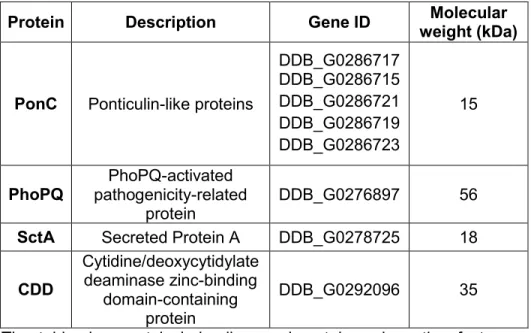
Tableau 1.1 Liste des combinaisons bactérie-protozoaire où l’enrobage de bactéries a été observé. ... 15 Table 2.1. Major proteins associated with MLBs based on mass spectrometric analyses. ... 29 S2.1 Table. Complete list of proteins associated with MLBs based on mass
Liste des figures
Figure 1.1. Le développement multicellulaire chez D. discoideum ... 3
Figure 1.2. La voie phago-endocytique chez D. discoideum ... 6
Figure 1.3. Les corps multilamellaires produits par les protozoaires ... 7
Figure 1.4. Les corps multilamellaires sont formés par l’invagination des membranes lysosomales chez D. discoideum ... 8
Figure 1.5. Certaines bactéries peuvent survivre à l’intérieur des protozoaires ... 11
Figure 1.6. L’enrobage de bactéries par les protozoaires ... 14
Figure 1.7. Les protozoaires peuvent enrober des billes de polystyrène dans des corps multilamellaires ... 16
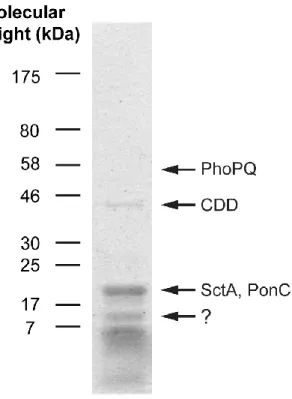
Figure 2.1. Protein profile of purified MLBs ... 30
Figure 2.2. SctA is an MLB-associated protein ... 32
Figure 2.3. MLBs have different morphologies ... 33
Figure 2.4. The H36 and AD7.5 antibodies recognize the same protein bands in reducing and non-reducing conditions ... 35
Figure 2.5. Comparison of the anti-SctA and H36 antibodies as MLB markers. ... 36
Figure 3.1. Protocole de purification de CML produits par D. discoideum ... 48
Figure 3.2. Images en microscopie à fluorescence des échantillons de billes enrobées purifiées ... 53
Figure 3.3. Images en microscopie électronique à transmission des échantillons de billes enrobées et purifiées ... 54
Figure 3.4. Images en microscopie à fluorescence des échantillons contenant des amibes D. discoideum en présence de billes enrobées... 55
Figure 3.5. Images en microscopie à fluorescence des échantillons contenant des ciliés T. pyriformis en présence de billes enrobées ... 57
Figure 3.6. Images en microscopie à fluorescence des échantillons contenant des ciliés T. pyriformis en présence de CML de D. discoideum ... 58
Figure 3.7. Séries d’images en microscopie confocale de corps fécaux produits par T. pyriformis en présence de CML de D. discoideum après 90 minutes de contact . 59 Figure 3.8. Images en microscopie électronique à transmission des échantillons contenant des ciliés T. pyriformis en présence de CML de D. discoideum ... 62
Liste des abréviations
AMPc : adénosine monophosphate cyclique ARNm : acide ribonucléique messager ATP : adénosine triphosphate
BSA : albumine de sérum bovin (Bovine Serum Albumin)
CHAPS : 3-[(3-cholamidopropyl)diméthylammonio]-1-propanesulfonate CML : corps multilamellaire
DAPI : 4',6'-diamidino-2-phénylindole DTT : Dithiothréitol
EDTA : Éthylène diamine tetra-acétique G : Gauss
GFP : protéine fluorescente verte (Green Fluorescent Protein) GlcNAc-1-P : N-acétylglucosamine-1-phosphate IgG: immunoglobuline G kDa : kilodalton kV: kilovolt LB: Lysogeny Broth M: molaire
MALDI-TOF-MS: Spectrométrie de masse à temps de vol et désorption-ionisation laser assistée par matrice (Matrix-Assisted Laser Desorption/Ionization
Time-Of-Flight Mass Spectrometry)
MET : microscopie électronique à transmission MLB : Multilamellar Bodies
mM: millimolaire
PBS : tampon phosphate salin (Phosphate Buffered Saline) PCB: Plate Count Broth
pH: potentiel hydrogène
PMSF : fluorure de phénylméthylsulfonyle (Phenylmethylsulfonyl Fluoride) RPM : rotation par minute
SDS-PAGE : électrophorèse en gel de polyacrylamide en présence de dodécylsulfate de sodium (Sodium Dodecyl Sulfate Polyacrylamide Gel
Electrophoresis)
TEM : Transmission Electron Microscopy TSA : Tryptic Soy Agar
À mes parents, pour la vie qu’ils m’ont
donnée
Remerciements
La réalisation de ce projet de maîtrise a été possible grâce au support et à la présence de nombreuses personnes. Tout d’abord, je souhaite remercier mon directeur de recherche, le Dr Steve Charette, pour sa grande disponibilité, son écoute et ses encouragements continus tout au long de mon projet qui a pris quelques fois une tournure sinueuse. Steve, merci de m’avoir accordé la chance inestimable de faire partie de ton équipe. Tu es l’acteur principal de l’atmosphère incroyable et chaleureuse qui demeure au fil des années au sein de ce laboratoire. Un grand merci également aux deux autres membres de mon comité d’évaluation, les Dre Caroline Duchaine et Manon Couture, pour leurs commentaires judicieux et le temps qu’elles ont accordé à l’encadrement de ce projet. De plus, l’aboutissement de ces travaux n’aurait pu avoir lieu sans la contribution des organismes subventionnaires : le CRSNG et le FRQNT pour les bourses de maîtrise et le CRIPA et l’AELIÉS pour les bourses de voyage et la subvention pédagogique.
Si les années consacrées à ce projet ont été aussi formidables, c’est grâce à de nombreuses personnes travaillant au sein de l’équipe de recherche. Je ne pourrais oublier de remercier Valérie, ma première formatrice de stage qui m’a tout appris de la vie de laboratoire, compagne de voyage hors pair et complice absolue du projet des bactéries enrobées. Tu as été et reste un modèle pour ma future vie professionnelle, et une grande amie tout au long de mon séjour au laboratoire. Merci pour ta grande écoute, ta complicité et de constituer ma source première de potins croustillants! Je tiens également à remercier Katherine, pour ta générosité et toutes les fois où tu es venue à mon secours alors que je me débattais avec les Mac, Cynthia, pour ta bonne humeur constante et Jade, pour ton amitié de longue date, ta folie divertissante et de m’avoir permis de partager les aléas de la culture des amibes! Merci à Sabrina, cette force tranquille, en voyage j’y ai découvert une personne géniale et amusante. Je remercie également Alex et Martin, la relève, et Antony, pour avoir fait grandir ma culture des mathématiciens et bio-informaticiens célèbres! Enfin, les anciens : Myriam et son énergie débordante, Mélanie, Jean-Guillaume, Stéphanie et Geneviève, qui ont contribué chacun d’eux à rendre chaque jour au laboratoire si agréable.
Je ne remercierai jamais assez mes parents, Hélène et Richard, pour nous avoir tout donné, à moi et à ma sœur, afin que l’on ait les meilleurs outils dans la vie. Je n’aurais pas pu demander meilleurs parents. À mon père, tout particulièrement, merci pour ta présence et la fierté que tu me témoignes chaque jour. Merci à ma grande sœur Estelle d’être présente dans ma vie : malgré nos petits différends fraternels, je ne t’échangerais pour rien au monde. Pour finir, je remercie également mes amies Marie-Ève, qui a survécu au baccalauréat avec moi et dont l’amitié m’a été précieuse toutes ces années, et Audrey : depuis près de 10 ans qu’on se connaît, tu es restée aussi vraie et attentive qu’au premier jour.
Avant-propos
Le chapitre 2 de ce mémoire est rédigé sous la forme d’un article scientifique qui a été soumis à la revue PLOS ONE le 14 mars 2016 (numéro de manuscrit : PONE-D-16-10674). Cet article porte sur l’identification des protéines retrouvées sur les corps multilamellaires produits par l’amibe Dictyostelium discoideum. Les auteurs sont Alix
M. Denoncourt, Valérie E. Paquet, Ahmadreza Sedighi et Steve J. Charette. Tous
les auteurs sont affiliés à l’Institut de Biologie Intégrative et des Systèmes, Université Laval.
Mon statut concernant cet article est celui de première auteure. J’ai rédigé la totalité de l’article à l’exception des sections portant sur les immunoprécipitations avec l’anticorps H36 et les immunobuvardages de type Western avec les anticorps H36 et AD7.5 (écrites par S. J. Charette), ainsi qu’une partie de la section Résultats traitant de l’identification des protéines par spectrométrie de masse (écrite par V. E. Paquet). S. J. Charette et V. E. Paquet ont également révisé l’article. J’ai réalisé la majorité des expériences qui y sont présentées. V. E. Paquet a participé activement à la purification et à la préparation des échantillons de corps multilamellaires pour la spectrométrie de masse ainsi qu’à l’analyse des résultats de l’identification des protéines. Les immunoprécipitations avec l’anticorps H36 et les immunobuvardages de type Western avec les anticorps H36 et AD7.5 ont été effectués par A. Sedighi. Cette étude a été entièrement réalisée sous la supervision de S. J. Charette.
Chapitre 1
Introduction
1.1 Les protozoaires
Le terme «protiste» regroupe l’ensemble des organismes eucaryotes unicellulaires qui, par opposition aux organismes supérieurs, ne forment pas de tissus spécialisés, bien que certaines espèces possèdent un stade multicellulaire. Parmi ceux-ci, les protistes hétérotrophes sont également connus sous l’appellation de «protozoaire» qui constitue plutôt un regroupement paraphylétique que d’un véritable taxon (Adl et
al., 2005). Les protozoaires peuvent être classés en quatre grandes catégories selon
leur mode de locomotion, soit le déplacement par pseudopodes (amibes), cils (ciliés), flagelles (flagellés) ou spores flagellées (sporozoaires). Certains sont des parasites d’animaux alors que d’autres vivent de façon libre dans l’environnement. Ces derniers se retrouvent dans pratiquement tous les écosystèmes terrestres et aquatiques ainsi que dans plusieurs installations artificielles telles que les tours de refroidissement, les unités dentaires et les réseaux d’eau potable (Greub et Raoult, 2004).
De nombreux protozoaires se nourrissent de bactéries, champignons ou algues par phagocytose. Les caractéristiques propres à chaque groupe fonctionnel de protozoaire leur confèrent une niche écologique particulière. Ainsi, les amibes dominent les systèmes biologiques du sol où elles peuvent avoir accès aux pores de petite taille dans la matrice du sol par extension de leurs pseudopodes afin d’y chasser leurs proies (Ekelund et Ronn, 1994). La prédation par les protozoaires constitue une source majeure de mortalité bactérienne dans les écosystèmes marins, d’eau douce et du sol (Fenchel, 1987). Ce faisant, les protozoaires bactériovores participent activement au contrôle des populations bactériennes (Fenchel, 1987) en plus de favoriser le recyclage des nutriments dans les réseaux trophiques (Bamforth, 1985). Certains prédateurs bactériens sont plus spécifiques que d’autres dans la sélection de leurs proies. Par exemple, l’amibe Acanthamoeba
castellanii fait preuve de discrimination entre les différentes bactéries cibles à l’aide
(Brown et al., 1975). Par conséquent, les protozoaires constituent d’importants modulateurs de la structure génétique et fonctionnelle des communautés microbiennes (Griffiths, 1999; Ronn et al., 2002).
1.2 L’amibe Dictyostelium discoideum
Plusieurs protozoaires sont utilisés à titre d’organismes modèles pour l’étude de divers processus cellulaires fondamentaux, tirant profit de leurs caractéristiques communes avec certaines cellules humaines. Le cilié Tetrahymena (Eisen et al., 2006) ainsi que les amibes Acanthamoeba (Sandstrom et al., 2011) et Dictyostelium
discoideum (Bozzaro et Eichinger, 2011; Cosson et Soldati, 2008; Dallaire-Dufresne et al., 2011) sont parmi les plus fréquemment employés. D. discoideum est un
phagocyte professionnel ubiquitaire des sols humides se nourrissant de bactéries et autres micro-organismes. L’utilisation de cette amibe en tant qu’organisme modèle est de la plus grande praticité : elle croît à la température de la pièce dans un milieu de culture axénique ou en présence de bactéries digestibles, possède un court temps de génération (entre 4 et 12 heures) et son petit génome haploïde est entièrement séquencé et annoté (Eichinger et al., 2005). Cette dernière caractéristique permet la réalisation de manipulations génétiques de toutes sortes telles que l’inactivation ciblée de gènes par recombinaison homologue (Charette et
al., 2006a; Kuspa et al., 1995) et l’étiquetage de gènes à l’aide de vecteurs
d’expression (Levi et al., 2000; Manstein et al., 1995).
D. discoideum est également une amibe dite «sociale», c’est-à-dire qu’elle est
capable de former des structures multicellulaires lorsque la nourriture vient à manquer, une stratégie visant la survie de la collectivité au détriment de l’individu. D’un état végétatif et solitaire, les cellules évoluent vers différentes phases d’agrégation, de différenciation cellulaire et de morphogénèse afin de permettre la formation de corps fructifères supportant des masses de spores capables de résister à des environnements moins favorables (Figure 1.1) (Kessin, 2001). Ces spores sont éventuellement dispersées par contact avec des petits invertébrés du sol (ex. : nématodes) alors que les cellules de la tige des corps fructifères sont sacrifiées. Le développement multicellulaire chez D. discoideum constitue un vaste sujet de recherche incluant, entre autres, les surprenantes notions de coopérativité et
d’altruisme chez un organisme unicellulaire ainsi que les phénomènes de communication intercellulaire et de chimiotaxie.
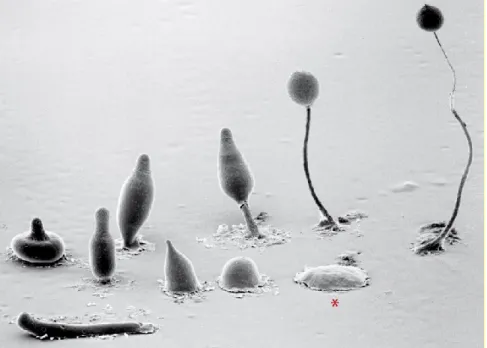
Figure 1.1. Le développement multicellulaire chez D. discoideum. Dans
le sens horaire à partir de l’astérisque (*): en situation de famine, les amibes sécrètent des vagues d’AMPc menant à l’agrégation d’environ 100 000 cellules en un monticule. Ce dernier s’allonge en hauteur pour former une pointe constituée des cellules contrôlant l’organisation et le développement de la structure. Au stade suivant, les amibes peuvent soit procéder directement à la production des corps fructifères, soit former un plasmode (en bas à gauche sur l’image). Celui-ci possède de remarquables capacités photo- et thermotactiques permettant sa migration selon des gradients de lumière et de chaleur afin de repérer les conditions les plus favorables. Lors de la culmination des corps fructifères, les cellules de la tige sécrètent de grandes quantités de cellulose pour rigidifier la structure et meurent durant le processus. Les cellules restantes s’encapsulent d’une paroi de cellulose et de mucopolysaccharides caractéristiques des spores, puis celles-ci sont soulevées jusqu’au sommet de la tige. Image en microscopie électronique: Copyright, M.J. Grimson & R.L. Blanton, Biological Sciences Electron Microscopy Laboratory, Texas Tech University.
L’intérêt suscité en recherche par D. discoideum réside également dans le fait de sa ressemblance saisissante avec les macrophages du système immunitaire animal. Les leucocytes tels que les macrophages, neutrophiles et cellules dendritiques sont qualifiés de phagocytes professionnels au regard de leur efficace ingestion de micro-organismes, tout comme D. discoideum qui peut internaliser jusqu’à 300 bactéries
par heure (Bozzaro et al., 2008; Steinert, 2011). Les amibes et les cellules de mammifères partagent des stratégies phagocytiques de base similaires (Cosson et Soldati, 2008) telles que la capacité de repérer et chasser les proies par chimiotaxie (van Es et Devreotes, 1999) ainsi que les mécanismes de mise à mort des micro-organismes faisant intervenir une variété d’enzymes et de transporteurs ioniques). De plus, le trafic membranaire et la voie endocytique chez D. discoideum sont hautement similaires aux processus en vigueur chez les macrophages (Cardelli, 2001; Solomon et Isberg, 2000). Par ailleurs, il existe un haut degré de conservation entre les protéomes de l’humain et de D. discoideum (Eichinger et al., 2005), et cette orthologie permet l’étude de certaines protéines d’intérêt dans le contexte simplifié que constitue l’amibe. Enfin, une des contributions les plus notables du modèle amibien est son utilisation comme hôte alternatif de plusieurs bactéries pathogènes infectant les macrophages (Bonifait et al., 2011; Bozzaro et al., 2008; Clarke, 2010; Cosson et Soldati, 2008; Dallaire-Dufresne et al., 2011; Steinert, 2011). D.
discoideum est donc largement employé pour l’étude de la virulence bactérienne et
des interactions hôte-pathogène.
1.3 La voie phago-endocytique
Les amibes acquièrent les nutriments nécessaires à leur survie par l’internalisation de molécules via la formation de vésicules. Ce processus est désigné par le terme «phagocytose» lorsqu’il y a ingestion de particules solides alors que la macropinocytose réfère à l’engouffrement de fluides dans de larges vacuoles ayant habituellement de 0,5 à 2 µm de diamètre (Mercanti et al., 2006). Chez D.
discoideum, des souches axéniques ont été sélectionnées en laboratoire pour leur
capacité à s’alimenter par macropinocytose, sans l’apport de bactéries comestibles. La phagocytose d’une particule est initiée par sa liaison à des récepteurs membranaires de surface et la transduction subséquente de signaux intracellulaires induisant la réorganisation locale du cytosquelette d’actine (Mellman, 1996). Il y a alors invagination de la membrane plasmique en une coupe phagocytique afin d’encercler la particule qui est engouffrée dans la cellule (Figure 1.2). Le matériel ingéré se retrouve emprisonné dans un phagosome pendant environ une minute, avant le retrait du manteau de protéines du cytosquelette entourant la vésicule
(Hacker et al., 1997; Maniak et al., 1995). Le phagosome mature fusionne ensuite rapidement avec des vésicules contenant des pompes à proton de type vacuolaire (H+-ATPase de type V ou V-ATPase) qui sont incorporées dans la membrane du
compartiment résultant, le lysosome (Bush et al., 1994; Clarke et al., 2002; Nolta et
al., 1994; Temesvari et al., 1996). La fusion des vésicules permet également
l’introduction d’enzymes lysosomales moins de 3 minutes après l’ingestion de bactéries (Souza et al., 1997) alors que le compartiment est acidifié par l’action des pompes à protons (Aubry et al., 1993; Padh et al., 1991). Chez D. discoideum, deux classes d’enzymes de type hydrolase sont acheminées successivement aux lysosomes : celles portant la modification post-traductionnelle N-acétylglucosamine-1-phosphate (GlcNAc-1-P) et celles modifiées avec un mannose-6-phosphate (Souza et al., 1997). Les protéases à cystéine, modifiées par l’ajout d’un GlcNAc-1-P, jouent un rôle majeur dans la dégradation des bactéries internalisées dans les lysosomes (Mehta et al., 1995; North et Cotter, 1991).
Une fois la digestion de la particule complétée, le compartiment revient à un pH neutre et se voit dépouillé de plusieurs protéines telles que les pompes H+-ATPase
(Aubry et al., 1993; Padh et al., 1993). Ce lysosome tardif (ou post-lysosome) acquiert également plusieurs autres marqueurs, notamment l’actine, la coronine et la vacuoline (Rauchenberger et al., 1997). Parallèlement, le lysosome tardif permet la formation de structures composées de multiples couches membranaires appelées corps multilamellaires, ceux-ci ne se formant que lors de la phagocytose de bactéries et non lors de l’internalisation de fluides (Hohl, 1965; Marchetti et al., 2004). Le contenu du lysosome tardif est finalement sécrété dans l’environnement par fusion du compartiment avec la membrane plasmique.
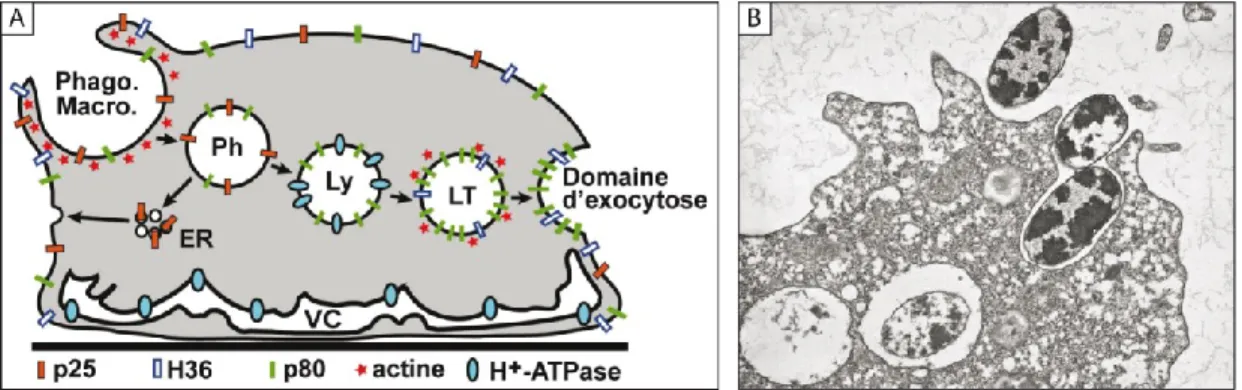
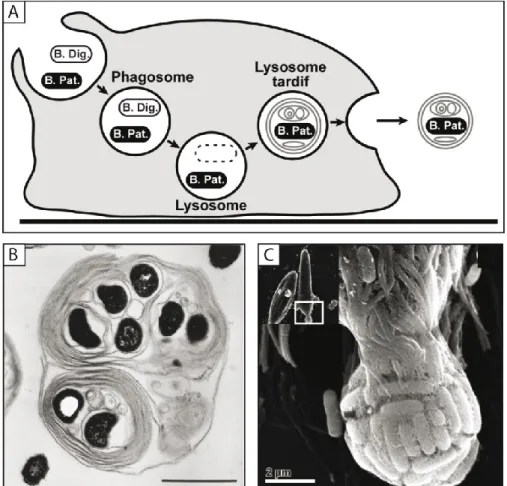
Figure 1.2. La voie phago-endocytique chez D. discoideum. A. Schéma
hypothétique de la voie phago-endocytique chez D. discoideum. Plusieurs protéines distribuées dans la voie phago-endocytique peuvent servir de marqueurs pour la visualisation des différents compartiments. La protéine p25 est internalisée lors de la formation de la coupe phagocytique puis est retournée à la surface via un système d’endosomes de recyclage (Charette
et al., 2006b). La protéine p80 s’accumule quant à elle tout au long de la voie
phago-endocytique (Ravanel et al., 2001) alors que la pompe H+-ATPase est
associée aux lysosomes (Bush et al., 1994; Nolta et al., 1994; Temesvari et
al., 1996) et à la vacuole contractile (Fok et al., 1993). Le cytosquelette
d’actine est impliqué dans la formation de la coupe phagocytique ou macropinocytique en plus de se retrouver sur les lysosomes tardifs (Rauchenberger et al., 1997). Enfin, la protéine reconnue par l’anticorps H36 se situe majoritairement sur la membrane plasmique. Ph : phagosome, Ly : lysosome, LT : lysosome tardif, ER : endosomes de recyclage. Image : Steve Charette, communication personnelle. B. Les différentes étapes de la phagocytose de bactéries Klebsiella aerogenes par D. discoideum : adhésion de l’amibe à la bactérie, internalisation de la proie dans un phagosome, mise à mort et dégradation de la bactérie. Image en microscopie électronique à transmission reproduite de Cosson et Soldati, 2008.
1.4 Les corps multilamellaires
Les corps multilamellaires (CML) sont de petites structures protéo-lipidiques d’origine lysosomale, composées de multiples membranes concentriques et dont l’aspect se rapproche de celui de pelures d’oignon (Figure 1.3). Une grande variété de cellules eucaryotes produisent et sécrètent des CML ou des vésicules apparentées (appelées corps fécaux ou fecal pellets), incluant les amibes, ciliés et autres protistes phagotrophes (Allen et Wolf, 1979; Buck, 1990, 2005; Chekabab et
al., 2012; Gezelius, 1959; Hohl, 1965; Paquet et al., 2013). Chez D. discoideum, les
CML sont produits abondamment lorsque les cellules se nourrissent activement de bactéries digestibles, bien que la présence de CML puisse encore être détectée dans des populations d’amibes à différentes étapes du développement multicellulaire (après ingestion de bactéries) (Hohl, 1965). La morphologie des CML
varie grandement selon le type de protozoaire, allant de lamelles concentriques étroitement assemblées à des spirales de membranes relâchées (Figure 1.3). De même, la taille de ces structures dépend de l’identité du protozoaire : alors que les CML produits par D. discoideum sont de l’ordre d’environ 1 µm (Gezelius, 1961; Mercer et Shaffer, 1960) ceux issus de protozoaires plus imposants tels que
Tetrahymena et Acanthamoeba peuvent atteindre 5 µm de diamètre (Berk et al.,
2008; Berk et al., 1998).
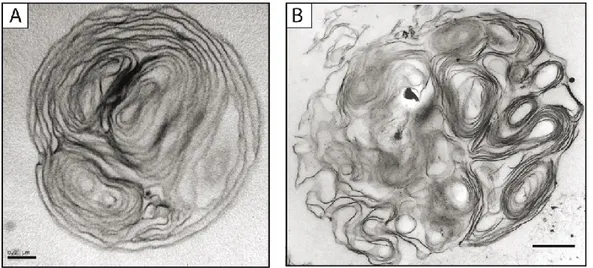
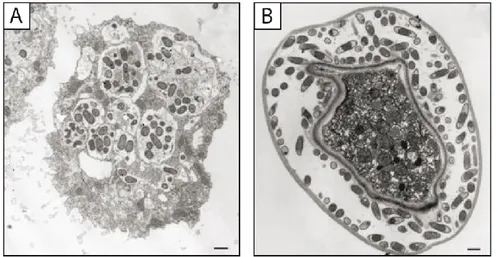
Figure 1.3. Les corps multilamellaires produits par les protozoaires. A.
Image en microscopie électronique à transmission d’un corps multilamellaire produit par l’amibe D. discoideum en présence de bactéries digestibles
Klebsiella aerogenes. Image : Steve Charette, communication personnelle. B. Image en microscopie électronique à transmission d’un CML produit par le
cilié Tetrahymena sp. en présence de bactéries digestibles Escherichia coli DH5α. Image reproduite de Berk et al., 2008. Échelle : A = 0,2 µm et B = 0,5 µm.
La fonction biologique des CML chez les protozoaires est inconnue, malgré que plusieurs études aient suggéré un rôle d’éjection de déchets bactériens non digestibles (Gezelius, 1959; Hohl, 1965) ou encore d’externalisation de protéines (Barondes et al., 1985). Même si l’ingestion de bactéries est nécessaire à la formation des CML chez D. discoideum, le processus en soi dépend vraisemblablement du métabolisme du protozoaire. En effet, la composition lipidique des CML chez D. discoideum, en majorité des phospholipides et des lipides neutres (ex. : les stérols), révèle une origine amibienne plutôt que bactérienne aux membranes qui composent ces structures (Paquet et al., 2013). Cette information
appuie les observations selon lesquelles les CML seraient le résultat de l’invagination répétitive de membranes lysosomales à l’intérieur des compartiments (Denoncourt et al., 2014) (Figure 1.4). En présence de bactéries digestibles comme en présence d’U18666A, une drogue qui altère le transport intracellulaire du cholestérol chez les mammifères, l’invagination des membranes lysosomales et la production de CML sont stimulées chez les cellules (Marchetti et al., 2004). Cela suggère donc un lien entre le métabolisme des stérols chez les protozoaires et la formation des CML, mais les mécanismes moléculaires gouvernant ce processus restent à être élucidés. Enfin, le type de bactérie internalisée a également une incidence sur la formation des CML puisque la morphologie de ces structures diffère grandement chez les amibes phagocytant des bactéries à Gram positif comparativement à celles confrontées à des bactéries à Gram négatif (Denoncourt
et al., 2014).
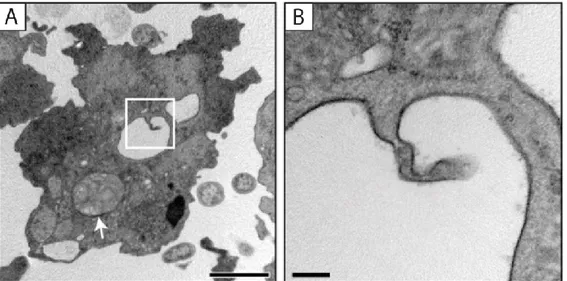
Figure 1.4. Les corps multilamellaires sont formés par l’invagination des membranes lysosomales chez D. discoideum. A. Image en
microscopie électronique à transmission d’une cellule de D. discoideum cultivée en présence de bactéries digestibles K. aerogenes et arborant un CML intra-lysosomal (flèche) ainsi qu’un profil d’invagination de la membrane lysosomale (encadré). B. Grossissement de l’encadré en A montrant l’invagination de la membrane du lysosome. Images reproduites de Denoncourt et al., 2014. Échelle : A = 2 µm et B = 0,2 µm.
Peu d’informations sont disponibles à propos de la composition protéique des CML et des gènes impliqués dans leur biogenèse. En fait, une des rares protéines identifiées sur les CML est la discoidine I (Barondes et al., 1985), une lectine ayant
un rôle dans l’adhésion cellulaire et la migration ordonnée des amibes lors du développement multicellulaire (Springer et al., 1984). Détectée sur les CML à l’aide d’un anticorps monoclonal spécifique, la discoidine I semblerait toutefois être associée uniquement aux CML présents et excrétés par les cellules au stade multicellulaire (Barondes et al., 1985). Certains composants bactériens ont également été décelés sur les CML, entre autres des polysaccharides capsulaires (Cooper et al., 1986), non digestibles par les amibes (Osen et al., 1965).
Chez les cellules humaines, des structures appelées «corps lamellaires» peuvent être considérées comme les analogues morphologiques des CML. En effet, ces corps lamellaires possèdent le même aspect de multiples couches membranaires concentriques et se présentent comme des organelles de sécrétion et de stockage de lipides. Mesurant entre 0,1 et 2,4 µm de diamètre, les corps lamellaires sont retrouvés chez diverses cellules du corps humain, notamment celles de l’épithélium pulmonaire. Les corps lamellaires produits par les pneumocytes de type II sont connus pour leur rôle de véhicule pour les protéines de surfactant pulmonaire. Toutefois, la formation de ces structures lipidiques diffère vraisemblablement de celle des CML puisqu’il ne semble pas y avoir de lien avec le processus de phagocytose. Des corps lamellaires sont également produits chez les macrophages, des cellules phagocytaires du système immunitaire. Chez ces dernières, les corps lamellaires auraient une origine lysosomale en plus d’être composés en majorité de phospholipides et de cholestérol. D’ailleurs, il a été suggéré que les corps lamellaires constituent un moyen de disposer de l’excès de cholestérol et d’échanger des lipides entre les différentes cellules. Enfin, certaines maladies impliquant le métabolisme ou le transport des lipides provoquent l’accumulation pathologique de membranes lysosomales menant à la formation de corps lamellaires (Schmitz et Muller, 1991).
1.5 Relation hôte-bactéries
Résultats d’une longue coévolution de plus d’un milliard d’années (Greub et Raoult, 2003), les multiples interactions entre protozoaires et bactéries ont mené à l’émergence de plusieurs micro-organismes résistants à la prédation. En effet, la pression exercée par l’activité prédatrice des protozoaires a contribué à la
diversification des caractéristiques fonctionnelles chez les populations bactériennes et à la sélection des adaptations les plus susceptibles de permettre leur survie (Matz et Kjelleberg, 2005). Parallèlement, ces mécanismes de résistance face aux prédateurs primitifs présentent de fortes similarités avec les traits de virulence observés chez les bactéries pathogènes infectant les eucaryotes supérieurs (Adiba
et al., 2010). Ainsi, des agents pathogènes tels que Streptomyces californicus
(Yli-Pirila et al., 2007) et Mycobacterium avium (Cirillo et al., 1997) voient leur virulence augmenter à la suite de leur incubation en présence de protozoaires. Ces derniers, plus particulièrement les amibes, présentent de nombreuses ressemblances avec les macrophages du système immunitaire animal, notamment les mécanismes de phagocytose et la machinerie microbicide. En conséquence, la résistance à la prédation par les protozoaires est considérée comme étant une condition évolutive préalable au développement de la pathogénicité bactérienne (King et al., 1988). Les stratégies de défense contre les prédateurs peuvent impliquer la modification morphologique de la bactérie, la production de métabolites secondaires ou encore de systèmes de sécrétion d’effecteurs. Les bactéries résistantes sont dites extracellulaires lorsque leur action inhibe leur ingestion ou leur reconnaissance par le prédateur alors que les bactéries intracellulaires peuvent survivre ou se multiplier à l’intérieur de la cellule hôte. Par exemple, Salmonella enterica parvient à modifier la composition de ses lipopolysaccharides de surface afin d’entraver sa détection par l’amibe Naegleria gruberi (Wildschutte et al., 2004). Escherichia coli O157 :H57, une souche bactérienne causant des colites hémorragiques chez l’humain, sécrète des exotoxines létales pour le cilié Tetrahymena thermophila (Lainhart et al., 2009). La stratégie de survie intracellulaire est l’une des plus remarquables. Les bactéries ingérées sont capables d’éviter la digestion à l’intérieur du prédateur et de se loger dans des vacuoles ou directement dans le cytoplasme de l’hôte (Figure 1.5A). D’autres encore peuvent résider dans des kystes, les formes dormantes et hautement résistantes produites par certains protozoaires confrontés à des conditions environnementales défavorables (Figure 1.5B). L’exemple le plus connu de survie et de réplication intracellulaire est sans contredit celui de Legionella
pneumophila, une bactérie pathogène causant de graves infections pulmonaires.
détourner la voie phagocytique et à inhiber la fusion entre le phagosome et les lysosomes afin d’échapper à la dégradation (Bozue et Johnson, 1996). L.
pneumophila recrute ensuite différents organites (mitochondries, petites vésicules et
réticulum endoplasmique rugueux) qui s’associent avec le phagosome, permettant à la bactérie de se camoufler alors qu’elle se multiplie dans ce compartiment modifié (Finsel et Hilbi, 2015; Prashar et Terebiznik, 2015). Les légionelles, comme les protozoaires, abondent dans les environnements d’eau douce et dans de nombreuses installations hydriques artificielles (tours de refroidissement, douches domestiques, spas, etc.) à partir desquelles elles sont aérosolisées et inhalées par l’humain (Abu Kwaik et al., 1998; Fields, 1996). Si les bactéries viennent à atteindre les voies respiratoires inférieures, elles infectent les macrophages alvéolaires d’une manière hautement similaire à celle employée chez l’amibe (Horwitz, 1983; Segal et Shuman, 1999; Swanson et Isberg, 1995). En fait, les protozoaires constituent les hôtes naturels de L. pneumophila, celle-ci étant moins apte à se répliquer de façon extracellulaire dans l’environnement (Murga et al., 2001). L’infection chez l’humain serait alors la conséquence indirecte de l’adaptation de cette bactérie à son hôte amibien. D’ailleurs, il a été proposé que la légionellose ne soit non pas causée par les bactéries en libre circulation, mais bien par celles associées aux protozoaires (Rowbotham, 1980).
Figure 1.5. Certaines bactéries peuvent survivre à l’intérieur des protozoaires. A. Image en microscopie électronique à transmission d’une
amibe Acanthamoeba astronyxis permettant la survie intracellulaire de bactéries Pseudomonas aeruginosa après 72 heures de co-culture. B. Après 6 jours de co-culture, les amibes forment des kystes résistants à l’intérieur desquels se retrouvent les bactéries P. aeruginosa. Images reproduites de
Les protozoaires sont donc considérés comme de véritables réservoirs de micro-organismes pathogènes dans l’environnement, notamment pour les bactéries
Mycobacterium spp. (Krishna-Prasad, 1978), Listeria monocytogenes (Ly et Muller,
1990) et Francisella tularensis (Berdal et al., 1996). En plus de supporter la prolifération de ces bactéries en grandes quantités, les protozoaires constitueraient également un vecteur de transmission qualifié de «Cheval de Troie» en ce sens que les bactéries internalisées sont protégées des premières lignes de défense du système immunitaire (Barker et Brown, 1994). Par exemple, la capacité de
Mycobacterium avium à infecter les cellules épithéliales intestinales chez la souris
est augmentée lorsque la bactérie est co-inoculée avec l’amibe Acanthamoeba
castellanii (Cirillo et al., 1997). L’accentuation de la virulence n’est pas le seul
avantage dont bénéficient les micro-organismes résidant dans les protozoaires. En effet, les parasites intracellulaires sont protégés contre une variété de stress physiques ou chimiques en plus de profiter d’une augmentation de leur survie à long terme (revu dans (Denoncourt et al., 2014)). Ainsi, la bactérie Afipia felis résiste à la chloration lorsqu’incluse dans des kystes d’Acanthamoeba polyphaga (La Scola et Raoult, 1999). Shigella sonnei et Shigella dysenteriae se logeant dans A. castellanii sont protégées de l’action de la gentamicine (Saeed et al., 2009). Enfin, l’association de L. pneumophila avec Acanthamoeba sp. diminue de 1,5 à 2 fois l’efficacité des radiations ultraviolettes à éliminer les bactéries (Cervero-Arago et al., 2014).
Les mécanismes permettant aux bactéries internalisées de s’échapper de leur hôte ne sont pas toujours bien compris. Dans certaines situations, il y a induction de la lyse du protozoaire afin de permettre la libération d’une grande quantité de cellules bactériennes. L’éjection non-lytique de la bactérie est également possible, entre autres dans le cas de Mycobacterium tuberculosis (Hagedorn et al., 2009). Un autre processus de sortie méconnu est celui de l’enrobage des bactéries dans des CML qui sont ensuite sécrétés par exocytose.
1.5.1 L’enrobage de bactéries
L’enrobage de bactéries consiste en l’inclusion de ces micro-organismes dans des CML ou des corps fécaux produits par les protozoaires. En effet, certaines bactéries peuvent survivre à l’ingestion par un protozoaire et ainsi résister à la dégradation
enzymatique s’opérant dans les lysosomes du prédateur. Elles se retrouvent alors enrobées dans les CML se formant au terme de la voie phagocytique. Ces enrobages sont ensuite relâchés dans le milieu extérieur par la fusion du lysosome tardif avec la membrane plasmique (exocytose) ou par la lyse du protozoaire induite par les bactéries. Chez D. discoideum, l’enrobage de bactéries survient lorsqu’il y a phagocytose simultanée de bactéries digestibles, stimulant la formation de CML, et de bactéries résistantes se retrouvant enrobées dans ces CML (Figure 1.6).
L’enrobage de bactéries est un phénomène complexe et encore mal compris à ce jour (Denoncourt et al., 2014). L’issue de l’interaction entre une bactérie et un protozoaire dépend d’une multitude de facteurs, notamment les conditions de croissance et les proportions relatives entre les deux micro-organismes. De plus, deux souches d’une espèce bactérienne ne seront pas nécessairement enrobées par un même protozoaire (Paquet et Charette, 2016), ce qui témoigne de la très grande variabilité et la complexité qu’impliquent les interactions bactéries-protozoaires.
À l’heure actuelle, cinq espèces bactériennes pathogènes sont connues pour être enrobées par des protozoaires (Tableau 1.1), mais quelques bactéries non-pathogènes telles que Cupriavidus sp. et Rathayibacter triciti sont aussi maintenant connues pour être incluses dans des CML (Paquet et Charette, 2016). Les protozoaires connus pour accomplir de l’enrobage de bactéries appartiennent au groupe des ciliés ou des amibes.
Le phénomène de l’enrobage de bactéries soulève l’intérêt en recherche du fait que ces bactéries, toujours viables à l’intérieur des CML, sont protégées contre une multitude de stress chimiques ou physiques. En effet, la nature lipidique hautement compactée des CML constituerait une barrière physique limitant l’impact de divers agents et conditions environnementales sur les bactéries enrobées. Par exemple, L.
pneumophila enrobée dans des CML produits par Acanthamoeba polyphaga ou Acanthamoeba castellanii peut résister à l’action de biocides couramment employés
dans la désinfection de tours de refroidissement ainsi qu’à des cycles de gel-dégel (Berk et al., 1998). Lorsqu’elles sont enveloppées dans des corps fécaux sécrétés par Tetrahymena tropicalis, les légionelles présentent également une augmentation
de leur survie à long terme en milieu pauvre en plus d’être significativement plus infectieuses dans des pneumocytes humains (Koubar et al., 2011). De plus, il a été démontré que des bactéries E. coli O157:H7 incluses dans des corps fécaux de
Tetrahymena pyriformis étaient capables de se multiplier et de s’échapper de
l’enrobage lorsqu’exposées à un milieu riche (Gourabathini et al., 2008).
Figure 1.6. L’enrobage de bactéries par les protozoaires. A. Schéma
hypothétique de la voie phagocytique chez D. discoideum menant à l’enrobage de bactéries. Les bactéries digestibles (B. Dig.) sont dégradées dans les lysosomes alors que les bactéries résistantes (B. Pat.) sont incluses dans les corps multilamellaires naissants à l’étape du lysosome tardif. Image : Steve Charette, communication personnelle. B. Image en microscopie électronique à transmission d’un corps multilamellaire produit par l’amibe Acanthamoeba castellanii et contenant des bactéries Legionella
pneumophila. Image reproduite de Berk et al., 1998. C. Image en
microscopie électronique à balayage d’un corps fécal en voie d’être sécrété par le cilié Tetrahymena sp. et contenant de nombreuses bactéries
Escherichia coli O157:H7. Image reproduite de Smith et al., 2012. Échelle : B
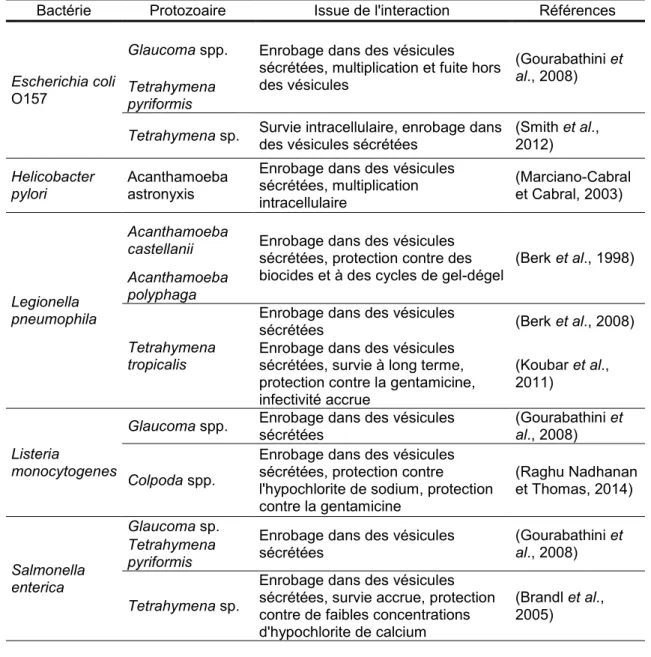
Tableau 1.1 Liste des combinaisons bactérie-protozoaire où l’enrobage de bactéries a été observé.
Bactérie Protozoaire Issue de l'interaction Références
Escherichia coli
O157
Glaucoma spp. Enrobage dans des vésicules sécrétées, multiplication et fuite hors des vésicules
(Gourabathini et
al., 2008) Tetrahymena
pyriformis
Tetrahymena sp. Survie intracellulaire, enrobage dans des vésicules sécrétées (Smith et al., 2012) Helicobacter
pylori
Acanthamoeba astronyxis
Enrobage dans des vésicules sécrétées, multiplication intracellulaire (Marciano-Cabral et Cabral, 2003) Legionella pneumophila Acanthamoeba
castellanii Enrobage dans des vésicules sécrétées, protection contre des
biocides et à des cycles de gel-dégel (Berk et al., 1998)
Acanthamoeba polyphaga Tetrahymena tropicalis
Enrobage dans des vésicules
sécrétées (Berk et al., 2008)
Enrobage dans des vésicules sécrétées, survie à long terme, protection contre la gentamicine, infectivité accrue
(Koubar et al., 2011)
Listeria
monocytogenes
Glaucoma spp. Enrobage dans des vésicules sécrétées (Gourabathini et al., 2008) Colpoda spp.
Enrobage dans des vésicules sécrétées, protection contre l'hypochlorite de sodium, protection contre la gentamicine
(Raghu Nadhanan et Thomas, 2014)
Salmonella enterica
Glaucoma sp. Enrobage dans des vésicules
sécrétées (Gourabathini et al., 2008) Tetrahymena pyriformis Tetrahymena sp.
Enrobage dans des vésicules sécrétées, survie accrue, protection contre de faibles concentrations d'hypochlorite de calcium
(Brandl et al., 2005)
Tableau reproduit de Denoncourt et al., 2014.
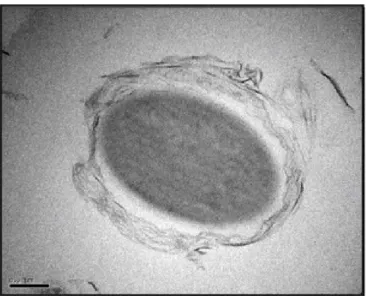
Bien que les mécanismes dirigeant l’enrobage des bactéries ne soient pas connus, il est établi que ce processus est sous le contrôle du protozoaire et non de la bactérie résistante. En effet, l’amibe D. discoideum parvient à enrober des billes de polystyrène dans des CML, ces billes physiologiquement inertes permettant de mimer le comportement des bactéries résistantes (Figure 1.7) (Denoncourt et al., 2014). Ainsi, il convient qu’étudier la physiologie du protozoaire est primordial dans
Figure 1.7. Les protozoaires peuvent enrober des billes de polystyrène dans des corps multilamellaires. Image en microscopie électronique à
transmission d’une bille de polystyrène enrobée dans un corps multilamellaire par l’amibe D. discoideum en présence de bactéries digestibles K.
aerogenes. Image reproduite de Denoncourt et al., 2014. Échelle = 0,2 µm.
1.6 Problématique
Les données rassemblées à ce jour sur l’enrobage de bactéries permettent d’entrevoir un rôle pour ce processus dans la persistance et la propagation de bactéries pathogènes dans l’environnement. En effet, les bactéries enrobées conservent leur viabilité et sont aptes à se libérer des CML lorsque des conditions favorables se présentent. Protégées contre l’action des désinfectants et d’autres agressions du milieu extérieur, elles représentent donc une difficulté supplémentaire dans l’éradication des agents pathogènes. Certaines études indiquent également que la virulence des bactéries pathogènes pourrait être exacerbée après leur passage dans un protozoaire (Cirillo et al., 1997; Koubar et al., 2011). De plus, la quantité de CML et de corps fécaux relâchés dans l’environnement pourrait être très importante considérant l’ubiquité des protozoaires et leur étroite association avec les bactéries. Enfin, le nombre de bactéries pathogènes pouvant être enrobées par un protozoaire est pratiquement incalculable puisque, chaque interaction entre un protozoaire et une souche bactérienne étant unique, les possibilités de combinaisons sont pratiquement infinies.
L’aspect central de la problématique entourant le phénomène de l’enrobage de bactéries est que l’aérosolisation et l’inhalation subséquente de CML chargés d’agents pathogènes pourraient constituer un vecteur d’importance dans la transmission d’infections respiratoires. Les installations hydriques artificielles telles que les tours de refroidissement et les réseaux d’eau potable, mais également les étendues d’eau douce stagnante supportent communément la croissance de protozoaires et de bactéries potentiellement pathogènes, et sont donc susceptibles de générer des aérosols assortis de CML contaminés. Rowbotham fut le premier à émettre l’hypothèse que des vésicules d’origine amibienne contenant de grandes quantités de bactéries L. pneumophila soient les principaux véhicules de transmission de la maladie du Légionnaire (Rowbotham, 1980, 1986). En effet, les CML sont suffisamment petits (moins de 5 µm) pour atteindre les voies respiratoires inférieures lorsqu’inhalés par l’humain et, une fois à l’intérieur des alvéoles pulmonaires, les bactéries pathogènes incluses dans les CML pourraient facilement infecter les macrophages et autres cellules de l’hôte. L’enrobage de bactéries dans des CML porte vraisemblablement plus à conséquence que leur inclusion dans des kystes ou des cellules végétatives de protozoaires puisque la taille réduite des CML leur permettrait de s’infiltrer plus profondément dans le tractus respiratoire que les kystes ou les cellules végétatives.
Les données préliminaires montrent que les CML produits par D. discoideum peuvent être aérosolisés et que leur structure n’est pas endommagée lors du processus (V. Paquet, communication personnelle). Ainsi, cela suggère que des bactéries incluses dans des CML pourraient survivre aux stress imposés par l’aérosolisation et conserver leur potentiel infectieux. Le phénomène de l’enrobage de bactéries pourrait donc expliquer pourquoi de fortes doses infectieuses de micro-organismes peuvent être propagées sur de très longues distances sans souffrir de la dessiccation (Nguyen et al., 2006; Nygard et al., 2008).
La problématique du présent projet porte sur le manque de connaissances que nous avons sur la fonction biologique des CML et les processus de formation de ces structures chez l’amibe. La compréhension des mécanismes de formation des CML pourrait permettre de développer des outils pour mieux contrôler leur production dans l’environnement et ainsi limiter l’enrobage de bactéries pathogènes dans
certaines installations humaines critiques. Le premier pas vers ces réalisations serait l’identification précise des éléments composant les CML, notamment le contenu protéique qui demeure inconnu à ce jour. De plus, l’implication des CML dans la propagation de bactéries infectieuses consiste en un phénomène plutôt accidentel : le véritable rôle des CML dans la physiologie des protozoaires reste encore à être découvert. La formation de CML ou de structures apparentées est un processus conservé parmi un grand nombre de cellules eucaryotes, et il est donc peu probable que de telles structures ne possèdent pas une quelconque fonction d’importance chez ces organismes. Une autre avenue pour étudier cet aspect de la problématique est de considérer le rôle des CML d’un point de vue écologique. Quelle est l’importance de la sécrétion de CML pour une population d’amibes? Pour répondre à cette question, il importe de déterminer l’impact de la production des CML sur les populations de protozoaires cohabitant dans un écosystème.
1.7 Objectifs spécifiques
La présente étude vise à élucider les mécanismes de formation et le rôle physiologique des CML chez l’amibe D. discoideum. À cet effet, la caractérisation à la fois biochimique et écologique des CML a été entreprise. Les objectifs spécifiques associés à ce projet sont :
1. Identifier et caractériser les protéines majeures retrouvées sur les CML.
Les fonctions des protéines détectées pourraient donner des indications sur les acteurs moléculaires régissant la production des CML ou sur la fonction biologique de ces structures. Cet objectif correspond au chapitre 2 du présent document et est exposé sous la forme d’un article scientifique.
2. Analyser l’impact de la production de CML dans des populations de
protozoaires. Dans un contexte écologique où la cohabitation entre divers
protozoaires et bactéries est inévitable, il importe d’évaluer la possibilité de réinternalisation des CML par d’autres protozoaires. En déterminant quelles sont les interactions entre les CML et différentes populations de protozoaires, des indices sur la fonction biologique de ces structures pourraient être obtenus. Cet objectif correspond au chapitre 3 du document.
Chapitre 2
Identification de protéines retrouvées sur les
corps multilamellaires produits par
Dictyostelium discoideum
2.1 Résumé
L’amibe Dictyostelium discoideum sécrète des CML lorsqu’elle se nourrit de bactéries digestibles. La présente étude visait à élucider le rôle physiologique des CML et les mécanismes moléculaires dirigeant leur formation. Quatre protéines majeures ont été identifiées sur les CML par spectrométrie de masse, incluant SctA et une protéine contenant un domaine cytidine/déoxycytidylate déaminase (CDD). SctA est un constituant des pycnosomes, des structures membraneuses continuellement sécrétées par les cellules. La présence de SctA sur les CML a été confirmée par immunofluorescence et par immunobuvardage de type Western à l’aide d’un anticorps spécifique anti-SctA. La protéine CDD, de fonction inconnue, pourrait constituer une des protéines reconnues par l’anticorps H36 utilisé précédemment comme marqueur de CML. Des analyses d’immunofluorescence et de cytométrie en flux ont confirmé que H36 est un meilleur marqueur de CML que l’anti-SctA. Cette étude est une étape additionnelle pour élucider le rôle des CML dans la physiologie des protozoaires.
Identification of proteins associated with
multilamellar bodies produced by Dictyostelium
discoideum
Alix M. Denoncourt1,2,3, Valérie E. Paquet1,2,3, Ahmadreza Sedighi1,2,3, and Steve J.
Charette1,2,3
1. Institut de Biologie Intégrative et des Systèmes, Pavillon Charles-Eugène-Marchand, Université Laval, Quebec City, QC, Canada
2. Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie de Québec (Hôpital Laval), Quebec City, QC, Canada
3. Département de biochimie, de microbiologie et de bio-informatique, Faculté des sciences et de génie, Université Laval, Quebec City, QC, Canada
2.2 Abstract
Dictyostelium discoideum amoebae produce and secrete multilamellar bodies
(MLBs) when fed digestible bacteria. The aim of the present study was to elucidate the physiological role of MLBs. The lipid composition of MLBs is mainly amoebal in origin, suggesting that MLB formation is a protozoa-driven process that could play a significant role in amoebal physiology. We identified four major proteins on purified MLBs using mass spectrometry in order to better understand the molecular mechanisms governing MLB formation and, eventually, to elucidate the true function of MLBs. These proteins included SctA and a protein containing a cytidine/deoxycytidylate deaminase (CDD) zinc-binding region. SctA is a component of pycnosomes, which are membranous materials that are continuously secreted by amoebae. The presence of SctA on MLBs was confirmed by immunofluorescence and Western blotting using a specific anti-SctA antibody. The CDD protein may be one of the proteins recognized by the H36 antibody, which was used as a MLB marker in a previous study. The function of the CDD protein is unknown. Immunofluorescence and flow cytometric analyses confirmed that the H36 antibody is a better marker of MLBs than the anti-SctA antibody. This study is an additional step to elucidate the potential role of MLBs and revealed that only a small set of proteins appeared to be present on MLBs.
2.3 Introduction
Multilamellar bodies (MLBs) are structures of lysosomal origin composed of multiple concentric membrane layers (Schmitz and Muller, 1991). They are produced by various types of eukaryotic cells, including protozoa such as Dictyostelium
discoideum, which are soil organisms that feed mainly on bacteria by phagocytosis.
They produce MLBs ranging in size from 0.5 to 2 µm and secrete them into the environment (Gezelius, 1961; Mercer and Shaffer, 1960; Paquet et al., 2013).
D. discoideum MLBs are produced in abundance when the cells are grown in the
presence of digestible bacteria but are virtually absent when the cells are grown in nutrient liquid medium (Denoncourt et al., 2014; Hohl, 1965; Marchetti et al., 2004;
appear to be a waste disposal system that serves only to eliminate undigested bacterial remains. They are likely formed by repetitive inward budding of the membrane of lysosomal compartments (Denoncourt et al., 2014; Marchetti et al., 2004). Moreover, based on biochemical analyses of purified MLBs, it appears that lipids in MLBs are mainly amoebal in origin rather than being similar to the bacterial lipid profile. These results indicate that MLB membranes are the product of amoebal metabolism (Paquet et al., 2013). Hence, even if digestible bacteria are required for
D. discoideum to produce MLBs, the process depends largely on the metabolic
capability of the amoebae. MLBs may thus play a significant albeit unknown role in amoebal physiology.
MLBs, which are also called expelled vesicles and fecal pellets, are produced by various types of protozoa and are also involved in the bacteria packaging process, a phenomenon observed when ingested bacteria can resist enzymatic degradation that normally occurs in the phago-endocytic pathway before being packaged in MLBs or related structures. To date, viable packaged bacteria have been observed in the case of five bacterial pathogenic species, including the respiratory pathogen
Legionella pneumophila (reviewed in (Denoncourt et al., 2014). Bacteria packaged in
vesicles are more resistant to a variety of stresses, including biocides and antibiotics (Berk et al., 1998; Brandl et al., 2005; Koubar et al., 2011; Raghu Nadhanan and Thomas, 2014). The bacteria packaging process may thus be involved in the persistence and transmission of some pathogenic bacteria. It has been suggested that bacteria-containing MLBs would also be small enough to be aerosolized and to be inhaled by humans (Berk et al., 1998).
Given that MLB formation is under the control of the protozoa, the elucidation of the molecular mechanisms governing this process would provide a better understanding of the bacteria packaging phenomenon. This objective cannot be achieved without a more extended knowledge of the biochemical composition of MLBs and, more specifically of the protozoal proteins associated with these structures. Identifying these proteins and their functions may provide clues to the physiological roles of MLBs. Some proteins have already been identified on D. discoideum MLBs, including discoidin I and a cysteine proteinase, as well as yet unidentified glycosylated proteins (Barondes et al., 1985; Emslie et al., 1998; Fukuzawa and
Ochiai, 1993). However, discoidin I appears to be associated with MLBs solely in specific circumstances associated to multicellular development since vegetative cells do not contain this protein (Barondes et al., 1985; Fukuzawa and Ochiai, 1993). In the present study, we used a proteomic approach to identify four major proteins on purified MLBs, including SctA and a protein containing a cytidine/deoxycytidylate deaminase (CDD) zinc-binding region. Based on immunoprecipitation and mass spectrometric analyses, the CDD protein may be one of the epitopes recognized by the H36 antibody (Mercanti et al., 2006). This antibody has been used as an MLB marker (Paquet et al., 2013), but its epitope is unknown.
2.4 Material and methods
2.4.1 Amoeba, bacteria, and antibodies
D. discoideum DH1-10 cells (Cornillon et al., 2000) were grown at 21°C in HL5
medium supplemented with 15 µg/mL of tetracycline as previously described (Mercanti et al., 2006). They were subcultured twice a week in fresh medium to prevent the cultures from reaching the confluence. They were also grown on bacterial lawns as described below.
K. aerogenes bacteria were grown on LB agar (Millipore, USA) at 37°C, typically for
24h, before being used for the bacteria/amoebae co-culture experiments.
The H36 antibody (monoclonal mouse antibody) has been previously described (Mercanti et al., 2006). The anti-SctA antibody (B4.2) is a monoclonal mouse antibody (Sabra et al., 2016). Both antibodies were kindly provided by P. Cosson. The AD7.5 mouse monoclonal antibody, which recognizes N-acetylglucosamine-1-phosphate, was a gift from Hudson H. Freeze (Sanford-Burnham Medical Research Institute, La Jolla, CA, USA) (Mehta et al., 1996).
2.4.2 Bacteria/amoebae co-cultures and purification of MLBs
2 x 106 D. discoideum cells were grown with K. aerogenes on HL5 agar in 15 cm
Petri dishes for 7 days at 21°C to obtain large phagocytic plaques. Samples of the phagocytic plaques collected using sterile pipette tips were diluted in fresh HL5 medium and were processed for immunofluorescence as described below.
D. discoideum cells were grown in the presence of K. aerogenes to induce them to
secrete large amount of MLBs. The amoebae and bacteria were mixed in a proportion of 1:1000, respectively. They were plated on HL5 agar and were incubated at 21°C. After 5 or 6 days, the bacterial lawn was almost entirely
consumed by the D. discoideum cells. At this point, the co-culture was harvested using a sterile scraper, resuspended in 10 mL of starvation buffer (2 mM Na2HPO4,
14.7 mM KH2PO4, 100 mM sorbitol, 100 µM CaCl2, and 1 % HL5) (Smith et al.,
2010), and centrifuged at 450 x g for 5 min to pellet the amoebae. The supernatant was mixed with 5 x 107 D. discoideum cells freshly grown in liquid HL5. The new
co-culture was shaken at 200 rpm overnight at 21°C and was centrifuged at 450 x g for 5 min. The supernatant contained MLBs and particles (<0.5 µm) of various appearances. To concentrate the MLBs and separate them from the particulate material, 1 mL of supernatant was deposited on a 6-mL sodium bromide gradient ranging in density from 1.0 to 1.5 g/mL in a glass tube. The tube was centrifuged at 3220 x g for 45 min at room temperature. The yellowish aggregate corresponding to the pure MLB fraction (Paquet et al., 2013) was collected using a Pasteur pipette and was transferred to a 1.5-mL tube. The purified MLBs were washed twice with PBS by centrifuging them at 17,000 x g for 10 min between each wash. The protein concentration of the pelleted MLBs was determined using the Quick Start™ Bradford Protein Assay kit 1 (Bio-Rad, Canada). The purified MLBs were stored at 4°C in a small volume of fresh 1x PBS. The purified MLBs were examined by transmission electron microscopy (TEM) as previously described (Paquet et al., 2013).
2.4.3 Protein extraction from purified MLBs
The pellet of purified MLBs was resuspended in denaturation solution to obtain a concentration of 0.5 µg/µL. Two different denaturation solutions (DS1 and DS2) were used to determine whether the composition of the solution had an impact on the
identification of the proteins. The DS1 solution was composed of 10 M urea, 2% CHAPS, 50 mM DTT, and 1 M thiourea. The DS2 solution was composed of 10 M urea, 2% CHAPS, and 200 mM DTT. The proteins were solubilized and denatured at 95˚C for 5 min. The samples were mixed by inversion for 1 h and were centrifuged at 17,000 x g for 10 min. One-half volume of 3x TEX loading buffer was added to obtain a final concentration of 1x TEX. The lipidic structures were disrupted using a syringe and a 26G needle, and the mixture was heated at 95˚C for a further 5 min. The heating steps were omitted for samples that were to be assessed by Western blotting with the anti-SctA and H36 antibodies.
2.4.4 SDS-PAGE and Western blot analyses
The solubilized proteins were separated on 10% SDS-PAGE or 4-20% nUView Tris-Glycine gradient gels (NuSep, USA) in reducing (5% (v/v) 2-mercaptoethanol added to the samples loaded on the gel) or non-reducing conditions. Four major protein bands were excised from the gels run in non-reducing conditions for mass spectrometric analyses (see below). Samples were also separated on 12% SDS-PAGE gels for mass spectrometric analyses of total MLB proteins. Gels run in reducing conditions were used for Western blotting with the anti-SctA, H36, and AD7.5 antibodies. Gels run in non-reducing conditions were also used for Western blotting with H36 and AD7.5 antibodies.
Protein bands were electrotransferred to nitrocellulose membranes, which were immersed in 50 ml TBS (10 mM Tris, pH 7.4, and 150 mM NaCl) for 5 min. The membranes were incubated with TBSM (10 mM Tris, pH 7.4, 150 mM NaCl, and 7% skim milk) overnight at 4°C to block non-specific binding. The membranes were washed five times for 5 min with TBST (10 mM Tris, pH 7.4, 150 mM NaCl, and 0.1% Tween 20) and were incubated for 90 min at room temperature with the anti-SctA antibody (undiluted hybridoma supernatant), H36 (ascite diluted 1:20,000 in TBST), or AD7.5 antibody (hybridoma supernatant diluted 1:50 in TBST). They were washed three times for 5 min in TBST and were incubated for 1 h at room temperature with peroxidase-conjugated goat mouse IgG (Sigma-Aldrich, Canada) or goat anti-mouse IgG IRDye 680RD (Li-cor, USA). They were washed six times for 5 min in TBST. The protein bands were revealed using an ECL chemiluminescent detection