HAL Id: dumas-01799903
https://dumas.ccsd.cnrs.fr/dumas-01799903
Submitted on 25 May 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Profil clinique et biologique des patients suspects de
gastroparésie : comparaison des patients diabétiques de
type 1 versus type 2
Julie Drouhard
To cite this version:
Julie Drouhard. Profil clinique et biologique des patients suspects de gastroparésie : comparaison des patients diabétiques de type 1 versus type 2. Médecine humaine et pathologie. 2018. �dumas-01799903�
1
FACULTE MIXTE DE MEDECINE ET DE PHARMACIE DE ROUEN
ANNEE 2018
THESE POUR LE DOCTORAT EN
MEDECINE
Diplôme d’état
Par
Julie DROUHARD
Née le 20 Octobre 1989 à Bois-Guillaume (76)
Présentée et soutenue publiquement le 09 Avril 2018
Profil clinique et biologique des patients suspects
de gastroparésie : comparaison des patients
diabétiques de type 1 versus type 2
PRESIDENT DU JURY :
Monsieur le Professeur Hervé LEFEBVRE
DIRECTEUR DE THESE : Monsieur le Professeur Gaëtan PREVOST
2 ANNEE UNIVERSITAIRE 2017 - 2018
U.F.R. DE MEDECINE ET DE-PHARMACIE DE ROUEN ---
DOYEN : Professeur Pierre FREGER
ASSESSEURS : Professeur Michel GUERBET
Professeur Benoit VEBER Professeur Pascal JOLY Professeur Stéphane MARRET
I - MEDECINE
PROFESSEURS DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mr Frédéric ANSELME HCN Cardiologie
Mme Gisèle APTER Havre Pédopsychiatrie
Mme Isabelle AUQUIT AUCKBUR HCN Chirurgie plastique
Mr Fabrice BAUER HCN Cardiologie
Mme Soumeya BEKRI HCN Biochimie et biologie moléculaire
Mr Ygal BENHAMOU HCN Médecine interne
Mr Jacques BENICHOU HCN Bio statistiques et informatique médicale
Mr Olivier BOYER UFR Immunologie
Mme Sophie CANDON HCN Immunologie
Mr François CARON HCN Maladies infectieuses et tropicales
Mr Philippe CHASSAGNE (détachement) HCN Médecine interne (gériatrie) – Détachement Mr Vincent COMPERE HCN Anesthésiologie et réanimation chirurgicale
Mr Jean-Nicolas CORNU HCN Urologie
Mr Antoine CUVELIER HB Pneumologie
3 Mr Jean-Nicolas DACHER HCN Radiologie et imagerie médicale
Mr Stéfan DARMONI HCN Informatique médicale et techniques de communication
Mr Pierre DECHELOTTE HCN Nutrition
Mr Stéphane DERREY HCN Neurochirurgie
Mr Frédéric DI FIORE CB Cancérologie
Mr Fabien DOGUET HCN Chirurgie Cardio Vasculaire
Mr Jean DOUCET SJ Thérapeutique - Médecine interne et gériatrie
Mr Bernard DUBRAY CB Radiothérapie
Mr Philippe DUCROTTE HCN Hépato-gastro-entérologie
Mr Frank DUJARDIN HCN Chirurgie orthopédique - Traumatologique
Mr Fabrice DUPARC HCN Anatomie - Chirurgie orthopédique et traumatologique
Mr Eric DURAND HCN Cardiologie
Mr Bertrand DUREUIL HCN Anesthésiologie et réanimation chirurgicale
Mme Hélène ELTCHANINOFF HCN Cardiologie
Mr Manuel ETIENNE HCN Maladies infectieuses et tropicales
Mr Thierry FREBOURG UFR Génétique
Mr Pierre FREGER HCN Anatomie - Neurochirurgie
Mr Jean François GEHANNO HCN Médecine et santé au travail
Mr Emmanuel GERARDIN HCN Imagerie médicale
Mme Priscille GERARDIN HCN Pédopsychiatrie
M. Guillaume GOURCEROL HCN Physiologie
Mr Dominique GUERROT HCN Néphrologie
Mr Olivier GUILLIN HCN Psychiatrie Adultes
Mr Didier HANNEQUIN HCN Neurologie
Mr Fabrice JARDIN CB Hématologie
Mr Luc-Marie JOLY HCN Médecine d’urgence
Mr Pascal JOLY HCN Dermato – Vénéréologie
Mme Bouchra LAMIA Havre Pneumologie
Mme Annie LAQUERRIERE HCN Anatomie et cytologie pathologiques Mr Vincent LAUDENBACH HCN Anesthésie et réanimation chirurgicale Mr Joël LECHEVALLIER HCN Chirurgie infantile
Mr Hervé LEFEBVRE HB Endocrinologie et maladies métaboliques
Mr Thierry LEQUERRE HB Rhumatologie
4
Mr Hervé LEVESQUE HB Médecine interne
Mme Agnès LIARD-ZMUDA HCN Chirurgie Infantile Mr Pierre Yves LITZLER HCN Chirurgie cardiaque
Mr Bertrand MACE HCN Histologie, embryologie, cytogénétique
M. David MALTETE HCN Neurologie
Mr Christophe MARGUET HCN Pédiatrie
Mme Isabelle MARIE HB Médecine interne
Mr Jean-Paul MARIE HCN Oto-rhino-laryngologie
Mr Loïc MARPEAU HCN Gynécologie - Obstétrique
Mr Stéphane MARRET HCN Pédiatrie
Mme Véronique MERLE HCN Epidémiologie
Mr Pierre MICHEL HCN Hépato-gastro-entérologie
M. Benoit MISSET HCN Réanimation Médicale
Mr Jean-François MUIR (surnombre) HB Pneumologie
Mr Marc MURAINE HCN Ophtalmologie
Mr Philippe MUSETTE HCN Dermatologie - Vénéréologie
Mr Christophe PEILLON HCN Chirurgie générale
Mr Christian PFISTER HCN Urologie
Mr Jean-Christophe PLANTIER HCN Bactériologie - Virologie Mr Didier PLISSONNIER HCN Chirurgie vasculaire
Mr Gaëtan PREVOST HCN Endocrinologie
Mr Jean-Christophe RICHARD (détachement) HCN Réanimation médicale - Médecine d’urgence
Mr Vincent RICHARD UFR Pharmacologie
Mme Nathalie RIVES HCN Biologie du développement et de la reproduction
Mr Horace ROMAN HCN Gynécologie - Obstétrique
Mr Jean-Christophe SABOURIN HCN Anatomie - Pathologie
Mr Guillaume SAVOYE HCN Hépato-gastrologie
Mme Céline SAVOYE–COLLET HCN Imagerie médicale
Mme Pascale SCHNEIDER HCN Pédiatrie
Mr Michel SCOTTE HCN Chirurgie digestive
Mme Fabienne TAMION HCN Thérapeutique
Mr Luc THIBERVILLE HCN Pneumologie
Mr Christian THUILLEZ (surnombre) HB Pharmacologie
5
M. Gilles TOURNEL HCN Médecine Légale
Mr Olivier TROST HCN Chirurgie Maxillo-Faciale
Mr Jean-Jacques TUECH HCN Chirurgie digestive Mr Jean-Pierre VANNIER (surnombre) HCN Pédiatrie génétique
Mr Benoît VEBER HCN Anesthésiologie - Réanimation chirurgicale
Mr Pierre VERA CB Biophysique et traitement de l’image
Mr Eric VERIN HB Service Santé Réadaptation
Mr Eric VERSPYCK HCN Gynécologie obstétrique
Mr Olivier VITTECOQ HB Rhumatologie
Mme Marie-Laure WELTER HCN Physiologie
MAITRES DE CONFERENCES DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mme Noëlle BARBIER-FREBOURG HCN Bactériologie – Virologie
Mme Carole BRASSE LAGNEL HCN Biochimie
Mme Valérie BRIDOUX HUYBRECHTS HCN Chirurgie Vasculaire
Mr Gérard BUCHONNET HCN Hématologie
Mme Mireille CASTANET HCN Pédiatrie
Mme Nathalie CHASTAN HCN Neurophysiologie
Mme Sophie CLAEYSSENS HCN Biochimie et biologie moléculaire
Mr Moïse COEFFIER HCN Nutrition
Mr Serge JACQUOT UFR Immunologie
Mr Joël LADNER HCN Epidémiologie, économie de la santé
Mr Jean-Baptiste LATOUCHE UFR Biologie cellulaire
Mr Thomas MOUREZ HCN Virologie
Mr Gaël NICOLAS HCN Génétique
Mme Muriel QUILLARD HCN Biochimie et biologie moléculaire
Mme Laëtitia ROLLIN HCN Médecine du Travail
Mr Mathieu SALAUN HCN Pneumologie
Mme Pascale SAUGIER-VEBER HCN Génétique Mme Anne-Claire TOBENAS-DUJARDIN HCN Anatomie
6 PROFESSEUR AGREGE OU CERTIFIE
Mr Thierry WABLE UFR Communication
7 II - PHARMACIE
PROFESSEURS
Mr Thierry BESSON Chimie Thérapeutique
Mr Roland CAPRON (PU-PH) Biophysique
Mr Jean COSTENTIN (Professeur émérite) Pharmacologie
Mme Isabelle DUBUS Biochimie
Mr Loïc FAVENNEC (PU-PH) Parasitologie
Mr Jean Pierre GOULLE (Professeur émérite) Toxicologie
Mr Michel GUERBET Toxicologie
Mme Isabelle LEROUX - NICOLLET Physiologie
Mme Christelle MONTEIL Toxicologie
Mme Martine PESTEL-CARON (PU-PH) Microbiologie
Mr Rémi VARIN (PU-PH) Pharmacie clinique
Mr Jean-Marie VAUGEOIS Pharmacologie
Mr Philippe VERITE Chimie analytique
MAITRES DE CONFERENCES
Mme Cécile BARBOT Chimie Générale et Minérale
Mr Jérémy BELLIEN (MCU-PH) Pharmacologie
Mr Frédéric BOUNOURE Pharmacie Galénique
Mr Abdeslam CHAGRAOUI Physiologie
Mme Camille CHARBONNIER (LE CLEZIO) Statistiques
Mme Elizabeth CHOSSON Botanique
Mme Marie Catherine CONCE-CHEMTOB Législation pharmaceutique et économie de la santé
Mme Cécile CORBIERE Biochimie
Mr Eric DITTMAR Biophysique
Mme Nathalie DOURMAP Pharmacologie
8
Mme Dominique DUTERTE- BOUCHER Pharmacologie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr François ESTOUR Chimie Organique
Mr Gilles GARGALA (MCU-PH) Parasitologie
Mme Nejla EL GHARBI-HAMZA Chimie analytique
Mme Marie-Laure GROULT Botanique
Mr Hervé HUE Biophysique et mathématiques
Mme Laetitia LE GOFF Parasitologie – Immunologie
Mme Hong LU Biologie
M. Jérémie MARTINET (MCU-PH) Immunologie
Mme Marine MALLETER Toxicologie
Mme Sabine MENAGER Chimie organique
Mme Tiphaine ROGEZ-FLORENT Chimie analytique
Mr Mohamed SKIBA Pharmacie galénique
Mme Malika SKIBA Pharmacie galénique
Mme Christine THARASSE Chimie thérapeutique
Mr Frédéric ZIEGLER Biochimie
PROFESSEURS ASSOCIES
Mme Cécile GUERARD-DETUNCQ Pharmacie officinale
Mr Jean-François HOUIVET Pharmacie officinale
PROFESSEUR CERTIFIE
Mme Mathilde GUERIN Anglais
ATTACHES TEMPORAIRES D’ENSEIGNEMENT ET DE RECHERCHE
Mme Anne-Sophie CHAMPY Pharmacognosie
M. Jonathan HEDOUIN Chimie Organique
9 LISTE DES RESPONSABLES DES DISCIPLINES PHARMACEUTIQUES
Mme Cécile BARBOT Chimie Générale et minérale
Mr Thierry BESSON Chimie thérapeutique
Mr Roland CAPRON Biophysique
Mme Marie-Catherine CONCE-CHEMTOB Législation et économie de la santé
Mme Elisabeth CHOSSON Botanique
Mme Isabelle DUBUS Biochimie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr Loïc FAVENNEC Parasitologie
Mr Michel GUERBET Toxicologie
Mr François ESTOUR Chimie organique
Mme Isabelle LEROUX-NICOLLET Physiologie
Mme Martine PESTEL-CARON Microbiologie
Mr Mohamed SKIBA Pharmacie galénique
Mr Rémi VARIN Pharmacie clinique
10 III – MEDECINE GENERALE
PROFESSEUR
Mr Jean-Loup HERMIL (PU-MG) UFR Médecine générale
MAITRE DE CONFERENCE
Mr Matthieu SCHUERS (MCU-MG) UFR Médecine générale
PROFESSEURS ASSOCIES A MI-TEMPS – MEDECINS GENERALISTE
Mr Emmanuel LEFEBVRE UFR Médecine Générale
Mme Elisabeth MAUVIARD UFR Médecine générale
Mr Philippe NGUYEN THANH UFR Médecine générale
Mme Marie Thérèse THUEUX UFR Médecine générale
MAITRE DE CONFERENCES ASSOCIE A MI-TEMPS – MEDECINS GENERALISTES
Mr Pascal BOULET UFR Médecine générale
Mr Emmanuel HAZARD UFR Médecine Générale
Mme Marianne LAINE UFR Médecine Générale
Mme Lucile PELLERIN UFR Médecine générale
11 ENSEIGNANTS MONO-APPARTENANTS
PROFESSEURS
Mr Serguei FETISSOV (med) Physiologie (ADEN)
Mr Paul MULDER (phar) Sciences du Médicament
Mme Su RUAN (med) Génie Informatique
MAITRES DE CONFERENCES
Mr Sahil ADRIOUCH (med) Biochimie et biologie moléculaire (Unité Inserm 905)
Mme Gaëlle BOUGEARD-DENOYELLE (med) Biochimie et biologie moléculaire (UMR 1079)
Mme Carine CLEREN (med) Neurosciences (Néovasc)
M. Sylvain FRAINEAU (med) Physiologie (Inserm U 1096)
Mme Pascaline GAILDRAT (med) Génétique moléculaire humaine (UMR 1079)
Mr Nicolas GUEROUT (med) Chirurgie Expérimentale
Mme Rachel LETELLIER (med) Physiologie
Mme Christine RONDANINO (med) Physiologie de la reproduction Mr Antoine OUVRARD-PASCAUD (med) Physiologie (Unité Inserm 1076)
Mr Frédéric PASQUET Sciences du langage, orthophonie
Mme Isabelle TOURNIER (med) Biochimie (UMR 1079)
CHEF DES SERVICES ADMINISTRATIFS : Mme Véronique DELAFONTAINE
HCN - Hôpital Charles Nicolle HB - Hôpital de BOIS GUILLAUME
CB - Centre Henri Becquerel CHS - Centre Hospitalier Spécialisé du Rouvray CRMPR - Centre Régional de Médecine Physique et de Réadaptation SJ – Saint Julien Rouen
12
Par délibération en date du 3 mars 1967, la faculté a arrêté que les opinions émises
dans les dissertations qui lui seront présentées doivent être considérées comme
propres à leurs auteurs et qu’elle n’entend leur donner aucune approbation ni
improbation.
13
Remerciements
A Monsieur le Professeur Gaëtan PREVOST,
Vous me faites l’honneur de diriger cette thèse,
Merci pour votre aide, vos conseils et votre disponibilité durant ce travail, Merci pour vos enseignements de qualité durant ces quatre années d’internat,
A Monsieur le Professeur Hervé LEFEBVRE,
Vous me faites l’honneur de présider ce jury de thèse et de juger ce travail, Merci de m’avoir communiqué votre passion de l’Endocrinologie,
Merci pour vos enseignements de qualité et votre encadrement durant ces quatre années,
A Monsieur le Professeur Guillaume GOURCEROL,
Vous me faites l’honneur de participer à ce jury de thèse, Merci d’avoir accepté de juger ce travail,
14 A Sandrine et Adeline,
Merci pour avoir grandement contribué à mon apprentissage tout au long de mon internat, Pour votre disponibilité, votre joie de vivre communicative,
Vous êtes des modèles de compétence, de gentillesse et d’humanité,
A Margaux et Lucile,
Vous avez été mes premières « chefs » et m’avez tant appris ! Merci pour votre gentillesse, votre disponibilité et votre patience,
A Justine, Anne-Françoise, Karima,
Merci pour votre aide au quotidien,
Pour votre disponibilité, votre écoute et votre bienveillance,
A Pauline,
Pour ton amitié, ta bonne humeur, ta gentillesse,
Pour tous ces bons moments passés au cours de notre cursus,
Pour m’avoir soutenue et rassurée durant ces derniers mois, et pour ces « ronchonneries » partagées,
Merci ! Je suis heureuse de poursuivre l’aventure à tes côtés,
A mes co-internes Emilie, Anne-Laure, Morgane, Renée, Valentina,
Merci d’avoir permis que ce dernier semestre se passe si bien, avec une équipe féminine au top et soudée,
Merci pour votre bonne humeur et votre complicité,
Et surtout merci de m’avoir supporté pendant ces dernières semaines !
A mes co-internes d’Endocrinologie actuels et passés : Caroline G, Caroline F, Stéphanie F, Clémence, Rominou, Henry, Antoine-Guy, Julien, Delphine, Marc-Antoine, Malanie,
Je suis heureuse de vous avoir rencontrés, J’ai également beaucoup appris à vos côtés,
Merci d’avoir fait en sorte que chaque semestre se passe si bien !
Aux autres internes que j’ai rencontrés au travers de mes semestres, Que d’agréables souvenirs pour chacun de ces stages !
A toute l’équipe du service d’Endocrinologie du CHU, médicale et para-médicale, Aux secrétaires : les Aurélies et Vanessa, les Stéphanies,
Merci pour votre accueil au début de mon internat,
Pour avoir contribué à mon apprentissage tout au long de ces années, Pour vos qualités humaines,
J’ai plaisir à venir vous retrouver et travailler à vos côtés tous les jours,
Aux équipes du service de Médecine Interne-Endocrinologie et du service de Cardiologie du CHI d’Elbeuf :
Merci pour avoir contribué à ma formation, Pour avoir passé d’agréables stages avec vous, J’aurai plaisir à vous retrouver bientôt,
15 A mes parents, à mamie Lily
MERCI,
Pour avoir été d’un soutien infaillible depuis le début de mon cursus, Pour avoir toujours été bienveillants,
Pour m’avoir permis de réaliser mes rêves, Je vous aime,
A mes cousines Anne-Laure, Claire, Marion,
Vous m’avez toujours considérée comme votre quatrième petite sœur, avec tant de bons moments partagés ! Vous avez toujours été de bons conseils et protectrices,
Merci de votre soutien,
A ma famille et ma belle-famille :
Merci de m’avoir toujours soutenue au cours de ces années d’études,
A mes amis : Elodie, Baptiste, Marion D, Thomas, Fanny, Eric
Merci pour votre soutien et votre amitié, à très vite pour une nouvelle virée tous ensemble !
A Pascaline,
Tu m’accompagnes depuis notre P2, nous avons traversé tellement de choses et nous sommes soutenues durant ce long cursus. Tu as toujours été présente lorsque j’en avais besoin même si nous n’arrivons plus à nous voir aussi souvent qu’avant. Tu es une amie précieuse. A quand notre prochaine virée shopping ?
A Romain, mon amour
Merci de partager ma vie,
Tu as toujours su m’aider, me soutenir, me rassurer chaque jour,
Enfin, merci pour ton aide précieuse, pour ta relecture assidue et pour tous tes conseils avisés,
Je t’aime,
A Martin,
Merci d’illuminer notre vie depuis 18 mois,
Pour tes sourires et tes progrès qui enchantent notre quotidien, Je t’aime mon trésor,
Merci à tous ceux que j’ai malencontreusement oubliés, car à ces heures tardives, les idées ne sont pas toujours claires…
16
Abréviations
ADO : anti-diabétiques oraux
CGMS : continuous glucose monitoring system CIC : cellules interstitielles de Cajal
CMM : complexe moteur migrant DPP-4 : dipeptidyl-peptidase 4 DT1 : diabète de type 1 DT2 : diabète de type 2 EBV : Epstein-Barr virus
GCSI : gastroparesis cardinal symptom index GIP : peptide insulinotrope dépendant du glucose GIQLI : gastrointestinal quality of life index GLP-1 : glucagon-like peptide 1
HbA1c : hémoglobine glyquée HO-1 : heme-oxygenase 1
IGF-1 : insuline-like growth factor 1 NO : monoxyde d’azote
NOSn : NO synthase neuronale
PAGI-SYM : patient assessment of upper gastrointestinal disorders - symptom severity index PAGI-QOL : patient assessment of upper gastrointestinal disorders – quality of life
SCF : stem cell factor TSS : total symptom score VGN : vidange gastrique normale VGR : vidange gastrique ralentie
VIH : virus de l’immunodéficience humaine VIP : vasoactive intestinal peptide
17
Table des matières
Remerciements
...13
Abréviations
...16
Introduction
...20
I. Physiologie de la vidange gastrique ... 21
A. Rappels anatomiques ... 21
B. Rappels histologiques ... 22
C. Motricité de l’estomac ... 23
D. Régulation des phénomènes moteurs ... 25
1. Les cellules interstitielles de Cajal ... 26
2. Le système nerveux entérique ... 27
3. Le système nerveux extrinsèque : rôle du système nerveux autonome sympathique et parasympathique... 28
4. La régulation hormonale ... 28
5. Impact de la glycémie sur la vidange gastrique ... 29
II. Gastroparésie diabétique ... 30
A. Définition et épidémiologie ... 30
B. Principales autres causes de gastroparésie ... 32
C. Retentissement ... 33
1. Impact de la vidange gastrique sur l’équilibre glycémique ... 33
2. Impact sur la qualité de vie ... 35
3. Impact sur la morbi-mortalité ... 35
4. Impact économique... 35
5. Iatrogénie ... 36
D. Physiopathologie de la gastroparésie diabétique ... 36
1. Dysfonction gastrique ... 37
2. Mécanismes extrinsèques ... 38
3. Mécanismes intrinsèques et histopathologie ... 38
18
b) Cellules de Cajal et muscle lisse ... 40
c) Macrophages et Hème-Oxygénase 1 ... 41
E. Diagnostic ... 43
1. Présentation clinique... 43
2. Etude morphologique initiale ... 45
3. Scintigraphie de vidange gastrique ... 46
4. Les tests respiratoires ... 51
5. Capsule digestive ... 53 6. IRM gastrique ... 54 7. Autres tests... 55 F. Approches thérapeutiques ... 56 1. Traitement médical ... 57 a) Mesures hygiéno-diététiques ... 57 b) Agents prokinétiques ... 58 c) Traitement anti-émétique ... 60 d) Traitement antalgique ... 61 e) Nutrition artificielle ... 62
f) Prise en charge du diabète ... 62
g) Approche psychologique ... 63
2. Nouvelles approches thérapeutiques ... 63
a) Injections intra-pyloriques de toxine botulique ... 63
b) Pyloroplastie ... 64
c) Stimulation électrique gastrique ... 64
3. Traitement chirurgical ... 66
a) Gastrectomie ... 66
b) Transplantation pancréatique ... 66
III. Objectifs de l’étude ... 66
Matériels et méthodes
...67
I. Caractéristiques de l’étude ... 68
19
A. Critères d’inclusion ... 68
B. Critères d’exclusion ... 68
III. Critère de jugement ... 69
A. Principal ... 69
B. Secondaires ... 69
IV. Déroulement de l’étude ... 69
V. Analyse statistique ... 72
Résultats
...73
I. Caractéristiques de la population ... 74
II. Critère de jugement principal ... 78
A. Comparaison des sujets diabétiques de type 1 (vidange gastrique normale versus ralentie) . 78 B. Comparaison des sujets diabétiques de type 2 (vidange gastrique normale versus ralentie) . 82 III. Critère de jugement secondaire : comparaison des sujets atteints de gastroparésie, type 1 versus type 2 ... 85
Discussion
...88
I. Recherche de facteurs favorisant le ralentissement de la vidange gastrique parmi les DT1 et les DT2 ... 89
II. Comparaison des DT1 et DT2 ayant une gastroparésie avérée ... 92
III. Forces et limites de l’étude ... 93
IV. Conclusion et perspectives ... 95
Références bibliographiques
...100
20
Introduction
21
I. Physiologie de la vidange gastrique
A. Rappels anatomiques
L’estomac est un organe creux dont la fonction est de stocker le bol alimentaire, d’amorcer sa digestion et de le délivrer progressivement en petites particules au duodénum, via le pylore.
Cet organe a une forme globale en J, divisé en deux parties distinctes au niveau de l’incisure angulaire en :
- une portion verticale représentant les deux tiers de l’estomac, le fundus, comportant la grosse tubérosité et le corps de l’estomac ;
- une portion horizontale ou antre pré-pylorique, séparée du fundus par une ligne tirée de l’incisure angulaire (figure 1) (1)
22 L’innervation de l’estomac provient de 2 systèmes : parasympathique (nerf vague) et sympathique (nerf grand sympathique), entre lesquels existent des anastomoses. Trois pédicules d’innervation se distinguent :
- le pédicule de la petite courbure, constitué des branches du nerf vague à destinée fundique, jouant un rôle sécrétoire. Quelques branches terminales à destinée antro-pylorique ont un rôle moteur sur le couple antre-pylore ;
- le pédicule duodéno-pylorique, formé de branches descendantes du plexus hépatique ; - le pédicule gastro-omental, accessoire, satellite de l’artère gastroduodénale et formé
comme le précédent de branches descendantes du plexus hépatique (1).
B. Rappels histologiques
La paroi de l’estomac est épaisse de 5 mm et comporte, de dedans en dehors : une muqueuse glandulaire plissée, une sous-muqueuse, une musculeuse et une sous-séreuse. L’ensemble est recouvert d’une séreuse (péritoine viscéral) (1).
La muqueuse gastrique comprend un épithélium de surface qui s’invagine en formant des cryptes qui communiquent avec des glandes sécrétrices. Il existe trois principaux types de muqueuse gastrique (figure 2) :
- la muqueuse cardiale au niveau du cardia sécrétant du mucus ;
- la muqueuse fundique située dans la grosse tubérosité et le corps de l’estomac, qui comporte :
o des cellules pariétales (ou bordantes) sécrétant de l’acide chlorhydrique et du facteur intrinsèque
o des cellules principales sécrétant du pepsinogène
o des cellules neuroendocrines produisant de l’histamine et de la ghréline
- la muqueuse pylorique située dans l’antre, constituée de : o cellules mucosécrétantes
23 o cellules neuroendocrines à gastrine (cellules G) stimulant la synthèse d’acide
chlorydrique au niveau fundique
o cellules neuroendocrines à sérotonine (cellules EC), à somatostatine (cellules D)
La sous-muqueuse contient des vaisseaux et des nerfs.
La musculeuse gastrique est composée de trois couches de muscle lisse (couche oblique interne, circulaire moyenne et longitudinale externe).
Enfin, la séreuse péritonéale vient recouvrir l’estomac. Le tissu conjonctif présent entre la musculeuse et la séreuse est la sous-séreuse (1).
figure 2. Structure histologique de la paroi gastrique. D’après (1).
C. Motricité de l’estomac
La principale fonction de l’estomac proximal (fundus et partie proximale du corps gastrique) est de former un réservoir pour accueillir le bol alimentaire. Il a une contenance moyenne de 500 ml à vide et peut se distendre jusqu’à 4 litres en post-prandial. L’estomac distal (partie distale du corps gastrique et antre) génère des contractions qui permettent de broyer et mélanger le bol alimentaire aux sécrétions gastriques, puis d’assurer la vidange gastrique jusqu’au duodénum (figure 3).
24 figure 3. Les différentes étapes du devenir des aliments dans l’estomac, et la cinétique de vidange
gastrique mesurée par scintigraphie (A + B : lag phase, C : vidange gastrique linéaire). D’après (1).
En période de jeûne, l’estomac proximal n’est animé d’aucune contraction phasique mais est le siège d’une contraction tonique de repos qui génère une pression intra-gastrique permanente de 6 à 7 mmHg. L’estomac distal et l’intestin grêle sont animés d’une activité motrice cyclique, le complexe moteur migrant (CMM).
Chaque cycle dure entre 90 et 120 minutes avec trois phases qui se succèdent :
- phase I : absence de contraction (ou phase de quiescence) d’une durée de 45 à 60 minutes
- phase II : contractions irrégulières d’une durée de 30 à 45 minutes
- phase III : contractions de forte intensité, d’une fréquence maximale de 3 par minute dans l’estomac, permettant l’évacuation des particules indigestibles dans l’intestin grêle. Cette dernière phase ne dure que quelques minutes et précède un nouveau cycle (1–3).
La prise d’un bol alimentaire supprime le CMM et laisse place à une activité contractile régulière. Au niveau de l’estomac proximal, la pression intra-gastrique s’abaisse en dessous de 5
25 mmHg : c’est le réflexe d’accommodation fundique, permettant l’augmentation du volume gastrique sans augmentation de la pression intra-gastrique. Ce phénomène est sous la dépendance d’une boucle réflexe vago-vagale qui active des motoneurones inhibiteurs (à monoxyde d’azote NO et/ou vasoactive intestinal peptide VIP) du système nerveux entérique. Parallèlement à cela, il y a une inhibition des circuits cholinergiques stimulateurs médiée par les récepteurs α2 adrénergiques et sérotoninergiques (5-HT1A, 5-HT3, 5-HT4). Cette accommodation permet le stockage des aliments dans l’estomac proximal (1,4).
La pression intra-gastrique va ensuite progressivement revenir à sa valeur basale jusqu’à la survenue d’une contraction fundique permettant le remplissage de l’estomac distal. Sous l’impulsion des cellules de Cajal formant un pacemaker gastrique situé au niveau de la grande courbure, des contractions circulaires de grande amplitude à une fréquence de 3 par minute, propagées du haut de l’estomac distal vers le pylore fermé, vont permettre de mélanger et broyer les aliments par rétropulsion. Cette phase de mélange est appelée « lag phase » et dépend de contractions coordonnées antro-pyloro-duodénales (sous la dépendance de motoneurones à acétylcholine).
Les aliments sont broyés pour obtenir des particules d’une taille de 1 à 3 mm, capables de franchir le pylore. Ce dernier est un sphincter pulsatile qui permet de vider progressivement l’estomac, en fonction de la pression intra-duodénale et de ses capacités d’absorption (1,4,5).
Le rythme moyen de vidange gastrique chez l’homme est de l’ordre de 1 à 4 calories par minute. La vidange gastrique est relativement rapide et constante pour les liquides, plus lente (plusieurs heures) pour les solides et les graisses nécessitant une phase initiale de broyage et de mélange plus longue (figure 3). Les glucides sont évacués plus rapidement que les protéines, qui elles-mêmes sont évacuées avant les graisses. Enfin, les éléments indigestibles tels que les fibres sont évacués en dernier, en période inter-digestive avec l’arrivée de la phase III du CMM (5).
D. Régulation des phénomènes moteurs
Différents acteurs interagissent entre eux pour réguler la motricité gastrique : les cellules de Cajal, le système nerveux entérique, les cellules musculaires lisses, le système nerveux extrinsèque et enfin les sécrétions hormonales.
26
1. Les cellules interstitielles de Cajal
L’existence des cellules interstitielles de Cajal (CIC) a été décrite pour la première fois en 1911 par Ramon y Cajal (6). Ces cellules rythmogènes sont responsables de l’automatisme du tube digestif (elles exercent une fonction de pace-maker gastrique) et de la synchronisation de cette activité motrice.
Elles sont situées entre les couches musculaires longitudinale et circulaire, à proximité des plexus myentériques et sont reliées entre elles sous forme de réseau. Au niveau gastrique, elles se regroupent pour former de véritables pacemakers locaux, dont le principal se situe dans le corps gastrique au niveau de la grande courbure. Elles se répartissent ensuite sur l’ensemble de la longueur du colon et de l’intestin grêle.
Différents sous-types de cellules de Cajal ont été identifiées :
- les CIC-MY et les CIC-IM, que l’on retrouve entre les couches musculaires longitudinale et circulaire
- les CIC-SM, situées à la surface sous-muqueuse de la couche musculaire circulaire. Ces cellules génèrent une activité électrique spontanée (ondes lentes) au rythme moyen de 3 par minute (3 à 5 dans le fundus, 1 à 2 dans l’antre et jusqu’à 12 par minute dans le duodénum). Ces dépolarisations rythmiques sont transmises aux cellules musculaires lisses via une propagation de cellule à cellule le long du tractus digestif. Ces ondes lentes ne génèrent par elles-mêmes aucune contraction musculaire mais rapprochent le potentiel membranaire du seuil de déclenchement d’un potentiel d’action. La contraction musculaire survient lorsque le seuil de dépolarisation est atteint, entraînant une salve de potentiels d’action. Les ondes lentes déterminent donc la fréquence maximale atteignable des contractions digestives tandis que le nombre de salves de potentiels d’action détermine la puissance de ces contractions (figure 4).
Ce réseau possède de multiples connexions avec les cellules musculaires lisses mais également avec le système nerveux entérique qui va réguler l’activité contractile digestive à la hausse ou à la baisse (2–4).
27 figure 4. Potentiel membranaire et déclenchement des potentiels d’action. D’après (3).
2. Le système nerveux entérique
Le système nerveux entérique (ou intrinsèque) consiste en un vaste réseau de plus de cent millions de neurones qui s’étendent sur toute la longueur du tube digestif. Il est constitué de deux plexus ganglionnaires : le plexus myentérique (ou plexus d’Auerbach) contrôlant la motricité digestive et le plexus sous-muqueux (ou plexus de Meissner) contrôlant les sécrétions digestives.
Les neurones sensitifs sont reliés à différents types de récepteurs localisés dans la paroi digestive : mécano, chémo et thermorécepteurs.
Les motoneurones peuvent exercer des actions stimulatrices (dépolarisation membranaire et survenue de potentiels d’action entrainant la contraction digestive) via l’acétylcholine, la substance P et les tachykinines ou des actions inhibitrices (hyperpolarisation membranaire entrainant la relaxation digestive) via le NO et le VIP.
Les interneurones exercent un rôle de coordination de l’activité motrice et permettent le lien entre les neurones sensitifs et les motoneurones pour former des boucles de régulation autonomes (ou réflexe entérique) qui ne font pas intervenir le système nerveux extrinsèque. Cependant, il existe
28 aussi des connexions entre les interneurones et le système nerveux extrinsèque permettant de réguler l’activité contractile (2–4,7).
3. Le système nerveux extrinsèque : rôle du système
nerveux autonome sympathique et parasympathique
Le système nerveux extrinsèque, par l’intermédiaire des systèmes sympathique et parasympathique, joue un rôle modulateur sur l’activité entérique réflexe. La modulation peut être stimulatrice (à médiation cholinergique principalement) ou inhibitrice (mettant en jeu le NO et le VIP). Très schématiquement, le système parasympathique joue essentiellement un rôle excitateur, à l’inverse du système sympathique plutôt inhibiteur sur la contractilité digestive.
Le nerf vague (ou nerf pneumogastrique), acteur majeur du système parasympathique, possède majoritairement des fibres afférentes sensitives (80%) qui relayent les informations sensitives de l’estomac jusqu’au système nerveux central. Les fibres efférentes (20%) relayent des informations motrices stimulatrices et inhibitrices. Le système nerveux sympathique relaye également des informations sensitives mais son implication motrice est moindre au niveau gastrique (4).
4. La régulation hormonale
La ghréline, principale hormone orexigène, sécrétée par l’estomac, stimule la vidange gastrique. La sérotonine a un effet inhibiteur via les récepteurs HT1 et stimulant via les récepteurs HT2 et 5-HT4.
L’histamine a un effet stimulant via les récepteurs de type H1.
Lors de l’arrivée des nutriments dans le duodénum, un rétrocontrôle négatif ralentissant la vidange gastrique se met en place, médié par différentes hormones :
- le peptide inhibiteur gastrique ou peptide insulinotrope dépendant du glucose (GIP), sécrété par les cellules K duodénales et jéjunales ;
29 - la motiline, sécrétée par les cellules endocrines duodénales, qui joue un rôle essentiel
dans l’apparition du complexe moteur migrant en période inter-digestive ; - le glucagon-like peptide-1 (GLP-1), sécrété par les cellules L iléales et coliques ; - le peptide YY, synthétisé par les cellules iléales (2,5).
5. Impact de la glycémie sur la vidange gastrique
L’hyperglycémie aiguë sévère (glycémie supérieure à 2,70 g/l) exerce un effet inhibiteur sur la vidange gastrique par réduction du tonus fundique, des contractions antrales et par renforcement du tonus pylorique (8,9). Inversement, l’hypoglycémie accélère la vidange gastrique (10). Cette relation a d’abord été démontré chez le sujet sain (11) puis au cours du diabète de type 1 (12) et de type 2 (13). Les mêmes constats ont été établis devant des hyperglycémies très modérées s’inscrivant dans les valeurs physiologiques post-prandiales (autour de 1,50 g/l) (14). Il est cependant difficile de connaître précisément l’impact de ces hyperglycémies « physiologiques » sur la vidange gastrique, tant la variabilité intra-individuelle de la vidange gastrique des solides est importante, allant jusqu’à 30% de variation d’un jour à l’autre. Cette variabilité est d’autant plus importante chez le sujet diabétique que chez le sujet sain (15).
La corrélation entre la glycémie et la vidange gastrique n’est pas aussi évidente chez le sujet diabétique de type 2. Il semblerait même qu’à l’inverse l’hyperglycémie puisse accélérer la vidange gastrique chez certains patients au début de la maladie et en dehors de toute atteinte neuropathique (16–18).
L’hyperglycémie aiguë est également responsable d’une sensibilité accrue à la distension gastrique et peut induire des dysrythmies gastriques, ces deux éléments étant responsables de symptômes dyspeptiques (6). De plus, elle entrave la réponse aux traitements prokinétiques, notamment à l’érythromycine (19).
L’équilibre glycémique sur le long terme n’a pas un impact aussi évident sur la vidange gastrique comme l’attestent plusieurs études ne montrant aucune corrélation entre le taux d’HbA1c et le temps de vidange gastrique (20,21). A l’inverse, une seule étude menée chez le diabétique de type 1 avec un suivi prolongé pendant 27 ans a pu montrer une corrélation positive entre la vidange gastrique, l’HbA1c et la survenue de complications microangiopathiques (rétinopathie et
30 néphropathie) (22). En outre, il n’est pas évident qu’améliorer l’équilibre glycémique en abaissant l’HbA1c accélère nettement la vidange gastrique mais d’autres études avec suivi prolongé sont nécessaires pour évaluer cette hypothèse (16,23,24).
II. Gastroparésie diabétique
A. Définition et épidémiologie
La gastroparésie se caractérise par un ralentissement de la vidange gastrique en l’absence de toute obstruction mécanique.
Les premières observations de rétention gastrique chez le sujet diabétique remontent à 1925, par Boas. Par la suite, Ferroir J. a mené en 1937 la première étude morphologique par l’intermédiaire de clichés radiographiques après repas marqué au Barium, montrant que les contractions gastriques étaient plus lentes, moins vives et moins propagées chez le sujet diabétique que chez le sujet sain (25,26).
C’est Kassander P. en 1958, qui évoque pour la première fois la relation entre rétention gastrique et neuropathie digestive sous l’entité de « gastroparesis diabeticorum », d’après une série de 6 patients diabétiques insulinés asymptomatiques présentant une importante rétention gastrique (après ingestion de repas marqués au Barium) semblable à celle observée chez les patients vagotomisés (27).
Traditionnellement, la survenue d’une gastroparésie est considérée comme une complication rare du diabète de type 1 évolué avec équilibre glycémique médiocre. Cependant, les dernières études sur le sujet ont établi, d’une part que la gastroparésie survenait non seulement au cours du diabète de type 1 et de type 2, d’autre part qu’il s’agissait d’une complication beaucoup plus fréquente que ce que l’on pensait, et enfin, qu’elle ne préjugeait pas toujours de l’ancienneté du diabète.
La prévalence exacte de la gastroparésie demeure inconnue car elle dépend des critères diagnostiques utilisés (critères cliniques subjectifs et/ou paracliniques objectifs) et de la population d’étude. Elle est donc difficile à estimer tant la corrélation entre la symptomatologie digestive et le temps de vidange gastrique est faible. Selon d’anciennes séries, elle était estimée entre 28 et 65% des patients présentant des symptômes digestifs évocateurs, tout type de diabète confondu
31 (7,28,29). L’atteinte prédominait chez le type 1 évolué et concernait près de 50% des patients contre 30% des type 2 (30–32), ce qui était corrélé avec la prévalence des complications microvasculaires chez ces patients (9). En revanche, l’euglycémie n’était pas toujours obtenue au cours de l’évaluation de la vidange gastrique dans ces études, et l’on sait que l’hyperglycémie impacte à la hausse le temps de vidange gastrique, ce qui a pu induire une sur-estimation de la prévalence de la gastroparésie dans ces séries.
Les données actuelles révèlent que 5 à 12% des patients diabétiques auraient un ralentissement objectif de la vidange gastrique (33).
Une étude américaine prospective effectuée sur près de 600 patients diabétiques retrouve une incidence cumulée à 10 ans de suivi de 5,2% au cours du diabète de type 1, de 1% au cours du type 2 et 0,2% dans le groupe contrôle. Les sujets diabétiques de type 1 avaient un risque relatif de développer une gastroparésie multiplié par 33 en comparaison au groupe contrôle alors que pour les sujets diabétiques de type 2 le risque était multiplié par 7,5 (31). Jung, aux Etats-Unis, a estimé la prévalence globale de la gastroparésie toutes causes confondues à 24,2/100000 personnes (9,6/100000 chez les hommes et 37,8/100000 chez les femmes) et l’incidence globale à 6,3/100000 personnes-année (2,4/100000 chez les hommes et 9,8/100000 chez les femmes). Il s’agissait d’une étude basée sur des critères scintigraphiques de vidange gastrique associés à une symptomatologie évocatrice évoluant depuis plus de 3 mois. Dans cette population, la gastroparésie diabétique représentait 25% des cas (30,34).
La prévalence exacte de la gastroparésie diabétique est difficile à estimer, il est probable qu’elle soit globalement sous-estimée car elle est souvent pauci-symptomatique (35).
Après l’étude DCCT (The Diabetes Control and Complications Trial) chez le type 1, qui a démontré la réduction des atteintes microangiopathiques de l’ordre de 40 à 60% dans le groupe de traitement intensif avec une hémoglobine glyquée atteinte à 7% contre 9% dans le groupe de traitement conventionnel, s’en est suivie l’étude prospective observationnelle EDIC (The Epidemiology of Diabetes Intensive Complications) ayant pour but d’évaluer les effets bénéfiques à long terme d’un équilibre glycémique optimal sur la survenue des complications du diabète.
Bharucha a étudié la vidange gastrique de 78 patients issus de la population de ces deux études. Il en
résulte une prévalence de la gastroparésie dans cette cohorte de 47%, la vidange gastrique était normale pour 50% des patients et accélérée dans 3% des cas. Il n’y avait pas plus de ralentissement de la vidange gastrique parmi les patients issus du groupe de traitement conventionnel (HbA1c à 9%) que dans le groupe de traitement intensif (HbA1c à 7%). (6,22).
32 Comme nous l’avons constaté précédemment, la gastroparésie touche préférentiellement les femmes avec un sex-ratio de l’ordre de 4 femmes pour 1 homme. Il a également été montré que la vidange gastrique était ralentie chez les femmes saines, comparativement aux hommes, cependant les mécanismes expliquant cette différence sont inconnus (7,36).
La gastroparésie diabétique concerne donc préférentiellement le diabète de type 1, en particulier lorsqu’il évolue depuis plus de 10 ans et volontiers compliqué au plan microvasculaire. Cependant la gastroparésie touche une proportion non négligeable de diabétiques de type 2, et ce phénomène va probablement s’accentuer. En effet, l’OMS estimait en 2013 que le diabète, majoritairement de type 2, touchait 350 millions d’individus dans le monde. En considérant une prévalence de 1%, la gastroparésie touchait donc 5 millions d’individus dans le monde en 2013 et ces chiffres vont encore s’accroitre au cours des prochaines années puisque l’OMS estime que le diabète touchera 592 millions de personnes d’ici 2035 (5,37). En France, le diabète touchait plus de 3 millions de personnes en 2015, dont plus de 30 000 susceptibles d’être atteintes de gastroparésie.
Par ailleurs, les incrétino-mimétiques apparus ces dernières années et de plus en plus largement utilisés dans la prise en charge du diabète de type 2, sont connus pour retentir sur la vidange gastrique et peuvent très probablement contribuer à aggraver une gastroparésie sous-jacente (34).
B. Principales autres causes de gastroparésie
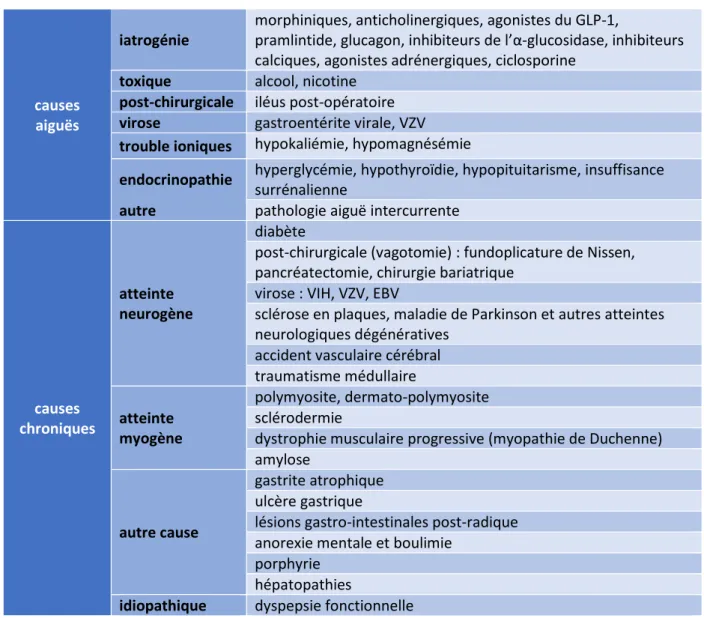
Les différentes causes de gastroparésies sont listées dans le tableau 1 (32,33).
Différentes études ont pu montrer que le diabète était l’une des causes les plus fréquentes de gastroparésie (30% des cas en moyenne selon les séries), les autres principales causes étant post-chirurgicales et iatrogènes. Enfin, dans environ 30% des cas, aucune cause n’est mise en évidence et la gastroparésie est dite idiopathique (32,33,38,39).
33
causes aiguës
iatrogénie
morphiniques, anticholinergiques, agonistes du GLP-1,
pramlintide, glucagon, inhibiteurs de l’α-glucosidase, inhibiteurs calciques, agonistes adrénergiques, ciclosporine
toxique alcool, nicotine post-chirurgicale iléus post-opératoire virose gastroentérite virale, VZV trouble ioniques hypokaliémie, hypomagnésémie
endocrinopathie hyperglycémie, hypothyroïdie, hypopituitarisme, insuffisance surrénalienne
autre pathologie aiguë intercurrente
causes chroniques
atteinte neurogène
diabète
post-chirurgicale (vagotomie) : fundoplicature de Nissen, pancréatectomie, chirurgie bariatrique
virose : VIH, VZV, EBV
sclérose en plaques, maladie de Parkinson et autres atteintes neurologiques dégénératives
accident vasculaire cérébral traumatisme médullaire atteinte
myogène
polymyosite, dermato-polymyosite sclérodermie
dystrophie musculaire progressive (myopathie de Duchenne) amylose
autre cause
gastrite atrophique ulcère gastrique
lésions gastro-intestinales post-radique anorexie mentale et boulimie
porphyrie hépatopathies
idiopathique dyspepsie fonctionnelle
tableau 1. Etiologies de la gastroparésie.
C. Retentissement
1.
Impact de la vidange gastrique sur l’équilibre glycémique
Il existe une relation bi-directionnelle entre l’équilibre glycémique et la vidange gastrique. Comme nous l’avons vu précédemment, la glycémie impacte le temps de vidange gastrique. A l’inverse, la vitesse d’arrivée des nutriments dans l’intestin détermine grandement la réponse glycémique post-prandiale.
34 Le temps de vidange gastrique impacte à hauteur de 30% la variance des glycémies post-prandiales (6,40). Aussi, lorsque la vidange gastrique est ralentie, la glycémie post-prandiale s’élève peu et le risque est à l’hypoglycémie chez les sujets insulinés car le pic d’action de l’insuline va précéder l’absorption des glucides. Cela peut aboutir à une grande instabilité glycémique avec une tendance à l’hyperglycémie chronique entrecoupée d’épisodes d’hypoglycémies post-prandiales, pouvant être sévères (32). Lorsque la vidange gastrique est accélérée, cela peut conduire à des hyperglycémies post-prandiales. C’est le constat qui a été établi chez certains diabétiques de type 2 dans les toutes premières années de la maladie. La vidange gastrique a donc été identifiée comme cible thérapeutique pour améliorer l’équilibre glycémique post-prandial de ces patients (24).
Au cours de la dernière décennie, une nouvelle classe thérapeutique est apparue dans la stratégie de traitement du diabète de type 2 : les incrétino-mimétiques comprenant les analogues du GLP-1 (exenatide, liraglutide, lixisenatide) et les inhibiteurs de la dipeptidyl-peptidase 4 (DPP-4) (sitagliptine, vildagliptine, saxagliptine), l’enzyme dégradant le GLP-1 (9).
Le GLP-1 et le GIP sont responsables de « l’effet incrétine » : la stimulation accrue de la sécrétion insulinique en réponse à une charge orale en glucose comparativement à une charge intra-veineuse identique. Ce sont deux déterminants majeurs à l’origine de 50 à 70% de la sécrétion insulinique post-prandiale (41). Cet effet est particulièrement réduit au cours du diabète de type 2 (9). Par ailleurs, la demi-vie plasmatique du GLP-1 endogène est extrêmement courte puisqu’il est dégradé par la DPP-4, ubiquitaire, en moins de 2 minutes.
Les analogues du GLP-1, résistants à la DPP-4 endogène, exercent un important effet ralentisseur sur la vidange gastrique, ce qui n’est pas le cas des inhibiteurs de la DPP-4 ni du GIP endogène (39,42). Cet effet est particulièrement bénéfique chez les patients dont la vidange gastrique est rapide, permettant ainsi d’améliorer l’équilibre glycémique post-prandial (6). Ces molécules possèdent d’autres effets bénéfiques : effet central anorexigène et inhibition de la sécrétion de glucagon.
35
2. Impact sur la qualité de vie
La gastroparésie retentit sur la qualité de vie, d’autant plus lorsque les symptômes dyspeptiques sont quotidiens. Plusieurs études ont pu mettre en évidence des scores de qualité de vie significativement plus faibles au cours de la gastroparésie diabétique comparativement aux autres causes de gastroparésie et aux sujets sains (43–45).
3. Impact sur la morbi-mortalité
Bien que la gastroparésie diabétique soit associée à une morbidité accrue par l’instabilité glycémique, par les complications nutritionnelles et hydro-électrolytiques qu’elle peut provoquer, il ne semble pas y avoir de sur-mortalité liée à la gastroparésie en elle-même, sauf peut-être lorsqu’elle est sévère et réfractaire (46,47). L’augmentation de la mortalité qui a pu être décrite par certaines études n’est probablement pas due à la gastroparésie en elle-même mais aux atteintes cardiovasculaires et rénales qui co-existent avec la gastroparésie (7,30,46,48).
4. Impact économique
La gastroparésie diabétique constitue un problème actuel et futur de santé publique via le nombre accru d’hospitalisations et de thérapeutiques qu’elle engendre. En effet, le nombre de séjours hospitaliers impliquant la gastroparésie diabétique a beaucoup augmenté au cours des dernières années (158% d’augmentation entre 1995 et 2004 aux Etats-Unis) aboutissant à plus de 10000 hospitalisations annuelles aux Etats-Unis à partir de 2004 (49). Ce phénomène est en partie expliqué par un meilleur diagnostic de la gastroparésie, mais également par l’allongement de l’espérance de vie des patients diabétiques et par l’incidence accrue du diabète et de ses complications. L’amélioration des techniques de prise en charge du diabète a nettement contribué à diminuer la mortalité cardio-vasculaire ce qui expose davantage les patients aux complications microangiopathiques liées à l’ancienneté du diabète. Enfin, l’arrivée de l’électrostimulation gastrique au début des années 2000 a très possiblement contribué à cette augmentation du nombre d’hospitalisations, nécessaires pour la mise en place du dispositif, le suivi et la prise en charge
36 d’éventuelles complications infectieuses (34). Les hospitalisations sont volontiers répétées et la durée de séjour est plus longue pour le motif de la gastroparésie comparativement aux autres atteintes digestives liées au diabète (48). D’après une série rétrospective, les facteurs conduisant à l’hospitalisation devant une exacerbation de la gastroparésie étaient le déséquilibre glycémique et les causes infectieuses (50).
Cela induit en conséquence des coûts de santé qui vont continuer de s’accroître au cours des prochaines années (49).
Abell T. a estimé que le coût moyen de prise en charge des cas de gastroparésie sévère
s’élevait aux alentours de 7000 dollars mensuels par patient. Le séjour hospitalier et le support nutritionnel parentéral représentaient les principaux pôles de dépense (51).
5. Iatrogénie
La vidange gastrique impacte fortement l’absorption digestive des agents pharmacologiques pris par voie orale. Chez les patients présentant un ralentissement sévère de la vidange gastrique, l’absorption médicamenteuse pourra être très retardée et impacter les taux sériques qui seront fluctuants, particulièrement pour les molécules à courte demi-vie (32).
D. Physiopathologie de la gastroparésie diabétique
La physiopathologie de la gastroparésie diabétique est complexe et incomplètement comprise. Elle semble être le résultat d’atteintes mixtes du système nerveux autonome extrinsèque, du système nerveux entérique et de remaniements histologiques impliquant les cellules de Cajal et les cellules musculaires lisses.
37
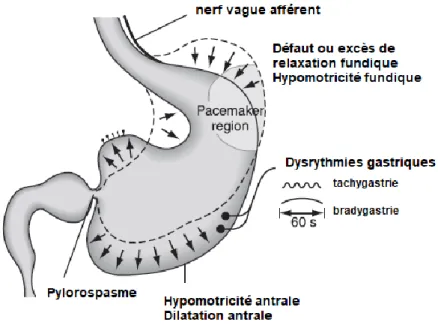
1. Dysfonction gastrique
La dysfonction gastrique observée au cours de la gastroparésie diabétique met en jeu plusieurs anomalies motrices (figure 5) :
- un défaut d’accommodation fundique lors de l’arrivée du bol alimentaire, occasionnant un défaut de compliance gastrique ou à l’inverse une relaxation fundique excessive. S’y associe une hypomotricité fundique entravant la vidange du fundus ;
- une désorganisation de l’activité électrique causant une hypomotricité antrale et la perte de la synchronisation des contractions antro-pyloro-duodénales conduisant à l’accumulation des aliments au niveau de l’antre gastrique ;
- une contraction excessive du pylore (pylorospasme) qui constitue un véritable obstacle à la vidange gastrique des aliments.
L’ensemble de ces phénomène aboutit à une stase alimentaire gastrique (5,26,33,35).
38
2. Mécanismes extrinsèques
L’atteinte du système nerveux autonome, plus précisément du nerf vague, a été le premier mécanisme incriminé dans la genèse de la gastroparésie d’origine diabétique (7). Chez les patients diabétiques, la mise en évidence d’altérations neuronales sur des biopsies gastriques suggère la présence de cette neuropathie (9,52,53).
La dysfonction du nerf vague a été observée au cours d’une étude analysant la sécrétion de polypeptide pancréatique et de ghréline, médiée par le nerf vague, en réponse à la prise d’un repas fictif. Les sécrétions de ces peptides étaient nettement diminuées chez les patients atteints de gastroparésie diabétique comparativement aux sujets contrôles et aux patients dont la gastroparésie était idiopathique. La réponse était similaire dans le groupe de patients ayant subi une vagotomie dans le cadre d’une chirurgie, suggérant donc une atteinte du nerf vague chez les patients diabétiques comme facteur impliqué dans la gastroparésie (54).
Des anomalies structurelles du nerf vague (dégénérescence des fibres sensitives et motrices, démyélinisation) ont également été décrite (9,34).
La neuropathie autonome au cours du diabète touche à la fois le système parasympathique mais également le système sympathique. Cette atteinte neuropathique, est partiellement réversible après restauration de l’équilibre glycémique et de la fonction rénale après double transplantation rein-pancréas. La vidange gastrique se trouve également améliorée (34,55).
Au cours du diabète, la présence d’une neuropathie périphérique constitue un facteur de risque de développer une gastroparésie (34,56).
3. Mécanismes intrinsèques et histopathologie
Plusieurs anomalies histologiques dans le cadre de la gastroparésie diabétique ont été mise en évidence. Dans une large cohorte prospective américaine de patients atteints de gastroparésie, 83% d’entre eux présentaient des anomalies histologiques après analyse de biopsies gastriques (53).
39
a) NO et NO Synthase neuronale
La digestion normale implique une homéostasie entre les neurotransmetteurs stimulants (acétylcholine et substance P) et inhibiteurs (NO et VIP).
Le système nerveux entérique consiste en une multitude de neurones distribués le long du tractus digestif, exprimant la NO synthase neuronale (NOSn) synthétisant le NO, dont la plus forte concentration se situe au niveau pylorique. Le NO exerce divers effets dont certains s’opposent entre eux : il intervient dans la phase d’accommodation gastrique (phase de distension fundique lors de l’arrivée du bol alimentaire) mais également dans la phase de vidange et plus particulièrement au niveau pylorique en permettant la relaxation du pylore. En revanche, le NO diminue le nombre et l’amplitude des contractions gastriques ce qui peut contribuer à allonger le temps de vidange gastrique (57).
Chez l’animal, une étude a montré que les sujets déficients pour la NOSn présentaient une stase gastrique importante avec la présence de bézoards. La vidange gastrique des solides et des liquides était ralentie par rapport aux sujets contrôles (58).
Chez l’homme, il a été montré dans la gastroparésie diabétique que le NO et la NOSn étaient diminués, ce qui se traduit par un défaut d’accommodation fundique lors de la prise alimentaire (diminution de la capacité gastrique) et par l’augmentation du tonus pylorique entravant la vidange gastrique (57,59). Ce défaut d’expression semble être partiellement dû à une apoptose des neurones entériques (5,6).
Le NO a donc été une cible potentielle pour l’élaboration de thérapeutiques permettant de restaurer ses fonctions sur la vidange gastrique. La régulation de la NOSn est complexe et fait intervenir de nombreux facteurs tels que la glycémie, l’insuline et l’insulin-like growth factor 1 (IGF-1) (7,34). Il a d’ailleurs été démontré, dans un modèle animal, que l’administration d’insuline permettait de restaurer l’expression de la NOSn et de normaliser la vidange gastrique (59). Dans ce même modèle, l’administration d’un inhibiteur de la phosphodiesterase (enzyme inhibant le NO), le sildenafil, corrige les altérations de la vidange gastrique en diminuant les spasmes pyloriques. Bien que ces effets intéressants aient été mis en évidence chez l’animal ; chez l’homme, les résultats sont discordants et l’augmentation de la concentration en NO n’améliore pas toujours la vidange gastrique ni les symptômes post-prandiaux liés à la gastroparésie (60) voire même ralentit davantage la vidange gastrique (61). Ces effets discordants peuvent être expliqués par les effets opposés
40 générés par le NO sur la vidange gastrique : la distension fundique induite vient contre-balancer les effets positifs de la relaxation pylorique en entraînant une stase alimentaire fundique (60).
La perte d’expression de la NOSn chez les patients diabétiques résulterait d’un rétro-contrôle négatif des produits terminaux de glycation qui, par l’intermédiaire d’un récepteur spécifique, peuvent interagir avec le système nerveux entérique (62). Par ailleurs, cette perte d’expression interviendrait rapidement après l’installation du diabète (63).
Bien que la perte d’expression de la NOSn soit associée au ralentissement de la vidange gastrique, elle n’explique pas à elle seule le développement de la gastroparésie diabétique et agirait plutôt comme un cofacteur dans la genèse de la gastroparésie diabétique.
b) Cellules de Cajal et muscle lisse
La raréfaction des CIC représente le deuxième élément déterminant dans la genèse de la gastroparésie diabétique. Ce mécanisme a été décrit dans plusieurs études, essentiellement chez l’animal, dans des modèles diabétiques de type 1 et de type 2 (63–66). Cette perte de cellules concerne essentiellement les sous-types MY et IM au niveau antral ce qui altère la propagation des ondes lentes générées au niveau fundique. On n’observe pas de perte cellulaire au niveau fundique. En revanche, il existe des anomalies structurales du réseau de cellules à ce niveau (perte de communication) à l’origine de dysrythmies gastriques (64,65,67).
Ce mécanisme a également été décrit chez l’homme : dans une série de 36 patients diabétiques de type 2, la densité de CIC était significativement plus faible comparativement au groupe contrôle. Parallèlement, l’expression de NOSn et de substance P était également altérée (68). Le registre américain du Gastroparesis Clinical Research Consortium (étude prospective américaine sur la gastroparésie débutée en 2006), a permis de montrer que 50% des patients diabétiques (type 1 et 2 confondus) dans cette cohorte avaient une nette raréfaction des CIC sur des biopsies gastriques et que la vidange gastrique était significativement allongée dans ce sous-groupe de patients. Cette raréfaction des CIC est d’autant plus marquée que le ralentissement de la vidange gastrique est important chez les patients diabétiques (7,53). A l’inverse, dans le sous-groupe de gastroparésie idiopathique, la perte des CIC n’était pas corrélée au temps de vidange gastrique (53).
Cette atteinte est associée au développement d’une dysrythmie gastrique à type de tachygastrie (fréquence d’ondes lentes supérieure à 3,5 par minute) en période prandiale et
inter-41 digestive. Les patients diabétiques présentant ce type d’anomalie sont susceptibles d’avoir une symptomatologie digestive plus marquée (67). La restauration du rythme de dépolarisation par l’adjonction de domperidone améliore les symptômes digestifs appuyant ce lien entre la dysrythmie et la symptomatologie digestive (5).
Le maintien des CIC résulte d’un équilibre entre les mécanismes protecteurs et destructeurs. L’insuline, l’IGF-1 et le Stem Cell Factor (SCF, facteur de croissance de cellules souches) ont été identifiés comme facteurs protecteurs des CIC. Le SCF est exprimé par les cellules musculaires lisses. Le diabète entraine l’apparition d’une fibrose et d’une atrophie des cellules musculaires lisses médiée par l’état d’insulinopénie et la carence en IGF-1, réduisant la sécrétion de SCF. Ceci contribue à la perte des CIC qui n’est donc pas directement liée à l’hyperglycémie (66).
Une raréfaction des fibres nerveuses du plexus myentérique, corrélée à la perte des CIC a également été décrite dans la littérature. Selon les séries, elle touche en moyenne un tiers des patients ayant une gastroparésie (diabétique et idiopathique) (26,32,53).
c) Macrophages et Hème-Oxygénase 1
Le diabète constitue un état de stress oxydatif néfaste pour les CIC. L’Hème Oxygénase 1 (HO 1) est une enzyme anti-oxydante activée dans les macrophages M2 CD206+ cytoprotecteurs, normalement surexprimés chez les sujets diabétiques (69). Chez l’animal diabétique de type 1, l’inactivation d’HO 1 est corrélée à la perte des CIC et à l’allongement de la vidange gastrique. Ces effets sont totalement réversibles après restauration de l’activité d’HO 1 par adjonction d’hémine (63) ou de monoxyde de carbone (9).
Une autre étude réalisée sur un modèle animal de diabète de type 2 a montré la perte sélective de la sous-population de macrophages M2 CD206+ chez les sujets présentant un ralentissement de la vidange gastrique. Parallèlement, était observée une surexpression des macrophages M1 pro-inflammatoire n’exprimant pas HO 1 (69).
Le même constat est fait au cours de la gastroparésie diabétique chez l’homme avec une corrélation existant entre la disparition des macrophages M2 CD206+ et le nombre de CIC, à la différence de la gastroparésie idiopathique (70).
42 La présence d’un infiltrat de cellules immuno-compétentes CD45+ a également été décrite dans la gastroparésie diabétique et idiopathique (53).
L’expression de l’hème oxygénase 1 dans la sous-population de macrophages M2 semble être un facteur anti-oxydant nécessaire à la survie des cellules interstitielles de Cajal, et a donc un rôle protecteur contre le développement de la gastroparésie diabétique.
La survenue d’une gastroparésie dans le cadre du diabète peut donc être le résultat d’une atteinte de la commande nerveuse gastrique, d’un dysfonctionnement neuro-musculaire, d’une atteinte du système immunitaire ou de l’ensemble de ces mécanismes intriqués (figure 6).