T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier Discipline ou spécialité : Radiophysique et Imagerie Médicales
JURY
Mr Manuel BARDIES, Chargé de recherche INSERM, Nantes, Rapporteur
Mme Isabelle BERRY, Professeur, Université Paul Sabatier, Toulouse, Examinateur
Mme Marie-Claude BORDAGE, Chargée de Recherche CNRS, Toulouse, Directrice de thèse Mr Frédéric COURBON, Maître de Conférences, Université Paul Sabatier, Toulouse, Co-directeur Mr Libor MAKOVICKA, Professeur, Université de Franche-Comté, Besançon, Rapporteur
Mr Jean-Philippe VUILLEZ, Professeur, Université Joseph Fourier, Grenoble, Examinateur
Ecole doctorale : GEET Unité de recherche : LAPLACE
Directeur(s) de Thèse : M-C. Bordage, F. Courbon
Présentée et soutenue par
Karina MEYNARD
Le 29 JUIN 2009
Titre :
POLYMERISATION RADIO-INDUITE: CALCUL DE DOSE ET
MODELISATION DANS LE CAS D'IRRADIATIONS PROLONGEES DE
SOURCES NON-SCELLEES
Voici venu le temps des remerciements ! De nombreuses personnes ont contribué de près ou de loin à l’aboutissement de ce travail et bien sûr, je ne voudrais oublier personne…Alors, que ceux que j’ai omis de citer veulent bien me pardonner d’ avance.
Ce travail de thèse s’inscrit dans la continuité d’un projet de recherche initié courant 2005, dans le cadre de mon DEA, encadrée à l’époque par Mr Frédéric COURBON. Pour cette raison, c’est à lui que j’adresserai mes premiers remerciements. En effet, sans son insistance et son engouement pour ce projet, je n’aurais peut être jamais vécu cette belle expérience. Je manifeste donc toute ma gratitude à Mr Frédéric COURBON, mon co-directeur de thèse, pour la confiance qu’il a su m’accorder et l’implication dont il a su faire preuve malgré ses lourdes responsabilités. Je tiens à exprimer ma profonde reconnaissance à ma directrice de thèse, Marie-Claude BORDAGE, chargée de recherche au CNRS, qui a su me conseiller, m’encourager et me soutenir pendant ce long voyage. Je lui suis très reconnaissante pour son professionnalisme, son écoute et sa disponibilité qui m’ont permis de mener à bien ce projet. Qu’elle soit convaincue de toute l’amitié que j’ai à son égard.
Je remercie respectueusement tous les membres de mon jury, d’avoir accepté de juger ce travail. Merci à Mme Isabelle BERRY, Professeur à l’Université Paul Sabatier de Toulouse, pour m’avoir honorée de sa présence en tant que Présidente de Jury. Un grand merci à mes deux rapporteurs, Mr Manuel Bardiès, Chargé de recherche à l’unité INSERM de Nantes, et à Mr MAKOVICKA, Professeur à l’Université de Franche-Compté, pour l’intérêt qu’ils ont porté à mon travail. J’adresse également mes sincères remerciements à Mr Jean-Philippe VUILLEZ, Professeur de l’Université Joseph Fourier pour sa participation en tant qu’examinateur.
Durant ces années, j’ai eu la chance de pouvoir travailler avec Mr Michel TERRISSOL, Professeur de l’Université Paul Sabatier. J’ai pu bénéficier de ses conseils et de sa grande expérience sur la simulation par méthode Monte Carlo. Je lui suis sincèrement reconnaissante.
Je remercie le Conseil Régional de la Guadeloupe pour son soutien financier, ainsi que le groupe de recherche PRHE, dont j’ai fait partie.
Ces années de thèse n’auraient évidemment pas été si enjouées sans les belles rencontres que j’ai pu faire au sein du labo : Soraya, Aude, Peyo, Vassant, Myriam, Cathy, Albert, Lucile, Maxime, sans oublier mes collègues de bureau, les « deux Juliens », ainsi que tous les doctorants du batiment 3R2, au CHU de Rangueil : Christine et Marie-Christine, et à l’Institut Claudius Regaud : Julia, Olivier, Anne et les manips de l’IRM. Je les remercie tous pour leur sympathie, leur bonne humeur et leur disponibilité constante.
Je poursuivrai ces remerciements avec tous mes amis de la chorale « les voix du cœur » qui m’ont supportée (et que j’ai supporté !) en dehors de mes heures de travail. Merci pour ces heures volées et ces fous rires inoubliables.
Mes derniers remerciements (et pas des plus moindres !) sont destinés à ma famille sans qui je n’aurais pu faire ce long chemin. C’est à eux que je dédie ce travail. Merci maman pour ces longues heures d’écoute quasi-quotidiennes, où tu as su te montrer indulgente devant mes états d’âme passagers. « Woulo ! Jodi jou, nou rivé bod’ lanmè la, pa davraw fos é limiè Bondyé !» …
ABREVIATIONS & SYMBOLES
ADN Acide DésoxyriboNucléique
AMM Autorisation de Mise sur le Marché
CCD Charge Coupled Device
CT Computerized Tomography
CSDA Continuous Slowing Down Approximation
DPK Dose Point Kernel
IRM Imagerie par Résonance Magnétique
MC Monte Carlo
RIV Radiothérapie Interne Vectorisée
RMN Résonance Magnétique Nucléaire
SDPK Scaled Dose Point Kernel
SPECT Single Photon Emission Computed Tomography
TEL Transfert d’Energie Linéique
TEP Tomographie par Emission de Positons TPS Treatment Planification System
VIP Visible Photographic
CERN Centre Européen pour la Recherche Nucléaire EANM European Association of Nuclear Medicine
EURATOM Directive européenne
LNHB Laboratoire National Henri Becquerel
NIST National Institute of Standards and Technology MIRD Medical Internal Radiation Dose
ICRU International Commission on Radiation Units and Measurements BANANA Bis Acrylamide Nitrous oxide ANd Agarose
BANG Bis Acrylamide Nitrogen and Gelatine
MAGAS Methacrylic Acid Gelatin gel with AScorbic acid
MAGAT MethacrylicAcid Gelatin And Tetrakis (hydroxymethyl) phosphonium chloride MAGIC Methacrylic and Ascorbic Acid in Gelatin Initiated by Copper
PAG Poly Acrylamide Gel
PAGAT Polyacrylamide And Gelatin And Tetrakis THPC Tetrakis Hydroxyméthyl de phosphore
EGS Electron Gamma Shower
ETRAN Electron TRANsport
GEANT GEometry ANd Tracking
ITS Integrated Tiger Series
MCNP Monte-Carlo N-Particle transport
MOCA MOnte CArlo Simulator code
OREC Oak Ridge Electron transport Code
PENELOPE PENetration and Energy LOss of Positrons and Electrons PRESTA Parameter Reduced Electron STep Algorithm
131 I Iode 131 32 P Phosphore 32 90 Y Yttrium 90 60 Co Cobalt 60
Fe3+ Ions ferriques Fe2+ Ions ferreux HCl Acide chlorhydrique H2O Molécule d’eau H2O •+
Molécule d’eau ionisée H2O* Molécule d’eau excitée
H+ Ion hydrogène H• Radical hydrogène H3O + Ion hydronium H2 Molécule de hydrogène HO• Radical hydroxyde HO2 • Radical hydroperoxyl
H2O2 Molécule de peroxyde d’hydrogène
NaCl Chlorure de sodium
OH+ Molécule
OH- Anion hydroxyle
OH• Radical hydroxyde
R• Radical primaire
R2 Radicaux recombinés
RM• Chaîne radicalaire primaire RMn•, RMM
•
Chaînes radicalaires en croissance RMn+1
,
RMm •
Chaînes radicalaires en croissance Pn+m, Pn, Pm Polymères terminés
G(X) Rendement radiolytique
[ ]
AA
φ Taux de production des radicaux libres R• [R•] Concentration de radicaux libres
[M] Concentration de monomères
[RM•] Concentration de chaînes radicalaires oo
k Constante de la vitesse de recombinaison po
k Constante de la vitesse d’addition
p
k Constante de la vitesse de polymérisation to
k Constante de la vitesse de terminaison par rencontre avec un radical primaire t
k Constante de la vitesse de terminaison
n
P Degré de polymérisation
i
R Vitesse d’amorçage
rec
R Vitesse de recombinaison des radicaux libres add
R Vitesse d’addition sur le monomère
p
R Vitesse de polymérisation
t
R Vitesse de terminaison
tr
R Vitesse de terminaison par rencontre avec un radical primaire
μr Moment magnétique élémentaire
o
Br Champ magnétique principal
0
B Intensité du champ magnétique principal
Mr Moment macroscopique
Z
XY
M Composante transversale du moment macroscopique M
0
υ Fréquence de Larmor
γ Constante gyromagnétique
Θ Angle entre moment macroscopique Mr et axe du champ Bro
1
T Temps de relaxation « spin réseau »
2
T Temps de relaxation « spin »
* 2
T Temps de relaxation « spin » apparent
1
R Taux de relaxation (ou vitesse de relaxation) longitudinal
2
R Taux de relaxation (ou vitesse de relaxation) transversal
TE Temps d’échos
TR Temps de répétition
gel
OD Densité optique du gel non irradié I
gel
OD Densité optique du gel irradié
) (OD
Δ Variation de densité optique
) ( gel
T
I Intensité de lumière transmise par un gel non irradié
) (gelI T
I Intensité de lumière transmise par un gel irradié
I0 Intensité initiale CT N Nombre d’Hounsfield β Particule bêta γ Rayonnement gamma e- Electron e+ Positon e-th Electron thermalisé e-aq Electron aqueux
ε Energie moyenne du radionucléide
RX Rayons X
E Energie du photon incident
E0 Energie de liaison atomique
Ea Energie avec laquelle un électron est éjecté de l’atome par diffusion Compton
ρ Densité d’un milieu
e ρ Densité électronique A Ν Nombre d’Avogadro Z Numéro atomique a
Z Numéro atomique de l’élément a
eff
Z Numéro atomique effectif d’un milieu
a
A Masse molaire de l’atome a
a
w Fraction massique de l’atome a
a
W Somme des fractions massiques wa pondérées par pm
pm Pourcentage massique de la molécule m a
M Masse d’un atome a de la molécule
T
M Masse de la molécule
μ , μen Coefficients d’atténuation et d’absorption linéiques
( )
ES Pouvoir d’arrêt total pour l’énergie E
col
S Pouvoir d’arrêt par collision
tot
S Pouvoir d’arrêt total
rad
S Pouvoir d’arrêt par radiation
ρ
/
tot
S Pouvoir d’arrêt massique total
ρ
/
col
S Pouvoir d’arrêt massique par collision
ρ
/
rad
S Pouvoir d’arrêt massique par radiation
T Pouvoir de diffusion
ρ
/
T Pouvoir de diffusion massique
ρ
μ/ Coefficient d’attenuation massique
ρ
μen/ Coefficient d’absorption massique
gel milieu milieu
gel X
X
X = Rapport de grandeurs X d’un milieu par rapport au gel (X : densité, densité électronique, numéro atomique effectif, coefficient d’attenuation, pouvoir d’arrêt, pouvoir de diffusion,
facteur S)
dr Épaisseur d’une tranche de milieu
0
r Parcours moyen des électrons selon l’approximation du CSDA 0
/ r
r Distance normalisée par rapport à 0r
90
X Rayon de la sphère où 90% de l’énergie émise est absorbée
90 / X
r Distance normalisée par rapport à X90
n
ρ Nombre d’atomes par unité de volume
D Dose absorbée moyenne
( )
rd Dose absorbée moyenne à une distance r
) (r
F Fraction absorbée spécifique dans une tranche de milieu d’épaisseur dr
) / (r x
F Fraction absorbée spécifique F(r) normalisée (x=r0ou X90)
0
A Activité initiale
s
A~ Activité cumulée
( )
tAs Activité en fonction du temps phys
λ Constante radioactive physique
eff
λ Constante radioactive effective
i
ε Énergie moyenne émise par transition nucléaire i
n Nombre de particules
i Type de particule
E Energie absorbée
0
E Énergie émise par le volume source rs c
m La masse d’un volume cible
m
p Pourcentage massique de la molécule m
s r Volume source c r Volume cible ) ( c s i r ←r
φ Fraction absorbée dans le volume cible
(
c s)
i r ←r
Φ Fraction absorbée massique
(
r r)
i ←
( )
rΦ Fraction absorbée massique à une distance r
) (rc rs
S ← Facteur S
eff
T Période effective radioactive phys
T Période physique radioactive
biol
T Période biologique radioactive
) (e
-EABS Energie d’absorption des électrons
) (hν
EABS Energie d’absorption des photons
) (e+
EABS Energie d’absorption des positons
W Perte d’énergie
C
W Perte d’énergie seuil
CC
W Perte d’énergie seuil pour collision inélastique forte CR
W Perte d’énergie seuil pour émission Bremsstrahlung forte
C1 Déflexion angulaire moyenne
C2 Fraction maximale d’énergie perdue entre 2 collisions fortes
dmax Distance maximale permise entre deux collisions fortes
θ Angle de déflexion
c
θ Valeur seuil de l’angle de déflexion
λ Libre parcours moyen
) (h
T
λ Libre parcours moyen entre 2 collisions catastrophiques
) (h el
λ Libre parcours moyen entre 2 évènements catastrophiques élastiques
1 ,
el
λ Libre parcours moyen d’ordre 1 pour les collisions élastiques
) (h
in
λ Libre parcours moyen entre 2 évènements catastrophiques inélastiques
) (h br
λ Libre parcours moyen entre 2 émissions Bremsstrahlung catastrophiques
) (h
an
λ Libre parcours moyen entre 2 annihilations catastrophiques
Ω
d dσel
Section efficace différentielle de collision élastique
Ω
d Angle solide
a i,
σ Section efficace relative à l’effet ipour l’espece atomique a
i
σ Section efficace résultante relative à l’effet ipour un ensemble d’atomes
) (h i
σ Section efficace des évènements catastrophiques de type i
) (h
T
σ Section efficace totale des interactions catastrophiques
a
x Nombre d’espèces a présentes dans le milieu
s Distance entre 2 interactions catastrophiques
τ Distance échantillonnée s E Δ Perte d’énergie K , ,ξ1 ξ Nombres aléatoires i
p Probabilité pour que l’interaction iait lieu
ECUT Perte d’énergie seuil pour collision inélastique forte AE Energie d’absorption des électrons
(r, θ, ϕ) Coordonnées sphériques (z, r, ϕ) Coordonnées cylindriques
2D 2 dimensions
TABLE DES MATIERES
I
NTRODUCTION... -
1
-C
HAPITREI
:
L
A DOSIMETRIE PAR GELS EN RADIOTHERAPIE INTERNE VECTORISEE:
G
ENERALITES ET PROBLEMATIQUE... -
5
-I.1
La radiothérapie interne vectorisée ... 7
-I.1.1 Principe et applications ... 7
-I.1.2 Quantification de la dose absorbée ... 9
-I.1.2.1 Le formalisme recommandé ... - 10 -
I.1.2.2 Les fantômes anthropomorphiques ... - 13 -
I.1.2.3 Analyse quantitative par scintigraphie ... - 15 -
I.1.2.4 Pratiques dosimétriques et limitations... - 15 -
I.1.2.5 Apport des gels radiosensibles ... - 16 -
I.2
Principes généraux de la dosimétrie par gels ... 19
-I.2.1 Les gels de Fricke ... 20
-I.2.2 Les gels de polymères ... 20
-I.2.2.1 La polymérisation radio-induite ... - 21 -
I.2.2.2 Les gels normoxiques MAGIC... - 31 -
I.2.3 Révélation de la dose absorbée par imagerie ... 32
-I.2.3.1 L’Imagerie par Résonance Magnétique ... - 33 -
I.2.3.2 La tomographie optique... - 36 -
I.2.3.3 La tomographie par rayons X ... - 36 -
I.2.3.4 Les autres méthodes ... - 38 -
I.2.4 Etalonnage... 38
-I.3
Problématique ... 40
-C
HAPITREII
:
S
IMULATION PAR LA METHODE DEM
ONTEC
ARLO... -
43
-II.1
La méthode de Monte Carlo ... 46
-II.1.1 Principe ... 46
-II.1.2 Estimation des incertitudes statistiques ... 47
-II.2
Transport des particules... 48
-II.2.1 Interactions des photons et des électrons avec la matière... 48
-II.2.2 Méthodes de simulation adaptée au type de particules... 51
-II.2.3 Classification des codes Monte Carlo... 52
-II.2.4 Choix du code de simulation... 54
-II.3
Le code PENELOPE... 56
-II.3.1 Simulation mixte ... 58
-II.3.3 Modélisation d’un milieu et d’une géométrie ... 64
-II.3.3.1 Modélisation d’un milieu ... - 64 -
II.3.3.2 Définition des géométries... - 65 -
II.4
Application à la dosimétrie interne ... 66
-II.4.1 La méthode du Dose Point Kernel ... 66
-II.4.2 Méthode par simulation directe ... 68
-C
HAPITREIII
:
V
ALIDATION ET ADAPTATION DU CODEPENELOPE
POUR LA DOSIMETRIE INTERNE... -
71
-III.1
Cas de sources ponctuelles ... 74
-III.1.1 Influence des paramètres de simulation ... 74
-III.1.1.1 Sources monoénergétiques ... - 75 -
III.1.1.2 Spectres bêta... - 77 -
III.1.2 Influence de la géométrie... 80
-III.1.3 Comparaisons avec d’autres codes Monte Carlo ... 81
-III.1.3.1 Sources monoénergétiques ... - 82 -
III.1.3.2 Spectres bêta... - 86 -
III.2
Cas de sources volumiques... 88
-III.2.1 Adaptation du code ... 88
-III.2.2 Evaluation et validation ... 89
-III.2.3 Conclusion ... 92
-C
HAPITREIV
:
E
QUIVALENCE DU GELMAGIC
A L’
EAU ET AUX TISSUS BIOLOGIQUES... -
95
-IV.1
Modélisation du gel MAGIC... 100
-IV.1.1 Quantification des atomes... 100
-IV.1.2 Sections efficaces ... 102
-IV.1.2.1 Sections efficaces du gel ... - 102 -
IV.1.2.2 Influence des différents atomes ... - 103 -
IV.1.2.3 Comparaison avec l’eau ... - 107 -
IV.2
Equivalence du gel à d’autres milieux ... 109
-IV.2.1 Etude comparative des propriétés physiques ... 110
-IV.2.1.1 Fractions massiques et masse volumique ... - 110 -
IV.2.1.2 Densité électronique et Z effectif ... - 111 -
IV.2.1.3 Discussion ... - 112 -
IV.2.2 Etude comparative des propriétés d’interaction... 113
-IV.2.2.1 Atténuation et absorption des photons ... - 113 -
IV.2.2.2 Pouvoirs d’arrêt des électrons ... - 115 -
IV.2.2.3 Discussion ... - 117 -
IV.2.3 Etude comparative de propriétés dosimétriques ... 119
-C
HAPITREV
:
A
PPLICATIONS... -
125
-V.1
Correction de la dose absorbée dans des gels MAGIC radiomarqués à
l’yttrium 90 ... 128
-V.1.1 Situation du problème ... 128
-V.1.2 Conditions expérimentales de l’étude ... 131
-V.1.2.1 Description des étalons... - 131 -
V.1.2.2 Révélation de la dose absorbée ... - 131 -
V.1.3 Résultats ... 132
-V.1.3.1 Dosimétrie ... - 132 -
V.1.3.2 Correction de la courbe d’étalonnage R2/dose absorbée ... - 136 -
V.1.4 Discussion ... 137
-V.2
Nouveaux fantômes de gels irradiés par des sources non scellées 140
-V.2.1 Modèle d’irradiation pour une source surfacique ... 140-V.2.1.1 Fabrication du gel MAGIC... - 141 -
V.2.1.2 Irradiation ... - 142 -
V.2.1.3 Imagerie... - 143 -
V.2.1.4 Calculs dosimétriques... - 144 -
V.2.1.5 Résultats ... - 145 -
V.2.1.6 Discussion ... - 147 -
V.2.2 Modèle d’irradiation pour une source volumique... 148
-V.2.2.1 Elaboration du fantôme ... - 149 - V.2.2.2 Calcul dosimétrique... - 150 - V.2.2.3 Résultats ... - 150 - V.2.2.4 Discussion ... - 153 -
V.3
Conclusion... 156
-C
ONCLUSION... -
157
-A
NNEXES... -
159
-L
ISTE DES PUBLICATIONS... -
163
Figure I. 1 : Etapes d’un traitement en médecine nucléaire. ... 7
Figure I. 2 : Décroissance de l’activité d’une source radioactive au cours du temps. ... 11
Figure I. 3 : Modèles expérimentaux représentant les différentes applications en RIV. ... 18
Figure I. 4 : Addition radicalaire sur une molécule organique. ... 21
Figure I. 5 : Clusters de radicaux libres le long de la trajectoire d’un électron. ... 25
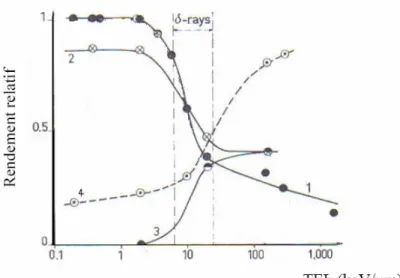
-Figure I. 6 : Influence du TEL sur le rendement des espèces crées par réactions radio-induites dans des solutions aqueuses. ... 25
-Figure I. 7 : Variation de la vitesse de polymérisation RP et du degré de polymérisation Pn en fonction de la vitesse d’initiationRi. ... 29
Figure I. 8 : Principe de la résonance magnétique... 33
Figure I. 9 : Relaxations longitudinale et transversale en imagerie par résonance magnétique. ... 34
Figure I. 10 : Séquence de spinéchos en imagerie par résonance magnétique... 35
Figure I. 11 : Séquence de multiéchos en imagerie par résonance magnétique. ... 35
Figure I. 12 : Méthodes d’étalonnage en dosimétrie par gels... 40
-Figure II. 1 : Répartition des 3 interactions élémentaires photon-matière en fonction de l’énergie incidente E0 et du numéro atomique Z... 49
Figure II. 2 : Organigramme des programmes et des fichiers entrée et sortie du code PENELOPE. ... 58
Figure II. 3 : Méthode « random hinge » du code PENELOPE. ... 61
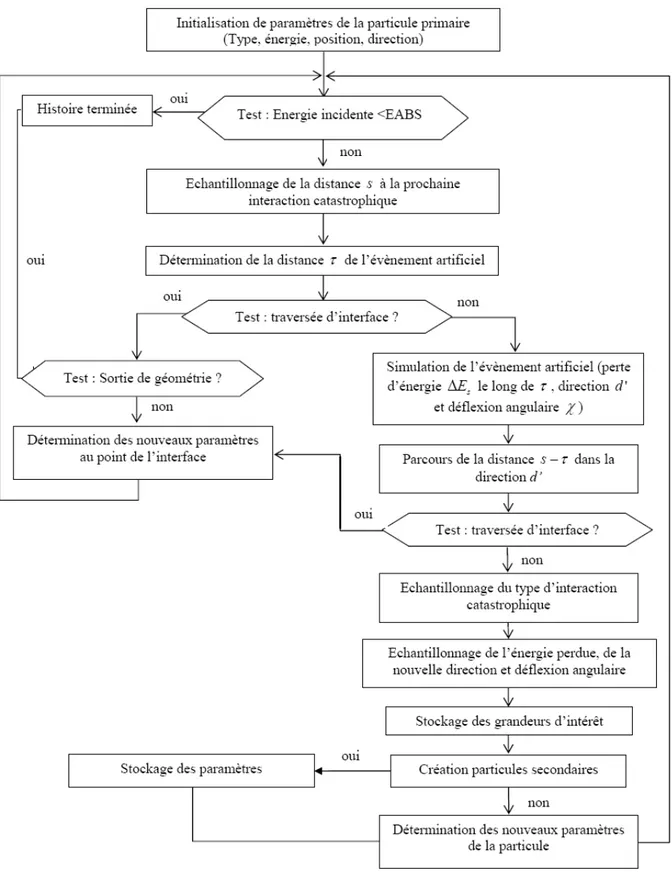
Figure II. 4 : Organigramme du transport des électrons par la simulation mixte de PENELOPE. ... 62
Figure II. 5 : Modélisation de géométries dans le code PENELOPE... 66
Figure II. 6 : Illustration de la méthode du Dose Point Kernel. ... 67
Figure II. 7 : Représentation plane d’une géométrie utilisée pour la méthode du Dose Point Kernel. ... 68
-Figure III. 1: Influence des paramètres de simulation sur les SDPK, F(r/r0), d’électrons monoénergétiques dans l’eau... 76
-Figure III. 2: Comparaison des spectres d’émission échantillonné et théorique de 131I, 32P et 90Y. ... 78
-Figure III. 3 : Ecart relatif entre les SDPK calculés par simulation détaillée et par simulation mixte du code PENELOPE dans l’eau pour 131I, 32P et 90Y. ... 79
-Figure III. 4 : Influence de l’épaisseur dr des structures sphériques utilisées pour le calcul de SDPK dans l’eau à 50 keV... 81
-Figure III. 5 : Comparaison de SDPK, F(r/r0), pour des électrons monoénergétiques d’énergie comprise entre 50 keV et 3 MeV dans l’eau calculées avec différents codes Monte Carlo... 83
-Figure III. 6 : Comparaison de SDPK, F(r/r0), calculés avec les codes PENELOPE, GEANT 4 et MCNPX, pour des électrons monoénergétiques d’énergie de 10 keV dans l’eau. ... 85
EGSnrc pour des sources I, P et Y. ... 87
-Figure III. 8 : Fraction auto-absorbée calculée avec PENELOPE, EGS4 et MCNP4B pour des sphères d’eau de masses variables (de 0,01 à 1000 g). ... 90
-Figure III. 9 : Facteurs S de sphères d’eau mélangée à 131I, 32P et 90Y. ... 91
Figure IV. 1 : Sections efficaces d’interaction pour 1 g de gel MAGIC. ... 102
Figure IV. 2 : Sections efficaces d’interaction pondérées photonatome du gel MAGIC... 104
Figure IV. 3 : Sections efficaces d’interaction pondérées électronatome du gel MAGIC. ... 106
Figure IV. 4 : Fractions massiques des atomes du gel MAGIC par constituant moléculaire. ... 107
Figure IV. 5 : Comparaison des fractions de probabilité d’interaction du gel MAGIC à celles de l’eau... 108
-Figure IV. 6 : Rapports entre les coefficients d’atténuation μ/ρ milieugel et d’absorption milieu gel en ρ μ / de l’eau ou d’un tissu biologique et ceux du gel MAGIC pour des photons de 1 keV à 5 MeV. ... 114
-Figure IV. 7 : Rapports entre les pouvoirs d’arrêt massiques radiatif milieu gel rad S /ρ , collisionnel milieu gel col S /ρ , total milieu gel tot S /ρ et les pouvoirs massiques de diffusion T/ρ milieugel de l’eau ou d’un tissu biologique et ceux du gel MAGIC pour des électrons entre 100 eV et 5 MeV. ... 116
-Figure IV. 8 : Variations du rapport de facteur S de l’eau, des différents milieux biologiques sur celui du gel MAGIC en fonction du rayon de la sphère pour un modèle source = cible... 120
-Figure V. 1 : Représentation des interfaces de milieux existants dans un fantôme de gel radioactif. Comparaison avec le modèle réalisé à partir du logiciel MIRDOSE. ... 129
Figure V. 2 : Photographie des gels MAGIC mélangés à une solution d’yttrium 90 d’activité croissante. 131 -Figure V. 3 : Récapitulatif des valeurs de facteur S de différents modèles de gels 90Y-MAGIC : Influence de la géométrie, du milieu et de la présence ou non d’une paroi de verre... 134
-Figure V. 4 : Variation du facteur S des gels 90Y-MAGIC en fonction de l’augmentation de leur masse volumique Δρ... 135
-Figure V. 5 : Courbe d’étalonnage des gels 90YMAGIC... 137
Figure V. 6 : Effet de bord à proximité d’une zone de gel de polymères irradiée... 140
-Figure V. 7 : Schéma du fantôme 90Ysurf/MAGIC. ... 141
Figure V. 8 : Dispositif de fabrication du gel MAGIC au sein du laboratoire de radiopharmacie. ... 141
Figure V. 9 : Fabrication (à droite) et stockage (à gauche) des gels irradiés par sources non scellées. ... 142
-Figure V. 10 : Représentation d’un voxel d’image IRM du fantôme 90Ysurf/MAGIC. ... 143
-Figure V. 11 : Spectre d’émission du rayonnement de freinage émis du fantôme 90Ysurf/MAGIC obtenu avec une caméra à scintillation. ... 144
-Figure V. 12 : Photographies du fantôme 90Ysurf/MAGIC après une semaine d’irradiation... 145
-Figure V. 13 : Distributions de dose absorbée du fantôme 90Ysurf/MAGIC calculées et mesurées à 187 h. 146 -Figure V. 14 : Répartition spatiale du rayonnement de freinage émis par le fantôme 90Ysurf/MAGIC... 147
-Figure V. 17 : Photographies de fantômes Yvol/MAGIC irradié et non irradié... 150
-Figure V. 18 : Images IRM pondérées en T2 et imagerie scanner RX du volume source du fantôme 90
Yvol/MAGIC... 151
-Figure V. 19 : Distributions de dose absorbée du fantôme 90Ysurf/MAGIC calculée et mesurée à 18h, 187 h et 331 h... 152
-Figure V. 20 : Variation de la réponse R2 du gel en fonction de la dose absorbée D dans le fantôme 90
Yvol/MAGIC... 152
-Figure V. 21 : Répartition spatiale du rayonnement de freinage émis par le fantôme 90Yvol/MAGIC... 153
-Figure V. 22 : Comparaison des courbes d’étalonnage obtenues par les méthodes multi échantillons et du rendement en profondeur... 155
-TABLES DES TABLEAUX
Tableau I. 1 : Rendements radicalaires et moléculaires de l’eau. ... 24 Tableau I. 2 : Monomères constituant les gels de polymères les plus courants. ... 32 Tableau II. 1 : Modèles physiques d’interaction et sections efficaces utilisés dans le code PENELOPE. .. 57 Tableau III. 1 : Paramètres de simulation pour le transport des électrons lors de calculs de SDPK dans l’eau. 75 -Tableau III. 2 : Gains de temps de calcul apportés par une simulation mixte au lieu d’une simulation détaillée pour des énergies comprises entre 50 keV et 1 MeV. ... 77
-Tableau III. 3 : Energie moyenne (ε) et distance (X90) calculées dans l’eau pour des sources ponctuelles de 131I, 32P et 90Y... 79
-Tableau III. 4 : Distance X90 et écart relatif par rapport au calcul de PENELOPE dans l’eau pour les codes EGS4-PRESTA, EGSnrc, ETRAN pour des sources 131I, 32P et 90Y. ... 86
Tableau IV. 1 : Nom, formule chimique et masse des constituants moléculaires du gel MAGIC 9%... 100 Tableau IV. 2 : Comparaison des fractions massiques du gel MAGIC 9% avec les valeurs publiées... 101 -Tableau IV. 3 : Coefficients stœchiométriques et quantités d’atomes H, C, N, O, S et Cu par gramme de gel MAGIC 9%. ... 101
-Tableau IV. 4 : Fractions massiques et masse volumique du gel MAGIC, de l’eau et de différents tissus biologiques. ... 110
-Tableau IV. 5 : Densité électronique ρe, densité électronique massique ρe/ρ, numéro atomique effectif
eff Z et rapports milieu gel e ρ , milieu gel eff Z et milieu gel e ρ
ρ / de l’eau et de différents tissus biologiques par rapport au gel MAGIC. ... 111
-Tableau IV. 6 : Possibilité d’équivalence du gel MAGIC à l’eau et aux tissus biologiques en termes de densité électronique et de numéro atomique effectif... 113
-Tableau IV. 7 : Possibilité d’équivalence du gel MAGIC à l’eau et aux tissus biologiques en termes de coefficients d’atténuation et d’absorption massiques, de pouvoirs d’arrêt massiques et de pouvoir de diffusion massique. ... 118
Tableau IV. 8 : Equivalence du gel MAGIC à l’eau et à des milieux biologiques en termes de facteur S. 121 -Tableau IV. 9 : Facteur S du gel (en Gy.Bq-1.s-1) et rapport milieu
gel
S pour l’eau et les tissus biologiques mélangés à 131I, 32P ou 90Y. ... 122
Tableau V. 1 : Fractions massiques et masse volumique du verre et de l’air... 129 -Tableau V. 2 : Facteur correctif du facteur S lié à la variation Δρ de la masse volumique du gel irradié. 135 -Tableau V. 3 : Comparaison des caractéristiques de l’étalonnage des gels MAGIC radiomarqués à 131I, 32P et 90
Y. ... 138
-INTRODUCTION
Les progrès constants de la biologie et de la pharmacologie offrent d’importantes perspectives d’évolution pour la radiothérapie interne vectorisée (RIV) à travers l’élaboration d’agents thérapeutiques (anticorps monoclonaux, peptides de synthèse...) qui permettent un ciblage tumoral plus sélectif et performant. Par cette approche, il est possible de délivrer aux tissus tumoraux des doses absorbées nettement supérieures à celles que peut apporter la radiothérapie externe, tout en préservant les tissus sains. Néanmoins, deux raisons limitent le développement de ce type de traitement : la première tient à la complexité du ciblage tumoral
in vivo, et l’autre est liée à l’absence de données fiables, facilement accessibles, concernant la
dose d’irradiation absorbée dans la tumeur et aux tissus sains. En effet, les difficultés de mise en œuvre d’études dosimétriques systématiques font, qu’en pratique, la RIV est prescrite au mieux en fonction du poids ou de la surface corporelle du patient. Pourtant, connaître la dose absorbée et déterminer la relation dose-effet pour les organes critiques et la tumeur sont une nécessité pour optimiser l’efficacité des traitements faisant usage des rayonnements ionisants. Par ailleurs, depuis une dizaine d’années, cette discipline thérapeutique doit faire face aux nouvelles directives européennes (EURATOM 97/43) [1], stipulant l’obligation que les doses reçues soient planifiées individuellement dans le cadre d’irradiation à des fins médicales. Cette réglementation a remis à jour l’urgence de disposer d’outils dosimétriques adaptés à la RIV, pour laquelle la dosimétrie in vivo n’est pas concevable.
Malgré le nombre important de dosimètres mis à disposition du physicien médical (chambres d’ionisation, détecteurs thermoluminescents, diodes, films radiologiques…), leur utilisation n’est pas adaptée aux émissions β- et α des radionucléides utilisés en RIV en raison de leur faible parcours dans l’organisme. De plus, ces dosimètres ne permettent pas d’accéder à une distribution tridimensionnelle de la dose absorbée au sein des organes.
Le recours aux gels radiosensibles a permis de pallier ce dernier problème en radiothérapie externe dès les années 80. Il s’agit de dosimètres chimiques, composés à plus de 80% d’eau, dont le principe d’utilisation repose sur la révélation de la dose absorbée par imagerie après un étalonnage préalable. Leur développement en milieu médical s’est accru par l’émergence de nouvelles techniques d’irradiation telles que la modulation de l’intensité du faisceau ou la stéréotaxie, imposant une vérification des planifications de traitements complexes en 3
dimensions. Aujourd’hui, les gels radiosensibles sont reconnus pour être les seuls détecteurs pouvant restituer la répartition spatiale de la dose absorbée. L’enjeu que représente le développement de cette méthode dosimétrique en routine clinique a été confirmé par la mise en place d’une association internationale appelée DOSGEL [2] qui organise, depuis 1999, des conférences bisannuelles pour informer sur les avancées de la dosimétrie par gels.
Devant le potentiel de cette méthode, des chercheurs se sont intéressés à l’utilisation de nouveaux gels radiosensibles, d’acronyme MAGIC (Methacrylic and Ascorbic Acid in Gelatin Initiated by Copper), pour la dosimétrie interne en RIV. Cette famille de gels présente l’avantage d’être peu sensible à l’oxygène de l’air ambiant qui peut inhiber la polymérisation radio-induite. Cela simplifie les phases de fabrication et d’utilisation des gels. Par ailleurs, il s’agit de dosimètres relatifs, ce qui implique la détermination de la relation liant leur réponse à la dose absorbée. Ce type de relation a déjà été établi en radiothérapie externe, mais les caractéristiques physiques différentes des radionucléides (énergie, débit de dose …) font que les résultats ne sont pas directement transposables pour des irradiations en RIV. Le recours à cette forme de dosimétrie dans ce dernier domaine passe donc par le développement de modèles expérimentaux rendant compte de l’énergie déposée au sein ou à proximité des organes soumis aux irradiations continues et prolongées à faibles débits des sources non scellées.
C’est dans ce contexte qu’a débuté en 2004, une étude de faisabilité sur des gels MAGIC rendus radioactifs par incorporation d’une solution d’yttrium 90. Les premiers résultats ont révélé une réponse reproductible des gels en fonction de la dose absorbée. Cependant, la quantification des dépôts d’énergie opérés dans le gel a été réalisée en utilisant un logiciel de dosimétrie généraliste, MIRDOSE, dédié initialement à la radioprotection. L’emploi de ce logiciel contraint à des simplifications concernant la géométrie des fantômes et le milieu d’irradiation. A l’époque, nous n’étions pas en mesure d’estimer l’erreur commise sur le calcul de la dose absorbée en faisant ces approximations. Ces travaux de thèse ont donc été initiés dans le but d’évaluer le gain de précision sur la dosimétrie par gels apporté par la mise en place d’une méthode de calcul, basée sur les techniques de Monte-Carlo offrant la possibilité de considérer les conditions réelles de l’expérience.
Pour mieux comprendre les atouts des gels MAGIC en RIV, nous commençons par rappeler dans le chapitre I, les principes généraux de la dosimétrie interne et les fondements du formalisme dosimétrique recommandé par le comité MIRD (Medical Internal Radiation Dose). Nous discutons à cette occasion, les limitations des moyens actuels mis en œuvre pour
appliquer ce formalisme en routine. Le chapitre II est consacré à la présentation de la méthode de Monte-Carlo et à son application dans un code récent, PENELOPE. Celui-ci permet de simuler le transport d’électrons et de positons d’énergie comprise entre 100 eV et 1 GeV, et le transport de photons à partir de 1 keV, dans des géométries complexes pouvant comporter des interfaces et des hétérogénéités. Cependant, la version distribuée n’autorisant que la simulation de sources ponctuelles et cylindriques, les deux chapitres suivants, III et IV, traitent de l’adaptation et la validation du logiciel PENELOPE pour les cas d’irradiations de gel MAGIC par sources non scellées de forme sphérique, forme la plus communément utilisée pour représenter les organes. Le chapitre III concerne particulièrement l’application de deux approches de calcul : la méthode du Dose Point Kernel, basée sur la distribution de dose autour d’une source ponctuelle, et la simulation par méthode directe, consistant à modéliser la répartition spatiale de la radioactivité. Le chapitre IV présente le calcul des données de base physiques du gel MAGIC et une étude sur son équivalence à l’eau et à certains tissus biologiques. Enfin, le chapitre V allie le calcul de dose absorbée par méthode de Monte-Carlo à la mesure des effets physico-chimiques traduisant la réponse du gel aux émissions d’une source radioactive d’yttrium 90. Il présente la mise en œuvre expérimentale des modèles théoriques développés dans le code PENELOPE, représentant trois configurations d’irradiation rencontrées couramment en radiothérapie interne vectorisée : le cas d’une source mélangée au milieu ciblé, celui d’une source placée au contact de la cible et celui d’une source sphérique placée au centre du volume cible.
CHAPITRE I
La dosimétrie par gels en radiothérapie interne
vectorisée : Généralités et problématique
I.1 La radiothérapie interne vectorisée
I.1.1 Principe et applications
La médecine nucléaire est la discipline qui recouvre l’ensemble des applications médicales ayant recours aux radioéléments artificiels sous forme non scellée. En pratique, l’acte médical se décompose en trois étapes :
- le marquage, qui consiste en l’association chimique du radioélément à une molécule vectrice dont le rôle est de conduire l’élément radioactif au sein des cellules ciblées,
- l’administration, c’est-à-dire l’absorption du médicament résultant ou du radioélément seul par voie intraveineuse, par inhalation ou par ingestion de gélule, - le ciblage, assuré par les propriétés de fixation sélective de la molécule vectrice et/ou par son affinité fonctionnelle avec les molécules de l’organisme (Figure I. 1).
Figure I. 1 : Etapes d’un traitement en médecine nucléaire.
Les radiopharmaceutiques sont administrés aux patients dans le but de diagnostiquer une pathologie ou de traiter une maladie. En diagnostic, l’objectif recherché est l’étude du métabolisme des organes. Les radionucléides utilisés doivent produire des rayonnements suffisamment pénétrants pour traverser le corps et pouvoir être détectés. Il s’agit essentiellement d’émetteurs gamma (γ) ou de positons (β+), de période physique assez courte (de quelques heures) et dont l’énergie est compatible avec les caractéristiques des systèmes de détection des caméras à scintillation (gamma-caméras et Tomographe à Emission de Positons, TEP). En thérapie, l’objectif est de détruire les cellules malignes. Les sources radioactives utilisées ont des périodes physiques plus longues, de l’ordre de plusieurs jours, et leurs
rayonnements sont de type bêta (β-), alpha (α) ou électron Auger, associés ou non à des rayonnements gamma (γ). Ce mode de thérapie est appelé radiothérapie métabolique ou encore radiothérapie interne vectorisée (RIV). Dans ce dernier terme, le mot « interne » rappelle que la source est introduite au sein des organes du patient par opposition à la radiothérapie externe où la source d’irradiation est située à l’extérieur du corps ; la notion de « vectorisation » renvoie au caractère systémique et ciblé de ce mode thérapeutique.
Parmi les radionucléides employés en RIV, l’iode 131 (131I) est de loin le plus fréquemment utilisé. Son principe d’action repose sur l’accumulation naturelle de l’élément stable 127I dans les tissus thyroïdiens. Par ce même procédé, l’incorporation de son isotope radioactif 131I dans cet organe permet le traitement de diverses pathologies telles que les hyperthyroïdies, les goitres non opérables, ainsi que les cancers différenciés de la thyroïde [3]. Au fil des années, les applications de 131I se sont diversifiées grâce à l’apparition d’autres agents pharmaceutiques tels que le métaiodobenzylguanidine (mIBG-131I) [4], dont l’autorisation de mise sur le marché (AMM) a permis de disposer de nouvelles armes thérapeutiques dans le traitement des tumeurs endocrines.
D’autres radionucléides, tels que le phosphore 32 (32P) ou l’yttrium 90 (90Y), sont également reconnus efficaces pour leurs caractéristiques physiques et leurs émissions β- d’énergie plus élevée. Comme 131I, l’utilisation du 32P ne nécessite pas obligatoirement de marquage préalable (Figure I. 1). C’est un émetteur bêta pur, souvent indiqué pour la maladie de Vaquez qui entraîne une surproduction de globules rouges. L’yttrium 90, quant à lui, a été initialement introduit pour les synoviorthèses. Celles-ci consistent en une injection de la source radioactive directement dans les cavités articulaires pour traiter certaines inflammations chroniques [5]. Par ce type de traitements, le radionucléide agit en détruisant la membrane synoviale affectée. Longtemps pratiqué à l’aide de corticoïdes ou d’acide osmique par action chimique, le traitement des synoviorthèses avec les radiopharmaceutiques β- s’est peu à peu développé du fait de la plus grande efficacité de ces médicaments [6] [7]. Parallèlement, l’utilisation de 90Y pour d’autres applications thérapeutiques s’est accrue au début des années 90 grâce à l’essor de la radioimmunothérapie. Cette méthode, basée sur le couplage du radioélément avec un anticorps monoclonal, a permis d’améliorer le contrôle des lymphomes malins non hodgkiniens évolutifs (Zevalin®: 90Y-MoAb; AMM européenne, 2004) [8] [9]. A la même période, un nouveau radiopharmaceutique, le 90Y-Dotatoc, a montré son efficacité sur les tumeurs endocrines métastatiques, souvent considérées comme une réelle impasse thérapeutique [10] [11].
Parmi l’ensemble des radionucléides couramment utilisés pour les traitements en RIV, 90Y est celui qui émet les rayonnements β- les plus énergétiques. Ses émissions ont une énergie maximale de 2,28 MeV (voir annexe 1) permettant d’atteindre des parcours de plus de 9 m dans l’air et 1 cm dans l’eau. Contrairement à 131I [12], l’utilisation de 90Y ne nécessite pas le confinement des patients dans des chambres radio-protégées car il n’est pas émetteur de rayonnements γ, ce qui réduit les coûts de traitement et améliore le confort des patients.
Durant ces dix dernières années, les essais cliniques sur ces nouveaux médicaments radio-marqués n’ont cessé de se multiplier, traduisant un intérêt grandissant pour la RIV [11] [13]. Plusieurs raisons peuvent expliquer ce développement :
⇒ Par cette approche thérapeutique, les doses délivrées localement sont supérieures à celles de la radiothérapie externe [14].
⇒ Le mode d’action, basé sur le concept du traitement sélectif et ciblé tout en limitant l’irradiation des tissus sains par l’action d’un agent vecteur approprié, répond parfaitement aux objectifs de la radiothérapie.
⇒ La RIV est une réponse innovante et complémentaire aux techniques conventionnelles [15] : par rapport à la radiothérapie externe, c’est un traitement systémique qui concerne des pathologies étendues, métastatiques, disséminées ou de trop petite taille pour être décelées par imagerie ; par rapport à la chimiothérapie, la toxicité est moindre et l’imagerie associée permet d’évaluer la biodistribution du traitement. Cependant, c’est probablement dans la combinaison de ces différentes méthodes de traitement que résident les avancées les plus prometteuses.
Si le potentiel thérapeutique de la RIV n’est plus à démontrer, estimer la quantité d’énergie absorbée dans un volume cible avec précision, généralement exprimée par unité de masse sous le terme de « dose absorbée », demeure encore problématique ce qui limite le développement clinique de la RIV du fait de l’absence de relation dose-effet bien maîtrisée.
I.1.2 Quantification de la dose absorbée
L’objectif de la dosimétrie est d’optimiser l’action thérapeutique produite sur les cellules ciblées tout en limitant l'irradiation des tissus sains avoisinants. Il s’agit d’un enjeu commun à toutes les disciplines thérapeutiques ayant recours aux rayonnements ionisants. En effet dès les premières applications, déterminer la dose délivrée par les radionucléides en RIV a été reconnu nécessaire pour augmenter l’efficacité des traitements [16]. Peu à peu, des
expériences cliniques en cancérologie ont confirmé l’utilité et l’enjeu de l’anticipation des risques de toxicité et de contrôle tumoral à travers une évaluation fiable de la dose administrée [17] [18]. Malgré les nombreuses avancées (§ I.1.2.2 et § I.1.2.3), la dosimétrie dans le cas d’irradiations par sources non scellées reste du domaine de la recherche. Pour mieux en comprendre les enjeux, nous nous proposons en premier lieu de détailler la méthodologie recommandée pour ce type d’application (§ I.1.2.1) puis, d’en préciser ses limitations (§ I.1.2.4).
I.1.2.1 Le formalisme recommandé
La dose absorbée moyenne D représente la quantité d’énergie déposée par unité de masse dans une région cible r suite à l’émission de rayonnements dans une région source c r . s
En médecine nucléaire, la dose délivrée par la source radioactive est communément estimée à partir de la méthodologie proposée par le comité Medical Internal Radiation Dose (MIRD). Ce formalisme fut proposé en 1968 par Loevinger and Berman [19]. A l’époque, leur objectif était d’établir une équation générale du calcul de la dose absorbée en intégrant l’ensemble des relations de la méthode de Marinelli définies par type de radiations ionisantes [20]. Depuis, la méthodologie du MIRD a été utilisée dans de nombreux travaux, présentés pour la plupart dans le Journal of Nuclear Medicine.
Selon ce formalisme, la dose absorbée D (en J. kg-1 ou Gy) est définie selon la relation suivante :
∑
← = i c s c i i s m r r A D ~ . ε .φ ( ) (eq. I. 1) - As ~(en Bq. s) représente l’activité cumulée pendant la durée totale de l’irradiation, - εi (en J. Bq
-1
. s-1) est l’énergie moyenne émise par transition nucléaire pour un type de rayonnement i,
- m (en kg) est la masse de la région cible c r , c
- )φi (rc ←rs (sans unité) est la fraction absorbée.
L’activité cumulée
L’activité cumulée A~s tient compte de l’évolution de l’activité dans un volume source au cours du temps. Elle correspond à la somme des transitions nucléaires produites durant un certain temps t et représente l’intégrale de l’activité As
( )
t ,dt t A A t s s ( ) ~ 0
∫
= (eq. I. 2) 0 A( )
t As t s A~Figure I. 2 : Décroissance de l’activité d’une source radioactive au cours du temps.
En pratique, la fonction As
( )
t est évaluée par des mesures répétées à intervalle de tempsréguliers. L’activité peut être mesurée soit par des comptages externes de prélèvements (sanguins, selles ou urines…), soit par des acquisitions d’images scintigraphiques [21] lorsqu’il s’agit d’une estimation de la fixation radioactive du corps entier. Pour une quantification dans un organe donné, seule la méthode par imagerie est envisageable. Le résultat de ce « comptage » dépend de l’activité initiale A présente dans l’élément considéré, 0 de la loi de décroissance radioactive de la source (période physique) mais aussi, des processus chimiques et biologiques (période biologique) qui s’opèrent dans l’organisme. Ces effets conduisent à une variation de As
( )
t suivant une loi exponentielle décroissante, caractériséepar la période effective T qui résulte des périodes physique eff Tphys et biologique Tbiol.
biol phys eff T T T 1 1 1 = + (eq. I. 3)
En intégrant les grandeurs A et 0 T dans l’expression (eq. I. 2), eff A~s s’écrit :
(
t)
dt A A t eff s =∫
− 0 0 exp ~ λ (eq. I. 4) effλ , la constante effective équivaut à
eff
T
2 ln
.
L’énergie moyenne par transition nucléaire
Lorsque la source est susceptible d’émettre plusieurs types de rayonnements lors d’une désintégration nucléaire, l’énergie moyenne totale émise, ε , est donnée par la relation :
∑
= i i ε ε (eq. I. 5)Les caractéristiques radiatives du spectre d’émission des radionucléides employés en médecine nucléaire sont connues. Elles sont établies par des organismes tels que le Laboratoire National Henri Becquerel (LNHB) [22] ou le National Institute of Standards and
Technology (NIST) [23], ou par des commissions internationales comme le International Commission of Radiation Units and Measurements (ICRU) [24].
La fraction absorbée
La fraction absorbée φi (rc ←rs) représente le rapport de l’énergie absorbée E dans le volume cible r sur l’énergie émise c E par le volume source 0 r , soit : s
0 ) ( E E r rc s i ← = φ (eq. I. 6)
Elle constitue la grandeur élémentaire à partir de laquelle a été fondé le formalisme du MIRD [25]. Sa valeur comprise entre 0 et 1, dépend des dimensions et de la position de la cible par rapport au lieu d’émission des rayonnements. Ainsi, dans le cas particulier où le parcours des particules est très inférieur aux dimensions du volume cible, φi (rc ←rs) tend vers 1 si la source et la cible sont confondues et φi (rc ←rs) est proche de 0 quand, à l’inverse, source et cible sont distinctes.
Des calculs de fractions absorbées sont disponibles dans la littérature [25] [26]. Cependant, la validité de ces grandeurs pour une application clinique impose que la configuration géométrique source/cible soit analogue à celle utilisée pour le calcul. Il s’agit souvent des fractions absorbées destinées à des estimations de dose en radioprotection. De plus, ces données concernent des volumes de forme simple, la plus commune étant la sphère.
La fraction absorbée massique
La fraction absorbée massique Φi
(
rc ←rs)
prend en compte la masse de l’organe cible. On la définit comme étant la fraction absorbée dans le volume cible par unité de masse.(
)
(
)
c s c i s c i m r r r r ← = ← Φ φ (eq. I. 7)L’intérêt de cette grandeur réside principalement dans le cas où φi (rc ←rs)<< 1, c’est-à-dire que la cible est éloignée de la source : Φi
(
rc ←rs)
devient peu sensible aux variations de taille et de forme. Des valeurs tabulées de fractions absorbées massiques pour les photons et les électrons ont été déterminées pour la plupart des organes cibles [26] et en un point situé à une distance donnée d’une source ponctuelle placée dans l’eau [27] [28].Le facteur S
En 1975, la notion de « facteur S » a été introduite dans l’équation eq. (I. 1) pour simplifier le
calcul de la dose absorbée D [29] [30]. Il s’agit d’une constante, S(rc ←rs), que l’on assimile à la dose moyenne absorbée par becquerel par seconde (Gy. Bq-1. s-1), soit pour une unité d’activité cumulée :
∑
← = ← i c s c i i s c m r r r r S( ) ε .φ ( ) (eq. I. 8)Le facteur S permet, avant tout, de simplifier l’expression de la dose absorbée (eq. I. 1). Il représente la combinaison, en une seule grandeur, de toutes les caractéristiques physiques et géométriques de l’irradiation (eq. I. 2). Ainsi, des facteurs S ont été calculés par Snyder et al. [29] et Bouchet et al. [31] pour divers radionucléides, des organes sources et des organes cibles de modèles d’homme adulte.
La détermination de la dose absorbée est ainsi réduite à l’expression:
) ( . ~ s c s S r r A D = ← (eq. I. 9)
Dès lors, appliquer le formalisme de MIRD requiert deux types d’informations :
- des données physiques regroupant à la fois l’ensemble des caractéristiques radiatives (énergie et type des émissions) et les paramètres géométriques (position, forme…) des volumes sources et cibles définis le plus souvent par l’intermédiaire de modèles mathématiques appelés fantômes anthropomorphiques (§ I.1.2.2),
- des données biologiques concernant les distributions spatiale et temporelle du radiopharmaceutique, préférentiellement obtenues par imagerie scintigraphique pour déterminer l’activité cumulée dans les différents organes (§ I.1.2.3).
I.1.2.2 Les fantômes anthropomorphiques
A l’époque où le fantôme de Snyder et al. a été élaboré [26], les hétérogénéités de masse volumique entre le squelette, les poumons et les tissus étaient déjà considérées. Ce fantôme est resté célèbre car il constitue la première représentation « réaliste » de l’anatomie humaine. Néanmoins, parce qu’il a été conçu dans un contexte de radioprotection, les formes géométriques matérialisant les organes demeurent très simples, limitées à des cylindres, des sphères ou des ellipses.
En 1978, le fantôme de Snyder et al. subit des modifications majeures en intégrant une meilleure définition des éléments constituant la tête [32]. Ces modifications entraînèrent de
nouveaux calculs de facteurs S pour des sources d’électrons et de photons d’émissions mono et
poly-énergétiques [33]. Ce n’est qu’en 1987, que Cristy and Eckerman élaborèrent une série de six fantômes supplémentaires représentant l’adulte, le nouveau-né et des enfants âgés respectivement de 1, 5, 10 et 15 ans [34]. Ces modèles ont été utilisés par Stabin and Konijnenberg [35] pour calculer les grandeurs physiques de base du logiciel de dosimétrie MIRDOSE [36], largement répandu en médecine nucléaire et radioprotection. Plus récemment, de nouveaux fantômes anthropomorphiques plus sophistiqués ont été intégrés dans d’autres logiciels tels que OLINDA/EXM (Organ Level INternal Dose Assessment with EXponential Modelling) [37] ou MABDOSE [38].
Malgré toutes ces améliorations, ces modèles mathématiques restent dans certains cas, éloignés de la morphologie du patient : En effet, les calculs réalisés par Clairand et al. [39] ont montré que les facteurs S relatifs à trois fantômes adultes de taille variable (entre 160 et
180 cm pour l’homme et 150 et 170 cm pour la femme) pouvaient présenter des différences supérieures à 20%. A travers cette étude, le manque de corrélation entre la masse des organes et la taille du patient a été mis en cause. Ces observations ont confirmé la nécessité de considérer les différences de corpulence entre les patients, indépendamment de leur âge, leur taille ou leur sexe, pour augmenter l’efficacité des traitements en RIV.
De plus, certaines évaluations dosimétriques pour des radionucléides émetteurs β-, ont montré leurs limites en aboutissant à des erreurs d’estimation pouvant atteindre 50% [40] [41]. La raison de ces discordances provient du faible parcours des particules β- émises par rapport aux dimensions de l’organe (parcours maximal d’environ trois millimètres pour 131I dans l’eau, par exemple). Ceci crée une hétérogénéité de distribution de dose accompagnée d’un gradient de dose élevé. Ces constats ont conduit à s’intéresser à des volumes d’intérêt beaucoup plus petits, à l’échelle millimétrique, d’une part pour réduire les erreurs systématiques sur les doses calculées constatées dans les fantômes de taille standard [42], et d’autre part pour respecter le postulat de la méthode du MIRD reposant sur le principe d’une distribution uniforme du radionucléide dans le volume [30].
La conception de fantômes voxelisés a été rendue possible grâce aux performances des systèmes d’imagerie tridimensionnelle tels que le scanner RX (ou imagerie par tomodensitométrie) permettant d’accéder à des modèles plus précis. Ces modèles ont d’abord été élaborés à partir d’êtres humains de taille standard, à l’exemple des modèles de Zubal [43] ou de VIP-MAN (Visible Photographic MAN) [44] proposés à partir des années 90. Très vite, les premières acquisitions d’images 3D de sujets humains ont suivi, menant ainsi vers une
dosimétrie personnalisée conforme à la morphologie du patient [45]. Mais, le développement de cette nouvelle approche de la dosimétrie reste à ce jour limité à cause des temps de calcul prohibitifs que requiert son application en routine clinique [46].
I.1.2.3 Analyse quantitative par scintigraphie
La quantification par imagerie consiste à associer l’intensité du signal d’une région de l’image (valeur d’un ou de plusieurs pixels) à la concentration radioactive de radiopharmaceutique (Bq/ml) que renferme cette région de l’objet. Idéalement, ce mode de quantification apparaît simple mais en pratique, sa mise en œuvre est sujette à de nombreux biais de détection à la fois liés aux caractéristiques intrinsèques des caméras (uniformité, résolution spatiale, sensibilité…) et aux phénomènes physiques qui ont lieu au sein du patient (absorption, diffusion, atténuation…). Des améliorations ont été apportées au cours de ces dernières années, notamment par l’ajout de scanner à rayons X couplé permettant de corriger l’atténuation des photons dans le patient. Cependant, d’autres facteurs propres au type de radiations de la RIV viennent se greffer à cette liste. Ils concernent essentiellement les limitations technologiques des systèmes de détection et l’influence des photons diffusés. En effet, les forts taux de comptage auxquels sont soumis ces détecteurs provoquent une saturation qui se caractérise par l’existence d’un temps mort durant lequel aucun photon incident n’est détecté. Par ailleurs, à cause des photons de haute énergie (131I, ou rayonnements de freinage des émetteurs bêta purs, 32P et 90Y) et des fortes concentrations de radioactivité, les rayonnements diffusés peuvent traverser les septas du collimateur et atteindre le cristal (phénomène de pénétration septale).
I.1.2.4 Pratiques dosimétriques et limitations
A l’heure actuelle, les avancées technologiques sont telles que certains logiciels de dosimétrie, comme 3D-ID [47], sont capables de combiner la méthode de Monte-Carlo pour simuler les trajectoires de particules, l’information anatomique réelle du patient, et la répartition spatiale de la radioactivité (par imagerie SPECT, Single Photon Emission Computed Tomography ou PET, Positron Emission Tomography) [48]. Ces progrès ont pu être réalisés grâce à l’amélioration de la quantification des images scintigraphiques et à l’évolution des fantômes anthropomorphiques, conduisant à des fractions de dose calculées à l’échelle du voxel (S voxel value). Néanmoins, pour les raisons évoquées précédemment (§ I.1.2.3), l’adaptation de ces nouveaux outils à la RIV se complexifie, d’une part, à cause des limites de détection des caméras à scintillation dans le cas d’émetteurs bêta purs et des
photons de haute énergie, et d’autre part, par des temps de calcul jugés beaucoup trop longs si l’on souhaite tenir compte des caractéristiques physiologiques propres à chaque patient (§ I.1.2.2).
De ce fait, en pratique, très peu d’études dosimétriques ont été réalisées. D’après une enquête datant de 1999 et menée par le comité de l’EANM (European Association of Nuclear Medicine) à l’échelle européenne, les estimations de dose absorbée en RIV demeuraient encore exceptionnelles [49]. Elles ne concernaient que cinq pays sur seize. De plus, lorsque l’étude dosimétrique est réalisée, le volume des organes est approximé à partir d’un examen morphométrique ou échographique ; les examens tomodensitométriques ne sont pas pratiqués systématiquement. Maîtriser la dose prescrite au patient est devenu depuis peu un enjeu légal puisque le décret d’application N° 2003-270, mis en vigueur en France le 24 mars 2003 [50] suite à la transposition de la directive européenne EURATOM 97/43, a induit l’application des principes de justification et d’optimisation lors d’expositions aux rayonnements ionisants. Il apparaît donc évident que la mise à disposition d’une méthode facile à mettre en œuvre et d’accessibilité rapide serait utile pour valider expérimentalement les calculs réalisés à partir des fantômes mathématiques existants (§ I.1.2.2) et amorcer l’automatisation des contrôles dosimétriques de la RIV en routine clinique.
I.1.2.5 Apport des gels radiosensibles
Valider le calcul de doses absorbées issu des logiciels de dosimétrie dédiés à la RIV suppose la mise à disposition d’outils ou de méthodes capables de décrire la distribution spatiale des sources non scellées et les conséquences de leurs émissions dans les volumes cibles. Cette validation peut avoir lieu à deux niveaux : à l’échelle des cellules et de ses constituants, et à l’échelle des organes. L’intérêt incontestable de la dosimétrie à l’échelle microscopique pour optimiser l’efficacité thérapeutique des traitements a provoqué, depuis les années 1990, une augmentation du nombre d’études recensées [51] [52]. Cependant, à des dimensions si petites, il apparaît difficile de pouvoir mettre au point un moyen expérimental pour vérifier les doses absorbées dans les cellules. Parallèlement, la macrodosimétrie à l’échelle de l’organe a comme finalité l’établissement d’une relation dose-effet à l’échelle tumorale. Idéalement, elle devrait permettre d’évaluer de manière simple la posologie et la conduite de l’irradiation nécessaire à l’éradication de la maladie et d’anticiper les effets radio-induits sur les organes critiques. Mais l’hétérogénéité de la distribution de doses absorbées observée, par exemple dans les cellules de neuroblastomes traités à 131I, complexifie cette relation [53]. Pourtant, en
imaginant qu’un dosimètre soit capable de rendre compte de cette hétérogénéité, on pourrait envisager la mesure expérimentale des doses absorbées à l’échelle de ces organes.
Les caractéristiques de gels radiosensibles semblent répondre aux exigences d’un modèle adapté pour la vérification expérimentale de la dosimétrie interne et l’étalonnage du signal en imagerie. En effet, ce sont des dosimètres chimiques, tridimensionnels et relatifs, capables de restituer la répartition spatiale des dépôts de dose absorbée par la mesure de leur réponse en imagerie 3D. Ils se composent majoritairement d’eau (> 80%) à l’image des tissus humains. Par ailleurs, des études ont démontré que les gels possèdent toutes les propriétés dosimétriques requises pour une utilisation en radiothérapie externe [54] [55] : leur réponse est reproductible, stable au cours du temps et linéaire avec l’énergie (jusqu’à environ 12 Gy), quel que soit le type de rayonnement. Il s’agit de dosimètres intégrateurs (ou passifs) : leur révélation en dose absorbée résulte de l’accumulation de l’énergie absorbée sur toute la durée de l’irradiation et elle peut être effectuée par lecture différée, ce qui constitue un avantage compte tenu des durées d’irradiation des traitements en RIV. En plus de ces propriétés générales, l’utilisation de tels dosimètres pourrait s’avérer particulièrement utile dans cette discipline pour plusieurs raisons :
⇒ Une malléabilité et une texture appropriées.
Ces propriétés permettraient de reproduire la forme des organes et d’élaborer des modèles réels, palpables et modulables. C’est un atout majeur rendant envisageable la réalisation de fantômes anthropomorphiques expérimentaux de forme et de taille indéfiniment variables. Les gels pourraient, ainsi, être des outils de validation expérimentale reproduisant fidèlement les formes anatomiques du patient et permettant d’accéder à une dosimétrie personnalisée. Trois modèles expérimentaux suffiraient alors à reproduire les principales situations cliniques rencontrées en radiothérapie vectorisée (Figure I. 3) :
- le modèle source = cible, représentant le cas de disfonctionnements thyroïdiens modélisés par une source distribuée de façon uniforme dans le gel,
- le modèle source < cible, correspondant aux injections intracavitaires comme les
synoviorthèses, représentées par une source volumique placée dans le gel,
- le modèle source > cible symbolisant l’action d’anticorps radiomarqués à la
surface d’une cellule, cette dernière étant matérialisée par le gel. ⇒ Un dosimètre tridimensionnel de haute résolution.