Découverte de nouveaux marqueurs
pharmacogénomiques de la maladie du greffon contre
l’hôte en transplantation de cellules souches
hématopoïétiques
Thèse
Isabelle Laverdière
Doctorat en pharmacie
Philosophiae doctor (Ph.D.)
Québec, Canada
© Isabelle Laverdière, 2014
Résumé
La transplantation de cellules souches hématopoïétiques (CSH) constitue une avenue thérapeutique potentiellement curative pour plusieurs cancers hématologiques comme la leucémie. L’utilisation d’une thérapie immunosuppressive pour prévenir la maladie du greffon contre l’hôte (GvHD) est un déterminant majeur du succès de la greffe. Malgré tout, cette complication survient chez 25 à 50% des transplantés et est une cause majeure de mortalité. L’optimisation du régime d'immunosuppression est un facteur facilement modifiable qui pourrait améliorer le pronostic des patients. Particulièrement, les polymorphismes du génome du donneur ou du receveur dans les voies pharmacogénomiques des immunosuppresseurs pourraient influencer l’exposition et l’action de ces médicaments, de même que le pronostic du patient. Le profilage de 20 pharmacogènes prioritaires chez des paires de donneurs-receveurs en greffe de CSH a permis d’identifier des variations génétiques liées au risque de la GvHD aiguë. Principalement, le statut génétique du receveur pour les protéines ABCC1 et ABCC2, impliquées dans le transport du méthotrexate (MTX), ainsi que des cibles moléculaires de ce médicament (ATIC et MTHFR) ont été associées au risque de GvHD aiguë. Similairement, le NFATc1, codant pour une cible moléculaire de la cyclosporine, augmentait lui aussi le risque de la maladie. Les porteurs de deux génotypes à risque et plus étaient particulièrement prédisposés à développer cette complication. Par surcroît, le statut génétique du donneur influençait également le pronostic du receveur après la greffe. Entre autres, des allèles protecteurs ont été identifiés dans les voies liées au transport (SLC19A1) et à l’action du MTX (DHFR). Inversement, NFATc2 a été associé à une augmentation du risque de GvHD aiguë. Afin de mieux comprendre les associations observées entre ces marqueurs génétiques et le risque de GvHD aiguë, une étude prospective innovante est en cours chez des greffés de CSH. Cette étude permettra d’étudier comment la génétique du patient ou du donneur peut influencer la pharmacocinétique et la pharmacodynamie des immunosuppresseurs, de même que leurs liens avec la GvHD aiguë. Ces paramètres sont quantifiés grâce à des approches analytiques que nous avons mises au point afin de répondre aux besoins spécifiques et uniques de cette étude. Les approches proposées dans cette thèse sont complémentaires aux méthodes classiques de suivi des immunosuppresseurs et pourraient aider à optimiser la pharmacothérapie du patient. Une meilleure identification des patients à haut risque de GvHD aiguë avant la greffe, basée sur des marqueurs pharmacogénomiques identitaires, pourrait guider le choix de la prophylaxie immunosuppressive, et ainsi améliorer l’issue clinique de la greffe.
Abstract
Hematopoietic stem cells transplantation (HSCT) is a potentially curative therapy for several hematological cancers such as leukemia. Following transplantation, effective immunosuppression prophylaxis is mandatory to prevent the graft-versus-host disease (GvHD) and improved the clinical outcome. However, GvHD still occurs in 25-50% of transplanted patient and is associated with high mortality rate. Optimization of immunosuppressive therapy is an easily modifiable factor that can improve the prognosis of patient after HSCT. In particular, polymorphisms of recipient and donor in genes with functions related to drugs transport, metabolism and action might influence the exposure and the efficacy of immunosuppressive therapy, and thus the clinical outcome. The evaluation of 20 candidate pharmacogenes in donor-recipient pairs of HSCT identified genetic polymorphisms associated with the risk of GvHD. Recipient genetic status for ABCC1 and ABCC2, related to methotrexate (MTX) transport, as well as polymorphisms in genes encoding molecular targets (ATIC and MTHFR) of this drug, exhibit a remarkable influence on acute GvHD prevalence. Similarly, the cyclosporin molecular target NFATc1 also increases the risk of GvHD. Importantly, the presence of ≥2 of these SNPs was found to be associated with high risk of developing severe grade of acute GvHD. In donor, we identified protective alleles in pathways related to transport (SLC19A1) and action (DHFR) of MTX. Conversely, NFATc2 enhances the risk of acute GvHD. To improve our understanding of the process behind these associations, we have an ongoing prospective study in HSCT. This innovative study will provide the opportunity to evaluate the influence of such genetic markers on the pharmacokinetic and pharmacodynamic of immunosuppressive drugs, as well as their relation with the risk of GvHD. For the specific needs of our study, we have developed two analytical methods based on mass spectrometry. The approaches we proposed in this thesis are complementary to conventional monitoring method and are promising tools to optimize drug therapy in HSCT. Identification of such biomarkers assessed before transplantation can help personalized patient care in order to prevent GvHD and improve survival.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations... xv
Remerciements ... xix
Avant-Propos ... xxiii
Introduction ... 1
1. Greffe allogénique de CSH et ses indications ... 3
2. Cellules souches hématopoïétiques ... 4
2.1 Sources de CSH ... 6
2.1.1 Moelle osseuse ... 6
2.1.2 Sang périphérique ... 7
2.1.3 Sang de cordon ombilical... 8
3. Caractéristiques cliniques liées aux succès de la greffe ... 9
3.1 Histocompatibilité de la greffe ... 11
3.1.1 Types de donneurs allogéniques ... 11
3.1.2 Système multigénique des antigènes leucocytaires humains ... 12
3.1.3 Compatibilité HLA entre le donneur et le receveur ... 12
3.1.4 Registres nationaux et internationaux de donneurs ... 15
4. Réaction allogénique de la greffe ... 16
4.1 Rejet du greffon: l’effet de l’hôte contre le greffon ... 16
4.2 Effet du greffon versus la tumeur ... 16
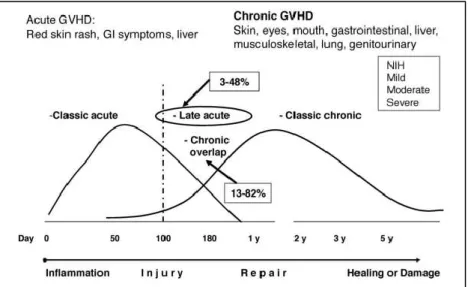
4.3 Maladie du greffon contre l’hôte ... 17
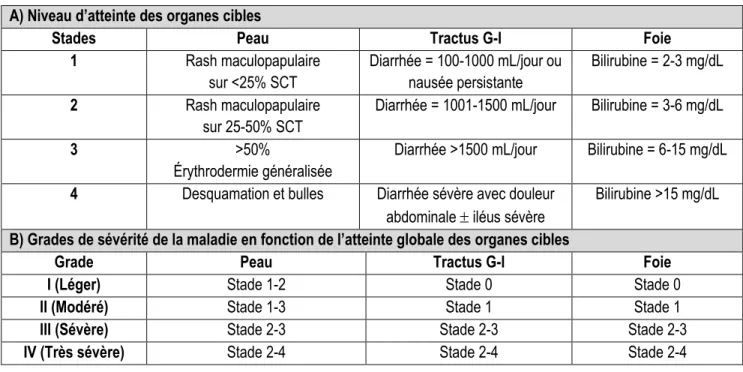
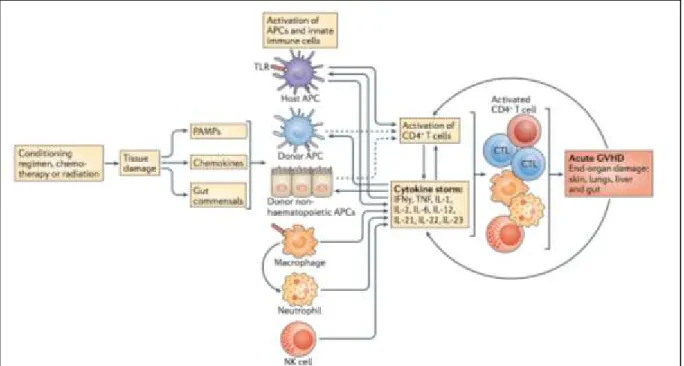
4.3.1 La GvHD aiguë ... 18
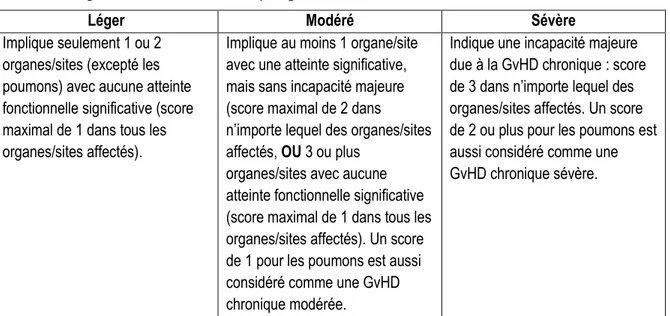
4.3.2 La GvHD chronique ... 21
5. Pharmacothérapie de la greffe ... 24
5.1 Régime de conditionnement préparatoire à la greffe ... 24
5.2 Régime prophylactique d’immunosuppresseurs ... 25
5.2.1 Régimes préventifs courants ... 26
5.2.2 Inhibiteurs de la calcineurine ... 27
5.2.3 Méthotrexate ... 29
5.2.4 Mycophenolate mofetil ... 30
5.2.5 Corticostéroïdes ... 32
5.3 Pharmacocinétique des immunosuppresseurs en prévention de la GvHD ... 33
5.3.1 Cyclosporine et tacrolimus ... 33
5.3.2 Mycophenolate mofetil ... 35
5.3.3 Méthotrexate ... 36
5.5 Marqueurs génétiques non HLA et leur influence sur le risque de GvHD ... 39
5.5.1 Polymorphismes structuraux et délétions de gènes ... 40
5.5.2 Polymorphismes de gènes liés aux réponses immunitaires ou inflammatoires ... 40
5.5.3 Polymorphismes de pharmacogènes des voies des immunosuppresseurs ... 41
5.5.3.1 Polymorphismes des voies pharmacocinétiques des immunosuppresseurs en greffe de CSH ... 41
5.5.3.2 Polymorphismes des voies pharmacodynamiques des immunosuppresseurs en greffe de CSH ... 45
6. Hypothèses, objectifs, méthodologie et importance des articles dans la démarche scientifique ... 52
6.1 Étude systématique des polymorphismes génétiques des voies PK et PD des immunosuppresseurs, dans les génomes des donneurs et des receveurs, en lien avec la GvHD ... 56
6.1.1 Sélection des gènes candidats et des polymorphismes de ces gènes ... 57
6.1.2 Étude exploratoire dans une population de 104 patients greffés de CSH et leurs donneurs respectifs ... 58
6.1.3 Étude des marqueurs génétiques dans une population de 420 paires de donneurs-receveurs en greffe de CSH ... 59
6.1.4 Analyse des données génétiques en lien avec le résultat clinique ... 61
6.2 Mieux comprendre l’association entre la présence des marqueurs génétiques, la pharmacocinétique et l’action d’immunosuppresseurs en greffe de CSH et leur impact clinique pour le patient ... 61
6.2.1 Développer une approche basée sur la spectrométrie de masse pour quantifier le niveau d’exposition aux immunosuppresseurs, et l’évaluer chez des patients greffés de CSH ... 62
6.2.2 Développer une méthode analytique basée sur la spectrométrie de masse afin d’évaluer l’efficacité du MMF à sa cible IMPDH, et de l’évaluer chez des patients greffés de CSH ... 63
6.2.3 Effectuer une étude prospective en greffe apparentée de CSH au CHU de Québec ... 64
6.3 Étude du métabolisme de l’immunosuppresseur tacrolimus par la voie de glucuronidation ... 64
Chapitre II ... 67
Étude de marqueurs du risque de GvHD en greffe de CSH liés aux voies pharmacogénomiques de la CsA et du MTX ... 67
Résumé ... 68
Chapitre III ... 101
Développement d’une méthode sensible et spécifique permettant de quantifier simultanément les immunosuppresseurs les plus fréquemment utilisés en clinique de transplantation au Québec ... 101
Résumé ... 102
Chapitre IV ... 127
Développement d’une méthode sensible et spécifique permettant d’objectiver l’efficacité du mycophenolate mofetil à sa cible thérapeutique ... 127
Résumé ... 128
Chapitre V. ... 155
Étude prospective en greffe de CSH au CHU de Québec ... 155
Résumé ... 156
Chapitre VI ... 167
Étude du métabolisme de glucuronidation du tacrolimus ... 167
Résumé ... 168
Prédicteurs PGx du risque de GvHD liés à l’utilisation des inhibiteurs de la calcineurine et du MTX en greffe
de CSH ... 186
Présentation et critique de la population à l’étude ... 187
Fonctionnalité potentielle des marqueurs PGx identifiés pour la GvHD aiguë ... 188
Polymorphismes identifiés dans le génome du receveur ou du donneur et leur rôle potentiel... 188
Localisation du polymorphisme dans le gène et son impact fonctionnel potentiel ... 193
Spécificité des marqueurs PGx de la CsA et du MTX pour la GvHD aiguë ... 194
Autres facteurs impliqués dans l’équation ... 195
Influence de marqueurs PGx sur l’exposition et l’efficacité des immunosuppresseurs en prévention de la GvHD en greffe de CSH ... 196
Quantification simultanée d’immunosuppresseurs communs en greffe de CSH par spectrométrie de masse en tandem ... 196
Évaluation de l’activité IMPDH par spectrométrie de masse dans les lymphocytes de patients greffés de CSH ... 197
Étude prospective et ses perspectives ... 198
Identification d’une signature génique du risque de la GvHD aiguë et de l’efficacité attendue aux immunosuppresseurs ... 199
Complémentarité des approches pour le mieux-être du patient ... 204
Intégration des marqueurs en clinique: une longue route pavée de défis ... 207
Métabolisme du tacrolimus par la voie de glucuronidation ... 208
Conclusion ... 209
Bibliographie ... 211
Annexe ... 241
Étude de l’influence des polymorphismes des gènes de la stéroïdogenèse sur le risque de récidive du cancer de la prostate, ainsi que sur le profil hormonal ... 241
Mise en contexte de l’annexe ... 242
Le cancer de la prostate ... 243
Le rôle des hormones stéroïdiennes sexuelles dans le cancer de la prostate ... 244
Les androgènes ... 244
Les estrogènes ... 245
Les récepteurs hormonaux et corégulateurs ... 247
Polymorphismes des voies de la stéroïdogenèse et le risque du cancer de la prostate ... 249
Résumé ... 253
Importance des polymorphismes génétiques de la voie 5-réductase en cancer de la prostate et leurs associations avec les hormones circulantes et intraprostatiques. ... 253
Résumé ... 281
Influence des variations génétiques des voies métaboliques de l’estradiol sur le risque de progression en cancer de la prostate. ... 281
Résumé ... 318
Identification de patients à haut risque de progression du cancer de la prostate par des marqueurs génétiques liés aux corégulateurs du récepteur aux androgènes. ... 318
Liste des tableaux
Tableau 1. Comparaison des sources de CSH. ... 8 Tableau 2. Résumé des facteurs de risque cliniques associés à la GvHD aiguë et à la mortalité en greffe de
CSH. ... 10 Tableau 3. Classification de la GvHD aiguë. ... 19 Tableau 4. Diagnostic de la GvHD chronique: grades de sévérité. ... 22 Tableau 5. Résumé des études PGx portant sur les voies PK des immunosuppresseurs en greffe de CSH. .. 44 Tableau 6. Variations génétiques associées au risque de GvHD en greffe de CSH. ... 47 Tableau 7. Caractéristiques des deux cohortes étudiées. ... 60 Tableau 8. Caractéristiques de la cohorte prospective en greffe apparentée de CSH. ... 164
Liste des figures
Figure 1. Fréquences des causes de mortalité après la transplantation de CSH. ... 3
Figure 2. Mobilisation et "homing" des CSH à la moelle osseuse. ... 5
Figure 3. Localisation des registres mondiaux de donneurs. ... 15
Figure 4. Classification moderne de la GvHD basée sur le consensus de la National Institute of Health. ... 18
Figure 5. Physiopathologie de la GvHD aiguë. ... 21
Figure 6. Physiopathologie de la GvHD chronique... 23
Figure 7. Mécanisme d'action de la cyclosporine et du tacrolimus. ... 28
Figure 8. Voies impliquées dans la PK et la PD du methotrexate dans la cellule. ... 30
Figure 9. Mécanisme d'action du mycophenolate mofetil. ... 31
Figure 10. Réactions allogéniques induites par les disparités donneurs-receveurs de gènes polymorphes. .... 39
Figure 11. Étude prospective en greffe de CSH. ... 158
Figure 12. Impact de TPMT*2 et *3 sur le mécanisme et la toxicité de l'azathioprine. ... 193
Figure 13. Risque de récurrence du cancer du sein... 201
Figure 14. Courbe cumulative du risque de GvHD aiguë par groupe de risque. ... 203
Figure 15. Courbe cumulative du risque de GvHD chronique par score de risque. ... 204
Figure 16. Prédiction du risque de la GvHD basée sur les niveaux d'IL-7 ... 206
Figure 17. Voies de synthèse des hormones stéroïdiennes. ... 245
Figure 18. Voies métaboliques liées aux estrogènes et à leurs métabolites. ... 247
Liste des abréviations
2-OHE1/E2 2-hydroxyestrone/estradiol 2-MeOE1/E2 2-méthoxyestrone/estradiol
3 ou 5-UTR Région non traduite (ou untranslate region) en 3 ou 5 du gène 3-diol Androstane-3, 17β-diol
3α-diol-3G Androstane-3α, 17β-diol-3-glucuronide 3α-diol-17G Androstane-3α, 17β-diol-17-glucuronide 4-OHE1/E2 4-hydroxyestrone/estradiol
4-MeOE1/E2 4-méthoxyestrone/estradiol
ABC Transporteur ATP Binding Casette
acMPAG Acyl-MPA-glucuronide
AMP Adénosine monophosphate
APS Antigène spécifique à la prostate
AR Récepteur des androgènes
ARNm ARN messager
ASC Aire sous la courbe
ATIC 5-aminoimidazole-4-carboxamide ribonucléotide formyltransférase/IMP cyclohydrolase
C0h Concentration au creux
C2h Concentration 2 heures post-dose
CaP Cancer de la prostate
Cellule NK Cellule tueuse naturelle ou «natural killer »
CEU Résidents de l’Utah originaires de l’Europe du Nord et de l’Ouest
CHU Centre Hospitalier Universitaire
CHUL Centre Hospitalier Université Laval
CIBMTR Center for International Blood Marrow Transplant Research
CMV Cytomégalovirus
COMT Catéchol-O-méthyltransférase
CPA Cellule présentatrice d’antigènes
CsA Cyclosporine
CSH Cellules souches hématopoïétiques
CYP Cytochrome P450
DHEA Déhydroépiandrostérone
DHFR Dihydrofolate réductase
DHT Dyhydrotestostérone
ER ( ou ) Récepteur des estrogènes (alpha ou beta)
Foxp3 Forkhead box P3
FPGS Folypoly-glutamate sunthétase
GGH Glutamyl hydroxylase
G-CSF Facteur stimulant les colonies de granulocytes
GvHD Maladie du greffon contre l’hôte ou « graft-versus-host disease » GVT Effet du greffon versus la tumeur
GWAS Étude d’association pangénomique
HDQ Hôpital Hôtel-Dieu de Québec
HER-2 Facteur de croissance épidermique humain
HLA Antigènes leucocytaires humains
HSD17B 17-hydroxystéroïde déshydrogénase
ICT Irradiation corporelle totale
IL Interleukine
IMPDH Inosine 5-monophosphate déshydrogénase KIR Killer cell Ig-like receptor
LIQ Limite inférieure de quantification
miARN Micro-ARN
miHA Antigène mineur d’histocompatibilité
MMF Mycophenolate mofetil
MPA Acide mycophénolique
MPAG MPA-glucuronide
MTHFR 5,10-méthylenetetrahydrofolate réductase
MTX Méthotrexate
NCCN National Comprehensive Cancer Network
NCOA2 Coactivateur-2 de récepteur nucléaire ou « Nuclear receptor coactivator 2» NFAT Facteur nucléaire des lymphocytes T activés
NIH National Institute of Health
NQO NAD(P)H quinone oxidoréductase
PCR Réaction en chaîne par polymérase ou « Polymerase chain reaction »
PD Pharmacodynamique
PG Polyglutamate
PGx Pharmacogénomique
PK Pharmacocinétique
SIRT1 Sirtuin1 (corépresseur)
SLC Transporteur de soluté
SNP Polymorphisme d’une seule paire de bases
SR Score de récidive
SULT Sulfotransférase
Taco-G Tacrolimus glucuronide
TGF Facteur de croissance de transformation ou « transforming growth factor » Th1 ou Th2 Cellule T auxiliaire de type 1 ou 2
TNF Facteur de nécrose tumorale alpha ou « Tumor necrosis factor alpha »
TNM Classification du stade du cancer selon 3 critères : tumeur, ganglion et métastase
TPMT Thiopurine méthyltransférase
Treg Cellule T régulatrice
TSER Polymorphisme génétique dans une région activatrice du gène TYMS
TYMS Thymidilate synthase
UGT UDP-glucuronosyltransférase
UV Ultraviolet
WBMA World Bone Marrow Association
À mon père, cet homme vaillant, charitable et silencieux,
...qui m’a appris que les gestes bienveillants, posés envers son prochain, valent mieux que des mots qui virevoltent et s’évanouissent,
Remerciements
Et voilà, nous y sommes, l’achèvement de mon doctorat. Ces dernières années resteront gravées dans ma mémoire, et auront été sans l’ombre d’un doute des plus enrichissantes. Une grande réalisation professionnelle, et surtout une belle aventure sur les plans humain et personnel. J’ai eu la chance de côtoyer tous les jours des gens extraordinaires qui ont rendu cette expérience unique. Je vous dois mes plus sincères remerciements pour votre soutien, votre aide et votre amitié.
Particulièrement, je remercie ma directrice, Dre Chantal Guillemette, qui m’a offert cette opportunité unique d’évoluer au sein de son laboratoire, et d’apprendre le beau métier de chercheur. Un immense merci d’avoir cru en moi et en mes capacités, alors que je n’avais aucune expérience en laboratoire à mon arrivée. Je ne pouvais espérer une meilleure mentore, qui par sa passion et son expérience du métier, sa rigueur et sa vaillance au travail, nous pousse à nous dépasser encore et toujours. J’ai réalisé bien plus que ce que j’avais espéré! Je tiens également à remercier Dr Éric Lévesque, mon codirecteur, dont la passion, l’enthousiasme et le positivisme sont contagieux. Merci d’avoir pris tout le temps qu’il fallait pour discuter avec moi, en long et en large, de l’évolution de mes travaux de recherche, et de m’avoir fait confiance. La carrière de clinicien-chercheur n’est pas de tout repos, mais ta porte était toujours ouverte. Motivation assurée lorsqu’on travaille avec toi. Enfin, à vous deux, je tiens à vous exprimer ma reconnaissance la plus sincère pour votre soutien et vos conseils judicieux, tant du point de vue scientifique que personnel.
Également, à mes évaluateurs de thèse les docteurs Ryad Tamouza, Chantale Simard et Jean Lefebvre, je vous remercie d’avoir pris de votre précieux temps pour me lire et commenter mes travaux.
À tous les membres du laboratoire, je vous remercie d’avoir égayé mon quotidien. Une superbe équipe dynamique, talentueuse, passionnée, où l’entraide est omniprésente. Le temps a passé bien vite en votre compagnie, et vous allez tous me manquer beaucoup. À Lyne, merci d’être ce que tu es, une fille authentique, humaine et à l’écoute des autres. Garde ton sourire contagieux et ton professionnalisme. Je vais m’ennuyer de nos dîners remplis d’histoires et de fous rires. Merci aussi d’avoir été là quand j’en avais besoin. Chère Mél (et non pas Mélanie!), je crois sincèrement que cette aventure n’aurait pas été la même sans toi. On a vécu ensemble les hauts et les bas des études aux cycles supérieurs depuis la maitrise, relevé des défis et surtout réalisé de belles choses. Au cours des cinq dernières années, j’ai découvert une fille talentueuse, passionnée,
attentionnée, et une amie. Merci pour tout, tout, tout! Tu as fait la différence pour moi. Joannie, tu es une fille formidable, une organisatrice hors pair, mais surtout une personne de cœur toujours d’agréable compagnie. Je garde particulièrement un beau souvenir de notre séjour à Paris, merci de t’avoir impliquée à 250% dans le projet sans compter tes efforts et tes heures en chambre froide! Et vive le vin, le fromage, la tarte sifflet et les pains au chocolat! À Kimmy, merci d’être venue à ma rescousse pour me montrer les rudiments du laboratoire, de l’extraction d’ARN à la PCR! Tu as été pleine de patience pour moi. Tu m’as prise sous ton aile, et je t’en suis reconnaissante. Au-delà du labo, j’ai apprécié nos multiples discussions sur la vie devant un café, un plat chez St-Hubert ou en prenant une marche à -30°C! Je te souhaite que la vie soit bonne avec toi, tu le mérites. À Isa G, qui a intégré l’équipe à une vitesse phénoménale, je te remercie pour toutes les discussions que nous avons eues et le support que tu m’as offert. Ton sourire et ta joie de vivre font de toi une personne exceptionnelle. Merci de m’avoir incité à prendre soin de moi un peu plus, je tiens encore ma résolution du jour de l’an 2013! Chère Judith (Juju pour les intimes), brillante, talentueuse, à l’écoute des autres, j’ai vraiment apprécié ta présence et nos discussions. Merci de tes encouragements. Aux nouvelles recrues, Anaïs, Guillaume et Alan, venue directement d’Europe, à Sylvia et Yannick, votre arrivée a été rafraichissante. Avec vous, la relève du labo est bien assurée, vous êtes des gens pleins de talents. Anaïs garde ta candeur, ça fait de toi une personne unique qui sème la joie partout où tu passes. Guillaume, mon encyclopédie scientifique préférée, je te souhaite toute la chance que tu mérites professionnellement et personnellement. Continue de travailler aussi fort, ça te mènera loin. Alan, mon sauveur, merci pour ton aide avec les scripts d’extraction, ça va me coûter cher en poutine et en jello! Sylvia, nos conversations quotidiennes en anglais m’ont beaucoup aidée à parfaire mon vocabulaire, je t’en remercie, et j’espère que tu t’accompliras comme tu le souhaites, autant professionnellement que personnellement. Yannick, on se connait depuis peu et je te souhaite tout le succès que tu désires. Tu vas aller loin, j’en suis certaine. Aux anciens boys du labo, Mario, Étienne, Olivier, Vincent et Pierre, merci d’avoir fait « rocker » la place. À Mario, qui s’est impliqué avec tout son cœur auprès des étudiants, je te souhaite la meilleure des chances dans tes projets. À Étienne, tu as le talent de tes ambitions. Tu iras loin, ça ne fait aucun doute pour moi. Tu as la faculté unique d’équilibrer le travail et le divertissement, chanceux! Vincent, toujours plein d’idées et de projets, un gars engagé et impliqué. Bonne chance avec ta belle petite famille. Oli, ce fut un plaisir de te côtoyer et de discuter avec toi, je te souhaite une superbe carrière de pharmacien. Garde ta belle authenticité. Pierre, je salue ton parcours et ton ambition, surtout ne lâche pas, et tu vas atteindre ton but. Douce Christine, perfectionniste, sensible et à l’écoute. Je garde de beaux souvenirs de nos soupers, des cours de boxe et de nos vacances en Gaspésie au sommet du Mont-Albert! À Hugo et Marie-Odile, que j’ai côtoyés malheureusement pas assez longtemps, j’ai beaucoup appris de vous pendant ce court laps de temps. Ce fut un plaisir de vous connaître. Renaud, tu as été un super stagiaire. Je te remercie de ton positivisme, de ta compréhension et de ta gentillesse. Sindy et Luciana, merci pour votre implication respective dans le projet prostate et le projet de
greffe, votre participation et votre rigueur ont fait la différence. Je tiens également à remercier Patrick et Véro qui font un travail remarquable en chimie analytique. Un merci particulier a Patrick pour ta patiente et tes multiples explications à mes nombreuses et répétées questions! La dernière arrivée parmi nous, mais non la moindre, Michèle. Tu es une femme merveilleuse, facile d’approche avec un cœur immense. Merci pour ta disponibilité, tes conseils et tes attentions à mon égard en temps difficiles.
Je tiens à souligner également le plaisir que j’ai eu à côtoyer les membres des autres équipes avec qui je me suis liée d’amitié. Particulièrement l’équipe OB. Mél Verreault avec qui j’ai eu beaucoup de discussions sérieuses et moins sérieuses! Jocelyn à qui je ne pouvais m’empêcher de prendre une frite de son club hebdomadaire. À Sophie, tu es épatante! J’espère avoir la chance de travailler avec toi à nouveau, le monde de la pharmacie est petit! Martin, merci d’être tout simplement toi, franc, fondamentalement gentil et sans tralalala. À Anna, Sarah, Valérie, Louis et Cyril, je vous souhaite beaucoup de succès. À Karine et Simon de l’équipe Durocher, je vous remercie pour votre joie de vivre!
Un merci tout spécial aux gens qui ont participé aux succès de mes travaux de doctorat. Particulièrement, je tiens à souligner l’implication des Drs Félix Couture, Marc Lalancette et Alain Filion, hémato-oncologistes, qui ont réalisé le recrutement des participants à l’HDQ. Aux infirmières de l’équipe de greffe et de recherche, mesdames Stéphanie Dugay, Karine Trudel et Suzanne Vincent, je dis un immense merci pour votre implication. Je tiens à souligner l’aide toute spéciale que m’ont apportée Stéphanie Dugay, Thérésa Jones, et ma chère Diane. Merci à l’équipe de biochimie clinique, mesdames Lucie Ouellet, Sylvie Roy et Cynthia Pichette pour la préparation des plasmas. Un remerciement particulier à tous nos collaborateurs de Paris. Pr Gérard Socié qui a rendu possible l’initiation et la continuité de cette belle et, je l’espère, longue collaboration entre nos deux laboratoires. Merci également aux Drs Ryad Tamouza, Pascale Loiseau et Reem Al-Daccak, de même qu’à toutes leurs équipes, pour leur chaleureux accueil lors de mes séjours à Paris. Cette expérience unique a été tellement enrichissante pour moi, tant professionnellement que personnellement. J’en garderai toujours un excellent souvenir. Je suis privilégiée d’avoir eu cette opportunité exceptionnelle (merci Chantal et Éric!). Remerciements également à l’équipe de la plate-forme de séquençage, Sylvie, Patrick, Nicolas et Anne. Sylvie, je ne te remercierais jamais assez pour ton implication bien au-delà de ce que ton travail l’exigeait. Merci pour tous tes judicieux et précieux conseils. À Valérie-Ève qui m’a tellement simplifié la vie avec les prélèvements, un immense merci pour ton temps et ta disponibilité. À Sun de l’équipe de biostatistiques, j’ai beaucoup appris au fil de nos collaborations. Toujours disponible pour répondre à mes questions.
Enfin, ma famille, mes supporteurs numéro un depuis toujours. Mon père et ma mère qui m’ont appris que l’effort est le prix de la réussite. Merci de m’avoir offert votre soutien inconditionnel dans toutes mes quêtes, et tout au long de mes études doctorales. Je vous remercie de toutes vos attentions à mon égard qui m’ont rendu la vie plus facile et agréable. Carine, ma soeur, ton appui soutenu et tous tes mots d’encouragement m’ont fait du bien. Ryan et Victoria, mes filleuls, vous êtes mes deux rayons de soleil! À Pierre-Luc, mon amoureux, merci pour tes pensées magiques, et surtout de me rappeler qu’il n’y a pas juste le travail qui compte. Ta patiente et tes attentions quotidiennes ont fait toute la différence. Ma famille, je vous aime, je ne vous le dirai jamais assez.
Avant-Propos
Cette thèse, intitulée « Découverte de nouveaux marqueurs pharmacogénomiques de la maladie du greffon contre l’hôte en transplantation de cellules souches hématopoïétiques », présentée à la faculté des études supérieures de l’Université Laval pour l’obtention du grade de Philosophiae Doctor, est rédigée sous forme d’insertion d’articles, sauf pour le Chapitre V. Ce dernier présente en détail l’étude prospective qui est en cours au CHU de Québec, de même que ma contribution et celle de chacun des intervenants principaux du projet. Dans la présente section, je définirai mes contributions pour chacun des articles insérés dans cette thèse, de même que celles des coauteurs.
Le premier article intitulé « Cyclosporin and methotrexate-related pharmacogenomics predictors of acute graft-versus-host disease » (Laverdière et al. 2014), dont je suis la première auteure, est prêt pour publication. Ce projet est le fruit d’une collaboration internationale avec le laboratoire d’immunohistocompatibilité de l’hôpital St Louis de Paris, les médecins-greffeurs de l’Hôtel-Dieu de Québec et notre laboratoire. J’ai contribué à ce projet à différents niveaux. Notamment, j’ai choisi les gènes candidats et j’ai effectué la sélection des polymorphismes qui ont été étudiés chez les participants. Le recrutement des patients de Québec et l’acquisition des données cliniques ont été effectués par les Drs Félix Couture, Alain Filion, Marc Lalancette et Éric Lévesque. J’ai effectué l’extraction de l’ADN génomique pour ces échantillons. Pour ce qui est de la cohorte européenne, Gérard Socié, Pascale Loiseau, Ryad Tamouza, Regis Peffault de Latour, Marie Robin, et Dominique Charron ont rendu possible l’accès à la cohorte de Paris et l’acquisition des données cliniques. J’ai effectué le profilage génétique des participants à Paris. De ce fait, j’ai visité le laboratoire de Paris pour effectuer les analyses génétiques des patients. J’ai coordonné l’aspect organisationnel du projet entre le laboratoire de Paris et le nôtre. J’ai été impliquée dans la mise à jour de la base de données et j’ai contribué aux analyses statistiques, à l’interprétation des résultats, ainsi qu’à la rédaction et la révision du manuscrit. Tous les auteurs ont participé à la révision critique du manuscrit. Ma directrice et mon codirecteur, Chantal Guillemette et Éric Lévesque, ont conceptualisé et supervisé l'étude, effectué l'analyse et l’interprétation des résultats, et contribué à la rédaction et la révision de l’article scientifique. J’estime avoir contribué à 80% des résultats de ce projet.
Le deuxième article intitulé « A liquid chromatography-tandem mass spectrometry (LC-MS/MS) method for monitoring drug exposure in hematopoietic stem cell transplant recipients » (Laverdière et al. 2012), dont je suis première auteure, a été publié dans la revue J Chromatogr B Analyt Technol Biomed Life Sci. (facteur
d’impact : 2,888) en février 2012. Ce manuscrit a été réalisé avec la participation de l’assistant de recherche Patrick Caron, chimiste, qui a développé et validé la méthode d’analyse, et effectué les dosages présentés dans cet article. Il a également participé à la rédaction et la révision du manuscrit. Pour ma part, j’ai effectué la préparation des échantillons, j’ai contribué à l’analyse et l’interprétation des données, ainsi qu’à la rédaction de l’article scientifique. Félix Couture a recruté les patients et fait l’acquisition des données clinique. Les Drs Chantal Guillemette et Éric Lévesque ont conceptualisé et supervisé l’étude, participé à l’analyse et à l’interprétation des données, ainsi qu’à la rédaction et la révision de l’article scientifique. J’estime que ma contribution pour ce projet est d’environ 50%. L'article qui est inséré dans cette thèse est identique à la version qui a été publiée.
Le troisième article intitulé « Liquid chromatography-coupled tandem mass spectrometry based assay to evaluate inosine-5-monophosphate dehydrogenase activity in peripheral blood mononuclear cells from stem cell transplant recipients » (Laverdière et al. 2012), dont je suis première auteure, a été publié dans la revue Anal Chem. (facteur d’impact : 5,856) en janvier 2012. J’ai réalisé la mise au point de l’essai enzymatique pour évaluer l’activité catalytique de l’inosine 5-monophosphate déshydrogénase, préparé les lysats cellulaires à partir des échantillons de sang des patients, et effectué les essais enzymatiques. Patrick Caron a développé et validé la méthode de spectrométrie pour la quantification des composés d’intérêt, et a effectué les dosages présentés dans cette étude. Il a également participé à la rédaction et la révision du manuscrit. J’ai effectué les analyses statistiques et participé à l’interprétation des données, ainsi qu’à la rédaction du manuscrit. Félix Couture a participé au recrutement des patients et à l’acquisition des données. Les Drs Chantal Guillemette et Éric Lévesque ont conceptualisé et supervisé l’étude, participé à l’analyse et à l’interprétation des données, ainsi qu’à la rédaction et la révision de l’article scientifique. Ma contribution à cet article est de 60%. L'article qui est inséré dans cette thèse est identique à la version qui a été publiée.
Le quatrième article intitulé « In vitro investigation of human UDP-glucuronosylltransférase isoforms responsible for tacrolimus glucuronidation : predominant contribution of UGT1A4 » (Laverdière et al. 2011), dont je suis première auteure, a été publié dans la revue DMD (facteur d’impact : 3,733) en juillet 2011. J’ai réalisé les essais enzymatiques décrits dans ce manuscrit. Patrick Caron a effectué tous les dosages des métabolites glucuronides. J’ai participé à l’analyse des données, ainsi qu’à la rédaction du manuscrit. Mario Harvey a effectué une relecture critique du manuscrit. Les Drs Chantal Guillemette et Éric Lévesque ont conceptualisé et supervisé l’étude, participé à l’analyse et à l’interprétation des données, ainsi qu’à la rédaction et la révision de l’article scientifique. J’estime avoir contribué à 70% des résultats pour ce projet.
Les trois articles additionnels suivants sont présentés en annexe de cette thèse.
Le cinquième article intitulé « Importance of 5-reductase polymorphisms on circulating and intraprostatic androgens in prostate cancer » (Lévesque, Laverdière et al. 2014), dont je suis seconde auteure, a été publié dans la revue Clinical Cancer Res. (facteur d’impact : 7,742) en février 2014. Pour cet article, j’ai effectué la majorité des analyses statistiques en collaboration avec Mélanie Rouleau. J’ai généré l’ensemble des tableaux et des figures présentées dans ce manuscrit, et Mélanie Rouleau en a fait la révision. J’ai participé à l’interprétation des résultats, de même qu’à la rédaction de la méthodologie et la révision critique du manuscrit. Patrick Caron et Véronique Turcotte ont effectué l’ensemble des dosages hormonaux par spectrométrie de masse par des méthodes analytiques déjà établies. Tous les patients ont été recrutés à l’Hôtel-Dieu de Québec par les Drs Yves Fradet et Louis Lacombe. Dr Bernard Têtu a fourni les échantillons de tissus humains. Les Drs Chantal Guillemette et Éric Lévesque ont conceptualisé et supervisé l’étude, participé à l’analyse et à l’interprétation des données. Ma contribution à cet article est de 30%. L'article qui est inséré dans cette thèse est identique à la version qui a été publiée.
Le sixième article intitulé « Steroidogenic germline polymorphism predictors of prostate cancer in the estradiol pathway » (Lévesque, Laverdière et al. 2014), dont je suis seconde auteure, a été publié dans la revue Clinical Cancer Res. (facteur d’impact : 7,742) en mars 2014. Pour cet article, les analyses statistiques, les figures et les tableaux ont été effectués par Étienne Audet-Walsh et moi-même. Mélanie Rouleau a contribué aux analyses statistiques et à la révision du tableau pour le volet des hormones. Patrick Caron a effectué l’ensemble des dosages hormonaux par spectrométrie de masse par des méthodes analytiques déjà établies. Les patients ont été recrutés à l’Hôtel-Dieu de Québec par les Drs Yves Fradet et Louis Lacombe. Tous les auteurs ont participé à la révision critique du manuscrit. Les Drs Chantal Guillemette et Éric Lévesque ont conceptualisé et supervisé l’étude, participé à l’analyse et à l’interprétation des données, ainsi qu’à la rédaction et la révision de l’article scientifique. J’estime avoir contribué à 40% des résultats. L'article qui est inséré dans cette thèse est identique à la version qui a été publiée.
Le septième article intitulé « Androgen receptor coregulator polymorphisms identify a subset of patients at high risk of prostate cancer progression » (Laverdière et al. 2014), dont je suis la première auteure, est prêt pour publication. Ma contribution à ce projet, s’est faite à différents niveaux. Notamment, j’ai fait la sélection des polymorphismes à l’étude dans les gènes codant pour les corégulateurs. J’ai participé au génotypage, au maintien de la base de données, aux analyses statistiques et à l’interprétation des résultats. Également, j’ai
participé à la rédaction de la méthodologie, de la discussion et à la conception de tous les tableaux, de même qu’à la révision du manuscrit. Sindy Magnan a participé aux analyses statistiques, à l’interprétation des données, à la conception des tableaux et à la rédaction du manuscrit. Isabelle Gilbert a collaboré aux analyses statistiques. Les patients ont été recrutés à l’Hôtel-Dieu de Québec par l’équipe d’uro-oncologie (Drs Yves Fradet et Louis Lacombe). Tous les auteurs ont participé à la révision critique du manuscrit. Les Drs Chantal Guillemette et Éric Lévesque ont conceptualisé et supervisé l’étude, participé à l’analyse et à l’interprétation des données, ainsi qu’à la rédaction et la révision de l’article scientifique. J’estime avoir contribué à 60% des résultats.
Cette thèse comprend l’introduction où sont discutés les différents thèmes étudiés pendant mes travaux de doctorat. La première partie consiste en une revue de la littérature et à la présentation de la démarche scientifique. La section suivante inclut quatre chapitres, présentant trois articles scientifiques et une description détaillée de l’étude prospective qui est en cours au Centre Hospitalier Universitaire de Québec. Les articles scientifiques sont rédigés en anglais et chacun est précédé d'un résumé en français. La structure de ceux-ci est identique et se présente comme suit : résumé, introduction, matériel et méthodes, résultats, discussion, bibliographie, tableaux et figures. Ces chapitres sont ensuite suivis de la discussion des résultats obtenus, des perspectives du projet et d'une conclusion. Le document se termine par une liste des références citées dans la thèse et d’une annexe. Celle-ci inclut une brève introduction sur le cancer de la prostate et les trois articles supplémentaires auxquels j’ai participé.
Introduction
Donnall Thomas est l’un des pionniers en transplantation de cellules souches hématopoïétiques (CSH). C’est en 1959 qu’il réalisa la toute première greffe de CSH réussie chez l’humain en transplantant deux enfants atteints d’une leucémie de stade avancé. Après irradiation corporelle complète, chacun des enfants a reçu un greffon de moelle osseuse provenant de son jumeau identique. Moins de 15 jours après l’intervention, les deux patients démontraient un retour de leur fonction hématologique et une évolution favorable de la maladie. Cette rémission fut malheureusement de courte durée puisqu’une reprise de la leucémie est survenue sept et 12 semaines après la procédure chez l’un et l’autre des sujets respectivement (Thomas, Lochte et al. 1959). Néanmoins, Dr Thomas fit ainsi la preuve, pour la toute première fois, que cette thérapie était réalisable chez l’humain et, qui plus est, présentait un potentiel clinique curatif. Ses contributions pour l’avancement des connaissances et l’utilisation clinique de la greffe de CSH furent d’ailleurs reconnues par un prix Nobel de la médecine en 1990 (Cosimi 2006).
Cinquante ans plus tard, plus de 50 000 greffes de CSH sont réalisées annuellement dans le monde pour traiter divers cancers et maladies hématologiques non malignes graves. Une augmentation du nombre de greffes réalisées a été notée entre 1990 et 2010 en Europe. En Amérique, selon l’Organisation mondiale de la santé, 19 463 greffes allogéniques de CSH ont été réalisées entre 2006 et 2008, dont 70% pour traiter des leucémies (Gooley, Chien et al. 2010, Gratwohl, Baldomero et al. 2010, Passweg, Baldomero et al. 2012, Gratwohl, Baldomero et al. 2013). Les progrès réalisés au cours de la dernière décennie ont permis d’améliorer l’efficacité et l’innocuité de la greffe de CSH, et ont également favorisé son déploiement à plus large échelle en clinique. Notamment, une meilleure compréhension de la diversité immunologique du système des antigènes leucocytes humains (HLA), de la disponibilité de nouvelles technologies de typage, de la diversification des sources de CSH, et de l’arrivée de nouvelles molécules pharmacologiques dans l’arsenal thérapeutique sont des avancées ayant permis d’améliorer le pronostic des patients après la greffe (Blazar, Murphy et al. 2012, Park and Seo 2012, Passweg, Halter et al. 2012). Bien que cette thérapie ait le potentiel de sauver des vies, elle cause également des complications sérieuses et potentiellement mortelles, dont la maladie du greffon contre l’hôte (GvHD). Cette dernière est fréquente et est l’une des principales barrières limitant le succès de la greffe (Rezvani and Storb 2012).
L’objectif de cette thèse vise à mieux comprendre l’impact de variations génétiques non HLA dans le génome du receveur ou de son donneur sur le risque de GvHD, et la survie du patient après la transplantation de CSH allogénique.
L’hypothèse qui sous-tend mes travaux de doctorat est que la constitution génétique du receveur et de son donneur pour certains gènes non HLA pourrait influencer le résultat clinique de la greffe, en étant associée à une susceptibilité génétique propice à certaines complications. Je me suis prioritairement intéressée aux variations des gènes impliqués dans les voies pharmacocinétiques (PK) et pharmacodynamiques (PD) des immunosuppresseurs. D’une part, la prophylaxie immunosuppressive est essentielle après la greffe pour prévenir la GvHD et, d’autre part, il s’agit d’un facteur facilement modifiable. Ainsi, une meilleure connaissance de la susceptibilité génétique pré-greffe pourrait potentiellement aider à personnaliser davantage la thérapie du patient pour son plus grand bénéfice.
Dans l’introduction, je présente les caractéristiques spécifiques de la greffe allogénique de CSH. Les critères de succès de cette thérapie et les complications allogéniques qui lui sont inhérentes sont notamment abordés. Un accent est également mis sur les stratégies permettant d’optimiser la thérapie immunosuppressive utilisée en prévention de ces complications. La démarche scientifique est également présentée en détail. Les chapitres II à VI portent sur l’étude du rôle de polymorphismes génétiques des voies PK et PD des immunosuppresseurs sur le pronostic du patient, particulièrement dans le contexte de la GvHD. Le chapitre II documente l’influence des variations de 20 gènes candidats impliqués dans l’exposition et l’efficacité de la cyclosporine (CsA), du tacrolimus et du méthotrexate (MTX) en lien avec la GvHD. Les chapitres III et IV présentent deux approches analytiques visant à: 1) quantifier simultanément l’exposition aux immunosuppresseurs fréquemment utilisés après la greffe, et 2) évaluer l’efficacité du mycophenolate mofetil (MMF) à sa cible thérapeutique. Au chapitre V, sont présentés les détails de l’étude initiée en greffe de CSH au Centre Hospitalier Universitaire (CHU) de Québec. Cette étude permettra d’étudier prospectivement les liens entre différents marqueurs génétiques, biologiques et cliniques. Le chapitre VI présente l’étude in vitro du métabolisme du tacrolimus par la voie de glucuronidation. Au dernier chapitre, je conclus en discutant des résultats obtenus dans le cadre de ma thèse. Les perspectives et les avenues futures découlant de mes travaux seront présentées.
1. Greffe allogénique de CSH et ses indications
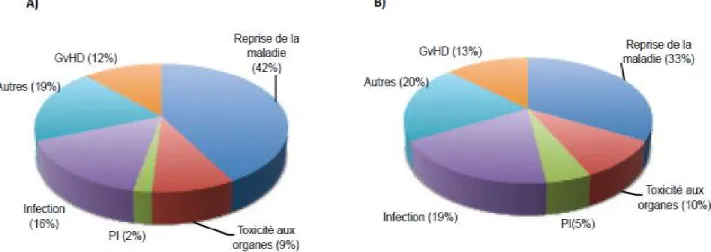
Dans le cadre de mes travaux de doctorat, je me suis consacrée à la greffe allogénique (allogreffe), plus particulièrement dans le contexte de cancers hématologiques. Ce type de greffe est utilisé pour le traitement de maladies hématologiques sévères malignes et non malignes. La greffe vise à remplacer le système hématologique du patient par des CSH provenant d’une autre personne. Dans près de 85% des cas, l’allogreffe est réalisée chez des patients atteints d’un cancer hématologique (Gratwohl, Baldomero et al. 2013). D’un point de vue mondial, la leucémie myéloïde aiguë est le principal cancer justifiant le recours à la greffe (32% des cas), suivi de la leucémie lymphoïde aiguë (16%), du syndrome myélodysplasique (16%) et du lymphome non hodgkinien (9%) (von Andrian and Mackay 2000, Gratwohl, Baldomero et al. 2013, Hahn, McCarthy et al. 2013). Dans ce contexte spécifique, le greffon a pour objectifs non seulement de rétablir les fonctions médullaires détruites par la chimiothérapie, mais également d’éradiquer les cellules cancéreuses résiduelles ayant survécu à la chimiothérapie. Cette réaction allogénique bénéfique, nommée l’effet du greffon versus la tumeur (GVT), est induite par les cellules immunocompétentes contenues dans le greffon (Shlomchik 2007, Gyurkocza, Rezvani et al. 2010). La cause principale de décès après la greffe est la reprise de la maladie maligne sous-jacente qui survient chez plus du tiers des patients. Le stade de la maladie au moment de la greffe est l’un des importants facteurs associés au risque de reprise de la maladie maligne. Les causes de mortalité découlant de la greffe et leurs prévalences moyennes sont résumées à la figure 1 (Barrett and Battiwalla 2010).
Figure 1. Fréquences des causes de mortalité après la transplantation de CSH (2002-2007).
A) Greffe familiale identique, et B) greffe non apparentée. PI, Pneumonie interstielle. Adaptée de Barrett et collaborateurs 2010.
2. Cellules souches hématopoïétiques
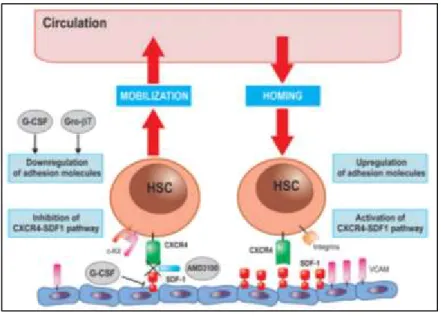
Le fondement de la transplantation de CSH repose sur les faits suivants : 1) ces cellules sont autorenouvelables et multipotentes, et 2) elle sont capables de migrer vers leur environnement dédié (niche) grâce à un processus dynamique d’autoguidage. Une fois perfusées au patient, les CSH du donneur ont la capacité d’aller occuper la moelle osseuse du receveur ("phénomène de homing"), de proliférer et de rétablir les fonctions médullaires en se différenciant en toutes les lignées sanguines (Suarez-Alvarez, Lopez-Vazquez et al. 2012, Servais, Beguin et al. 2013). Un régime de conditionnement préparatoire est requis avant la greffe afin de permettre une prise efficace du greffon. Ce régime à base de chimiothérapie ou d’irradiation corporelle totale (ICT) permet d’éradiquer la moelle osseuse du patient, et rend ainsi la niche disponible pour les CSH du donneur. L’acceptation et le maintien de ce greffon sont dépendants du niveau de tolérance de l’hôte envers les cellules du greffon (réaction allogénique) (Khouri, Keating et al. 1998, Slavin, Nagler et al. 1998, Servais, Beguin et al. 2013). La capacité des cellules immunitaires du greffon à détruire les cellules résiduelles de l’hôte joue également un rôle dans la survie de ce greffon (Locatelli, Lucarelli et al. 2014). Les CSH résident dans deux types d’environnement spécifique, soit la niche principale ostéoblastique ou la niche vasculaire secondaire. Dans la moelle osseuse, les cellules sont en quiescence pour l’autorenouvèlement. La niche vasculaire constitue quant à elle un réservoir de cellules souches activées capables de proliférer et de se mobiliser rapidement aux sites de blessures. L’équilibre entre les processus d’autorenouvèlement et de différenciation est soumis à un contrôle fin s’opérant entre la CSH et son environnement dédié. Également, la localisation des CSH entre les deux niches est dynamique et bidirectionnelle. En effet, les CSH ont la capacité de quitter la niche ostéoblastique et de voyager dans la circulation sanguine vers les tissus périphériques et la niche endovasculaire. Elles peuvent également quitter la périphérie pour retourner à la moelle osseuse (Suarez-Alvarez, Lopez-Vazquez et al. 2012). Cette caractéristique est d’ailleurs mise à profit pour faciliter la collecte des CSH du donneur. Grâce à des approches pharmacologiques, il est possible de favoriser la mobilisation des cellules de la moelle vers le sang périphérique. Ce processus complexe fait intervenir une multitude de molécules, telles des chimiokines, des facteurs de croissance, des enzymes protéolytiques, des molécules d’adhésion et de signalisation agissant de concert localement ou de façon systémique. Particulièrement, l’axe SDF-1 (CXCL12)/CXCR4 est très important pour réguler la mobilisation et le maintien des CSH à la niche en exerçant un gradient chimioattractif sur les cellules. La molécule d’adhésion VCAM-1 et son récepteur 4ß1, la tyrosine-kinase c-KIT et son récepteur CD117, de même que le plasminogène (précurseur de la protéase plasmine) sont des exemples d’autres molécules impliquées dans ce processus (Figure 2) (Sahin and Buitenhuis 2012, Alvarez, Carrillo et al. 2013).
Figure 2. Mobilisation et "homing" des CSH à la moelle osseuse.
Ces deux phénomènes font intervenir des processus opposés, mais mettant en jeu les mêmes molécules. La diminution de l’expression des molécules d’adhésion et de la chimiokine SDF-1 promeut la mobilisation des CSH vers le sang périphérique. Inversement, les CSH qui expriment le récepteur membranaire CXCR4 sont attirées vers la niche ostéblastique exprimant la chimiokine SDF-1. La cytokine G-CSF favorise la mobilisation des CSH vers la périphérie en : 1) induisant la libération de protéases menant à la diminution des molécules d’adhésion, et 2) en diminuant l’expression en ARNm de SDF-1. Tirée de Suarez-Alvarez B. 2012
La reprise de la fonction hématologique est attendue dans les 14 à 30 jours après la greffe, selon la source de CSH. La prise du greffon est confirmée lorsque, pour trois jours consécutifs, les neutrophiles sont >0.5 x 109/L et les plaquettes >20 x 109/L en l’absence de transfusions sanguines. Toutefois, cette reprise est progressive et la chronologie de repopulation des différents types cellulaires est variable (Rocha, Labopin et al. 2004, Seggewiss and Einsele 2010). Par exemple, les neutrophiles, les plaquettes et les cellules tueuses naturelles (cellule NK) récupèrent en quelques semaines, alors que les cellules B et T récupèrent en quelques mois ou années (Marie-Cardine, Divay et al. 2008, Bosch, Khan et al. 2012, Perales and van den Brink 2012). Également, la vitesse à laquelle ce processus survient est influencée par plusieurs facteurs, dont l’âge du patient, l’intensité de la chimiothérapie, l’occurrence de la GvHD, la présence de disparités géniques entre le donneur et le receveur, la prophylaxie préventive et la constitution du greffon (Marie-Cardine, Divay et al. 2008, Perales and van den Brink 2012). Durant les premiers mois après la greffe, on observe la coexistence des cellules résiduelles du receveur (lymphocytes T et cellules présentatrices d’antigènes, CPA) et des cellules du donneur. Progressivement, un chimérisme s’opère, c’est-à-dire que les cellules du donneur
éliminent les cellules résiduelles du patient et, par la même occasion, les cellules cancéreuses. Dans le cas des maladies malignes, un chimérisme complet est souhaitable. Parfois, seulement un chimérisme mixte sera possible. Dans ce cas, les cellules de l’hôte persistent et représentent de 5 à 95% des cellules sanguines totales (Barrett 2006, Locatelli, Lucarelli et al. 2014). Cette situation survient particulièrement lors de l’utilisation d’un conditionnement à intensité réduite. Toutefois, un chimérisme partiel peut être acceptable dans certaines situations cliniques. Par exemple, en traitement de la thalassémie sévère, la coexistence stable (2 ans et plus) des cellules du donneur et du receveur peut suffire à améliorer significativement les symptômes du patient et empêcher la reprise de la maladie (Andreani, Nesci et al. 2000, Andreani, Testi et al. 2008).
2.1 Sources de CSH
Pendant plus de 20 ans, la moelle osseuse a été la seule source de CSH disponible. C’est grâce à la découverte des CSH circulantes dans les années 60 qu’on a pu diversifier la provenance du greffon. Toutefois, ce n’est que vers la fin de 1980 que ces cellules ont pu être utilisées concrètement en clinique de greffe. Cette avancée a été possible grâce au développement des technologies d’aphérèse et à la découverte de molécules capables de mobiliser les CSH dans le sang périphérique. Par la suite, l’utilisation de cette source de cellules a rapidement gagné en popularité et est maintenant le type de greffon préféré dans 75% des greffes (Korbling and Freireich 2011). La découverte des CSH dans le sang de cordon ombilical est quant à elle survenue en 1978, ce qui a permis neuf ans plus tard de réaliser avec succès la première greffe mondiale de sang de cordon chez un enfant atteint d’anémie de Fanconi (Cheuk 2013). Chacune de ces trois sources de CSH possède ses avantages et ses inconvénients (Tableau 1). Également, des facteurs comme l’intensité du conditionnement, les manipulations du greffon (ex : déplétion des lymphocytes T) et la thérapie immunosuppressive ont un impact sur les risques et les bénéfices attendus avec chacune des sources. Le choix du type de greffon doit notamment tenir compte de la disponibilité du donneur, de l’âge du patient et de sa condition clinique (Cheuk 2013). Aucune évidence ne démontre la supériorité de l’une ou l’autre des sources de CSH pour ce qui est de la survie globale des patients (S.C.T.C.G 2005, Brunstein, Setubal et al. 2007, Bittencourt, Lopes et al. 2009, Friedrichs, Tichelli et al. 2010, Chen, Xu et al. 2013).
2.1.1 Moelle osseuse
La moelle osseuse est une source riche en cellules souches et est obtenue par une ponction intra-osseuse effectuée sous anesthésie générale ou épidurale. Le prélèvement s’effectue au niveau de la crête iliaque puisqu’il s’agit de l’os contenant le plus de moelle osseuse. Dans certains cas, un prélèvement au niveau du
sternum est possible. De 500 à 1000 millilitres de moelle sont habituellement prélevés chez l’adulte. La durée de la procédure varie entre une à deux heures et requiert une hospitalisation de 24 heures. L’anesthésie et la douleur induite par la méthode de prélèvement sont les deux inconvénients principaux pour le donneur (http:/www.chuq.qc.ca/fr/les_soins/cancerologie/greffe_moelle_osseuse, http//www.cancer.ca/en/cancer- information/diagnosis-and-treatment/stem-cell-transplant/). En ce qui a trait à la vitesse de la reprise hématologique et à la GvHD, la moelle osseuse offre un profil intermédiaire de risque comparativement aux deux autres sources de CSH, soit les CSH du sang périphérique et du sang de cordon ombilical. Également, advenant une incompatibilité sanguine (ABO) entre le donneur et le receveur, des manipulations du greffon peuvent être requises avant son injection pour diminuer son contenu en globules rouges (Cheuk 2013).
2.1.2 Sang périphérique
Le don de CSH à partir du sang périphérique s’effectue en clinique externe et ne requiert pas d’anesthésie. Les CSH sont prélevées par aphérèse. Cette procédure consiste à faire circuler le sang du donneur dans un appareil qui récolte les CSH (cellules CD34+) et retourne ensuite le sang au donneur. La procédure prend de trois à quatre heures et peut être répétée quotidiennement jusqu’à cinq jours consécutifs, afin de récolter une quantité suffisante de CSH. Les effets indésirables les plus fréquents pendant la collecte sont des frissons, des étourdissements, des picotements ou des crampes (http://www.hema-quebec .qc.ca/userfiles/file/ media/francais/publications/depcelsouche_potentiel.pdf, http:/www.chuq.qc.ca/fr/les_soins/cancerologie/greffe _moelle_osseuse, http//www.cancer.ca/en/cancer-information/diagnosis-and-treatment/stem-cell-transplant/). La quantité de CSH en circulation dans le sang est très faible en condition physiologique (0,01-0,05%) (Suarez-Alvarez, Lopez-Vazquez et al. 2012). C’est pourquoi le donneur reçoit un agent permettant de mobiliser les cellules souches vers le sang périphérique avant de faire son don. La molécule pharmacologique la plus utilisée est le filgrastim (Neupogen) qui est une forme recombinante du facteur stimulant les colonies de granulocytes (G-CSF). Le traitement consiste en une injection journalière sous-cutanée à débuter quatre jours avant la première aphérèse et à poursuivre jusqu’à la fin de la collecte de CSH (Suarez-Alvarez, Lopez-Vazquez et al. 2012, Society 2014). Une des particularités de ce type de greffon est son contenu dix fois plus élevé en CSH et de dix à 30 fois plus important en leucocytes, comparativement à la moelle osseuse (Heimfeld 2003). Il en résulte une reconstitution hématologique plus rapide et un potentiel moindre de rejet. En contrepartie, une augmentation du risque de GvHD est observée (Bittencourt, Lopes et al. 2009, Locatelli, Lucarelli et al. 2014).
2.1.3 Sang de cordon ombilical
Les cellules souches contenues dans le sang de cordon sont prélevées après l’accouchement et sont congelées pour un usage futur. Cette procédure est sans danger pour l’enfant et la mère. La principale limite de cette source de CSH découle du faible volume de sang dans le cordon. De ce fait, un nombre fixe et limité de CSH peut être récolté et perfusé au patient. On réserve habituellement ce type de transplantation aux enfants ou aux adultes de petite taille chez qui la dose cible de CSH peut être atteinte (http://www.hema-quebec.qc.ca/userfiles/file/media/francais/publications/depcelsouche_potentiel.pdf, http//www.cancer.ca/en/ cancer-information/diagnosis-and-treatment/stem-cell-transplant/). La quantité totale plus faible de cellules perfusées au patient est associée à un risque accru d’échec de la prise du greffon (5-10%), au ralentissement de la reprise hématologique, et secondairement à une incidence plus élevée d’infections (Anasetti, Aversa et al. 2012). Pour les patients de plus grande taille sans donneur compatible, une double greffe de sang de cordon peut être tentée (greffon provenant de deux donneurs distincts) (Brunstein, Gutman et al. 2010). En contrepartie, ce type de greffe présente les avantages suivants: le greffon est rapidement accessible une fois identifié, et la permissivité des discordances HLA est plus grande (Anasetti, Aversa et al. 2012). L’usage de cette source de CSH est relativement récent chez l’adulte. Son utilisation chez l’enfant est quant à elle courante et appuyée par une expérience clinique plus longue (Brunstein, Setubal et al. 2007).
Tableau 1. Comparaison des sources de CSH.
Variables Moelle osseuse Sang périphérique Sang de cordon
Intervalle entre le début de la recherche du
donneur et la greffe 3-6 mois 3-6 mois 2-4 semaines
Volume total du greffon 500-1000 mL 50-300 mL 25-150 mL
Dose minimale de cellules requises pour la greffe 2 x108/kg cellules
nucléées 2 x10
6/kg CD34+ 2 x107/kg cellules nucléées
Contenu en globules rouges Élevé Élevé Faible
Doses supplémentaires possibles Oui Oui Non
Reprise du greffon 21 jours 14 jours 30 jours
Reprise immunologique Plus rapide Plus rapide Plus lente
Risque de GvHD Intermédiaire Plus élevé Plus faible
Risque d’infections en post-greffe Plus faible Plus faible Plus élevé
Risque de transmission virale Plus élevé Plus faible Plus faible
Risque de reprise de la maladie Plus élevé Plus faible Plus élevé
Autres Collecte sous anesthésie G-CSF avant la
collecte Permissivité HLA Quantité limité de CSH Congélation des CSH Adapté de Cheuk D. 2013
3. Caractéristiques cliniques liées aux succès de la greffe
Différents facteurs cliniques en lien avec le donneur, le receveur ou la greffe ont été associés au pronostic du patient. L’âge du receveur et du donneur au moment de la greffe, le stade de la maladie, le statut fonctionnel du patient, l’indication de la greffe, la compatibilité donneur-receveur pour les HLA, la compatibilité du sexe, l’intensité du conditionnement, la source de CSH et le choix de la thérapie immunosuppressive ont été identifiés comme des éléments contribuant au succès de la greffe. L’importance de ces facteurs diffère selon le résultat clinique évalué et le type de greffe allogénique (Ratanatharathorn, Nash et al. 1998, Lee, Klein et al. 2007, Hahn, McCarthy et al. 2008, Flowers, Inamoto et al. 2011, Jagasia, Arora et al. 2012, Furst, Muller et al. 2013, Harris, Ferrara et al. 2013).
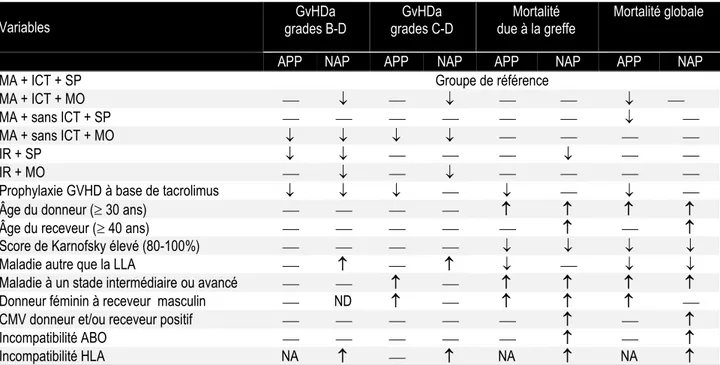
Notamment, une étude d’envergure récente a fait le point sur l’importance de ces facteurs pour le pronostic clinique des patients, et ce pour différents types de donneurs. Ainsi, les liens qui unissent ces facteurs au risque de GvHD aiguë et à la mortalité ont été étudiés dans une population adulte d’allogreffes apparentées et non apparentées. Cette étude incluait 5561 patients cancéreux figurant au registre du Center for International Blood Marrow Transplant Reasearch (CIBMTR) de 1999 à 2005. Le CIBMTR est une organisation de recherche regroupant plus de 450 centres de transplantation à travers le monde. Les résultats de cette étude sont résumés au tableau 2 (Jagasia, Arora et al. 2012).
Tableau 2. Résumé des facteurs de risque cliniques associés à la GvHD aiguë et à la mortalité en greffe de CSH.
APP, donneurs apparentés (n=3151) ; NAP, donneurs non apparentés (n=2370) ; CMV, statut cytomégalovirus ; ICT, irradiation corporelle totale ; IR, conditionnement à intensité réduite ; LLA, leucémie lymphoïde aiguë ; MA,
conditionnement myéloablatif ; MO, greffe de moelle osseuse ; NA, non applicable ; ND, non disponible ; SP, greffe de CSH mobilisées du sang périphérique;. GvHDa, GvHD aiguë de grades A à D, le grade A étant l’absence de GvHD et le grade D la forme la plus sévère de la maladie.
Score de Karnofsky, statut de performance (bien-être et capacité à réaliser les activités de la vie quotidienne) des patients atteints du cancer (100% = parfaite santé et 0= décés).
Régime de conditionnement pré-greffe, MA : busulfan 9mg/kg avec mephalen 150mg/m2 ou ICT 5 Gy, et IR : toutes les autres combinaisons sont considérées comme à intensité réduite.
Compatibilité : HLA, déterminée par génotypage de haute résolution des allèles HLA-A*, -B*, -C* et –DRB1* ; ABO, système standard de classification des groupes sanguins basé sur la présence des antigènes A et B à la surface des globules rouges (groupe O = absence des antigènes A et B).
(augmentation) ou (diminution) du risque du résultat clinique (GvHD, mort) associé à un facteur clinique donné; aucune association. Adapté de Jagasia et collaborateurs 2012.
Variables grades B-D GvHDa
GvHDa grades C-D
Mortalité due à la greffe
Mortalité globale
APP NAP APP NAP APP NAP APP NAP
MA + ICT + SP Groupe de référence
MA + ICT + MO
MA + sans ICT + SP
MA + sans ICT + MO
IR + SP
IR + MO
Prophylaxie GVHD à base de tacrolimus
Âge du donneur ( 30 ans)
Âge du receveur ( 40 ans)
Score de Karnofsky élevé (80-100%)
Maladie autre que la LLA
Maladie à un stade intermédiaire ou avancé
Donneur féminin à receveur masculin ND
CMV donneur et/ou receveur positif
Incompatibilité ABO
3.1 Histocompatibilité de la greffe
Du point de vue de l’histocompatibilité, la greffe allogénique est plus complexe que la greffe autologue où le patient reçoit ses propres CSH. Par surcroît, l’importance de la compatibilité HLA est d’autant plus critique en greffe de CSH par rapport à la greffe d’organes solides. En effet, la transplantation de CSH possède une immunobiologie unique qui se distingue du fait que le phénomène de rejet est bidirectionnel. D’une part, l’hôte peut rejeter le greffon et, de l’autre, les cellules allogéniques du greffon peuvent attaquer les tissus de l’hôte. Ce dernier phénomène, connu sous le nom GvHD, sera présenté plus amplement dans un chapitre suivant. Également, par opposition à la greffe d’organes solides où l’organe greffé contient peu de cellules immunocompétentes, le greffon de CSH est constitué à la fois de CSH et de cellules immunitaires du donneur (Shlomchik 2007, Ferrara, Levine et al. 2009) .
3.1.1 Types de donneurs allogéniques
L’histocompatibilité entre le receveur et le donneur est l’un des déterminants majeurs du succès de la greffe, particulièrement pour la prise du greffon, la rapidité de la reprise hématologique, la récurrence de la maladie maligne sous-jacente, le risque de GvHD et la survie (Furst, Muller et al. 2013). En première intention, on privilégie l’utilisation d’un greffon provenant d’un donneur de la fratrie HLA compatible à un donneur non apparenté (Saber, Opie et al. 2012). Partageant le même patrimoine génétique, les chances de trouver un frère ou une sœur haplo-génoidentique pour les HLA sont de 25%. Ainsi, la fratrie est un bassin facilement accessible de donneurs potentiellement compatibles pouvant permettre de réaliser rapidement la greffe. Cet aspect revêt une importance particulière étant donné qu’une augmentation du délai d’attente pour procéder à la greffe a un impact négatif sur le pronostic clinique du patient. Notamment, l’attente prolongée augmente le risque de mortalité, diminue la survie sans reprise de la maladie et peut mener à une détérioration clinique du patient le rendant inapte à la greffe (Frassoni, Labopin et al. 2000, Craddock, Labopin et al. 2011). Le terme greffe syngénique (génétiquement identique) est utilisé pour désigner une greffe entre des jumeaux identiques.
En l’absence d’un donneur de la fratrie haplo-identique, les alternatives possibles sont les suivantes: donneur non apparenté HLA compatible, donneur familial partiellement compatible ou une greffe de sang de cordon. Le recours à un donneur non apparenté qui a une incompatibilité pour un des locus HLA principaux (HLA-A, -C, ou –DRB1) peut être envisagé, quoique cette option offre un pronostic moins favorable (Fernandez-Vina, Klein et al. 2013). Le donneur compatible non apparenté est une alternative intéressante permettant d’espérer une