Irisine, adipokines et résistance à l’insuline
Mémoire
Claire Huth
Maîtrise en kinésiologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Claire Huth, 2015
Résumé
La résistance à l’insuline et l’obésité sont des sujets d’intérêt majeur de la recherche. Le muscle squelettique, étant le site principal de la captation insulinodépendante du glucose, est une cible d’intervention privilégiée dans la lutte contre cette dysfonction métabolique. L’interaction entre le tissu adipeux et le muscle squelettique, par le biais des myokines et des adipokines, joue un rôle dans cette captation insulinodépendante du glucose. Le sujet de ce mémoire porte sur l’étude de l’irisine et de deux adipokines, la leptine et l’adiponectine, et leur lien avec la résistance à l’insuline. Les travaux ont été réalisés chez des hommes non diabétiques. Les résultats ont montré que des niveaux circulants élevés d’irisine sont reliés à un profil métabolique détérioré et que la santé du tissu adipeux est un prédicteur de la sensibilité à l’insuline plus puissant que l’obésité abdominale.
Abstract
Insulin resistance and obesity are areas of intense research. Skeletal muscle, as the major site of insulin-mediated glucose uptake, is major target in the search for solutions against this metabolic dysfunction. The interaction between adipose tissue and skeletal muscle, through myokines and adipokines, plays a role in insulin-mediated glucose uptake. The subject of this thesis focuses on the study of irisin and two adipokines, leptin and adiponectin, and their relationship with insulin resistance, in middle aged non-diabetic men. Results showed that high levels of circulating irisin are associated to a deteriorated metabolic profile, and that an adipose tissue health secretion profile is a more powerful predictor of insulin sensitivity than abdominal obesity.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations ... xvii
Remerciements ... xxi
Avant-propos ... xxiii
Chapitre 1. Introduction générale ... 1
Chapitre 2. Revue de la littérature ... 5
2.1. L’obésité, la résistance à l’insuline et la condition physique ... 5
2.1.1. L’obésité ... 5
2.1.2. L’intolérance au glucose ... 13
2.1.3. La résistance à l’insuline ... 14
2.1.4. Le lien entre l’obésité et la résistance à l’insuline ... 15
2.1.5. Le lien entre la sensibilité à l’insuline et le « fitness » ... 16
2.1.6. Le tissu adipeux et le muscle squelettique: organes sécrétoires ... 17
2.2. Irisine ... 19
2.2.1. Définition ... 19
2.2.2. Localisation ... 20
2.2.3. Les niveaux circulants d’irisine ... 21
2.2.4. Les actions potentielles de l’irisine ... 22
2.2.5. Relation avec la résistance à l’insuline ... 22
2.3. Adiponectine ... 23
2.3.2. Niveaux circulants ... 23
2.3.3. Rôles ... 24
2.3.4. Relation avec la sensibilité à l’insuline ... 24
2.4. Leptine ... 27
2.4.1. Définition ... 27
2.4.2. Niveaux circulants ... 27
2.4.3. Rôles ... 28
2.4.4. Relation avec la résistance à l’insuline ... 28
2.5. Adiposopathie ... 31
2.5.1. Définition et concept de l’adiposopathie ... 31
2.5.2. Outils diagnostic : le rapport adiponectine : leptine ... 31
2.5.3. Relation avec la résistance à l’insuline ... 32
Chapitre 3. Questions de recherche ... 35
Chapitre 4. Irisin is more strongly predicted by muscle oxidative potential than adiposity in non-diabetic men. 37 4.1. Résumé ... 38
4.2. Abstract ... 39
4.3. Introduction ... 40
4.4. Materials and Methods ... 42
4.5. Results ... 46
4.6. Discussion ... 51
4.7. Acknowledgments ... 54
4.8. References ... 55
Chapitre 5. Fitness and adiposopathy are better predictors of insulin sensitivity than adiposity or abdominal obesity in middle-aged non-diabetic men. ... 59
5.1. Résumé ... 60
5.2. Abstract ... 61
5.4. Materials and Methods ... 64 5.5. Results ... 67 5.6. Discussion ... 72 5.7. Conclusion ... 75 5.8. Acknowledgments ... 76 5.9. References ... 77 Chapitre 6. Discussion ... 81 Chapitre 7. Conclusion ... 83 Bibliographie ... 85 ANNEXE 1 ... 99 ANNEXE 2 ... 101 ANNEXE 3 ... 103 ANNEXE 4 ... 105
Liste des tableaux
Tableau 2-1 : La classification selon l’OMS de l’insuffisance pondérale, du surpoids et de l’obésité chez
l’adulte en fonction de l’IMC. ... 6
Tableau 2-2 : Classification du risque de maladies cardiovasculaires, du diabète de type 2 et d’hypertension artérielle en fonction du tour de taille. ... 7
Table 4-1 : Physical characteristics, fitness, insulin sensitivity and vastus lateralis enzyme activities of the subjects ... 46
Table 4-2: Plasma profile of subjects (n=53) ... 47
Table 4-3: Pearson correlations (r values) between anthropometric measures, fitness, insulin sensitivity, and adipokines with circulating irisin levels. n=35 to 53; †, p<0.05; *, p<0.01. ... 48
Table 4-4: Multiple regression modelling of circulating irisin levels ... 49
Table 4-5: Effects of weight loss in glucose-intolerant subjects (n=8) ... 50
Tableau 5-1 : Physical characteristics, fitness, and insulin sensitivity of the subjects ... 67
Tableau 5-2 : Plasma profile of subjects. ... 68
Tableau 5-3 : Pearson correlations (r values) between anthropometric measures, fitness, insulin sensitivity and plasma inflammatory markers. *, p<0.01 ... 69
Tableau 5-4 : Pearson correlations (r values) between anthropometric measures, fitness, and insulin sensitivity with plasma adipokines and the adiponectin/leptin ratio. *, p<0.01 ... 70
Tableau 5-5 : Multiple regression modelling of insulin sensitivity ... 70
Liste des figures
Figure 1-1 : Interaction entre le tissu adipeux et le muscle squelettique ... 2 Figure 2-1 : Localisation des différents dépôts adipeux Lee, Wu et al. (2013). Présentation des dépôts: superficiel ou sous-cutané « superficial », intra péritonéal ou omental « omental » et rétro-péritonéal ou viscéral « mesenteric, retroperitoneal ». ... 8 Figure 2-2 : Influence du tissu adipeux et de quelques adipokines sur l’organismeLee, Wu et al. (2013) ... 9 Figure 2-3 : Origines des adipocytes blanc, beige et brun ... 11 Figure 2-4 : Conséquence de l’accumulation des lipides intramyocellulaires sur la cascade de réactions à l’insuline. ... 16 Figure 2-5 : Fonction sécrétoire du muscle squelettique. ... 19 Figure 2-6 : Présentation de l’irisine, sa sécrétion dans le muscle squelettique et son action sur l’adipocyte blanc ... 20 Figure 2-7 : Relation entre l’adiponectine et la sensibilité à l’insuline ... 26 Figure 2-8 : L’action de la leptine sur le métabolisme des lipides intramyocellulaires ... 30 Figure 2-9 : L’adiposopathie et la genèse du diabète de type 2, de l’athérosclérose et d’une dyslipidémie. .... 33
Liste des équations
Équation 2-1 : Formule de l'IMC. ... 6 Équation 2-2 : Formule qui permet d’obtenir la densité du corps ... 8
Liste des abréviations
ACC: acétyl Coenzyme A carboxylaseAcyl-CoA: acyl-Coenzyme A Acetyl-CoA: acétyl-Coenzyme A
AMPK: “adenosine monophosphate activated protein kinase k”
APPL1: “adaptator protein containing a ph (pleckstrin homology) domain 1” ARNm: acide ribonucléique messager
Arp46: “endoplasmic reticulum protein of 46 kDa” bAT: tissu adipeux beige (“beige adipose tissue”) BAT: tissu adipeux brun (“brown adipose tissue”) CaMKK: “calmodulin-dependant protein kinase kinase” COX: cytochrome oxydase
CPT1: carnitine palmitoyltransférase 1 CS: citrate synthase
DAGs: diacylglycérols
EDTA: acide éthylène diamine tétraacétique
Ero1-La : « endoplasmic reticulum oxidoreductase » FNDC5: “fibronectin type III domain-containing protein 5” GLUT: « glucose transporter »
HADH: hydroxyle Coenzyme A deshydrogénase
HOMA-IR: “homeostasis model assessement of insulin resistance” ICH: « International Conference on Harmonization »
IL6: interleukine 6
IMC: indice de masse corporelle IRS-1: « insulin receptor substrate-1 » kDa: kilo Dalton
LIME: Lipides IntraMyocellulaires et leurs Effets Malonyl-CoA: malonyl-Coenzyme A
MYF5: “myogenic factor 5” NRF1: “nuclear respiratory factor” ob/ob: gène obèse/obèse
OGTT: « oral glucose tolerance test » OMS: Organisation Mondiale de la Santé
PEPS: Pavillon de l’Éducation Physique et des Sports
PGC-1α: “peroxisome proliferator-activated receptor gamma coactivator 1-alpha” PKC: protéine kinase C
PPARα: “peroxisome proliferator-activated receptor α” PPARϒ: “peroxisome proliferator-activated receptor ϒ” RACK1: “receptor for activated protein kinase C1” TFAM: “mitochondrial transcription factor A” TNF-α: “tumor necrosis factor – α”
UCP1: « uncoupling protein 1 »
UCP3: « mitochondrial uncoupling protein 3 » VO2max: la consommation maximale d'oxygène
WAT: tissu adipeux blanc (“white adipose tissue”) WHO: “World Health Organisation”
Je dédie ce mémoire à tous ceux qui ont cru en moi pendant cette belle aventure ainsi qu’à ceux qui le liront.
Remerciements
Je tiens tout d'abord à remercier mon directeur de maitrise, Denis Joanisse, sans qui cette belle aventure n'aurait pas été possible. Merci pour votre patience et votre confiance, on sait bien que de nous deux vous êtes celui qui a le plus confiance en moi et en mes capacités. Votre porte a toujours été ouverte que ce soit pour refaire le monde ou pour le travail. Pendant ces deux ans, j'aurai beaucoup appris sur votre passion pour la recherche et surtout le muscle squelettique. J'admire chaque fois l'engouement que vous avez pour ces sujets et encore plus lorsque j'ai la chance de pouvoir m'asseoir dans un de vos cours.
Un grand merci aussi à Pascale Mauriège qui fut presque comme une codirectrice sans la charge de corrections, quoique tu participeras à la correction finale de mon travail de maitrise. Merci pour le temps que tu m'accordais chaque fois que je passais la tête par la porte de ton bureau, pour tes conseils et ton soutien et surtout un gros merci pour le prêt de ta bible sur le tissu adipeux!
Merci à Angelo Tremblay pour nos discussions philosophiques, vos grandes idées et nos nombreuses rencontres surprises aux détours des couloirs du PEPS.
Je n'oublie pas non plus les gens de mon bureau, Marie-Lou Filliatrault et Alexandre Hamman pour nos petites discussions au milieu de notre travail dans notre beau sous-sol du PEPS. Leur expérience m'a beaucoup aidée à me sortir des méandres du cours de biostatistiques et d'éthique. Mais il y a une personne en particulier qui m'a permis de surmonter les moments difficiles et les baisses de motivation, merci à toi Caroline Doyon. Qui m'a soutenue quand je perdais pied et qui m'a fait traverser la terrible épreuve du séminaire de maitrise. Toi qui m’as fait découvrir le bonheur de travailler en surface en faisant le tour des cafés de Québec, qui m'a fait découvrir presque tous les chocolats favoris de Québec et surtout le Québec. Un clin d'œil pour Pénélope et Catherine qui nous ont rejointes plus tardivement.
Bien évidemment, toute cette aventure n'aurait pas été aussi agréable sans la bonne compagnie des gens du LABSAP et de la clinique de kinésiologie, Marc et Sarah, Francine et Lucie, les filles du bureau de la fraise Maya, Marina, Marie-Claude et Lucie, et Shirin notre nouvelle post doc qui m'aide à entretenir mon addiction pour les cafés latté. Merci pour nos diners partagés, nos entraînements et nos moments de détentes. Quand on débarque en terre inconnue, et que l'on est loin de sa famille et de ses amis, c'est agréable de se faire aussi bien adopter.
Merci à Suzanne et Nathalie qui m'ont aidée dans toutes les démarches administratives pendant ces deux ans et surtout pour nos "petites" pauses papotages/placotage.
Je remercie toutes les personnes qui ont travaillé sur le projet LIME avant mon arrivée et lors de ma maitrise, merci à Michel Lacaille et Marie-Julie Dubois de m'avoir montré en détail les techniques de dosage. Merci à nos sujets sans qui rien n'aurait pu être réalisé.
Merci aussi à l'European Chiropractor's Union et à l'office national des anciens combattants qui m'ont, en partie, soutenue financièrement.
Un immense merci outre atlantique à ma famille, je pense tout particulièrement à ma mère et ma sœur sans oublier mes cousins, cousines, oncles et tantes, pour leur soutien indéfectible dans cette folle entreprise bien que par moment je sais qu'au fond d'eux ils auraient souhaité que j'arrête pour retourner auprès d'eux lorsque la séparation était trop douloureuse.
Merci à mes amis qui m'ont permis de me sortir la tête des sciences et de m'évader que ce soit ici au Québec ou lors de mes voyages en France. La liste est bien trop longue donc un gros merci à tous et j'espère que vous vous reconnaitrez. Un clin d'œil du côté de la Suisse, Damir, on ne se connait pas depuis longtemps pourtant on a l'impression du contraire et nos échanges depuis notre rencontre m'ont aidé à terminer ce chapitre bien plus vite que je ne m'en serais crue capable.
Pour finir, je souhaite remercier mon futur conjoint, Jean-Philippe Pialasse. Merci mon chéri pour avoir été là pendant ces deux années, dans les hauts et les bas du quotidien et lors de notre sprint final de rédaction où l'on a franchi la ligne d'arrivée comme pour le semi-marathon de Montréal, main dans la main.
Avant-propos
Pendant ma maitrise j’ai travaillé sous la direction du Dr Denis R. Joanisse, dans le laboratoire des sciences de l’activité physique au Pavillon de l’Éducation Physique et des Sports (PEPS). Mes travaux de maitrise ont porté sur le projet Lipides IntraMyocellulaire et leurs Effets (LIME) du Dr Joanisse, dont le recrutement des participants ainsi que l’acquisition des données étaient en partie déjà faits. Mon projet portait sur la contribution des adipokines et des cytokines inflammatoires à la résistance à l’insuline du muscle squelettique chez l’humain. Pour cela, des échantillons de plasma prélevés lors des verrouillages euglycémique-hypersinsulinémiques du projet LIME ont été utilisés pour doser les différentes cytokines et adipokines. J’ai participé aux dosages de ces molécules et complété la base de données pour ensuite procéder aux analyses statistiques. Les résultats récoltés m’ont permis d’écrire deux manuscrits, dont je suis la première auteure, le premier manuscrit portant sur l’irisine est soumis à « Journal of Physiology and Biochemestry » et le deuxième manuscrit sur l’adiposopathie le sera prochainement.
En ce qui concerne les renseignements sur les coauteurs des articles présentés dans les chapitres 4 et 5, la Dre Pascale Mauriège a participé à l’élaboration de la question de recherche avec le Dr Denis Joanisse. Marie-Julie Dubois est la professionnelle de recherche, de l’équipe du Dr André Marette, qui a effectué une grande partie des analyses plasmatiques. Michel Lacaille est le professionnel de recherche de l’équipe du Dr Joanisse et il a également effectué des analyses sur les échantillons plasmatiques. En ce qui me concerne, j’ai participé aux dosages, mis à jour la base de données et effectué les analyses statistiques ainsi que l’écriture des deux manuscrits avec l’aide de mon directeur de recherche. Drs André Marette, John Weinagel et Angelo Tremblay ont participé à la révision des deux manuscrits ainsi qu’à l’élaboration du projet LIME. Les co-auteurs sont les mêmes pour les deux articles et ont contribué de la même façon pour les deux articles.
Au cours de ces deux années, j’ai pu présenter mes résultats dans des congrès au Québec lors de la réunion annuelle de la Société québécoise de lipidologie, de nutrition et de métabolisme (SQLNM), de la journée annuelle de la recherche à la faculté de médecine de l’université Laval et lors de la 24e Journée scientifique de
la recherche universitaire du CRIUCPQ. J’ai également pu présenter par affiche au niveau international lors du congrès Experimental Biology à San Diego en 2014. Enfin, j’ai eu la chance de faire un stage dans le laboratoire du Dr David Hood à l’Université de York à Toronto pour apprendre la technique d’immunobuvardage de type Western.
Chapitre 1.
Introduction générale
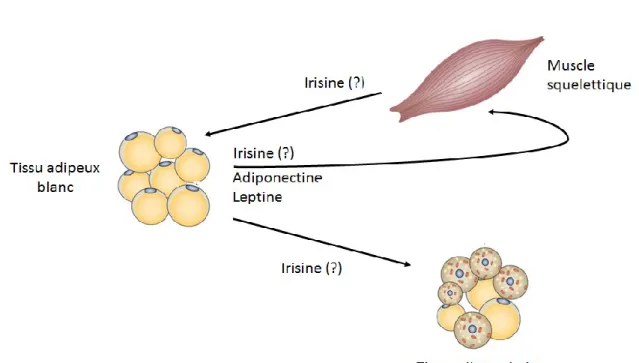
L'obésité est un problème de santé publique et est en constante augmentation. Des données de recherches montrent que 62% des hommes et 45,1% des femmes sont en surpoids ou obèses au Canada, et cela coûte 4,6 milliards de dollars au gouvernement en frais de santé (Mokdad, Serdula et al. 1999; Canada and santé 2011). L’obésité, et surtout l’obésité viscérale, ont également un impact sur la résistance à l’insuline, et sont des facteurs de risque du syndrome métabolique et de maladies cardiovasculaires (Smith, Lovejoy et al. 2001). Souvent s’installe avec l’obésité, une résistance à l’insuline au niveau du muscle squelettique. Cette résistance à l’insuline pourrait être le résultat de plusieurs changements découlant de la surcharge en triglycérides et en acides gras corporels. Par exemple, il a été décrit que l’obésité a pour conséquence d’augmenter les acides gras libres en circulation et ces acides gras vont venir infiltrer le muscle squelettique. Cette infiltration peut aboutir au blocage de la cascade de réaction à l’insuline et donc la cellule va devenir résistante à l’insuline (Badin, Louche et al. 2011). D’autres mécanismes pourraient aussi expliquer la résistance à l’insuline du muscle squelettique, par exemple, l’inflammation ou les niveaux circulants des différentes adipokines. De ce contexte, lors de ma maîtrise, je me suis principalement focalisée sur l’interaction entre le muscle squelettique et le tissu adipeux par l’étude de trois molécules, leurs interactions illustrées à la figure 1-1.
La résistance à l’insuline est une incapacité de la cellule à effectuer la captation insulinodépendante du glucose, et le muscle squelettique en est le joueur clé car il est le site principal de cette captation en phase post-prandial (DeFronzo, Jacot et al. 1981). Le muscle squelettique a également d’autres fonctions que la régulation de la glycémie, par exemple, la production de myokines (Pedersen and Febbraio 2012). Un des sujets sur lequel porte mon mémoire est la découverte récente de l’irisine (Bostrom, Wu et al. 2012), qui a été décrite premièrement comme étant une myokine, et qui aurait une action de brunissement du tissu adipeux blanc en tissu adipeux beige. Ce tissu adipeux beige aurait des propriétés métaboliques particulières, qui sont exposées dans la section portant sur l’irisine dans le chapitre 2, mais la principale étant l’augmentation de la dépense énergétique et son influence sur la sensibilité à l’insuline (Cannon and Nedergaard 2004; Bostrom, Wu et al. 2012). L’irisine est une molécule controversée et certains chercheurs ont montré qu’elle n’est pas uniquement une myokine, car ils l’ont retrouvée dans d’autres tissus de l’organisme, comme le tissu adipeux (Roca-Rivada, Castelao et al. 2013). De ce fait, la question de son action sur d’autres tissus que le tissu adipeux est à envisager.
Les deux autres molécules d’intérêt ici, dans l’étude de la résistance à l’insuline au niveau du muscle squelettique, sont la leptine et l’adiponectine. Ces deux molécules sont des adipokines, protéines sécrétées et
mises en circulation par le tissu adipeux. Elles ont différentes actions, mais en partagent aussi d’autres dont une porte sur la sensibilisation à l’insuline (Caselli 2014; Khan and Joseph 2014). En plus de ce lien avec la sensibilité à l’insuline, elles ont également été utilisées pour mesurer le niveau d’adiposopathie chez l’humain (Bays 2004). L’adiposopathie ou le « sick fat » est mesurée de différentes façons, le rapport adiponectine : leptine étant la méthode qui a été retenue dans ce mémoire (Inoue, Maehata et al. 2005). Il s’agit d’une mesure de la santé sécrétoire du tissu adipeux. Ce rapport nous permet d’estimer à quel point le tissu adipeux est fonctionnel en sa qualité d’organe sécrétoire (Bays and Stein 2003). Il est connu que la leptine et l’adiponectine ont un effet positif sur la sensibilité à l’insuline donc on peut supposer que, si le tissu adipeux est « non fonctionnel », la personne aura plus de risques, de développer une résistance à l’insuline (Bays, Mandarino et al. 2004) .
Figure 1-1 : Interaction entre le tissu adipeux et le muscle squelettique Adaptée de Bartelt and Heeren (2014)
Au vu de ce qui est établi dans la littérature, les questions que nous nous sommes posées portent sur le lien entre la résistance à l’insuline et l’irisine ou l’adiposopathie. Est-ce que l’on pourrait les utiliser comme outil
diagnostic ou cible thérapeutique dans la lutte contre l’obésité et la résistance à l’insuline? Pour essayer de répondre à ces interrogations nous avons cherché, dans un premier temps, à savoir quelles seraient les relations entre le niveau plasmatique d’irisine et la composition corporelle, la sensibilité à l’insuline, le « fitness » et l’activité enzymatique mitochondriale du muscle squelettique. Notre hypothèse était que l’augmentation du niveau d’irisine serait reliée à l’adiposité et à une santé métabolique détériorée. Nos résultats sont présentés dans le chapitre 4. Avec la même cohorte de sujets que celle utilisée lors de cette première analyse, nous avons ensuite évalué les taux plasmatique de marqueurs inflammatoires, d’adipokines et l’adiposopathie ainsi que leur relation avec la réponse à l’insuline. Notre hypothèse de recherche était qu’une bonne santé adipeuse indiquée par un rapport adiponectine : leptine élevé sera un élément prédictif de la sensibilité à l’insuline indépendant de l’adiposité et du « fitness ». Les résultats de cette deuxième série d’analyses sont présentés dans le chapitre 5. Le chapitre 2 présente le cadre théorique utilisé lors des travaux qui sont présentés dans les chapitres 4 et 5.
Chapitre 2.
Revue de la littérature
2.1. L’obésité, la résistance à l’insuline et la condition physique
Dans cette première partie, nous allons aborder les grandes lignes sur l’obésité, ses différentes formes et l’impact sur le tissu adipeux, pour ensuite discuter d’une de ses conséquences, la résistance à l’insuline. Ces deux thèmes étant très vastes, seuls les points les plus importants pour la compréhension de ce sujet et des articles des chapitres 4 et 5 seront abordés.
2.1.1. L’obésité
2.1.1.1. Définition
D’après l’organisation mondiale de la santé (OMS), le surpoids et l’obésité sont définis comme une accumulation anormale ou excessive de graisse qui présente un risque pour la santé. L’obésité est également reconnue depuis 1997 par l’OMS comme étant une maladie (2000). Elle est caractérisée par une hyperplasie (c.-à-d., augmentation du nombre) et une hypertrophie (c.-à-d., augmentation de la taille) des adipocytes. Pour en faire son évaluation, en plus des techniques d’imageries (p.ex., DEXA, IRM, tomographie) et la pesée hydrostatique utilisée en recherche, les outils principalement utilisés en clinique sont : la pesée, le calcul de l’IMC, la mesure des plis cutanés, la mesure du tour de taille et l’impédance bio-éléctrique. L’obésité est également définie en fonction des différents dépôts de tissu adipeux, qui sont généralement classifiés comme sous cutanés ou viscéraux. Nous nous attarderons ici aux mesures de l’IMC, du tour de taille et de la pesée hydrostatique, soient celles exploitées dans les travaux des chapitres 4 et 5.
2.1.1.2. Les outils diagnostic de l’obésité : L’IMC
L’IMC, ou indice de masse corporelle, est obtenue par calcul, la masse en (kg) divisée par la taille au carré (m2),
il est donc exprimé en kg/m2 (Équation 2-1).
𝐼𝑀𝐶 = 𝑚𝑎𝑠𝑠𝑒
Équation 2-1 : Formule de l'IMC.
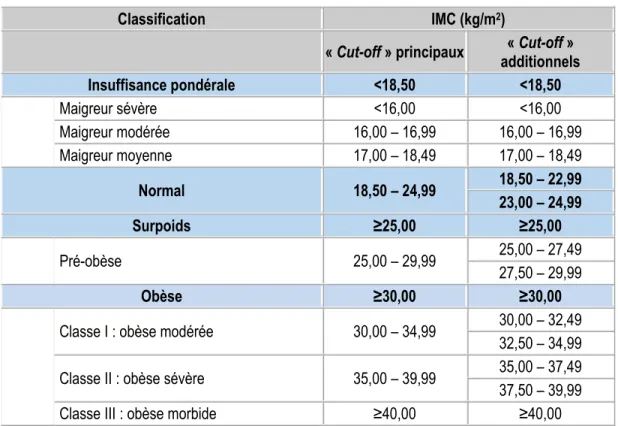
Les résultats de ce calcul, sous forme de fourchette, servent à classifier l’état d’obésité tel que présenté dans le tableau 2-1. Ils permettent de répartir les gens dans une des catégories allant de la maigreur sévère (IMC<16 kg/m2) à l’obésité morbide (IMC≥40 kg/m2) en passant par la normalité (18,5< IMC< 24,9 kg/m2). La
mesure de l’IMC permet d’avoir une idée générale de la masse grasse, car la corrélation entre le niveau de masse grasse et l’IMC est relativement forte, ainsi que celle avec les dysfonctions métaboliques en lien avec les niveaux de masse grasse comme la résistance à l’insuline (Wang 2004). Par contre la présence d’une forte (comme chez les haltérophiles) ou d’une faible (comme chez les sarcopéniques) masse musculaire peut fausser ces relations.
Cette formule facile à obtenir par tous praticiens permet de donner une idée assez générale de l’état de la personne, mais elle a ses limites. Elle ne permet pas de renseigner sur la composition corporelle avec précision (% de masse grasse et de masse maigre) ni sur la répartition de la masse adipeuse (Romero-Corral, Somers et al. 2008). Pour cela, une mesure de bio-impédance ou du tour de taille est un bon compromis, mais le DEXA « Dual-energy X-ray absorptiometry » et la pesée hydrostatique sont les mesures de référence de l’évaluation de la composition corporelle.
Classification IMC (kg/m2)
« Cut-off » principaux additionnels « Cut-off »
Insuffisance pondérale <18,50 <18,50 Maigreur sévère <16,00 <16,00 Maigreur modérée 16,00 – 16,99 16,00 – 16,99 Maigreur moyenne 17,00 – 18,49 17,00 – 18,49 Normal 18,50 – 24,99 18,50 – 22,99 23,00 – 24,99 Surpoids ≥25,00 ≥25,00 Pré-obèse 25,00 – 29,99 25,00 – 27,49 27,50 – 29,99 Obèse ≥30,00 ≥30,00
Classe I : obèse modérée 30,00 – 34,99 30,00 – 32,49 32,50 – 34,99 Classe II : obèse sévère 35,00 – 39,99 35,00 – 37,49 37,50 – 39,99
Classe III : obèse morbide ≥40,00 ≥40,00
Tableau 2-1 : La classification selon l’OMS de l’insuffisance pondérale, du surpoids et de l’obésité chez l’adulte en fonction de l’IMC.
2.1.1.3. Les outils diagnostic de l’obésité : la mesure du tour de taille
La mesure du tour de taille est, rapide à obtenir, facile et peu coûteuse. Elle permet spécifiquement de déterminer le degré d’obésité abdominale. Elle se réalise à l’aide d’un mètre couturier et la mesure peut se prendre à différents niveaux, en passant par l’ombilic, 2,5 cm en dessous de ce dernier, à la partie la plus mince de la taille, à mi-distance entre la dernière côte et le haut de la crête iliaque. Il est à noter que le protocole de mesure du tour de taille n’a pas d’influence sur sa relation avec les risques de maladies cardiovasculaires (Ross, Berentzen et al. 2008).
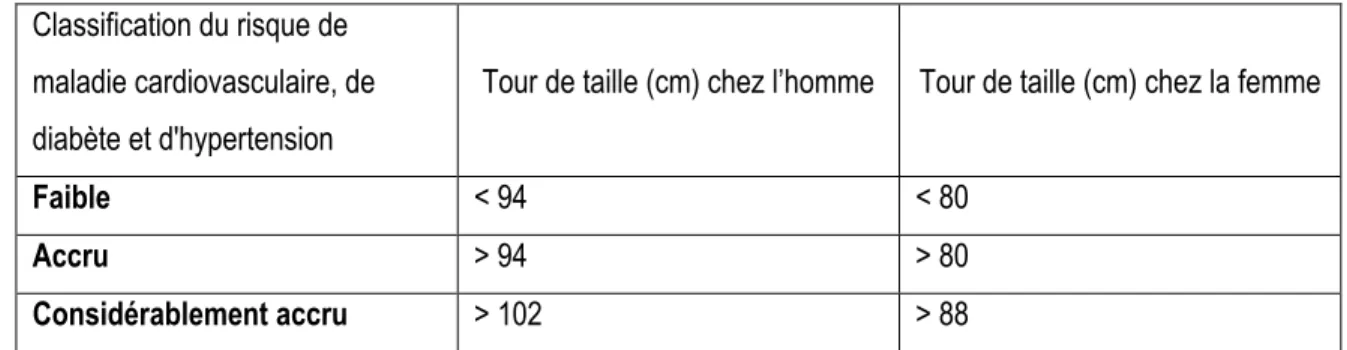
Plus le tour de taille est élevé et plus on a un risque élevé de développer des pathologies cardiovasculaires. Comme indiqué dans le tableau 2-2, ce risque est considéré accru dès 94 cm de tour de taille chez l'homme et 80 cm chez la femme (Canada 2003; Katzmarzyk, Janssen et al. 2006).
Classification du risque de maladie cardiovasculaire, de diabète et d'hypertension
Tour de taille (cm) chez l’homme Tour de taille (cm) chez la femme
Faible < 94 < 80
Accru > 94 > 80
Considérablement accru > 102 > 88
Tableau 2-2 : Classification du risque de maladies cardiovasculaires, du diabète de type 2 et d’hypertension artérielle en fonction du tour de taille.
Adapté de : Lignes directrices canadiennes pour la classification du poids chez les adultes Santé Canada (2003)
2.1.1.4. Les outils diagnostic de l’obésité : la pesée hydrostatique
La pesée hydrostatique permet d’obtenir une estimation très précise de la composition corporelle qui s’exprime en kilogramme de masses grasse et maigre. Un individu est défini comme obèse si son taux de masse grasse est supérieur à 25 % pour un homme et 35 % pour une femme.
La méthode est basée sur le principe de la poussée d’Archimède, et utilise les variables suivantes : le poids du corps en kilogramme mesuré avant la pesée hydrostatique (Pc), le poids du corps lorsqu’il est complètement immergé dans l’eau (Pi) et la valeur de la densité de l’eau (ρ). Ces variables sont ensuite corrigées pour le volume d’air résiduel des poumons (Vrp) à l’aide d’une expiration forcée maximale et une estimation de l’air emprisonné dans les intestins de 100 cc (Vin)(Behnke and Wilmore 1974). Ceci permet d'obtenir la densité corporelle, comme présenté dans l'équation 2-2.
𝑑𝑒𝑛𝑠𝑖𝑡é 𝑑𝑢 𝑐𝑜𝑟𝑝𝑠 = ((𝑃𝑐−𝑃𝑖)−(𝜌 ×(𝑉𝑟𝑝+𝑉𝑖𝑛)))(𝜌 ×𝑃𝑐) Équation 2-2 : Formule qui permet d’obtenir la densité du corps
À partir de la densité du corps, le pourcentage de masse grasse peut ensuite être calculé à partir de différentes formules selon le sexe et l’âge comme par exemple celle de Siri (Siri 1993) ou de Brozek et collaborateurs (Brozek, Grande et al. 1963).
2.1.1.5. Les différents dépôts de tissus adipeux
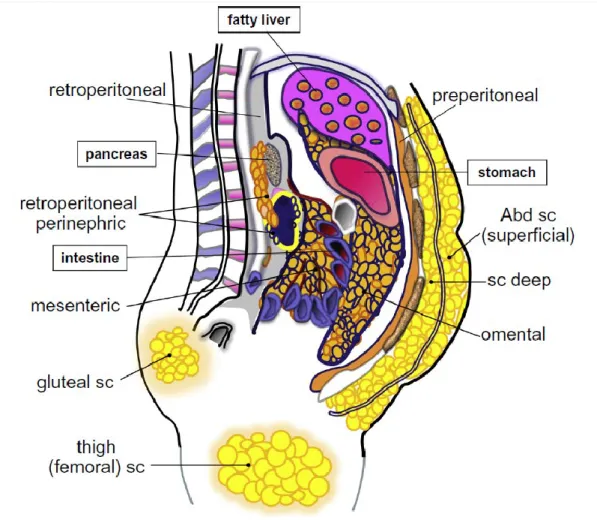
Le tissu adipeux est réparti, dans le corps, en deux familles représentées sur la figure 2-1 : les dépôts sous-cutanés et viscéraux. Chaque famille contient des sous catégories,par exemple le sous cutané pouvant être différencié en sous cutané superficiel ou profond et le viscéral en rétropéritonéal, omental et mésentérique. (Lee, Wu et al. 2013; Hsieh, Wang et al. 2014).
Figure 2-1 : Localisation des différents dépôts adipeux Lee, Wu et al. (2013). Présentation des dépôts: superficiel ou sous-cutané « superficial », intra péritonéal ou omental « omental » et rétro-péritonéal ou viscéral « mesenteric, retroperitoneal ».
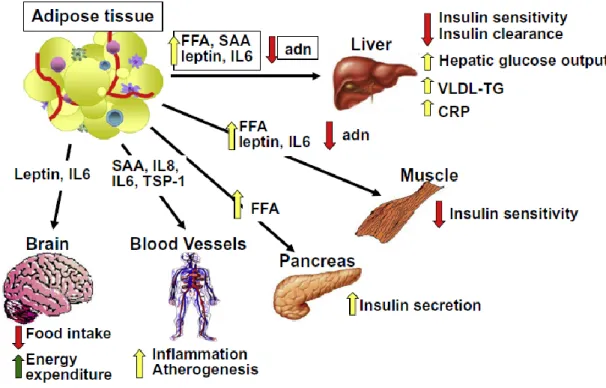
Ayant des localisations différentes, ils diffèrent également par leur origine génétique, composition cellulaire, physiologie, immunologie, innervation, vascularisation, métabolisme et leur profil sécrétoire (Lee, Wu et al. 2013; Bays 2014). Le tissu adipeux n’est pas uniquement une réserve énergétique, il a également une fonction sécrétoire importante (Bays, Gonzalez-Campoy et al. 2008; Galic, Oakhill et al. 2010). Comme présenté sommairement à la figure 2-2 il secrète un nombre important d’adipokines et de cytokines qui sont détaillées dans le tableau en annexe 3.
Figure 2-2 : Influence du tissu adipeux et de quelques adipokines sur l’organismeLee, Wu et al. (2013)
Les deux classes principalement étudiées sont les tissus adipeux sous-cutané et viscéral. Le dépôt sous-cutané est souvent considéré « protecteur » (Bays, Fox et al. 2010), alors que le viscéral a une réputation de tissu « pathologique » (Fox, Massaro et al. 2007). Pourtant, ces deux tissus ont à la fois un rôle protecteur et pathologique. Ils protègent le corps lors de chocs ou d’appuis et forment une couche d’isolant thermique (Jensen 2009). Mais ils sont également tous les deux responsables de l’augmentation du risque de certaines pathologies, le tissu sous-cutané jouant plutôt un rôle dans la résistance à l’insuline (Smith, Lovejoy et al. 2001) alors que le tissu viscéral étant un facteur de risque du syndrome métabolique et de maladies cardiovasculaires (Katzmarzyk, Janssen et al. 2006; Bays 2014).
2.1.1.6. Les différents types de tissus : le tissu adipeux blanc
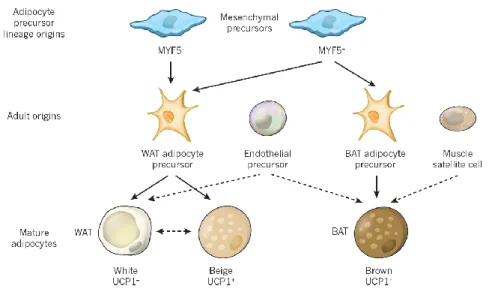
Le tissu adipeux blanc est composé d’un à deux tiers d’adipocytes et le reste du tissu est composé de préadipocytes, de cellules immunitaires, de fibroblastes, de cellules endothéliales et d’éléments vasculaires (Smas and Sul 1995). L’origine des adipocytes composant le tissu adipeux blanc («white adipose tissue»; WAT) est commune aux tissus adipeux beige et brun, la différenciation d’un précurseur mésenchymateux, se fait en présence ou non du « Myogenic factor 5 » (MYF5) (Peirce, Carobbio et al. 2014) comme représenté à la figure 2-3. L’adipocyte mature du tissu adipeux blanc n’a pas d’UCP1 (« uncoupling protein 1 ») comparé aux tissus brun et beige (Peirce, Carobbio et al. 2014). Le tissu adipeux blanc a principalement une fonction de stockage d'énergie sous forme de triglycérides dans les adipocytes et qui sont hydrolysés en acides gras et glycérol pour servir de substrat, selon les besoins, aux autres tissus comme le muscle (De Naeyer, Ouwens et al. 2011; Bastard and Bruno 2013). En cas de balance énergétique positive chronique, l’adipogenèse s’active, et cela aboutit aux conséquences que l’on connait : l’obésité et la résistance à l’insuline (Xu, Barnes et al. 2003; Bays, Gonzalez-Campoy et al. 2008{Xu, 2003 #547). Le WAT est également reconnu pour son action endocrine sécrétant des adipokines et des cytokines inflammatoires et son état sécrétoire est modifié en cas d’hypertrophie des adipocytes (Jung and Choi 2014); annexe 4). Sa localisation, sous-cutanée versus viscérale, nous renseigne également sur le risque relatif de complications, résistance à l’insuline ou maladies cardiovasculaires, que la personne peut développer, comme il en a été discuté ci-dessus. Cela s’expliquerait par le fait que le dépôt viscéral aurait plutôt tendance à s’hypertrophier et donc cela modifierait le profil sécrétoire alors que le tissu sous-cutané aurait plutôt tendance à l’hyperplasie, mais ce dernier peut également s’hypertrophier (Weyer, Foley et al. 2000).
2.1.1.7. Les différents types de tissus : le tissu adipeux brun
Le tissu adipeux brun (« brown adipose tissue » ; BAT) est constitué d’adipocytes contenant des gouttelettes de triglycérides, qui peuvent effectuer la lipogenèse et la lipolyse, et d’un grand nombre de mitochondries ce qui est inhabituel pour les adipocytes (Lanthier and Leclercq 2014). Ces mitochondries ont d'ailleurs une grande quantité d’UCP1 qui découple la phosphorylation oxydative de la chaîne de transport des électrons, pour plutôt favoriser la production de chaleur. Elles ont aussi une morphologie particulière, dotées de stries parallèles, et ayant plus de replis membranaires, ce qui leur confère une plus grande capacité de respiration et d'oxydation des substrats et donc de thermogénèse (Jean-Philippe Bastard 2013). La couleur brune du BAT lui vient du fer contenu dans les nombreuses mitochondries. On pensait initialement que le BAT était présent uniquement chez le nouveau-né avec une localisation interscapulaire, et au niveau de la nuque pour protéger du froid (Harms and Seale 2013). Il y a quelques années, du BAT a été découvert chez des sujets humains adultes après stimulation par le froid ou par le système nerveux parasympathique via la noradrénaline (Nedergaard, Bengtsson et al.
2007). Des analyses chez l’humain ont montré que l’activation du BAT est inversement corrélée à l’âge, l’IMC et la graisse viscérale (Saito, Okamatsu-Ogura et al. 2009). Ces résultats ont mis en lumière la possibilité d’exploiter ce tissu comme cible thérapeutique dans la lutte contre l’obésité et la résistance à l’insuline.
2.1.1.8. Les différents types de tissus : le tissu adipeux beige
Le tissu adipeux beige (« beige adipose tissue »; bAT) possède à la fois des caractéristiques du WAT et du BAT. Comme le BAT, le bAT est relativement riche en mitochondries qui expriment un niveau élevé d’UCP1. La transformation du WAT en bAT se ferait après une exposition prolongée au froid et serait réversible au bout de plusieurs semaines (Rosenwald, Perdikari et al. 2013). Cette possibilité de transformation du WAT en bAT devient intéressante si, comme le BAT, il est capable d’augmenter la dépense énergétique et donc d’induire une perte de poids avec une amélioration de la sensibilité à l’insuline (Lanthier and Leclercq 2014).
Figure 2-3 : Origines des adipocytes blanc, beige et brun
Tirée de Peirce, Carobbio et al. (2014)
2.1.1.9. Le tissu musculaire chez l’obèse
Le muscle squelettique représente 35-45 % du poids d’un individu normal (Pedersen and Febbraio 2012), explique environ 16 % de la dépense énergétique de repos et est un lieu important du métabolisme du glucose et des lipides. Chez le sujet obèse, il y a une augmentation de la masse musculaire et de la surface des fibres
musculaires, mais cette augmentation de surface ne va pas avec une augmentation du nombre de capillaires (Bjorntorp 1995). De plus, les sujets obèses ont tendance à avoir plus de fibres de type II. Ces fibres sont moins sensibles à l’insuline (Krotkiewski and Bjorntorp 1986), car leur capacité oxydative est diminuée du fait de leur nombre moins élevé de mitochondries et de leur taille plus petite (Kelley, He et al. 2002). En comparaison aux fibres de type I, leur capacité à oxyder les lipides est faible (Riou, Pigeon et al. 2009). Ces observations sont étayées par l’étude des enzymes du métabolisme aérobie du muscle squelettique chez l’obèse (Riou, Pigeon et al. 2009) : l’activité de la cytochrome C oxydase (COX) qui est impliquée dans la chaine respiratoire, la citrate synthase (CS) qui est une des enzymes du cycle de Krebs et l’hydroxyl CoA deshydrogénase (HADH) qui est impliquée dans la β-oxydation des lipides. Leurs activités sont négativement corrélées à la quantité de masse grasse (van Baak 1999; Kim, Hickner et al. 2000). On observe également une augmentation de la concentration des lipides au niveau du muscle squelettique lors de l’obésité. Cette infiltration du muscle squelettique par les acides gras, les lipides intramyocellulaires, joue un rôle majeur dans la résistance à l’insuline (Hulver and Dohm 2004; Moro, Galgani et al. 2009; Badin, Louche et al. 2011).
2.1.1.10. Les causes de l’obésité
Les deux grandes causes les plus étudiées sont un excès de l’apport calorique et une diminution de l’activité physique (voire une sédentarité), conduisant à une balance énergétique positive (Lau, Douketis et al. 2007). Il y a également des facteurs génétiques (Bleich, Cutler et al. 2008), socio-économiques, (par exemple le niveau d’études (Drewnowski and Specter 2004) (Canada and santé 2011) , des facteurs environnementaux (p. ex., le stress et le manque de sommeil et le temps d’écran qui semble un facteur de plus en plus important avec l’explosion du travail sur ordinateur et l’accès aux nouvelles technologies (James 2008)).
2.1.1.11. Les conséquences de l’obésité
Les grandes conséquences de l’obésité portent sur la santé en général. Parmi celle-ci on note l’intolérance au glucose, le diabète de type 2, l’hypertension artérielle, les maladies cardio-vasculaires, les dyslipidémies, les maladies cérébrovasculaires, le syndrome métabolique, les problèmes pulmonaires, gastro-intestinaux, de l’appareil reproducteur, psychosociaux ainsi que des risques plus élevés pour certains types de cancers et des problèmes ostéoarticulaires (Segula 2014). L’obésité entraîne également la formation de dépôts adipeux ectopiques, lorsque la capacité de stockage du tissu adipeux est exacerbée il y a la formation de dépôts au niveau du foie, des artères et du muscle squelettique. Ces dépôts ectopiques ont des conséquences sur la santé, p.ex., respectivement, une stéatose hépatique, l’athérosclérose et la résistance à l’insuline. Les conséquences de l’obésité sont également économiques. L’obésité ne cesse de croître, son taux ayant
augmenté de 70 % aux États-Unis de 2000 à 2010 (Skolnik and Ryan 2014), et les chiffres canadiens de 2013 donnant des pourcentages d’individus en surpoids ou obèses de 62 % pour les hommes et 45,1 % pour les femmes dans la population adulte âgée de 18 ans et plus (cf annexe 2). D’après le dernier rapport conjoint de l’Agence de la santé publique du Canada et de l’Institut canadien d’information sur la santé, plus d’un adulte canadien sur quatre est obèse selon les données recueillies de 2007 à 2009. C'est aussi 8,6 % des enfants canadiens de 6 à 17 ans qui sont atteints d’obésité (Canada and santé 2011). L’obésité étant un facteur de risque de maladies chroniques, de formes de cancers, d’une diminution du bien-être social et d’une augmentation des risques de dépression, les chiffres budgétaires parlent d’eux même quant à l’importance de lutter contre ce fléau. L’obésité aurait coûté environ 4,6 milliards de dollars à l’économie canadienne en 2008 (Canada and santé 2011).
En résumé, l'obésité résulte de l’hypertrophie et de l’hyperplasie des adipocytes qui va aboutir à des conséquences sur la santé comme le développement d’une intolérance au glucose, d’un diabète de type 2 et de maladies cardiovasculaires. L’importance de l’hypertrophie d’un dépôt adipeux par rapport à un autre est un élément important dans le diagnostic et il peut être estimé par la mesure du tour de taille. Ces éléments seront discutés davantage dans le chapitre 5.
2.1.2. L’intolérance au glucose
2.1.2.1. Définition
L'intolérance au glucose est un défaut dans la capacité de gérer la glycémie sanguine, et se situe entre une glycémie normale et un diabète franc. Cet état est évalué par un test oral de tolérance au glucose (OGTT) (1985). L'intolérance au glucose est considérée comme un facteur de risque majeur dans le développement du diabète de type 2, environ un tiers des personnes qui en sont atteintes risqueront de développer un diabète de type 2 (Warram, Sigal et al. 1996). L’intolérance au glucose peut être le résultat d’une résistance à l’insuline, ou un défaut dans la sécrétion de l’insuline.
2.1.2.2. Outils diagnostic : l’OGTT
Le test oral de tolérance au glucose est réalisé après une nuit à jeun. Le sujet consomme alors un bolus de 75 g de glucose par prise orale, et des prises de sang sont effectuées au début et aux 30, 60, 90 et 120 minutes (Ukropec, Penesova et al. 2008; Pigeon, Riou et al. 2009; DeFronzo and Abdul-Ghani 2011). Une glycémie
comprise entre 7,8 mmol/L et 11 mmol/L à 120 min post absorption est interprétée comme une intolérance au glucose ; au-delà de 11mmol/L il s'agit d'un diagnostic de diabète (DeFronzo and Abdul-Ghani 2011).
2.1.3. La résistance à l’insuline
2.1.3.1. Définition
La résistance à l’insuline est l’incapacité de la cellule à répondre adéquatement au signal insulinique, en particulier en lien avec la captation du glucose. Elle se produit dans plusieurs tissus, dont le foie, le muscle squelettique et le tissu adipeux. En réponse à cette résistance, les cellules β du pancréas vont alors produire plus d’insuline, mais avec temps, la résistance augmente, le pancréas s’épuise et cela conduit à une hyperglycémie et une hyperinsulinémie qui peuvent aboutir, au développement d’un diabète de type 2 (Gonzalez-Campoy, Richardson et al. 2014).
2.1.3.2. Outils diagnostic : le verrouillage euglycémique hyperinsulinémique (le « clamp »)
Il sert d’outil de mesure de la sensibilité à l’insuline et est considéré le « gold standard » la mesure de référence. Le test se déroule sur une durée de 2 à 3h, le sujet reçoit par injection une dose supraphysiologique d’insuline pendant toute la durée du test. La glycémie est contrôlée toutes les 5 minutes, et le débit d’une injection de glucose est ajusté afin de maintenir une glycémie dans les valeurs physiologiques pendant l’ensemble du test. Pour le réaliser, il est demandé au sujet de ne pas pratiquer d’activité physique 24 à 48h avant le test pour ne pas modifier sa réponse à l’insuline (Mikines, Sonne et al. 1988; Rice, Janssen et al. 1999) et d’être à jeun depuis 12h (Oppert, Nadeau et al. 1997). Dans ces conditions d’insuline supraphysiologique, le foie cesse sa production de glucose, et la majeure partie de la captation du glucose s’effectue dans le muscle. La sensibilité à l’insuline est généralement obtenue lors des 30 dernières minutes du test, souvent exprimée en M/I (le taux d’infusion de glucose sur la concentration d’insuline). Il s’agit donc d’une excellente mesure de la sensibilité musculaire à l’insuline (Ukropec, Penesova et al. 2008; Pigeon, Riou et al. 2009).
2.1.3.3. Les causes de la résistance à l’insuline
L’obésité est sûrement le facteur principal de la résistance à l’insuline avec la prise en compte de la contribution des différents dépôts adipeux, viscéraux et sous-cutanés (Bays 2014). Comme expliqué plus haut, l’adiposité viscérale est un facteur prédisposant davantage au développement du syndrome métabolique, d’un diabète de type 2 et des maladies cardiovasculaires alors que l’adiposité sous-cutanée peut être un facteur menant à une dysfonction de la sécrétion du tissu adipeux, une inflammation et le risque de surcharge énergétique entraînant le développement de dépôts ectopiques (Bays 2014). L’alimentation a une influence sur la sécrétion d’insuline ;
un bolus de glucose va entraîner une sécrétion d’insuline et la sensibilité à l’insuline va également être augmentée pour réguler la glycémie (Sacks, Carey et al. 2014). On sait que l’activité physique améliore la sensibilité à l’insuline à la suite de l’entraînement pour permettre au muscle de refaire ses réserves en glycogène (Prigeon, Kahn et al. 1995). Ainsi, une personne ayant déjà des problèmes de poids et un mode de vie sédentaire est plus encline à développer une résistance à l’insuline (Tuomilehto, Lindstrom et al. 2001) et des maladies cardiovasculaires (Nocon, Hiemann et al. 2008). La condition physique évaluée par la mesure du VO2max est également un très bon prédicteur de la sensibilité à l’insuline (Allen, Nemeth et al. 2007). Au niveau
cellulaire, la résistance à l’insuline peut être due à l’accumulation de lipides intramyocellulaires et/ou à une différence dans la structure des phospholipides membranaires (Haag and Dippenaar 2005). Le vieillissement (Defronzo 1979), la génétique, certaines maladies comme le syndrome de Cushing (Blecher 1984) ou un diabète auto-immun (Chiu, Tsai et al. 2007) et certains médicaments peuvent induire une résistance à l’insuline (Aiman, Najmi et al. 2014; Goncalves, Araujo et al. 2014).
2.1.3.4. Les conséquences de la résistance à l’insuline
Les conséquences de la résistance à l’insuline sont des problèmes métaboliques, dont le développement d’une intolérance au glucose, de la dyslipidémie, des dysfonctions endothéliales, des anomalies des facteurs de la coagulation, des changements hémodynamiques, des maladies cardiovasculaires, des accidents vasculaires cérébraux et d’une augmentation des facteurs inflammatoires (Reaven 2005).
Comme pour l’obésité, il n’y a pas que des conséquences sur la santé, mais il y en a aussi sur l’économie. En 2008/2009 c’est 2,4 millions de personnes vivant au Canada qui avaient un diagnostic de diabète, soit 6,8% de la population du Canada. D’un point de vue économique, cela représente 2,5 milliards de dollars pour les dépenses en santé (CANADA 2009).
2.1.4. Le lien entre l’obésité et la résistance à l’insuline
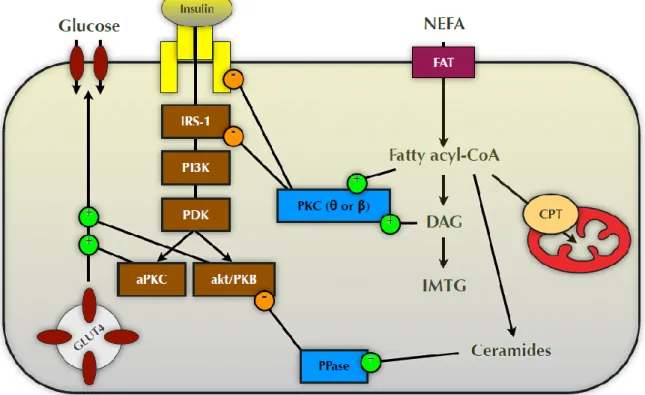
Une dysfonction du tissu adipeux, comme dans certains cas d’obésité, entraîne une augmentation de mise en circulation des acides gras libres. Avec l’obésité il y a également un phénomène de surcharge des capacités de stockage du tissu adipeux qui entraîne la formation des dépôts ectopiques dans le foie, le muscle et l’intima des artères. Ce dépôt dans le muscle squelettique mène à une augmentation des lipides intramyocellulaires comme illustré dans la figure 2-3 (Perseghin, Scifo et al. 1999). Cette infiltration chronique en lipides va mener à une «lipotoxicité» qui est définie par l’accumulation de longues chaines d’acyl-Coenzyme A (acyl-CoA), de diacylglycérols (DAGs) et des céramides (Adams, Pratipanawatr et al. 2004; Timmers, Schrauwen et al. 2008).
Cette lipotoxicité va entraîner une résistance à l’insuline par le biais de l’activation d’une protéine kinase C (PKC), isoforme θ ou β, par les lipides intramyocellulaires (Griffin, Marcucci et al. 1999). Cette PKC va inhiber 2 sites de la cascade de réactions à l’insuline : le récepteur à l’insuline et « l’insulin receptor substrate-1 » (IRS-1). Les céramides vont activer une protéine phosphatase qui va inhiber la protéine kinase B de la cascade de réactions à l’insuline (Hulver and Dohm 2004). Ces mécanismes vont diminuer la captation insulino-dépendante du glucose du muscle squelettique (Badin, Louche et al. 2011).
Figure 2-4 : Conséquence de l’accumulation des lipides intramyocellulaires sur la cascade de réactions à l’insuline.
Certains des mécanismes cellulaires qui montrent le lien entre l'accumulation de lipides intramyocellulaires et la résistance à l'insuline. DAG, diacylglycérols; TAG, triglycérides; IRS-1, le substrat du récepteur de l'insuline 1; PI3K, le
phosphatidylinositol 3-kinase; PDK, phosphatidylinositol kinase dépendante; Akt / PKB, la protéine kinase B; PKC, protéine kinase C; aPKC, protéine atypique kinase C; PPase, protéine phosphatase; CPT-1, de la carnitine palmitoyltransférase 1; (+), L'activation; (-), l'inhibition. Adaptée de Hulver and Dohm (2004)
2.1.5. Le lien entre la sensibilité à l’insuline et le « fitness »
La pratique régulière d’activité physique permet d’améliorer la puissance aérobie ou VO2max ainsi que des
paramètres de la santé métabolique (Riou, Pigeon et al. 2009). Le VO2max est la capacité aérobie maximale à
l’effort, c'est-à-dire la capacité qu’à l’organisme à utiliser l’oxygène lors d’un effort aérobie maximal, l’équivalent anglophone de cette définition est le « fitness ». Il faut faire attention de ne pas le confondre avec la condition
physique car une personne active peut avoir une bonne condition physique sans pour autant avoir un VO2max
d’athlète.
L’activité physique est connue pour son impact sur la sensibilité à l’insuline (Buresh 2014). Après une séance d’activité physique les myocytes sont plus sensibles à l’insuline pour faciliter la captation du glucose dans le but de refaire les réserves énergétiques de la cellule. Cette sensibilité augmentée grâce à l’activité est donc un moyen naturel de régulation de la glycémie pour les personnes intolérantes au glucose ou ayant un diabète de type 2.
Mais quand est-il de la relation directe du « fitness », mesurée par le VO2max, et la sensibilité à l’insuline ainsi
que son rôle de prédicteur de la sensibilité à l’insuline? Des études montrent qu’il y a une relation négative entre la résistance à l’insuline et le niveau de « fitness » {Eriksson, 1996 #684}. Des sujets sains sédentaires avec des mesures anthropométriques similaires à des sujets sédentaires intolérants au glucose ou diabétiques de type 2, ont, en moyenne, un VO2max supérieur de 15% (Leite, Monk et al. 2009). L’hémoglobine glyquée, qui
est un bon indice de surveillance du diabète, montre également une relation négative avec le VO2max
(Tanisawa, Ito et al. 2014). Une étude plus récente réalisée sur des sujets féminins vient également confirmer ces faits et montre que cette relation est indépendante du tour de taille (Shalev-Goldman, McGuire et al. 2014).
2.1.6. Le tissu adipeux et le muscle squelettique: organes sécrétoires
Le tissu adipeux est maintenant connu comme étant un organe sécrétoire et pas uniquement une grande réserve énergétique (Galic, Oakhill et al. 2010). La sécrétion et la mise en circulation des adipokines ainsi que leurs actions ont été des sujets de recherche important lors des 20 dernières années, depuis la découverte de la leptine comme étant spécifiquement sécrétée par les adipocytes (Zhang, Proenca et al. 1994). Une liste, en ANNEXE 4, présente les principales adipokines produites par le tissu adipeux blanc. L’accent a également été mis sur leurs actions exocrines ciblant les tissus métaboliquement actifs comme le muscle squelettique. Les adipokines qui ont une action sur le muscle squelettique sont surtout la leptine et l’adiponectine, augmentent la captation du glucose, son stockage sous forme de glycogène et augmentent la β oxydation des acides gras intramyocellulaires (Caselli 2014; Khan and Joseph 2014). Ces adipokines seront décrites plus en détail dans les sections suivantes du mémoire.
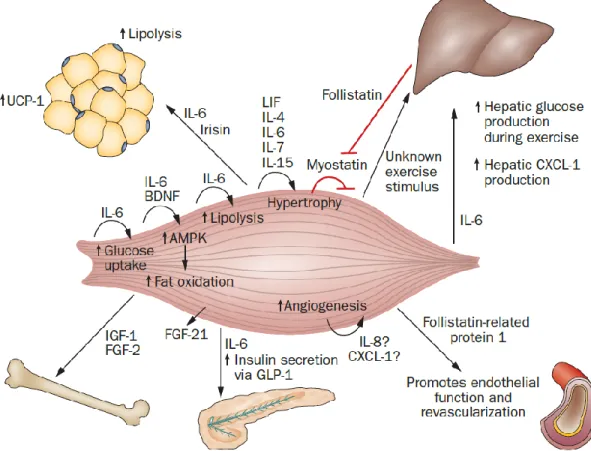
Le muscle squelettique, par ses contractions, induit des changements métaboliques comme la captation insulino-dépendante ou indépendante du glucose (Ryder, Gilbert et al. 2001), et représente également une source de production de molécules sécrétées, les myokines (Pedersen and Febbraio 2012). Parmis ces :
myokines, certaines auraient une action sur la dépense énergétique et/ou sur la captation du glucose et sont d’intérêt dans le contexte de la résistance à l’insuline.
La myostatine a pour actions de réguler l’hypertrophie du muscle squelettique par une action inhibitrice (Rodgers and Garikipati 2008), de maintenir l’homéostasie du métabolisme et de réguler la fonction ainsi que la masse de tissu adipeux (Guo, Jou et al. 2009). Elle est inhibée par l’activité physique et la follistatine, produite par le foie, et il en résulte une hypertrophie du muscle squelettique ainsi qu’une diminution du tissu adipeux total (Lin, Arnold et al. 2002). La myostatine semble être plus exprimée lors de surpoids (Hittel, Berggren et al. 2009).
L’IL6 aurait un rôle au niveau de la régulation énergétique du myocyte. Lors de la contraction musculaire, il y aurait une augmentation des sécrétions d’IL6 par le muscle lui-même (Fischer 2006), indépendamment du contexte inflammatoire (Keller, Hellsten et al. 2006), pour répondre à un besoin énergétique en glycogène de la cellule lors de l’exercice (Pedersen 2012). Ces faits ont été étayés par l’observation qu’une ingestion de glucose pendant l’exercice diminuerait la sécrétion musculaire d’IL6 (Pedersen and Febbraio 2008).
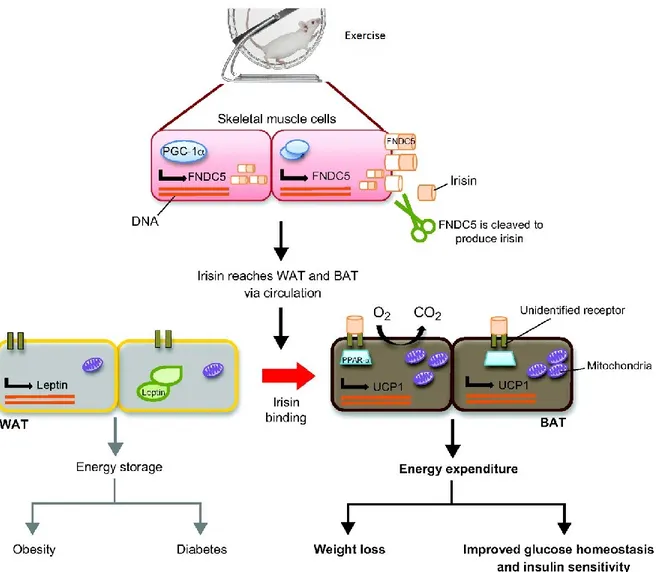
L’irisine, découverte par Boström en 2012, a été initialement décrite comme une myokine (Bostrom, Wu et al. 2012) mais certains travaux récents indiquent qu’elle serait aussi sécrétée par d’autres tissus (Aydin, Kuloglu et al. 2014). Ses actions seraient d’induire un brunissement du tissu adipeux blanc en tissu adipeux beige et donc d’augmenter le métabolisme de base (Bostrom, Wu et al. 2012). Elle aurait également une action, in vitro, d’induction de la biogenèse mitochondriale et du métabolisme oxydatif dans la cellule musculaire en culture (Vaughan, Gannon et al. 2014). Son expression serait augmentée par l’activité physique (Brenmoehl, Albrecht et al. 2014) et/ou une dégradation de la santé métabolique (Pardo, Crujeiras et al. 2014).
Figure 2-5 : Fonction sécrétoire du muscle squelettique. Tirée de Pedersen and Febbraio (2012)
En résumé, dans un contexte d’obésité, les acide gras mis en circulation infiltrent le muscle squelettique et ont pour conséquence d’induire une résistance à l’insuline qui mène à une intolérance au glucose puis au développement d’un diabète de type 2. Nous étudierons la relation entre les molécules d’adiponectine et de leptine ainsi que le concept de l’adiposopathie présentés dans les sections suivantes. Les articles des chapitres 4 et 5 traiteront du lien entre l’irisine, l’adiposopathie et la résistance à l’insuline.
2.2. Irisine
2.2.1. Définition
Peptide récemment découvert par Boström et al. (2012), elle a été observée initialement comme provenant du muscle squelettique. Les résultats de Boström et al. (2012) ont posé comme hypothèse que lors de l’activité physique il y a une augmentation du « Peroxisome proliferator-activated receptor gamma coactivator 1-alpha » (PGC-1α) qui va entraîner une augmentation de sécrétion de « Fibronectin type III domain-containing protein
naissance à l’irisine qui est ensuite mise en circulation afin que son action s’effectue au niveau du tissu adipeux blanc avec un effet de « brunissement » du tissu adipeux blanc en tissu adipeux beige, comme illustré dans la figure 2-5. Tout ceci a été décrit d’après les observations effectuées dans des modèles rongeurs; chez l’humain chaque observation est un sujet à controverse comme discuté dans la revue de littérature de Crujeiras, Pardo
et al. (2014).
Figure 2-6 : Présentation de l’irisine, sa sécrétion dans le muscle squelettique et son action sur l’adipocyte blanc Adaptée de Castillo-Quan (2012) Creative Commons Attribution by-nc-sa/3.0, Published by The Company of Biologists Ltd
2.2.2. Localisation
Boström et al. (2012) ont décrit l'irisine comme sécrétée au niveau du muscle squelettique et l’ont donc définie comme une myokine. Certains auteurs se sont alors penchés sur la localisation précise de son lieu de sécrétion
au niveau du muscle squelettique (Dun, Lyu et al. 2013; Brenmoehl, Albrecht et al. 2014) et d’autres ont vérifié si l’irisine était sécrétée par d’autres types de muscles, comme le muscle cardiaque, voir d’autres tissus. Des sites d’expression de l’irisine ont été découverts au niveau du foie, de l’estomac, de la rate, des glandes salivaires, du muscle squelettique, du muscle cardiaque et du tissu adipeux (Aydin, Kuloglu et al. 2014; Aydin, Kuloglu et al. 2014) (Moreno-Navarrete, Ortega et al. 2013; Roca-Rivada, Castelao et al. 2013; Aydin, Kuloglu et al. 2014).
Ces observations ont mené à questionner la classification de l’irisine en tant que myokine. Certains chercheurs ont tiré des conclusions, à la suite de leurs recherches, et ont pris position sur le fait que l’irisine pourrait plutôt être une adipokine car elle est retrouvée en plus grande quantité dans une population de sujet ayant un IMC plus élevé et étant plus dégradés métaboliquement (Huh, Panagiotou et al. 2012; Crujeiras, Pardo et al. 2014; Crujeiras, Pardo et al. 2014; Pardo, Crujeiras et al. 2014).
2.2.3. Les niveaux circulants d’irisine
Les différents travaux qui ont étudié l’irisine ne montrent pas de régularité quant à ses niveaux circulants. Il semblerait que différentes conditions auraient un rôle dans cette fluctuation; par exemple les taux l’irisine seraient plutôt « augmentés » par l'activité physique ou alors par un profil de santé métabolique dégradé. Étant initialement observée en plus grande concentration circulante à la suite de l’activité physique, on pourrait s’attendre à retrouver plus d’irisine chez une population entraînée (Bostrom, Wu et al. 2012; Huh, Panagiotou et al. 2012). Pourtant, plusieurs études ne retrouvent pas d’augmentation des niveaux circulants d’irisine dans une telle population entraînée ou juste après une période d’activité physique (Timmons, Baar et al. 2012; Kurdiova, Balaz et al. 2014; Seo, Kwak et al. 2014). De plus en plus de données montrent une augmentation des niveaux circulants d’irisine dans des populations plus dégradées métaboliquement (Huh, Panagiotou et al. 2012; Park, Zaichenko et al. 2013; Stengel, Hofmann et al. 2013) mais pas diabétiques (Choi, Kim et al. 2013; Liu, Liu et al. 2014). Il faut également prêter attention aux études qui ont observé des corrélations avec l’expression de l’ARNm du FNDC5, car ce dernier n’est pas toujours représentatif du niveau de sécrétion (Erickson 2013; Sanchis-Gomar, Alis et al. 2014). Aussi l’anticorps utilisé dans le dosage de l’irisine n’est peut-être pas toujours, adéquat comme le montre l’étude de (Roca-Rivada, Castelao et al. 2013). Les différents anticorps utilisés après l’étude de Boström, car celui de l’étude initiale n’est plus disponible, montrent qu’au lieu d’avoir une bande à 12 kDa, certains donnent une bande à 25 kDa, d’autres à 45-50 kDa (Roca-Rivada, Castelao et al. 2013). Cela nous amène à réfléchir sur le poids moléculaire réel de l’irisine en circulation et quelle partie du FNDC5 est réellement clivée et mise en circulation et sous quelle forme l’irisine serait active.
2.2.4. Les actions potentielles de l’irisine
2.2.4.1. Action sur le tissu adipeux blanc
Le grand intérêt envers l’irisine porte principalement sur son action potentielle sur le brunissement du tissu adipeux blanc en tissu adipeux beige (Bostrom, Wu et al. 2012). Le brunissement du tissu adipeux blanc en beige aurait pour effet de le rapprocher du tissu adipeux brun, c'est-à-dire d’augmenter la dépense énergétique par thermogénèse. Cela a pour conséquence une balance énergétique négative qui pourrait entraîner une perte de poids et par conséquent une meilleure sensibilité à l’insuline. Mais des données récentes supportent d’autres actions sur le muscle (Vaughan, Gannon et al. 2014).
2.2.4.2. Action sur le muscle squelettique
A l’heure actuelle, il n’y a qu’une seule étude qui s’est intéressée à l’action de l’irisine sur le métabolisme de la cellule musculaire (Vaughan, Gannon et al. 2014). Les chercheurs ont mis en culture des myocytes C1C12, et les ont traitées avec différentes concentrations d’irisine et pendant différentes durées. Les résultats ont montré qu’une exposition à l’irisine entraîne une augmentation de la capacité glycolytique basale et à son maximum, du métabolisme oxydatif basal et à son pic (par la mesure d’oxygène consommée), de la quantité de « mitochondrial uncoupling protein 3 » (UCP3), de GLUT4, de PGC1-α, du « Nuclear Respiratory Factor » (NRF1) et du « Mitochondrial Transcription Factor A » (TFAM). PGC-1α agit comme un régulateur du métabolisme et sur la biosynthèse mitochondriale en induisant l’expression de NRF et TFAM qui contrôlent le processus de biogénèse mitochondriale. Ces résultats étaient dépendants du temps d’exposition et de la dose d’irisine. Il y a donc une augmentation du métabolisme oxydatif ainsi que de la biogenèse mitochondriale, à la suite de l’exposition à l’irisine. Cela suggére que l’irisine pourrait ainsi avoir un rôle autocrine qui augmenterait le métabolisme oxydatif ainsi que la biogénèse mitochondriale musculaire.
2.2.5. Relation avec la résistance à l’insuline
Il semblerait que l’irisine ait des comportements similaires à l’insuline. Par exemple, leurs niveaux circulants semblent évoluer de la même façon. Ils augmenteraient lorsque la santé métabolique se dégrade agissant comme un mécanisme de compensation (Crujeiras, Pardo et al. 2014). Il y a une corrélation positive entre le niveau plasmatique d’irisine et le HOMA-IR, un indicateur de la résistance à l’insuline (Park, Zaichenko et al. 2013). Il est également observé une baisse de l’irisine ainsi que de l’insuline lors d’une perte de poids ou par
chirurgie bariatrique (Lopez-Legarrea, de la Iglesia et al. 2014). Par contre, de façon surprenante, l’irisine est augmentée dans les cas d’obésité et de résistance à l’insuline mais dans les populations avec un diabète de type 2 ses niveaux circulants sont diminués (Moreno-Navarrete, Ortega et al. 2013; Liu, Liu et al. 2014). En résumé, l'irisine est une molécule très intéressante pour son rôle potentiel dans le brunissement du tissu adipeux blanc en beige et sa conséquence positive sur la dépense énergétique et la sensibilité à l’insuline.
2.3. Adiponectine
L’étude de l’adiponectine est un domaine vaste, les facteurs influençant sa sécrétion ainsi que les rôles exposés dans ce mémoire en sont une liste non exhaustive et choisie en lien avec la résistance à l’insuline.
2.3.1. Définition
En 1995, Lodish décrivait pour la première fois l’adiponectine comme une adipokine exclusivement sécrétée par les adipocytes (Scherer, Williams et al. 1995). Elle fût connue originalement comme l’Acrp30 « adipocyte
complement-related protein of 30-kDa » et adipoQ chez la souris ou GBP28 et ApM1 chez l'humain, avant d’être
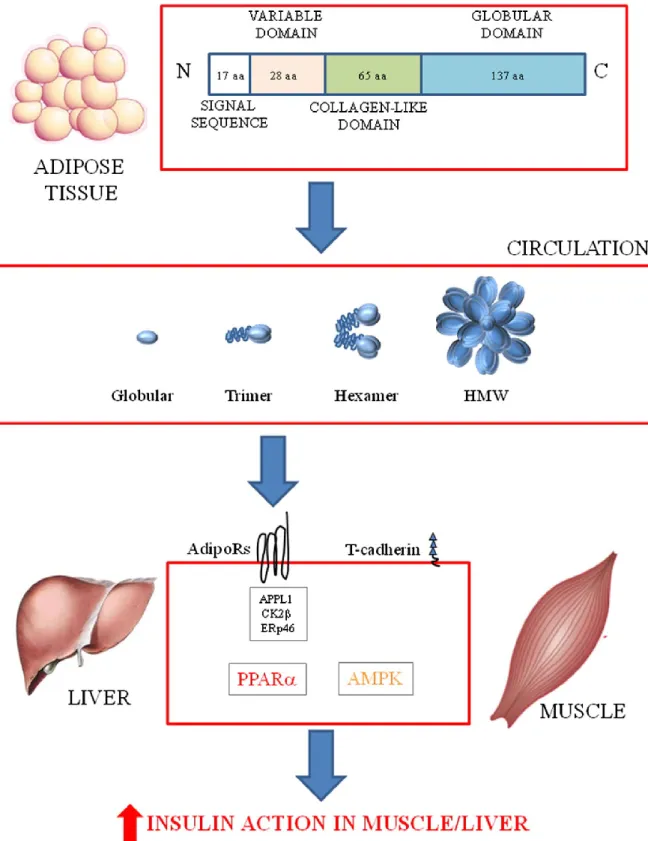
renommée adiponectine, toutes espèces confondues (Bastard and Bruno 2013). Cette protéine est composée de 247 acides aminés, avec un poids moléculaire de 30 kDa chez la souris et de 28 kDa chez l’humain. Elle est sécrétée sous forme globulaire, le monomère d’adiponectine. Ces monomères se combinent soit par liaison hydrophobe pour former des trimères (3) soit par des ponts disulfures pour former des héxamères (6) et des molécules de haut poids moléculaire (18) (440 kDa) comme illustré sur la figure 2-7 (Wang, Lam et al. 2008). La forme de haut poids moléculaire est la forme circulante majoritaire et elle est également impliquée dans les rôles physiologiques protecteurs (Aso, Yamamoto et al. 2006). Sa synthèse est régulée au niveau du réticulum endoplasmique des adipocytes 3T3-L1 et fait intervenir l’«endoplasmic reticulum oxidoreductase (Ero1-Lα) » et des régulateurs du « peroxisome proliferator-activated receptor ϒ » (PPARϒ) et du gène SIRT1 (Qiang, Wang et al. 2007).
2.3.2. Niveaux circulants
Les concentrations plasmatiques d’adiponectine représentent environ 0,01 % des protéines plasmatiques, les valeurs normales de l’ordre de 5 à 30 mg/L (Ye and Scherer 2013). Les valeurs circulantes de l’adiponectine varient en fonction du sexe, les femmes ayant des concentrations plus élevées que les hommes, la testostérone inhibant la synthèse d’adiponectine chez ces derniers (Wang, Lam et al. 2008). Il y a également une diminution
de la sécrétion d’adiponectine dans les cas d’obésité, de stress oxydatif et lors d’état chronique de faible inflammation (Phillips and Kung 2010). Par contre, la relation avec la masse grasse et la sensibilité à l’insuline est moins flagrante dans les cas de pathologies comme la lipodystrophie génétique (Cook and Semple 2010).
2.3.3. Rôles
L’adiponectine a une action antidiabétique, en stimulant la β-oxydation des acides gras dans la cellule musculaire, et en augmentant l’utilisation et la captation du glucose (Yamauchi, Kamon et al. 2002). Elle agirait également au niveau du système nerveux central et aurait pour action d’augmenter la dépense énergétique ce qui induirait une perte de poids (Turer and Scherer 2012). L’injection d’adiponectine recombinée aurait une action sur le foie en améliorant la sensibilité à l’insuline et au niveau du pancréas en stimulant la production d’insuline (Okamoto, Ohara-Imaizumi et al. 2008).
Elle a également un rôle dans la protection vasculaire dans la lutte contre l’athérogénèse. Pour cela elle agit sur les molécules d’adhésion aux cellules endothéliales, elle inhibe la transformation des macrophages en cellules spumeuses et la prolifération des cellules musculaires lisses (Kubota, Terauchi et al. 2002) (Ouchi, Kihara et al. 2001).
Dans son implication anti-inflammatoire, elle serait capable de réguler la production des espèces oxygénées réactives et donc de lutter contre le stress oxydatif (Ouedraogo, Wu et al. 2006), de diminuer la réponse inflammatoire induite par le TNF-α (Ouedraogo, Wu et al. 2006) et lutter contre les effets néfastes des cytokines pro-inflammatoires au niveau endothélial ce qui diminue le risque d’athérosclérose (Goldstein, Scalia et al. 2009).
Elle aurait enfin un effet bénéfique dans les pathologies rénales; par son activation de l’AMPK elle permettrait de réduire la perméabilité des podocytes à l’albumine et de réduire le dysfonctionnement podocytaire (Sharma, Ramachandrarao et al. 2008).
2.3.4. Relation avec la sensibilité à l’insuline
La cascade de réactions reliant l’adiponectine à la sensibilité à l’insuline n’est pas encore totalement décrite, mais certains mécanismes commencent à s’éclaircir comme illustré à la figure 2-7. L’adiponectine en circulation vient se fixer sur son récepteur R1 ou R2 et active une cascade de réactions passant par l’ « adaptator protein