UNIVERSITÉ CLERMONT AUVERGNE
UFR DE MÉDECINE ET DES PROFESSIONS PARAMÉDICALES THÈSE D’EXERCICE
pour le
DIPLÔME D’ÉTAT DE DOCTEUR EN MÉDECINE par
PLAINFOSSÉ, Olivier
Présentée et soutenue publiquement le 19 juin 2020
Pneumatisation du rocher et rhinorrhée cérébrospinale après résection chirurgicale de schwannomes vestibulaires.Y a t-il un lien ?
Président du jury : Monsieur le Professeur Laurent GILAIN Directeur de thèse : Monsieur le Professeur Thierry MOM
Membres du jury :
Monsieur le Professeur Paul AVAN Monsieur le Professeur Benoît GODEY
1 UNIVERSITÉ CLERMONT AUVERGNE
UFR DE MÉDECINE ET DES PROFESSIONS PARAMÉDICALES THÈSE D’EXERCICE
pour le
DIPLÔME D’ÉTAT DE DOCTEUR EN MÉDECINE par
PLAINFOSSÉ, Olivier
Présentée et soutenue publiquement le 19 juin 2020
Pneumatisation du rocher et rhinorrhée cérébrospinale après résection chirurgicale de schwannomes vestibulaires.Y a t-il un lien ?
Président du jury : Monsieur le Professeur Laurent GILAIN Directeur de thèse : Monsieur le Professeur Thierry MOM
Membres du jury :
Monsieur le Professeur Paul AVAN Monsieur le Professeur Benoît GODEY
2
UNIVERSITE CLERMONT AUVERGNE
PRESIDENTS HONORAIRES : JOYON Louis
UNIVERSITE D’AUVERGNE : DOLY Michel
: TURPIN Dominique : VEYRE Annie
: DULBECCO Philippe : ESCHALIER Alain
PRESIDENTS HONORAIRES : CABANES Pierre
UNIVERSITE BLAISE PASCAL : FONTAINE Jacques
: BOUTIN Christian : MONTEIL Jean-Marc : ODOUARD Albert : LAVIGNOTTE Nadine PRESIDENT DE L'UNIVERSITE et
PRESIDENT DU CONSEIL ACADEMIQUE PLENIER : BERNARD Mathias
PRESIDENT DU CONSEIL ACADEMIQUE RESTREINT : DEQUIEDT Vianney VICE-PRESIDENT DU CONSEIL D'ADMINISTRATION : WILLIAMS Benjamin VICE-PRESIDENT DE LA COMMISSION DE LA RECHERCHE : HENRARD Pierre VICE PRESIDENTE DE LA COMMISSION DE LA
FORMATION ET DE LA VIE UNIVERSITAIRE : PEYRARD Françoise
DIRECTEUR GENERAL DES SERVICES : PAQUIS François
UFR DE MEDECINE ET DES PROFESSIONS PARAMEDICALES
DOYENS HONORAIRES : DETEIX Patrice:
: CHAZAL Jean
DOYEN : CLAVELOU Pierre
3 LISTE DU PERSONNEL ENSEIGNANT
PROFESSEURS HONORAIRES :
MM. BACIN Franck - BEGUE René-Jean - BOUCHER Daniel - BOURGES Michel - BUSSIERE Jean-Louis - CANO Noël - CASSAGNES Jean - CATILINA Pierre - CHABANNES Jacques – CHAZAL Jean - CHIPPONI Jacques -
CHOLLET Philippe - COUDERT Jean - DASTUGUE Bernard - DAUPLAT Jacques – DECHELOTTE Pierre - DEMEOCQ François - DE
RIBEROLLES Charles - ESCANDE Georges -Mme FONCK Yvette - MM. GENTOU Claude
- GLANDDIER Gérard - Mme GLANDDIER Phyllis – M. JACQUETIN Bernard – Mme LAVARENNE Jeanine - MM. LAVERAN Henri - LESOURD Bruno - LEVAI Jean-Paul - MAGE Gérard - MALPUECH Georges - MARCHEIX Jean-Claude - MICHEL Jean-Luc - MOLINA Claude - MONDIE Jean-Michel - PERI Georges - PETIT Georges - PHILIPPE Pierre - PLAGNE Robert -
PLANCHE Roger - PONSONNAILLE Jean - REY Michel - Mme RIGAL Danièle - MM. ROZAN Raymond - SCHOEFFLER Pierre - SIROT Jacques -
SOUTEYRAND Pierre - TANGUY Alain - TERVER Sylvain - THIEBLOT Philippe - TOURNILHAC Michel - VANNEUVILLE Guy - VIALLET Jean-François - Mle VEYRE Annie
PROFESSEURS EMERITES :
MM. - BEYTOUT Jean - BOITEUX Jean-Paul - BOMMELAER Gilles - CHAMOUX Alain -
DETEIX Patrice – DUBRAY Claude - ESCHALIER Alain - IRTHUM Bernard - KEMENY Jean- Louis – LABBE André - Mme LAFEUILLE Hélène – MM. LEMERY Didier - LUSSON Jean- René - RIBAL Jean-Pierre
M. VAGO Philippe Histologie-Embryologie Cytogénétique
M. AUMAITRE Olivier Médecine Interne
M. LABBE André Pédiatrie
M. AVAN Paul Biophysique et Traitement de l'Image
M. DURIF Franck Neurologie
M. BOIRE Jean-Yves Biostatistiques, Informatique Médicale et Technologies de Communication
M. BOYER Louis Radiologie et Imagerie Médicale option
PROFESSEURS DES UNIVERSITES-PRATICIENS HOSPITALIERS
PROFESSEURS DE CLASSE EXCEPTIONNELLE
4 Clinique
M. POULY Jean-Luc Gynécologie et Obstétrique
M. CANIS Michel Gynécologie-Obstétrique
Mme PENAULT-LLORCA Frédérique Anatomie et Cytologie Pathologiques M. BAZIN Jean-Etienne Anesthésiologie et Réanimation
Chirurgicale
M. BIGNON Yves Jean Cancérologie option Biologique
M. BOIRIE Yves Nutrition Humaine
M. CLAVELOU Pierre Neurologie
M. DUBRAY Claude Pharmacologie Clinique
M. GILAIN Laurent O.R.L.
M. LEMAIRE Jean-Jacques Neurochirurgie
M. CAMILLERI Lionel Chirurgie Thoracique et Cardio-
Vasculaire
M. DAPOIGNY Michel Gastro-Entérologie
M. LLORCA Pierre-Michel Psychiatrie d’Adultes
M. PEZET Denis Chirurgie Digestive
M. SOUWEINE Bertrand Réanimation Médicale
M. BOISGARD Stéphane Chirurgie Orthopédique et
Traumatologie
Mme DUCLOS Martine Physiologie
M. SCHMIDT Jeannot Thérapeutique
M. BERGER Marc Hématologie
M. GARCIER Jean-Marc Anatomie-Radiologie et Imagerie Médicale
M. ROSSET Eugénio Chirurgie Vasculaire
M. SOUBRIER Martin Rhumatologie
M. CAILLAUD Denis Pneumo-phtisiologie
M. VERRELLE Pierre Radiothérapie option Clinique
M. CITRON Bernard Cardiologie et Maladies Vasculaires
M. D’INCAN Michel Dermatologie -Vénéréologie
Mme JALENQUES Isabelle Psychiatrie d'Adultes Mle BARTHELEMY Isabelle Chirurgie Maxillo-Faciale
M. GERBAUD Laurent Epidémiologie, Economie de la Santé et
Prévention
M. TAUVERON Igor Endocrinologie et Maladies Métaboliques
M. MOM Thierry Oto-Rhino-Laryngologie
M. RICHARD Ruddy Physiologie
M. RUIVARD Marc Médecine Interne
M. SAPIN Vincent Biochimie et Biologie Moléculaire
M. BAY Jacques-Olivier Cancérologie
M. COUDEYRE Emmanuel Médecine Physique et de Réadaptation
Mme GODFRAIND Catherine Anatomie et Cytologie Pathologiques
M. ABERGEL Armando Hépatologie
M. LAURICHESSE Henri Maladies Infectieuses et Tropicales
PROFESSEURS DE 1ère CLASSE
5
M. TOURNILHAC Olivier Hématologie
M. CHIAMBARETTA Frédéric Ophtalmologie
M. FILAIRE Marc Anatomie – Chirurgie Thoracique et
Cardio-Vasculaire
M. GALLOT Denis Gynécologie-Obstétrique
M. GUY Laurent Urologie
M. TRAORE Ousmane Hygiène Hospitalière
M. ANDRE Marc Médecine Interne
M. BONNET Richard Bactériologie, Virologie
M. CACHIN Florent Biophysique et Médecine Nucléaire
M. COSTES Frédéric Physiologie
M. FUTIER Emmanuel Anesthésiologie-Réanimation
Mme HENG Anne-Elisabeth Néphrologie
M. MOTREFF Pascal Cardiologie
Mme PICKERING Gisèle Pharmacologie Clinique
M. RABISCHONG Benoît Gynécologie Obstétrique
Mme CREVEAUX Isabelle Biochimie et Biologie Moléculaire
M. FAICT Thierry Médecine Légale et Droit de la
Santé Mme KANOLD LASTAWIECKA Justyna Pédiatrie
M. TCHIRKOV Andréï Cytologie et Histologie
M. CORNELIS François Génétique
M. DESCAMPS Stéphane Chirurgie Orthopédique et
Traumatologique
M. POMEL Christophe Cancérologie – Chirurgie Générale
M. CANAVESE Fédérico Chirurgie Infantile
M. LESENS Olivier Maladies Infectieuses et Tropicales
M. AUTHIER Nicolas Pharmacologie Médicale
M. BROUSSE Georges Psychiatrie Adultes/Addictologie
M. BUC Emmanuel Chirurgie Digestive
M. CHABROT Pascal Radiologie et Imagerie Médicale
M. LAUTRETTE Alexandre Néphrologie Réanimation Médicale
M. AZARNOUSH Kasra Chirurgie Thoracique et
Cardiovasculaire
Mme BRUGNON Florence Biologie et Médecine du Développement et de la Reproduction
Mme HENQUELL Cécile Bactériologie Virologie
M. ESCHALIER Romain Cardiologie
M. MERLIN Etienne Pédiatrie
Mme TOURNADRE Anne Rhumatologie
M. DURANDO Xavier Cancérologie
M. DUTHEIL Frédéric Médecine et Santé au Travail
Mme FANTINI Maria Livia Neurologie
M. SAKKA Laurent Anatomie – Neurochirurgie
M. BOURDEL Nicolas Gynécologie-Obstétrique
PROFESSEURS DE 2ème CLASSE
6
M. GUIEZE Romain Hématologie
M. POINCLOUX Laurent Gastroentérologie
M. SOUTEYRAND Géraud Cardiologie
M. EVRARD Bertrand Immunologie
M. POIRIER Philippe Parasitologie et Mycologie
M. CLEMENT Gilles Médecin Générale
Mme MALPUECH-BRUGERE Corinne Nutrition Humaine
M. VORILHON Philippe Médecine Générale
Mme BOTTET-MAULOUBIER Anne Médecine Générale
M. CAMBON Benoît Médecine Générale
M. TANGUY Gilles Médecine Générale
Mme CHAMBON Martine Bactériologie Virologie
Mme BOUTELOUP Corinne Nutrition
M. MORVAN Daniel Biophysique et Traitement de l’Image
Mle GOUMY Carole Cytologie et Histologie, Cytogénétique
Mme FOGLI Anne Biochimie Biologie Moléculaire
Mle GOUAS Laetitia Cytologie et Histologie, Cytogénétique
M. MARCEAU Geoffroy Biochimie Biologie Moléculaire
MAITRES DE CONFERENCES DES UNIVERSITES -
PRATICIENS HOSPITALIERS
PROFESSEURS DES UNIVERSITES
PROFESSEURS ASSOCIES DES UNIVERSITES
MAITRES DE CONFERENCES HORS CLASSE
MAITRES DE CONFERENCES DE 1ère CLASSE
7 Mme MINET-QUINARD Régine Biochimie Biologie Moléculaire
M. ROBIN Frédéric Bactériologie
Mle VERONESE Lauren Cytologie et Histologie, Cytogénétique
M. DELMAS Julien Bactériologie
Mle MIRAND Audrey Bactériologie Virologie
M. OUCHCHANE Lemlih Biostatistiques, Informatique Médicale et Technologies de Communication
M. LIBERT Frédéric Pharmacologie Médicale
Mle COSTE Karen Pédiatrie
Mle AUMERAN Claire Hygiène Hospitalière
Mme CASSAGNES Lucie Radiologie et Imagerie Médicale
M. LEBRETON Aurélien Hématologie
M. BUISSON Anthony Gastroentérologie
Mme PONS Hanaë Biologie et Médecine du Développement
et de la Reproduction
M. JABAUDON-GANDET Matthieu Anesthésiologie – Réanimation Chirurgicale
M. BOUVIER Damien Biochimie et Biologie Moléculaire
M. COLL Guillaume Neurochirurgie
Mme SARRET Catherine Pédiatrie
M. MAQDASY Salwan Endocrinologie, Diabète et Maladies
Métaboliques
Mme NOURRISSON Céline Parasitologie – Mycologie
Mme VAURS-BARRIERE Catherine Biochimie Biologie Moléculaire
M. BAILLY Jean-Luc Bactériologie Virologie
Mle AUBEL Corinne Oncologie Moléculaire
M. BLANCHON Loïc Biochimie Biologie Moléculaire
Mle GUILLET Christelle Nutrition Humaine
M. BIDET Yannick Oncogénétique
M. MARCHAND Fabien Pharmacologie Médicale
M. DALMASSO Guillaume Bactériologie
M. SOLER Cédric Biochimie Biologie Moléculaire
M. GIRAUDET Fabrice Biophysique et Traitement de
l’Image
Mme VAILLANT-ROUSSEL Hélène Médecine Générale
Mme LAPORTE Catherine Médecine Générale
M. LOLIGNIER Stéphane Neurosciences – Neuropharmacologie
Mme MARTEIL Gaëlle Biologie de la Reproduction
M. PINEL Alexandre Nutrition Humaine
M. PIZON Frank Santé Publique
MAITRES DE CONFERENCES DES UNIVERSITES
MAITRES DE CONFERENCES DE 2ème CLASSE
8
M. BERNARD Pierre Médecine Générale
Mme ESCHALIER Bénédicte Médecine Générale
Mme RICHARD Amélie Médecine Générale
M. TESSIERES Frédéric Médecine Générale
9 A NOTRE MAITRE ET PRESIDENT DE THESE
Monsieur le Professeur Laurent GILAIN Professeur des Universités, Praticien Hospitalier Oto-rhino-laryngologie et Chirurgie cervico-faciale Chef de service
Vous me faites l’honneur d’accepter la présidence de cette thèse.
Votre expertise chirurgicale, vos qualités d’enseignant et votre art de la rhétorique ont été un exemple pour moi et je vous en suis profondément reconnaissant.
10 A NOTRE JURY DE THESE
Monsieur le Professeur Thierry MOM
Professeur des Universités, Praticien Hospitalier Oto-rhino-laryngologie et Chirurgie cervico-faciale
Vous m’avez fait l’honneur de me confier et de me diriger au long de ce travail. Votre passion pour notre métier et vos connaissances scientifiques sont dignes de respect.
Votre maîtrise chirurgicale, vos qualités d’enseignant mais également humaines m’ont profondément enrichi.
Recevez le témoignage de mon estime et de ma gratitude. Monsieur le Professeur Benoît GODEY
Professeur des Universités, Praticien Hospitalier Oto-rhino-laryngologie et Chirurgie cervico-faciale Chef de service
Vous me faites l’honneur d’accepter de juger ce travail.
Vos qualités d’otologiste et votre force à toute épreuve sont un exemple pour moi. L’accueil que vous m’avez réservé au sein de votre service m’a permis de progresser et je
vous en remercie.
J’espère pouvoir travailler à vos côtés prochainement. Recevez ici le témoignage de mon profond respect. Monsieur le Professeur Paul AVAN
Professeur des Universités, Praticien Hospitalier Biophysique et Traitement de l’image
Votre présence dans ce jury est un honneur.
Votre expertise et l’étendue de vos connaissances scientifiques sont un exemple pour moi. Veuillez trouver ici l’expression de mon estime.
Monsieur le Docteur Toufic KHALIL Praticien Hospitalier
Neurochirurgie
Je vous remercie d’avoir accepté de juger ce travail.
Votre expertise neurochirurgicale et l’occasion de travailler à vos côtés m’a beaucoup appris. Recevez ici le témoignage de ma sincère gratitude.
11 A MES MAITRES
Au Professeur Franck JEGOUX
Je tiens à vous remercier pour votre enseignement. J’espère pouvoir travailler à vos côtés prochainement. Ne voyez pas en ce vouvoiement un manquement aux ordres mais une
profonde marque de respect.
Au Docteur Nicolas SAROUL
J’ai beaucoup appris à tes côtés. Ton sens critique est un exemple pour moi. Ta maîtrise chirurgicale est indéniable tout comme ton affection pour les Cowboys Fringants. Grâce à toi,
je pourrai gravir des montagnes, à vélo notamment …
Au Docteur Aubry HOUETTE
Ta gentillesse et ton humour décapant te caractérisent. Je te remercie pour m’avoir appris l’utilisation idoine du shaver en épargnant la luette bien entendu …
Au Docteur Alexis DISSARD
Ton aisance chirurgicale et footballistique font de toi un précieux coéquipier ou un redoutable adversaire. Te côtoyer sur le champ opératoire et sur le synthétique a été un
plaisir pour moi. Je te souhaite le meilleur.
Au Docteur Mathilde PUECHMAILLE
Une rigueur sans faille pour enseigner et des conseils avisés pour les rencontres … Sois remerciée pour cela.
Au Docteur Laura MONTRIEUL
L’art de la persuasion, l’efficacité et la gentillesse : beaucoup de qualités qui sont une source d’inspiration pour moi.
Au Docteur Justine BECAUD
Je suis admiratif de ta rigueur qui est le maître mot pour progresser. Je te remercie sincèrement.
Aux Docteurs Vincent DUPUCH et Rémy PASTOUREL
Toujours partants pour un soccer, des guerriers sur le terrain. Je suis heureux de vous avoir côtoyés.
Au Docteur Charles CABURET
Tu as beaucoup contribué à ma formation au Puy-en-Velay et tu restes avant tout un ami pour moi. Je te souhaite le meilleur.
12 Au Docteur Aurélie BACHY
Un caractère bien trempé ainsi que de grandes qualités humaines. Je te souhaite beaucoup de réussite.
Au Docteur Maxime CODET
Ta gentillesse et tes talents de grimpeur sont indéniables. J’espère pouvoir travailler à tes côtés prochainement pour aller plus haut …
Au Docteur Valentine PARENT
Je n’oublierai pas ton professionnalisme, les soirées à Marseille et Montpellier. Je te souhaite le meilleur.
Au Docteur Lucie PEIGNÉ
La patience et la franchise te caractérisent, des qualités humaines incontestables. Je te souhaite le meilleur.
Au Docteur Sarah DEBERGÉ
J’ai apprécié travailler à tes côtés et je n’oublierai pas les valeurs importantes que tu portes à l’environnement. Je te souhaite le meilleur.
Au Docteur Olivier DE CROUY-CHANEL
Ton efficacité chirurgicale et ta rapidité d’exécution resteront un exemple pour moi. J’espère pouvoir travailler à tes côtés prochainement.
Au Docteurs Samir TRIKI et Catalin AGRICI
Vous avez marqué mon début d’internat et m’avez donné goût à notre métier. Je vous en suis profondément reconnaissant.
Au Docteur Marc DURAND et Larbi CHELIKH
13 A MES CO-INTERNES
Au Docteur Maeva MONTERO
La gentillesse incarnée et un sourire à toute épreuve. Un réel plaisir d’avoir travaillé à tes côtés.
Au Docteur Quentin MARTINEZ
Le beau gosse expert en relations humaines : tout pour réussir en somme. Je te souhaite le meilleur.
A Jens Erik PETERSEN
Un grand fédérateur déjanté, toujours au service du collectif. Tu as été un véritable « Didier Deschamps » pour moi. Je te souhaite le meilleur car tu le mérites.
A Alexane LERE
Ton humour, tes qualités de manager et ton pragmatisme sont une source d’inspiration pour moi. Je te souhaite beaucoup de bonheur ainsi qu’à Amaury et à ton merveilleux Prince
d’Aurillac …
A Luce COMPAGNONE
Une détermination sans faille qui te permettra d’aller loin. Je te souhaite une grande réussite.
A Victor GOSSELET
Un ambianceur sans égal et un ami avant tout. J’ai apprécié travailler à tes côtés. J’ai appris grâce à toi dans le domaine des relations humaines et je t’en remercie…
A Mohamed EL YAGOUBI
L’incarnation même de la gentillesse et du dévouement. Tu as été un véritable ami et j’apprécie ton sens critique qui te permettra d’aller loin. Je te souhaite le meilleur.
A Antoine BARRAT
Sans conteste un futur talent. Des dribbles ravageurs et un coup de raquette d’une précision chirurgicale. Je te souhaite le meilleur.
A Chloé TRILLAT
L’âme d’un chef et aussi beaucoup d’humour. J’ai apprécié travailler à tes côtés. Je te souhaite le meilleur.
Aux petits nouveaux : Margaux LOUKINE, Manon BACHELET, Mathilde REY, Nalick LOMBION.
A Morgane VITRY (notre maman bretonne), à Gwenolé TANGUY (Le Boucher de Ploërmel), à Camille LE BIHAN (et ses petits ponts ravageurs, je t’aurai un jour…), à Paul COUDERT (alias Steven Spielberg), à Vincent MAZOUÉ (funambule hors pair), et à Na’im BEN MILOUD (expert en relations humaines).
14 AUX EQUIPES
Dans le service
Dalila (la patronne), Marina, Bérengère, Jess’, Karine, Clémentine, Mélanie (maîtresse Jedi), Mathilde, Guillaume, Mégane, Valérie, Pascale, Mira, Kiki, Martine, Christian, Philippe, Estelle, Michel, Amandine, Noëmie, Christian, François
A la consultation
Cathy (toujours le sourire), Christine (maman de l’audiométrie, un véritable plaisir de travailler à tes côtés), Sylvie, Marie-Line, Franck, Laura
Au secrétariat
Fabienne (une organisation à la pointe), Chrystelle, Christelle, Catherine, Aurélie, Angélique, Gisèle, Anne-Marie, Gérard
Au bloc
Sonia, Pauline, Lauriane, Katy, Elise, Françoise, Johanne, Estelle, Mélanie, Lorie, Pauline, Najate
Aux Anesthésistes
Catherine SAINTE-ROSE, Ghislaine ROCHE, Elisabeth CARRIER DE BOISSY, Fabienne COMMUN, Véronique SARRAZIN, François LONGERAS
Aux Audioprothésistes
Dominique MENETRIER, Anne-Marie COJOCARU, Antoine GENSTY
A Bruno PEREIRA pour sa précieuse analyse statistique
A l’équipe du Service d’ORL du CHU de Rennes A l’équipe du Service d’ORL du CH de Montluçon
A l’équipe du Service d’ORL du Puy-en-Velay et en particulier à Xavier (roi du VTT) A l’équipe du Service de Neurochirurgie de Clermont-Ferrand
15 A MA FAMILLE
A mes parents
Si je suis ici aujourd’hui, c’est en grande partie grâce à vous. Maman, tu n’as cessé d’être à nos côtés dans toutes les étapes de notre vie, avec une force et un amour sans égal. Papa, tu m’as transmis cette force mentale et cette détermination, dignes des plus grands marins, qui m’ont permis de gravir des sommets. Jamais je ne pourrai assez vous remerciez pour ce que
vous faites pour moi.
A mon grand frère Julien
Tu continues d’être un exemple pour moi. La forêt défrichée est toujours plus évidente à parcourir.
A ma petite sœur Hélène
Ma complice. J’espère de tout mon cœur que tu iras loin.
A toute ma famille de France et de Madagascar. A mon oncle Jean-Claude, mon confident. A ma cousine Emma.
A MES AMIS
Du lycée, JérÔme et Louis. De la fac, Kévin et Florian (la joie de vivre), Sylvère (le virtuose) et Lucas (mon cycliste breton), Thibaud (fidèle du SUAPS), Lionel (futur prix Nobel). Du soccer lundi 20h30 d’Aubière, en particulier Crispin, et du soccer Rennais. Trugarez dit Yann.
16
« Tout obstacle renforce la détermination. Celui qui s’est fixé un but n’en
change pas »
17
Pneumatisation du rocher et rhinorrhée
cérébrospinale après résection chirurgicale de
18
TABLE DES MATIÈRES
Sommaire
LISTE DES TABLEAUX ET DES FIGURES ... 19
LISTE DES ABRÉVIATIONS ... 20
RÉSUMÉ ... 21 MOTS-CLÉS ... 21 INTRODUCTION ... 22 MATÉRIELS ET MÉTHODES ... 25 Population ... 25 Stade tumoral ... 25 Procédure chirurgicale ... 26 Voie RS ... 27 Voie TL ... 28
Identification des fuites de LCS ... 28
Traitement des fuites de LCS ... 29
Evaluation scannographique de la pneumatisation temporale ... 29
Analyse statistique ... 33
RÉSULTATS ... 34
DISCUSSION ... 39
CONCLUSION ... 52
19
LISTE DES TABLEAUX ET DES FIGURES
TABLEAUX
Tableau I : Comparaisons des données démographiques des 206 patients de l'étude avec et sans RCS après résection chirurgicale de SV
Tableau II : Répartition des valeurs concernant la distance entre la paroi postérieure du MAI et la cellule la plus proche, parmi les patients présentant un mur postérieur du MAI pneumatisé
Tableau III : Données de la littérature concernant le taux de fuites de LCS et de méningites après chirurgie d'exérèse de SV
Tableau IV : Classification scannographique des cellules du rocher
FIGURES
Figure 1 : Dessins schématiques représentant la classification du stade tumoral dans cette étude
Figure 2 : Classification de la pneumatisation péri-sigmoïdienne selon Han et al. Figure 3 : Classification de la pneumatisation de l’apex pétreux
Figure 4 : Classification de la pneumatisation du mur postérieur du MAI
Figure 5 : Coupe scannographique d’un rocher droit en coupe axiale. Systématisation de sa pneumatisation en trois zones.
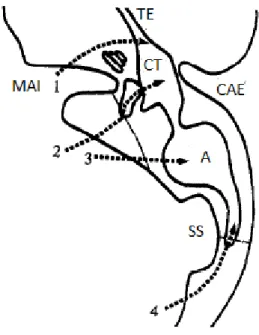
Figure 6 : Schéma des voies d’écoulement potentielles des RCS au niveau d’un rocher gauche en coupe axiale, à l’étage du MAI, selon Nutik et Korol.
20
LISTE DES ABRÉVIATIONS
CUSA : Cavitronic UltraSound Aspirator dB HL : Décibel Hearing Level
DS : Déviation Standard
IMC : Indice de Masse Corporelle
IRM : Imagerie par Résonance Magnétique kg/m² : kilogramme par mètre carré
LCS : Liquide CérébroSpinal MAI : Méat Acoustique Interne mL : millilitre
mm : millimètre n : nombre
ORL : Oto-Rhino-Laryngologiste PEA : Potentiels Évoqués Auditifs RCS : Rhinorrhée CérébroSpinale RS : RétroSigmoïde SP : Sus-Pétreuse SV : Schwannome Vestibulaire TE : Trompe d’Eustache TL : TransLabyrinthique Valeur-p : Valeur probabilité
21
RÉSUMÉ
Introduction - Le degré de pneumatisation du rocher ainsi que sa répartition, pourraient être probablement liés au risque de rhinorrhée cérébrospinale (RCS) après chirurgie pour schwannome vestibulaire (SV). En particulier un rocher très pneumatisé, jusqu’à l’apex, pourrait augmenter le risque de RCS ; une pneumatisation du mur postérieur du méat acoustique interne (MAI) pourrait favoriser ce risque dans les voies rétrosigmoïdes (RS). La question de l’efficacité de l’obturation de la trompe d’Eustache (TE) en prévention de la RCS post-opératoire mérite aussi d’être vérifiée.
Matériels et Méthodes - Etude rétrospective sur 206 patients opérés consécutivement d’un SV entre septembre 2003 et février 2018, par voie RS ou translabyrinthique (TL). Les données recueillies incluaient les caractéristiques des patients, la survenue de RCS, de méningite et le degré de pneumatisation pétreuse. Cette dernière est évaluée sur les scanners des rochers pré-opératoires, permettant de distinguer quatre groupes, en fonction de leur pneumatisation péri-sigmoïdienne d’après Han et al. en 2007. La pneumatisation de l’apex pétreux et celle du mur postérieur du MAI sont notées.
Résultats - 164 résections sont réalisées par voie RS et 42 par voie TL (âge moyen de 53,6 ans +/-12,8, avec un sexe ratio de 97 hommes pour 109 femmes). La durée moyenne de suivi est de 5 ans, 10 mois. 25 patients (12,1%) présentent une RCS, 8 (3,6%) une méningite. La voie d’abord (p=0,314), le sexe (p=0,922), l’âge (p=0,29), l’IMC (p=0,58), le stade tumoral (p=0,758) ne sont pas liés au risque de RCS. Le risque de RCS ne diffère pas entre les quatre groupes de pneumatisation périsigmoïdienne (p=0,284) ni quand l’apex pétreux est pneumatisé notamment dans les voies TL (p=0,348). Une corrélation très significative entre la pneumatisation du mur postérieur du MAI et RCS après voie RS est retrouvée (p=0,006). L’obturation de la TE ne prévient pas le risque de RCS dans les voies TL (p=1,00).
Conclusion - L’importance de la pneumatisation pétreuse et le risque de RCS post-opératoire ne semblent pas liés. Mais la pneumatisation du mur postérieur de MAI augmente le risque de RCS dans les voies RS. L’obturation de la TE dans les voies TL ne suffit pas à prévenir la RCS post-opératoire.
MOTS-CLÉS
Schwannome vestibulaire, rhinorrhée cérébrospinale, pneumatisation du rocher, facteurs de risque
22
INTRODUCTION
Les schwannomes vestibulaires (SV) sont des tumeurs bénignes développées aux dépens de la gaine de Schwann du nerf cochléovestibulaire, VIIIème nerf crânien. Ils représentent environ 80 % des tumeurs développées dans l’angle pontocérébelleux et 8 % des tumeurs intracrâniennes (1).
L’exérèse chirurgicale en est actuellement le traitement de référence ainsi que le traitement historique. Au début du XXème siècle, les SV sont diagnostiqués à un stade tardif d’hypertension intracrânienne et le traitement est réalisé par voie sous-occipitale rétrosigmoïde, avec comme chefs de file, Cushing et Dandy (2,3). Sous l’impulsion de House en 1964 (4), la voie translabyrinthique (TL) prend son essor, la voie sous-occipitale est remplacée par la voie rétrosigmoïde (RS) et le concept de travail de collaboration en double équipe oto-neurochirurgicale se développe. L’objectif de la chirurgie d’exérèse des SV est alors concentré sur l’amélioration du pronostic vital. L’expérience grandissante et les avancées des techniques microchirurgicales ont contribué à une diminution significative de la mortalité relative à la chirurgie d’exérèse des SV. En 1913, Marx, le premier à réaliser une voie d’abord transtemporale, rapporte un taux de mortalité d’environ 80 % (5). La mortalité est rapportée par Cushing à 20% en 1917 (2) (sur 30 patients), par Dandy à 10 % en 1941 (3) (sur 46 patients). Cinquante ans plus tard, Samii et al. rapportent un taux de 1,1% de mortalité en 1992 (6) (sur 1000 patients) et de 0% en 2006 (7) (sur 200 patients).
Avec l’avénement des potentiels évoqués auditifs (PEA) au début des années 90, les SV sont diagnostiqués à des stades plus précoces, dès l’apparition de signes cochléaires unilatéraux. Cependant, un grand nombre de petits SV intraméatiques sont associés à des PEA normaux. Ainsi, Gilain et al. rapportent une sensibilité des PEA à 76 % (8) et en 2004, Cueva retrouve une sensibilité à 71 % et une spécificité à 76 % (9) . Depuis les années 90 et 2000, l’Imagerie
23 par Résonance Magnétique (IRM), par sa très grande sensibilité, devient l’examen de
référence du diagnostique de SV. Le protocole actuel permet ainsi de détecter des SV millimétriques.
Aujourd’hui, le premier objectif reste l’amélioration du pronostic vital en cas de SV évolué au stade d’hypertension intracrânienne. La résection doit alors être la plus complète possible (7,10–14), afin de lever une compression du tronc cérébral. Les objectifs suivants, la préservation de la fonction faciale et de l’audition, représentent les enjeux actuels du traitement des SV, en particulier pour les SV de petite taille, n’engageant pas le pronostic vital. Ainsi, de nos jours, la fonction faciale est préservée dans 93 à 100% des cas (7,10,11,13,14) et l’audition dans 53,3% des cas (7). La préservation de la fonction auditive peut être optimisée par monitorage des produits de distorsion acoustiques selon Mom et al. (15) ou par monitorage des potentiels microphoniques cochléaires selon Lourenço et al. (16).
Par ailleurs, une des alternatives au traitement chirurgical est la radiothérapie : la radiothérapie unidose (type Gamma-knife) ou la radiothérapie fractionnée permettent un contrôle satisfaisant des SV, même si elles ont besoin de faire la preuve à long terme de leur innocuité et de leur efficacité en utilisant des doses faibles, recherchant une préservation fonctionnelle (1). La surveillance clinique et IRM des SV représente la deuxième alternative et trouve sa place du fait de l’évolutivité souvent faible de ces tumeurs.
En somme, l’indication d’un traitement chirurgical des SV est portée pour des tumeurs évolutives, et les fonctions faciale et auditive doivent être préservées au mieux. Les complications fonctionnelles sont d’autant moins bien acceptées par les patients qu’il s’agit d’une tumeur bénigne qui peut être surveillée plusieurs années.
24 Les fuites de liquide cérébrospinal (LCS) représentent la complication la plus fréquente après
la paralysie faciale et la dégradation auditive (17–20). Elles augmentent significativement le risque de méningites - complications pouvant engager le pronostic vital - qui surviennent dans 8 à 35% (21,22) des fuites de LCS non traitées et dans environ 1% (23) des cas de fuites de LCS traitées. Elles sont associées à une augmentation de la durée du séjour hospitalier et à une augmentation de la probabilité de reprise chirurgicale (19,24–30).
Les LCS ont été réduites, suite aux progrès de la chirurgie. Toutes voies d’abord confondues, Hoffman révise la littérature, de House en 1968, à Rodgers and Luxford en 1992 (29), et fait état d’une incidence de fuites de LCS allant de 0 à 30 %. Plus récemment, Selesnick et al. (31) rapporte, dans une méta-analyse concernant des études de 1985 à 2004, toutes voies d’abord confondues, une moyenne de 10,6% de fuites de LCS, sur 5964 patients.
Révéler d’éventuels facteurs de risque de fuites de LCS permettrait d’en limiter la survenue. De nombreuses études (32–35) ont tenté d’identifier des facteurs de risque de fuites de LCS et ont évalué les effets de mesures préventives variées. Parmi les facteurs évoqués, le degré de pneumatisation de l’os pétreux semble jouer un rôle important (26,36). En effet, quelque soit la voie d’abord, le LCS circule au travers des cellules pneumatisées de l’os pétreux qui sont exposées par fraisage au cours de la chirurgie, occasionnant alors une fuite sous forme de rhinorrhée et/ou d’otorrhée, via l’oreille moyenne.
L’objectif principal de cette étude est d’évaluer l’association entre le degré de pneumatisation de l’os pétreux et la survenue de rhinorrhée cérébrospinale (RCS) après chirurgie d’exérèse de SV par voie RS ou TL, par une analyse rétrospective de l’anatomie scannographique du rocher. Les objectifs secondaires sont l’analyse de l’influence de la voie d’abord, du sexe, de l’âge, de l’indice de masse corporelle (IMC), du stade du SV, de l’obturation de l’oreille
25 moyenne et de la trompe d’Eustache (TE) dans la voie TL et du colmatage du mur postérieur
du méat acoustique interne (MAI) dans la voie RS, sur l’incidence de la RCS.
MATÉRIELS ET MÉTHODES
Population
Un recueil rétrospectif des données concernant les patients opérés d’une exérèse de SV entre septembre 2003 et février 2018, en double équipe oto-neurochirugicale, au Centre Hospitalier Universitaire de Clermont-Ferrand, en France, est réalisé. Après exclusion des patients dont l’anatomopathologie de la tumeur est différente d’un schwannome (méningiome, kyste épidermoïde), le recueil compte 206 patients. 109 patients sont des femmes et 97 sont des hommes. 112 SV sont situés du côté droit et 94 du côté gauche. 164 résections sont réalisées par voie RS et 42 par voie TL. L’IMC est recueilli pour 187 patients.
Stade tumoral
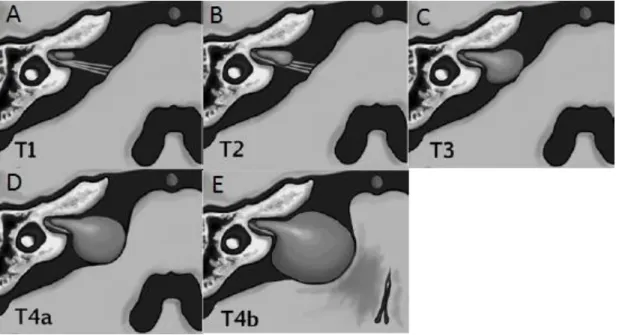
Les tumeurs sont classées en stade selon leur extension intra- et extraméatique, évaluée sur l’IRM pré-opératoire. Les tumeurs strictement intraméatiques sont classées stade I. Les tumeurs débordant la portion intraméatique et n’atteignant pas le tronc cérébral sont classées stade II. Les tumeurs atteignant le tronc cérébral sont classées stade III. Les tumeurs comprimant le tronc cérébral sont classées stade IVa. Les tumeurs atteignant la ligne médiane sont classées stade IVb (Figure 1).
26 Figure 1. Dessins schématiques représentant la classification du stade tumoral dans cette
étude (10). A : stade I, tumeur strictement intraméatique. B : stade II, tumeur débordant la portion intraméatique et n’atteignant pas le tronc cérébral. C : stade III, tumeur atteignant le tronc cérébral. D : stade IVa, tumeur comprimant le tronc cérébral. E : stade IVb, tumeur atteignant la ligne médiane.
Procédure chirurgicale
Les patients sont opérés en double équipe oto-neurochirurgicale. Dans tous les cas, la fonction nerveuse faciale est monitorée. Pour les voies RS, le monitorage auditif par produits de distorsion acoustiques ou potentiels microphoniques cochléaires a lieu si l’audition pré-opératoire est considérée comme utile selon la classification de la surdité selon l’American Academy of Otolaryngology – Head and Neck Surgery (Annexe I), c’est-à-dire avec un seuil tonal moyen inférieur ou égal à 50 dB HL et un score d’intelligibilité maximale supérieur ou égal à 50%.
27 Voie RS
Le patient est installé en décubitus dorsal, un billot sous l’épaule homolatérale à la tumeur, la tête fixée dans une têtière de Mayfield. La craniectomie est réalisée par un volet osseux occipital au ras du sinus sigmoïde et du sinus latéral, en évitant d’ouvrir les cellules péri-sigmoïdiennes. En cas d’ouverture de celles-ci, un colmatage est effectué avec, de manière variable, de la cire de Horsley, de la poudre d’os, du muscle et de la colle de fibrine. Après ouverture durale et vidange de la grande citerne, si la détente cérébelleuse n’est pas satisfaisante, une perfusion de 150 mL de Mannitol est administrée, le patient est hyperventilé et mis en position proclive. Le débulking de la tumeur est réalisé aux instruments froids et au CUSA (Cavitronic UltraSound Aspirator), en séparant méticuleusement la capsule tumorale des nerfs crâniens et du tronc cérébral. Le mur postérieur du MAI est fraisé pour permettre l’exposition de la portion intraméatique de la tumeur et sa résection rétrograde. Le colmatage des cellules exposées du mur postérieur du MAI n’est pas toujours précisé. Cette donnée est relevée afin de déterminer si elle est corrélée à la survenue de RCS. Le colmatage est réalisé, de manière variable, avec du muscle, de la cire de Horsley et de la colle de fibrine. La duremère est soigneusement suturée et étanchéifiée avec de la poudre d’os, de la colle de fibrine et parfois un patch musculaire. Le volet osseux est repositionné, suivi par la fermeture du plan musculaire, du plan sous-cutané et du plan cutané. La résection tumorale est la plus complète possible, parfois partielle si l’adhérence de la tumeur au tronc cérébral ou au nerf facial est importante.
28 Voie TL
Le patient est installé en décubitus dorsal. Une incision rétro-auriculaire en forme de C est réalisée à distance du pavillon. Un lambeau musculo-périosté en T - la barre transversale longeant la linea temporalis et la barre verticale rejoignant la pointe de la mastoïde - est levé. La mastoïdectomie permet de repérer l’antre et l’enclume. Une tympanotomie postérieure est effectuée. Puis, de manière inconstante, l’enclume est retirée puis la TE et la caisse du tympan sont toutes deux obturées par un fragment musculo-aponévrotique. Cette donnée est relevée afin de déterminer si elle est corrélée à la survenue de RCS. Les canaux semi-circulaires sont fraisés puis le vestibule ouvert. La méninge rétro-sigmoïdienne, pré-sigmoïdienne et temporale sont squelettisées. Le MAI est fraisé sur 180° puis la méninge ouverte et la citerne postérieure vidangée. Le débulking de la tumeur est réalisée aux instruments froids, de façon rétrograde et parfois au CUSA, en séparant méticuleusement la capsule tumorale des nerfs crâniens et du tronc cérébral. La cavité opératoire est colmatée avec de la graisse prélevée au niveau du flanc abdominal, fermeture renforcée par de la colle biologique et depuis peu, précédée d’un colmatage systématique de toutes les cellules exposées de l’os temporal par de la cire de Horsley. Les plans musculaire, sous-cutané et cutané sont fermés séparément. La résection tumorale est la plus complète possible, parfois partielle si l’adhérence de la tumeur au tronc cérébral ou au nerf facial est importante.
Identification des fuites de LCS
Il existe plusieurs types de fuites de LCS : les collections sous-cutanées de LCS en regard de la cicatrice et les fuites au travers de la cicatrice, la rhinorrhée, et l’otorrhée. La méningite
29 sans fuite constatée dite « méningite occulte » est parfois considérée comme un type de fuite
(26,27). Les patients suspects de RCS subissent un test de provocation. Les patients sont assis au bord du lit, tête penchée en avant durant quelques minutes. S’il n’y a pas de rhinorrhée, le test est considéré comme négatif. Si une rhinorrhée est constatée, un test révélant la présence de glucose dans le liquide est réalisé (bandelette urinaire) voire un dosage de la bétâ-2-transferrine (37) en cas de doute.
Traitement des fuites de LCS
Les patients présentant une RCS sont traités soit de façon conservative par ponction lombaire, diurétique type Acétazolamide, soit de façon chirurgicale par obturation de l’oreille moyenne et de la TE par voie transmastoïdienne, par exclusion d’oreille externe ou par obturation de l’orifice pharyngé de la TE par voie endonasale. La mise en place d’un drain lombaire ou d’une dérivation ventriculo-péritonéale est parfois complémentaire.
Les patients présentant une collection sous-cutanée de LCS en regard de la cicatrice ou une fuite au travers de la cicatrice sont traités soit de façon conservative par pansement compressif, ponction de la collection, ponction lombaire, diurétique type Acétazolamide, soit de façon chirurgicale par reprise de la fermeture de la cicatrice sous anesthésie générale. La mise en place d’une dérivation ventriculo-péritonéale est parfois complémentaire.
Evaluation scannographique de la pneumatisation temporale
Sur les 206 patients, 162 ont un scanner pré-opératoire, du crâne ou des rochers, en coupes osseuses.
30 Pour caractériser le degré de pneumatisation globale de l’os temporal, la classification décrite
par Han et al. (38) est utilisée (Figure 2). Le sinus sigmoïde est ici la structure de référence. Sur une coupe axiale, parallèle au plan de Francfort (Reid’s baseline), à l’étage où l’articulation incudo-malléaire apparaît comme un cornet de glace et où le MAI est visualisé, trois droites parallèles, faisant un angle de 45° dans la direction antérolatérale, sont mises en place : au niveau du point de jonction le plus antérieur entre le sinus sigmoïde et le rocher pour la première, au niveau du point de jonction le plus latéral entre le sinus sigmoïde et le rocher pour la deuxième et au niveau du point le plus postérieur du sinus sigmoïde pour la troisième. La pneumatisation péri-sigmoïdienne est classée en quatre groupes selon le degré de pneumatisation autour du sinus sigmoïde : le groupe 1 dit « hypopneumatisé » lorsque la pneumatisation reste antéromédiale à la première droite ; le groupe 2 dit « modérément pneumatisé » lorsque la pneumatisation s’étend dans l’espace entre les deux premières droites ; le groupe 3 dit « bien pneumatisé » lorsque la pneumatisation s’étend dans l’espace entre la deuxième et le troisième droites ; et le groupe 4 dit « hyperpneumatisé » lorsque la pneumatisation s’étend en postérolatéral, au-delà de la troisième droite. Cette classification est corrélée au volume de la pneumatisation totale de l’os temporal (38).
31
(a) (b)
(c) (d)
Figure 2. Classification de la pneumatisation péri-sigmoïdienne selon Han et al. (38). Trois droites parallèles, faisant un angle de 45° dans la direction antérolatérale, sont mises en place : au niveau du point de jonction le plus antérieur entre le sinus sigmoïde et le rocher pour la première, au niveau du point de jonction le plus latéral entre le sinus sigmoïde et le rocher pour la deuxième et au niveau du point le plus postérieur du sinus sigmoïde pour la troisième. (a) Groupe 1 : « hypopneumatisé », la pneumatisation reste antéromédiale à la première droite.
32 (b) Groupe 2 : « modérément pneumatisé », la pneumatisation s’étend dans l’espace entre les
deux premières droites. (c) Groupe 3 : « bien pneumatisé », la pneumatisation s’étend dans l’espace entre la deuxième et le troisième droites. (d) Groupe 4 : « hyperpneumatisé », la pneumatisation s’étend en postérolatéral, au-delà de la troisième droite.
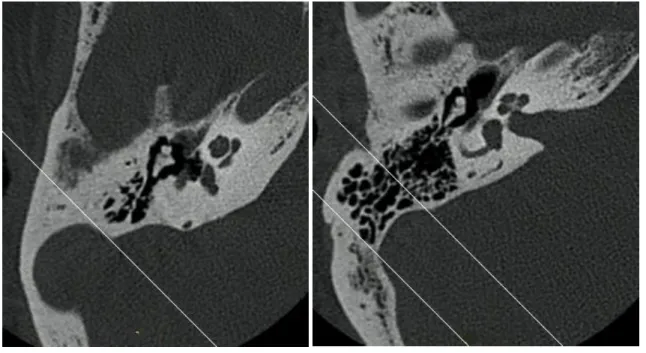
La pneumatisation au niveau de l’apex pétreux est relevée et classée en deux groupes (Figure 3). Sur les coupes axiales, parallèle au plan de Francfort (Reid’s baseline), si des cellules sont présentes au niveau de l’apex pétreux, celui-ci est considéré comme pneumatisé. Lorsqu’aucune cellule n’est retrouvée, alors l’apex pétreux est considéré comme éburné. La pneumatisation de l’apex pétreux est directement corrélée au volume de la pneumatisation totale de l’os temporal (39).
(a) (b)
Figure 3. Classification de la pneumatisation de l’apex pétreux. (a) Apex pétreux pneumatisé. (b) Apex pétreux éburné.
La pneumatisation du mur postérieur du MAI est relevée et classée en deux groupes (Figure 4). Sur les coupes axiales, parallèle au plan de Francfort (Reid’s baseline), pour lesquelles le MAI est visualisé, si des cellules sont présentes à moins d’un centimètre de la paroi postérieure du MAI, le mur postérieur du MAI est considéré comme pneumatisé et la distance
33 entre la paroi postérieure du MAI et la cellule la plus proche est mesurée. Lorsqu’aucune
cellule n’est retrouvée à moins d’un centimètre de la paroi postérieure du MAI, alors le mur postérieur du MAI est considéré comme éburné.
(a) (b)
Figure 4. Classification de la pneumatisation du mur postérieur du MAI. (a) Mur postérieur du MAI pneumatisé. (b) Mur postérieur du MAI éburné.
Analyse statistique
Toutes les analyses sont réalisées en formulation bilatérale pour un risque d’erreur de première espèce de 5% avec le logiciel Stata (version 15, StataCorp, College Station US). Ainsi, une différence est considérée comme statistiquement significative quand le degré de signification est inférieur à 5%. Les patients sont décrits par des effectifs et pourcentages pour les variables catégorielles et par la moyenne et écart-type associé ou la médiane et intervalle interquartile pour les variables de nature quantitative, au regard de leur distribution statistique. La normalité est étudiée par le test de Shapiro-Wilk. Les comparaisons entre groupes sont réalisées pour les variables quantitatives par analyse de variance (ANOVA) (ou test de Student), ou test de Kruskal-Wallis (ou test de Mann-Whitney) si les conditions d’application
34 des tests paramétriques ne sont pas respectées. L’homoscédasticité est étudiée par le test de
Bartlett. Les comparaisons entre groupes concernant les paramètres de nature catégorielle sont réalisées par le test du Chi2 ou le cas échéant par le test exact de Fisher.
RÉSULTATS
206 patients sont inclus dans l’étude. L’âge moyen des patients est de 53,6 ans (SD 12,8, 13-77 ans). 109 patients (52,9%) sont des femmes et 97 (47,1%) sont des hommes. 112 (54,4%) SV sont situés du côté droit et 94 (45,6%) du côté gauche.
L’IMC est recueilli pour 187 patients et est en moyenne à 25,5 kg/m² (SD 3,94, 17,3-37,6 kg/m²). 48,1% ont un IMC < 25, 37,4% sont en surpoids (IMC 25-29,9), 14,4% sont obèses (IMC 30-39.9) et aucun patient n’est obèse morbide (IMC ≥ 40).
8 patients (3,9%) présentent un SV stade I, 39 patients (18,9%) un stade II, 64 patients (31,1%) un stade III, 63 patients (30.1%) un stade IVa et 32 patients (15,5%) un stade IVb. 164 résections (79,6%) sont réalisées par voie RS et 42 (20,4%) par voie TL.
Un scanner pré-opératoire est réalisé chez 162 des 206 patients. Concernant la pneumatisation péri-sigmoïdienne, 5 patients (3,1%) sont classés dans le groupe 1, 33 (20,4%) dans le groupe 2, 28 (17,3%) dans le groupe 3 et 96 (59,3%) dans le groupe 4. 45 patients (27,7%) ont un apex pétreux pneumatisé et 117 (72,2%) éburné. 74 patients (45,7%) ont un mur postérieur du MAI pneumatisé et 88 (54,3%) éburné ; parmi les patients dont le mur postérieur du MAI est pneumatisé, la distance entre la paroi postérieure du MAI et la cellule la plus proche est mesurée pour 61 d’entre eux et la distance moyenne est de 4,4 mm (SD 3,2, 0,0-9,8), le 1er
35 La durée de suivi moyenne est de 2158 jours soit 5 ans, 10 mois et 28 jours (écart-type 1334,
5-5229 jours), avec une médiane à 2017. 25 patients (12,1%) présentent une fuite de LCS, dont 24 rhinorrhées et 1 otorrhée. Les fuites surviennent en moyenne au 157ème jour
(écart-type 610, 1-3111), avec une médiane à 7 et un troisième quartile à 25. Une comparaison des données démographiques entre les patients présentant une RCS et ceux ne présentant pas de RCS est présentée dans le Tableau I. 8 patients (3,6%) présentent une méningite, dont 6 à la suite d’une RCS. Une corrélation statistiquement significative entre la survenue de RCS et la survenue de méningites est retrouvée (p<0,001).
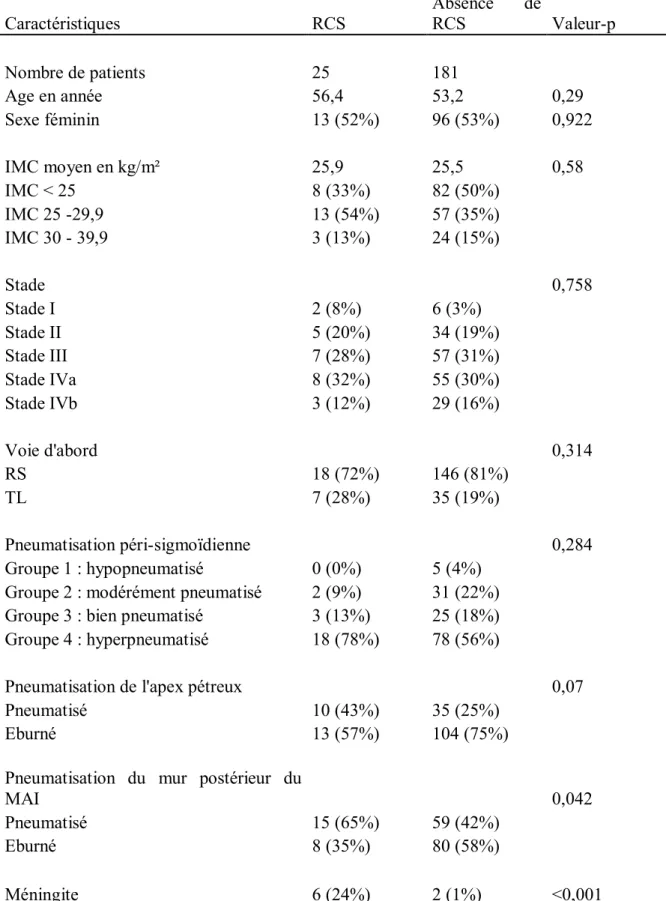
36 Tableau I. Comparaisons des données démographiques des 206 patients de l'étude avec
et sans RCS après résection chirurgicale de SV
Caractéristiques RCS Absence RCS de Valeur-p
Nombre de patients 25 181 Age en année 56,4 53,2 0,29 Sexe féminin 13 (52%) 96 (53%) 0,922 IMC moyen en kg/m² 25,9 25,5 0,58 IMC < 25 8 (33%) 82 (50%) IMC 25 -29,9 13 (54%) 57 (35%) IMC 30 - 39,9 3 (13%) 24 (15%) Stade 0,758 Stade I 2 (8%) 6 (3%) Stade II 5 (20%) 34 (19%) Stade III 7 (28%) 57 (31%) Stade IVa 8 (32%) 55 (30%) Stade IVb 3 (12%) 29 (16%) Voie d'abord 0,314 RS 18 (72%) 146 (81%) TL 7 (28%) 35 (19%) Pneumatisation péri-sigmoïdienne 0,284 Groupe 1 : hypopneumatisé 0 (0%) 5 (4%)
Groupe 2 : modérément pneumatisé 2 (9%) 31 (22%) Groupe 3 : bien pneumatisé 3 (13%) 25 (18%) Groupe 4 : hyperpneumatisé 18 (78%) 78 (56%)
Pneumatisation de l'apex pétreux 0,07
Pneumatisé 10 (43%) 35 (25%)
Eburné 13 (57%) 104 (75%)
Pneumatisation du mur postérieur du
MAI 0,042
Pneumatisé 15 (65%) 59 (42%)
Eburné 8 (35%) 80 (58%)
37 Parmi les patients opérés par voie TL, 32 (76,2%) ont une obturation de l’oreille moyenne et
de la TE. Parmi les patients opérés par voie RS, un colmatage des cellules exposées du mur postérieur du MAI est précisé pour 17 patients (10,4%).
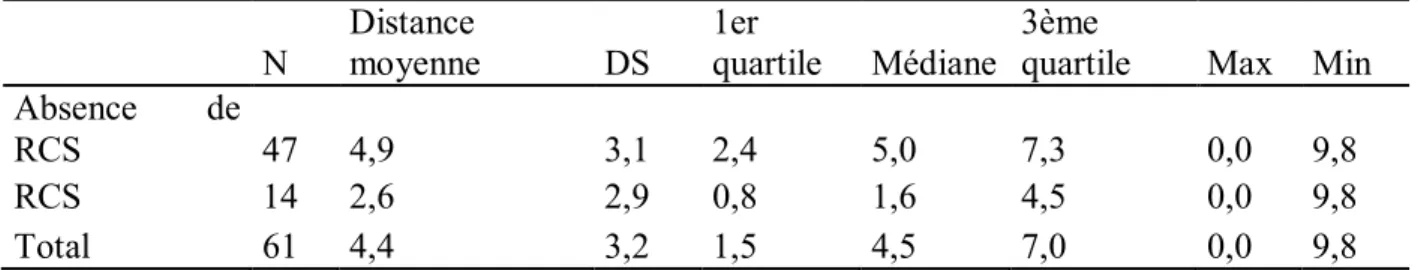
Toutes voies d’abord confondues, il n’est pas retrouvé de différence statistiquement significative dans la survenue de RCS entre les différents groupes de pneumatisation péri-sigmoïdienne (p=0,284). Il n’est pas retrouvé de corrélation statistiquement significative entre la pneumatisation de l’apex pétreux et la survenue de RCS (p=0,070). Une corrélation statistiquement significative entre la pneumatisation du mur postérieur du MAI et la survenue de RCS est retrouvée (p=0,042). Lorsque l’on considère les patients présentant un mur postérieur du MAI pneumatisé, la distance entre la paroi postérieure du MAI et la cellule la plus proche est inversement corrélée à la survenue de RCS, de façon statistiquement significative (p=0,02). La répartition des valeurs concernant ces patients est représentée dans le Tableau II.
Tableau II. Répartition des valeurs concernant la distance entre la paroi postérieure du MAI et la cellule la plus proche, parmi les patients présentant un mur postérieur du MAI pneumatisé
N Distance moyenne DS 1er quartile Médiane 3ème quartile Max Min Absence de
RCS 47 4,9 3,1 2,4 5,0 7,3 0,0 9,8
RCS 14 2,6 2,9 0,8 1,6 4,5 0,0 9,8
Total 61 4,4 3,2 1,5 4,5 7,0 0,0 9,8
38 Une corrélation statistiquement significative entre la pneumatisation du mur postérieur du
MAI et la survenue de RCS, après voie RS, est retrouvée (p=0,006). Il n’est pas retrouvé de corrélation statistiquement significative entre la pneumatisation de l’apex pétreux et la survenue de RCS, après voie TL (p=0.348).
Une corrélation statistiquement significative est retrouvée entre la pneumatisation péri-sigmoïdienne et celle de l’apex pétreux (p=0,048).
11,0% des voies RS présentent une RCS contre 16,7% des voies TL : il n’est pas retrouvé de corrélation statistiquement significative entre la voie d’abord et la survenue de RCS (p=0,314). 11,9% des femmes présentent une fuite de LCS contre 12,4% des hommes : il n’est pas retrouvé de corrélation statistiquement significative entre le sexe et la survenue de RCS (p=0,922). La moyenne d’âge des patients présentant une RCS est de 56,4 ans (SD 13,6, 28-75 ans) contre une moyenne de 53,2 ans (SD 12,7, 13-77 ans) chez les patients ne présentant pas de RCS : il n’est pas retrouvé de corrélation statistiquement significative entre l’âge et la survenue de RCS (p=0.29). L’IMC moyen des patients présentant une RCS est de 25,9 kg/m² (SD 3,8, 18,0-32,2 kg/m²) contre une moyenne de 25,5 kg/m² (SD 4,0, 17,3-35,6 kg/m²) chez les patients ne présentant pas de RCS : il n’est pas retrouvé de corrélation statistiquement significative entre l’IMC et la survenue de RCS (p=0,58). 25,0 % des stade I présentent une RCS, 12,8% des stades II, 10,9% des stades III, 12,7% des stades IVa et 9,4% des stades IVb : il n’est pas retrouvé de corrélation statistiquement significative entre le stade tumoral et la survenue de RCS (p=0,758) (Tableau I).
Parmi les patients opérés par voie TL, 20,0% des patients dont l’oreille moyenne et la TE ne sont pas obturées, présentent une RCS, contre 15,6% chez les patients dont l’oreille moyenne
39 et la TE sont obturées : il n’est pas retrouvé de corrélation statistiquement significative entre
l’absence d’obturation de l’oreille moyenne et de la TE et la survenue de RCS (p=1,00). Parmi les patients opérés par voie RS, 8,8% des patients pour lesquels les cellules exposées du mur postérieur du MAI ne sont pas colmatées, présentent une RCS, contre 29,4% chez les patients ayant un colmatage : le colmatage des cellules exposées du mur postérieur du MAI est statistiquement associé à la survenue de RCS (p=0,024).
DISCUSSION
Dans cette série, 25 patients (12,1%) présentent une RCS. Ce résultat est comparable aux données récentes de la littérature. Sur 17 études publiées entre 1991 et 2017 (Tableau III), on constate 0 à 17,3% de fuites de LCS (10,17,26,27,29,36,40–50). Une méta-analyse publiée en 2004 par Selesnick et al. (31), regroupant 25 études avec un total de 5964 patients, retrouve une moyenne de 10,2% de fuite de LCS. Nous avons choisi d’exclure les fuites de LCS transcutanées et les tuméfactions cicatricielles isolées, car ces dernières reflètent probablement davantage une hypertension intracrânienne post-opératoire plutôt qu’une origine mécanique de la fuite de LCS (43).
40 Tableau III. Données de la littérature concernant le taux de fuites de LCS et de
méningites après chirurgie d'exérèse de SV
Etudes Durée n Voies d'abord % fuite LCS % méningite Russel et al., 2017 (50) 2004 à 2013 275 TL 12,0 Copeland et al., 2015 (49) 09/1999 à 05/2013 457 RS, TL, SP 9,8 Stieglitz et al., 2011 (48) 2000 à 2007 519 RS 4,2 0 Goddard et al., 2010 (47) 01/2000 à 10/2008 61 TL 0,0 Stieglitz et al., 2010 (46) 2000 à 2007 519 RS 4,2 0 Stieglitz et al., 2009 (10) 01/2001 à 12/2006 420 RS 4,5 0 Jacob et al., 2007 (45) 359 RS, TL, SP 12,9 Fishman et al., 2004 (44) 01/1995 à 12/1999 196 RS, TL, SP 6,6 Becker et al., 2003 (43) 1979 à 2000 300 RS, TL, SP 11,0 0,7 Bani et Gilsbach, 2002 (42) 1989 à 2000 224 RS 6,3 0 Brennan et al., 2001 (41) 04/1975 à 06/1999 624 RS, TL 10,7 Falcioni et al., 1999 (40) 200 TL 0,0 0 Celikkanat et al., 1995 (36) 6 dernières années 129 TL 6,2 0 Nutik et Korol, 1995 (17) 156 RS 14,1 3,2 Hoffman, 1994 (26) 1979 à 1991 381 RS, TL 17,3 3,2 Rodgers et Luxford, 1993 (29) 1982 à 1988 723 TL 6,8 2,9 Bryce et al., 1991 (27) 04/1975 à 03/1990 321 RS, TL 13,4 5,3
SP = sus-pétreuse ; n est exprimé en unité ; l’étude de Brennan et al. (41) contient les patients de l’étude de Bryce et al. (27) ; l’étude de Stieglitz et al. réalisée en 2011 (48) reprend la même population que l’étude de Stieglitz et al. réalisée en 2010 (46).
8 patients (3,6%) présentent une méningite, dont 6 à la suite d’une RCS : une corrélation statistiquement significative entre la survenue de RCS et la survenue de méningite est retrouvée (p<0,001). Ces résultats sont comparables aux données récentes de la littérature. Sur 17 études publiées entre 1991 et 2017 (Tableau III), on constate 0 à 5,3% de méningites (10,17,26,27,29,36,40–50). Dans la méta-analyse publiée en 2004 par Selesnick et al. (31), 13
41 études font état du nombre de méningites, et retrouvent 86 méningites pour 2316 patients
opérés (3,7%) ; 60 % de ces méningites sont consécutives à une fuite de LCS et une corrélation statistiquement significative est établie entre les fuites de LCS et le risque de méningite (p<0,0001). Bryce and al. (27), Tos et Thomsen (51) et Hoffman (26) retrouvent cette corrélation statistiquement significative. Rodgers et Luxford (29) ne retrouvent pas cette corrélation mais expliquent leur résultat par le fait que, dans leur étude, les fuites de LCS, une fois constatées, sont stoppées rapidement. En effet, une reprise chirurgicale pour colmater la fuite de LCS est réalisée si le traitement conservateur (pansement compressif mastoïdien) n’est pas efficace au bout de 48 heures. Cette attitude est basée sur l’hypothèse que plus longtemps la fuite persiste, plus grande est la probabilité que le LCS soit contaminé. Cette hypothèse est étayée par Celikkanat et al. (36) qui concluent que l’intervalle de temps entre le début de la fuite de LCS et la reprise chirurgicale doit être court pour limiter le risque de méningite. Par ailleurs, ces résultats sont à nuancer car la plupart des études ne différencient pas les méningites bactériennes des méningites aseptiques et les critères diagnostiques de méningites varient selon les études.
Les RCS après exérèse de SV sont probablement multifactorielles. Un des facteurs suggéré est la pneumatisation du rocher, variable entre les individus. Cette dernière peut être systématisée en trois zones (52), illustrées dans la Figure 5 : les cellules mastoïdiennes, les cellules périlabyrinthiques divisées en groupes supralabyrinthique et infralabyrinthique, et les cellules de l’apex pétreux. Le groupe supralabyrinthique est lui-même divisé en groupes postéro-supérieur, postéro-médial et subarcuate (Tableau IV).
42 Figure 5. Coupe scannographique d’un rocher droit en coupe axiale. Systématisation de sa
pneumatisation en trois zones. CM, cellules mastoïdiennes ; CPL, cellules périlabyrinthiques ; CAP, cellules de l’apex pétreux.
Tableau IV. Classification scannographique des cellules du rocher (38,52) 1. Cellules mastoïdiennes a) Présinusiennes b) Sinusiennes c) Postsinusiennes 2. Cellules pétreuses a) Cellules périlabyrinthiques 1) Cellules supralabyrinthiques i) Cellules postérosupérieures ii) Cellules postéromédiales iii) Cellules subarcuates 2) Cellules infralabyrinthiques b) Cellules de l’apex pétreux
Dans la voie RS, lorsque le mur postérieur du MAI est fraisé, le LCS peut s’écouler à travers les cellules périlabyrinthiques et en particulier les cellules postéro-médiales, puis rejoindre l’antre mastoïdien, l’oreille moyenne et s’écouler par la TE. C’est le mécanisme principal de RCS pour cette voie d’abord, selon Hoffman (26), Bani et Gilsbach (42) et Stieglitz et al. (10,46,48). Hoffman constate l’absence de fuites de LCS en l’absence de fraisage contre 14 % de fuites de LCS lorsque le mur postérieur du MAI est fraisé (p=0,014) (26). Nutik et Korol (17) soulignent que les fuites de LCS sont potentialisées par le degré de fraisage du mur
43 postérieur du MAI. Cependant, le fraisage est nécessaire pour la résection de la partie
intraméatique du SV (10). Par ailleurs, on note l’importance de la pneumatisation apicale, au-dessus du MAI, qui peut être impliquée dans la RCS, lors d’un fraisage haut situé, en particulier lorsque le bulbe jugulaire est haut situé (46). Le deuxième mécanisme est l’infiltration du LCS à travers les cellules mastoïdiennes péri-sigmoïdiennes, ouvertes lors de la craniotomie. Le LCS gagne ensuite l’antre mastoïdien, l’oreille moyenne, puis la TE. Dans la voie TL, l’exposition des cellules apicales et périlabyrinthiques crée une route jusqu’à l’oreille moyenne et la TE pour le LCS. Les cellules apicales communiquent également avec les cellules péri-tubaires qui sont présentes dans 92% des cas où l’apex pétreux est pneumatisé (53) et constituent une voie directe vers la TE pour la RCS. Le LCS peut également passer dans l’oreille moyenne via le vestibule et la fenêtre ovale.
Par ailleurs, l’otoliquorrhée résulte d’un défect osseux dans le mur postérieur du méat auditif externe ou à travers une perforation tympanique.
44 Figure 6. Schéma des voies d’écoulement potentielles des RCS au niveau d’un rocher gauche
en coupe axiale, à l’étage du MAI, selon Nutik et Korol (17). A = antre mastoïdien, CAE = conduit auditif externe, CT = caisse du tympan, MAI = méat acoustique interne, SS = sinus sigmoïde. Les voies d’écoulement de RCS à travers les cellules du rocher sont modélisées par les flèches numérotées : 1 via les cellules de l’apex pétreux jusqu’au CT ou TE, 2 via le vestibule ouvert et la fenêtre ovale, 3 via les cellules périlabyrinthiques et l’antre mastoïdien, et 4 via les cellules mastoïdiennes péri-sigmoïdiennes ouvertes lors de la craniotomie.
Peu d’études s’intéressent à l’influence de la pneumatisation du rocher sur les RCS post-opératoires. Celikkanat et al. (36) et Yamakami et al. (54) retrouvent une incidence plus élevée de fuites de LCS dans les cas de rochers très pneumatisés. Stieglitz et al. (46) retrouvent une corrélation statistiquement significative entre le volume global de la pneumatisation pétreuse mesuré par tomodensitométrie et la survenue de fuites de LCS (p=0,0042). Ainsi, une augmentation de 10% du volume de pneumatisation augmente de 26% le risque de fuite de LCS. L’aire de pneumatisation à l’étage du MAI en coupe axiale est significativement corrélée au volume global de pneumatisation pétreuse (p<0,0001). Ainsi, une augmentation de 10% de l’aire de pneumatisation à l’étage du MAI augmente de 48 % le risque de fuite de LCS.
45 La choix de l’utilisation de la classification établie par Han et al. en 2007 (38) est basé sur la
corrélation statistiquement significative qu’il existe entre le degré de pneumatisation de la mastoïde péri-sigmoïdienne et le volume global de la pneumatisation pétreuse (p<0,001). De plus, le sinus sigmoïde et l’articulation incudo-malléaire en forme de cornet de glace sont des structures aisément identifiables, sur un scanner en coupes osseuses axiales. En pratique clinique, il est plus simple d’utiliser cette classification que de calculer une aire ou un volume de pneumatisation. D’autre part, nous avons choisi de relever le caractère pneumatisé ou non de l’apex pétreux car il est directement impliqué dans les RCS, surtout après voies TL. Le caractère pneumatisé ou non du mur postérieur du MAI est, quant à lui, directement impliqué dans les RCS, surtout lorsque ce dernier est fraisé dans les voies RS (26). Nous avons choisi la distance d’un centimètre entre la première cellule rencontrée et la paroi postérieure du MAI pour déterminer la pneumatisation du mur postérieure du MAI, du fait de la pertinence chirurgicale : en effet, un fraisage du mur postérieur du MAI dépasse rarement cette distance. Concernant la pneumatisation mastoïdienne péri-sigmoïdienne, Yamakami et al. (54) retrouvent 11% de mastoïde éburnée et Pellet et al. (55) 13 à 20% de mastoïde éburnée. Nos résultats, bien que difficilement comparables, semblent cohérents avec les données de la littérature avec 3,1% de mastoïde hypopneumatisée et 20,4% de mastoïde modérément pneumatisées. Concernant la pneumatisation du mur postérieur du MAI, Yamakami et al. (54) retrouvent 17% de pneumatisation, Lang et Kerr (56) 22% et Stieglitz et al. (48) 30%. Nous retrouvons 45,7% de pneumatisation, ce qui peut paraître important par rapport aux données de la littérature. Cependant, la définition du caractère pneumatisé du mur postérieur du MAI diffère selon les études, ce qui rend les données difficilement comparables (48). Concernant la pneumatisation de l’apex pétreux, Yamakami et al. (54) retrouvent 31% de pneumatisation et Virapongse et al. (39) 35%. Nous retrouvons 27,7% de pneumatisation, résultat comparable aux données de la littérature.
46 Toutes voies d’abord confondues, il n’est pas retrouvé de différence statistiquement
significative dans la survenue de RCS entre les différents groupes de pneumatisation péri-sigmoïdienne (p=0,284). Cependant, un échantillon de patients plus importants pourraient révéler une différence. On observe en effet 18,8% de RCS dans le groupe hyperpneumatisé, 10,7% dans le groupe bien pneumatisé, 6,1% dans le groupe modérément pneumatisé et 0% dans le groupe hypopneumatisé.
Toutes voies d’abord confondues, il n’est pas retrouvé de corrélation statistiquement significative entre la pneumatisation de l’apex pétreux et la survenue de RCS (p=0,070). Cependant, un échantillon de patients plus importants pourraient révéler une différence. On observe en effet 22,2% de RCS dans le groupe pneumatisé contre 11,1% de RCS dans le groupe éburné. En considérant uniquement les voies TL, nous ne retrouvons pas de corrélation statistiquement significative (p=0,348).
Toutes voies d’abord confondues, une corrélation statistiquement significative entre la pneumatisation du mur postérieur du MAI et la survenue de RCS est retrouvée (p=0,042). Lorsque l’on considère les patients présentant un mur postérieur du MAI pneumatisé, la distance entre la paroi postérieure du MAI et la cellule la plus proche est inversement corrélée à la survenue de RCS, de façon statistiquement significative (p=0,02) (Tableau II). En considérant uniquement les voies RS, la corrélation est encore plus importante (p=0,006). Ce résultat suggère l’importance d’analyser la pneumatisation du mur postérieur du MAI sur le scanner pré-opératoire, d’identifier les cellules ouvertes à ce niveau après résection du SV et de colmater les cellules visualisées (17,26,48). L’identification peut se faire visuellement au microscope, ou à l’endoscope comme l’a décrit Valtonen et al. (35). Un contrôle à la palpation à l’aide d’un crochet pointu peut également être réalisé.
47 Une corrélation statistiquement significative est retrouvée entre la pneumatisation
péri-sigmoïdienne et celle de l’apex pétreux (p=0,048), comme le montrent Yamakami et al. (p<0,01) (54).
Il n’est pas retrouvé de corrélation statistiquement significative entre la voie d’abord et la survenue de RCS (p=0,314). Hoffman (p=0,174) (26), Brennan et al. (p=0,46) (41), Becker et al. (p=0,82) (43) et Jacob et al. (45) ne retrouvent pas non plus d’association statistiquement significative. La méta-analyse de Selesnick et al. (31) réalisée en 2004, regroupant 25 études avec un total de 5964 patients, ne retrouve pas de différence statistiquement significative entre les trois principales voies d’abord (p=0,31) : 10,6% de fuites pour les voies RS, 9,5% pour les voies TL et 10,6% pour les voies sus-pétreuses (SP). Cependant, Bryce et al. (27) retrouvent statistiquement plus de fuites de LCS chez les patients opérés par voies d’abord combinées TL et voie de la fosse moyenne, comparativement à la voie RS et à la voie TL seule ; Copeland et al. (49) retrouvent statistiquement plus de fuites de LCS chez les patients opérés par voie TL (15%) que chez les patients opérés par voies RS ou SP (7%) (p=0,005).
Il n’est pas retrouvé de corrélation statistiquement significative entre le sexe et la survenue de RCS (p=0,922). Hoffman (26) et Copeland et al. (49) ne retrouvent pas non plus d’association statistiquement significative. Cependant, Russel et al. (50) publient en 2017 une étude sur 275 patients retrouvant significativement plus de fuites de LCS chez les hommes.
Il n’est pas retrouvé de corrélation statistiquement significative entre l’âge et la survenue de RCS (p=0,29). Rodgers et Luxford (29), Hoffman (26), Bani et Gilsbach (42), Becker et al.