THÈSE
Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR de médecine et de pharmacie
Institut de chimie des milieux et matériaux de Poitiers - IC2MP (Diplôme National - Arrêté du 25 mai 2016)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Santé-Environnement
Présentée par :
Astrid Bacle
Perturbateurs endocriniens et patients en insuffisance rénale chronique terminale : impact des techniques d'hémodialyse
sur l'exposition au Bisphénol A et à ses dérivés chlorés
Directeur(s) de Thèse : Antoine Dupuis, Sarah Thévenot Soutenue le 13 septembre 2017 devant le jury
Jury :
Président Valérie Sautou Professeur des Universités, PH, Université de Clermont-Ferrand Rapporteur Bertrand Decaudin Professeur des Universités, PH, Université de Lille 2
Rapporteur Gaël Grimandi Professeur des Universités, PH, Université de Nantes Membre Antoine Dupuis Maître de conférences, PH, Université de Poitiers Membre Sarah Thévenot Maître de conférences, Université de Poitiers
Membre Olivier Fardel Professeur des Universités, PH, Université de Rennes 1
Pour citer cette thèse :
Astrid Bacle. Perturbateurs endocriniens et patients en insuffisance rénale chronique terminale : impact des techniques d'hémodialyse sur l'exposition au Bisphénol A et à ses dérivés chlorés [En ligne]. Thèse
Santé-Environnement. Poitiers : Université de Poitiers, 2017. Disponible sur Internet <http://theses.univ-poitiers.fr>
1
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(Faculté Médecine et Pharmacie) (Diplôme National - Arrêté du 25 mai 2016)
Ecole Doctorale : Sciences pour l’environnement Gay Lussac
Secteur de Recherche : Santé-Environnement Présentée par :
Astrid BACLE
************************
Perturbateurs endocriniens et patients en insuffisance rénale chronique terminale : impact des
techniques d’hémodialyse sur l’exposition au Bisphénol A et à ses dérivés chlorés
************************ Directeur de Thèse : Dr Antoine DUPUIS Co-Directeur de Thèse : Dr Sarah THEVENOT
************************ Soutenue le 13 septembre 2017
devant la Commission d’Examen
************************
JURY
Pr Bertrand DECAUDIN Professeur (Université de Lille) Rapporteur
Dr Antoine DUPUIS Maitre de conférences (Université de Poitiers) Directeur
Pr Olivier FARDEL Professeur (Université de Rennes) Examinateur
Pr Gaël GRIMANDI Professeur (Université de Nantes) Rapporteur
Pr Valérie SAUTOU Professeur (Université de Clermont Ferrand) Examinateur
2
REMERCIEMENTS
A Monsieur le Professeur Bertrand DECAUDIN,
Je suis très honorée que vous ayez accepté de juger ce travail et d’en être rapporteur. Vos connaissances et activités dans le domaine de la pharmacie clinique et l’évaluation des dispositifs médicaux font toute mon admiration. Vos remarques me fourniront assurément des éléments pour améliorer ma réflexion.
A Monsieur le Professeur Gaël GRIMANDI,
Je suis très honorée que vous ayez accepté de juger ce travail et d’en être rapporteur. Vos connaissances et activités dans le domaine des dispositifs médicaux
apporteront un jugement pertinent pour l’évaluation de cette thèse. C’est avec
beaucoup d’intérêt que je prendrai connaissance de vos commentaires et critiques.
A Madame le Professeur Valérie SAUTOU,
Je suis très honorée que vous ayez (encore !) accepté de participer à ce jury et d’avoir juger ce travail.
A Monsieur le Professeur Olivier FARDEL,
Je suis très honorée de vous compter parmi les membres de mon jury et vous suis reconnaissante de l’intérêt porté à ce travail. Merci également de m’avoir accueilli dans votre équipe de recherche.
A Madame le Docteur Sarah THEVENOT,
Je te témoigne toute ma gratitude pour cette thèse. Merci de m’avoir pris « sous ton
aile » il y a cinq ans et de m’avoir proposé ce très beau sujet. Tes idées, ta
détermination, ta motivation (et ton humour !) font toute mon admiration. C’est sûr
nos longues discussions sur le sujet vont me manquer...
A Monsieur le Docteur Antoine DUPUIS,
Je vous témoigne également toute ma reconnaissance pour cette thèse. Merci de m’avoir encadré et guidé tout au long de mon internat et de m’avoir proposé ce sujet qui m’a tant passionné ! Je suis très admirative de votre travail. Vos cours d’anglais vont assurément me manquer !
3
Ce travail est le résultat d’un travail d’équipe,
Madame le Professeur Virginie MIGEOT, je vous remercie du soutien que vous m’avez témoigné toutes ces années. Votre management de l’équipe force toute mon admiration.
Madame le Professeur Sylvie RABOUAN, merci pour votre écoute, vos idées, et votre soutien dans les moments de doutes. Nos longues discussions au laboratoire vont me manquer.
Monsieur le Professeur Pascal CARATO, merci pour votre soutien et votre esprit ch’ti !
Merci à Pascale PIERRE-EUGENE, pour ton aide si précieuse toutes ces années, pour ton dévouement et ton organisation sans faille.
Merci à tous les membres de l’équipe : Manon, Marion, Claire, Laurence, Sabrina, Steeve, Nicolas, Bertrand et Guillaume.
Merci à Monsieur le Professeur GUILHOT de nous avoir accueilli au sein du CIC.
Merci également à toutes les personnes qui m’ont aidé et soutenu de loin comme de près,
Merci aux Pharmaciens du CHU de Poitiers, de m’avoir si bien accueilli et formé il y a déjà presque 6 ans !
Merci aux préparateurs de la pharmacie et les techniciens du laboratoire de pharmacocinétique du CHU de Poitiers,
Merci (tout plein !) à Sophie, pour ton soutien, ta disponibilité et ta détermination! Merci à mes (nouveaux) collègues Pharmaciens du CHU de Rennes,
Merci à mes nombreux co-internes de Poitiers,
Merci à mes parents, à mon frère et à Daphné pour leur soutien indéfectible, promis
après celle-là j’arrête !
Merci à ma famille,
Merci à Charlotte, pour son soutien et son accueil Rennais !
4
SOMMAIRE
LISTE DES ABREVIATIONS ET ACRONYMES 10
LISTE DES TABLEAUX 12
LISTE DES FIGURES 13
INTRODUCTION 14
1ère PARTIE : SYNTHESE BIBLIOGRAPHIQUE 17
Chapitre 1: La maladie rénale chronique et la dialyse 18
I. La Maladie Rénale Chronique 18
I.1. Définition, classification et terminologie 18
I.2. Méthodes d’estimation de la fonction rénale 19
I.3. Epidémiologie de la MRC 20
I.4. Dépistage et diagnostic 22
II. La prise en charge du patient par suppléance rénale 23
II.1. Les différentes techniques d’épuration extra-rénale 23
II.1.A. Hémodialyse en centre 23
II.1.A.a. Hémodialyse conventionnelle 24
II.1.A.b. Hémofiltration 25
II.1.A.c. Hémodiafiltration 26
II.1.A.d. Biofiltration libre d’acétate 28
II.1.B. Hémodialyse autonome 29
II.β. L’eau en hémodialyse 30
II.2.A. Qualité de l’eau d’alimentation des générateurs 31
II.2.B. Qualité du dialysat 35
II.2.C. Qualité du liquide de substitution 35
II.3. Les dispositifs médicaux 37
Chapitre 2: Micropolluants émergents et patients dialysés : exemple des
perturbateurs endocriniens 41
I. Les perturbateurs endocriniens 41
I.1. Définition 41
I.2. Classification 41
I.3. Mécanisme d’action 42
I.4. Présence dans l’environnement 45
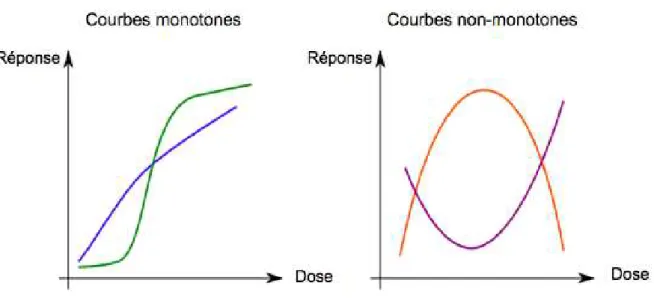
I.5. Courbe dose effet non monotone 45
5
II. Le Bisphénol A 47
II.1. Formules, propriétés physico-chimiques et usages 47
II.2. Aspects réglementaires 50
II.3. Présence dans l’environnement 51
II.4. Exposition de la population générale 52
II.5. Toxicocinétique 54
II.6. Mécanisme d’action et toxicité 56
II.6.A. Mécanisme d’action 56
II.6.B. Toxicité 57
III. les dérivés chlorés du BPA 62
III.1. Formation et propriétés physico-chimiques 62
III.β. Présence dans l’environnement et exposition de la population
générale 63
III.γ. Mécanisme d’action et toxicité 65
III.4. Toxicocinétique 67
Chapitre 3: Bisphénol A et patient hémodialysé 68
I. Présence du BPA dans les dialyseurs 68
6
2ème PARTIE : Exposition au BPA et aux ClxBPA du patient insuffisant rénal
chronique traité par hémodialyse 76
Chapitre 1: Approche « milieu » quantification du BPA et des ClxBPA apportés
par les dispositifs médicaux et l’eau utilisés en hémodialyse 79
I. Quantification du bisphenol A dans l’eau et les dispositifs médicaux utilisés
dans le traitement par hémodialyse 79
Résumé 79
Determination of bisphenol A in water and the medical devices used in
hemodialysis treatment 80
Abstract 80
I. Introduction 81
II. Materials and methods 84
II. 1. Water purification process 84
II. 2. Dialysis machine and dialysate 84
II. 3. Dialyzers 85
II.4. Water sample analysis 87
II.4.A. Sample preparation 88
II.4.B. Online SPE UPLC-MS/MS analysis 88
II.4.C. Method validation 89
II.4.D. Assigning values to non-detected/non-quantified data 89
II.5. Statistical analysis 89
III. Results and discussion 90
III. 1. BPA in rinsing solution, tubing and dialyzers 90
III. 2. BPA in water purification process 92
III. 3. BPA in dialysate 93
IV. Conclusion 94
Acknowledgments 95
7
II. Evaluation de l’exposition au bisphénol A et à ses dérivés chlorés lors du
traitement par hémodiafiltration en ligne 100
Résumé 100
Assessment of patient’s risk of exposure to bisphenol A and its chlorinated
derivatives during online hemodiafiltration 101
Abstract 101
I. INTRODUCTION 102
II. METHODS 104
II.1. Water purification process 104
II.2. Production of ultrapure dialysate 105
II.3. Replacement fluid 107
II.4. Tubing 108
II.5. Dialyzers 108
II.6. Water samples analysis 109
II.7. Statistical analysis 112
III. RESULTS 113
II.1. BPA and ClxBPA are detected throughout the water purification 113
II.2. Leaching of BPA from ultrafilters and dialysis concentrates 114
II.3. BPA and ClxBPA in ultrapure dialysate and replacement fluid 114
II.4. BPA leaching from tubing and HDF dialyzers 116
IV. DISCUSSION 117
8
Chapitre 2 : Approche clinique : mise au point de biomarqueurs d’exposition
au BPA et aux ClxBPA chez le patient hémodialysé 125
I. Quantification du bisphénol A et de ses dérivés chlorés dans l'urine humaine
par UPLC-MS/MS 126
Résumé 126
Reliable quantification of bisphenol A and its chlorinated derivatives in human
urine using UPLC-MS/MS method 127
Abstract 127
II. Détermination rapide et ultrasensible du bisphénol A et de ses dérivés
chlorés dans l’urine par UPLC-MS/MS 129
Résumé 129
Ultra-sensitive determination of bisphenol A and its chlorinated derivatives
in urine using a high throughput UPLC-MS/MS method 130
Abstract 130
III. Dosage plasmatique du bisphenol A et ses dérivés chlorés chez les patients
traités par hémodialyse : étude préliminaire 131
I. Introduction 131
II. Matériels et méthodes 133
II.1. Composés chimiques et réactifs 133
II.β. Réalisation de la gamme d’étalonnage et pré-traitements des
échantillons 133
II.3. Dosage des composés 134
II.4. Mise au point de la méthode de dosage 138
II.5. Etude des effets matrices 139
II.6. Recueil des échantillons 140
II.6.1. Les patients en IRCT 140
II.6.2. Population témoin 141
III. Résultats 141
III.1. Maitrise de la contamination par le BPA et ClxBPA 141
III.2. Etude des effets matrices 141
9
III.4. Mise en application de la méthode de dosage 143
IV. Discussion 145 V. Conclusion 146 DISCUSSION GENERALE 147 CONCLUSION 154 ANNEXES 157 REFERENCES BIBLIOGRAPHIQUES 178 RESUMES DE LA THESE 190
10
LISTE DES ABREVIATIONS ET ACRONYMES
AFSSA Agence Française de Sécurité Sanitaire de l’Alimentation AhR Aryl hydrocarbon Receptor
ANSES Agence nationale de sécurité́ sanitaire de l’alimentation, de l’environnement et
du travail
ANSM Agence Nationale de la Sécurité du Médicaments et des produits de santé
BBP Benzylbuthyl-phthalate
BPA Bisphénol A
BPA-G Glucuronide du BPA BPF Bisphénol F
BPS Bisphénol S
CAR Constitutive Androstane Receptor
CCE Commission des Communautés Européennes CE Commission Européenne
CG Cockcroft et Gault
CHDM 1,4-CycloHexaneDiMéthanol
ClxBPA Dérivés chlorés du bisphénol A
CMR Cancérogènes Mutagènes et toxique pour la Reproduction CPP Comité de Protection des Patients
DDT DichloroDiphénylTrichloroéthane DEHP Di(2-Ethyl-Hexyl)-Phtalate DFG Débit de Filtration Glomérulaire DJT Dose Journalière Tolérable DMS Dispositif Médical Stérile
DMT DiMéthyl Téréphtalate
DP Dialyse Péritonéale
DPA Dialyse Péritonéale Automatisée
DPCA Dialyse Péritonéale Continue Ambulatoire ECHA Agence européene des produits chimiques EFS Établissement Français du Sang
EFSA Autorité européenne de sécurité des aliments EI Etalons internes
EM Effets Matrices
Erα Estrogen receptor alpha Erβ Estrogen receptor beta
11
HAS Haute Autorité de Santé
HD Hémodialyse
HDF Hémodiafiltration
HDF-Ol Hémodiafiltration en ligne HF Hémofiltration
ICH International Conference on Harmonization of technical requirements for
registration of pharmaceuticals for human use
IMC Indice de Masse Corporelle
INRS Institut National de Recherche et de Sécurité IRC Insuffisance Rénale Chronique
IRCT Insuffisance Rénale Chronique Terminale
K/DOQI Kidney Foundation, Kidney Disease Outcomes Quality Initiative
LC/MS-MS Chromatopgraphie liquide couplée à la spectrométrie de masse en tandem LD Limite de Détection
LOQ Limit Of Quantification
MDRD Modification of Diet in Renal Disease MRC Maladie Rénale Chronique
NHANES National Health And Nutrition Examination Surveys NKF National Kidney Foundation
NORMAN Network of Reference laboratories and related organizations for monitoring
and biomonitoring of emerging polluants
OMS Organisation Mondiale de la Santé PE Perturbateur Endocrinien
Ph.Eur Pharmacopée Européenne
PM Poids Moléculaire pmh par million d’habitants
PPAR Peroxisome Proliferator-Activated Receptor PVC Polychlorure de vinyle
PXR Pregnane X Receptor
REIN Réseau Epidémiologie et Information en Néphrologie RES Réseau Environnement Santé
RXR Récepteur X rétinoïde
SCENIHR Scientific Committee on Emerging and Newly Identified Health Risks SHBG Sex Hormone Binding Globlulin
SPE Extraction en phase solide
TMCD β,β,4,4-tétraméthyl-1,3-cyclobutanediol TSH Thyroid Stimulating Hormone
UDPGA Acide UDP-glucuronique
12
LISTE DES TABLEAUX
Tableau 1: Stade de la maladie rénale chronique en fonction du débit de filtration glomérulaire ... 19 Tableau 2: Facteurs de risques de la MRC. ... 22 Tableau 3: Principes et modalités de traitement en hémodialyse (HD), hémofiltration (HF) et hémodiafiltration (HDF). ... 24 Tableau 4: Programme minimal annuel de contrôle des installations de traitement . 33 Tableau 5: Relations entre les contaminants de l'eau en HD et leurs effets toxiques potentielles ... 33 Tableau 6: Résultats bactériologiques et endotoxiniques de l'eau en HD et en HDF 36 Tableau 7: Exemples de familles de molécules à effets PE et de leurs sources
potentielles dans l'envirronnement ... 42 Tableau 8: Concentration en BPA dans différents types de nourritures et matériels non alimentaires. ... 53 Tableau 9:Synthèse de l'expertise de l'ANSES sur les effets sanitaires du BPA... 58 Tableau 10: Synthèse bibliographiques sur les niveaux de BPA libérés par les
dialyseurs et les conditions expérimentales utilisées ... 70 Tableau 11: Concentrations sanguines de BPA retrouvées dans la littérature ... 74
13
LISTE DES FIGURES
Figure 1: Principe de l'hémodialyse conventionnelle ... 25
Figure 2: Principe de l'hémofiltration ... 26
Figure 3: Principe de l'hémodiafiltration ... 27
Figure 4: HDF en post-dilution ... 27
Figure 5: HDF en pré-dilution ... 28
Figure 6: Différentes étapes de purification de l'eau en HD, HF et HDF. ... 31
Figure 7: Exemple de boucle de traitement d'eau pour hémodialyse (CHU de Poitiers). ... 32
Figure 8: Schéma d'un générateur de dialyse ... 39
Figure 9: Le système endocrinien ... 43
Figure 10: Différents types de récepteurs des xénobiotiques. ... 44
Figure 11: Exemples de courbes monotones et non-monotones... 46
Figure 12: Structure chimique du bisphénol A. ... 47
Figure 13: Devenir du BPA dans l'organisme après une administration par voie orale ... 55
Figure 14:Voies métaboliques majeures du BPA chez les mammifères. ... 56
14
15
L’Agence européenne des produits chimiques (ECHA) a classé le 16 juin 2017 le bisphénol A (BPA) comme substance « extrêmement préoccupante » pour ses propriétés de perturbation endocrinienne humaine.
Le BPA, largement utilisé depuis une cinquantaine d’années, comme monomère dans la production de plastiques de type polycarbonate et de résines époxys, est une substance ubiquitaire détectée dans les urines chez environ 95% de la population occidentale (1). Interdit depuis quelques années dans les biberons, il reste cependant présent dans de nombreux produits de la vie courante ainisi que dans certains produits de santé comme par exemple dans les dispositifs médicaux. Sa présence a notamment été démontrée dans les dialyseurs, utilisés dans le traitement des patients souffrant d’insuffisance rénale chronique terminale (IRCT). Dans son dernier rapport de février 2015, le Scientific Committee on Emerging and Newly Identified Health Risks (SCENIHR) a d’ailleurs conclu que les patients hémodialysés étaient particulièrement à risque vis-à-vis de l’exposition au BPA. En effet, cette
population est particulièrement surexposée en raison d’une accumulation du BPA
résultant d’une incapacité à l’éliminer par voie urinaire et d’une exposition chronique
par voie parentérale en raison d’un relargage par la coque et la membrane des
dialyseurs (2–6). A ce jour, seul le BPA provenant des dialyseurs a été intégré dans
l’évaluation des risques liés à cette exposition, car les apports provenant des autres
dispositifs médicaux (DM) utilisés en hémodialyse n’ont pas été étudiés. Il en est de
même pour l’eau qui est utilisée en grande quantité (environ 150 litres/séance) pour produire le dialysat nécessaire à la dialyse ou encore pour le liquide de substitution infusé au patient lors de l’hémodiafiltration en ligne (HDF-Ol). Il a pourtant été démontré que l’eau issue des usines de traitement d’eau potable pouvait contenir du BPA (7) voire des dérivés chlorés de ce dernier. Ces dérivés chlorés (ClxBPA),
résultent de la forte réactivité du BPA contenu dans l’eau avec le chlore utilisé pour
la potabilisation de cette dernière. Les ClxBPA, ont été reconnus, pour certains,
comme ayant une activité œstrogénique 105 fois plus importante que le BPA lui
16
L’objectif de notre travail a été d’étudier l’exposition au BPA et aux ClxBPA du patient souffrant d’IRCT traité par l’hémodialyse à travers deux approches complémentaires :
- la détermination des quantités de BPA et ClxBPA apportées par l’eau et
l’ensemble des dispositifs médicaux utilisés en hémodialyse conventionnelle et hémodiafiltration en ligne,
- le développement de biomarqueurs d’exposition afin de mesurer l’impact de
cette exposition chez le patient dans une approche clinique
La première partie de ce document aborde la maladie rénale chronique et les
techniques d’hémodialyse et présente une synthèse bibliographique concernant les
pertubateurs endocriniens (PE) et en particulier le BPA et ses ClxBPA. La problématique de l’exposition des patients hémodialysés à ces PE est également traitée.
La deuxième partie présente tout d’abord nos travaux concernant l’exposition au
BPA des patients traités par hémodialyse conventionnelle et l’exposition au BPA et à
ses ClxBPA des patients traités par HDF-Ol. Enfin elle expose les méthodes de
dosage que nous avons développées dans l’urine et dans le plasma afin d’estimer
l’exposition de ces patients au BPA et à ses ClxBPA.
Une discussion générale des résultats obtenus et une conclusion sont proposées à la fin de ce mémoire.
17
18
Chapitre 1: La Maladie Rénale Chronique et la dialyse
I. La Maladie Rénale Chronique
I.1. Définition, classification et terminologie
L’insuffisance rénale chronique (IRC) est la résultante d’une destruction anatomique irréversible des néphrons de plus de 60% de la masse. Dès le stade modéré de cette
pathologie, les néphrons sains s’hypertrophient sous l’influence des facteurs de
croissance, pour maintenir les capacités d’excrétion du rein et assurer l’équilibre
hydro-électrolytique de l’organisme. La capacité d’adaptation des néphrons
fonctionnels tend à dissimuler l’importance de la MRC, et retarde la prise en charge, car plusieurs facteurs en sont responsables :
- L’IRC est asymptomatique, longtemps silencieuse,
- l’âge élevé du patient,
- l’existence de pathologies associées.
Le concept de MRC a été développé en 2002 par une fondation internationale : la Kidney Disease Outcomes Quality Initiative (K/DOQI). Selon la K/DOQI « la MRC est définie, indépendamment de la néphropathie sous-jacente, par la présence de lésions rénales ou la baisse du Débit de Filtration Glomérulaire (DFG) < 60
ml/min/1.73 m2 pendant plus de 3 mois, et classée en 5 stades de sévérité croissante
évaluée par le niveau de DFG » (9).
En France, l’Haute Autorité de Santé (HAS) a donc actualisé en 2012, les différents stades de la MRC (tableau 1). Le stade 3 se distingue par deux niveaux de sévérité (3A et 3B) (10).
19
Tableau 1: Stade de la maladie rénale chronique en fonction du débit de filtration glomérulaire (10)
Stade DFG (ml/min/1,73 m²) Définition
1 > 90 Maladie rénale chronique*
avec DFG normal ou augmenté
2 entre 60 et 89 Maladie rénale chronique*
avec DFG légèrement diminué
3A entre 45 et 59
Insuffisance rénale chronique modérée
3B entre 30 et 44
4 entre 15 et 29 Insuffisance rénale chronique sévère
5 < 15 Insuffisance rénale chronique terminale
*avec marqueurs d’atteinte rénale : albuminurie, hématurie, leucocyturie, ou anomalies morphologiques ou histologiques, ou marqueurs de dysfonction tubulaire, persistant plus de 3 mois (deux ou trois examens consécutifs).
Si l’emploi du terme de MRC tend à se généraliser pour les stades 1 et β, il est usuel de parler d’insuffisance rénale chronique (IRC) modérée et sévère pour les stades γ et 4 et enfin d’insuffisance rénale chronique terminale (IRCT) pour le stade 5 de la MRC.
I.2. Méthodes d’estimation de la fonction rénale
En pratique clinique la fonction rénale est évaluée à partir de la créatinine sérique à l’aide d’équation permettant d’estimer le DFG. Ce dernier reste le meilleur marqueur quantitatif de la fonction rénale. Il permet le diagnostic et la classification en stades de gravité de la MRC. En 1976, une formule est proposée par Cockcroft et Gault (11) (CG):
Cette dernière, étant trop imprécise, devrait être abandonnée au profit de la formule MDRD (12) (Modification of Diet in Renal Disease), simplifiée en 2000 :
DFG-CG ml/min = [(140 – âge) x poids/créatininémie] x k avec créatininémie en μmol/L, poids en kg, âge en années ;
20
La formule CKD-EPI (13) proposée en 2009 (Chronic Kidney Disease- Epidemiology Collaboration), est actuellement recommandée en raison de meilleures performances pour les valeurs normales de DFG :
I.3. Epidémiologie de la MRC
- Epidémiologie de la MRC avant l’arrivée au stade d’IRCT (stade 1 à 4):
La MRC est un problème de santé publique majeur au niveau mondial. En 2015, 600 millions de personnes soit près de 10% de la population mondiale souffraient d'une MRC. L'Organisation Mondiale de la Santé (OMS) prévoit une augmentation de la prévalence de 17 % dans les 10 ans à venir (14).
La prévalence est variable d'un pays à un autre et l´accès aux traitements dépend du niveau socio-économique du pays concerné.
Aux Etats-Unis, la National Health And Nutrition Examination Surveys (NHANES), a montré une augmentation de la prévalence des stades 1 à 4 de la MRC de 13,7% entre 1999-2002 et de 14,7% entre 2011-2014. La NHANES estime à près de 23 millions d’américains touchés par la MRC en 2014 (15). Les données européennes sont peu nombreuses, mais une étude Norvégienne, publiée en 2007, a rapporté une prévalence de la MRC très proche de celle relevée aux Etats-Unis soit une prévalence de 10,2%, dont 4,4% de patients au stade 3-4 (16).
DFG-CKD-EPI = a*(créatininémie/b) c *(0.993) âge
- a = 166 (femme noire), 163 (homme noir), 144 (femme blanche), 141 (homme blanc) - b = 0.7 (femme), 0.9 (homme) - c = -0.γβ9 (femme avec créatinémie ≤ 0.7 mg/dl), -1.209 (femme avec créatinémie > 0.7), -0.411 (homme avec créatinémie ≤ 0.9), -1.209 (homme avec créatinémie > 0.9
DFG-MDRD ml/min/1,73m2 = 186,3 x créatininémie- 1,154 x âge- 0,203 x (0,742 si
femme) x (1,21 si africain)
avec créatininémie en mg/dL, âge en années.
–
créatininémie en μmol/L, poids en kg, âge en années k= 1,βγ pour l’homme, 1,04 pour la femme.
21
La prévalence des différents stades de la MRC est inconnue en France, seules des études transversales renseignent sur la fréquence des atteintes rénales notamment chez les sujets âgés. La HAS évalue à 10% la prévalence des adultes présentant un ratio albumine/créatinine urinaire > 3 mg/mmol ou un DFG inférieur à 60
ml/min/1,73m2. En 2016, la fondation du rein recense environ 3 millions de
personnes souffrant d'une MRC en France (17).
- Epidémiologie de l’IRCT (stade 5) :
La prévalence des patients recevant un traitement de suppléance rénale est estimée
dans de nombreux pays. Cette estimation permet d’approcher la prévalence du stade
5 de la MRC.
En France, en 2015, le registre du Réseau Epidémiologique et Information en Néphrologie (REIN), précise que près de 82 295 patients sont traités pour une IRCT (45 862 patients prévalents en dialyse et 36 433 porteurs de greffon) (18). Le nombre de nouveaux patients ayant démarré un premier traitement de suppléance rénale est de 11 093, soit un taux d’incidence de 166 par million d’habitants (pmh). L’âge médian des patients prévalents en dialyse est de 70,6 ans, et de 57,0 ans pour la greffe.
En Europe, le registre Européen Renal Association - European Dialysis and Transplant Association (ERA-EDTA) collecte les données sur l’incidence et la prévalence du traitement de suppléance rénale dans 35 pays européens. En 2014, le rapport estimait à 1γγ pmh l’incidence globale et une prévalence de 924 pmh (19). Aux Etats Unis, l’incidence de l’IRCT est la plus élevée au monde avec γ70 pmh et la prévalence de 2067 pmh.
- Incidence selon la maladie initiale:
En France, l’épidémiologie de la MRC s’est modifiée au cours des 20 dernières
années. Les glomérulonéphrites primitives qui représentaient les causes les plus fréquentes dans les années 1970 sont désormais la 3ème cause responsable de la MRC avec 12.0 % en 2015. Les néphropathies hypertensive et vasculaire (26%) et la néphropathie diabétique (22%) sont désormais les premières causes de la MRC. La distribution des néphropathies initiales diffère chez les hommes et chez les
22
femmes (p <0,0001) ; la proportion de néphropathie hypertensive est plus importante chez les hommes. Que ce soit au niveau européen ou américain, le constat est identique, l’hypertension et le diabète sont les deux premières causes responsables de la MRC.
I.4. Dépistage et Diagnostic
Le dépistage de la MRC repose dans un premier temps sur l’identification des
patients à risque. Les facteurs de risque de la MRC ont été décrits par la HAS en 2012 et par la National Kidney Foundation (NKF) en 2013 (20). Ils sont résumés dans le tableau 2.
Tableau 2: Facteurs de risques de la MRC (20).
Facteur de risque de la MRC Age > 60 ans
Sexe masculin Ethnicité
Conditions socio-économiques défavorables Hypertension artérielle traitée ou non
Diabète, obésité, syndrome métabolique Tabagisme
Maladie cardiovasculaire athéromateuse, insuffisance cardiaque Uropathie, malformation urinaire, lithiase rénale
Maladie auto-immunes Médicaments nephrotoxiques
Antécédents familiaux de maladies rénales
Chimiothérapie, radiothérapie, injection de produit de contraste Grossesse
Ce dépistage est réalisé une fois par an et porte sur :
- le dosage de la créatininémie avec estimation du DFG,
- la mesure de l’albuminurie à partir d’un échantillon urinaire.
La confirmation du diagnostic s’effectue lorsque les signes d’atteinte rénale (diminution du DFG, albuminurie, hématurie, leucocyturie, anomalie morphologique) persisteront pendant plus de 3 mois.
23
II. La prise en charge du patient par suppléance rénale
La prise en charge par une technique de suppléance rénale est habituellement
indiquée lorsque le DFG est inférieur à 15 ml/min/1,73 m2 ou lorsqu’apparaissent les
premières manifestations cliniques du syndrome d’insuffisance rénale terminale. Il
existe deux types de suppléance : la greffe rénale et l’épuration extra-rénale. Seules
les techniques d’épuration extra-rénale seront traitées dans ce chapitre.
II.1. Les différentes techniques d’épuration extra-rénale
Selon le dernier rapport français du REIN, les techniques se répartissent entre (18) : - l’hémodialyse (HD):
o en centre: modalité d’épuration extra rénale avec présence médicale
permanente,
o en unité de dialyse médicalisée (UDM): modalité hors centre, sans
nécessité de présence médicale permanente.
o autonome: modalité hors centre regroupant des patients autonomes en
autodialyse simple, autodialyse assistée ou en hémodialyse à domicile et également les patients en entrainement.
- la dialyse péritonéale (DP): modalité de traitement à domicile avec ou sans assistance par une infirmière diplômée d’état ou un membre de l’entourage. Plus de 55% des patients dialysés sont traités en centre. On note une augmentation
de l’UDM ces dernières années (18,9% en 2015) aux dépens de l’HD en centre et
surtout de l’HD autonome. En revanche, le recours à la dialyse péritonéale reste stable (6,5% des patients en 2015) (18).
II.1.A. L’hémodialyse en centre
Au 31/12/2015, 42 891 patients sont traités par HD (18). L’HD conventionnelle reste
la technique de référence en France. Elle est utilisée chez 70% des patients traités
par HD. L’hémodiafiltration (HDF) est utilisée dans 29.6% cas et l’hémofiltration (HF)
dans 0,2% des cas. L’HDF est une technique, dont l’utilisation est en constante
augmentation en France (prévalence augmentée de1,9% entre les deux rapports du REIN de 2014 et 2015). Ces techniques diffèrent par leurs modalités de transfert des
24
solutés : diffusion ou convection (21). D’une façon générale, ces techniques ont pour but d’éliminer les toxines urémiques et de corriger les désordres hydro-électrolytiques, phosphocalciques et acido-basiques. Les principes et modalités de mise en œuvre des principales techniques de dialyse sont reportées dans le tableau ci-dessous.
Tableau 3: Principes et modalités de traitement en hémodialyse (HD), hémofiltration (HF) et hémodiafiltration (HDF) (PM= poids moléculaire).
Mode de traitement HD HF HDF
Principe physique
majoritaire diffusion convection convection diffusion + Taille des molécules
épurées bas PM moyen PM moyen et haut PM Durée des séances 4 à 6 heures 2 à 3 heures 3 à 5 heures
Nombre
séance/semaine 3 à 4 3 à 4 3 à 4
débit sanguin 300 mL/min 200 mL/min 350-400 mL/min
II.1.A.a. L’hémodialyse conventionnelle
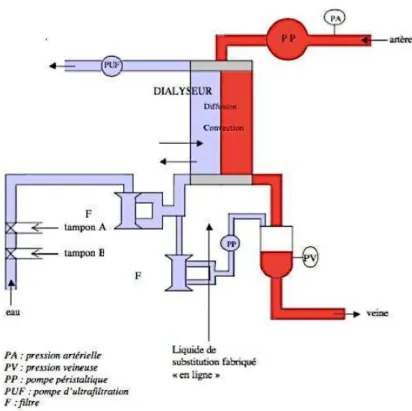
En HD conventionnelle, le transfert des déchets est diffusif. Ces transferts se font à travers une membrane semi-perméable extracorporelle dont la perméabilité varie selon le modèle (diamétres et nombres de pores différents) et contenue dans un dispositif médical stérile, le dialyseur. Il s’agit d’un transfert passif de soluté et de molécules de faible poids moléculaire contenu dans le sang selon un gradient de concentration du milieu le plus concentré vers le moins concentré. Les échanges se font avec un liquide : le dialysat. Le dialysat est obtenu par dilution d’une solution concentrée d’acide et de concentré de bicarbonate avec de l’eau pure (Figure 1).
Ces éléments sont mélangés au niveau du générateur d’HD à l’aide de pompes
proportionnantes. Sa composition électrolytique est proche du plasma sanguin normal. En sortie du dialyseur sont acheminés l’excès d’eau et les déchets (urée, créatinine) extraits du sang (22).
25
Figure 1: Principe de l'hémodialyse conventionnelle (23)
II.1.A.b. Hémofiltration
En HF, le transfert des solutés se réalisent par convection, selon un gradient de pression hydrostatique (24). A chaque séance, 30 à 40 litres de plasma sont ultrafiltrés pour éliminer les déchets en particulier l’urée, un tel volume doit être
compensé par la réinjection d’une solution stérile et apyrogène identique à celle du
dialysat utilisé en HD, à la différence que l'ion bicarbonate est le plus souvent remplacé par l'ion lactate. La solution peut être réinjecté à la sortie de l'hémofiltre (HF en post-dilution) ou à l’entrée de l’hémofiltre (HF en pré-dilution) (Figure 2). La réinjection peut également s’effectuer selon deux modalités qui peuvent être associées (dilution mixte). Au cours de la séance d'HF, les concentrations plasmatiques en électrolytes tendent à s'équilibrer sur celles de la solution de réinjection, de la même façon qu'en HD conventionnelle où les concentrations plasmatiques tendent à s'ajuster sur celles du dialysat. Cette régulation du bilan hydrique est obtenue en prescrivant un volume de réinjection correspondant au volume ultrafiltré diminué de la perte de poids souhaitée par rapport au poids initial du patient avant l’HF (22).
26
Figure 2: Principe de l'hémofiltration (23)
II.1.A.c. Hémodiafiltration
L’HDF est une technique d’épuration associant de façon concomitantes une composante diffusive (HD) à une composante convective (HF) permettant ainsi d’optimiser l’épuration des toxines urémiques de haut poids moléculaire (PM) ( > 5kD).
Le développement de cette technique nécessite la production « en ligne » d’un
liquide de substitution stérile, produit à partir d’un dialysat (Figure 3). Elle assure une dose élevée et contrôlée de volume convectif avec un liquide de substitution produit par ultrafiltration du dialysat. Le dialysat ultrapure est amené au dialyseur de haute perméabilité et le liquide de substitution est infusé selon la modalité d'HDF.
27
Figure 3: Principe de l'hémodiafiltration (23)
La composition du liquide de substitution est proche de celle du plasma. La substitution se fait de façon simultanée à la filtration et est isovolumique au volume filtré à laquelle on soustrait l'ultrafiltration liée à la perte de poids. La substitution peut s’opérer en post-dilution, en aval du dialyseur (Figure 4) ou en pré-dilution (Figure 5) en amont du dialyseur (25).
28
Figure 5: HDF en pré-dilution (26) (UF : ultrafiltre)
Maduel et al. ont montré une réduction de 30% de la mortalité toutes causes confondues, de 33% de la mortalité cardio-vasculaire et de 55% de la mortalité infectieuse en HDF par rapport à l’HD conventionnelle haut flux. La réduction de la mortalité est associée à l’infusion au patient d’un volume de liquide de substitution d’au moins βγ litres (27).
II.1.A.d. Biofiltration libre d’acétate
Cette technique consiste à utiliser un dialysat non physiologique puisque sans bicarbonate et sans substance tampon. Dans ces conditions, il existe une perte importante de bicarbonate de sodium à travers la membrane du dialyseur, ce qui revient à mettre le sang du patient en situation d'acidose métabolique à la sortie du dialyseur. Cette acidose est compensée par la réinjection, dans le circuit sanguin, d'une quantité importante de bicarbonate de sodium. Le débit de réinjection de cette substance est ajusté en fonction de la perte de bicarbonate qui dépend à la fois de la surface membranaire et du débit sanguin. En pratique 6 à 8 litres de bicarbonate de sodium à 1,4 % (167 mmol/L) sont réinjectés à la sortie du dialyseur (28). L'avantage de cette technique est de pouvoir apporter au patient la quantité nécessaire de bicarbonate pour un meilleur contrôle de l'équilibre acido-basique. Elle évite la précipitation de carbonates dans le dialysat, permet un entretien plus facile du
29
générateur. Elle évite aussi l'utilisation d'acide acétique et, donc, la présence d’acétate dans le dialysat.
II.1.B. Hémodialyse autonome
L’HD hors centre permet de prendre en charge, des patients autonomes en autodialyse simple, ou assistée ou en HD à domicile ainsi que les patients en entrainement.
L’autodialyse simple est réservée à des patients autonomes et formés à la technique d’HD, en mesure d’assurer eux-mêmes tous les gestes nécessaires à leur traitement. L’aide d’un(e) infirmier(e) peut être sollicitée pour la ponction pour le branchement. L’autodialyse assistée, est réservée à des patients partiellement autonomes, qui requièrent l’assistance d’un (e) infirmier (e) pour réaliser plusieurs gestes pendant la séance en allant du branchement au débranchement (29).
30
II.β. L’eau en hémodialyse
La qualité de l’eau pour hémodialyse répond à des critères de conformité
physicochimique et bactériologique définis par :
les articles R.1321-2 et R.1321-3 du Code de la Santé publique (30), la Pharmacopée Européenne édition en cours,
la circulaire DGS/DH/AFSSAPS n°2000-337 du 20 juin 2000 relative à la diffusion d’un guide pour la production d’eau pour l’hémodialyse des patients insuffisants rénaux (31),
la circulaire N°DHOS/E4/AFSSAPS/DGS/2007/52 du 30 janvier 2007 relative aux spécifications techniques et à la sécurité sanitaire de la pratique de l’hémofiltration et de l’hémodiafiltration en ligne dans les établissements de santé (32),
la norme NF S93-315 de Novembre 2008 « Fluides pour hémodialyse-Exigences et recommandations aux utilisateurs » (33).
Ces textes imposent de réaliser une analyse de risques destinée à anticiper les dysfonctionnements les plus fréquents liés aux conditions de traitement propres à
chaque installation. La circulaire du β0 juin β000 encadre la pratique de l’HD, et a été
complétée par celle du 30 janvier 2007 relative à l’HF et à l’HDF. L’eau pour
hémodialyse doit donc répondre aux normes de conformité́ physicochimiques et
bactériologiques, notamment définies par la Pharmacopée Européenne. Cette eau,
en tant que médicament, est sous la responsabilité́ du pharmacien hospitalier.
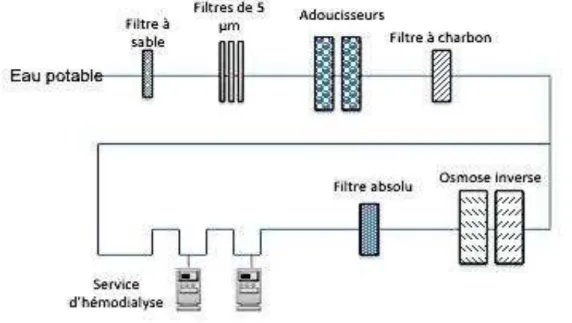
Il convient d’être particulièrement vigilant vis-à-vis des risques environnementaux et de la présence de contaminants potentiels, notamment les substances inorganiques (métaux lourds, nitrates) et les substances organiques (pesticides). Il est nécessaire de disposer d’un système de traitement permettant de garantir, en permanence, une qualité de production d’eau compatible avec la pratique de l’HDF-Ol. Il est conseillé d’utiliser un procédé de deux osmoses successives ou tout autre à efficacité similaire ou supérieure (32,33). Les différentes étapes de purification de l’eau en HD sont présentées dans la figure 6.
31
Figure 6: Différentes étapes de purification de l'eau en HD, HF et HDF (OI : Osmose Inverse, HD : Hémodialyse, HF : Hémofiltration, HDF : Hémodiafiltration).
II.2.A.Qualité de l’eau d’alimentation des générateurs
Cette eau est produite en continu à partir de l’eau de ville (réseau public) (Figure 6). La qualité de l’eau de ville alimentant l’hôpital, sous la responsabilité du distributeur, doit correspondre aux articles R.1321-2 et R.1321-3 du Code de la Santé publique
(30). L’eau pour hémodialyse requiert l'emploi successif de plusieurs techniques
complémentaires. L’utilisation combinée de ces techniques permet d’obtenir une eau aux qualités physico-chimiques et bactériologiques conformes aux recommandations de la Pharmacopée Européenne. L’eau pour hémodialyse est le constituant majeur du dialysat produit par le générateur de dialyse après mélange avec les concentrés.
En moyenne, 30 000 litres d’eau par an sont utilisés pour un patient traité par HD, à
raison de 3 séances par semaine.
Les différentes étapes de traitement d’eau sont (Figure 7) :
le filtre à sable permet la filtration grossière de l’eau. Une grande quantité de sable débarrasse l’eau de ses impuretés. La finesse de filtration est de γ0 à 40 µm.
les 3 filtres à cartouches éliminant les particules de taille ≥ 5 µm.
l’adoucisseur, résine échangeuse d’ions, déminéralise l’eau de ses ions Mg2+
et Ca2+, en échange d’ions Na+. L’appareil de mesure en aval, le testomat, permet de surveiller la dureté de l’eau.
32
le filtre à charbon a 3 actions : celle d’éliminer chlore et chloramines, absorber les matières organiques, les pesticides, les virus, les bactéries et filtrer les matières solides, les colloïdes.
l’osmoseur extrait les substances organiques et inorganiques de l’eau, par application d’une pression mécanique.
le filtre absolu retient les particules de taille ≥ à 0.β2 µm de l’eau.
Figure 7: Exemple de boucle de traitement d'eau pour hémodialyse (CHU de Poitiers).
Un contrôle des paramètres physico-chimiques, endotoxiniques et
microbiologiques est réalisé régulièrement et après chaque intervention majeure sur le système de production d’eau, et la boucle de distribution d’eau.
Paramètres physico-chimiques
Une analyse physico-chimique, en «départ de boucle», c’est à dire sur l’eau
alimentant la boucle de production, est obligatoire au démarrage de la technique pour validation de la mise en route du circuit. Puis il est recommandé de respecter au minimum le rythme et la nature des contrôles physico-chimiques préconisés par la circulaire du 20 juin 2000 (31), fondés sur le nombre de séances de traitement annuel par site (Tableau 4).
33
Tableau 4: Programme minimal annuel de contrôle des installations de traitement Nombre de séances assurées chaque année pour l’eau alimentant les générateurs
< 200 200 à 10 000 > 1000 à 10 000 > 10 000
1 fois/ an 2 fois/ an 4 fois/ an 12 fois/ an
Les valeurs des paramètres dosés doivent répondre aux normes de la Pharmacopée
Européenne en rigueur. Parmi les contaminants de l’eau pour hémodialyse, certains
ont de nombreux effets indésirables liés à une concentration trop élevée de métaux et d’ions (Tableau 5). Le respect des exigences de la Pharmacopée Européenne est primordial, en raison des échanges importants qui ont lieu entre le dialysat et le sang lors de la séance, du caractère chronique de ce traitement, et du risque d’accumulation chez le patient insuffisant rénal (IR).
Tableau 5: Relations entre les contaminants de l'eau en HD et leurs effets toxiques potentielles
Contaminants Sources Effets toxiques Seuil
Toxique
Aluminium Eau de ville «l’encéphalopathie du dialysé » (34),
ostéopathie, anémie 60 µg/L
Calcium-Magnésium
Eau de ville Syndrome de l’ « eau dure » : nausée,
vomissement ; céphalées, flush, myalgie, troubles tensionnels
88 mg/L
Chloramines Eau de ville Hémolyse, méthémoglobinémie (35).,
anémie 0.25 mg/L
Cuivre Canalisations
et générateurs Nausée, frisson, céphalées, hépatopathies, fièvre, hémolyse, anémie 0.49 mg/L
Fluor Eau de ville Ostéoporose, ostéomalacie (36). 1 mg/L
Nitrate Engrais Hémolyse, hypotension, cyanose, nausée,
méthémoglobinémie 21 mg/L
Sodium résines
échangeuses d’ions saturées
Hypertension, œdèmes pulmonaire,
tachycardie, tachypnée, vomissement, céphalée, insuffisance respiratoire, crise, coma, mort
300 mg/L
Sulfate Eau de la ville Nausée, vomissement, acidose métabolique 200 mg/L
Zinc canalisations
en « acier inoxydable
34
Il existe également des contaminants organiques solubles (acides humiques et fulviques), issus de la dégradation de la matière végétale, à pouvoir colmatant, renforcé par leur capacité́ à chélater des métaux naturels polyvalents (tels le fer, l’aluminium et la silice). La maîtrise de ces contaminants pose aux techniciens de maintenance des installations d’HD des problèmes aigus lorsque les capacités de traitement des usines du réseau de ville sont saturées. Une fraction de faible poids moléculaire de ces contaminants organiques (moins de β00 Da) subsiste dans l’eau pour hémodialyse, même après passage sur les cartouches de charbon actif et après l’osmose inverse. A l’heure actuelle, la présence de ces substances ne semble pas préoccupante (38).
Paramètres endotoxiniques et microbiologiques
o Les endotoxines1
Le taux d’endotoxines de l’eau d’alimentation des générateurs doit être inférieur à 0,25 UI/mL. Le prélèvement est effectué sur un tube apyrogène.
o Microbiologie
Les seuils sont différents selon la technique de dialyse pratiquée. Le nombre de microorganismes totaux doit être inférieur à 100 UFC/L (unités formant colonies) pour l’HDF et à 100 UFC/mL pour l’HD. Lorsque les deux techniques sont utilisées, c’est la valeur la plus exigeante qui doit être prise en compte soit celle de l’HDF : 100 UFC/L.
Le dénombrement des germes se fait sur un échantillon d’un litre d’eau d’alimentation des générateurs de dialyse prélevée en départ de boucle, en utilisant
la technique de filtration sur membrane à 0,45 μm, après mise en culture sur milieux
pauvres, de type TGEA (Tryptone Glucose Extract Agar, est un milieu développé
pour le dénombrement des micro-organismes dans l’eau) ou R2A (Reasoner´s 2A,
gélose utilisée pour les numérations des bactéries dans les eaux potables) pendant une durée minimale de 7 jours à 20-22°C (32). Au-delà des seuils cités précédemment, l’identification des microorganismes est indispensable.
1 Endotoxines : toxines situées dans la membrane de certaines bactéries Gram négatif, de
nature lipopolysaccharidique (LPS). Elles sont libérées lors de la lyse de ces bactéries et peuvent entrainer un choc septique.
35
II.2.B. Qualité du dialysat
Il existe deux types de dialysat : le dialysat utilisés en HD conventionnelle (anciennement appelé bain de dialyse), et le dialysat ultrapure utilisé en HDF.
La préparation du dialysat s’effectue en deux étapes d’ultrafiltration (Figure 8) :
- une filtration par le premier ultrafiltre de l’eau purifiée pour HD qui entre dans
le circuit hydraulique pour prévenir la contamination bactérienne à l’intérieur
du générateur de dialyse, pour former l’eau ultrapure. Cet ultrafiltre est installé
à l’arrière de l’appareil.
- une filtration de l’eau ultrapure à travers un 2ème ultrafiltre destiné à évacuer
les éventuelles bactéries provenant des concentrés. Cet ultrafiltre est installé à côté du premier ultrafiltre.
Pour l’HD conventionnelle comme pour l’HDF, les contrôles microbiologiques et endotoxiniques du dialysat doivent être effectués avant la mise en route puis une fois par mois durant le premier trimestre d’utilisation et ensuite une fois par trimestre, ou encore après chaque intervention sur le circuit hydraulique du générateur (à l’exception du remplacement des ultrafiltres), en tenant compte des recommandations du fabricant du système. Ces contrôles de dialysat seront effectués à l’entrée du dialyseur sur chaque générateur.
Les objectifs finaux doivent être inférieurs à 100 UFC/mL pour le dialysat de l’HD, 10 UFC/100 mL pour le dialysat ultrapure de l’HDF.
Concernant les endotoxines la limite admissible est la même que pour l’eau alimentant les générateurs c'est-à-dire à 0,25 UI/mL.
II.2.C. Qualité du liquide de substitution
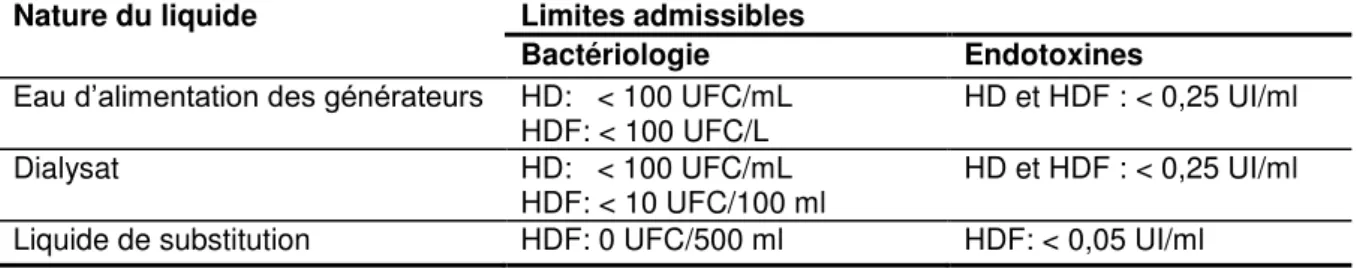
Pour la préparation en ligne du liquide de substitution (pour HDF et HF), une troisième étape s’ajoute aux deux 1ers ultrafiltres: la filtration du dialysat à travers un filtre à usage unique qui génère un liquide de substitution non pyrogène (Figure 8). Le liquide de substitution est produit par une nouvelle ultrafiltration du dialysat «ultrapure». Ce liquide de substitution ne doit contenir aucune bactérie (0 UFC/500 mL) dans l’échantillon prélevé et doit contenir moins de 0,05 UI/mL d’endotoxines.
36
Un contrôle microbiologique et endotoxinique sera réalisé pour chaque générateur avant sa mise en route, puis une fois par mois durant le premier trimestre d’utilisation et ensuite une fois par trimestre. Il porte sur un échantillon de 500 mL au minimum, prélevé avant le branchement ou après le débranchement du patient de la séance d’HDF.
Les résultats attendus pour les différentes eaux et liquides utilisés en HD sont résumés dans le tableau ci- dessous (Tableau 6).
Tableau 6: Critères bactériologiques et endotoxiniques pour l'eau pour hémodialyse, le dialysat et le liquide de substitution
Nature du liquide Limites admissibles
Bactériologie Endotoxines
Eau d’alimentation des générateurs HD: < 100 UFC/mL HDF: < 100 UFC/L
HD et HDF : < 0,25 UI/ml
Dialysat HD: < 100 UFC/mL
HDF: < 10 UFC/100 ml HD et HDF : < 0,25 UI/ml
37
II.3. Les dispositifs médicaux
Les dispositifs médicaux utilisés en HD font partie de la classe IIb. Ils représentent un niveau élevé de risque, principalement en raison des risques d'infection. L'Agence Nationale de la Sécurité du Médicaments et des produits de santé (ANSM) exerce une surveillance sur ces dispositifs dans le cadre de la matériovigilance.
Il est impératif d’utiliser des dispositifs médicaux (générateurs, moniteurs, filtres du dialysat) ayant le marquage CE en respectant les consignes du fabricant figurant dans la notice ou le manuel d’utilisation du dispositif (32).
Les différents dispositifs médicaux utilisés en hémodialyse
o Les dialyseurs
Le dialyseur ou « rein artificiel », est un dispositif médical stérile (DMS) et est l’un des principaux composants du système mis en place pour permettre l’HD. Le dialyseur est constitué de plusieurs milliers de fibres (ou capillaires), creuses et poreuses. L’assemblage de ces fibres contenues et scellées dans le dialyseur (coque le plus souvent en polycarbonate) constitue une membrane. Le fonctionnement du dialyseur reproduit le principe des échanges transmembranaires qui permettent de séparer sélectivement différentes substances.
Les principales caractéristiques des dialyseurs sont :
- la nature de la membrane, cellulosique ou synthétique,
- la géométrie et la surface en m2 : petite surface (< 1,0 m2), de surface
intermédiaire (entre 1,0 et 1,5 m2), et ceux de grande surface (entre 1,5 et 2,1
m2),
- le diamètre des capillaires, - la perméabilité,
38
En ce qui concerne la perméabilité, il importe de distinguer :
- la perméabilité diffusive : définissant l’efficacité, dépendant essentiellement de l’épaisseur et de la surface de la membrane, définie par le KoA (valeur de la clairance de l’urée pour des conditions déterminées),
- la perméabilité hydraulique (ou pente) dépendant de la porosité de la membrane définie comme le rapport de la surface totale des pores sur la surface totale de la membrane,
- le point de coupure (cut-off) se définissant comme la masse molaire la plus élevée d’un soluté pouvant traverser la membrane, et dont le principal déterminant est le diamètre.
Les dialyseurs utilisés au cours de HDF-Ol nécessitent des membranes de grande
surface > 2 m2 et de haute perméabilité (porosité > 40 mL/h/mm Hg), ils sont dit de
« haut-flux » (39).
o Les ultrafiltres
Les ultrafiltres sont composés de membrane à masse fibreuse creuse le plus souvent en polysulfone hautement adsorbante, utilisée comme filtre anti-bactérien et
anti-pyrogène pour la fabrication d’un liquide de dialyse ultrapure. C’est un élément
central du système qui sert en outre à la préparation du liquide de substitution pour l’HDF-Ol.
o Les générateurs de dialyse
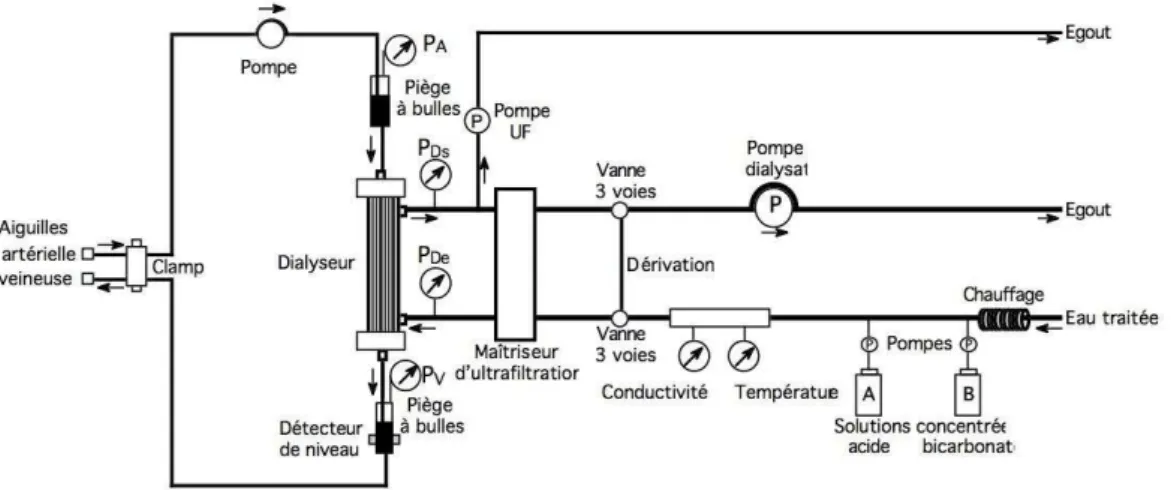
Les générateurs de dialyse sont des DM sous la double responsabilité du pharmacien hospitalier et des ingénieurs du biomédical qui assurent la maintenance. Ils permettent la séance de dialyse (Figure 8). Ce sont des dispositifs complexes qui assurent simultanément :
- la préparation du dialysat et son ajustement à la prescription médicale, - la circulation du dialysat à travers le dialyseur,
- la circulation sanguine dans le circuit extra corporel,
- le contrôle en continu de la composition du dialysat, de la quantité de liquide retirée au patient,
39
- le maintien à la température corporelle du patient.
Figure 8: Schéma d'un générateur de dialyse (40)
À ces fonctions élémentaires, s'ajoutent des options qui permettent également de
mesurer en continu différents paramètres, tel que l’évaluation des performances
d’épuration et le contrôle de la tolérance hémodynamique pour s'assurer de la qualité de la dialyse et la sécurité du patient (41).
Le dialysat (pour l’HD) et le dialysat ultrapure (pour l’HDF) sont préparés tout au long de la séance de dialyse par le générateur, à partir d'une eau ultrapure mélangée avec des solutions concentrées en ions et du bicarbonate de sodium (utilisé comme tampon). Historiquement, liquides, ces concentrés, considérés comme des médicaments, sont de plus en plus souvent sous forme de poudres sèches (limitant ainsi le risque de contamination microbiologique) contenus dans des cartouches. L’eau pour hémodialyse et les DM nécessaires aux séances de dialyse sont sous la responsabilité du pharmacien hospitalier.
Pour cela, il se doit, de connaître et de respecter les textes en vigueur notamment pour la qualité des différentes eaux en HD, ainsi que les fréquences de contrôle. Il doit également avoir une connaissance solide de la réglementation concernant les normes biochimiques, bactériologiques et endotoxiniques. Le pharmacien hospitalier doit avoir des notions sur les différentes techniques de traitement de l’eau pour hémodialyse afin de connaître les zones critiques de contamination pour cibler les points de prélèvements afin de valider la qualité de l’eau, et interpréter les résultats.
40
Le pharmacien hospitalier doit prendre en compte un certain nombre de caractéristiques communes à tous ces DM utilisés en HD:
- l’utilisation simple et sure, - le rapport qualité/prix, - la biocompatibilité2,
- l’absence de composés chimiques connus pour leur toxicité.
Les deux derniers critères demeurent les plus importants pour le pharmacien hospitalier.
Ces critères n’intègrent cependant pas encore les risques liés à la présence de
perturbateurs endocriniens comme le bisphénol A. Pourtant, sa présence a bien été démontrée au niveau des dialyseurs, aussi bien au niveau de la coque (polycarbonate) qu’au niveau des composants des membranes de dialyse
(polysulfone, polymethylmethacrylate, triacetate de cellulose et cellulose) (3–5).
2 Biocompatibilité : « capacité d’un matériau à être utilisé avec une réponse appropriée de
41
Chapitre 2: Micropolluants émergents et patients dialysés : exemple des perturbateurs endocriniens
Les perturbateurs endocriniens (PE) sont des substances chimiques capables de
«perturber» le système hormonal. Ils sont largement répandus dans l’environnement.
I. Les perturbateurs endocriniens
I.1. Définition
Selon l’Organisation Mondiale de la Santé (OMS) : « un perturbateur endocrinien est une substance ou un mélange exogène, ayant des propriétés susceptibles d’induire une perturbation endocrinienne dans un organisme intact, chez ses descendants ou au sein de sous-populations » (42).
I.2. Classification
L’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES), a été́ saisie en mai 2016 pour proposer des critères définissant les PE.
La Commission européenne (CE) a rendu public le 15 juin 2016 une proposition de critères d’identification des PE en trois catégories37:
- PE « avérés », - PE « présumés», - PE « suspectés ».
Parmi les substances « suspectées » d’être des PE, on retrouve les pesticides
organochlorés comme le dichlorodiphényltrichloroéthane (DDT), le
dibromochloropropane, les phtalates, et des plastifiants (alkylphénol) comme le BPA. En 2001, la commission des communautés européennes (CCE) a listé au moins 124 substances suspectes prioritaires, et la liste des substances à effet PE ne cesse de s’agrandir(44). Le tableau 7 présente quelques exemples de substances à effet PE et leurs sources (liste non exhaustive).
42
Tableau 7: Exemples de familles de molécules à effets PE et de leurs sources potentielles dans l'environnement (45)
Famille chimique Sources potentielles Exemples
Phtalates Matières plastiques, cosmétiques Dibutyl phtalate Alkylphénols Détergents, plastiques, pesticides Nonylphenol Hydrocarbures
aromatiques polycycliques
Sources de combustion: fumée de cigarette, émission des moteurs diesels, incendies
Benzo(a)pyrène
Polychlorobiphényls Transformateurs électriques PCB, Arochlor
Anciens pesticides Résiduels de stockage, pollution
rémanente DDT, Dieldrine, Chlordane
Autres pesticides Agriculture, nettoyages urbains,
jardins particuliers Atrazine, Ethylène, Thiourée, Heptachlor, Lindane, Malathion
Retardateurs de flamme
Mousses pour les mobiliers, tapis,
équipements électroniques Polybromodiphényles (PBDE)
Dérivés phénoliques Désinfectants, plastiques,
cosmétiques BPA, Parabens, Halogéno-phénols
I.γ. Mécanisme d’action
Les PE sont des substances chimiques d’origine naturelle ou artificielle étrangères à
l’organisme. Elles peuvent interférer avec le fonctionnement du système endocrinien (Figure 9) et induire des effets néfastes sur l’organisme d’un individu ou sur ses descendants (42). Ces substances peuvent interférer avec «la production, la sécrétion, le transport, le métabolisme, la liaison, l’action ou l’élimination des hormones naturelles» (46).
43
Figure 9: Le système endocrinien (47)
Les PE peuvent modifier le fonctionnement d’une partie du système endocrinien selon plusieurs mécanismes :
- en mimant l’action d’une hormone naturelle en se fixant sur le récepteur
cellulaire et en entrainant une réponse normale, c’est un mécanisme agoniste,
- en bloquant les récepteurs hormonaux, c’est un mécanisme antagoniste,
- en agissant sur la synthèse, le transport, le métabolisme et l'excrétion des hormones, modifiant ainsi les concentrations d'hormones naturelles.
Différentes catégories de récepteurs peuvent être activées par les PE. Il est possible de les classer en deux grands types :
- les récepteurs des xénobiotiques au sens strict : récepteur aux hydrocarbures aromatiques (AhR) de la dioxine et des hydrocarbures aromatiques polycycliques, récepteur pregnan X (PXR) capable de lier des médicaments et des pesticides, récepteur constitutif des androstanes (CAR),
- les récepteurs de composés endogènes comme les récepteurs hormonaux qui sont susceptibles d’être modulés par ces xénobiotiques (récepteurs aux œstrogènes ER α et ).
44
La principale fonction des récepteurs des xénobiotiques, comme par exemple PXR ou AhR, sont l’adaptation de l’organisme à l’afflux de xénobiotiques puisqu’ils sont responsables de l’induction de systèmes enzymatiques et de leur élimination.
Concernant les récepteurs de composés endogènes, leur activation illégitime par des facteurs environnementaux conduit à une perturbation endocrinienne ou métabolique (Figure 10).
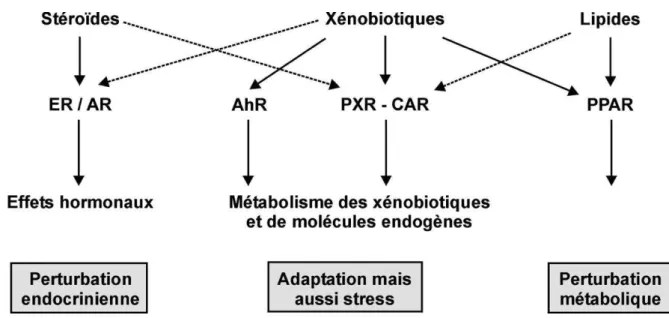
Figure 10: Différents types de récepteurs des xénobiotiques (48) (ER : récepteur aux œstrogènes, AR : récepteur aux androgènes, PPAR : récepteur activé par les
proliférateurs de peroxysomes, AhR : récepteur aux hydrocarbures aromatiques, PXR : récepteur pregnan X, CAR : récepteur constitutif des androstanes.
La toxicité d’un xénobiotique peut donc provenir simultanément de l’interaction avec
son récepteur spécifique et de l’interaction avec des récepteurs de composés
endogènes. Il est difficile d’établir une classification schématique des mécanismes d’action, d’autant que l’affinité de ces substances exogènes aux récepteurs de composés endogènes est également à prendre en compte. Les PE agissent à différentes étapes: synthèse des hormones, transport, métabolisme, ou encore liaison avec les récepteurs nucléaires constituant les cibles naturelles des hormones. Le mécanisme le plus fréquent reste la liaison au récepteur nucléaire, empêchant les ligands naturels de s’y fixer (48).
Par ailleurs, les PE peuvent perturber la synthèse des ligands de récepteurs