Évaluation de la structure épidermique des substituts
cutanés produits par la méthode d’auto-assemblage
Mémoire
Laetitia Angers
Maîtrise en sciences pharmaceutiques
Maître ès sciences (M.Sc.)
Québec, Canada
© Laetitia Angers, 2015
Résumé
Une adaptation de la méthode d’auto-assemblage développée au LOEX permet de produire des substituts cutanés bicouches ayant un phénotype psoriasique. Le premier objectif de ce travail était d’évaluer si une conservation par la congélation des substituts cutanés était envisageable afin d’avoir accès à ces derniers en tout temps pour effectuer des analyses physiochimiques sans délais. Les études réalisées sur des substituts sains montrent qu’elle ne l’est pas dans sa méthodologie actuelle puisqu’elle affecte la fonction barrière des substituts. Par ailleurs, en raison du rôle des lipides épidermiques dans la fonction barrière et de leur implication dans le psoriasis, une caractérisation de ces lipides a été effectuée par chromatographie en phase gazeuse. Les résultats obtenus montrent principalement une diminution de la proportion d’acide linoléique dans les substituts par rapport à la peau normale humaine. Ces résultats sont prometteurs en raison du rôle de cet acide et de ses métabolites dans l’inflammation.
Abstract
Adaptation of the self-assembly method developed at LOEX allows us to produce bilayered skin substitutes with psoriatic phenotype. The first aim of this study was to evaluate if freezing of the skin substitutes is possible without affecting its integrity, in order to access the skin substitutes in anytime to perform physicochemical analysis without delay. Results, obtained with control skin substitutes produced via the standard described self-assembly method, showed that freezing clearly affected the skin barrier function of the skin substitutes. Moreover, because of their implication in skin barrier and in psoriasis pathology, epidermal skin lipids of control and psoriatic skin substitutes were characterized by gas chromatography. Results showed mainly a significant reduction of the linoleic acid proportion in skin substitutes compared to normal human skin. These results are promising because of the implication of linoleic acid and its metabolites in inflammation.
Table des matières
Résumé ...iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations ... xv
Remerciements ... xvii
Avant-propos ... xix
1.
Introduction générale ... 1
1.1. La peau ... 2 1.1.1. L’hypoderme ... 3 1.1.2. Le derme ... 4 1.1.3. L’épiderme ... 4 1.1.3.1.La couche cornée ... 7 1.2. Le psoriasis ... 8 1.2.1. Histologie ... 10 1.2.2. Étiologie du psoriasis ... 111.3. Analyse des lipides par chromatographie ... 12
1.4. Les lipides de la peau saine ... 14
1.4.1. Les lipides de surface ... 14
1.4.2. Les lipides épidermiques ... 14
1.4.3. Les lipides de la couche cornée... 17
1.4.3.1.Les céramides ... 20
1.4.3.2.Les stérols ... 23
1.4.3.3.Les acides gras ... 24
1.5. Les lipides de la peau psoriasique ... 25
1.5.1. Les lipides du sérum ... 25
1.5.2. Les lipides de l’épiderme et du stratum corneum ... 26
1.6. L’absorption percutanée ... 27
1.6.1. Facteurs influençant la perméabilité de la peau ... 28
1.6.1.2.Les facteurs physicochimiques ... 29
1.6.2. Les voies de passage ... 29
1.6.3. Le flux ... 30
1.6.4. Les coefficients de diffusion et de partage ... 31
1.6.5. La méthode ... 31
1.7. La spectroscopie infrarouge à réflexion totale atténuée (ATR) ... 32
1.8. Le génie tissulaire ... 34
1.8.1. Modèles de substituts de peau saine ... 34
1.8.2. Modèles de substituts de peau psoriasique ... 36
1.8.3. Utilisation et conservation ... 37
1.9. Objectifs du projet ... 39
2.
Congélation des substituts cutanés ... 41
2.1. Résumé ... 42
2.2. Article ... 43
2.2.1. Abstract ... 44
2.2.2. Introduction ... 45
2.2.3. Material and methods ... 48
2.2.4. Results ... 51
2.2.5. Discussion ... 54
2.2.6. Conclusion ... 57
2.3. Legend to Figures ... 58
2.4. Acknowledgements ... 58
2.5. Tables and figures ... 59
2.6. References ... 65
3.
Analyses des lipides épidermiques ... 69
3.1. Mise en contexte... 70
3.2. Matériel et méthodes ... 70
3.2.1. Extraction et culture cellulaire ... 70
3.2.2. Méthode d’auto-assemblage ... 71
3.2.3. Isolation de l’épiderme ... 72
3.2.4. Analyses chromatographiques ... 73
3.2.4.1.Analyses par chromatographie sur couche mince (HPTLC) ... 73
3.2.4.2.Analyses par chromatographie gazeuse ... 74
3.2.5. Analyses statistiques ... 76
3.3. Résultats et discussion ... 76
3.3.1. Méthode d’analyse ... 76
3.3.3. Analyses par chromatographie en phase gazeuse des lipides
épidermiques d’une peau saine et des substituts sains ... 80
3.3.3.1.Phospholipides ... 80
3.3.3.2.Triglycérides ... 84
3.3.4. Analyse par chromatographie en phase gazeuse des lipides épidermiques des substituts sains et psoriasiques ... 85
3.3.4.1.Phospholipides ... 85
3.3.4.2.Triglycérides ... 86
3.4 Conclusion ... 88
4.
Conclusions ... 91
4.1. Conclusions par objectif ... 92
4.2. Limitations ... 94
4.3. Perspectives ... 94
Bibliographie ... 97
Liste des tableaux
Tableau 3.1 Étapes d’extraction des lipides ... 73 Tableau 3.2 Liste des standards pour les analyses par HPTLC ... 73 Tableau 3.3 Acides gras analysés par chromatographie en phase gazeuse ... 77
Liste des figures
Figure 1.1 Couches de la peau normale humaine ... 2
Figure 1.2 Couches de l’épiderme de la peau normale humaine ... 5
Figure 1.3 Différenciation des kératinocytes au travers des différentes couches de l’épiderme ... 6
Figure 1.4 Représentation « Briques dans le mortier » des cornéocytes de la couche cornée 8 Figure 1.5 Les cinq différentes formes de psoriasis ... 9
Figure 1.6 La boucle inflammatoire du psoriasis ... 12
Figure 1.7 Variation de la concentration de certains lipides au travers des couches de l’épiderme, en % massique ... 16
Figure 1.8 Composition lipidique de l’épiderme dans ses différentes couches, en % massique ... 16
Figure 1.9 Formation des feuillets lipidiques bilamellaires ... 18
Figure 1.10 Formation des feuillets lipidiques ... 20
Figure 1.11 Les différentes classes de céramides ... 21
Figure 1.12 Voies de formation des céramides ... 23
Figure 1.13 Structure du cholestérol ... 24
Figure 1.14 Les voies de passage au travers de la couche cornée ... 30
Figure 1.15. Cellule de Franz statique ... 32
Figure 1.16 Spectre infrarouge d’une peau normale humaine ... 33
Figure 3.1 Séparation des lipides sur plaque chromatographique ... 75
Figure 3.2 Exemple d’une TLC obtenue par le système de séparation des céramides en 1D ... 79
Figure 3.3 Proportion des lipides épidermiques des biopsies de peau et des substituts sains dans la fraction « Phospholipides » ... 80
Figure 3.4 Structure de l’acide linoléique ... 81
Figure 3.5 Série des oméga-3 et 6 ... 82
Figure 3.6 Métabolites des acides oméga-6 ... 84
Figure 3.7 Proportion des lipides épidermiques des biopsies de peau et des substituts sains dans la fraction « Triglycérides» ... 85
Figure 3.8 Proportion des lipides épidermiques des substituts sains et psoriasiques dans la fraction « Phospholipides» ... 86
Figure 3.9 Proportion des lipides épidermiques des substituts sains et psoriasiques dans la fraction « Triglycérides» ... 87
Figure 3.10 Longueur de chaines des lipides épidermiques des substituts sains et psoriasiques dans la fraction « Triglycérides» ... 88
Liste des abréviations
12‐HETE Acide 12‐hydroxyeicosatétraénoïque 3T3 3‐day transfer, inoculum 3 x 105cell ADN Acide désoxyribonucléique APCI Atmospheric‐pressure chemical ionization ATR Attenuated total reflectance CER Céramide DMEM Dulbecco's modified Eagle medium DMSO Diméthylsulfoxyde EDTA Acide éthylène diamine tétraacétique EGF Facteur de croissance épidermique ELSD Evaporative light scattering detector ESI Electrospray ionization FDA Food and Drug Administration FID Flame ionization detector FNHS Frozen normal human skin FSS Frozen skin substitute FTIR Fourier transform infrared spectroscopy GC Chromatographie en phase gazeuse HDL High density lipoprotein HPLC High performance liquid chromatography HPTLC High performance thin layer chromatography K Kératine K2CO3 Carbonate de potassium,KCl Chlorure de potassium LDL Low density lipoprotein LOEX Laboratoire d'organogénèse expérimentale MAP microtubule‐associated protein MCT mercury cadmium telluride MRP‐8 Myeloid‐related protein 8 MS Spectrométrie de masse n‐3 Oméga‐3 n‐6 Oméga‐6 NHS Normal human skin NPLC Normal‐phase liquid chromatography PBS Phosphate buffered saline PUFA Polyinsaturated fatty acids SCID Severe combined immunodeficiency SD Écart‐type SKALP Skin‐derived antileukoprotease SS Skin substitute SSLs Skin surface lipids TGF Transforming growth factor TOF‐MS Time of flight mass spectrometry UPLC Ultra performance liquid chromatography VLDL Very low density lipoprotein
Remerciements
La réalisation de mes travaux de maîtrise s’est effectuée au Laboratoire d’Organogénèse Expérimentale (LOEX) du Centre hospitalier universitaire de Québec (Hôpital Enfant-Jésus) sous la direction du Dr Roxane Pouliot.
Je tiens tout d’abord à remercier ma directrice de recherche, le Dr Roxane Pouliot, pour son support tout au long de mes études. Ses conseils, sa grande disponibilité et son écoute ont été grandement appréciés et m’ont permis d’apprendre et de progresser tout au long de mon cheminement à la maîtrise.
Je veux également remercier tous les membres de l’équipe de recherche, en particulier Jessica Jean et Isabelle Gendreau pour leur aide et leurs conseils. Merci spécialement à Sarah Dubois Declercq avec qui j’ai réalisé la première partie de mon projet. Sa présence et son soutien auront permis de mener à bien ces travaux communs.
Je profite de l’occasion pour remercier tous les membres du LOEX, en particulier ceux de mon bureau pour leur dynamisme. Merci à François Dominique Scott pour son aide en statistique et à Marie Leroy pour son support lors des analyses en infrarouge.
Merci également aux organismes subventionnaires suivants : FQRNT, CRSNG et IRSC ainsi qu’à Hydro-Québec pour leur support financier.
Finalement, un merci tout particulier à ma famille et à mes proches qui m’ont encouragée tout au long de mes études.
Avant-propos
Le deuxième chapitre de ce mémoire fait l’objet d’un article intitulé ATR-FTIR and drug
permeation studies of cryopreserved human tissue-engineered skin substitutes for pharmaceutical studies perspective qui sera soumis dans le journal Skin Pharmacology
avec Sarah Dubois Declercq et moi-même comme coauteurs principaux en raison d’une contribution équivalente à cet article.
J’ai développé et réalisé la majorité des expériences de ce projet conjointement avec Sarah Dubois Declercq. Les extractions cellulaires des kératinocytes et fibroblastes utilisés pour la production des substituts sains avaient préalablement été effectuées par d’anciens membres du groupe de recherche. La production des substituts cutanés a été effectuée avec Sarah Dubois Declercq dans un partage des tâches égal sous la supervision initiale de Jessica Jean. Les analyses d’absorption percutanée ont principalement été réalisées par Sarah Dubois Declercq, mais j’ai participé au traitement des données avec l’aide de celle-ci et de Marielle Robert. J’ai réalisé les analyses de spectroscopie infrarouge et j’en ai analysé les données. Les analyses statistiques ont été prises en charge par Sarah Dubois Declercq. Finalement, Sarah Dubois Declercq et moi avons rédigé l’article sous la supervision du Dr Roxane Pouliot.
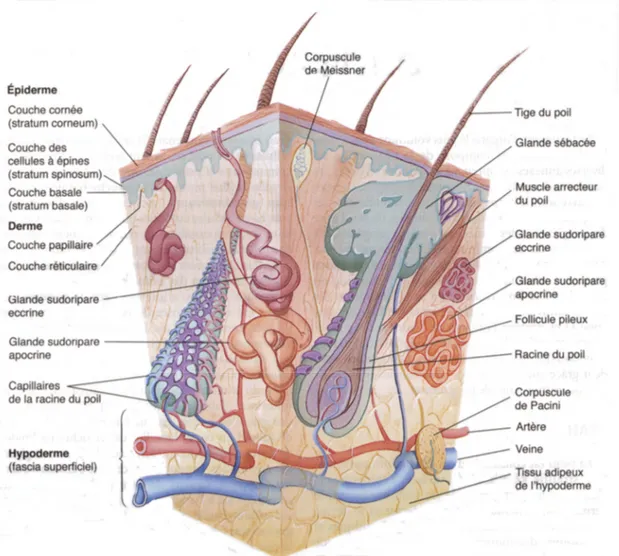
1.1. La peau
La peau est un épithélium d’un poids moyen de 4 kg, d’une superficie d’environ 2 m2 et
d’une épaisseur moyenne de 2 mm (Mélissopoulos & Levacher, 1998; Schaefer & Redelmeier, 1996), ce qui en fait le plus grand et le plus lourd organe du corps humain. Cet organe simple en apparence, mais complexe en réalité, est formé de trois couches : l’épiderme, le derme et l’hypoderme (Marieb, 2005). La peau joue un rôle crucial à différents niveaux par l’action de ses quatre principales fonctions (Gartner & Hiatt, 2007).
Figure 1.1 Couches de la peau normale humaine (Tirée de (Gartner & Hiatt, 2007))
1) Tout d’abord, constituant l’interface entre l’intérieur du corps et le monde extérieur, la peau joue un rôle de protection très important. Elle agit en tant que barrière physique,
chimique, biologique et immunologique pour contrer les agents pathogènes (Harding, 2004) En tant que barrière, la peau permet aussi de réguler la perte d’eau. Différents mécanismes interviennent pour assurer cette fonction de barrière. Parmi ceux-ci se trouvent un système de défense immunitaire basé sur l’interaction entre différents types cellulaires (Gartner & Hiatt, 2007; Ovalle & Nahirney, 2008) de même que la présence d’une couche acide en surface. Effectivement, la couche cornée est à un pH variant entre 4 et 5,5, ce qui lui confère des propriétés antiseptiques (Choi, et al., 2007).
2) La peau agit également comme thermorégulateur. En effet, elle permet de maintenir la température du corps humain à une température d’environ 37°C (Mélissopoulos & Levacher, 1998). Cette thermorégulation est rendue possible grâce à la présence des poils et des glandes sudoripares (Heath, et al., 2008) de même qu’à la contraction et dilatation des vaisseaux sanguins (Eroschenko & di Fiore, 2012). L’hypoderme agit également comme couche isolante.
3) Différents récepteurs tactiles et sensoriels se retrouvent dans la peau, ce qui lui confère des propriétés au niveau de la perception. Les récepteurs sensoriels qui s’y retrouvent sont des mécanorécepteurs, des thermorécepteurs et des nocicepteurs (Kierszenbaum, et al., 2006).
4) Finalement, la quatrième fonction principale de la peau consiste à métaboliser la vitamine D (Gartner & Hiatt, 2007). En effet, lors de l’absorption de rayons ultraviolets par la peau, le cholestérol qui s’y retrouve est transformé en vitamine D3. Par la suite, cette dernière sera elle-même modifiée par le foie et les reins en vitamine D active (Heath, et al., 2008).
1.1.1. L’hypoderme
L’hypoderme est un tissu adipeux représentant 15 à 20 % du poids corporel. Des extensions de fibres de collagène et de fibres élastiques le relient au derme (Mélissopoulos &
Levacher, 1998). Il est composé de cellules, les adipocytes, et de tissu conjonctif (Kierszenbaum, et al., 2006). Les adipocytes ont la particularité de pouvoir subir une importante variation de volume en peu de temps lorsqu’il y a changement du poids corporel (Mélissopoulos & Levacher, 1998). L’hypoderme joue un rôle important comme isolant thermique et amortisseur des chocs extérieurs (Stevens & Lowe, 2005). Il représente par ailleurs la plus grande réserve d’énergie de tout le corps humain (Lowe & Anderson, 2014) en emmagasinant les lipides sous forme de triglycérides (phase de captation) pour ensuite les relarguer sous formes d’acides gras ou encore de glycérol (lipolyse). L’hypoderme constitue également une réserve d’hormones stéroïdes et est un site important dans la transformation des androgènes en oestrogènes (Mélissopoulos & Levacher, 1998).
1.1.2. Le derme
Le derme est un tissu conjonctif relié à l’épiderme par la jonction dermo-épidermique. Il se divise en deux zones, soit le derme papillaire, d’où ont lieu les échanges avec l’épiderme, et la couche réticulaire (Mélissopoulos & Levacher, 1998). Le derme est principalement constitué de fibroblastes qui se trouvent dans une matrice extracellulaire qu’ils produisent eux-mêmes. Effectivement, les fibroblastes sont responsables de la synthèse du collagène, de l’élastine et de glycoprotéines de structure dont est constituée la matrice. Le derme contient également un réseau de capillaires qui alimente les trois couches cutanées en nutriments et en oxygène et qui élimine les déchets qui y sont produits (Mélissopoulos & Levacher, 1998). On retrouve également dans le derme les glandes sébacées et sudoripares, les cellules du système immunitaire (Jean, 2010; Marieb, 2005; Mélissopoulos & Levacher, 1998) de même que des fibres nerveuses et des récepteurs sensoriels tels des mécanorécepteurs, des thermorécepteurs et des nocicepteurs (Kierszenbaum, et al., 2006).
1.1.3. L’épiderme
L’épiderme constitue la couche externe de la peau et joue un rôle important dans la formation d’une barrière physique, chimique, biologique et immunologique contre les agents extérieurs (Mélissopoulos & Levacher, 1998). Cette structure est stratifiée et non
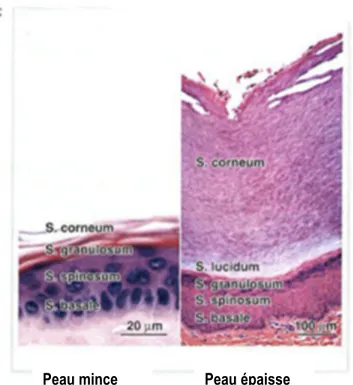
vascularisée. Elle est composé de kératinocytes se subdivisant en quatre ou cinq couches (Marieb, 2005) soit la couche basale, la couche épineuse, la couche granuleuse, la couche claire, présente uniquement au niveau de la plantes des pieds et de la paume des mains, et la couche cornée. Son épaisseur varie entre 0,05 mm et 1,5 mm.
Figure 1.2 Couches de l’épiderme de la peau normale humaine (Tirée de (Ash, et al., 2012))
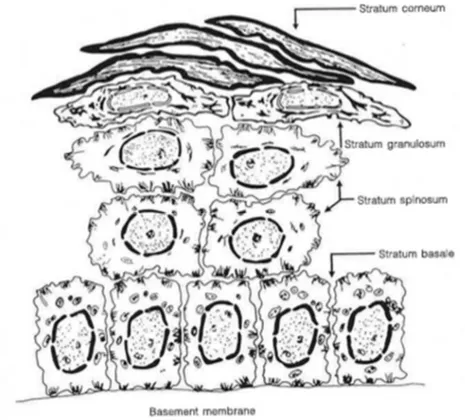
L’épiderme est composé à 80 % de kératinocytes (Mélissopoulos & Levacher, 1998). Ces cellules subissent un processus de différenciation cellulaire lors de leur migration au travers des différentes couches de l’épiderme jusqu’à la surface de ce dernier (Gartner & Hiatt, 2007; Junqueira & Carneiro, 2005; Ovalle & Nahirney, 2008). Ce faisant, ils synthétisent différentes protéines de la famille des kératines. Ce sont des protéines qui contribuent entre autres au rôle de barrière (Stevens & Lowe, 2005). L’épiderme est donc en constant renouvellement. De la couche basale à la couche cornée, les kératinocytes changent d’aspect. Dans la couche basale, ils sont de forme cylindrique et perpendiculaires aux papilles du derme (Mélissopoulos & Levacher, 1998). La différenciation cellulaire commence dans cette couche, alors qu’un kératinocyte se divise en deux cellules; une
restera dans la couche basale où elle continuera à se différencier et une migrera vers les couches supérieures. On retrouve dans cette couche les kératines de type 5 et 14 (Blumenberg & Tomic-Canic, 1997). Les kératinocytes situés dans la 2e couche, soit la
couche épineuse, sont de forme polyédrique avec un noyau sphérique (Wysocki, 1999). Il y a présence de desmosomes rattachant les kératinocytes entre eux (Eckert, 1989). On retrouve également dans cette couche les kératines de type 1 et 10 (Blumenberg & Tomic-Canic, 1997). Au niveau de la couche granuleuse, les kératinocytes sont d’apparence fusiforme (Mélissopoulos & Levacher, 1998), alors qu’au niveau de la couche claire, ils présentent une forme aplatie et ont un noyau très petit, voire absent (Wysocki, 1999). Finalement, dans la couche cornée, les kératinocytes n’ont plus de noyau ni d’organites cytoplasmiques. Rendus en surface, ils se détachent afin d’être remplacés par de nouvelles cellules. Ce processus porte le nom de desquamation (Mélissopoulos & Levacher, 1998).
Figure 1.3 Différenciation des kératinocytes au travers des différentes couches de l’épiderme
L’épiderme, en plus des kératinocytes, contient également des mélanocytes. La mélanine, que synthétisent ces cellules, a la propriété d’absorber les rayons ultraviolets du soleil permettant ainsi la protection de l’ADN cellulaire (Mélissopoulos & Levacher, 1998). Les cellules de Langerhans et les cellules de Merkel sont deux autres types cellulaires retrouvés dans l’épiderme. Alors que les premières sont impliquées dans le système immunitaire (Kierszenbaum, et al., 2006; Mélissopoulos & Levacher, 1998), les secondes le sont au niveau des récepteurs sensoriels du toucher (Wysocki, 1999). L’épiderme contient également des terminaisons nerveuses reliées au derme (Stellman & Dufresne, 2000).
1.1.3.1. La couche cornée
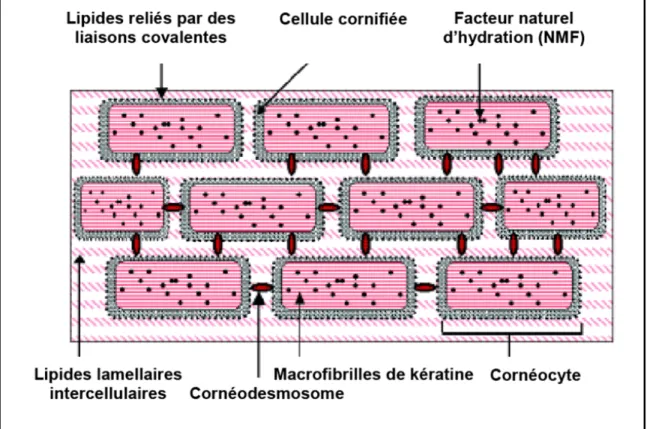
La couche cornée étant directement en contact avec le monde extérieur, elle est la principale actrice dans la fonction de barrière physique (Mélissopoulos & Levacher, 1998). Elle est constituée de cornéocytes, c’est-à-dire de kératinocytes complètement différenciés, imbriqués dans une matrice intercellulaire de lipides (Walters, 2002). Cette organisation est souvent représentée par l’illustration de briques dans du mortier. Grâce à leur organisation spécifique, ces différents lipides interviennent en tant que barrière par le biais de plusieurs mécanismes. Par conséquent, ils jouent un rôle important au niveau de la perméabilité de la peau (Bernard, et al., 2007; Duque Fernandez, 2008).
Figure 1.4 Représentation « Briques dans le mortier » des cornéocytes de la couche cornée (Tirée de (Harding, 2004) et modifiée par Jessica Jean (Jean, 2010))
1.2. Le psoriasis
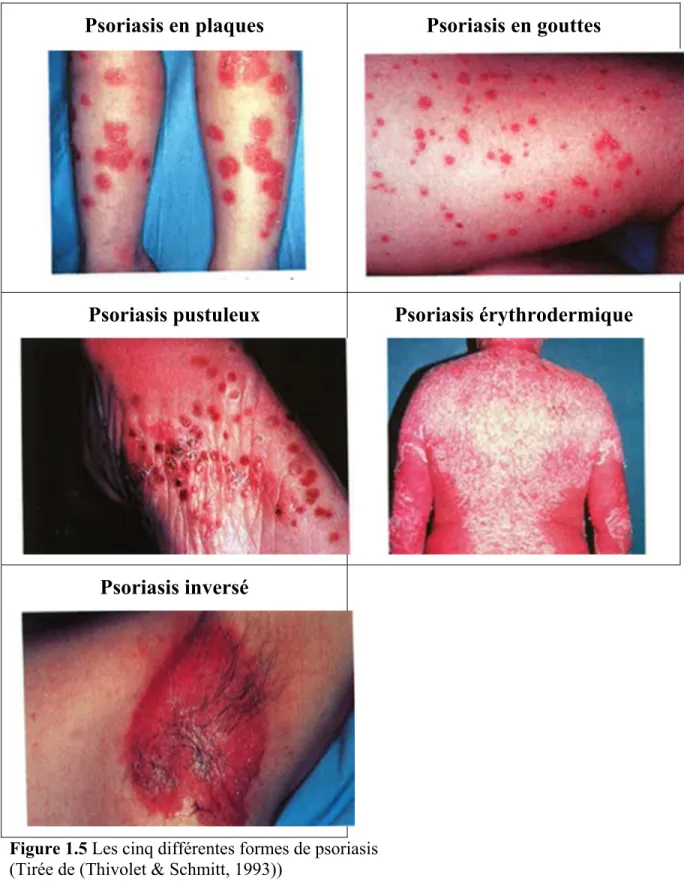
Le psoriasis est une dermatose érythémato-squameuse qui est auto-immune et non contagieuse. Il s’agit d’une maladie chronique touchant 3 à 5% de la population. Comme son nom l’indique, cette dermatose est reconnaissable par des plaques rouges (érythème) recouvertes de squames. Elle peut se présenter sous cinq formes différentes, soit le psoriasis en plaques, en gouttes, inversé, pustuleux ou érythrodermique (Nicolas & Thivolet, 1997). Le psoriasis en plaques est le plus commun, représentant environ 80% des cas (Dubertret, 2004).
Psoriasis en plaques
Psoriasis en gouttes
Psoriasis pustuleux
Psoriasis érythrodermique
Psoriasis inversé
Figure 1.5 Les cinq différentes formes de psoriasis (Tirée de (Thivolet & Schmitt, 1993))
1.2.1. Histologie
Le psoriasis est caractérisé par une augmentation de la prolifération des kératinocytes et par une maturation incomplète de ces derniers. Effectivement, au lieu de prendre entre 28 et 44 jours, leur processus de différenciation au travers des différentes couches de l’épiderme ne prend qu’autours de 4 jours (Federman, et al., 1999). Le derme et l’épiderme des lésions psoriasiques sont également infiltrés par des cellules du système immunitaire. En outre, il y a augmentation de l’angiogénèse de même que présence d’anomalies au niveau de la composition protéinique, certaines protéines étant sur- ou sous-exprimées. Ces anomalies peuvent être regroupées en trois catégories, soit celles reliées à la différenciation ou à l’hyperprolifération des kératinocytes et à l’infiltration des cellules du système immunitaire.
Au niveau des anomalies protéiniques reliées à la différenciation des kératinocytes, la filaggrine est un marqueur qui est sous-exprimé dans une peau psoriasique. Elle se retrouve habituellement dans la couche granuleuse, qui est absente dans une peau lésionnelle (Bernard, et al., 1988). Les marqueurs de différenciation terminale K1 et K10 sont également sous-exprimés (Mils, et al., 1994). À l’inverse, il y a surexpression de l’involucrine, une protéine impliquée dans la stabilisation de l’enveloppe kératinisée (Ishida-Yamamoto & Iizuka, 1995). C’est le cas également du marqueur de différenciation MRP-8, impliqué dans la formation de liens avec le Ca2+ et dans la réorganisation du
cytosquelette, et du SKALP, impliqué dans la dégradation de l’élastine (Nagpal, et al., 1996).
Différentes protéines présentes dans les peaux psoriasiques sont aussi impliquées dans l’hyperprolifération des kératinocytes. Il y a ainsi une augmentation du nombre de récepteurs du facteur épidermique de croissance (EGF) dans les couches supérieures d’un épiderme psoriasique par rapport à celui d’une peau saine (Nanney, et al., 1986). Le TGF-α est également augmenté (Turbitt, et al., 1990), tout comme l’activité de la kinase MAP, impliquée dans la régulation de la prolifération cellulaire (Dimon-Gadal, et al., 1998). Différents marqueurs de la kératine sont également affectés dans une peau lésionnelle.
C’est le cas entre autres des K5, K6, K14 et K16 qui sont surexprimées (Thewes, et al., 1991).
Une peau psoriasique présente également de nombreuses dérégulations au niveau des interleukines, un groupe de cytokines particulièrement important au niveau du système immunitaire. En effet, les interleukines 8, 13, 17, 22 et 23 sont, par exemple, surexprimées, alors que l’interleukine 10 est, au contraire, sous-exprimée dans la peau psoriasique (Menter & Stoff, 2010).
1.2.2. Étiologie du psoriasis
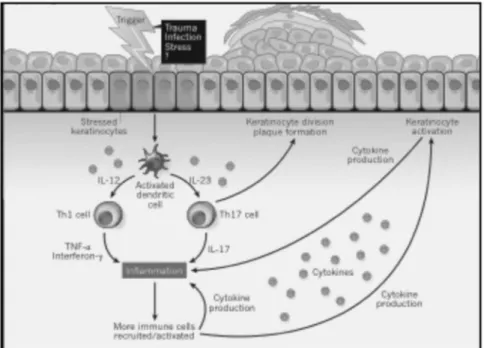
Les causes exactes du psoriasis sont à ce jour inconnues. Il est toutefois généralement admis que des facteurs immunologiques, environnementaux et génétiques entreraient en jeu (Nicolas & Thivolet, 1997). Une fois le processus de la maladie enclenché, il en résulte une boucle impliquant la réponse immunitaire du système et le stress subi par les kératinocytes. En effet, chez une personne à la peau saine, suite à une agression de l’épiderme, la réponse inflammatoire rapide poussera les cellules immunitaires à produire des facteurs de croissance afin de favoriser la division des kératinocytes et ainsi réparer rapidement la blessure. L’inflammation disparaitra ensuite. Dans le cas d’une peau psoriasique, l’inflammation perdure en raison d’une réponse exagérée du système immunitaire (Ainsworth, 2012). La réponse n’est toutefois pas constante puisque la maladie évolue en phases de poussées de plaques suivies par des phases de rémission. Le psoriasis se divise en trois niveaux de gravité selon le pourcentage de peau atteinte : la forme légère (moins de 2 %), la forme modérée (2 à 10 %) et la forme grave (plus de 10 %) (Lebwohl, et al., 2004).
Figure 1.6 La boucle inflammatoire du psoriasis (Tirée de (Ainsworth, 2012))
1.3. Analyse des lipides par chromatographie
L’isolation des lipides d’un échantillon naturel tel que la peau se fait principalement par extraction avec des solvants organiques. Différentes combinaisons peuvent être utilisées afin de limiter les pertes et la dénaturation des lipides au cours du processus. Des solvants neutres, acides ou basiques peuvent être employés, chacun présentant certains inconvénients (Myher & Kuksis, 1995). Alors que les solvants neutres résultent en un faible recouvrement des phospholipides acides, des lysophospholipides et des acides gras non-estérifiés, les solvants acides peuvent générer des lysophospholipides lorsque l’échantillon contient initialement des plasmalogènes. L’emploi de solvants alcalins, d’un autre côté, engendre un risque de désacyler certains composés.
Une fois l’isolation des lipides effectuée, des analyses par chromatographie peuvent être effectuées. Cette technique est une méthode analytique permettant de séparer physiquement des espèces chimiques. Ces dernières sont mises en solution dans une phase mobile qui passe au travers d’une phase stationnaire. Les différentes molécules sont éluées à un rythme
plus ou moins rapide en fonction de leurs propriétés et de celles des phases mobiles et stationnaires. Il existe plusieurs types de techniques chromatographiques qui peuvent être classées en fonction de leur phase mobile et du mécanisme de séparation entrant en jeu. Les lipides de la peau saine et de la peau psoriasique ont été analysés par différents groupes de recherche à l’aide de méthodes chromatographiques variées.
Plusieurs études utilisent la chromatographie sur couche mince afin de séparer ou d’analyser différentes classes de lipides présentes dans la peau (Farwanah, et al., 2002; Imokawa, et al., 1989; Melnik, et al., 1989; Ponec & Weerheim, 1990; Weerheim & Ponec, 2001; Wertz, et al., 1985). Afin de quantifier les lipides, un densitomètre peut être utilisé (Motta, et al., 1993). La chromatographie sur couche mince est toutefois une méthode encombrante, nécessitant beaucoup de temps et une concentration de molécules assez spécifique si l’on veut obtenir une détection nette et optimale. De plus, la quantité maximale de molécules pouvant être séparée en une analyse est limitée (Gildenast & Lasch, 1997). Afin de palier à certains de ces inconvénients, la chromatographie sur couche mince peut aussi être utilisée en précurseur d’une autre méthode chromatographique. Cette technique d’analyse implique l’utilisation d’une plaque de silice sur laquelle les extraits de lipides sont mis à éluer. La plaque est ensuite grattée et hydrolisée, ce qui permet ensuite l’analyse par chromatographie en phase gazeuse ou liquide. Alors que le chromatographe gazeux est principalement couplé à un MS (Gonzalez-Illan, et al., 2011; Michael-Jubeli, et al., 2011; Pons, et al., 2002), la chromatographie liquide, quant à elle, a aussi été utilisée couplée à divers autres détecteurs. On retrouve ainsi par exemple des analyses par ESI-MS, par APCI-MS (Farwanah, et al., 2002) et par ELSD (Christie, 1985).
Par ailleurs, certains lipides ont été analysés spécifiquement dans différentes études. C’est le cas des céramides de la couche cornée dont la caractérisation a entre autres été effectuée par NPLC-ESI-MS, ce qui a permis d’identifier 342 céramides différents et de découvrir une nouvelle classe de céramides présents dans la peau, le CER[ADS] en plus des 10 déjà connus (Masukawa, et al., 2008). Par ailleurs, les acides gras libres ont été analysés spécifiquement par GC-MS et GC-FID (Norlen, et al., 1998). Plus récemment, l’UPLC en phase inverse a commencé à être utilisé pour les analyses lipidiques couplé, par exemple, à
un TOF-MS (Rainville, et al., 2007). Son utilisation permet une séparation meilleure et plus rapide qu’avec un HPLC standard. Il est à noter que pour les analyses en chromatographie liquide, la phase inverse est à privilégier au dépend de la phase normale puisqu’elle offre une meilleure compatibilité avec les échantillons biologiques et lipophiles (Rainville, et al., 2007).
1.4. Les lipides de la peau saine
1.4.1. Les lipides de surface
La peau est un site riche en lipides ayant des fonctions diversifiées. Elle est recouverte en surface par une couche de lipides (SSLs) sous forme d’un film hydrolipidique. Ces SSLs sont composés d’un mélange de lipides sébacés et épidermiques incluant entre autres des triglycérides, des esters et des squalènes. La fraction acide gras des SSLs est riche en acides gras à longues chaînes, mais pauvre en polyinsaturés (PUFAs). Ces lipides de surface possèdent entre autres des propriétés antimicrobiennes (De Luca & Valacchi, 2010).
1.4.2. Les lipides épidermiques
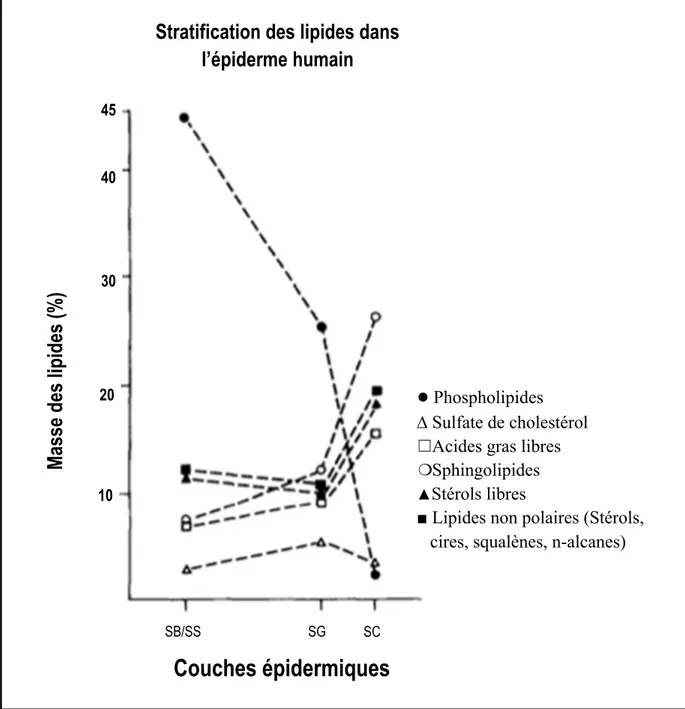
La composition lipidique varie au travers des différentes couches de l’épiderme. Tout au long du processus de kératinisation, celle-ci change, passant d’une composition contenant davantage de lipides polaires à une composition comportant majoritairement des lipides neutres. Ce changement de composition lipidique n’est toutefois pas linéaire, certains lipides augmentant en concentration dans une couche supérieure pour diminuer par la suite (Lampe, et al., 1983).
(Modifiée de (Lampe, et al., 1983))
La couche basale de l’épiderme est constituée principalement de phospholipides, au deux tiers en poids, ainsi que de cholestérol, de triacylglycérol, d’acides gras libres et de glucosylcéramides (Yardley, 1990). Alors qu’il y a très peu de sphingolipides dans les premières couches de l’épiderme, ces derniers représentent 20 % des lipides de la couche
Stratification des lipides dans
l’épiderme humain
●
Phospholipides ∆ Sulfate de cholestérol ☐ Acides gras libres ❍ Sphingolipides ▲Stérols libres■ Lipides non polaires (Stérols, cires, squalènes, n-alcanes)
Couches épidermiques
SC SG SB/SS 10 20 30 40 45Figure 1.7 Variation de la concentration de certains lipides au travers des couches de l’épiderme, en % massique
Masse d
cornée. À l’opposé, la quantité de glycolipides diminue à mesure que l’on monte dans les différentes couches de l’épiderme, pour devenir pratiquement inexistante dans la couche cornée. Les squalènes sont distribués dans toutes les couches de l’épiderme, tout comme le sulfate de cholestérol. Il y a toutefois une augmentation de la présence de ce dernier dans la couche granuleuse (Lampe, et al., 1983). Les acides gras retrouvés dans l’épiderme sont soit sous forme libre, soit liés dans les triglycérides, les phospholipides, les glycosylcéramides et les céramides (Proksch, et al., 2008).
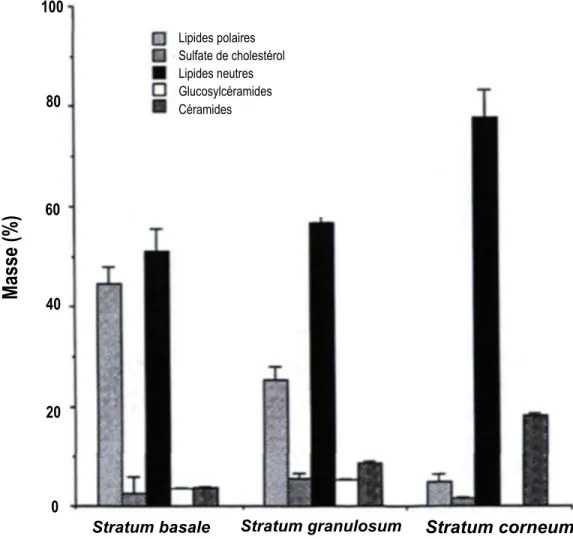
Figure 1.8 Composition lipidique de l’épiderme dans ses différentes couches, en % massique
(Modifiée de (Lampe, et al., 1983))
Stratum basale Stratum granulosum Stratum corneum Lipides polaires Sulfate de cholestérol Lipides neutres Glucosylcéramides Céramides 0 0 20 40 60 80 100
Masse (%)
1.4.3. Les lipides de la couche cornée
Les lipides de la couche cornée se présentent sous la forme d’une bicouche lipidique bien organisée en phase lamellaire. Ils représentent environ 15 % en poids de la masse sèche totale de la couche cornée (Harding, 2004) et 20 % de son volume. Ils sont composés principalement entre 45 à 50 % en masse de céramides, 25 % de cholestérol et 10 à 15 % d’acides gras sous forme libre, pour une composition environ équimolaire de ces trois classes de lipides (Tfayli, et al., 2013). La composition lipidique exacte de la couche cornée varie toutefois selon différents facteurs. Parmi ceux-ci se retrouvent l’âge, le sexe, la localisation anatomique et les saisons. Ainsi, avec l’âge a lieu une diminution de la quantité totale de lipides. Il y a également une baisse de la quantité lipidique en hiver par rapport à l’été ou au printemps (Rogers, et al., 1996). Il est à noter que les triglycérides, les acides gras saturés à chaînes courtes et les acides gras insaturés retrouvés dans la couche cornée proviendraient de contamination du sérum et n’auraient, par conséquent, aucun rôle connu dans la fonction barrière de la peau (Harding, 2004).
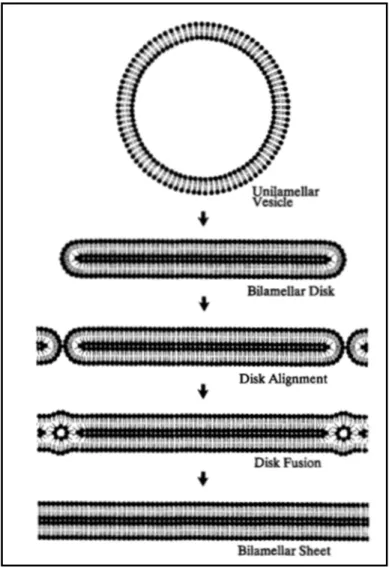
Les lipides intercellulaires de la couche cornée proviennent de lipides précurseurs présents dans les corps lamellaires au niveau des couches épineuses et granuleuses. Ces corps lamellaires, d’une dimension de 0,2 x 0,3 mm, forment une membrane bicouche contenant différents lipides : des phospholipides, des glucosylcéramides, des sphingomyélines et du cholestérol. Ils contiennent également des enzymes tels que des hydrolases et protéases lipidiques, des lipases neutres et des cathepsines ainsi que des peptides antimicrobiens (Elias & Feingold, 2013). Les lipides précurseurs sont assemblés dans les corps lamellaires en disques lamellaires au niveau des couches épineuse et granuleuse. Les corps poursuivent ensuite leur ascension pour atteindre l’interface entre la couche granuleuse et la couche cornée (Downing, 1992). Ils fusionnent alors avec la membrane cellulaire et sécrètent leur contenu lipidique dans les espaces intercellulaires (Madison, 2003). Les lipides sont d’abord déposés en feuillets à double couches lipidiques qui s’enligneront par la suite sous l’action de la phospholipase A2. La présence de l’enzyme β-glucocérébrosidase permettra
alors la fusion entre les membranes afin de former des rangées uniformes de feuillets lipidiques (Downing, 1992; Schaefer & Redelmeier, 1996).
Figure 1.9 Formation des feuillets lipidiques bilamellaires (Tirée de (Downing, 1992))
L’action de différents enzymes présents dans l’épiderme permet la formation de lipides spécifiques. Ainsi, la formation des céramides provient de l’action de la β-glucocérébrosidase sur les glucosylcéramides et de la sphingomyélinase sur les sphingomyélines alors que le sulfate de cholestérol est métabolisé par les stéroïdes sulfatase en cholestérol. Les phospholipases, quant à elles, transforment les phospholipides en acides gras libres et en glycérol (Feingold, 2007). Parmi les phospholipases impliquées, une d’intérêt, comme vu précédemment, est la phospholipase A2, présente en plusieurs
niveau de la membrane des lipides extracellulaires de même qu’au niveau de la régulation de la barrière cutanée (MaoQiang, et al., 1996).
(Tirée de (Schaefer & Redelmeier, 1996). La première flèche indique l’action de la phospholipase A2 et la 2e flèche, celle de la cérébrosidase)
Par ailleurs, l’action des différents enzymes, en plus de permettre la formation de lipides spécifiques, a d’autres fonctions. Ainsi, elle permet de réguler la perte d’eau par le biais de la formation de glycérol lors de la transformation des phospholipides par les phospholipases. Ce processus aide à maintenir l’hydratation de la couche cornée. En outre, les acides gras libres formés lors de l’action de ces mêmes phospholipases ont un impact sur l’acidité de la couche cornée (Fluhr, et al., 2001). Le maintien du pH à un certain niveau selon la profondeur dans les couches épidermiques est très important. Ainsi, une augmentation de ce dernier induira entre autres une hausse de l’activité des protéases, causant une augmentation de la desquamation des cornéocytes et une diminution de la fonction barrière du stratum corneum (Hachem, et al., 2003; Hachem, et al., 2005). L’action de la β-glucocérébrosidase et de la phospholipase A2 est également dépendante du
pH (Schaefer & Redelmeier, 1996).
L’organisation des lipides en feuillets lamellaires joue un rôle crucial dans la fonction barrière. Les lipides de la couche cornée humaine et animale ont, par conséquent, été investigués par différents groupes de recherche avec des méthodes variées telles que la diffraction par rayons X, la calorimétrie différentielle à balayage, la spectroscopie par Figure 1.10 Formation des feuillets lipidiques
résonnance magnétique, la spectroscopie Raman et la spectroscopie infrarouge (Bernard, et al., 2007).
1.4.3.1. Les céramides
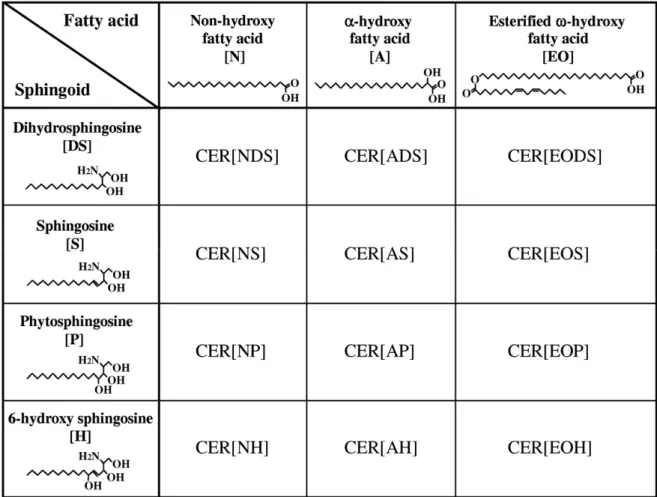
Les céramides de la couche cornée jouent un rôle important au niveau de la stabilité des bicouches lipidiques et de la fonction barrière de la peau face à la perte d’eau (Coderch, et al., 2003). Certains céramides seraient également impliqués au niveau de la régulation de la kératinisation (Masukawa, et al., 2008). Ils ont également différents rôles physiologiques dans la transduction de signaux et la régulation cellulaire au niveau de l’apoptose, dans l’arrêt de la croissance cellulaire, dans la différenciation, dans la sénescence et dans les réponses immunitaires (Masukawa, et al., 2008). Les acylcéramides auraient un rôle particulièrement important au niveau de fonctions liées à l’organisation membranaire dans la couche cornée alors que les acylglucosylcéramides seraient plus impliquées au niveau de fonctions liées à l’empilement membranaire dans les corps lamellaires (Motta, et al., 1994). Une diminution de la quantité totale de céramides présents de même qu’une modification au niveau de la proportion des différents types de céramides sont d’ailleurs caractéristiques de plusieurs maladies de peau (Coderch, et al., 2003). Les céramides sont constitués d’un groupement sphingosine lié par une liaison amide à un acide gras qui peut être hydroxylé ou non. Quatre groupements sphingosines sont retrouvés : sphingosine (S), dihydrosphingosine (dS), 6-hydroxysphingosine (H) et phyto-sphingosine (P). Pour ce qui est des acides gras, il y a trois possibilités : un acide gras non hydroxylé (N), un acide gras α-hydroxylé (A), un acide gras estérifié ω-hydroxylé (EO). Les céramides sont classés en fonction des groupements les constituant, ce qui donne 12 classes possibles. Les longueurs des chaines des groupements sont toutefois variables, laissant place à un éventail beaucoup plus large de céramides. À ce jour, 11 classes de céramides ont été observées dans le
stratum corneum, seulement la classe des CER [EOdS] ne l’ayant pas été (Masukawa, et
Figure 1.11 Les différentes classes de céramides (Tirée de (Masukawa, et al., 2008))
Dans la majorité des céramides, les chaines sont longues (24 à 26 carbones) et saturées avec une petite tête polaire (Bouwstra, et al., 2003). Cela résulte en des lipides ayant un haut point de fusion et se trouvant dans un état ordonné solide cristallin à la température du corps humain. En effet, conjointement avec les acides gras libres, le cholestérol et le sulfate de cholestérol, les céramides forment une structure bicouche bien organisée dans un domaine orthorhombique et hexagonal (Coderch, et al., 2003; Mendelsohn, et al., 2006). Une variation de certains facteurs du système tels que la température et la pression peut engendrer une transition de phase. Le système devient alors dans un état gel ou encore liquide cristallin, phases dans lesquelles il y a présence de lipides en conformation gauche et dans lesquelles ces derniers sont par conséquent dans un arrangement davantage désorganisé (Ongpipattanakul, et al., 1994). Cette température de transition est fortement
influencée par la composition lipidique et est autour de 75°C pour la peau normale humaine (Bernard, et al., 2007).
La production des céramides dans la couche cornée peut se faire par deux voies selon les différentes classes. La première voie, qui est catalysée par la β-glucocérébrosidase et la sphingomyélinase, implique la dégradation des glucosylcéramides et des sphingomyélines. La seconde est catalysée par la sérine palmitoyltransférase et la céramide synthase. Elle implique, quant à elle, la formation de céramides à partir de l’acide palmitique et de la sérine (Choi & Maibach, 2005).
Figure 1.12 Voies de formation des céramides (Modifiée de (Schaefer & Redelmeier, 1996))
1.4.3.2. Les stérols
Le cholestérol est le stérol présent majoritairement dans la couche cornée, représentant 27 % des lipides de cette dernière. Celle-ci contient également du sulfate de cholestérol (3 %) de même que des esters de cholestérol (2 à 5 %) (Chilcott & Price, 2008). Le cholestérol est synthétisé majoritairement dans l’épiderme à partir d’acétate (Proksch, et al., 2008) et serait orienté perpendiculairement à la surface bicouche membranaire (Khelashvili, et al., 2010). Il joue un rôle important au niveau de la fluidité de la membrane (Madison, 2003). Le sulfate de cholestérol, quant à lui, est impliqué dans la cohésion des cornéocytes et dans la desquamation (Thivolet & Schmitt, 1993).
Synthase dihydrocéramide Sphingosine Dihydrocéramide Déhydrogénase dihydrocéramide Céramide P DG Synthase sphingomyéline UDP-Glc UDP Synthase Glucosylcéramide Sphingomyéline Glucosylcéramide
Figure 1.13 Structure du cholestérol
1.4.3.3. Les acides gras
Les acides gras libres présents dans la matrice lipidique proviennent de l’hydrolyse des phospholipides (Fluhr, et al., 2001). En plus de jouer un rôle dans la régulation de la synthèse du cholestérol et de son transport, ils permettent de moduler les structures membranaires (Mélissopoulos & Levacher, 1998; Schaefer & Redelmeier, 1996). Ils sont majoritairement saturés, avec un nombre de carbones allant de 14 à 28 (Chew & Maibach, 2006), ceux avec une chaine de 22 et 24 carbones étant les plus fréquents. La quantité d’acides gras libres dans l’épiderme augmente de la couche basale à la couche cornée. Les acides gras n-6 sont ceux présents en plus grand nombre, les acides 18 : 2 (n-6), 18 : 3 (n-6) et 18 : 4 (n-6) représentant 70 % des acides gras cutanés. Ces acides gras sont particulièrement importants : les acides gras n-6 sont précurseurs de l’acide arachidonique, qui est impliqué dans les phénomènes inflammatoires en étant transformé en prostaglandines, alors que les acides gras n-3 sont impliqués dans la formation de l’acide eicosapentaénoïque, impliqué lui aussi dans l’inflammation par sa métabolisation en acide 15-hydroxy-eicosapentaénoïque. Les acides gras oméga-3 et oméga-6 font d’ailleurs partie des acides gras essentiels. Ces derniers ont d’importantes fonctions au niveau cutané, tant au niveau de la modulation de la structure membranaire et de l’imperméabilité de la peau
HO
H
H H
qu’au niveau de la régulation du transport et de la synthèse du cholestérol (Thivolet & Schmitt, 1993).
1.5. Les lipides de la peau psoriasique
L’étude par microscopie électronique de la couche cornée de peau psoriasique a montré entre autres la présence d’espaces intercellulaires plus grands, de jonctions intercellulaires moins résistantes et d’une adhésion intracellulaire moins efficace. Ces altérations pourraient être causées entre autres par une homéostase anormale du cholestérol (Pietrzak, et al., 2006). Chez les mammifères, le cholestérol est effectivement un régulateur essentiel de l’organisation des lipides (Maxfield & Tabas, 2005). Il est d’ailleurs admis dans la littérature que les personnes atteintes de psoriasis souffrent d’un dysfonctionnement au niveau du métabolisme des lipides. Une désorganisation au niveau de ces derniers peut engendrer de graves conséquences en affectant, par exemple, différentes fonctions cellulaires telles que les signaux de transduction (Maxfield & Tabas, 2005). Au cours des dernières années, les différences tant au niveau des lipides de surface que des lipides de la couche cornée, épidermiques et du sérum ont été investiguées chez des sujets en santé et atteints de psoriasis. Il n’est toutefois pas encore clair si les anomalies observées au niveau lipidique chez ces derniers sont causées par le psoriasis ou si, au contraire, elles sont des précurseurs de la maladie (Pietrzak, et al., 2010).
1.5.1. Les lipides du sérum
Tout d’abord, la composition lipidique au niveau du sérum a été évaluée chez des individus sains et des individus souffrant de psoriasis. Les différentes études sont parfois contradictoires en raison possiblement des changements rapides pouvant survenir dans la composition du sérum et des effets liés entre autres à l’alimentation, aux saisons, à l’origine ethniques et aux hormones. Il ressort toutefois de façon générale une augmentation significative au niveau du cholestérol total (Akhyani, et al., 2007; Mallbris, et al., 2006; Rocha-Pereira, et al., 2001; Kural, et al., 2003) et des triglycérides (Akhyani, et al., 2007;
Pietrzak, et al., 2006; Rocha-Pereira, et al., 2001; Vahlquist, et al., 1987; Vanizor Kural, et al., 2003). Les lipoprotéines transportant le cholestérol seraient également affectées, la quantité de lipoprotéines de très basses (VLDL) et de basses densités (LDL) étant augmentée (Akhyani, et al., 2007; Pietrzak, et al., 2006; Rocha-Pereira, et al., 2001; Vahlquist, et al., 1985; Vahlquist, et al., 1987; Vanizor Kural, et al., 2003) alors que la quantité des lipoprotéines de haute densité (HDL) est diminuée (Pietrzak, et al., 2006; Rocha-Pereira, et al., 2001; Vahlquist, et al., 1985). Certaines études n’ont toutefois pas obtenu de différences tant au niveau de la quantité des LDL et des VLDL que des HDL (Akhyani, et al., 2007; Farshchian, et al., 2007). Une réduction de la quantité d’acide linoléique et α-linolénique ainsi qu’une augmentation de la quantité d’acide dihomo-γ-linolénique au niveau des chaînes acides gras des triglycérides, des phospholipides et des esters de cholestérol a aussi été observée (Vahlquist, et al., 1985). Par ailleurs, les différences observées entre le sérum des patients sains et des patients atteints de psoriasis seraient plus prononcées lorsque le psoriasis est présent sous une forme sévère (Akhyani, et al., 2007; Vahlquist, et al., 1985).
1.5.2. Les lipides de l’épiderme et du stratum corneum
Au niveau des lipides épidermiques, les études sont parfois contradictoires. Une étude a permis ainsi d’observer une augmentation du pourcentage en poids des céramides entre des échantillons de peau saine et psoriasique, passant de 18,8 % à 24,9 % (Motta, et al., 1993). Le cholestérol est aussi augmenté (10,5 % comparé à 16,2 %) de même que les squalènes (1,9 % comparé à 10 %). À l’opposé, il y a une réduction de la quantité de triglycérides (33,4 % comparé à 23,4 %) et d’acides gras libres (23,1 % comparé à 16,2 %). Cette diminution pourrait être expliquée par le renouvellement plus rapide des kératinocytes lésionnels impliquant un processus oxydo-dépendant nécessitant de l’énergie. Il y aurait donc une consommation accrue de ces lipides. D’autres études montrent également une augmentation de la quantité totale des lipides et du cholestérol, mais font état, à l’opposé d’une augmentation des triglycérides. Du côté des phospholipides, une étude montre une diminution de ces derniers alors que d’autres font état d’une augmentation (Pietrzak, et al., 2010). Les longueurs de chaines des acides gras seraient aussi plus courtes (Khyshiktuyev,
et al., 2008) dans les peaux psoriasiques et la fraction d’acides gras estérifiés serait moins importante (Fortinskaia, et al., 1996).
La présence d’anomalies au niveau des céramides du stratum corneum est, quant à elle, moins controversée, certains de ses effets ayant été clairement observés (Motta, et al., 1994). Il est effectivement connu qu’il y a une augmentation de la perte d’eau transépidermique au niveau des plaques psoriasiques. La peau se retrouve alors dans un état de sous-hydratation. Ce phénomène serait relié entre autres à des perturbations au niveau des lipides, ces derniers étant impliqués au niveau de la rétention d’eau. Plus spécifiquement, les longues chaines N-acyl saturées des acides gras des céramides y joueraient un rôle particulièrement important. Or, il a été montré que, dans la peau psoriasique lésionnelle, il y a une modification au niveau de la composition des céramides. Ainsi, il y a une augmentation des céramides avec le groupement phytosphingosine. De même, certains céramides ayant le groupement spingosine sont également augmentés alors que d’autres avec ce même groupement, dont le CER[EOS], subissent une diminution. La diminution de ce dernier serait particulièrement problématique puisque sa présence serait cruciale pour la formation des couches bilamellaires (Motta, et al., 1993).
1.6. L’absorption percutanée
L’absorption percutanée est une méthode permettant de mesurer quantitativement le passage d’une molécule au travers des différentes couches de la peau jusqu’à atteindre le système sanguin, qui distribuera la molécule au travers du corps humain. Effectivement, la peau, malgré la présence de la couche cornée, n’est pas imperméable. Pratiquement toutes les substances peuvent la traverser, de façon plus ou moins rapide en fonction de différents facteurs (Mélissopoulos & Levacher, 1998).
1.6.1. Facteurs influençant la perméabilité de la peau
Les facteurs influençant la perméabilité de la peau peuvent être regroupés en deux catégories : les facteurs biologiques et les facteurs physicochimiques. Les premiers reflètent les variations interindividuelles au niveau cutané. Parmi ceux-ci se retrouvent les caractéristiques de la peau, soit entre autres l’épaisseur et l’hydratation de sa couche cornée, sa température et son flux sanguin.
1.6.1.1. Les facteurs biologiques
Plus le stratum corneum d’une peau saine est épais, moins celle-ci sera perméable. De même, un renouvellement rapide de cette couche épidermique permet un ralentissement de l’absorption au travers de la peau en ne permettant pas aux principes actifs de s’y accumuler (Fernandez, 2008). À l’opposé, une augmentation de la température favorise l’absorption percutanée (Chang & Riviere, 1991) tout comme le fait une augmentation du flux sanguin. Effectivement, un flux sanguin plus élevé signifie que les principes actifs sont éliminés plus rapidement du derme. Le gradient de concentration dans la peau est donc plus élevé, ce qui favorise la diffusion au travers de celle-ci (Barry, 1983). Une bonne hydratation du stratum corneum permet également de favoriser l’absorption percutanée (Blank, 1952).
Les caractéristiques de la personne elle-même telles que son âge et origine ethnique font également partie des facteurs biologiques. De fait, une personne plus jeune aura tendance à avoir une peau plus perméable qu’une personne plus âgée (Feldmann & Maibach, 1970). De même, une peau noire sera généralement moins perméable qu’une peau caucasienne (Drill, et al., 1980). Il est à noter que le sexe de la personne ne semble pas avoir d’influence sur la perméabilité de la peau (McCormick & Abdelrahman, 1991).
1.6.1.2. Les facteurs physicochimiques
Les facteurs physicochimiques, quant à eux, sont reliés à la formulation des principes actifs. Ils incluent entre autres certaines propriétés de ces derniers de même que le pH et la nature de la formulation. Le poids moléculaire du principe actif utilisé a ainsi de l’influence sur la perméabilité. En effet, il doit être inférieur à 100 000 daltons pour que la molécule puisse être absorbée par la peau. Un poids inférieur à 600 daltons favorisera en outre une plus grande diffusion transcutanée (Barry, 2004). Le caractère lipophile de la molécule a également de l’importance puisque le stratum corneum ne permet principalement que l’absorption des molécules amphiphiles ou moyennement lipophiles (Fernandez, 2008). Le pKa du principe actif, combiné au pH cutané, influencera également la perméabilité. En effet, de ces derniers dépendra le pourcentage de la molécule présente sous forme ionisée, une forme qui semble se distribuer moins facilement, diminuant ainsi l’absorption percutanée (Croutham, et al., 1971; Lopez, et al., 1996). La formulation du principe actif influencera également la perméabilité. En effet, si les excipients ont un pH acide, cette dernière sera réduite. À l’inverse, la présence dans la formulation de certaines molécules telles que l’éthanol et le diméthylsulfoxide aura l’effet opposé (Fernandez, 2008).
1.6.2. Les voies de passage
Le passage des molécules au travers de la peau peut s’effectuer par deux voies différentes : la voie transépidermique et la voie par les annexes cutanées. La première voie se sous-divise en deux types de passage, soit le passage transcellulaire et le passage intercellulaire. Le passage transcellulaire implique le passage de la molécule au travers des cornéocytes, en alternance entre des structures lipophiles et hydrophiles alors que, dans le passage intercellulaire, la molécule diffuse entre les cornéocytes (Potts & Francoeur, 1991; Schaefer & Redelmeier, 1996). La voie par les annexes cutanées, quant à elle, est caractérisée par le passage des molécules soit par les follicules pilo-sébacés, soit par les glandes sudoripares (Scheuple & Blank, 1973). Le premier est majoritairement employé par les grosses molécules ayant un groupement polaire (Scheuple, 1967) alors que le deuxième l’est par certains composés hydrophiles ayant un petit poids moléculaire de même que par des
électrolytes, ces derniers diffusant dans le liquide aqueux des conduits sudoripares (Pinnagoda, et al., 1990).
Figure 1.14 Les voies de passage au travers de la couche cornée (Tirée de (Schaefer & Redelmeier, 1996))
1.6.3. Le flux
L’absorption percutanée peut être caractérisée par le calcul du flux, c’est-à-dire la quantité de la molécule étudiée qui est diffusée par unité de surface de couche cornée et par unité de temps. Il est calculé à l’aide de la formule suivante :
où J est le flux en μg.cm-2.h-1, Q est la quantité de la molécule absorbée en μg, S est l’aire
de la couche cornée en cm2 et t est le temps de contact de la substance avec la peau en h. Le
graphique du flux en fonction de la concentration de la molécule donne une droite dont la pente correspond au coefficient de perméabilité (Kp) qui est caractéristique de la molécule étudiée. Ce dernier est indépendant de la concentration, mais dépend d’autres facteurs tels
J Q
que l’épaisseur de la peau (e) et des coefficients de partage (Km) et de diffusion (D) selon l’équation suivante (Mélissopoulos & Levacher, 1998; Schaefer & Redelmeier, 1996).
1.6.4. Les coefficients de diffusion et de partage
Le coefficient de diffusion caractérise la résistance du milieu face à la diffusion de la molécule au travers de la peau. Le calcul de ce coefficient implique la température du milieu, le rayon de la molécule étudiée de même que la viscosité du milieu. De son côté, le coefficient de partage caractérise l’affinité de la molécule pour le milieu aqueux et la membrane cutanée (Beetge, et al., 2000). On le calcule donc à l’aide des concentrations de la molécule dans le solvant organique et dans l’eau. Une distribution en faveur du solvant organique donnera un coefficient de partage plus élevé et bien souvent une plus grande perméabilité.
1.6.5. La méthode
La perméabilité d’un échantillon de peau ou d’un substitut cutané en présence d’une molécule peut être mesurée à l’aide de cellules à diffusion de type Franz (Franz, 1975). L’échantillon est placé et tenu fermement à l’aide d’une pince entre les deux chambres de la cellule à diffusion (compartiments donneur et receveur). Le compartiment receveur est rempli avec du milieu de culture et est maintenu à 37°C sous agitation. La molécule étudiée est déposée sur l’échantillon dans le compartiment donneur et le milieu du compartiment receveur est prélevé à des temps définis. Ce type de système d’absorption est dit statique. Il existe également des systèmes plus complexes avec des cellules dynamiques dans lesquelles le milieu receveur est constamment renouvelé. Le système de cellules à diffusion de type Franz n’est pas limitant quant aux molécules étudiées. La contrainte de ce côté provient de l’appareil utilisé pour analyser les prélèvements. Un compteur à scintillation liquide permet une analyse assez facile, ne nécessitant pas de développement de méthodes analytiques complexes. Toutefois, il nécessite l’emploi de molécules radioactives, ce qui
KpKm D
peut devenir rapidement contraignant. L’analyse des prélèvements peut également s’effectuer par chromatographie, permettant l’utilisation de molécules non marquées. Les analyses de perméabilité avec le système de cellules à diffusion de type Franz permettent de mesurer la quantité de molécules ayant passé au travers des différentes couches de la peau en fonction du temps, de même que la vitesse de passage (flux).
Figure 1.15. Cellule de Franz statique (Tirée de (Jean, 2010))
1.7. La spectroscopie infrarouge à réflexion totale atténuée (ATR)
Les radiations infrarouges, qui correspondent à la région du spectre électromagnétique se situant entre la région du visible et celles des micro-ondes, ont des fréquences comprises entre 10 000 et 100 cm-1. Lorsqu’elles atteignent une molécule, ces radiations sont
absorbées par celle-ci sous forme d’énergies de vibrations moléculaires, qui peuvent être quantifiées dans un spectre de vibration sous forme de bandes. Un spectre de vibration obtenu suite à une analyse infrarouge est caractéristique de l’échantillon étudié. Effectivement, la fréquence d’absorption de chaque bande du spectre est dépendante des masses relatives et de la géométrie des atomes composant l’échantillon de même que de la force de leurs liaisons (Silverstein, et al., 1998). La largeur des bandes dépend également entre autres de la vitesse des molécules. Une analyse infrarouge permettra ainsi d’obtenir des informations sur la structure et la conformation de l’échantillon. Dans le cadre des
! "#$ %&' ( )* +, - $ . - * &$/ &$ ( &' ( )")&)$ 0* &$ 0*&$ 12345 6$ 5 / 7 8* #)"7 - +)$9/ ++- &#$ 5 / 7 8* #)"7 - +)$#- , - : - &#$ ; "<"- &$ =* ##- $9>* ?")* )"/ +$
analyses effectuées sur les substituts cutanés produits au LOEX, la bande de vibration symétrique des groupements CH2, qui a une fréquence aux alentours de 2850 cm-1, est
particulièrement intéressante (Bernard, 2007). En effet, cette bande est caractéristique des chaines acyle des lipides. Étant donné que la fréquence de cette bande dépend de l’organisation des lipides, son étude permet d’évaluer la conformation des chaines hydrocarbonées des lipides de la couche cornée de substituts cutanés et d’échantillons de peau de même que les transitions de phase.
Figure 1.16 Spectre infrarouge d’une peau normale humaine
(La flèche indique la bande d’intérêt à une fréquence d’environ 2850 cm-1)
Lorsqu’elles se trouvent dans un état ordonné, les chaines acyles des lipides sont en conformation trans alors que, dans un état davantage désordonné, on en retrouve également en conformation gauche. La présence de ces conformères fait augmenter la fréquence de vibration. La longueur des chaines acyle et leur degré d’insaturation de même que la nature de la tête polaire des lipides influencent la température de transition entre ces états ordonné et désordonné (Casal & Mantsch, 1984; Ongpipattanakul, et al., 1994; Rowat, et al., 2006). L’utilisation de la spectroscopie infrarouge ATR permet l’analyse de la couche cornée de la peau normale humaine et des substituts cutanés en minimisant les risques de dommages à
cette dernière. En effet, aucune préparation n’est nécessaire pour effectuer l’analyse, l’échantillon étant déposé directement sur le cristal ATR (Mendelsohn, et al., 2006).
1.8. Le génie tissulaire
Plusieurs méthodes de préparation de substituts de peau reproduisant une ou plusieurs couches de la peau ont été développées au cours des dernières années (Jean, et al., 2011; MacNeil, 2007). Les substituts peuvent contenir du matériel allogénique, xénogénique ou autologue et peuvent être d'usage temporaire, semi-permanent ou encore permanent. Différents modèles sont actuellement disponibles sur le marché (Fodor, 2003; Horch, et al., 2005; Jean, et al., 2011). En raison des caractéristiques les différenciant, les substituts développés n'ont pas tous la même utilité. À ce jour, aucun substitut reproduisant intégralement la peau n’a été développé. Afin de reproduire pleinement les fonctions cutanées et d'avoir les mêmes propriétés, ce substitut idéal se devrait d'avoir entre autres les trois couches de la peau, soit l'épiderme, le derme et l’hypoderme, avec un épiderme bien différencié et un derme vascularisé (Gibot, et al., 2010; MacNeil, 2007). De plus, les propriétés du substitut devraient idéalement s'apparenter à celles de la peau. Une structure permettant une vascularisation et une réinnervation du derme rapide est ainsi recherchée. Également, la présence d’un derme permettant une réparation de la blessure rapide et d’un épiderme fonctionnel permettant de retrouver rapidement une bonne fonction barrière est grandement souhaitable. Le substitut doit aussi pouvoir bien s’intégrer au niveau du lit de la plaie lorsqu’il est utilisé en clinique (Auger, et al., 2004).
1.8.1. Modèles de substituts de peau saine
Les modèles de substituts de peau saine disponibles sur le marché peuvent être regroupés en trois catégories selon qu’ils contiennent seulement un derme, un épiderme ou bien encore ces deux couches. Il existe trois approches principales pour la production de substituts in vitro, soit les approches par gel, échafaudage et auto-assemblage (Auger, et al., 2004).
La méthode de production utilisant un gel comme matrice permet d’obtenir des reconstructions de peau intéressantes, mais avec des propriétés mécaniques assez faibles (Parenteau, et al., 2000). Un exemple de substituts utilisant cette méthode est Apligraf® (Novartis), qui a été approuvé dès 1998 par la FDA pour le traitement des ulcères. Ce substitut bicouche consiste en des fibroblastes allogéniques ensemencés dans un gel de collagène bovin de type 1, sur lequel sont ensemencés des kératinocytes (Wilkins, et al., 1994).
Les substituts cutanés peuvent également être produits à l’aide d’un échafaudage. Ce dernier peut être fait à partir de biomatériaux naturels ou bien encore synthétiques. Il peut également être ensemencé avec des cellules ou bien être acellulaire (Auger, et al., 2004; Auger, et al., 2004). Alloderm® (LifeCell), un substitut dermique obtenu à partir de traitements sur des peaux de cadavres, en est un exemple. Les substituts produits avec un échafaudage acellulaire ont l’avantage d’être rapidement disponibles pour une greffe, mais leur utilisation implique toutefois une 2e chirurgie afin de greffer par la suite un épiderme
autologue cultivé ou bien provenant d’un site donneur (Auger, et al., 2004). Ce type de substitut produit par échafaudage est par conséquent peu fréquent. Les substituts produits avec un échafaudage cellularisé sont, à l’opposé, retrouvés plus fréquemment. Dermagraft® (Shire), un substitut dermique avec un échafaudage de polyglactine, en constitue un exemple. On retrouve également des substituts à échafaudage cellularisé bicouches tels qu’Academia et OrCelTM. Ce type de substituts est principalement développé
en milieu académique.
Finalement, la méthode d’auto-assemblage constitue une autre approche pour produire des substituts cutanés. Celle-ci est basée sur la propriété qu’ont les cellules mésenchymateuses telles que les fibroblastes à produire leur propre matrice extracellulaire in vitro. Cette méthode permet de produire des substituts exempts de matériel exogène lorsque les cellules du patient sont utilisées. Cette méthode est également applicable à d’autres organes que la peau (Auger, et al., 2004).
1.8.2. Modèles de substituts de peau psoriasique
Le développement de modèles de peau psoriasique a également fait l’objet de recherches au cours des dernières années et différentes techniques ont été développées afin de produire des modèles in vivo et in vitro. Les premiers se divisent en différentes catégories, soit les mutations spontanées, les modèles produits génétiquement et les xénotransplantations (Jean, et al., 2012).
Les modèles à mutations spontanées, souvent chez la souris, ne représentent globalement pas de bons modèles puisqu’ils ne permettent pas de générer un phénotype psoriasique assez complet. Ils peuvent toutefois permettre l’étude de certains aspects spécifiques de la maladie (Mizutani, et al., 2003). Une centaine de mutations chez la souris menant à certaines caractéristiques du phénotype psoriasique a été recensée (Sundberg, et al., 1990) et de multiples modèles ont été développés dans les dernières décennies (Gudjonsson, et al., 2007).
Les modèles produits génétiquement sont les plus fréquents et incluent les modèles d’animaux transgéniques et knockout. Les modifications génétiques apportées ont différentes cibles telles que le système immunitaire, l’endothélium vasculaire et les protéines épidermiques. Ces modèles permettent de reproduire en tout ou en partie différentes caractéristiques importantes du phénotype psoriasique, soit l’épaisseur épidermique, la différenciation anormale des kératinocytes, l’augmentation de l’angiogénèse et l’infiltration épidermique de cellules T (Jean, et al., 2012).
Les modèles produits par xénotransplantation, quant à eux, consistent en la greffe d’un morceau de peau psoriasique ou d’un substitut de peau psoriasique sur une souris génétiquement modifiée. Trois types de souris sont principalement utilisés, soit la souris nue athymique qui n’a pas de thymus et donc de cellules T (Raychaudhuri, et al., 2001), la souris SCID qui n’a pas de cellules T et B (Gudjonsson, et al., 2007) et finalement la souris à mutations spontanées AGR129 qui n’a pas non plus de cellules T et B en plus d’avoir des cellules NK immatures (Boyman, et al., 2004). Ce dernier modèle permet d’obtenir un taux moins élevé du rejet des greffons par rapport aux deux autres. Les modèles de