Condition corporelle et fécondité des orignaux de l’Est du
Québec en réponse à la variation de la densité
Mémoire
Janick Gingras
Maîtrise en biologie – avec mémoire
Maître ès sciences (M. Sc.)
Québec, Canada
iii
Résumé
L’objectif de cette étude était d’établir les relations entre l’abondance des orignaux (Alces alces), leur condition corporelle et la fécondité des femelles dans le contexte de l’augmentation marquée de leur densité au cours des dernières décennies dans l’Est du Québec. Les résultats indiquent une diminution de la condition corporelle des orignaux à forte densité, particulièrement au niveau des réserves de gras et de la masse musculaire, que nous associons à une réduction de la disponibilité des ressources. Notre étude suggère que les femelles peuvent tout de même maintenir un taux de fécondité élevé en réduisant la taille de leur portée et en conservant ainsi de l’énergie pour se reproduire pendant plus d’années. Nous concluons qu’en absence de prédateurs, l’équilibre à court ou moyen terme entre la nourriture et les grands herbivores est peu probable, ce qui peut entraîner des conséquences négatives sur la dynamique de régénération naturelle de la sapinière à bouleau blanc.
v
Abstract
The main objective of this study was to investigate the relationships between relative moose (Alces alces) abundance, body condition and female fecundity in the context of the increase of moose density over the last decades in eastern Québec. Our results revealed a decline in body condition at high moose density, particularly in fat reserves and muscular mass, that we associated with a reduction in food resources. Our study suggest that moose females can maintain high fecundity despite the decline in body condition by reducing litter size at ovulation and conserving energy to increase the probability of reproducing during more years. We conclude that in absence of predators, equilibrium with forage is unlikely for large herbivores over short- or mid-term. Consequently, large herbivore populations may have negative effects on the natural regeneration dynamic of balsam fir-paper birch forests.
vii
Avant-propos
Ce mémoire comprend trois chapitres, soit l’introduction générale de l’étude, le chapitre principal rédigé en anglais selon le format approprié pour le publier dans la revue scientifique Journal of Wildlife Management et une conclusion générale. Les coauteurs du chapitre principal ont contribué à l’élaboration de l’étude ainsi qu’à la révision du manuscrit.
Je tiens à remercier le Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG), l’Université Laval et le ministère des Ressources naturelles et de la Faune du Québec (MRNF) pour avoir soutenu financièrement ce projet de maîtrise. Je remercie aussi le Fonds québécois de recherche sur la nature et les technologies (FQRNT), le CRSNG, la Fondation de l’Université Laval et la fondation Héritage Faune de m’avoir remis des bourses d’études. Pour leur soutien logistique, je remercie la Société des établissements de plein air du Québec (Sépaq) et la ZEC Casault.
Je tiens également à remercier mon directeur de maîtrise, Jean-Pierre Tremblay, pour m’avoir proposé de réaliser un projet qui m’a passionné du début jusqu’à la fin. J’ai grandement apprécié sa disponibilité, ses commentaires constructifs et sa bonne humeur quotidienne! Merci à mon codirecteur Serge Couturier pour ses conseils et sa passion contagieuse sur le terrain. Ce fut un immense plaisir de travailler avec eux. J’aimerais aussi remercier Gaétan Daigle pour ses recommandations dans les analyses statistiques et Steeve D. Côté pour son appui dans l’interprétation des résultats.
Ce projet a pu être réalisé grâce à un travail remarquable de plusieurs stagiaires, techniciens et assistants de recherche. Je les remercie pour leur minutie, leur joie de vivre et leur dévouement pour le travail. La récolte des données a été grandement facilitée par la collaboration des employés de la réserve faunique de Matane, de la réserve faunique des Chic-Chocs et de la ZEC Casault. Je tiens à les remercier pour leur intérêt pour ce projet.
viii
Bien entendu, ce projet n’aurait pas pu être réalisé sans la participation de tous les chasseurs qui ont gentiment accepté de donner un peu de leur temps.
Au cours de ma maîtrise, j’ai été entourée par de précieux amis qui ont su me motiver et m’en apprendre beaucoup. Je remercie ainsi toutes les personnes des laboratoires de Jean-Pierre Tremblay et Steeve D. Côté pour leur présence et le partage de leurs connaissances! Merci aussi à ma famille, mon copain et mes amis pour leur support moral. Je remercie particulièrement ma mère Hélène Lapointe. Malgré qu’elle ait traversé une rude épreuve au cours de ma maîtrise, elle m’a toujours encouragé et m’a montré à quel point elle était fière de moi. Sa forte persévérance est une qualité que j’admire beaucoup.
ix
Table des matières
RÉSUMÉ ... iii
ABSTRACT ... v
AVANT-PROPOS ... vii
TABLE DES MATIÈRES ... ix
LISTE DES TABLEAUX ... xi
LISTE DES FIGURES ... xiii
1. INTRODUCTION GÉNÉRALE ... 1
1.1LIMITATION ET RÉGULATION DES POPULATIONS D’ONGULÉS ... 1
1.2CONSÉQUENCES DES FORTES DENSITÉS D’ONGULÉS ... 3
1.2.1 Végétation ... 3
1.2.2 Condition corporelle ... 3
1.2.3 Succès reproducteur des femelles ... 4
1.2.4 Fréquence des rencontres ... 5
1.3LA SITUATION DE L’ORIGNAL DANS L’EST DU QUÉBEC ... 6
1.4OBJECTIFS ET HYPOTHÈSES ... 7
1.5APPROCHE MÉTHODOLOGIQUE ... 7
1.6CONTRIBUTION DES AUTEURS ... 8
2. OPPOSITE RESPONSES OF BODY CONDITION AND FERTILITY TO VARIATION IN MOOSE POPULATION DENSITY ... 11
RÉSUMÉ ... 13 ABSTRACT ... 15 2.1INTRODUCTION ... 17 2.2STUDY AREA ... 19 2.3METHODS ... 21 2.3.1 Forage Availability ... 21 2.3.2 Body Condition ... 21 2.3.3 Female Fertility ... 22 2.3.4 Statistical Analyses ... 22 2.4RESULTS ... 24 2.4.1 Forage Availability ... 24 2.4.2 Body Condition ... 24 2.4.3 Female Fertility ... 36 2.5DISCUSSION ... 37 2.5.1 Forage Availability ... 37 2.5.2 Body Condition ... 38 2.5.3 Female Fertility ... 40 2.6MANAGEMENT IMPLICATIONS ... 42
x
ACKNOWLEDGMENTS ... 42
3. CONCLUSION GÉNÉRALE ... 44
3.1COMPROMIS DANS L’ALLOCATION DES RESSOURCES ALIMENTAIRES ... 44
3.2TOLÉRANCE DES GRANDS HERBIVORES À LA LIMITATION DES RESSOURCES ... 46
3.3GESTION DES POPULATIONS SURABONDANTES DE GRANDS HERBIVORES ... 47
3.4UN NOUVEAU FACTEUR LIMITANT : LA TIQUE D’HIVER ... 48
3.5AVENUES DE RECHERCHE ... 49
4. BIBLIOGRAPHIE ... 51
xi
Liste des tableaux
Tableau 1.1. Contribution des auteurs de l’article présenté au chapitre 2. ... 9 Table 2.1. Environmental characteristics and sampling effort within two wildlife reserves
with contrasted moose densities located in the Gaspé Peninsula in eastern Québec, Canada. ... 20
Table 2.2. Factors contributing to the variation in hind foot length of moose (male: n =
202; female: n = 167) in two wildlife reserves from eastern Québec, Canada, with contrasted moose densities in 2009-10. Alternative general linear models combining the variables denoted by X were compared using the Akaike information criterion with a correction for finite sample sizes (AICc). Age, age2 and year were included as covariates. Models with ∆AICc ≤ 2 are shown and best models are in bold. Parameters with an asterisk (*) are statistically different from 0 ( = 0.05).. ... 25
Table 2.3. Factors contributing to the variation in rump fat thickness of moose (males: n =
240; females: n = 188) in two wildlife reserves from eastern Québec, Canada, with contrasted moose density in 2009-10. Alternative general linear models combining the variables denoted by X were compared using the Akaike information criterion with a correction for finite sample sizes (AICc). Age, age2, harvest date, year and reproductive state for females were included as covariates. Models with ∆AICc ≤ 2 are shown and the best models are in bold. Parameters with an asterisk (*) are statistically different from 0 ( = 0.05).. .... 27
Table 2.4. Factors contributing to the variation in the mass of kidney fat in moose (males: n
= 157; females: n = 147) in two wildlife reserves from eastern Québec, Canada, with contrasted moose density in 2009-10. Alternative general linear models combining the variables denoted by X were compared using the Akaike information criterion with a correction for finite sample sizes (AICc). Age, age2, harvest date, year and reproductive state for females were included as covariates. Models with ∆AICc ≤ 2 are shown and the best models are in bold. Parameters with an asterisk (*) are statistically different from 0 ( = 0.05). ... 30
Table 2.5. Factors contributing to the variation in peroneus mass of moose (males: n = 89;
females: n = 74) in two wildlife reserves from Eastern Québec, Canada, with contrasted the moose density in 2009. Alternative general linear models combining the variables denoted by X were compared using Akaike information criterion with a correction for finite sample sizes (AICc). Age, age2, harvest date, year and reproductive state for females were included as covariates. Models with ∆AICc ≤ 2 are shown and the best models are in bold. Parameters with an asterisk (*) are statistically different from 0 ( = 0.05). ... 32
xii
Table 2.6. Factors contributing to the variation in the dressed body mass of moose (males =
235; females = 158) in two wildlife reserves from eastern Québec, Canada, with contrasted moose density in 2009-10. Alternative general linear models combining the variables denoted by X were compared using the Akaike information criterion with a correction for finite sample sizes (AICc). Age, age2, harvest date, year and reproductive state for females were included as covariates. Models with ∆AICc ≤ 2 are shown and the best models are in bold. Parameters with an asterisk (*) are statistically different from 0 ( = 0.05).. ... 35
Tableau 3.1. Pourcentages des orignaux mesurés qui avaient des tiques d’hiver dans trois
territoires à densités contrastées de l’Est du Québec en 2009-10. ... 49
Tableau 5.1. Données descriptives des orignaux mesurés dans trois territoires à vocation
faunique de l’Est du Québec en 2009-10. L’écart-type se trouve entre les parenthèses. ... 64
xiii
Liste des figures
Figure 1.1. Localisation des trois territoires à vocation faunique de l’étude. ... 8 Figure 2.1. Variation in rump fat thickness of moose in relation with harvest date, age and
density in two wildlife reserves from eastern Québec, Canada, with contrasted population density in 2009-10: a) Males (n = 240), b) Females (n = 188). Symbols represent the mean rump fat thickness ± 95% confidence intervals estimated from best general linear models. Significant differences between densities are indicated by an asterisk (*). A small offset was added to values on the x-axes to improve readability.. ... 28
Figure 2.2. Peroneus mass of moose (males: n = 89; females: n = 74) in relation with age,
sex and density in two wildlife reserves from eastern Québec, Canada, with contrasted population density in 2009. Symbols represent the mean peroneus mass ± 95% confidence intervals estimated from the best general linear models. Significant differences between densities are indicated with an asterisk (*).A small offset was added to values on the x-axes to improve readability. ... 33
Figure 2.3. Ovulation rate of adult moose females (n = 80) as a function of age and density
in two wildlife reserves from eastern Québec, Canada, with contrasted population density average over 2008, 2009 and 2010. Symbols represent the ovulation rate ± 95% confidence intervals estimated from the best models. A small offset was added to values on the x-axes to improve readability. ... 36
Figure 3.1. Variation de la longueur de la patte arrière des orignaux dans deux réserves
fauniques de l’Est du Québec avec des densités d’orignaux contrastées en 2009-10. Les symboles représentent la longueur moyenne ± l’intervalle de confiance à 95%. ... 45
1
1. Introduction générale
La gestion et la conservation de la faune se sont développées en réponse à la nécessité de restaurer les populations fauniques surexploitées ou dont l’habitat a été dégradé par les activités humaines. Cependant, en profitant de certains facteurs tels que la disparition des prédateurs naturels et l’augmentation des habitats productifs générée par la sylviculture et l’agriculture, plusieurs populations de grands herbivores atteignent dorénavant un niveau d’abondance dépassant les limites de variabilité historiques connues (Côté et al. 2004; McCabe et McCabe 1997). En diminuant la qualité et l’abondance des ressources alimentaires de leur habitat (Coomes et al. 2003; Martin et al. 2010), les densités élevées d’ongulés peuvent entraîner des effets négatifs sur leur condition corporelle, leur reproduction et leur survie (Ferguson et al. 2000; Stewart et al. 2005). Une régulation naturelle peut alors permettre de ramener les densités à un point d’équilibre avec les ressources (Sinclair 1989; Sinclair 1998). La prolifération des maladies et des parasites avantagée par les fortes densités d’ongulés est un autre facteur qui peut favoriser ce point d’équilibre (Anderson et al. 1986; Garner et Wilton 1993; Messier et al. 1989). Par contre, certaines populations semblent se maintenir à forte densité malgré une forte détérioration de leur habitat (Saether et al. 1996; Simard et al. 2008). Ces cas de surabondances de grands herbivores nous amènent à nous questionner sur la régulation de ces populations ainsi que sur les mécanismes qui leur permettent de tolérer une diète de plus faible qualité.
1.1 Limitation et régulation des populations d’ongulés
Des facteurs comme les conditions météorologiques peuvent limiter la croissance des populations d’ongulés sans les réguler. Ces facteurs sont souvent abiotiques, c’est-à-dire non biologiques, et varient indépendamment de la densité des ongulés (Sinclair 1998). C’est ce qu’on observe lorsque les précipitations en été modifient la qualité de l’habitat (Bo et Hjeljord 1991; Stewart et al. 1977) ou lorsque l’accumulation de neige augmente les dépenses énergétiques associées au déplacement (Bishop et Rausch 1974), ce qui peut
2
diminuer le taux de reproduction et de survie des individus au sein d’une population (Sinclair 1998).
La prédation et la compétition pour les ressources alimentaires sont deux facteurs biotiques couramment utilisés pour expliquer la régulation des populations d’ongulés. Ces facteurs régulateurs altèrent le taux de croissance d’une population dépendamment de la densité. Ils tendent ainsi à ramener la population à un niveau d’équilibre après que celui-ci ait été perturbé (Sinclair 1989; Sinclair 1998). Par exemple, une population de loups (Canis lupus), dont la densité fluctue selon l’abondance des orignaux (Alces alces), stabilise la densité de ces grands herbivores en affectant le taux de survie (Lewis et Murray 1993; McLaren et Peterson 1994; Messier et Crête 1985). Dans une population à forte densité où les prédateurs naturels sont absents ou en plus faible nombre, la compétition pour les ressources peut devenir le facteur de régulation des populations (Ferguson et al. 2000; Sinclair et al. 1985). Un équilibre stable existe alors entre une population et la nourriture disponible dû à une diminution de la reproduction et/ou à une augmentation de la mortalité associées à une diète de moins bonne qualité (Caughley 1970; McCullough 1979; Sinclair et al. 1985). Des études suggèrent cet équilibre entre la nourriture et les ongulés tels que le gnou bleu (Connochaetes taurinus; Sinclair et al. 1985) et le cerf de Virginie (Odocoileus virginianus; McCullough 1979).
Depuis les dernières décennies, plusieurs régions du monde ont connu un accroissement considérable des populations d’ongulés qui est dû entre autres à la disparition des prédateurs naturels, à des climats moins rigoureux facilitant la survie hivernale et à une diminution de la pression de chasse (Côté et al. 2004; Loison et Langvatn 1998; Peterson 1999). Par exemple, le nombre de cerfs de Virginie a augmenté d’environ 25 000 individus en 1931 à 900 000 individus au début des années 1990 en Virginie, États-Unis (Knox 1997). Ces densités élevées de grands herbivores provoquent une forte détérioration de la forêt causée par le broutement intensif (Coomes et al. 2003; Martin et al. 2010; Tremblay et al. 2005). Les cas de surabondances d’ongulés semblent suggérer que la compétition pour les ressources n’entraîne pas d’effet majeur sur le taux de croissance d’une population. Le maintien de fortes densités peut être expliqué par une adaptation de la diète (Coomes et
3 al. 2003) et/ou de sources de nourriture additionnelles qui ne sont pas dépendantes de la densité telles que la chute de lichen arboricole (Tremblay et al. 2005). De plus, la plasticité et la forte tolérance des cervidés face à la détérioration de leur habitat peuvent favoriser le maintien de niveaux d’abondance élevés (Saether et al. 1996; Simard et al. 2008; Skogland 1990), en optant, par exemple, pour des stratégies de reproduction plus conservatrices (Simard et al. 2008).
1.2 Conséquences des fortes densités d’ongulés
1.2.1 Végétation
Les fortes densités d’ongulés peuvent détériorer la qualité et l’abondance des ressources alimentaires de leur habitat par leurs effets directs sur la survie, la croissance et la reproduction des plantes consommées (Stewart et al. 2009; Tremblay et al. 2007), mais aussi par leurs effets indirects en modifiant les relations compétitives entre les plantes (Hornberg 2001; Mathisen et al. 2010). En défavorisant la croissance et la régénération des espèces préférées montrant une bonne valeur nutritive, les grands herbivores peuvent avantager les plantes résistantes ou tolérantes au broutement généralement peu digestibles et provoquer la modification du patron de succession végétale (Martin et al. 2010; McLaren et al. 2004; Tremblay et al. 2007). Des études ont montré les effets négatifs de l’orignal sur la régénération du sapin baumier (Abies balsamea), une espèce dominante du régime alimentaire de l’orignal à l’hiver, au profit de l’épinette blanche (Picea glauca), espèce peu digestible, sur l’Isle Royale, États-Unis (McInnes et al. 1992) et à Terre-Neuve, Canada (Gosse et al. 2011; Thompson et Curran 1993).
1.2.2 Condition corporelle
Un habitat détérioré par le broutement d’une population surabondante de grands herbivores peut provoquer une diminution de la croissance squelettique, des réserves de gras et de la
4
masse musculaire, ce qui peut réduire conséquemment la masse corporelle (Couturier et al. 2010; Ferguson et al. 2000; Klein 1968). Par exemple, dans le sud-ouest de la France, une taille squelettique du chevreuil (Capreolus capreolus) plus petite dans les zones où la densité est élevée montre les impacts négatifs des ressources limitées sur la croissance squelettique (Toïgo et al. 2006). Plusieurs études suggèrent l’existence d’une relation entre la qualité de l’habitat et la masse corporelle chez les grands herbivores (cerf élaphe, Cervus elaphus: Rodriguez-Hidalgo 2010; caribou, Rangifer tarandus: Klein 1968, Couturier et al. 2009a; cerf de Virginie: Severinghaus 1979). La condition corporelle peut influencer la survie des ongulés (Ferguson et al. 2000; Loison et al. 1999). Dans le nord-ouest des États-Unis, Bender et al. (2008) ont suggéré que la probabilité de mortalité augmente approximativement de 1.4 fois pour chaque pourcentage de gras corporel en moins chez le wapiti (Cervus elaphus). Cependant, Mysterud et Ostbye (2006) n’ont trouvé aucune relation entre la densité des populations et la masse corporelle chez le chevreuil en Norvège.
1.2.3 Succès reproducteur des femelles
En ayant un effet négatif sur la condition corporelle, la diminution de la qualité et de l’abondance de la nourriture peut influencer certains paramètres relatifs au succès reproducteur des femelles ongulés tels que la fécondité (Stewart et al. 2005). La reproduction chez les femelles représente des coûts métaboliques importants, principalement lors de la période de lactation (Clutton-Brock et al. 1989). Sous l’influence d’un régime alimentaire de faible qualité, un compromis entre la croissance et la reproduction peut entraîner un retardement de la première ovulation chez les femelles (Bonenfant et al. 2009; Forchhammer et al. 2001). Pimlott (1959) a montré que des habitats de bonne qualité pour l’orignal à Terre-Neuve ont un pourcentage plus élevé de femelles de 1,5 an qui se reproduisent (67 %) comparativement à 29 % dans des habitats de plus faible qualité. Le retardement de la première reproduction chez les femelles peut avoir un impact sur la démographie d’une population puisque les juvéniles (1,5 an) représentent généralement une grande proportion de la population (Franzmann et Schwartz 1997). De
5 plus, à forte densité, les femelles peuvent réduire le nombre d’ovulations doubles, qui peuvent donner des jumeaux, pour ainsi réduire leurs dépenses énergétiques (Franzmann et Schwartz 1985; Keech et al. 2000).
Cependant, certaines études ont révélé que les populations d’ongulés peuvent maintenir une productivité élevée malgré une faible qualité et abondance des ressources (Crête et al. 1993; Saether et al. 1996; Simard et al. 2008), ce qui peut favoriser la persistance de fortes abondances d’ongulés mentionnés précédemment. Par exemple, Skogland (1990) a montré que 30 années de ressources limitantes chez le caribou associées avec une réduction de 23 % de la masse corporelle n’ont pas mené à un déclin du taux de reproduction. Avec un déclin de l’abondance des ressources, les femelles peuvent moduler leurs stratégies de reproduction afin de maintenir un taux de fécondité élevé (Clutton-Brock et al. 1996). Simard et al. (2008) ont observé que les cerfs de Virginie femelles à l’île d’Anticosti, Québec, conservent leur énergie en réduisant le nombre d’ovulations doubles pour augmenter la probabilité de se reproduire pendant plus d’années.
1.2.4 Fréquence des rencontres
Des effets négatifs peuvent aussi être reliés à une augmentation de la fréquence des rencontres entre les ongulés dans une population à forte densité. Par exemple, au cours du rut, une fréquence plus élevée d’interactions physiques entre les mâles, qui entraînent des coûts énergétiques, a été associée à l’augmentation de la densité chez le daim (Dama dama; Alvarez 1993, Pélabon et al. 1999) et le wapiti (Vander Wal et al. 2012). Une augmentation de la fréquence des rencontres entre les individus d’une population peut aussi avantager la prolifération des maladies et des parasites (Anderson et al. 1986; Garner et Wilton 1993; Messier et al. 1989). La tique d’hiver (Dermacentor albipictus) est un exemple de parasite particulièrement néfaste pour l’orignal en provoquant la perte de plaques de poils et en provoquant ainsi des coûts énergétiques supplémentaires pour conserver sa chaleur au cours de l’hiver (Addison et al. 1994; McLaughlin et Addison 1986; Samuel 2004).
6
1.3 La situation de l’orignal dans l’Est du Québec
Depuis les années 1990, les populations d’orignaux de l’Est du Québec montrent une croissance exponentielle qui serait possiblement due aux coupes forestières qui ont engendré des habitats productifs, aux modalités de chasse favorisant l’augmentation des populations et à l’absence du loup disparu de la rive sud du Saint-Laurent à la fin du 19e siècle. En 2007, un inventaire aérien a permis d’estimer la population d’orignaux de la réserve faunique de Matane à 4,8 orignaux par km2 (Lamoureux et al. 2007), soit une augmentation de 240 % par rapport à celui réalisé en 1995 (2,0/km2; St-Onge et al. 1995). Cette population d’orignal atteint un niveau d’abondance dépassant les limites de variabilité historiques connues rencontrées au Québec.
Ces fortes densités d’orignaux entraînent des répercussions sur la sapinière à bouleau blanc de l’Est (Lambert et al. en prép.). Depuis quelques années, le broutement intensif de l’orignal interfère avec le processus de régénération de la forêt à la suite des coupes forestières (Fleury 2008). Une carence en tiges feuillues et une augmentation de l’utilisation du sapin baumier semblent suggérer que l’espèce dépasse la capacité de support du milieu (Fleury 2008) estimée à plus de 2 orignaux par km2 selon Crête (1989). La forte pression de broutement à ces niveaux de densité peut altérer l’intégrité écologique de la sapinière à bouleau blanc de l’Est (Barrette et al. en prép.; Gosse et al. 2011; Tremblay et al. 2007) avec des rétroactions négatives sur les populations d’orignaux. La chasse sportive constitue une activité hautement pratiquée dans l’Est du Québec qui génère des retombées considérables contribuant au développement économique régional (Bouchard 2007). Afin de gérer les populations d’orignaux sur une base durable, il importe de vérifier les effets des niveaux élevés d’abondance des populations atteints au cours de la dernière décennie sur la condition corporelle et la fécondité des orignaux.
7
1.4 Objectifs et hypothèses
Dans cette étude, nous cherchons à établir les relations entre l’abondance des orignaux, leur condition corporelle et la fécondité des femelles. En réponse à la diminution de la qualité de leur alimentation, nous émettons l’hypothèse qu’il y a un déclin dépendant de la densité dans la condition corporelle des orignaux. Nous nous attendons ainsi à ce que la diminution de la qualité et de l’abondance des ressources dans les territoires à fortes densités d’orignaux entraîne une réduction des indices de condition corporelle. Nous émettons également l’hypothèse que les femelles peuvent moduler leurs stratégies de reproduction pour maintenir une bonne fécondité malgré le manque de ressources. Nous prédisons donc qu’un déclin de la condition corporelle à forte densité amène une réduction du taux d’ovulation double, mais une augmentation du taux d’ovulation global, puisque la probabilité de se reproduire pendant plus d’années est plus élevée.
1.5 Approche méthodologique
Le projet s’appuie sur une expérience naturelle misant sur la variation de la densité de l’orignal entre trois territoires à vocation faunique de l’Est du Québec, soit la ZEC Casault, la réserve faunique des Chic-Chocs et la réserve faunique de Matane (Figure 1.1). Ces trois territoires, situés majoritairement dans le domaine bioclimatique de la sapinière à bouleau blanc de l’Est, présentent des conditions environnementales comparables (Environnement Canada 2012; Tableau 2.1). La réserve faunique des Chic-Chocs a par contre une altitude moyenne plus élevée que les deux autres territoires (Sépaq 2011). Ces territoires abritent des densités d’orignaux différentes, variant de 1.0 à 4.8 orignaux/km2 (Dorais et Lavergne 2010, Lamoureux et al. 2007, Landry et Lavergne 2007) engendrées par des variations à long terme dans les modalités de chasse. Dans chaque territoire, des mesures sur les espèces ligneuses ont été prises dans des coupes forestières récentes pour évaluer les effets des fortes abondances d’orignaux sur la régénération forestière. Des mesures et des prélèvements ont également été effectués sur les orignaux abattus à la chasse sportive afin d’évaluer leur condition corporelle et la fécondité des femelles. Le chapitre principal de ce
8
mémoire porte sur les territoires de la réserve faunique des Chic-Chocs et de la réserve faunique de Matane pour lesquels les données d’âge et la période de prise de données étaient comparables. Des analyses descriptives ont tout de même été effectuées avec les données de la ZEC Casault (voir section 5. Annexe).
Figure 1.1. Localisation des trois territoires à vocation faunique de l’étude.
1.6 Contribution des auteurs
La contribution des auteurs de l’article présenté au chapitre 2 aux diverses étapes du projet est détaillée dans le Tableau 1.1.
9
Tableau 1.1. Contribution des auteurs de l’article présenté au chapitre 2.
J. Gingras J.-P. Tremblay S. Couturier
Conception du projet X X X
Mise en place du dispositif
expérimental X X X
Analyse des données X
Interprétation des résultats X X X
Rédaction X
Révision X X
11
2.
Opposite responses of body condition and fertility to variation in
moose population density
Janick Gingras1,3, Jean-Pierre Tremblay1,3 and Serge Couturier2
1 Département de biologie, Université Laval, 1045 avenue de la Médecine, Québec,
Québec, Canada, G1V 0A6.
2 Ministère des Ressources naturelles et de la Faune, Direction de l’expertise sur la faune et
ses habitats, 880 Chemin Ste-Foy, Québec, Québec, Canada, G1S 4X4.
3 Centre d’études nordiques, Université Laval, 2405 rue de la Terrasse, Québec, Québec,
13
Résumé
En réponse à des modalités de chasse conservatrices, à la disparition des prédateurs et à des modifications aux habitats, plusieurs populations de grands herbivores ont augmenté considérablement depuis les dernières décennies. C’est le cas dans certains territoires à vocation faunique au nord-est de l’Amérique du Nord où les populations d’orignaux (Alces alces) dépassent 3 individus/km2. La forte pression de broutement à ces densités risque d’altérer l’intégrité écologique des forêts avec des rétroactions éventuelles sur les orignaux. Nous avons émis l’hypothèse qu’un déclin des ressources alimentaires causé par les fortes densités provoque une diminution de la condition corporelle des orignaux, mais que les femelles peuvent ajuster leurs stratégies de reproduction pour maintenir une forte fécondité. Une augmentation de la pression de broutement dans la sapinière (Abies balsamea [L.] Mill.) à bouleau blanc (Betula papyrifera Marshall) de l’Est du Québec à forte densité d’orignaux était reliée à un déclin de 20 à 33 % de l’épaisseur du gras sous-cutané du dos en octobre chez les mâles et les femelles, respectivement, comparativement à une population adjacente à plus faible densité. Nous avons aussi observé une réduction de la masse du groupe musculaire péronier des mâles (3 %) et des femelles matures (8 %) dans le territoire à forte densité d’orignaux. À forte densité, la diminution de la condition corporelle a entraîné une réduction du nombre d’ovulations doubles de 28 % mais une augmentation du taux d’ovulation global (>15%). Nos résultats suggèrent que les femelles orignales peuvent maintenir une fécondité élevée malgré une diminution de leur condition corporelle en réduisant la taille de leur portée et en conservant ainsi de l’énergie pour augmenter la probabilité de se reproduire pendant plus d’années. L’ajustement des stratégies de reproduction des femelles montrent la plasticité des orignaux en réponse à la diminution de la qualité de leur diète. Nous concluons qu’en absence de prédateurs spécialistes, l’équilibre entre la nourriture et les grands herbivores est peu probable à court ou moyen terme. Une gestion des populations d’orignaux est donc nécessaire pour préserver l’intégrité écologique de la forêt boréale.
15
Abstract
Following predator extirpation, conservative hunting regulations, and habitat modifications, several large herbivore populations have increased considerably in recent decades. This is exemplified in some wildlife reserves and parks of northeastern North America where moose (Alces alces) populations exceed 3 individuals/km2. Heavy browsing pressure at such densities is potentially altering the ecological integrity of forests with an eventual negative retroaction effect on moose. We hypothesized that a density-dependent decrease in food resources would lead to a decline in body condition but that females would adjust their reproductive strategies to maintain high fertility. An increase in browsing pressure in balsam fir (Abies balsamea [L.] Mill.)-paper birch (Betula papyrifera Marshall) forests of Eastern Québec at high moose density was related to a 20 to 33% decline in lower rump fat thickness in males and females, respectively, in October compared to an adjacent population at a lower density. We also observed a decrease in the mass of the peroneus group of muscles for males (3%) and prime-aged females (8%) in the area at high moose density. At higher density, the decline in body condition led to a 28% reduction of the number of double ovulations but to an increase in the overall ovulation rate (>15%). Our results suggest that female moose can maintain high fertility despite a decline in body condition by reducing litter size at ovulation and conserving energy to increase the probability of annual reproduction. The adjustment of female reproductive strategies illustrates the plasticity of moose in response to decreasing diet quality. We conclude that in the absence of specialist predators, equilibrium with forage is unlikely for large herbivores at short- or mid-term. Active management of moose populations is required to maintain the ecological integrity of boreal forests.
17
2.1 Introduction
Two alternative hypotheses are commonly proposed to explain the population limitation of large herbivores. Under the predator-regulation hypothesis, predation stabilizes herbivores at low density releasing vegetation from top-down control by consumers and reducing competition for forage (Sinclair and Arcese 1995). The food-limitation hypothesis stipulates that an herbivore population increases until it reaches a dynamic equilibrium with food resources (bottom-up control; Caughley 1970). Many studies suggested equilibrium between forage and ungulate abundance (McCullough 1979, Sinclair et al. 1985, McLaren and Peterson 1994). However, several large herbivore populations increased considerably in abundance worldwide in recent decades (Côté et al. 2004), and dramatic shifts in forest composition were observed (Coomes et al. 2003, Martin et al. 2010). These cases raise interrogations about the stability of the equilibrium between herbivores and their food resources, especially under the food-limitation hypothesis (Sæther 1997).
At high population densities, the selective browsing of large herbivores has direct effects on vegetation by reducing seedling growth or killing seedlings of preferred plant species (Tremblay et al. 2007, Stewart et al. 2009, Hidding et al. 2012), and also indirect effects by favoring species that are tolerant or resistant to browsing (Mathisen et al. 2010). Consequently, large herbivores can force forests toward alternative successional pathways and reduce the quantity and quality of their food resource (McLaren et al. 2004, Tremblay et al. 2007, Hidding et al. 2012). For instance, in Newfoundland, densities of moose (Alces alces) up to 3/km2 negatively affected the capacity of balsam fir (Abies balsamea [L.] Mill.) to regenerate following canopy disturbance (Gosse et al. 2011).
A decline in diet quality can eventually exert negative impacts on body condition of ungulates such as reducing growth, fat reserves and muscular mass (Stewart et al. 2005, Toïgo et al. 2006, Simard et al. 2008). Relationships between habitat quality and body mass were observed in several large herbivore species (Severinghaus 1979, Simard et al. 2008,
18
Couturier et al. 2009a, Rodriguez-Hidalgo 2010). Body condition is a determinant factor of animal survival, particularly for the winter survival of young Cervidae (Loison et al. 1999).
The fertility of large herbivore females at high population densities may decrease through a resource-dependent reduction in body condition (Ferguson et al. 2000, Stewart et al. 2005). Reproduction involves high metabolic costs for females, mostly during lactation (Clutton-Brock et al. 1989). The probability of ovulation can be highly influenced by body condition during oestrus (Sand 1996, Testa and Adams 1998). For instance, in Sweden, a 25% decrease in the body mass of yearling moose females in autumn resulted in a 42% decline in the probability of ovulation (Sand 1996). At high density, a trade-off between growth and reproduction often results in delayed maturity among young females (Jorgenson et al. 1993, Forchhammer et al. 2001, Bonenfant et al. 2009). Litter size can also decrease with declining body condition (Franzmann and Schwartz 1985; Keech et al. 2000). For example, moose twinning rate varied from 49% in a low density region (0.2 moose/km2) to 1% in a high density region (> 4.0 moose/km2, Ferguson et al. 2000). However, some studies suggested that high productivity rate in abundant large herbivore populations could be maintained despite chronic impacts on the habitat (Saether et al. 1996, Simard et al. 2008, Skogland 1990). With a decline in browse availability, females can modify their reproductive strategy to maintain high fertility rate (Clutton-Brock et al. 1996). Simard et al. (2008) observed that white-tailed deer (Odocoileus virginianus) females on Anticosti Island, Québec, conserved energy by reducing litter size at ovulation to increase the probability of reproducing during most years.
Overabundance has been recently described in some wildlife reserves and parks of eastern Canada where moose density has increased exponentially since the 1990s, exceeding 4 individuals/km2 (Lamoureux et al. 2007, Gosse et al. 2011). The extinction of wolf (Canis lupus), conservative hunting regulations, and productive early successional habitat types generated by forest harvesting may have favored the increase of populations. A shortage in deciduous stems and an increase of balsam fir browsing rate suggested that moose populations exceeded carrying capacity (Lambert et al. in prep.) estimated to >2 moose/km2 (Crête 1989). The heavy browsing pressure at such density levels may be altering the
19 ecological integrity of balsam fir-paper birch (Betula papyrifera Marshall) forests of eastern Québec with eventual retroaction impacts on moose populations.
Here, we investigated the relationships between relative moose abundance, body condition and fertility. We seek to infer whether or not regulation by resources (bottom-up control) could limit the increase of moose density by declining body condition and female fertility in areas without specialized predators and conservative hunting regulations. In response to lower availability and quality of forage, we hypothesized a density-dependant decline in body condition. We also hypothesised that female moose could modulate their reproductive strategies to maintain high fertility despite a decline in food resources (Simard et al. 2008). We predicted that a decline in the availability and quality of forage and in body condition at higher density should lead to a reduction in the number of double ovulations but an increase in the overall ovulation rate.
2.2 Study Area
We compared forage availability, body condition and female fertility between two wildlife reserves with similar environmental conditions but contrasted moose densities due to different past harvest regime (Table 2.1). During the course of the study, the moose density in the Matane Wildlife Reserve was reduced through sport hunting (Lamoureux et al. 2012) but remained > 2.2 moose/km2 higher than on the Chic-Chocs Wildlife Reserve. The two reserves are located in the Gaspé Peninsula in eastern Québec, Canada and 20 km from each other (Table 2.1). This region has a perhumid sub-boreal climate with cool summers, cold winters and abundant rainfall and snowfall (Table 2.1). The topography is rugged, which some mountains reaching over 850 m above sea level. The forests belong to the boreal zone and are mostly part of the eastern balsam fir-paper birch bioclimatic subregion (Saucier et al. 2009). Mature forests are dominated by balsam fir, white spruce (Picea glauca [Moench] Voss), black spruce (P. mariana [Mill.] B. S. P.), paper birch and quaking aspen (Populus tremuloides Michx.; Saucier et al. 2009). Wolf has been extirpated from the region about a century ago (Boisjoly et al. 2010); black bear (Ursus americanus) and
20
coyote (Canis latrans) are the only natural predators of moose calves. Other mammalian herbivores include white-tailed deer and snowshoe hare (Lepus americanus), both at low density.
Table 2.1. Environmental characteristics and sampling effort within two wildlife reserves with contrasted moose densities located in the Gaspé Peninsula in eastern Québec, Canada
Chic-Chocs Wildlife Reserve (lower density)
Matane Wildlife Reserve (higher density) Geographic coordinates 48.75° – 49.13° N, 65.50° – 66.17° W 66.45° – 67.30° N, 48.53° – 48.92° W Area 1129 km2 1282 km2 Altitude (X ± sd ) 540 ± 160 m 440 ± 170 m Average annual
precipitation (rain – snow)a 586.0 mm – 531.4 cm 728.5 mm – 405.7 cm Average temperature
(annual – July – January)a 1.7°C – 16.4°C – -13.9°C 1.5°C – 16.2°C – -14.6°C
Moose density 1.1/km2 b 2007: 4.8/km2
2012: 3.3/km2 c Number of moose sampled
(2009 – 2010) 126 – 166 137 –143
Number of ovary pairs
sampled (2009 – 2010) 11 – 39 18 – 25
a Environment Canada 2012. b Dorais and Lavergne 2010
c Lamoureux et al. 2007, Lamoureux et al. 2012; the lower density in 2012 results from a harvest
management plan that began in 2008 with the aim of reducing the moose density in the Matane Wildlife Reserve.
21
2.3 Methods
2.3.1 Forage Availability
We compared forage abundance and use using three forest stands per reserve where we surveyed regeneration six years after clear-cut logging. We recorded abundance, height and browsing rate of woody saplings (>30 cm, Gosse et al. 2011) in 10 to 12 randomly selected circular plots (4 m2) per cutover (nobs = 66 plots). We computed browsing rate as the percentage of saplings with at least one browsed twig.
2.3.2 Body Condition
We derived body condition indices from 572 moose killed by sport hunters between 8 September and 29 October 2009 and 2010 (Table 2.1). We recorded harvest date, sex and the reproductive state of females inferred from the presence of milk. We estimated age using cementum layers of incisor teeth (Rolandsen et al. 2008) and skeletal growth with hind foot length from the calcaneum to the tip of the hoof (Zannèse et al. 2006). We estimated subcutaneous fat reserves from the average rump fat thickness at 5 and 10 cm from the base of the tail (± 0.05 cm; Huot 1988) and intraperitoneal fat reserves from kidney fat mass (± 0.05 g, ACBplus 3000, Adam Equipment, Danbury; Anderson et al. 1990). We used the mass of a group of indicator muscles as a proxy of the muscular mass: we dissected the muscle peroneus tertius with extensor digitorum longus and extensor digit III attached from the lower part of the leg and weighed them soon after collection (hereafter peroneus; ± 0.05 g, ACBplus 3000, Adam Equipment, Danbury; Couturier et al. 2009a). Peroneus data were not available in 2010. We also measured dressed body mass (live mass minus viscera and bleedable blood; ± 0.5 kg, CS2000 scale, Salter Brecknell, Pointe-Claire).
22
2.3.3 Female Fertility
We evaluated female fertility from the count of ovulation scars in 93 ovary pairs collected from females killed by hunters (Table 2.1). We preserved and prepared ovaries for microscopic examination (10X) following the method described in Simard et al. (2008) except that we coloured one 10 m slice out of 50. We counted the number of Corpus luteum (CL) originating from recent ovulation ( 1 year) and Corpus albicans (CA) referring to an ovulation that occurred the previous year (Langvatn et al. 1994). For ovulation of the current year, we restricted the count of CL to ovaries of females killed after October 5th as the rutting season of moose in this area occurs from September to mid-October (Claveau and Courtois 1989). We derived three indices of female fertility: adult ovulation rate corresponding to the percentage of adults that had at least 1 ovulation (CL 1 or CA 1); yearling ovulation rate (CL 1); and adult double ovulation rate corresponding to the percentage of ovulating adult females that had 2 ovulations within a single year (CL = 2 or CA = 2).
2.3.4 Statistical Analyses
We assessed the effect of moose density on sapling height and stem density per species using generalized linear mixed models (GLMM, function lme, package nlme, R version 2.14.0; Crawley 2007) and on browsing rate using GLMM with a binomial error distribution and a logit link (function glmer, package lme4, R version 2.14.0; Crawley 2007). We computed plots nested in the cutblocks as a random factor.
For all body condition parameters, we performed sex-specific analyses (n = 316 males and 256 females) because of sexual dimorphism. We excluded combinations of age and density for which n 4, i.e. calves, males ≥8.5-years-old, and females ≥11.5-years-old. We compared body condition parameters between wildlife reserves with contrasting moose
23 densities using general linear models (function lm, package stats, R version 2.14.0; Crawley 2007) and used age, age2 (non-linear effect), year, and reproductive state for females as covariates. We included harvest date as a covariate for all analyses involving body mass. We added kidney mass as a covariate to models of kidney fat mass to correct for the effect of organ size on fat mass (Serrano et al. 2008) and hind foot length to models of peroneus mass to correct for the effect of body size.
We compared variations in adult ovulation and adult double ovulation rates between density using GLMM with a binomial error distribution and a logit link (function glmer, package lme4, R version 2.14.0; Crawley 2007). We used age, age2 and year as covariates and moose identification as a random factor. We compared the yearling ovulation rate using generalized linear models with a binomial error distribution and a logit link (function lm, package stats, R version 2.14.0; Crawley 2007).
We transformed variables to ensure normality requirements using the boxcox procedure (package MASS, R version 2.14.0; Crawley 2007). The height of saplings was log transformed while rump fat thickness, kidney fat and stem density were squared-root transformed. We only compared models including simple effects and their two-way and three-way interactions, including the explanatory variable density, that were linked to our hypotheses. There was no strong correlation among independent variables according to the variation inflation factor (VIF <10, Chatterjee and Price 1977). We compared hierarchical models using the Akaike Information Criterion with a correction for finite sample sizes (AICc) and selected the model with the lowest AICc (Burnham and Anderson 2002). We also tested factors included in models within ∆AICc ≤ 2 of the best model (Stephens et al. 2005). We used least square means (package lsmeans, R version 2.14.0; Crawley 2007) to conduct a posteriori comparisons. Results are presented as means or lsmeans ± 95% confidence intervals (CI). The threshold for statistical significance was fixed at = 0.05.
24
2.4 Results
2.4.1 Forage Availability
The browsing rate of balsam fir was higher at high than at low moose density ( X = 71%, CI = 8-99% vs. X = 1%, CI= 0-22%, Z4,398 = 3.0, P = 0.003), but we detected no
difference in the browsing rate of paper birch (96%, CI = 43-100% vs. 66%, CI = 16-95%, Z4,57 = 1.5, P = 0.1). The height of balsam fir and paper birch was similar at both moose
densities (balsam fir: high = 91 ± 3 cm vs. low = 88 ± 3 cm t4,428 = 0.2, P = 0.9; paper birch:
high = 66 ± 15 cm vs. low = 86 ± 20 cm , t4,59 = 1.6, P = 0.2, respectively). We did not
detect any differences in the density of stems (balsam fir: high = 10,552 ± 16 001/ha vs. low = 20 217 ± 11,742/ha, t4,60 = -1.0, P = 0.4; paper birch: high = 1,433 ± 1,644/ha vs. low
= 1,297 ± 1,785/ha, t4,60 = 0.1, P = 0.9).
2.4.2 Body Condition
The best model and all alternative models indicated that hind foot length of males increased non-linearly with age (1.5-y-old = 76.1 ± 0.8 cm, 4.5-y-old = 79.4 ± 0.6 cm, 7.5-y-old = 80.2 ± 0.8 cm; Age: F1,198 > 78.9, P ≤ 0.001, Age2: F1,198 > 10.0, P < 0.002; Table 2.2). For
females, all models indicated that hind foot length increased with age until 7.5-years-old and decreased thereafter (1.5 y-old = 74.6 ± 0.8 cm, 7.5 y-old = 78.3 ± 0.5 cm, 10.5 y-old = 77.4 ± 1.1 cm; Age: F1,163 > 53.4, P ≤ 0.001, Age2: F1,164 > 19.1, P ≤ 0.001; Table 2.2).
Density appeared in the alternative model for females, but it was not significant (F1,163 =
25 Table 2.2. Factors contributing to the variation in hind foot length of moose (male: n = 202; female: n = 167) in two wildlife reserves from eastern Québec, Canada, with contrasted moose densities in 2009-10. Alternative general linear models combining the variables denoted by X were compared using the Akaike information criterion with a correction for finite sample sizes (AICc). Age, age2 and year were included as covariates. Models with ∆AICc ≤ 2 are shown and best models are in bold. Parameters with an asterisk (*) are statistically different from 0 ( = 0.05).
Density Age Age2 Year AICc ∆AICc
Males M1 X* X* 909.3 0.0 M2 X* X* X 910.4 1.1 Females F1 X* X* 730.9 0.0 F2 X X* X* 731.5 0.6
The best model and all alternative models of the variation in the rump fat thickness of males included the three-way interaction between density, age and harvest date (Table 2.3). During the rut, rump fat thickness of males 4.5 to 7.5-years-old decreased faster than for males ≤ 3.5-years-old (Figure 2.1a). Rump fat thickness of males 4.5 to 7.5-years-old was similar at both densities in mid-September and mid-October (15 Sept: F1,231 1.4, P 0.2;
15 Oct.: F1,231 3.4, P 0.07), but was 20% lower at high density than at low density at the
beginning of October (1 Oct.: F1,231 4.3, P 0.04; Figure 2.1a). We found no differences
through autumn in younger males (F1,231 1.9, P 0.2). For females, the two-way
interaction between density and harvest date was included in the best model and in all alternative models (Table 2.3). The accumulation of rump fat was similar at both densities in September (F1,181 2.7, P 0.1; Figure 2.1b). It was relatively stable for females at low
density but decreased progressively from 4.1 cm at the beginning of October to 3.2 cm by mid-October at high density, a 33% difference with females at low density (15 Oct.: F1,181 = 10.4, P = 0.01; Figure 2.1b). Age, age2 and reproductive state were also included in
26
all models (Table 2.3). Rump fat thickness of females increased non-linearly with age (Age: F1,180 18.6, P ≤ 0.001; Age2: F1,180 15.4, P ≤ 0.001). Lactating females had less
rump fat than non-lactating females (F1,180 13.5, P ≤ 0.001). The two-way interactions
density X age and density X reproductive state were included in one of the two best
alternative models, but the parameters were not significant (F1,180 < 0.7, P = 0.4; F1,180 =
27
Table 2.3. Factors contributing to the variation in rump fat thickness of moose (males: n = 240; females: n = 188) in two wildlife reserves from eastern Québec, Canada, with contrasted moose density in 2009-10. Alternative general linear models combining the variables denoted by X were compared using the Akaike information criterion with a correction for finite sample sizes (AICc). Age, age2, harvest date, year and reproductive state for females were included as covariates. Models with ∆AICc ≤ 2 are shown and the best models are in bold. Parameters with an asterisk (*) are statistically different from 0 ( = 0.05).
Density Age Age2 Harvest
date Year Reproductive state Density X Age Density X harvest date Density X Reproductive state Density X Age X Harvest date AICc ∆AICc Males M1 X X* X* X* - X X - X* 309.7 0.0 M2 X X* X* X* X - X X - X* 311.7 1.9 Females F1 X* X* X* X* X* X* 306.9 0.0 F2 X* X* X* X* X* X X* 308.4 1.5 F3 X* X* X* X* X* X* X 308.7 1.8
28
Figure 2.1. Variation in rump fat thickness of moose in relation with harvest date, age and density in two wildlife reserves from eastern Québec, Canada, with contrasted population density in 2009-10: a) Males (n = 240), b) Females (n = 188). Symbols represent the mean rump fat thickness ± 95% confidence intervals estimated from best general linear models. Significant differences between densities are indicated by an asterisk (*). A small offset was added to values on the x-axes to improve readability.
Variation in the mass of kidney fat in males was best explained by models including age2 and harvest date (Table 2.4). The mass of kidney fat increased with age until 4.5-years-old and decreased thereafter (1.5-y-old = 535 g ± 62, 4.5-y-old = 642 g ± 58, 7.5-y-old = 548 g ± 56; Age2: F1,151 > 6.3, P < 0.01). The mass of kidney fat decreased during the rut (F1,151 >
169.4, P ≤ 0.001). Density and the two-way interactions density X harvest date and density X age2 were included in one or two of the four best alternative models, but these parameters were not significant (density: F1,152 = 0.4, P = 0.6; density X harvest date: F1,150 < 3.1, P >
0.08; density X age2: F1,150 = 1.5, P = 0.2; Table 2.4). For females, all models included age,
age2, harvest date and reproductive state (Table 2.4). The mass of kidney fat increased with age until 6.5-years-old and decreased thereafter (1.5-y-old = 590 g ± 98, 6.5,y-old = 811 g ± 100, 10.5,y-old = 706 g ± 164; Age: F1,140 > 5.5, P < 0.02; Age2: F1,140 > 6.5, P < 0.01). It
29 than for non-lactating females (F1,140 > 17.7, P ≤ 0.001). Population density was included in
one of the 2 best alternative models, but it did not differ from 0 (F1,140 = 0.3, P = 0.6, Table
30
Table 2.4. Factors contributing to the variation in the mass of kidney fat in moose (males: n = 157; females: n = 147) in two wildlife reserves from eastern Québec, Canada, with contrasted moose density in 2009-10. Alternative general linear models combining the variables denoted by X were compared using the Akaike information criterion with a correction for finite sample sizes (AICc). Age, age2, harvest date, year and reproductive state for females were included as covariates. Models with ∆AICc ≤ 2 are shown and the best models are in bold. Parameters with an asterisk (*) are statistically different from 0 ( = 0.05).
Density Age Age2 Harvest date Year Reproductive state
Density X
Age2
Density X
Harvest date AICc ∆AICc Males M1 X* X* - 888.2 0.0 M2 X X* X* - X 889.4 1.3 M3 X X* X* - 890.0 1.8 M4 X X* X* - 890.0 1.9 M5 X X* X* - X X 890.1 1.9 Females F1 X* X* X* X* 885.8 0.0 F2 X* X* X* X X* 887.6 1.8 F3 X X* X* X* X* 887.8 2.0
31 The best model and all alternative models of the variation in the mass of the peroneus for males included age, age2 and harvest date (Table 2.5). Peroneus mass increased non-linearly with age (Age: F1,82 > 34.9, P ≤ 0.001; Age2: F1,84 > 10.1, P < 0.002; Figure 2.2)
and decreased with harvest date (F1,84 > 3.9, P < 0.05). Density was included in the best
model and in one of the 2 best alternative models. Peroneus mass was 3% lower at high density than at low density for all ages (F1,83 = 4.0, P = 0.05; Figure 2.2). The two-way
interaction density X age appeared in the second alternative model, but the parameter was
not significant (F1,82 = 0.5, P = 0.5; Table 2.5). For females, all models included age,
reproductive state and the two-way interaction between density and age2 (Table 2.5). The peroneus mass increased with age (F1,67 > 47.0, P ≤ 0.001; Figure 2.2) and was lower for
lactating females than for non-lactating ones (F1,66 > 9.3, P < 0.003). The mass of the
peroneus for females aged 1.5-year-old and ≥ 8.5-years-old was similar at both densities (F1,67 1.5, P 0.2), but was 8% lower at high density for females aged between 2.5 and
32
Table 2.5. Factors contributing to the variation in peroneus mass of moose (males: n = 89; females: n = 74) in two wildlife reserves from Eastern Québec, Canada, with contrasted the moose density in 2009. Alternative general linear models combining the variables denoted by X were compared using Akaike information criterion with a correction for finite sample sizes (AICc). Age, age2, harvest date, year and reproductive state for females were included as covariates. Models with ∆AICc ≤ 2 are shown and the best models are in bold. Parameters with an asterisk (*) are statistically different from 0 ( = 0.05).
Density Age Age2 Harvest date Reproductive state
Density X
Age
Density X
Age2 AICc ∆AICc
Males M1 X* X* X* X* - 999.1 0.0 M2 X* X* X* - 1001.0 1.9 M3 X* X* X* X* - X 1001.0 1.9 Females F1 X* X* X X* X* 831.8 0.0 F2 X* X* X* X X* X* 832.1 0.3
33 Figure 2.2. Peroneus mass of moose (males: n = 89; females: n = 74) in relation with age, sex and density in two wildlife reserves from eastern Québec, Canada, with contrasted population density in 2009. Symbols represent the mean peroneus mass ± 95% confidence intervals estimated from the best general linear models. Significant differences between densities are indicated with an asterisk (*).A small offset was added to values on the x-axes to improve readability.
Variation in the dressed body mass of males was best explained by models including age, age2 and harvest date (Table 2.6). Males dressed body mass increased non-linearly with age (1.5-y-old = 230 kg ± 14, 4.5-y-old = 339 kg ± 8, 7.5-y-old = 389 kg ± 12; Age: F1,114 >
129.2, P ≤ 0.001; Age2: F1,115 > 17.5, P ≤ 0.001) and decreased with harvest date (F1,115 >
6.9, P < 0.01). Density and the two-way interaction density X age occurred respectively in
four and two of the five best alternative models, but their parameters were not significant (density: F1,115 < 1.4, P > 0.2; density X age: F1,115 < 1.8, P > 0.2). For females, the best
model and all alternative models of the variation in dressed body mass included age, age2 and reproductive state (Table 2.6). Females dressed body mass increased with age until
7.5-34
years-old and decreased thereafter (1.5-y-old = 206 kg ± 10, 7.5-y-old = 297 kg ± 13, 10.5-y-old = 241 ± 43; Age: F1,153 > 172.6, P ≤ 0.001; Age2: F1,154 > 37.5, P ≤ 0.001). Lactating
females had a lower dressed body mass than non-lactating females (F1,154 > 16.0, P ≤
35
Table 2.6. Factors contributing to the variation in the dressed body mass of moose (males = 235; females = 158) in two wildlife reserves from eastern Québec, Canada, with contrasted moose density in 2009-10. Alternative general linear models combining the variables denoted by X were compared using the Akaike information criterion with a correction for finite sample sizes (AICc). Age, age2, harvest date, year and reproductive state for females were included as covariates. Models with ∆AICc ≤ 2 are shown and the best models are in bold. Parameters with an asterisk (*) are statistically different from 0 ( = 0.05).
Density Age Age2 Harvest date Year Reproductive state
Density X
Age AICc ∆AICc
Males M1 X* X* X* - 1189.1 0.0 M2 X* X* X* X - 1189.4 0.3 M3 X X* X* X* - 1190.1 0.9 M4 X X* X* X* X - 1190.2 1.1 M5 X X* X* X* - X 1190.4 1.3 M6 X X* X* X* X - X 1191.0 1.9 Females F1 X* X* X* 1496.7 0.0 F2 X* X* X X* 1498.5 1.8
36
2.4.3 Female Fertility
The single best model (AICc = 101.3) of the variation in adult ovulation rate included density (Z1,17 = -2.0, P = 0.05) as well as the linear and quadratic effects of age (Age: Z1,17
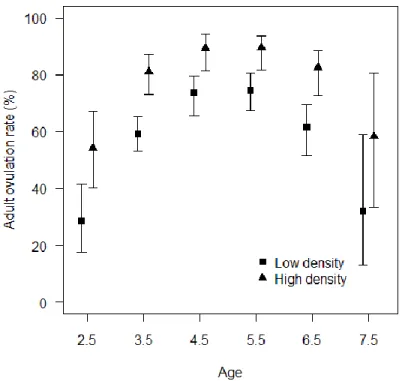
= 2.1, P = 0.04; Age2: Z1,17 < -2.9, P = 0.004). The ovulation rate of adult females was 15%
higher at high density (n = 36) than at low density (n = 44; Figure 2.3). The single best model (AICc = 18.2) for 1.5-year-old females (n = 10 and 8 for higher and lower density, respectively) was the null model. At higher density, only 1 out of 20 ovulating adult females had 2 ovulations (5%) while it reached 33% at lower density (n = 21).
Figure 2.3. Ovulation rate of adult moose females (n = 80) as a function of age and density in two wildlife reserves from eastern Québec, Canada, with contrasted population density average over 2008, 2009 and 2010. Symbols represent the ovulation rate ± 95% confidence intervals estimated from the best models. A small offset was added to values on the x-axes to improve readability.
37
2.5 Discussion
The comparison of body condition from moose killed by sport hunters on two adjacent wildlife reserves with contrasted densities revealed lower fat reserves and muscular mass at higher density, supporting the hypothesis of a density-dependant decline in body condition. This is in accordance with the observation of negative impact of heavy browsing pressure on forest regeneration. The diminution in body condition led to a reduction of double ovulations but an increase in the overall ovulation rate at high density. Reproductive strategies thus appear to diverge; under competition for resources at high density, females conserve energy by reducing litter size at ovulation to increase the probability of reproducing during most years (Simard et al. 2008). Our results support Saether et al. (1996) and Simard et al. (2008), suggesting that in absence of predation, an equilibrium with forage is unlikely for large herbivores.
2.5.1 Forage Availability
The largest effect of the high abundance of moose on woody plants was a higher browsing rate of regenerating balsam fir at high density than at low density (71% vs. 1%). Balsam fir makes up a high proportion of the moose winter diet in northeastern North America (Crête and Jordan 1982, Routledge and Roese 2004). Selective browsing of large herbivores can reduce the number of trees. For example, white-tailed deer browsing on Anticosti Island was the main cause of mortality of regenerating balsam fir (Tremblay et al. 2007). In Gros Morne National Park (3 moose/km2), Newfoundland, moose browsing on balsam fir accounted for the removal of > 92% of apical stems (Gosse et al. 2011). Despite the abundance of balsam fir at high density is half the estimation at low density, we did not detect a difference due to the small sampling effort and the high variability in our data. Lambert et al. (in prep.) observed 66% less balsam fir saplings and half the browsing rate at high moose density compared to lower density in the same region.
38
The strong preference of moose for paper birch (Bergerud and Manuel 1968) might explain the high browsing rate (> 66%) and the low sapling density (< 1,433/ha) observed for this species at both moose densities. A density of 1.1 moose/km2 in the low density area is not that low compared to moose densities elsewhere in North America that are typically < 0.6 moose/km2 (Karns 1998), and thus paper birch may be impacted by moose browsing even in our low density area. In the absence of moose browsing, a regenerating second growth stand in the eastern balsam fir-paper birch bioclimatic subdomain usually contains about 25,000 stems/ha (Déry 1995). Yet, birch is relatively tolerant to browsing due to its undefined growth (Lehtilä et al. 2000) and this might contribute to explain why we found no change in stem density and height at both densities.
We cannot exclude potential differences in the productivity of the habitat among the two wildlife reserves. The lower density Chic-Chocs Reserve is in average 100 m higher in altitude than the higher density Matane Reserve (Table 2.1) and the stocking of deciduous trees tend to be less abundant in the former. However, if such variation in productivity occurs, it would only make our conclusions more conservatives as the lower density area would also be the less productive leading to higher competition for limited forage.
2.5.2 Body Condition
Despite negative impacts on food resources, we did not observe a decrease in the body size of moose at higher density. Changes in foot length or skeletal growth are a slow process that may result from long-term local adaptations (Klein et al. 1987, Simard et al. 2008). According to Klein (1964), the skeleton has a higher growth priority than muscles and fat tissue and is therefore less affected by nutritional deficiencies. Furthermore, skeletal growth of ungulates occurs mostly during the year of birth and is thus highly influenced by maternal care (Solberg et al. 2007, Monteith et al. 2009). Maternal effects may reflect environmental and density-dependent conditions encountered by the mother that can induce time lags in the response to habitat deterioration (Couturier et al. 2009b, Rodriguez-Hidalgo et al. 2010). High densities of moose in eastern Québec are relatively recent;