THESE
Présentée àL’UNIVERSITE DE POITIERS
ECOLE SUPERIEURE D’INGENIEURS DE POITIERSECOLE DOCTORALE : INGENIERIE, CHIMIQUE, BIOLOGIQUE ET GEOLOGIQUE Pour l’obtention du grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(Diplôme National – Arrêté du 7 août 2006)Spécialité : Chimie et Microbiologie de l’Eau
ParFadi AL MARDINI
Master en Chimie et Microbiologie de l’Eau ________________________
Etude de l’adsorption du pesticide Bromacil sur charbon
actif en poudre en milieu aqueux
Effet compétiteur des matières organiques naturelles
________________________Soutenue le 16 septembre 2008, devant la commission d’examen :
Rapporteurs
M. Pierre LE CLOIREC
(Prof., UMR 6226, Laboratoire des Sciences Chimique de Rennes – ENSCR – Université de Rennes)
M. Emmanuel NAFFRECHOUX
(Prof., Laboratoire de Chimie Moléculaire et Environnement – ESIGEC – Université de Savoie)
Examinateurs
M. Joseph DE LAAT
(Prof., UMR 6008, Laboratoire de Chimie et Microbiologie de l’Eau – ESIP – Université de Poitiers)
M. Michel BAUDU
(Prof., UPRES 1068, Laboratoire des Sciences des Eaux et de l’Environnement –Université de Limoges)
RESUME
L’objectif de ce doctorat était de réaliser une étude détaillée des phénomènes d’adsorption du Bromacil (herbicide) sur un charbon actif en poudre, CAP SA-UF, à pH 7,8 et à 20 °C. L’application de plusieurs modèles d’isotherme d’équilibre mono-soluté a globalement montré que l’adsorption du Bromacil se fait sur deux types de sites. Les travaux sur la cinétique d’adsorption ont montré qu’il n’est pas possible de préciser a priori si la diffusion ou la réaction de surface est cinétiquement déterminante. Le modèle de réaction de surface du pseudo-second ordre s’applique particulièrement bien et conduit à des valeurs de constantes indépendantes de la concentration à l’équilibre, sauf pour les faibles concentrations à l’équilibre où les constantes deviennent significativement plus importantes. Cette observation d’ordre cinétique confirme parfaitement l’hypothèse de deux types de sites. Dans la dernière partie du travail, nous avons montré que les isothermes d’adsorption de quatre types de matières organiques naturelles sur le charbon étudié, présentent des allures particulières qui peuvent être interprétées par la présence de plusieurs fractions fictives (exploitables par le modèle IAST). Le mécanisme d’adsorption compétitive due aux fractions fortement adsorbables avec un effet sur les paramètres de l’isotherme d’adsorption est apparemment le mécanisme prépondérant dans notre cas.
ABSTRACT
The aim of this doctorate was to conduct a detailed study of the adsorption of Bromacil (herbicide) on a powdered activated carbon, PAC SA-UF, at pH 7.8 and at 20 °C. The application of several models of mono-solute equilibrium isotherm has generally shown that the adsorption of Bromacil is on two types of sites. Works on the kinetics adsorption have shown that it is not possible to specify apparently if the surface reaction is kinetically determinative. The model of pseudo-second order of the surface reaction applies particularly well and led to constant values independent of the equilibrium concentration, except for low equilibrium concentrations where the constants become significantly more important. This confirms perfectly the hypothesis based on two types of sites. In the last part, we showed that the adsorption isotherms of some natural organic matters on PAC have special shapes that may be interpreted by the presence of several fictitious fractions. The competitive adsorption due to fractions strongly adsorbable with an effect on the equilibrium parameters is apparently the predominant mechanism in our case.
Mots clés : Adsorption, Milieu aqueux, Charbon actif en poudre, Bromacil, Equilibre d’adsorption, Cinétique d’adsorption, Matières organiques naturelles, Compétition. Keywords: Adsorption, water, powdered activated carbon, Bromacil, Adsorption equilibrium, Adsorption kinetic, natural organic matter, competition.
REMERCIEMENTS
Cette étude a été réalisée au Laboratoire de Chimie et Microbiologie de l’Eau (CNRS UMR 6008) de l’Ecole Supérieur d’Ingénieur de Poitiers, avec le soutien financier de l’Université de Damas dans le cadre de l’accord Franco-Syrien.
Ce travail a été mené sous la direction de Monsieur le Professeur Bernard LEGUBE, Directeur du LCME, Directeur de l’ESIP et Directeur de ma thèse. Je tiens à lui exprimer mes grands remerciements et ma profonde reconnaissance pour m’avoir accueilli au sein de son laboratoire, pour son aide qui m’a permis de mener à bien ce travail et pour m’avoir donné l’opportunité d’étudier un tel procédé.
Je remercie Monsieur le Professeur Michel BAUDU, Directeur du Laboratoire des Sciences des Eaux et de l’Environnement (Université de Limoges) de l’honneur qu’il me fait en présidant le jury de thèse et en étant examinateur de ce mémoire.
Je tiens à remercier beaucoup Monsieur le Professeur Pierre LE CLOIREC, Directeur de l’Ecole Nationale Supérieure de Chimie de Rennes et du Laboratoire des Sciences Chimique de Rennes (Université de Rennes) et Monsieur le Professeur Emmanuel NAFFRECHOUX, Professeur au Laboratoire de Chimie Moléculaire et Environnement à l’ESIGEC (Université de Savoie), d’avoir accepté de juger ce travail et d’être rapporteurs de ce mémoire.
Mes remerciements s’adressent également à Monsieur le Professeur Joseph DE LAAT, Professeur au Laboratoire de Chimie et Microbiologie de l’Eau de l’ESIP (Université de Poitiers), d’avoir accepté d’examiner ce mémoire.
Je tiens à remercier également l’Université de Damas en Syrie pour le soutien financier toute la durée de l’étude de Master et de Doctorat en France. Je remercie particulièrement Madame la Professeur Malak AL JOUBEH, Présidente du département de Chimie à la faculté des Sciences (Université de Damas) pour son encadrement et son soutien.
Je remercie également l’ensemble du personnel du laboratoire, Professeurs, Maîtres de Conférences et Ingénieurs de Recherche, particulièrement Monsieur Bernard PARINET, Madame Florence BERNE et Monsieur Bertrand GOMBERT pour leur aide et leur conseil. Je tiens à remercier enfin tout le personnel administratif du laboratoire, de l’APTEN, de l’ESIP et de la bibliothèque des sciences, particulièrement Madame Laurence FUMERON, ainsi que Madame Nathalie LEBAULT et Madame Anne BRUNULLIERE, ainsi que les techniciens du laboratoire et de l’ESIP pour leur aide et en particulier Monsieur François MASSARO.
Un grand merci à tous mes collègues du laboratoire qui m’ont accompagné au long de ces quatre années de thèse dans une joie et une bonne humeur de tous les jours.
Je ne peux pas finir sans remercier mon père, ma mère et ma soeur et qui m’ont permis d’avoir la chance d’arriver jusqu’à là.
SOMMAIRE
Pages SYMBOLES
LISTE DES FIGURES LISTE DES TABLEAUX
INTRODUCTION GENERALE.... 19
CHAPITRE A : PARTIE BIBLIOGRAPHIE...22
I. L’équilibre adsorption/désorption...23
I.1. Approche thermodynamique... ..23
I.2. Approche expérimentale (isotherme de soprtion)...25
I.3. Modélisation des isothermes d’équilibre mono-soluté...26
I.3.1.Modèles mono-soluté à deux paramètres... ...27
I.3.2. Modèles mono-soluté à trois paramètres...30
I.3.3. Modèles mono-soluté à plus de trois paramètres... ...30
I.4. Modélisation des isothermes d’équilibre multi-solutés....38
I.4.1. Modèles mono-soluté étendus en modèles multi-solutés...38
I.4.2. Modèles pour l’adsorption compétitive...39
II . La cinetique adsorption/désorption...43
II.1. Introduction...43
II.2. Approche théorique et cinéthique globale ...43
II.2.1. Réaction globale ... ...43
II.2.2. Modèles cinétiques globaux...44
II.3. Etape dite « diffusion externe »...45
II.4. Etape dire « diffusion intra-particulaire »...46
II.4.1. Bases du modèle de WEBER et MORRIS...46
II.4.2. Expressions simpliffiées...48
II.5. Etape dire « réaction de surface » ...48
II.5.1. Expression de pseudo premier-ordre...48
II.5.2. Expression de pseudo second-ordre...49
II.5.3. Expression de nème ordre ...49
III . Le charbon actif ...56
III.1. Généralité sur le charbon actif ... . 56
III.2
.
Caractéristiques générales de CAP NORIT SA-UF étudié...56IV.L’herbicide bromacil et l’adsorption des pesticides derives de l’uraciel ...58
IIV.1. Introduction ...58
IIV.2. Adsorption des uraciles...58
V. Adsoprtion des matières organiquenaturelles sur charbon actif ...60
V.1. Introduction ...60
V.2. Adsorption des matières organiques naturelles (MON)...60
V.2.1. Equilibre d’adsorption des MON sur charbon actif...60
V.2.2. Cinétique d’adsorption des MON sur charbon actif ...62
V.2.3. Effet inhibiteur des MON sur l’adsorption de composé cible sur chartbon actif...63
CHAPITRE B : MATERIELS ET METHODES...64
I. Protocole expérimental général...65
I.1. Isotherme et cinétique en réacteur agité de laboratoire...65
I.1.1. Isothermes et cinétiques pour les « fortes concentrations » en Bromacil...65
I.1.2. Isothermes et cinétiques pour les très faibles concentrations en Bromacil...66
I.1.3. Isothermes et cinétiques d’adsorption des MON...66
I.2. Isothermes et cinétiques en réacteur avec mico-filtration incorporée...67
I.2.1. Réacteur avec micor-filtration incoporée ...67
I.2.2. Isothermes et cinétiques pour concentrations « moyennes » en Bromacil...69
I.2.3. Nettoyage des membranes...69
II. Réactif...70
II.1. Réactifs chimiques commerciaux...70
II.1.1.Bromacil………...70
II.1.2.Orthophosphates………...70
II.2. Matières organiques naturelles………...70
II.3. Eau naturelle………...71
II.4. Eau adoucie………...72
III. Méthodes analytiques...73
III.1 Dosage du Bromacil...73
III.1.1 Préambule...73
III.1.2. Pré-traitement de l'échantillon (pré-concentration)... ...73
III.2.1. SpectroscopieUV...75
III.2.2. pH métrie...75
III. 2.3. Dosage du carbone organique dissous (COD)...75
III.2.4. Analyse de l'azote total...78
CHAPITRE C : RESULTATS ET DISSCUSION...79
I. L’équilibre d'adsorption du Bromacil en eau pure ...80
I.1. Introduction... 80
I.2. Isotherme de sorption du Bromacil ...80
I.3. Modélisation par les modèles mono-soluté à deux paramètres...84
I.3.1. Modèle de FREUNDLICH...84
I.3.2. Modèle de LANGMUIR...86
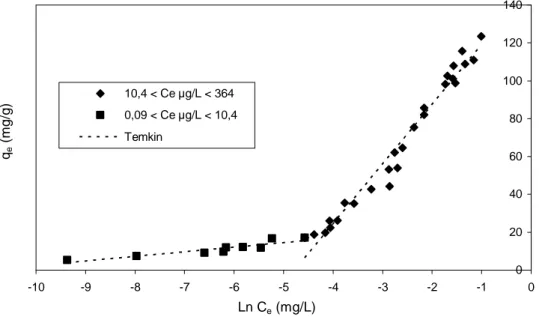
I.3.3. Modèle de TEMKIN...88
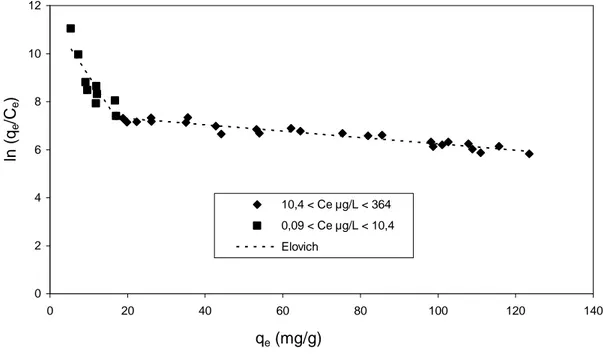
I.3.4. Modèle de ELOVICH...90
I.3.5. Modèle de DBININ-RADUSHKEVICH...92
I.3.6. Disscusion sur l'applicabilité des modèles (mono-soluté) à 2 paramètres...93
I.4. Modélisation par les modèles mono-soluté à trois paramètres...96
I.4.1. Résultats des régressions non linéaire...96
I.4.2. Résultats des régression linéaire ...102
I.5. Modèlisation par le modèle (mono-soluté) à quatre paramètres de langmuir-2 sites...110
I.6.Conclusion...110
II. Cinétiques d'adsorption du Bromacil en eau pure ...112
II.1. Introduction ...112
II.2. Exemple de résultats expérimentaux et l'applicabilié des modèles...112
II.3. Application des modèles de diffusion externe ...114
II.4. Application des modèles de diffusion intra-particulaire...114
II.4.1. Approche simplifiée...114
II.4.2. Modèles avec diffusivité ...116
II.5. Application des modèles de réaction de surface...123
II.5.1. Modèle de pseudo premier ordre ...123
II.5.2. Modèles de pseudo second ordre...123
II.5.3. Modèle de second ordre global...126
II.6. Impact de l'ordre de grandeur de la concentration initiale (C0) ou à l'équilibre (Ce) sur les valeur des paramètres cinétiques ...128
II.6.1. Modèles de diffusion intra-particulaire...128
II.6.2. Approche HSDM...134
II.6.3. Modèles de réaction de surface...136
III. Adsorption des matières organiques naturelles et effet de compétition sur l'adsoprtion du bromacil sur charbon actif
...142
III.1. Introduction ...142
III.2. Equilibre de sorption des MON sur le CAP SA-UF...142
III.2.1. Isotherme de sorption...144
III.2.2. Application des modèles de mon-osoluté, à deux paramètres...144
III.2.3. Application du modèle de IAST...151
III.2.4. Disscusion... 152
III.3.Cinétique de sorption des MON sur le CAP SA-UF...156
III.3.1. Application des modèles de diffusion ...156
III.3.2. Modèles de réaction de surface...158
III.3.3. Conclusion sur la cinétique d'adsorption des MON...159
III.4. Effet inhibiteur des MONsur l'adsorption du Bromacil ...160
III.4.1. Effet de la présence de AHA sur l'adsorption du Bromacil...160
III.4.2. Effet de la présence des MON sur l'adsorption du Bromacil...166
III.4.3. Disscusion sur l'effet inhibiteur des MON ...170
III.5. Conclusion...171
CONCLUSION GENERALE... 172
REFERENCE BIBLIOGRAPHIQUE...175
ANNEXES DE LA THESE...184
ANNEXE A : BIBLIOGRAPHIE...185
A-1. Modèle cinétique HSDM...186
A-2. Le charbon actif...188
A-2.1-Origine et fabrication du charbon actif...188
A-2.2- Structure du charbon actif...188
A-2.3- Texture du charbon actif...189
A-2.4- Surface spécifique d'un adsorbant...190
A-2.5- Propriétés superficielles du charbon actif...191
A-2.6- Facteur influençant l'équilibre d'adsorption...192
A-3. L'herbicide Bromacil...194
A-3.1- Introduction ...194
A-3.2- Caractéristiques physico-chimiques...194
A-3.3- Toxicologie...195
A-4.2- Extraction, "purification"et classification des MON aquatiques...200
A-4.3- Caractérisation des MON aquatiques...202
A-4.4- Acide humique "Aldrich"...203
ANNEXE B : MATERIEL & METHODES...204
B-1. Stabilité de la température de l'unité de micro-filtration...205
B-2. Rétrolavage et nettoyage de la membrane de l'unité de micro-filtration et adsorption par la membrane...206
B-2.1- Simple rétrolavage...206
B-2.2- Nettoyage spécifique en présence de MON...207
B-3. Hydrolyse du Bromacil...209
B-4. Protocole d'extraction du Bromacil pour analyse des faibles concentrations... 210
B-4.1- Généralités sur l'extraction liquide-solide...210
B-4.2- Utilisation de l'extraction liquide-solide pour la quantiification du bromacil...210
ANNEXE C : RESULTATS & DISCUSSION...212
C-1. Bromacil / CAP SA-UF : modèles cinétiques de diffusion externe...213
C-2. Bromacil / CAP SA-UF : modèles cinétiques de diffusion intra-particulaire...218
C-3. Bromacil / CAP SA-UF : modèles cinétiques de réaction de surface...218
C-4. Intégration du modèle cinétique de Langmuir, selon AZIZIAN (2004)...221
C-4.1-Bases de la démonstration de AZIZIAN ... 221
C-4.2- Correspondance avec le modèle de pseudo-premier ordre...221
C-4.3- Correspondance avec le modèle de pseudo second ordre...221
C-5. Rétention de COD par les membranes de filtration...223
C-6. MON/CAP SA-UF : isotherme mono-soluté à 2 paramètres...224
C-7. MON/ CAP SA-UF : Méthode de calcul IAST ...228
C-7.1- Objectif du calcul...228
C-7.2- Observations expérimentales et détermination des différentes fractions...228
C-7.3- Méthodes de calcul IAST utilisées dans la littérature...229
C-7.4- Méthode de calcul utilisée dans ce travail...230
C-8. MON/CAP SA-UF : Cinétiques d’adsorption ...232
C-9. Bromacil + MON/ CAP SA UF : Cinétiques d’adsorption...235
REFERENCE BIBLIOGRAPHIQUE DES ANNEXES...238
Symboles
a aire de l’interface solide/liquide
A0, A1, A2, … paramètres qui décrivent la solution mathématique (modèle HSDM) AHA acide humique Aldrich
BT = qmRT/∆Q dans isotherme de Temkin
Ce concentration du soluté à l’équilibre dans la phase aqueuse (mg.L -1
, µg.L-1) CeB concentration à l’équilibre en Bromacil (modèle IAST) (mg.L
-1
, µg.L-1) CeM concentration à l’équilibre en MON (modèle IAST) (mg.L
-1 COD)
Cs solubilité du soluté (mg.L
-1 ) Ct concentration en soluté à chaque temps t dans la phase aqueuse (mg.L
-1 )
C0 concentration initiale en soluté (mg.L
-1
, µg.L-1) C0B concentration initiale en Bromacil (modèle IAST) (mg.L
-1
, µg.L-1) C0M concentration initiale en MON (modèle IAST) (mg.L-1 COD) C* C* = (Ct – Ce)/ (C0 – Ce) (modèle HSDM) (sans dimension) COD et COT Carbone organique dissous et carbone organique total (mg.L-1)
D ou D0 diffusivité ou coefficient de diffusion effective (m 2
.s-1) Ds diffusivité de surface ou coefficient de diffusion de surface (m2.s-1) Ft = qt/qe avancement de la réaction (sans unité) HPLC chromatographie liquide haute performance
HPO fraction hydrophobe des MON (substances humiques)
kads constante de vitesse d’adsorption (dépend du modèle)
kdés constante de vitesse de désorption (dépend du modèle)
kf coefficient de transfert externe (Furusawa et Smith) (en m.min -1
) kV constante de diffusion intra-particulaire (Vermeulen) (en min-1) kW constante de diffusion intra-particulaire (Weber et Morris) (en m.L
-1
.min-0,5) k1app constante de vitesse de pseudo premier ordre (min
-1 ) k2app constante de vitesse de pseudo second ordre (L.mg
-1 .min-1) k2 constante de vitesse de second ordre global (L.mg-1.min-1)
Kd = qe/Ce coefficient de distribution (L.g
-1 )
KE constante de Elovich (en L.mg
-1 ) KF constante de Freundlich, relative à la capacité d’adsorption (mg
(1-n)
.Ln.g-1) KL constante d’équilibre de Langmuir et constante d’équilibre
K0F,i coefficient de l’isotherme (mono-soluté) de Freundlich (qe = KF.Ce
n
) de l’espèce i, à utiliser pour les modèles multi-solutés K0L,i constante d’équilibre de Langmuir mono-soluté de l’espèce i,
à utiliser pour les modèles multi-solutés
m masse de CAP (g, mg)
ms = m/V concentration en solide adsorbant (g.L
-1 ) MON matières organiques naturelles
n constante de Freundlich, relative à l’intensité de l’adsorption (sans unité) n0i coefficient de l’isotherme (mono-soluté) de Freundlich (qe = KF.Ce
n
) de l’espèce i, à utiliser pour les modèles multi-solutés
qe quantité de soluté retenue à l’équilibre par le solide (mg.g -1
) qeB quantité de Bromacil retenue à l’équilibre par le solide (mg.g
-1 ) qeM quantité de MON (COD) retenue à l’équilibre par le solide (mg.g
-1 ) qm quantité maximum de soluté retenue à l’équilibre par le solide
(en monocouche pour Langmuir) (mg.g-1)
qmDR capacité maximum d’adsorption dans les micropores (mg.g -1
)
q0m,i paramètre de l’isotherme mono-soluté de Langmuir de l’espèce i, à utiliser pour les modèles multi-solutés
qt concentration en soluté à chaque temps t sur le solide (mg.g -1
)
Ra ou R rayon du solide adsorbant (m)
RL = 1/(1+KLC0) (sans unité)
Série X correspond à une numérotation d’expérimentation de type équilibre SS aire spécifique de l’adsorbant (Furusawa et Smith) (en m
2 /m3) t* t* = t.Ds/R
2
(modèle HSDM) (sans dimension)
T température absolue (en K)
TPH fraction transphilique des MON (subastnaces non humiques) vC vitesse de diminution de Ct
vq vitesse d’augmentation de qt
V volume de solution (L)
β constante reliée à l’énergie d’adsorption par E = 1/(β)0,5
∆Q variation d’énergie d’adsorption (en J.mol-1)
ε potentiel de Polanyi = RT Ln (Cs/Ce) γi = 1/ni ni de l’isotherme de Freundlich (qe = KF.Ce
n )
θ taux de recouvrement (sans unité)
LISTE DES FIGURES
Figure A-1 : Les quatre types d’isotherme...24
Figure A-2 : Etape de transfert de masse pour l'adsorption sur charbon actif...42
Figure A-3 : Mécanismes et hypothèses incorporés dans le modèle HSDM ...51
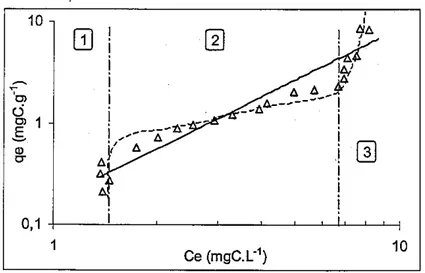
Figure A-4 : Isotherme de Freundlich montrant les trois zones correspondant aux fractions fictives...61
Figure A-5 : Modèle de diffusion intra-particulaire appliqué à l’adsorption d’acides humiques dérivés de la lignite sur CAP ...61
Figure B-1 : Schéma du réacteur CAP/MF ......68
Figure B-2 : Exemple de courbe d’étalonnage du Bromacil dans l’eau ultra pure pour la gamme de fortes concentrations (25 < C0 µg/L < 500)...74
Figure B-3 : Exemple d’une courbe d’étalonnage du Bromacil dans un mélange EUP/MeOH pour la gamme des faibles concentrations (1 < C0 µg/L <10)...74
Figure B-4 : Exemple d’une courbe d’étalonnage du Bromacil dans un mélange EUP/MeOH pour la gamme des très faibles concentrations (0,1< C0 µg/L <1)...76
Figure B-5 : Exemple d’une courbe d’étalonnage du Bromacil dans l’eau naturelle « Le Clain » pour la gamme des faibles concentrations (1< C0 µg/L <10)...76
Figure B-6 : Exemple d’une courbe d’étalonnage du Bromacil dans 3 types d’eaux pour la gamme des faibles concentrations (1< C0 µg/L < 7 )...77
Figure C-1 : Isotherme de l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms de 0,1 à 5 mg/L)...82
Figure C-2 : Isotherme de Freundlich de l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms de 0,1 à 5 mg/L)...84
Figure C-3 : Isotherme de Langmuir 1 de l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms de 0,1 à 5 mg/L)…...86
Figure C-4 : Isotherme de Langmuir 2 de l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms de 0,1 à 5 mg/L)...87
Figure C-5 : Isotherme de Temkin de l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms de 0,1 à 5 mg/L)...90
Figure C-6 : Isotherme de Elovich de l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms de 0,1 à 5 mg/L)...92
Figure C-7 : Isotherme de DUBININ-RADESHKEVICH de l’adsorption du Bromacil dans l’eau pure tamponnée pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms de 0,1 à 5 mg/L)...92
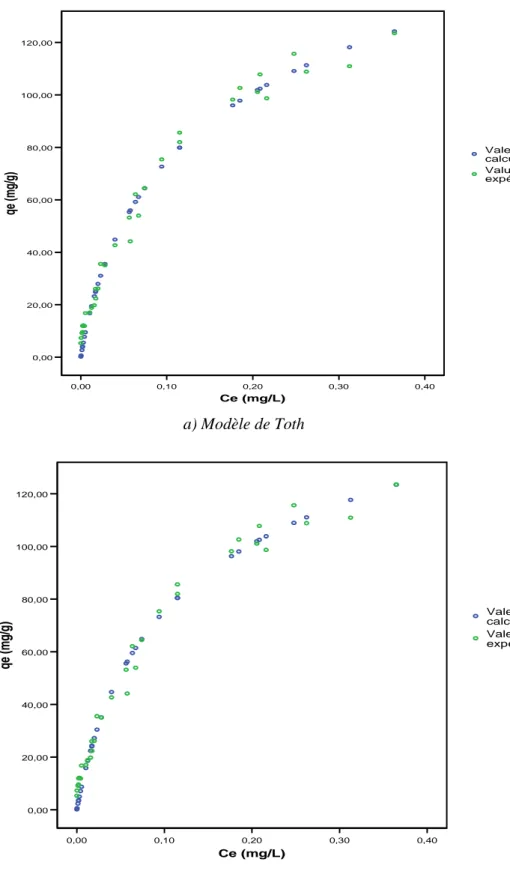
Figure C-8 : Adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms de 0,1 à 5 mg/L) - Isotherme expérimentale qe vs Ce (Fig. C-1) et valeurs prédites par le modèle de Tόth (a) et le modèle de Radke-Prausnitz I (b)…...100
Figure C-9 : Formes linéaires (avec recherche de « n ») des isothermes de REDLICH-PETERSON, avec paramètres de Langmuir II (Figure C-9a) et de REDLICH-PETERSON avec paramètres de Langmuir I (FigureC-9b) de l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms de 0,1 à 5 mg/L)...101
Figure C-10: Formes linéaires (avec recherche de « n ») des isothermes de REDLICH-PETERSON, RADKE-PRAUSNITZ (II et III) et FRITZ-SCHLUENDER (Figure C-10a) et de
Figure C-11: Formes linéaires (avec « n » imposé) des isothermes de TOTH, RADKE-
PRAUSNITZ (I, II et III) et FRITZ-SCHLUENDER de l’adsorption du Bromacil
dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms
de 0,1 à 5 mg/L)...105
Figure C-12 : Application de l’isotherme de LANGMUIR – 2 SITES à l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (C0 de 5 à 482 µg/L et ms de 0,1 à 5 mg/L)...111
Figure C-13 : Exemples de courbes d’évolution de la concentration en Bromacil pour l’adsorption sur CAP SA-UF en eau pure à pH 7,8...113
Figure C-14 : Exemple d’application des modèles de diffusion externe pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (# 5 ; 0 <Ft< ~0,9)...115
Figure C-15 : Exemple d’application du modèle simplifié de diffusion intra-particulaire pour le Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (# 5, tous points).. ...117
Figure C-16 : Exemple d’application du modèle simplifié de diffusion intra-particulaire pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (# 5 ; 0< F t <0,7)...117
Figure C-17 : Exemple d’application du modèle de diffusion intra-particulaire de VERMEULEN pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (# 5 ; 0 <Ft<0,8-0,9)...119
Figure C-18 : Exemple d’application des approches développéesde diffusion intra-particulaire (équation XIII) pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (# 5 : tous les points ; KL-Tόth = 1089 ; nTόth = 0,82)...121
Figure C-19 : Exemple d’application des approches développées de diffusion intra-particulaire (équation XIII) pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (# 5 : 0 <Ft< 0,91 ; KL-Tόth = 1089 ; nTόth = 0,82)...121
Figure C-20 : Exemple d’application du modèle HSDM (équation XXX) pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (# 5 : 0 <Ft< 0,91 ; nFreundlich = 0,2)...122
Figure C-21 : Exemple d’application du modèle de pseudo premier ordre pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (# 5 ; 0<Ft<0,85)...122
Figure C-22 : Application du modèle de pseudo-second ordre (équation XXI) pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (# 5)...125
Figure C-23 : Application du modèle de second ordre global pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF (# 5)………...127
Figure C-24 : Evolution des valeurs de diffusivité D (équation IX) et D0 (équation XIII) en fonction du rapport (C0 - Ce)/C0 (Expérimentations # 1 à 21 et # 24)...132
Figure C-25 : Evolution des valeurs du coefficient de diffusion de surface Ds (équation XXX) en fonction du rapport de Ce et C0 pour nFreundlich = 0,5 (Expérimentations # 5, 8, 9, 10, 13, 14, 19 et 23)...134
Figure C-26 : Evolution du rapport k2app/ms en fonction de Ce (Expérimentations # 1 à 29)...136
Figure C-27 : Evolution du rapport k2 (équation XXVII) en fonction de Ce (# 1 à 29)…………...136
Figure C-28 : Evolution du rapport kads en fonction de Ce (# 1 à 23)…………...140
Figure C-29 : Isotherme d’adsorption des MON dans l’eau pure tamponnée à pH (7,4 à 7,7) sur CAP SA-UF (C0 de 2,3 à 2,7 mg/L et ms de 1 à 150 ou 400 mg/L)...143
Figure C-30 : Exemple d’isotherme de FREUNDLICH d’adsorption de MON dans l’eau pure
tamponnée sur CAP SA-UF Cas de HPOVienne (C0 = 2,3 mg COD/L ; pH ~ 7,4 ; ms de
2,5 à 150 mg/L)...146
Figure C-31 : Exemple d’isotherme de LANGMUIR I d’adsorption de MON dans l’eau pure tamponnée sur CAP SA-UF Cas de HPOVienne (C0 = 2,3 mg COD/L ; pH ~ 7,4 ; ms de 2,5 à 150 mg/L)...146
Figure C-32 : Exemple d’isotherme de LANGMUIR II d’adsorption de MON dans l’eau pure tamponnée sur CAP SA-UF Cas de HPOVienne (C0 = 2,3 mg COD/L ; pH ~ 7,4 ; ms de 2,5 à 150 mg/L)...147
Figure C- 33 : Exemple d’isotherme de TEMKIN d’adsorption de MON dans l’eau pure tamponnée sur CAP SA-UF Cas de HPOVienne (C0 = 2,3 mg COD/L ; pH ~ 7,4 ; ms de 2,5 à 150 mg/L)...147
Figure C- 34 : Exemple d’isotherme de ELOVICH d’adsorption des MON dans l’eau pure tamponnée sur CAP SA-UF Cas de HPOVienne (C0 = 2,3 mg COD/L ; pH ~ 7,4 ; ms de 2,5 à 150 mg/L)...148
Figure C- 35 : Application du modèle IAST dans le cas de l’adsorption de HPOVienne sur le CAP SA- UF en eau pure tamponnée à pH 7,4...150
Figure C-36 : Calcul de l’isotherme d’adsorption de HPOCébron sur CAP SA-UF à partir des paramètres n0 et KF 0 du modèle IAST...153
Figure C- 37 : Exemple de l’évolution du COD en fonction du temps - Adsorption de AHA sur CAP SA-UF en eau pure à pH ~7,7 (# 30)...155
Figure C- 38 : Exemple d’application du modèle de diffusion externe classique pour l’adsorption de HPOCébron sur CAP SA-UF en eau pure à pH 7,4 (# 31)...155
Figure C- 39 : Exemple d’application des modèles de WEBER et MORRIS et de VERMEULEN pour l’adsorption de TPHVienne sur CAP SA-UF en eau pure à pH 7,5 (# 32)...157
Figure C- 40 : Exemple d’application du modèle de pseudo-second ordre (équation XXI) pour l’adsorption de HPOCébron dans l’eau pure tamponnée sur CAP SA-UF (# 31)...159
Figure C-41 : Exemples d’application d’isotherme mono-soluté à deux paramètres pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH ~ 7,7 sur CAP SA-UF, en présence d’acide humique Aldrich (2,3 à ~ 12,5 mg COD/L), à 20°C...161
Figure C- 42 : Exemple de cinétique d’adsorption du Bromacil (66,8 µg/L) à pH ~ 7,6 sur CAP SA- UF, en présence d’acide humique Aldrich (2,5 mg COD/L), à 20°C...163
Figure C- 43 : Exemples d’application d’isotherme mono-soluté à deux paramètres pour l’adsorption du Bromacil dans des eaux naturelles (ERA et ECF) ou dans des solutions tamponnées (pH 7,4 – 7,5) de MON aquatiques (HPOV et TPHV), sur CAP SA-UF, à 20°C...167
FIGURES DES ANNEXES Figure 1 : Représentation schématique de la structure cristalline du graphite (a) et de la structure "graphitique" d'un charbon actif (b)...189
Figure 2 : Représentation de la structure poreuse de charbon actif Extrait de THERMYA SA...190
Figure 3 : Représentation schématique de la surface interne et externe d’un charbon actif ...191
Figure 4 : Principaux groupements fonctionnels oxygénés de la surface du charbon actif...192 Figure 5 : Répartition des cultures en Martinique, carte fournie par le Conseil Général de la Martinique.197
Figure 7 : Montage d'extraction des MO par filtration sur résines XAD...201
Figure 8 : Principales caractéristiques des fractions HPO, TPH et HPI...202
Figure 9: Modèle structural des acides humiques...202
Figure 10 : Modèle structural des acides fulviques...203
Figure 11 : Exemple de l’évolution de la température en fonction du temps d’adsorption du Bromacil en en eau naturelle...205
Figure 12 : Exemple de suivi du débit du perméat avant et après un simple rétrolavage pour l’eau pure à Pm = 3,8 bar...206
Figure 13 : Effet des MON sur lé débit du perméat de l’unité de CAP/MF...207
Figure 14 : Suivi de l’absorbance à (λ=254 nm - b = 5 cm) d’une solution de 10 mg/L de AHA dans l’eau pure tamponnée à pH 7,6, dans le réacteur de l’unité de MF, en absence de CAP...208
Figure 15 : Test d'adsorbabilité du Bromacil sur la membrane minérale de MF (0,2 µm) en fonction en absence de CAP SA-UF, en eau pure tamponnée...208
Figure 16 : Hydrolyse d’adsorption du bromacil (3,43 mg/L) à pH 8 et 20 °C...209
Figure 17 : Protocole d'extraction liquide-solide...211
Figure 18 : Application des modèles de diffusion externe (modèle classique) pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF...213
Figure 19 : Application du modèle simplifié de diffusion intra-particulaire pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF...214
Figure 20 : Application du modèle de diffusion intra-particulaire de VERMEULEN pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF...215
Figure 21 : Application de l’approche développée de diffusion intra-particulaire (équation XIII) pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 surCAP SA-UF...216
Figure 22 : Quelques exemples d’application du modèle HSDM (équation XXX) pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF...217
Figure 23 : Application du modèle de pseudo premier ordre (LAGERGREN) pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF...218
Figure 24 : Application du modèle de pseudo-second ordre (équation XXI) pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF...219
Figure 25 : Application du modèle de second ordre global pour l’adsorption du Bromacil dans l’eau pure tamponnée à pH 7,8 sur CAP SA-UF...220
Figure 26 : Isotherme de FREUNDLICH de l’adsorption des MON dans l’eau pure tamponnée sur CAP SAUF...224
Figure 27 : Isotherme de TEMKIN de l’adsorption des MON dans l’eau pure tamponnée sur CAP SA-UF...225
Figure 28 : Isotherme de LANGMUIR I et II de l’adsorption des MON dans l’eau pure tamponnée sur CAP SA-UF...226
Figure 29 : Isotherme de ELOVICH de l’adsorption des MON dans l’eau pure tamponnée sur CAP SA-UF...227
Figure 30 : Application du modèle IAST dans le cas de l’adsorption de HPOVienne sur le CAP SA-UF en eau pure tamponnée à pH 7,4...229
Figure 32 : Evolution du COD en fonction du tempsAdsorption de HPOVienne sur CAP SA-UF en
eau pure à pH ~7,5, (# 33)...232
Figure 33 : Evolution du COD en fonction du tempsAdsorption de HPOCébron sur CAP SA-UF en
eau pure à pH ~7,4, (# 31)...233
Figure 34 : Application du modèle de pseudo-second ordre (équation XXI) pour l’adsorption de TPHVienne dans l’eau pure tamponnée sur CAP SA-UF (# 32) ...233
Figure 35 : Application du modèle de pseudo-second ordre (équation XXI) pour l’adsorption de
HPOVienne dans l’eau pure tamponnée sur CAP SA-UF (# 33)...234
Figure 36 : Application du modèle de pseudo-second ordre (équation XXI) pour l’adsorption de AHA
dans l’eau pure tamponnée sur CAP SA-UF (# 30)...234
Figure 37 : Cinétique d’adsorption du Bromacil à pH ~ 7,6 sur CAP SA-UF, en présence d’acide
humique Aldrich (2,5 mg COD/L), à 20°C...235
Figure 38 : Cinétique d’adsorption du Bromacil à pH ~ 7,6 sur CAP SA-UF, en présence d’acide
humique Aldrich (2,5 mg COD/L), à 20°C...236
Figure 39 : Cinétique d’adsorption du Bromacil à pH ~ 7,7 sur CAP SA-UF, en eau pure en présence
d’acide humique Aldrich (2,3 mg COD/L), à ~ 20°C...237
Figure 40 : Cinétique d’adsorption du Bromacil à pH ~ 7,6 sur CAP SA-UF, en eau du réseau
LISTE DES TABLEAUX
Tableau A-I : Principaux modèles d’équilibres « monosoluté »...35
Tableau A-II : Principaux modèles cinétiques ...54
Tableau A-III : Données bibliographiques sur le CAP SA-UF fabriqué en France (Le Blanc Mesnil)...56
Tableau A-IV : Autres données bibliographiques sur le CAP SA-UF...57
Tableau B-I : Paramètres débit/presson utilisés...69
Tableau B-II: Distribution moyenne des substances hydrophobes HPO et transphiliques TPH différentes de stations de prélèvement sur la rivière la Vienne...71
Tableau B-III :Analyse élémentaire des substances hydrophobes HPO et transphiliques TPH de différentes stations de prélèvement sur la rivière la Vienne...71
Tableau C-I : Conditions expérimentales des isothermes dans l’eau pure tamponnée...81
Tableau C-II : Paramètres de FREUNDLICH de l’adsorption du Bromacil en eau pure (pH 7,8) sur CAP SA-UF pour deux gammes de concentrations à l’équilibre..………...…....85
Tableau C-III : Paramètres de LANGMUIR de l’adsorption du Bromacil en eau pure (pH 7,8) sur CAP SA-UF pour deux gammes de concentrations à l’équilibre..………...…...88
Tableau C-IV : Paramètres de TEMKIN de l’adsorption du Bromacil en eau pure pH 7,8 sur CAP SA-UF pour deux gammes de concentrations àl’équilibre………...89
Tableau C-V : Paramètres de ELOVICH de l’adsorption du Bromacil en eau pure pH 7,8 sur CAP SA-UF pour deux gammes de concentrations àl’équilibre……...…...91
Tableau C-VI : Paramètres de DUBININ de l’adsorption du Bromacil en eau pure pH 7,8 sur CAP SA-UF pour deux gammes de concentrations àl’équilibre…….…...93
Tableau C-VII : Valeurs des paramètres d’isothermes d’adsorption à 2 paramètres du Bromacil en eau pure (pH 7,8) sur CAP SA-UF...95
Tableau C-VIII : Valeurs des paramètres d’isothermes d’adsorption à 3 paramètres du du Bromacil en eau pure (pH 7,8) sur CAP SA-UF...98
Tableau C-IX : Valeurs des paramètres d’isothermes d’adsorption à 3 paramètres du du Bromacil en eau pure (pH 7,8) sur CAP SA-UF avec n recherché...104
Tableau C-X : Valeurs des paramètres d’isothermes d’adsorption à 3 paramètres du du Bromacil en eau pure (pH 7,8) sur CAP SA-UF avec n imposé...108
Tableau C-XI : Bilan valeurs des paramètres d’isothermes d’adsorption à 3 paramètres du Bromacil en eau pure (pH 7,8) sur CAP SA-UF pour les meilleurs modèles à 3 paramètres ...109
Tableau C-XII : Conditions expérimentales des cinétiques dans l’eau pure tamponnée...112
Tableau C-XIII : Résultats d’application du modèle simplifiée Weber et Morris de diffusion intra-particulaire pour l'adsorption du Bromacil dans l'eau pure tamponnée à pH 7,8 sur CAP SA-UF...117
Tableau C-XIV : Résultats d’application des modèles complets de diffusion intraparticulaire de (équation XI et XV) pour l'adsorption du Bromacil dans l'eau pure tamponnée à pH 7,8 sur CAP SA-UF...118
Tableau C-XV : Résultats d’application du modèle de pseudo second ordre (équation XII ) pour l'adsorption du Bromacil dans l'eau pure tamponnée à pH 7,8 sur CAP SA-UF...126
Tableau C-XVI : Résultats d’application du modèle de pseudo second ordre global pour l'adsorption du Bromacil dans l'eau pure tamponnée à pH 7,8 sur CAP SA-UF. …………...128
Tableau C-XVII : Etude de l’effet de C0 ou Ce : Conditions expérimentales des cinétiques
dans l'eau pure tamponnée à pH 7,8...129
Tableau C-XVIII : Etude de l’effet de C0 ou Ce : Application des modèles de diffusion
intraparticulaire de (équation XI et XV) pour l'adsorption du Bromacil
dans l'eau pure tamponnée à pH 7,8 sur CAP SA-UF...130
Tableau C-XIX : Etude de l’effet de C0 ou Ce : Application de l’approche HSDM
(équation XXX) pour l'adsorption du Bromacil dans l'eau pure tamponnée
à pH 7,8 sur CAP SA-UF...133
Tableau C-XX : Etude de l’effet de ms : Application du modèle de pseudo second ordre
(équantion XXI) et de modèle de second ordre global (équation XXVII) pour l'adsorption du Bromacil dans l'eau pure tamponnée à pH 7,8 sur CAP SA-UF...137
Tableau C-XXI : Conditions expérimentales des isothermes dans l’eau pure tamponnée...143 Tableau C-XXII : Valeurs des paramètres d’isothermes d’adsorption à 2 paramètres des MON en eau pure (pH 7,4-7,7) sur CAP SA-UF (zone 2 la plus représentative
de Ce ou de ms)... ...148
Tableau C-XXIII : Valeurs des paramètres d’isothermes Freundlich des fractions fictives de MON (modèle IAST) pour l'adsorption en eau pure (pH 7,4-7,7) sur le
CAP SA-UF...151
Tableau C-XXIV : Conditions expérimentales des cinétiques dans l’eau pure tamponnée...155
Tableau C-XXV : Résultats d’application du modèle simplifiée Weber et Morris de diffusion de diffusion intra-particulaire pour l'adsorption des MON dans l'eau
pure tamponnée sur CAP SA-UF...157
Tableau C-XXVI : Résultats d’application du modèle de VERMEULEN de diffusion de diffusion intra-particulaire pour l'adsorption des MON dans l'eau
pure tamponnée sur CAP SA-UF...157
Tableau C-XXVII : Résultats d’application du modèle de pseudo second ordre (équation XXI) pour l'adsorption des MON dans l'eau pure tamponnée sur CAP
SA-UF...157
Tableau C-XXVIII : Conditions expérimentales des isothermes d’adsorption du Bromacil dans l'eau
pure tamponnée (pH 7,7) sur CAP SA-UF en présence de AHA……...159
Tableau C-XXIX : Comparaison des valeurs expérimentales et calculées (IAST) pour l’adsorption
Bromacil dans l’eau pure tamponnée (pH 7,7 - 20C°) en présence de AHA...161
Tableau C-XXX : Conditions expérimentales des cinétiques d’adsorption du Bromacil dans Eau
pure tamponnée (pH 7,7) sur CAP SA-UF, en présence de AHA COD/L) …….... ...163
Tableau C-XXXI : Résultats d’application des modèles de diffusion intra-particulaire pour
l’adsorption du Bromacil dans l’eau pure tamponnée (pH 7,7 à 7,8 - 20 °C) sur
CAP SA-UF, en en absence et présence de AHA (~ 2,5 mg COD/L)...164
Tableau C-XXXII : Résultats d’application des modèles de réaction de surface pour l’adsorption
du Bromacil dans l’eau pure tamponnée (pH 7,6 à 7,8- 20 °C) sur CAP SA-UF, en présence et en absence de AHA (2,3 à 2,5 mg COD/L)………...165
Tableau C-XXXIII : Conditions expérimentales des isothermes d’adsorption du Bromacil :
. dans l’eau pure tamponnée en présence de MON aquatiques et dans les
eaux naturelles...167
Tableau C-XXXV : Conditions expérimentales des cinétiques d’adsorption du Bromacil sur
CAP SA-UF, dans l’eau du réseau adoucie...168
Tableau C-XXXVI : Résultats d’application des modèles de diffusion intra-particulaire et de pseudo
second ordre pour l’adsorption du Bromacil sur CAP SA-UF dans l’eau du
réseau adoucie (pH 7,6 - 20 °C)...168
TABLEAUX DES ANNEXES
Tableau I : Conditions utilisées pour l’application de l’approche HSDM (équation XXX) en
réacteur « batch »...187
Tableau II : Tonnage des pesticides par culture en Martinique en 1996...197 Tableau III : Exemple de molécules détectées dans les eaux naturelles en Martinique...198 Tableau IV : Exemple de l’analyses de quelques pesticides retrouvés dans la rivière « la Capot»
en Martinique...198
Tableau V : Quelques caractéristiques de l’acide humique ALDRICH, comparativement à un acide
humique extrait de sol...203
Tableau VI : Rétention du carbone organique des MON par les membranes de filtration de
I
NTRODUCTION
Ce travail prend son origine dans une étude plus générale sur les pesticides retrouvés dans les eaux de l’'île de la Martinique, où, depuis les années 1990, l'agriculture s'est orientée vers une culture intensive de la banane. Cette culture très sensible aux ravageurs nécessite un emploi massif de pesticides et plus particulièrement d'insecticides et de nématicides (2600 tonnes de substances actives recensées en 1996).
En Martinique, de nombreux facteurs naturels favorisent le ruissellement (relief très accentué, aléas pluviométriques violents et fréquents) et concourent à amplifier le risque potentiel de transfert vers le milieu aquatique, dû notamment à la proximité très forte entre les parcelles cultivées et le milieu aquatique. Depuis le rapport BALLAND (1998), une prise de conscience concernant le risque « phytosanitaires » a eu lieu en Martinique, notamment par l'amélioration de la surveillance. Les résultats des campagnes d’analyses réalisées par le service Santé Environnement de la DSDS de la Martinique ont révélé une certaine contamination des ressources en eau potable. Une trentaine de substances ont pu être déjà détectées, et certaines à des concentrations approchant ou dépassant les limites tolérées dans les eaux de consommation (0,1 µg/L), comme le Chlordécone, l'Hexa-chlorocyclohexane (HCHβ), les dérivés de l'Aldicarbe et le Bromacil.
La première partie des études confiées au laboratoire a porté sur l’identification des métabolites de photolyse et d’hydrolyse naturelles de certains organo-phosphorés (Profénofos, Isofenphos, Isazophos, Disulfoton) et carbamates (Oxamyl, Ethiofencarbe, Carbendazime), molécules mères très utilisées mais bizarrement non retrouvées dans les eaux (ZAMY, 2004). Puis une étude sur l’adsorption de quatre substances cibles (Chlordécone, Disulfuton sulfoxyde, Bromacil et Aldicarbe sulfone) sur deux charbons actifs en poudre (Norit SA UF et Chemviron F 400) a été réalisée à partir de concentrations initiales de quelques centaines de microgrammes par litre (AL MARDINI, 2004).
Le thème de ce doctorat porte sur l’étude détaillée des phénomènes d’adsorption d’un pesticide sur un charbon actif, en complément de l’étude pour la Martinique mais en dehors de son cahier des charges. Le choix s’est porté sur le Bromacil de par la faiblesse du nombre de travaux portant sur l’adsorption de ce composé, mais aussi pour des raisons de facilités d’analyse à l’état de traces dans l’eau. Le Bromacil est un herbicide du groupe des uraciles, utilisé contre les graminées vivaces, broussailles, mauvaises herbes sur les terres non agricoles. Il est également utilisé pour le désherbage sélectif dans les cultures d'agrumes et d'ananas (CLAYTON et CLAYTON, 1981).
Les études d’adsorption d’un composé chimique en solution aqueuse sur charbon actif (ou autres matériaux adsorbants) sont généralement effectuées à partir de concentrations initiales de l’ordre du mg.L-1. De plus, ces études portent souvent sur des gammes de concentrations initiales assez réduites. Enfin, quand l’adsorbant est un sol, la variable expérimentale est la concentration initiale en composé chimique, alors que si l’adsorbant est un charbon actif, la variable est plutôt la masse de charbon. L’objectif de la première partie de notre travail a donc été d’étudier l’équilibre (§ C-I) et la cinétique (§ C-II) d’adsorption du Bromacil sur charbon actif en poudre, dans une gamme très large de concentration initiale en Bromacil (~ 5 µ g.L-1 à ~ 500 µ g.L-1) et par suite, relativement large pour les masses de charbon (0,1 à 5 mg.L-1). Les conditions appliquées ont toujours été identiques, en eau pure tamponnée et à température de 20 °C la plus constante possible. Dans un second temps, nous avons souhaité évaluer l’impact de la présence d’une matrice
Après avoir étudié l’adsorption de différentes matières organiques naturelles sur le même charbon actif en poudre, l’étude (équilibre et cinétique) de l’adsorption du Bromacil en présence de ces matières organiques naturelles a été menée dans les mêmes conditions expérimentales que les études en eau pure.
Le troisième aspect de ce travail devait être consacré à l’étude de l’adsorption du Bromacil et autres pesticides dans des eaux naturelles, traitées en continu dans un système CAP/MF. Bien que quelques premiers résultats aient été obtenus sur cet aspect, nous n’avons pas jugé utile les présenter dans le cadre du doctorat.
Une partie importante du mémoire est consacré à la bibliographie, notamment sur les modèles d’équilibre et de cinétique (chapitre A), ainsi qu’à une brève description des matériels et méthodes utilisées (chapitre B). Le chapitre C présente, commente et discute les principaux résultats obtenus. Les annexes de la thèse complètent le mémoire principal. Il regroupe en trois annexes (A, B et C) certains détails bibliographiques et expérimentaux et certains résultats non indispensables à la lecture du mémoire principal mais utiles pour l’expérimentateur qui souhaitera reproduire ou continuer nos travaux.
C
HAPITRE
A
P
ARTIE
I. L’équilibre adsorption/désorption
I.1. Approche thermodynamique
La sorption d’un composé chimique (organique ou minéral) à la surface d’un solide (sol, charbon actif, zéolithe, oxyde métallique, résidus divers) est un équilibre entre une réaction d’adsorption et la réaction inverse de désorption, qui peut être schématisé par :
(SITE LIBRE)solide + (SOLUTE)liquide ou gaz
désorption adsorption
←
→ (COMPLEXE)solide
Par suite, la sorption peut être caractérisée par une constante d’équilibre standard (K0) et par des constantes de vitesse d’adsorption (kads ou k1) et de désorption (kdés ou k-1).
Comme toute réaction chimique, la variation d’enthalpie libre en cours de réaction (∆G) est la différence entre l’enthalpie libre des produits (Gcomplexe) diminuée de la somme des enthalpies libres des réactifs (Gsite libre + Gsoluté), aux coefficients stoechiométriques près. Elle peut être exprimée par la relation suivante :
∆G = ∆G0 + RT.ln (a complexe/a site libre.asoluté)
∆G0 = variation d’enthalpie libre standard R = 8,314 J.mol.K-1
T = température absolue (K) a = activité (mol.L-1)
Négative en début de réaction, ∆G devient nulle quand l’équilibre est atteint et ∆G0 peut être alors exprimé par l’équation 1.
∆G0 = - RT.ln K0 (équation 1)
Quand ∆G0 < 0 (ce qui implique K0 > 1), la réaction est spontanée.
A l’équilibre, la variation d’enthalpie libre standard ∆G0 est encore la différence (équation 2) entre les énergies d’activation des réactions d’adsorption (E1) et de désorption (E-1). L’énergie d’activation est elle-même reliée à la constante de vitesse (k) de la réaction par la loi de ARRHENIUS (équation 3).
∆G0 = E1 – E-1 (équation 2)
et k = D.e-E/RT (équation 3)
D, coefficient de fréquence de collision Les équations (1), (2) et (3) permettent d’établir que :
Figure A-1 : Les quatre types d’isothermes
∆G0 = RT. Ln ( 1 1 − k k ) (équation 4) et par suite, K0 = 1 1 − k k (équation 5)
I.2. Approche expérimentale (isothermes de sorption)
Au plan expérimental, il est très fréquent dans les études de réaction de sorption, de relier la concentration en complexes de surface formés à l’équilibre (quantité de soluté retenue par le solide, qe, en mol.kg-1 ou kg.kg-1 ou unités dérivés) à la concentration en équilibre en soluté dans la phase liquide ou gazeuse (Ce, en mol.L-1 ou kg.kg-1 ou unités dérivées). La relation obtenue est appelée « isotherme d’équilibre » à condition que l’expérience soit effectuée à température constante.
qe = (
m V
). (C0 – Ce) + q0 (équation 6)
V : volume de solution, m : masse de solide adsorbant,
C0 : concentration initiale en soluté en phase liquide ou gazeuse,
q0 : concentration en soluté initialement présente sur le solide (généralement nulle ou négligeable).
Plusieurs auteurs, dont GILES et al. (1974), ont proposé une classification des isothermes de sorption basée sur leur forme et sur leur pente initiale. Les revues de HINZ (2001) et, plus récemment, de LIMOUSIN et al. (2007) présentent une synthèse plus ou moins détaillée de cette classification. Parmi les formes d’isothermes, ces auteurs distinguent (Fig. A-1) :
- la forme H, dite de « haute affinité », - la forme L, dite de « Langmuir »,
- la forme C, dite de « partition constante », - la forme S, dite « sigmoïdale ».
Les formes « L » et « H » sont les plus observées, notamment dans le cas de l’adsorption de composés organiques en solution aqueuse sur des charbons actifs.
La forme « H » est un cas particulier de la forme « L », où la pente initiale est très élevée. C’est le cas quand le soluté exhibe une forte affinité pour le solide.
La forme « L » correspondrait plutôt aux faibles concentrations en soluté dans l’eau. L’isotherme est de forme convexe, ce qui suggère une saturation progressive du solide. Quand Ce tend vers zéro, la pente de l’isotherme est constante.
La forme « S » présente un point d’inflexion révélateur d’au moins deux mécanismes d’adsorption. C’est le cas, par exemple, quand une première couche de soluté est d’abord adsorbée puis quand l’adsorption d’une ou plusieurs couches supplémentaires devient favorisée.
La forme « C » est une droite passant par zéro ce qui signifie que le rapport qe/Ce (appelé coefficient de distribution Kd) est constant. C’est souvent le cas de l’adsorption sur les argiles.
D’après HINZ (2001), une autre interprétation possible des données expérimentales est de tracer le coefficient de distribution Kd = qe/Ce en fonction de qe, en échelle linéaire ou logarithmique, notamment quand les expérimentations ont été effectuées sur plusieurs ordres de grandeur de concentration.
Le tracé de Kd vs qe exhibe :
- une pente négative presque constante (sauf pour les fortes valeurs de qe) pour les isothermes de type « L »,
- une pente négative décroissante pour le type « H », - une horizontale pour le type « C »,
- une pente positive pour le type « S » à faibles concentrations.
Toujours d’après HINZ (2001), les modélisations dites de « Langmuir », «Langmuir – 2 sites », « Tόth » et « Redlich-Peterson » sont celles qui décriraient le mieux les données de l’isotherme de type « L », alors que le type « H » serait mieux décrit par les modélisations dites de « Freundlich », « Langmuir-Freundlich » et « Freundlich généralisé ».
I.3. Modélisation des isothermes d’équilibre mono-soluté
De très nombreuses publications sont parues depuis le début du 20ème siècle et sont toujours produites. Il serait utopique d’en faire une étude bibliographique exhaustive. Seules quelques synthèses et travaux récents ont été pris en compte dans ce travail.
De nombreuses modélisations sont utilisées et parfois développées dans la littérature. La plupart de ces modèles sont présentés ci-après. On distingue :
- les modèles à deux paramètres (Freundlich, Langmuir, Temkin, Elovich et Dubinin-Radushkevich) ;
- les modèles à trois paramètres (Langmuir-Freundlich, Langmuir généralisé, Tόth, Sips, Redlich-Peterson, Fritz-Schluender, Radke-Prausnitz, Koble-Corridan, Jossens, Kislev, Hill-de Boer, Fowler Guggenheim);
- les modèles à quatre paramètres ou plus [par exemple dans HAMDAOUI et NAFFRECHOUX (2007b) : Weber-van Vliet, Fritz-Schluender, Baudu]
- les modèles numériques de type régression linéaire multi-paramètres (MLR) ou non linéaire
- les réseaux de neurones artificiels (ANN) (ex. : BRASQUET et LE CLOIREC, 2000).
Le tableau A-Iprésente les différents modèles d’isotherme (monosoluté) et leur expression linéaire. Dans ce tableau, la symbolisation des modèles à trois paramètres a été uniformisée
respectivement (comme dans l’isotherme de Langmuir) et l’exposant par « n » (comme dans l’isotherme de Freundlich).
I.3.1. Modèles mono-soluté à deux paramètres
a) Modèle de FREUNDLICH :
Le modèle simple et empirique de Freundlich (VAN BEMMELEN, 1888 ; FREUNDLICH, 1909) est le plus communément utilisé. On considère qu’il s’applique à de nombreux cas, notamment dans le cas de l’adsorption multicouche avec possibles interactions entre les molécules adsorbées.
qe = KF . Cen (équation 7)
La forme exploitée la plus courante est le tracé en échelle logarithmique des variations de qe en fonction de Ce :
log qe = log KF + n log Ce (équation 8)
Une autre exploitation possible des résultats par l’isotherme de Freundlich consiste à tracer en échelle logarithmique les variations du coefficient de distribution Kd en fonction de qe : log Kd = ( n 1 ) log KF + [ n n 1) ( − ]( log qe) (équation 9)
KF est une constante qui est relative à la capacité d’adsorption. Comme Ce est souvent exprimée en mg.L-1 et qe en mg.g-1, l’unité de KF est mg(1-n).Ln.g-1. En accord avec HASLEY (1952), la relation entre KF et la capacité maximum d’adsorption (qm) est :
KF = n m C q 0 (équation 10)
La constante n (adimensionnelle) donne une indication sur l’intensité de l’adsorption. Il est généralement admis (HAMDAOUI et NAFFRECHOUX, 2007a) que des faibles valeurs de n (0,1 < n < 0,5) sont caractéristiques d’une bonne adsorption, alors que des valeurs plus élevées révèlent une adsorption modérée (0,5 < n < 1) ou faible (n > 1). La constante « n » est très souvent remplacée par « 1/n » ou facteur d’hétérogénéité. Il faut noter que si n (ou 1/n) tend vers 1, l’isotherme devient linéaire donc de type C.
b) Modèle de LANGMUIR
Le second modèle le plus communément utilisé est celui de Langmuir (LANGMUIR, 1918). Les hypothèses initiales sont que le solide adsorbant présente une capacité d’adsorption limitée (qm), que tous les sites actifs sont identiques, qu’ils ne peuvent complexer qu’une seule molécule de soluté (adsorption monocouche) et qu’il n’y a pas d’interactions entre les molécules adsorbées. Il s’agit dans ce cas d’une simple application
K0 = (a complexes)éq. / (a sites libres)éq.. (a soluté)éq.
En remplaçant les activités par des concentrations et K0 par KL, l’équation devient :
KL = ) .( m e e q q Ce q − m e q q = θ = ) . 1 ( . e L e L C K C K + (équation 11)
KL, constante d’équilibre de Langmuir
θ, taux de recouvrement.
Des développements de l’équation 11 conduisent à des formes linéaires de l’isotherme de Langmuir. Parmi les cinq formes citées dans la littérature (ex. : HAMDAOUI et NAFFRECHOUX, 2007a), deux d’entre elles sont très couramment utilisées :
e q 1 = ( m q 1 ) + ( m e LC q K . . 1 ) « Langmuir I » (équation 12) e e q C = ( m L q K . 1 ) + ( m e q C ) « Langmuir II » (équation 13)
Quand qe et qm sont exprimées en mg.g-1 et Ce en mg.L-1, la constante KL est exprimée en L.mg-1. Notons que KL est souvent appelée « b » ou encore « L » et que certains auteurs définissent le rapport RL (équation 14) comme une grandeur sans unité indiquant si l’adsorption d’autant plus favorable que RL tend vers zéro (RL 0) et d’autant plus défavorable que RL tend vers un (RL 1) (HALL et al., 1966).
RL = 0 . 1 1 C KL + (équation 14) c) Modèle de TEMKIN
Le modèle de Temkin (TEMKIN et PYZHEV, 1940) repose sur l’hypothèse que, lors de l’adsorption en phase gazeuse, la chaleur d’adsorption due aux interactions avec l’adsorbat décroît linéairement avec le taux de recouvrement θ. C’est une application de la relation de Gibbs pour les adsorbants dont la surface est considérée comme énergétiquement homogène (TÓTH, 1971).
Plusieurs auteurs (HINZ, 2001 ; HAMDAOUI, 2006 ; SRIVASTAVA et al., 2006 ; LIMOUSIN et al., 2007 ; HAMEED, 2007 ; HAMDAOUI et NAFFRECHOUX, 2007a ; GIMBERT et al., 2008) proposent d’utiliser ce modèle en phase liquide, en traçant qe ou
θ en fonction de Ln Ce. max q qe = θ = ( Q RT ∆ ) ln (KT.Ce) (équation 15) -1 -1
T, température absolue (en K)
∆Q, variation d’énergie d’adsorption (en J.mol-1) KT, constante de Temkin (en L.mg-1)
Ce tracé permet de déterminer BT =
Q RT qm
∆ , puis en introduisant une valeur de qm (par exemple issue de l’application de Langmuir), de calculerla variation d’énergie d’adsorption
∆Q.
d) Modèle de ELOVICH
Le modèle de Elovich (ELOVICH et LARINOV, 1962) est basé sur un développement cinétique faisant l’hypothèse que les sites d’adsorption augmentent exponentiellement avec l’adsorption, ce qui implique une adsorption multi-couches. Quand il est utilisé (ex : HAMDAOUI et NAFFRECHOUX, 2007a), il est exprimé par la relation :
m e q q = θ = KE.CE. exp (-m e q q ) (équation 16)
KE, constante de Elovich (en L.mg-1)
Le tracé de ln ( e e C q ) vs qe permet d’atteindre qm et KE. ln ( e e C q ) = – ( m e q q ) + ln (KE.qm) (équation 17) e) Modèle de DUBININ-RADUSHKEVICH
Le modèle de Dubinin-Radushkevich (cité par KENNEDY et al., 2007) ne fait pas l’hypothèse d’une surface homogène ou d’un potentiel d’adsorption constant, comme le modèle de Langmuir. Sa théorie de remplissage du volume des micropores repose sur le fait que le potentiel d’adsorption est variable et que l’enthalpie libre d’adsorption est reliée au degré de remplissage des pores. L’isotherme de Dubinin-Radushkevich est donnée par l’équation : mDR e q q = exp (-βε2) (équation 18)
qmDR, capacité maximum d’adsorption dans les micropores
β, constante reliée à l’énergie d’adsorption par E = 0,5 ) ( 1 β ε, potentiel de Polanyi = RT Ln ( e s C C ) Cs, solubilité du soluté.
ln qe = ln qmDR – ( E RT )2. (ln ( e s C C )2 ) (équation 19) Le tracé de ln qe vs ln ( e s C C )2 permet d’atteindre qmDR et E.
I.3.2. Modèles mono-soluté à trois paramètres
La plupart de ces modèles étant dérivés des modèles simples de Langmuir et de Freundlich, il a été choisi, dans ce travail bibliographique, de symboliser les trois paramètres par « qm», « KL » et « n » pour simplifier la comparaison entre les différents modèles. Certaines revues de synthèse l’ont d’ailleurségalementfait (HINZ, 2001 ; LIMOUSIN et al., 2007).
a) Modèle de REDLICH-PETERSON
C’est le modèle monosoluté à trois paramètres qui est le plus cité et le plus utilisé dans la littérature parce que annoncé comme pouvant s’appliquer sur une large gamme de concentration (ex. : HINZ, 2001 ; CHOY et al., 2004 ; OZKAYA, 2006 ; SRIVASTAVA et al., 2006 ; KARADAG, 2007 ; LIMOUSIN et al., 2007 ; HAMDAOUI et NAFFRECHOUX, 2007b ; NCIBI, 2007 ; KUMAR et al., 2007 ; GIMBERT et al., 2008 ; SING et al., 2008). C’est un modèle empirique combinant les paramètres des équations de Langmuir et de Freundlich.
Dans la publication initiale (REDLICH et PETERSON, 1959), le modèle est appliqué à l’adsorption en phase gazeuse. Par analogie, son expression en phase liquide est de la forme (SRIVASTAVA et al., 2006, KUMAR et al., 2007, NCIBI, 2007 ; HAMDAOUI et NAFFRECHOUX, 2007b) : qe
[
n]
e L e C K AC ) ( 1+ = (équation 20) A et KL, constantes de Redlich-Peterson,D’après HINZ (2001) et LIMOUSIN et al. (2007), ce modèle peut s’écrire encore :
m e q q = θ n e L e L C K C K ) ( 1+ = (équation 21)
KL, constante de Langmuir (en L.mg-1) correspondant à A/qm du modèle précédent n, coefficient (de type “n” de FREUNDLICH) compris entre 0 et 1, correspondant à β,
K = KLn (ou β)
n e m n L m L e e C q K q K q C ) .( 1 + ( −1) = (équation 22)
Une autre forme possible de linéarisation est d’introduire les valeurs de KL et de qm de Langmuir et de tracer : ln [( e e L m q C K q ) – 1] = n. ln (KL. Ce) ln( −1) e e L m q C K q = n.ln (Ce) + ln KL
On peut noter que dans certaines conditions, notamment pour les fortes concentrations de soluté en phase liquide, l’expression de Redlich-Peterson devient comparable à celle de Freundlich.
(KLCe)n >> 1 qe = qm. KL (Ce)(1-n)
Si n = 0, l’isotherme devient linéaire (de type C). b) Modèle de TÓTH
C’est également un modèle très souvent cité et utilisé (ex. : HINZ, 2001 ; SRIVASTAVA et al., 2006 ; LIMOUSIN et al., 2007 ; HAMDAOUI et NAFFRECHOUX, 2007b ; PIKAAR et al., 2006 ; RUDZINSKI et PLAZINSKI, 2007 ; KUMAR et al., 2007 ; GIMBERT et al., 2008 ; SING et al., 2008).
Le modèle de Tόth a été établi pour l’adsorption en phase gazeuse (TÓTH, 1962) à partir de l’isotherme de Langmuir, mais en considérant que la surface de l’adsorbant n’est pas énergétiquement homogène. Ce modèle présente donc un intérêt particulier puisqu’il considère que la surface de l’adsorbant est hétérogène. En phase liquide, il est généralement utilisé comme une adaptation du modèle de Langmuir, proche du modèle empirique de Redlich-Peterson (équation 18). m e q q = θ
[
]
(1/ ) ) ( 1 L e n n e L C K C K + = (équation 23)Une linéarisation possible de l’isotherme de Tόth est, d’après RUDZINSKI et PLAZINSKI (2007) : n e e q C ) ( = n L m K q . ) 1 ( + n m q ) 1 ( .(Ce)n (équation 24)

![Figure B-2 : Exemple de courbe d’étalonnage du Bromacil dans l’eau ultra pure pour la gamme de fortes concentrations (25 < C 0 µg/L < 500) y = 4,9582E+02x R 2 = 9,9984E-01 0100020003000400050006000 0 2 4 6 8 10 12 [bromacil] µg/LAire](https://thumb-eu.123doks.com/thumbv2/123doknet/8060710.270258/74.892.133.703.215.500/figure-exemple-courbe-étalonnage-bromacil-fortes-concentrations-bromacil.webp)