THESE DE DOCTORAT
Pour l’obtention du grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
Faculté des Sciences Fondamentales et Appliquées(Diplôme National – Arrêté du 25 Avril 2002)
Ecole Doctorale : Ingénierie Chimique, Biologique, Géologique Secteur de Recherche : Aspects moléculaires et cellulaires de la Biologie
Présentée par
Thomas DAUBON
Mobilité cellulaire induite par les chimères
Bcr-Abl :
un nouveau modèle pour l’exploration des voies
effectrices des petites protéines G de la famille Rho
Thèse dirigée par le Dr Nicolas BOURMEYSTER
Soutenue publiquement le 05 décembre 2008
JURY
Rapporteurs : Dr Elisabeth GENOT Directeur de Recherche, INSERM, Bordeaux Dr Evelyne FRIEDERICH Directeur de Recherche, CNRS, Luxembourg Examinateurs : Pr Christophe AMPE Professeur, Université de Gand, Belgique
Dr Marleen VAN TROYS Professeur, Université de Gand, Belgique Dr Nicolas BOURMEYSTER Maitre de Conférences, Université de Poitiers Pr Alain KITZIS Professeur, Université de Poitiers
Sommaire
Abréviations ... 1
Index des figures et tableaux ... 4
Avant-propos : ... 7
INTRODUCTION ... 9
Chapitre 1 : ... 10
Rôle des petites protéines G ... 10
de la famille Rho dans la mobilité cellulaire ... 10
1/ Réorganisation du cytosquelette d’actine par les petites protéines G de la famille Rho ... 11
2/ Les petites protéines G ... 15
2-1/ La super-famille Ras ... 15
2-2/ Mécanisme d’activation des GTPases monomériques ... 16
2-2-1/ Adressage à la membrane plasmique : ... 16
2-2-2/ Activation des GTPases : ... 17
2-2-3/ Modèle dynamique d’échange de GDP contre du GTP : ... 19
3/ La famille Dbl ... 21
3-1/ Historique : ... 21
3-2/ Structure du domaine à activité facteur d’échange GDP/GTP ... 24
3-2-1/ Le domaine DH ... 24
3-2-2/ Le domaine PH : ... 25
4/ Les partenaires des petites protéines G de la famille Rho dans l’organisation du cytosquelette ... 29
4-1/ Rac1, Cdc42 et l’organisation du cytosquelette d’actine ... 29
4-1-1/ Les kinases : ... 29
4-1-2/ Les protéines favorisant la polymérisation de l’actine : ... 31
4-2/ RhoA et l’organisation du cytosquelette d’actine ... 33
5/ Les filaments d'actine ... 35
5-1/ Structure des filaments d’actine : ... 35
5-2/ Dynamique des filaments d’actine : ... 36
6/ Rôle des GTPases de la famille Rho dans la mobilité cellulaire ... 38
6-1/ La mobilité mésenchymateuse : ... 38
6-2/ La mobilité amoeboïde: ... 39
Chapitre 2 : ... 42
Bcr-Abl, les petites protéines G de la famille Rho et la mobilité cellulaire ... 42
1/ La chimère Bcr-Abl ... 43
1-1/ Le gène bcr-abl ... 43
1-1-1/ Le gène bcr (breakpoint cluster region) ... 43
1-1-2 Le gène abl (abelson) ... 44
1-1-3 Le gène bcr-abl : ... 45
1-2/ Les protéines de fusion Bcr-Abl ... 46
1-3/ Domaines de Bcr présents et absents dans Bcr-Abl ... 47
1-3-1/ La protéine Bcr ... 47
1-3-2/ Domaines de Bcr présents dans Bcr-Abl et leurs rôles ... 48
1-3-3/ Domaines de Bcr absents dans Bcr-Abl ... 52
1-4/ Domaines d’Abl présents et absents dans Bcr-Abl et leurs rôles ... 53
1-4-1/ La protéine c-Abl ... 53
1-4-2/ Domaine d’Abl absent dans Bcr-Abl ... 57
2/ Les GTPases de la famille Rho et Bcr-Abl ... 59
2-1/ Relations indirectes de Bcr-Abl avec les petites protéines G de la famille Rho : ... 59
2-2/ Relations directes de Bcr-Abl avec les petites protéines G de la famille Rho : ... 59
2-2-1/ La protéine p95vav : ... 59
2-2-2/ Bcr et Bcr-Abl ... 62
Chapître 1 : ... 71
1/ Introduction : ... 72
2/ Résultats : ... 72
2-1/ Mobilité différentielle des cellules Ba/F3 exprimant les chimères Bcr-Abl : ... 72
2-2/ Vav a un rôle majeur dans la mobilité des cellules Ba/F3p190 et Ba/F3p210 : ... 76
2-3/ Le domaine GEF de Vav est responsable de l’activation de Rac1 alors que RhoA est spécifiquement activé par le domaine GEF de p210bcr-abl : ... 78
2-3-1/ Construction des mutants des domaines GEF de p210bcr-abl et de Vav : ... 78
2-3-2/ Mesure des activités des domaines GEF de p210bcr-abl et de Vav : ... 80
2-4/ Vav contrôle la mobilité spontanée des cellules Ba/F3 : ... 81
2-5 / Le domaine GEF de p210bcr-abl permet la mise en place des mouvements amoeboïdes: ... 85
2-6/ Les mouvements amoeboïdes sont la conséquence de l’activation de RhoA par p210bcr-abl : ... 85
3/ Conclusion : ... 87
4/ Coopération entre les domaines GEF de Bcr-Abl et Vav : ... 90
4-1 : Etat d’activation de RhoA : ... 90
4-2 : Etat d’activation de Rac1 : ... 91
4-3 : Conclusion : ... 92
5 / Implication de l’activité GEF de Vav dans la prolifération cellulaire : ... 92
Chapître 2 : ... 95
1/ Introduction : ... 96
2/ Résultats : ... 98
2-1/ Caractérisation des effecteurs au sein des complexes Bcr-Abl : ... 99
2-2/ PAK contre ROCK : mobilité de type roulement contre mobilité amoeboïde : ... 101
2-3/ La Myosine-II joue un rôle essentiel dans la mobilité amoeboïde : ... 104
2-4/ La régulation de la LIMK2 induit le mouvement amoeboïde : ... 106
2-4-3/ Rôles respectifs des LIM-Kinases dans les mobilités de type amoeboïde et de
type roulement : ... 109
2-5/ ADF/destrine, un facteur dépolymérisant l’actine, indispensable à la mise en place des mouvements amoeboïdes : ... 113
2-5-1/ Régulation transcriptomique d’ADF/destrine : ... 113
2-5-2/ Régulation par phosphorylation d’ADF/destrine et de cofiline1 : ... 114
c/ Implication de l’ADF/destrine et de la cofiline1 dans la mobilité de type amoeboïde et de type roulement : ... 116
3/ Mise en évidence d’une boucle de rétro-activation de RhoA : ... 121
4/ Etude de l’actine dans la mobilité amoeboïde et dans la mobilité de type roulement : 122 4-1/ Mobilité amoeboïde : ... 122
4-2/ Mobilité de type roulement : ... 124
7/ Conclusion : ... 125
DISCUSSION ... 127
1/ Activités respectives des domaines GEF de p210bcr-abl et Vav... 128
1-1/ Rôles respectifs des GEFs en complexe avec Bcr-Abl dans l’activation des petites protéines G de la famille Rho : ... 128
1-2/ Mise en évidence d’une coopération entre les différentes activités GEF du complexe formé autour de Bcr-Abl : ... 129
1-3/ Rôle de l’activité GEF de Vav dans la transformation induite par Bcr-Abl: ... 132
2/ Mobilité des cellules Ba/F3 exprimant Bcr-Abl : ... 133
2-1/ Rôle de l’activation de RhoA et de Rac1 dans la mobilité des cellules exprimant Bcr-Abl : ... 133
2-2/ Caractérisation des voies d’activation des mobilités de type amoeboïde ou de type roulement: ... 135
2-2-1 / Mobilité amoeboïde : ... 135
2-2-2 / Mobilité de type roulement : ... 137
2-2-3 : Rac1 et RhoA induisent une activation différentielle et spécifique d’isoformes de voies effectrices : ... 138
2-2-4 : Réactivation de RhoA dans les lignées Ba/F3p190 et Ba/F3p210S509A co-exprimant ADF/destrine-myc : ... 142
1/ Méthodes de biologie moléculaire ... 146
1-1/ Mini- et maxi-préparation de plasmides : ... 146
1-2/ Mutagenèse dirigée : ... 147
1-3/ Digestion et électrophorèse de l'ADN : ... 148
1-4/ Principe général de la PCR : ... 148
1-5/ Ligature des produits PCR et des ADNc ... 148
1-6/ Transformation des bactéries par choc thermique : ... 149
1-7/ Séquençage de l’ADN : ... 149
1-8/ RT-PCR quantitative : ... 150
1-8-1/ Préparation des ARN totaux : ... 150
1-8-2/ Synthèse des ADN complémentaires simple brin : ... 150
1-8-3/ PCR : ... 151
2/ Méthodes de biologie cellulaire ... 152
2-1/ Culture de cellules Ba/F3 : ... 152
2-2/ Transfection des cellules Ba/F3 : ... 153
2-2-1/ Electroporation : ... 153
2-2-2/ Transfection avec NucleoTransfector AMAXA : ... 153
2-3/ Mesure de la croissance cellulaire : ... 154
2-3-1/ Comptage par cellule de Malassez : ... 154
2-3-2/ Incorporation de thymidine [3H] : ... 154
2-4/ Enregistrement en microscopie time-lapse des mouvements cellulaires ... 155
2-5/ Tests d’invasion cellulaire en chambre de Boyden : ... 155
2-6/ Test d’invasion cellulaire en collagène : ... 155
3/ Méthodes biochimiques ... 157
3-1 / Préparation de lysat cellulaire : ... 157
3-2 Dosages protéiques : ... 157
3-2-1/ Méthode de Bradford : ... 157
3-3-1/ Séparation des protéines sur gel de polyacrylamide (SDS-PAGE) : ... 158
3-3-2/ Electrotransfert sur membrane de nitrocellulose : ... 158
3-3-3/ Détection immunologique des protéines : ... 159
3-4/ Electrophorèse bidimensionnelle : ... 162
3-5/ Immunoprécipitations et co-immunoprécipitations : ... 162
3-6/ Marquage intracytoplasmique pour cytométrie en flux : ... 163
3-7 /Le marquage immunologique : ... 163
3-8 / Production et purification de protéines recombinantes : ... 164
3-8-1 / Production et purification de protéines en fusion poly-histidine : ... 164
3-8-2/ Production et purification de protéines recombinantes en fusion GST : ... 164
3-9/ Précipitation par affinité de partenaires moléculaires (Pull Down) : ... 165
3-9-1 Principe général : ... 165
3-9-2 / Extraction par affinité des formes actives des GTPases de la famille Rho : ... 166
3-10 / Mesure de l’activité d’échange en mant-GDP : ... 166
1
Abréviations
A
abl : Ableson
ADF : Actin Depolymerizing Factor ADP : Adénosine DiPhosphate ARF : ADP-Ribosylation Factor Arp2/3 : Actin-Related Proteins 2/3 ATP : Adénosine TriPhosphate B
Bcr : breakpoint cluster region C
Cdc42 : cell division cycle 42 Cdk : Cyclin-Dependent Kinases
CDM : Ced-5, Dock180 and Myoblast city CH : Calponin Homology
COP : Coat Protein CR : région conservée
CRIB : Cdc42/Rac Interactive Binding CRIK : Citron Kinase
CZH1/2 : CDM Zizimin Homology1/2 D
Dbl : Diffuse B-cell Lymphoma
DH : Dbl Homology
Dia : Drosophila diaphanous DTT : Dithiothréitol
E
EDTA : Acide ethylene Diamine-tétraacétique ERK : Extracellular signal Regulated Kinase ERM : Ezrin/Radixin/Moesin
F
FAK : Focal Adhesion Kinase G
GAP : GTPase Activating Protein
GDI : Guanine nucleotide Dissociation Inhibitor GDP : Guanosine Diphosphate
GEF : Guanine nucleotide Exchange Factor GRD : Ras GAP Related Domain
GST : Gluthation-S-Transférase GTP : Guanosine Triphosphate
2 IL3 : Interleukine 3
IQGAPs : IQ motifs containing GAPs J
JNK : c-jun N-terminal Kinase K
kD : Kilodalton L
LAL : Leucémie Aigüe Lymphoblastique LB : Luria Bertani
LIMK : LIM domain Kinase
LMC : Leucémie Myéloïde Chronique LPA : Acide LysoPhosphatidique M
MAPK : Mitogen-Activating Protein Kinase MBS : Myosin Binding Subunit
MEC : Matrice ExtraCellulaire MLC : Chaîne légère de myosine MLCK : Myosin Light Chain Kinase MMP : Matrix MétalloProtéinase
MRCK : Myotonic dystrophy kinase-related Cdc42-binding kinase N
NES : Nuclear Export Signal NF-κB : Nuclear Factor κB
NLS : Nuclear Localization Signal NP-40 : Nonidet P40
P
PAF : Point d’Adhérence Focaux PAK : p21 Activated Kinase
PBS : Tampon Phosphate isotonique pH 7,4 PEG : Polyéthylène Glycol
Ph : Chromosome Philadelphie PH : Pleckstrin Homology
PI3-K : PhosphatidylInositol-3 Kinase PIP : PhosphatidylInositol Phosphate PIX : PAK-interacting exchange factor PKA/C/N : Protéine Kinase A/C/N
3 Rac1 : Ras-related C3 botulinum toxin substrate 1
Ran : Ras-related nuclear protein Ras : Rat Sarcoma
Rho : Ras Homologue
RMN : Résonance Magnétique Nucléaire ROCK : Rho associated Kinase
RT-PCR : Reverse Trancriptase-Polymérase Chain Réaction S
SOS : Son of Sevenless
SH1/2/3 : Src Homology region 1/2/3
STAT : signal transducer and activators of transcription T
TNF : Tumor Necrosis Factor W
WASP : Wiskott-Aldrich Syndrome Protein
WAVE : WASP-like Verprolin-homologous protein WB : Western Blot X XPB : Xeroderma Pigmentosum B Z ZF : Zinc Finger Chiffre : 2D : deux dimensions 3D : trois dimensions
4
Index des figures et tableaux
IntroductionFigure I 1 Cascade des GTPases RhoA, Rac1 et Cdc42 impliquée dans l’organisation du cytosquelette des cellules Swiss 3T3 Figure I 2 Photo en microscopie électronique à balayage d’un fibroblaste
Figure I 3 Les différentes étapes de la migration cellulaire Figure I 4 Dendrogramme de la super- famille Ras
Figure I 5 Représentation schématique de la biosynthèse, de la séquestration et de la régulation des petites protéines G de la famille Rho Figure I 6 Emplacement des régions Switch I et II dans Rac1, Cdc42 et RhoA
Figure I 7 Protéines de la famille Dbl
Figure I 8 La famille Dbl avec ces 69 membres identifiés Figure I 9 Structure 3D du domaine DH de Sos
Figure I 10 Structure du domaine PH C-terminal de la pleckstrine
Figure I 11 Modèle d’activation des petites protéines G de la famille Rho par un domaine DH/PH Figure I 12 Modèle de contrôle du domaine DH par le domaine PH adjacent
Figure I 13 Voies de signalisation activées par Rac1 et Cdc42 et contrôlant la formation des lamellipodes et des filopodes Figure I 14 Voies de signalisation activées par RhoA et contrôlant la formation des fibres de stress
Figure I 15 Représentation de l’actine G et de l’actine F
Figure I 16 Polymérisation de l’actine par des facteurs d’assemblage Figure I 17 Formation d’un blebb chez Dictyostelium
Figure I 18 Migration d’un leucocyte dans une matrice de collagène dont les fibres sont fluorescentes Figure I 19 Le gène bcr et son messager
Figure I 20 Le gène abl et ses messager alternatifs Figure I 21 Les différents transcrits bcr-abl
Figure I 22 Structure en domaines de la protéine de fusion p190bcr-abl Figure I 23 Structure en domaines de la protéine de fusion p210bcr-abl Figure I 24 Structure en domaines de la protéine Bcr
Figure I 25 Résumé de voies de signalisation via Bcr-Abl
Figure I 26 Structure en domaines de la protéine codée par le gène abl
Figure I 27 Modèle d’activation de l’activité kinase de Bcr-Abl via les domaines SH3 et SH2 Figure I 28 Structure en domaine de la protéine Vav
Figure I 29 Modèle de contrôle du domaine DH par le domaine PH adjacent Figure I 30 Le complexe d’adhérence focale
Figure I 31 Localisation des GTPases de la famille Rho dans les cellules Ba/F3wt, Ba/F3p190 et Ba/F3p210 Figure I 32 Modèle de la régulation différentielle par les GTPases de la famille Rho entre p190bcr-abl et p210bcr-abl
Résultats :
Figure R 1 Cellules Ba/F3p190 (A) et Ba/F3p210 (B) étalées sur Matrigel
Figure R 2 Enregistrement en time-lapse des cellules Ba/F3 parentales, Ba/F3p190 et Ba/F3p210 cultivées en Matrigel 3D Figure R 3 Capacité de mobilité spontanée des cellules en chambre de Boyden avec ou sans traitement par le SDF-1
5 Figure R 5 Capacité de migration spontanée des cellules Ba/F3 parentales, Ba/F3p190 et Ba/F3p210 déplétées de Vav1 Figure R 6 Structures des domaines de Vav, VavL, VavT205A et p210bcr-ablS509A
Figure R 7 Western-blot anti-phospho-tyrosine sur traitées ou non par le CGP-571
Figure R 8 Immunofluorescence sur les cellules Ba/F3p190, Ba/F3p210 et Ba/F3p210S509A
Figure R 9 Pull-down GST-PAK-CD sur cellules exprimant ou non les mutants de Vav : Vav, VavT205A et VavL Figure R 10 Pull-down GST-C21 sur cellules Ba/F3 parentales, Ba/F3VavL
Figure R 11 Vidéomicroscopie des cellules Ba/F3 parentales, Ba/F3p190 ou Ba/F3p210 exprimant ou non Vav, VavT205A ou VavL
Figure R 12 Capacité de migration spontanée des cellules Ba/F3 parentales, Ba/F3p190 ou Ba/F3p210 exprimant ou non les mutants de Vav et Figure R 13 Enregistrement en time-lapse des cellules Ba/F3p210S509A cultivées en Matrigel 3D
Figure R 14 Capacité de migration spontanée des cellules traitées ou non par l'exoenzyme C3
Figure R 15 Enregistrement en time-lapse des des cellules Ba/F3 parentales, Ba/F3p190 ou Ba/F3p210 traitées à l'exoenzyme C3 Figure R 16 Modèle d'activation des petites protéines G de la famille Rho dans l'induction de deux mobilités différentes
Figure R 17 Pull-down GST-C21 sur cellules Ba/F3p210 ou Ba/F3p190 exprimant ou non les mutants de Vav Figure R 18 Pull-down GST-PAK-CD sur cellules Ba/F3p190, Ba/F3p210 ou Ba/F3p210S509A
Figure R 19 Expérience d’échange en mant-GDP sur Rac1 et RhoA avec Bcr-Abl-GST
Figure R 20 Evaluation de la prolifération cellulaire des différentes lignées sur 72 heures par comptage direct
Figure R 21 Evaluation de la prolifération cellulaire des différentes lignées sur 30 heures par mesure de l’incorporation de thymidine tritiée Figure R 22 Evaluation de la prolifération cellulaire des cellules Ba/F3p190,Ba/F3p210 et Ba/F3p210S509A
Figure R 23 Voies de signalisation contrôlant la polymérisation de l’actine
Figure R 24 Capacité migratoire spontanée des cellules Ba/F3p190 et Ba/F3p210 exprimant ou non RacN17 en chambre de Boyden Figure R 25 Modèle d'activation des petites protéines G de la famille Rho dans l'induction de deux mobilités différentes
Figure R 26 Présence des effecteurs de Bcr-Abl et Vav1 en complexe avec les différentes chimères
Figure R 27 Capacité migratoire spontanée des cellules exprimant ou non PAK1-KD en chambre de Boyden
Figure R 28 Capacité migratoire spontanée des traitées ou pas par 50 µM de Y27632, par siRNA-ROCK1 ou siRNA-ROCK2 Figure R 29 Les mouvements amoeboïdes des cellules Ba/F3p210 après traitement Y27632, siRNA-ROCK1 ou siRNA-ROCK2 Figure R 30 Analyse des mouvements (Y27632, le siROCK1 ou le siROCK2)
Figure R 31 Western-blot anti-CLM et sa forme phosphorylée
Figure R 32 Western-blot anti-phospho CLM après traitement par le Y27632, ou transfection de siRNA-ROCK1 ou de siRNA-ROCK2 Figure R 33 Analyse des mouvements cellulaires après traitement par la Blebbistatine
Figure R 34 Niveau d’expression des transcrits de la LIMK1 et de la LIMK2 mesuré par RT-PCR quantitative
Figure R 35 Western-blot à l’aide d’anticorps anti-LIMK1 et anti-LIMK2 dans les cellules Ba/F3p190, Ba/F3p210 et Ba/F3p210S509A Figure R 36 Western-blot anti-LIMK2 après traitement par 0, 2 ou 5 µM de MG132 pendant 12h
Figure R 37 Western-blot anti-phospho LIMK1 et anti-phospho-LIMK2 (Y27632, siRNA-ROCK1, siRNA-ROCK2 ou PAK1-KD) Figure R 38 Capacité de migration spontanée des cellules traitées par siRNA-LIMK1 ou siRNA-LIMK2
Figure R 39 Analyse des mouvements cellulaires après traitement par siLIMK1 ou siLIMK2 Figure R 40 Observation de la morphologie des cellules Ba/F3avec LIMK1-GFP et LIMK2-GFP Figure R 41 Mesure par RT-PCR quantitative et WB pour la cofiline1 et l’ADF/destrine
Figure R 42 Phosphorylation ADF/destrine et cofiline1
Figure R 43 Western-blot révélé à l’aide d’anticorps anti-SSH1L, anti-SSH2 et anti-SSH3
Figure R 44 Capacité de migration spontanée des cellules traitées par siRNA-ADF/destrine ou siRNA-cofiline1 Figure R 45 Capacité migratoire spontanée des cellules exprimant ADF-myc ou CFL-myc ou ADF-GFP ou CFL-GFP Figure R 46 Analyse des mouvements cellulaires après traitement par siADF ou le siCFL
6 Figure R 49 Analyse en microscopie time-lapse d’une cellule Ba/F3p210 co-exprimant l’actine-cherry
Figure R 50 Analyse par microscopie time-lapse de la localisation respective d’ADF/destrine, cofiline1 et actine dans les cellules Ba/F3p210 Figure R 51 Enregistrement en time-lapse des cellules Ba/F3p190 transfectées en (A) par l’actine-cherry et en (B) par p190bcr-abl-GFP
Discussion :
Figure C 1 Mouvements amoeboïdes d’un leucocyte observé dans une matrice de collagène fluorescente Figure C 2 Modèle de la mise en place des mobilités de type rolling et de type amoeboïde
Figure C 3 Modèle de mise en place de la mobilité de type rolling Figure C 4 Modèle de mise en place de la mobilité de type amoeboïde
Figure C 5 Modèle de rétro-activation de RhoA dans le cas de surexpression d’ADF/destrine
Matériel et Méthodes :
Figure MM 1 Plasmides utilisés pour les transfections des cellules Ba/F3 Figure MM 2 Déplétions des effecteurs de RhoA et de Rac1
Tableaux
Tableau R 1 Quantification des mouvements cellulaires
Tableau R 2 Quantification des mouvements cellulaires après traitement par l'exoenzyme C3 Tableau MM 1 Séquences des sondes pour les RT-PCR quantitatives
Tableau MM 2 Anticorps primaires utilisés Tableau MM 3 Anticorps secondaires utilisés
7
Avant-propos :
La migration cellulaire est un processus essentiel utilisé au sein de tous les organismes multicellulaires et est importante non seulement pendant le développement embryonnaire mais aussi tout au long de la vie pour la cicatrisation ou encore pendant la surveillance immunitaire. Un défaut de régulation de la migration cellulaire induit en particulier la progression des processus tumoraux dont l’invasion et la métastase des cellules cancéreuses sont les éléments les plus caractéristiques (Yamaguchi et al., 2005). L’étude des mécanismes fondamentaux de la migration cellulaire est indispensable pour mieux comprendre la biologie de ces maladies. La migration cellulaire est un processus multi-étapes qui est initié généralement par une protrusion de la membrane cellulaire suivie d’un déplacement de toute la cellule (Bailly et al., 2002).
La migration cellulaire est dirigée, dans la plupart des cas, par des signaux extracellulaires attractifs ou répulsifs. Ces signaux peuvent être des facteurs solubles qui peuvent agir à distance ou plus généralement à partir des cellules voisines (Stephens et al., 2008). Cela induit une large variété de signaux intracellulaires qui comprennent des changements dans l’organisation du cytosquelette d’actine et microtubulaire, dans le transport vésiculaire et dans la transcription (Stephens et al., 2008).
Le cytosquelette est constitué de filaments protéiques très abondants dans les cellules eucaryotes, dont les éléments sont très conservés au cours de l'évolution. En effet, certains procaryotes possèdent des protéines homologues aux protéines du cytosquelette des eucaryotes (Shih et al., 2006).
Il existe trois types de filaments dans les cellules eucaryotes. Chacun a une fonction particulière, correspondant à une échelle d'action différente, même s'il existe des interactions entre les différents types de filaments (Gordon-Weeks, 2004). Les microtubules, qui sont rigides, participent à la structure et à l'organisation globale de la cellule ainsi qu'au trafic vésiculaire (Kodama et al., 2004). L'actine, qui forme un réseau plus déformable, agit plus localement sur la membrane de la cellule et permet sa déformation. Certaines bactéries, telles que Listeria monocytogenes ou Shigella peuvent aussi utiliser l'actine de la cellule hôte pour se déplacer en polymérisant à leur surface un réseau branché de filaments, dont la structure a plusieurs points communs avec les réseaux que l'on peut observer dans les
8 vertébrés, sont aussi constitués d'un troisième de type de filament, les filaments intermédiaires, dont les fonctions sont moins bien connues mais qui semblent jouer un rôle dans le maintien de la forme cellulaire et l'ancrage des organites cellulaires. Ils interviennent aussi dans l'adhérence et la cohésion tissulaire car ils sont en relation avec les desmosomes et les hémidesmosomes (Yin et al., 2004).
Ces trois types de filaments ont des propriétés structurelles communes : ce sont des polymères constitués d'un assemblage de protéines élémentaires. Ces filaments sont très dynamiques, principalement aux extrémités où s'effectuent l'assemblage et le désassemblage de sous-unités. Ainsi, ces événements de polymérisation et de dépolymérisation permettent au cytosquelette de se réarranger très rapidement et de s'adapter aux signaux mécaniques et chimiques de l'environnement extérieur (Stephens et al., 2008).
Les premières observations de l’actine ont été réalisées en 1887 par W.D. Halliburton qui a extrait une protéine de muscles qui précipitait avec la myosine. Cette protéine a été caractérisée en 1942 par B.F. Straub qui l’a purifiée et baptisée actine. Le Dr Straub continua à travailler sur l’actine pendant de nombreuses années découvrant que l’actine liait l’ATP.
Le cytosquelette d’actine des cellules eucaryotes, qui va être particulièrement étudié dans ce manuscrit, joue donc un rôle essentiel dans le maintien de la polarité cellulaire, l’adhérence, la contractilité et la mobilité.
9
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
10
Chapitre 1 :
Rôle des petites protéines G
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
11
1/ Réorganisation du cytosquelette d’actine par les petites protéines G de
la famille Rho
La mobilité cellulaire nécessite l’existence d’un phénomène dynamique de réorganisation du cytosquelette d’actine. L’assemblage des filaments d’actine permet de former des structures membranaires en réponse à différents stimuli extracellulaires. L’étude des petites protéines G de la famille Rho, au début des années 1990, a permis d’intégrer la recherche sur la régulation du cytosquelette d’actine et celle concernant la transduction du signal à partir de récepteurs membranaires.
Le rôle de ces protéines dans l’organisation du cytosquelette d’actine a été démontré dans les études sur les cellules fibroblastiques mobiles. Ces cellules fibroblastiques, les Swiss 3T3, ont été micro-injectées avec les formes sauvages, mutantes activées ou inactivées de RhoA, Rac1 ou Cdc42. Le marquage par immunofluorescence de l’actine, la vinculine, la taline ou encore la paxilline a permis de déterminer l’action spécifique des trois petites protéines G de la famille Rho dans la réorganisation du cytosquelette d’actine, en réponse à différents stimuli.
La formation de petites protrusions en épines à la périphérie de la cellule, nommées filopodes, a été observée à la suite de la micro-injection de Cdc42G12V, la forme activée de Cdc42 (Kozma et al., 1995). Les filopodes sont des avancées de la membrane cellulaire en forme de doigt ou de fil, mesurant jusqu'à quelques micromètres de longueur et quelques nanomètres de diamètre. Leur architecture est structurée par des faisceaux parallèles de filaments d’actine (Block et al., 2008; Nagy et al., 2008). Il s’agit d’une structure dynamique formée à l’extrémité du front de migration cellulaire où elle établit de nouveaux contacts avec le substrat. Les filopodes jouent un rôle important dans l’établissement de la direction de migration des cellules (Nagy et al., 2008) (Figures I 1 et I 2).
De plus, après stimulation par Cdc42G12V, il a été observé, dans un deuxième temps, l’apparition de lamellipodes qui sont de larges avancées de membrane sur une faible épaisseur en forme de lamelle, sous-tendues par un ensemble de filaments d’actine associés en réseau. Puis, dans un délai plus long, apparait une augmentation du nombre et de la taille des fibres de stress, cables d’actine associés à de la myosine qui traversent de part en part la cellule.
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
12
Figure I 1 - Cascade des GTPases RhoA, Rac1 et Cdc42 impliquée dans l’organisation du cytosquelette des cellules Swiss 3T3 (D’après Mackay et Hall, 1998)
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
13 La micro-injection de Rac1 sous forme sauvage ou dominant positif (Rac1G12V) dans les cellules Swiss 3T3, ou la stimulation des cellules par du PDGF, de l’EGF ou de l’insuline entraîne une accumulation d’actine filamenteuse au niveau de la membrane et la formation de replis membranaires (Ridley et al., 1992a; Ridley et al., 1992b). Rac1 est également responsable de la mise en place de lamellipodes. Ces lamellipodes sont formés au front de migration cellulaire où ils dirigent la progression des cellules mobiles. La formation des lamellipodes semble être coordonnée avec celles des filopodes. Des replis membranaires, structuralement similaires aux lamellipodes mais formés sur la face dorsale des cellules adhérentes ou des leucocytes, sont également induits par Rac1 (Makino et al., 2007) (Figures I 1 et I 2).
Enfin, dans les conditions de microinjection de Rac1G12V, et de manière plus tardive, on observe l’apparition de fibres de stress accompagnées de l’agrégation de la vinculine et de la taline dans des points d’adhérence focaux (PAF).
La forme activée de RhoA (RhoAG14V) micro-injectée dans les cellules Swiss 3T3 entraine la mise en place de fibres de stress et de PAF (Paterson et al., 1990; Ridley et al., 1992a). Ces fibres en tension interagissent avec la matrice extracellulaire au niveau des PAF. Leur formation est corrélée avec une mobilité cellulaire moindre et un ancrage plus important à la matrice. L’acide lysophosphatidique (LPA) contenu dans le sérum est capable de reproduire la formation de fibres de stress et de PAF (Ridley et al., 1992a) (Figures I 1 et I 2).
En conclusion, ces résultats compilés ont permis de mettre en lumière une cascade d’activation entre les GTPases Cdc42, Rac1 et RhoA induisant séquentiellement la formation de structures membranaires distinctes. Cdc42, sous sa forme GTP, est responsable de la formation de filopodes et entraînerait l’activation de Rac1. Cette activation conduit à la formation de replis membranaires et de lamellipodes. Enfin, l’activation de Rac1 conduit à une activation de RhoA, entraînant la formation de plaques d’adhérence et de fibres de stress. Il existe un contrôle coordonné de la mobilité cellulaire par les petites protéines G de la famille Rho, à la fois sur le plan temporel et sur le plan spatial dans les fibroblastes Swiss 3T3 mais également dans d’autres types cellulaires (Malliri et al., 2003; Nobes et al., 1999) (Figures I 1 et I 2).
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
14 La migration des cellules d’origine mésenchymateuse en 2 dimensions est un processus multi-étapes qui nécessite la perte des contacts intercellulaires, le remodelage de la matrice extracellulaire et des changements dans l’organisation du cytosquelette (Raftopoulou et al., 2004; Ridley, 2001) (Figure I 3) :
•extension des lamellipodes et des filopodes, suite à l’élongation des filaments d’actine, au niveau du front de migration de la cellule
•formation de nouvelles adhérences au niveau du front de migration de la cellule •contraction du corps cellulaire, assurée par la contraction des filaments d’acto-myosine à l’arrière de la cellule
•déstabilisation des adhérences à l’arrière de la cellule
Figure I 3 : Les différentes étapes de la migration cellulaire. Cdc42 régule la direction de la migration, Rac1 induit la formation de protrusions membranaires au niveau du front de migration de la cellule et RhoA permet la contraction des filaments d’acto-myosine à l’arrière de la cellule. (D’après Raftopoulou, 2004)
RhoA, Rac1 et Cdc42 jouent donc un rôle essentiel dans ces processus de remodelage de la membrane plasmique par la régulation du cytosquelette d’actine.
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
15
2/ Les petites protéines G
2-1/ La super-famille Ras
Les petites protéines G constituent une famille d’au moins une centaine de protéines qui sont apparentées à la protéine Ras (Rat Sarcoma). Elles sont présentes depuis les eucaryotes inférieurs telle que la levure Saccharomyces cerevisiae (Rivero et al., 2001; Tanaka et al., 1998) jusqu’aux mammifères (Wennerberg et al., 2004), en passant par la drosophile, les nématodes et les plantes.
Les protéines de la super-famille Ras sont capables de lier le GDP et le GTP avec une forte affinité et possèdent une activité GTPasique intrinsèque permettant l’hydrolyse du GTP. Elles présentent entre elles d’importantes homologies de séquence qui traduisent une organisation très similaire en domaines structuraux et fonctionnels. Selon des critères d’homologie de séquence et de fonction, ces protéines ont été regroupées en cinq familles principales (Figure I 4).
La famille Ras comprend en particulier les protéines H-ras, K-ras et N-ras qui sont impliquées dans le contrôle de la prolifération cellulaire, la survie cellulaire, la différenciation, l’organisation du cytosquelette d’actine, la transcription ou encore le trafic vésiculaire (Mitin et al., 2005).
Figure I 4 : Dendrogramme de la super- famille Ras (D’après Vega and Ridley, 2008)
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
16 Les protéines de la famille Rab sont considérées comme des organisateurs du trafic intracellulaire assurant le ciblage et le transport des vésicules, leur orientation et la spécificité de leur arrimage avec une membrane cible (Grosshans et al., 2006). Les protéines de la famille Arf (ADP-Ribosylation Factor) sont particulièrement impliquées dans l’endocytose et l’exocytose, organisant la mise en place des vésicules à clathrine ou à COP (Coat Protein). Elles régulent la mise en place du bourgeonnement de ces vésicules (Donaldson et al., 2005). La protéine constituant la famille Ran (Ras-related nuclear protein) est essentielle pour la régulation de l’import mais également de l’export nucléaire de certaines protéines possédant un signal de localisation nucléaire (NLS) (Moore et al., 1991). Elles sont également impliquées dans l’organisation du fuseau durant la mitose (Kalab et al., 1999).
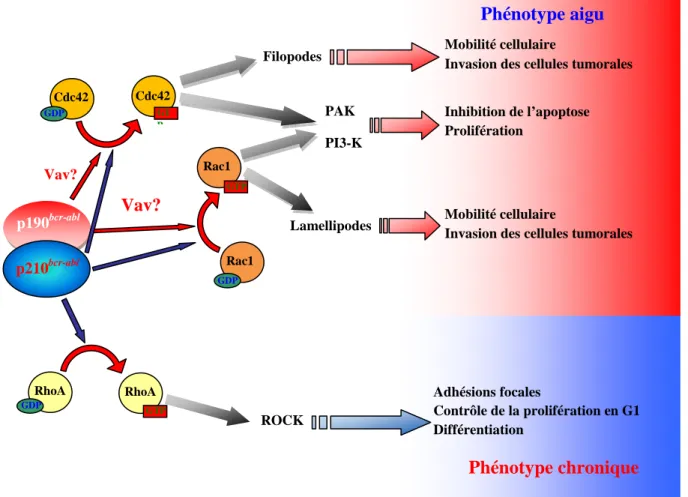
La famille Rho comprend 22 membres dont les plus connus sont RhoA, Rac1 et Cdc42Hs, nommée plus communément Cdc42 (Jaffe et al., 2005) (Figure I 4). Le premier gène de cette famille a été cloné en 1985 par Madaule et Axel dans le mollusque marin Aplysie (Madaule et al., 1985). La protéine de 192 acides aminés codée par ce gène présentait une homologie de séquence avec la petite protéine G Ras, elle a donc été nommée Rho pour « Ras Homolog ». Des protéines apparentées ont été découvertes ultérieurement dans des organismes aussi variés que la levure, la drosophile, les plantes ou l’homme. La fonction principale des petites protéines G de cette famille est de contrôler l’organisation du cytosquelette d’actine (Aspenstrom et al., 2004). Toutefois, mis à part ces effets sur le cytosquelette, les GTPases de la famille Rho agissent au niveau de nombreuses voies de signalisation, telles que l’apoptose, la prolifération ou la différenciation (Jaffe et al., 2005; Ridley, 2006).
2-2/ Mécanisme d’activation des GTPases monomériques
2-2-1/ Adressage à la membrane plasmique :
Les petites protéines G des familles Ras/Rho/Rab, bien que ne présentant pas de séquence hydrophobe, sont associées dans la cellule à des compartiments membranaires. La plupart des GTPases sont adressées à la membrane plasmique, lieu de leur activation, suite à des modifications post-traductionnelles. Synthétisées sous forme de précurseurs cytoplasmiques, elles sont modifiées afin d’assurer leur attachement à la membrane.
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
17 Les petites protéines G monomériques possèdent à leur extrémité C-terminale une séquence de type CAAX (C est une cystéine, A un résidu généralement aliphatique et X un résidu quelconque). Ce motif CAAX est modifié par l’adjonction d’un groupement isoprényl, soit farnésyl (15 carbones) pour les protéines dont le résidu X est une sérine ou une méthionine, soit géranylgéranyl (20 carbones) lorsque le résidu X est une leucine (Casey
et al., 1996; Winter-Vann et al., 2005) (Figure I 5). Les résidus AAX sont ensuite clivés
puis le résidu cystéine méthylé. Ensuite, les GTPases présentant en N-terminal de la séquence CAAX un groupement de cystéines subissent à ce niveau une palmitoylation qui augmente alors l’ancrage à des secteurs spécifiques de la membrane plasmique alors que la présence d’un groupement de résidus basiques permet l’adressage direct à la membrane (Hancock et al., 1991).
Malgré l’ancienneté de la découverte, les différences induites au niveau de la signalisation par le fait qu’une protéine soit farnésylée ou géranylgéranylée ne sont pas encore bien connues. Cependant, cette modification post-traductionnelle pourrait jouer un rôle dans la fonction des GTPases. En effet, il a été montré dans les NIH3T3 que l’expression de la protéine RhoB farnésylée participerait au pouvoir transformant de Ras, alors que géranylgéranylée, elle possèderait une activité anti-transformante (Mazieres et al., 2005).
2-2-2/ Activation des GTPases :
Les GTPases monomériques fonctionnent comme des interrupteurs moléculaires : liées au GDP, elles sont inactives, tandis que liées au GTP, elles sont actives. L’échange du GDP contre du GTP induit un changement de conformation important qui permet alors l’interaction de la GTPase avec de nombreuses protéines effectrices et l’activation de voies de transduction. Le retour à la forme inactive se fait par hydrolyse du GTP en GDP.
L’activité d’échange de nucléotide comme celle d’hydrolyse du GTP ont des vitesses intrinsèques en général très faibles. Deux grands types de protéines régulatrices contrôlent le cycle GDP/GTP : les facteurs d’échange GEF (GTP Exchange Factor) et les protéines GAP (GTPase Activating Protein). Les GEF interagissent avec les petites protéines G sous leur conformation inactive et favorisent le remplacement du GDP par le GTP. Ils sont spécifiques d’une ou plusieurs petites protéines G. Les protéines GAP, en s’associant aux petites protéines G activées, augmentent leur activité GTPasique intrinsèque et favorisent ainsi
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
18 Figure I 3 : Représentation schématique de la biosynthèse (haut), de la séquestration (milieu) et de la régulation (bas) des petites protéines G de la famille Rho.
(Cyt = cytosol ; EM = endomembranes ; ER = réticulum endoplasmique ; FT = farnésyl transférase ; GGT = géranyl-géranyl transférase ; PM = membrane plasmique ; PRR BP = protéine liant une région riche en proline)
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
19 l’hydrolyse du GTP et le retour à une conformation inactive (Figure I 5). Les protéines facteurs d’échange seront décrites plus précisément dans un chapitre ultérieur.
Pour les petites protéines G des familles Rho et Rab, il existe une troisième catégorie de protéines pouvant réguler l’activité de ces dernières : les GDI (Guanine nucleotide Dissociation Inhibitor) (Fukumoto et al., 1990). Trois activités ont été décrites pour les RhoGDI. Tout d’abord, elles inhibent l’activité d’échange de GDP contre du GTP de la protéine. Ensuite, elles ont la capacité de se lier à la forme active des GTPases, bloquant ainsi l’hydrolyse du GTP et empêchant leur interaction avec des effecteurs. Enfin, elles jouent un rôle important dans la localisation cellulaire des GTPases. En masquant le résidu hydrophobe C-terminal, les protéines GDI empêchent l’ancrage des GTPases à la membrane plasmique et maintiennent un pool de GTPases cytoplasmique. Ces GTPases monomériques sont donc cytosolubles sous forme inactive et membranaires sous forme active (Bustelo et
al., 2007) (Figure I 5). Trois isoformes de RhoGDI ont été décrites dont les spécificités de
reconnaissance pour les GTPases de la famille Rho varient (Olofsson, 1999).
De plus, il est intéressant de noter que certains effecteurs des GTPases peuvent réguler l’activité des GDI et donc créer une boucle de régulation. PAK (p21-activated kinase), un effecteur de Rac1, phosphoryle RhoGDI sur deux résidus sérine situés dans la poche de fixation du groupement isoprényl de la GTPase. Cette phosphorylation provoque le relargage de Rac1 et donc permet une activation de la GTPase par un GEF (DerMardirossian
et al., 2004). D’autres phosphorylations de RhoGDI sont responsables de l’augmentation de
l’affinité pour les GTPases et leur déphosphorylation semble nécessaire à la dissociation du complexe (Bourmeyster et al., 1996). La régulation de l’état d’activation des GTPases de la famille Rho passe donc non seulement par les trois types de partenaires que sont les GEF, les GAP et les RhoGDI, mais semble aussi passer par une boucle de régulation dépendante des effecteurs, comme cela a été démontré pour RhoGDI, Rac1 et PAK (DerMardirossian et
al., 2004).
2-2-3/ Modèle dynamique d’échange de GDP contre du GTP :
Par comparaison des structures de Ha-Ras dans les conformations inactives liées au GDP ou actives liées au GTP, il a été observé deux régions flexibles entourant le γ-phosphate du GTP : les régions Switch I et Switch II.
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
20 La région Switch I (résidus 30 à 38) est constituée d’une boucle L2 et d’un feuillet β nommé β2. La flexibilité de la boucle peut être contrôlée par la tyrosine en position 32, et la thréonine en position 35 lie spécifiquement le γ-phosphate du GTP par un pont hydrogène. La région Switch I est également le site de fixation de domaines de protéines effectrices. La région Switch II (résidus 60 à 76) est composée d’une boucle L4 et d’une hélice α2 (Figure I 6). Les résidus en position 60 et 61 interagissent avec le γ-phosphate du GTP. Chez tous les membres de la super famille Ras, les résidus 32 à 38 ainsi que la région des résidus 60 à 76 sont très conservés (Milburn et al., 1990).
Un modèle de la dynamique de l’échange GDP/GTP a été développé à partir de l’action de Tiam1 sur Rac1 (Worthylake et al., 2000). Le GEF se fixe sur deux portions rigides de la GTPase : la région située entre les feuillets β2 et β3, et sur la région Switch II. Les deux régions Switch changent alors de conformation ce qui a pour effet de déstabiliser la liaison au GDP. Par ce changement de conformation, la chaîne latérale d’un résidu situé juste en N-terminal de Switch II (le résidu Ala 59 pour Rac1) s’insinue dans le site de fixation du magnésium et la liaison du ribose avec la GTPase se défait. Le GDP est alors libéré. La place est alors libre pour la fixation du GTP qui, par ses liaisons avec la GTPase affermit le changement de conformation des régions Switch I et II, ce qui a pour effet de déstabiliser le complexe GEF/GTPase/GTP, induisant la dissociation du GEF (Figure I 5).
Figure I 6 : Emplacement des régions Switch I et II dans Rac1, Cdc42 et RhoA (représentation des structures des petites protéines G) (D’après www.cs.stedwards.edu)
Les petites protéines G de la famille Rho sont donc des interrupteurs moléculaires qui oscillent entre une forme inactive liée au GDP et une forme active liée au GTP. L’activité intrinsèque d’échange du GDP en GTP des petites protéines G de la famille Rho est très faible. L’augmentation de la vitesse d’échange est assurée par les GEFs. La majorité des protéines GEF spécifiques de la famille Rho font partie de la famille Dbl, Dbl étant le
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
21 premier membre identifié (Eva et al., 1985). D’autres GEFs ont été décrits, organisés au sein de la famille DOCK (Cote et al., 2007).
3/ La famille Dbl
3-1/ Historique :Le premier membre de la famille Dbl a été identifié lors d’un clonage d’une séquence d’ADN humain surexprimé dans un lymphome B diffus primaire. Cette séquence d’ADN transfectée entraîne la transformation des cellules NIH3T3 avec apparition de foyers cellulaires (Eva et al., 1985). Ce nouvel oncogène a été appelé dbl (Diffuse B-cell Lymphoma).
L’activité oncogénique de Dbl est obtenue par la coupure de la séquence N-terminale du proto-oncogène Dbl. Dbl contient une région d’environ 240 résidus permettant une homologie de séquence avec la protéine Cdc24 de la levure Saccharomyces cerevisiae, ainsi qu’avec Bcr produit du gène impliqué dans la Leucémie Myéloïde Chronique (Ron et al., 1991). Cdc24 coopère avec Cdc42 dans la polarisation et la sélection du site de bourgeonnement chez cette même levure. Une inactivation de Cdc24 conduit à une perte de l’activation de Cdc42. Dbl, homologue de Cdc24, semblait donc être un candidat pour la régulation de la protéine Cdc42 humaine. Hart et coll. en 1991 ont mis en évidence l’activité d’échange GDP/GTP des protéines Dbl et Cdc24 envers Cdc42.
Dbl, Cdc24 et Bcr représentaient donc les membres initiaux d’une nouvelle famille de GEF qui activent spécifiquement les petites protéines G de la famille Rho. Depuis, 69 membres distincts de cette famille Dbl ont été identifiés chez l’homme (Figures I 7 et I 8).
La région d’homologie entre Dbl, Cdc24 et Bcr est un domaine d’environ 180 acides aminés, contenant le domaine homologue à Dbl ou domaine DH (Dbl Homology) ainsi qu’un domaine adjacent en C-terminal, d’environ 100 résidus, appelé Plecktrine Homology (PH). Ce domaine en tandem porte l’activité facteur d’échange pour les petites protéines G de la famille Rho (Rossman et al., 2005).
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
22
Figure I 8 : La famille Dbl avec ces 69 membres identifiés (D’après Ren, 2005).
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
23
Figure I 7 : Protéines de la famille Dbl. Ces protéines sont toutes composées d’au moins un domaine DH/PH en tandem (les protéines soulignées sont celles qui ont une importance particulière dans ce manuscrit).
(D’après Zohn et al., 1998)
Les protéines de la famille Dbl ont toutes une activité facteur d’échange spécifique d’une ou plusieurs petites protéines G de la famille Rho. Par exemple, si Dbl est un facteur d’échange de Cdc42, son activité s’exerce également sur RhoA et Rac1, mais de manière moins efficace (Takai et al., 2001).
De façon intéressante, certaines protéines de la famille Dbl peuvent former des complexes stables avec une GTPase sans catalyser l’échange de nucléotide de cette dernière. La protéine Ost peut, par exemple, se lier uniquement avec la protéine Rac-GTP jouant ainsi le rôle d’effecteur et non pas de GEF. En effet, Ost est un GEF pour RhoA et Cdc42. Ainsi, par sa double fonction, il relie les voies de signalisation de ces trois GTPases (Horii et al., 1994; Lorenzi et al., 1999).
La famille Dbl comprend également des protéines à double activité GEF. Les protéines Sos 1/2 et Ras GEF présentent deux domaines à activité facteur d’échange. Le
SH3 SH3 RacGAP RacGAP SH3 SH2 S/T Kinase S/T Kinase DH PH S/T Kinase Abl RasGEF RasGEF RasGEF Dbl Lfc Lbc Net1 Cdc24 Scd1 Lsc Ost Dbs Tiam-1 Abr mSos1 mSos2 RasGRF Vav Ect2 Tim Fgd1 Trio Bcr-Abl Bcr
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
24 domaine à l’extrémité N-terminale est spécifique de Rac1 alors que le domaine GEF à l’extrémité C-terminale est spécifique des petites protéines G de la famille Ras, homologue de Cdc25 (Chardin et al., 1993). La présence de plusieurs domaines GEF permet d’envisager pour ce type de protéine un rôle coordonnateur des voies de signalisation impliquant les GTPases Ras et Rho (Quilliam, 2007; Roose et al., 2007).
Une autre protéine importante de ce type est Trio. Elle possède deux domaines GEF (GEF1 et GEF2) avec des spécificités différentes. Le domaine GEF1 de Trio est spécifique de RhoG, et donc permet la mise en place des voies de signalisation décrites précédemment via Rac1 (Bellanger et al., 2000; Blangy et al., 2000). Le domaine GEF2 quant à lui est spécifique de RhoA in vitro (Debant et al., 1996; Schmidt et al., 2002).
3-2/ Structure du domaine à activité facteur d’échange GDP/GTP
3-2-1/ Le domaine DH
Les premières études structurales portant sur les domaines DH ont été réalisées par cristallographie des domaines DH de Trio (Liu et al., 1998), de PIX (Aghazadeh et al., 1998), ou encore du tandem DH-PH de SoS et Dbs (Soisson et al., 1998; Worthylake et al., 2000).
Le domaine DH est composé de trois régions structurales très conservées, CR1, CR2 et CR3, séparées par plusieurs régions variables. Ces régions conservées, rapprochées dans l’espace, forment le corps du domaine DH. Elles sont constituées d’une longue hélice et sont séparées de groupes d’hélices α plus petites (Figure I 9).
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
25 Ces régions CR1, CR2, CR3 sont essentielles pour l’activité facteur d’échange, CR1 et CR3 semblant avoir une importance particulière puisqu’elles représentent les régions les plus conservées entre les protéines à domaine DH. Chez Dbl par exemple, leur importance est confirmée par le fait que la plupart des mutations dans ces régions, en particulier des résidus LLLKELL au cœur de la région CR3, abolit sa capacité transformante ainsi que son activité facteur d’échange (Hart et al., 1994).
De très nombreuses mutations ont été testées en divers points de la séquence de ces domaines DH ou de la jonction avec le domaine PH, dont les effets varient d’une perte de liaison aux GTPases jusqu’à une perte d’activité GEF complète (Feng et al., 2004; Zhu et
al., 2000a).
Une région impliquée dans un mécanisme d’oligomérisation des domaines DH de protéines GEF a été identifiée dans la région CR2 (Zhu et al., 2001). Cette oligomérisation semble être indispensable au pouvoir transformant de Dbl en augmentant le recrutement des GTPases et permettant une accélération et une coordination de l’activation de ces GTPases.
3-2-2/ Le domaine PH :
La structure du domaine PH a été obtenue par RMN et cristallographie pour les domaines PH de la Pleckstrine (Yoon et al., 1994) et de la Phospholipase Cδ1 (PLCδ1) (Ferguson et al., 1995). La structure secondaire de la Pleckstrine fait apparaître sept feuillets
β antiparallèles, disposés en deux blocs de 3 et 4 feuillets orientés de façon orthogonale, et formant ainsi un « sandwich » fermé par une hélice α située du coté carboxy-terminal. Cette
C-ter
N-ter
CR2
CR3
CR1
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
26 forme générale est conservée dans les différents domaines PH avec une variation due à la présence d’insertions, localisées principalement sur les boucles reliant les différents feuillets
β1 à β2, β3 à β4 et β6 à β7. Les boucles connectant les feuillets β2 à β3, β4 à β5 et β7 à l’hélice α C-terminale sont quant à elles très conservées entre les différents domaines PH (Figure I 10).
La liaison aux phosphoinositides est assurée au niveau de plusieurs résidus chargés positivement, aromatiques ou polaires, qui sont situés soit dans les feuillets β, soit dans les boucles les plus variables. Cette liaison aux phosphoinositides semble être différente d’un domaine PH à l’autre. Les acides aminés impliqués dans la liaison des phosphoinositides sont en général des résidus lysine ou arginine. Ces résidus établissent un lien spécifique avec les différents groupements phosphates de leurs ligands.
Chez les protéines de la famille Dbl, les domaines PH sont invariablement retrouvés en C-terminal des domaines DH. Il semble évident aujourd’hui que le tandem des deux domaines facilite l’interaction avec les Rho GTPases. En effet, plusieurs études ont montré qu’un domaine DH isolé présentait une activité facteur d’échange moindre que lorsqu’il est en tandem avec un domaine PH (Liu et al., 1998; Rossman et al., 2005). De plus, des formes tronquées dérivées des membres de la famille Dbl et ayant perdu tout ou partie de leur domaine PH ou présentant des mutations ponctuelles dans ces domaines ne sont plus capables de former des foyers cellulaires une fois exprimées dans les cellules NIH3T3 (Horii
et al., 1994; Whitehead et al., 1995).
N
β3-β4 β1-β2 β5-β6C
α1 α2Figure I 10 – Structure du domaine PH C-terminal de la pleckstrine (D’après Edlich et al., 2005)
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
27
Figure I 11 : Modèle d’activation des petites protéines G de la famille Rho par un domaine DH/PH. L’accumulation locale de phosphoinositides spécifiques à la membrane à proximité de petites protéines G de la famille Rho liées au GDP (à gauche) permet les interactions avec, par exemple, le PtdIns(4,5)P2 et le GEF pour induire la dissociation du GDP de la GTPase de la famille Rho (au centre ; la structure qui en résulte est représentée en dessous du schéma). La fixation du GTP sur la petite protéine G de la famille Rho est alors possible (à droite).
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
28 Il est à noter que la perte de la capacité transformante des protéines Lfc et Dbs par la délétion du domaine PH peut être restaurée en additionnant le domaine de ciblage membranaire de H-Ras (CAAX box), suggérant ainsi que le rôle du domaine PH est d’adresser la protéine à la membrane (Whitehead et al., 1995). Ce rôle d’adressage du domaine PH permettrait le rapprochement du domaine DH au voisinage des petites protéines G de la famille Rho, qui devront être à la membrane une fois activées (Rossman et al., 2005) (Figure I 11).
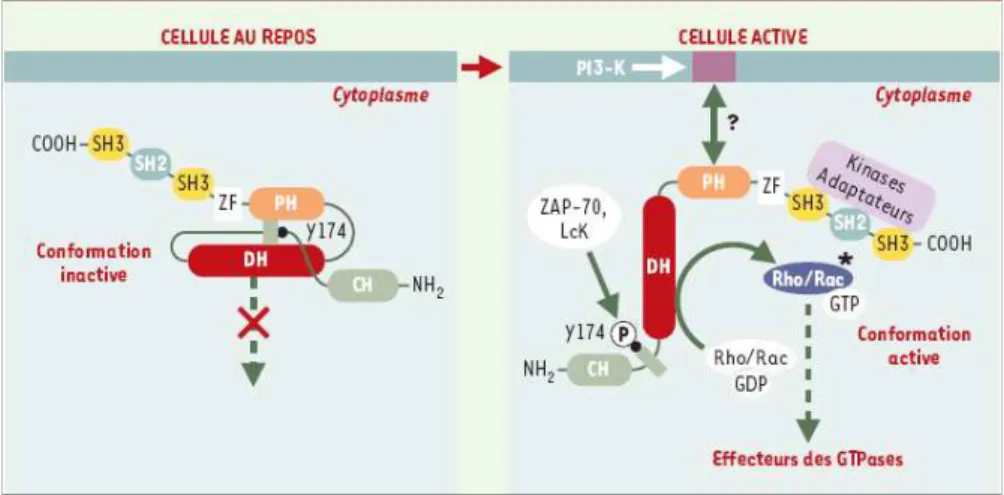
Le domaine PH a également été décrit en tant que régulateur fonctionnel du domaine DH (Das et al., 2000; Lemmon, 2005). Le domaine PH de Vav, un proto-oncogène de la famille Dbl spécifique de Rac1, semble jouer un rôle inhibiteur pour l’activation de Rac1 in
vivo. En effet, il semble que l’activité facteur d’échange de Vav sur Rac1 in vitro soit
stimulée en présence de PI3,4,5P3 et inhibée en présence de PI4,5P2. La présence du PI3,4,5P3 augmente également l’état de phosphorylation de Vav par la protéine kinase Lck in vitro (Han et al., 1998). Un modèle de régulation par les substrats et produits de la PI-3 kinase a été proposé (Das et al., 2000) (Figure I 12). Dans ce modèle, le PIP2 entraînerait l’interaction physique entre le domaine DH et le domaine PH, empêchant la liaison avec Rac1 et donc l’activité GEF. Au contraire, le PIP3 diminuerait l’affinité du domaine PH pour le domaine DH, permettant l’ouverture de la mâchoire DH/PH. Lck stabilisé sous forme ouverte peut être phosphorylé et Rac1 interagit avec le domaine DH/PH pour permettre son activation via l’échange GDP/GTP. L’hypothèse d’une régulation fonctionnelle de PH sur DH est appuyée par la présence entre les domaines DH et PH d’un coude flexible qui jouerait le rôle de charnière (Soisson et al., 1998). De plus, des mutations dans la zone charnière DH/PH entrainent l’inhibition de l’activité GEF (Zhu et al., 2000a).
Figure I 12 - Modèle de contrôle du domaine DH par le domaine PH adjacent (D’après Das et al., 2000)
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
29
4/ Les partenaires des petites protéines G de la famille Rho dans
l’organisation du cytosquelette
Nous venons de voir que différentes protéines pourvues de domaines GEF peuvent activer les petites protéines G de la famille Rho. Une fois activées, ces protéines vont à leur tour permettre l’activation de différents effecteurs.
4-1/ Rac1, Cdc42 et l’organisation du cytosquelette d’actine
Rac1 induit l’accumulation de filaments d’actine au niveau de la membrane plasmique, formant ainsi des lamellipodes et des replis membranaires (Hall, 1998). Quant à Cdc42, son activation permet la formation de filopodes (Nobes et al., 1999). De nombreux effecteurs de Rac1 et Cdc42 contribuent au réarrangement du cytosquelette d’actine en aval de l’activation de ces deux GTPases (Raftopoulou et al., 2004).
4-1-1/ Les kinases :
Les PAKs (p21 Activated Kinase) ont été les premières kinases régulées par les petites protéines G identifiées lors d’un screening de partenaires des GTPases activées dans le cytosol de cerveau de rat (Manser et al., 1995). Ces protéines sont les effecteurs directs de Rac1 et de Cdc42 mais pas de RhoA. Il existe plusieurs isoformes de PAK : PAK1 ou
αPAK, PAK2 ou γPAK et PAK3 ou βPAK, et un PAK non conventionnel appelé PAK4,
relativement proche de PAK2/γPAK. Les PAKs se lient uniquement aux formes GTP de Rac1 et Cdc42 par leurs domaines CRIB (Cdc42/Rac1 Interactive Binding) (Burbelo et al., 1995; Manser et al., 1995). In vitro, les isoformes PAK1 et PAK3 se fixent de manière identique à Rac1 et Cdc42, cependant Cdc42 sous forme GTP stimule l’activité de PAK1 de manière plus importante par rapport à Rac1 (Manser et al., 1995). Une fois activées par Rac1 et Cdc42, les PAKs peuvent activer d’autres protéines via leur activité sérine/thréonine kinase (Zhao et al., 2005).
Parmi celles-ci, les LIM Kinases, protéines à activité sérine kinase, prennent une place importante dans la signalisation induite par Rac1/Cdc42 via les PAKs (Arber et al., 1998). Les LIM kinases sont caractérisées par la présence de deux domaines LIM suivis par un domaine PDZ ainsi qu’un domaine kinase en C-terminal. A l’heure actuelle, deux
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
30 isoformes sont connus, LIMK1 et LIMK2, dont les seuls substrats connus sont les protéines de la famille ADF (Scott et al., 2007).
Les membres de la famille des Actin Depolymerizing Factors (ADF) comprenent notamment la cofiline1 et l’ADF/destrine. Leur phosphorylation sur la sérine 3 par les LIM kinases entraine l’inhibition de la liaison à l’actine F et donc de la capacité à catalyser la dépolymérisation et la coupure de l’actine F (Bamburg et al., 2008). Leurs fonctions apparaissent donc indispensables pour la dynamique de l’actine, générant de l’actine G ou de petits polymères indispensables au déclenchement ultérieur de la polymérisation de nouveaux filaments d’actine. L’action des LIMKs et de ADF/cofiline joue un rôle dans de nombreux processus qui requièrent un réarrangement rapide de l’actine (Van Troys et al., 2008) (Figure I 13).
La protéine MRCK (myotonin-related Cdc42-binding kinase) est un effecteur de Cdc42 grâce à son domaine CBD (Leung et al., 1998). Il a été montré une colocalisation de Cdc42 avec l’isoforme MRCKα à la périphérie de la cellule (Leung et al., 1998). L’expression de dominants positifs de Cdc42 ou d’un dominant positif de MRCK entrainent une augmentation de la phosphorylation de la MLC dans les cellules COS7, qui induit la formation des filopodes (Leung et al., 1998). L’activité de MRCKα, sans doute par l’intermédiaire de l’activation des protéines ERM (Ezrin/Radixin/Moesin) participe à la formation des filopodes induite par Cdc42 (Nakamura et al., 2000). De plus, MRCK peut aussi activer, tout comme ROCK, les LIM Kinases, induisant ainsi les mêmes cascades de signalisation que celles vues précédemment (Groeger et al., 2007).
La PI-4-P5 kinase est une cible plus ou moins spécifique de Rac1. La petite protéine G Rac1 sous forme GTP va interagir de manière directe avec la PI-4-P5K (Tolias et al., 1998). La PI-4-P5K phosphoryle le PI4P en PI4,5P2 qui libère des protéines de coiffe de l’extrémité des filaments d’actine comme la gelsoline ou la cofiline1, facilitant ainsi la polymérisation de l’actine pendant la formation des lamellipodes (Chatah et al., 2001) (Figure I 13). La synthèse de PIP2 par les trois isoformes de la PIP5K est contrôlée par RhoA mais aussi Rac1 et Cdc42. La régulation de la synthèse du PIP2 occupe donc une position centrale dans les voies de signalisation de ces trois petites protéines G de la famille Rho (Oude Weernink et al., 2004).
Enfin, il a été décrit l’activation par Rac1 de la PI3K, dont le substrat est le PIP2. Si les effets de cette activation sur les voies de contrôle de l’apoptose représentent un élément
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
31 majeur de cette voie [ travail collaboratif : (Rioux-Bilan et al., 2008)], la synthèse de PIP3 en réponse à Rac1 est également un élément très important dans la régulation de la mobilité cellulaire (Sidani et al., 2007; Van Troys et al., 2008).
4-1-2/ Les protéines favorisant la polymérisation de l’actine :
La protéine WASP, absente ou mutée chez les patients atteints du syndrome de Wiskott-Aldrich, est exclusivement exprimée dans les cellules hématopoïétiques (Symons et
al., 1996). Les cellules de ces patients présentaient une surface cellulaire anormalement
irrégulière, ce qui laissait présager un rôle de WASP avec le cytosquelette.
Les protéines de la famille WASP peuvent être séparées en deux groupes : les protéines WASP et N-WASP (la forme ubiquitaire), et les protéines WAVE (WASP-like Verprolin-homologous protein). Les protéines WAVE ne possèdent pas de site de liaison direct aux GTPases. Ainsi, WASP et N-WASP se lient directement à Cdc42 alors que les protéines WAVE ne présentent qu’une connexion fonctionnelle avec Rac1 (Miki et al., 1998).
Les protéines N-WASP et WAVE possèdent dans leur région C-teminale un domaine V (Verproline homologue) qui interagit directement avec les monomères d’actine, un domaine C (Central) qui lie le complexe Arp2/3, et un domaine A (Acide) qui modifie les structures tertiaires et quaternaires du complexe Arp2/3, régulant ainsi sa capacité à induire la polymérisation de l’actine (Panchal et al., 2003). Il faut noter que le domaine VCA et le domaine de liaison à Cdc42 forment une liaison intramoléculaire d’autoinhibition. La fixation de Arp2/3 n’est possible qu’à partir du moment où Cdc42 est fixé à WASP (Kim et
al., 2000). N-WASP et WAVE possèdent également dans leur région N-terminale un
domaine susceptible d’interagir avec la profiline. Cette protéine se fixe à l'actine monomérique, stimule l’échange ADP/ATP des monomères d’actine aidant à la réintégration de l'actine dans le polymère à l'extrémité + (Takenawa et al., 2007).
A la différence de WASP, responsable de la mise en place de filopodes en réponse à Cdc42, WAVE semble jouer un rôle important dans la formation des lamellipodes induits par Rac1 (Jaffe et al., 2005). En effet, il a été montré d’une part que WAVE est localisé préférentiellement au niveau des lamellipodes et d’autre part que la surexpression d’un mutant d’un domaine C-terminal de WAVE conduit à l’inhibition de la formation des replis membranaires induits par Rac1 (Miki et al., 1998) (Figure I 13).
Chapître 1 : Petites protéines G de la famille Rho et mobilité cellulaire
32
Les protéines IQGAPs (IQ motifs containing GAPs) constituent un second groupe
d’effecteurs communs à Rac1 et Cdc42. Les protéines IQGAPs sont des membres particuliers de la famille RasGAP, car aucune activité GAP n’a pu être mise en évidence à ce jour (Kuroda et al., 1996). IQGAP-1 favorise même l’état actif lié au GTP de Cdc42 (Swart-Mataraza et al., 2002). En absence de domaine CRIB, la forme GTP de Rac1 et Cdc42 est fixée par le domaine GRD (RasGAP Related Domain). IQGAP joue également un rôle dans la réorganisation du cytosquelette d’actine. Il a été observé que le complexe IQGAP/GTPases est colocalisé dans les replis membranaires, lié aux jonctions des filaments d’actine (Fukata et al., 1997). IQGAP par son activité GAP envers RhoA induit la dissociation du complexe RhoA/Dia1 pour favoriser le maintien de la polymérisation de l’actine (Brandt et al., 2007).
Figure I 13 : Voies de signalisation activées par Rac1 et Cdc42 et contrôlant la formation des lamellipodes et des filopodes. Rac1 et Cdc42 interagissent avec différentes cibles, comme la sérine/thréonine kinase PAK, la lipide kinase PIP-5 kinase, les protéines de la famille WASP/WAVE, qui sont toutes impliquées dans la réorganisation du cytosquelette d’actine.