« Réussir : c’est aller d’échec en échec sans perdre son enthousiasme » Winston Churchill
REMERCIEMENTS
Je souhaite tout d’abord remercier le Pr François Amalric, le Pr Chantal Trentesaux, le Dr Janet Hall et le
Dr Philippe Pourquier de m’avoir fait l’honneur de participer à mon jury de thèse et d’avoir accepter
d’évaluer mon travail.
Je voudrais ensuite remercier le Pr B.Salles de m’avoir accueillie, malgré les circonstances, dans son équipe au sein de laquelle j’ai découvert un environnement de travail de qualité et également d’avoir accepté avec Patrick Calsou le défi de mener une thèse à bien en deux petites années.
Ainsi, je remercie particulièrement Patrick, co-directeur de ma thèse, pour son encadrement et ses précieux conseils sur le projet NHEJ et télomère qui, je l’espère, sera concrétisé par la publication de notre travail dans EMBOJ. Je voudrais aussi le remercier pour son enseignement en biochimie et pour avoir partagé avec moi ses grandes connaissances scientifiques.
Un grand merci à Dennis Gomez, mon directeur de thèse, dans un premier temps pour m’avoir permis de réaliser cette thèse dans l’institut et dans la ville que j’avais choisis. Grâce à lui, j’ai pu concilier ma vie professionnelle et ma vie personnelle. Merci de m’avoir permis de m’intégrer très rapidement au sein de ce monde inconnu qu’était l’IPBS et de m’avoir soutenue lors des moments les plus difficiles, que ce soit à l’issue du concours comme au cours de ma thèse. Dans un deuxième temps, je le remercie de m’avoir initié aux mondes passionants des télomères et de la cancérologie et pour m’avoir transmis son savoir technique dont tous les petits trucs qui font qu’une manip marche du premier coup.
Merci à Céline Boby pour l’énorme contribution apportée au projet NHEJ et télomère et pour toutes ces mises au point qui ont été réalisées. Merci de m’avoir passé le flambeau et de m’avoir transmis la rigueur nécessaire à la réussite des essais NHEJ et surtout merci pour ta gentillesse et tout le soutien que tu m’as apporté.
Merci à Geneviève Pratviel pour le travail que nous avons effectué ensemble sur le projet « ligand » et pour l’initiation aux principes chimiques des porphyrines. Je voudrais également remercier Carmen
Romera pour sa gentillesse et la patience dont elle a fait preuve lors de nos nombreuses discussions
scientifiques au cours desquelles nous avons tenté de comprendre les mystères des interactions porphyrines-ADN.
Sébastien, comment te remercier pour tout ce que tu m’as apportée au cours de deux années de
voisinage de paillasse. Je réalise que j’ai eu une grande chance de travailler avec toi et je te remercie pour tous tes conseils, toujours avisés, pour les discussions scientifiques ou non autour de cafés salvateurs. Merci également de m’avoir permis d’exercer mon besoin de rangement en laissant un désordre constant, et pour toutes ces blagues qui je l’avoue maintenant, m’ont quand même bien fait rire quelque fois. Mais surtout, je te remercie d’avoir réussi à raviver la petite étincelle de passion qu’il me restait quand je suis arrivée dans l’équipe et enfin, merci d’avoir transformé une « collaboration » en une véritable amitié.
Merci à Cindy Iglesias pour son énergie et son sourire (comme son accent…) communicatifs. Merci pour ce soutien que tu m’as apportée au cours de cette dernière année de thèse et pour tous ces moments de fou rire.
Merci à Stéphanie Dauviller pour les mises au point initiales du test NHEJ et pour les manips de microscopie, merci également à Christine Delteil pour les irradiations laser localisée pour le projet TRF2 in vivo. Et je vous remercie toutes les deux pour vos enseignements et pour votre bonne humeur
Thèse Oriane BOMBARDE
2009
quotidienne. Merci à Philippe Frit pour toutes ses remarques pertinentes et pour tous les léonidas qu’il m’a apportés (en attendant les prochains… ou peut-être des macarons de chez Pillon ?). Un grand merci à
Alexandre Lalo, « mon » stagiaire à qui j’espère avoir appris autant que ce qu’il m’a appris. Merci pour
l’attention que tu as porté au projet TRF2 in vivo et pour ta bonne humeur constante malgré quelques horaires un peu étendus… Merci également à Carine Froment, de l’équipe de Bernard Monsarrat à l’IPBS qui m’a permis d’entrevoir le monde de la spectrométrie de masse et d’avoir pris en charge les analyses des phosphorylations de TRF2.
Enfin, je remercie tous les membres de l’équipe B.Salles, qui m’ont permis de réaliser cette thèse dans un environnement aussi agréable qu’intéressant et pour les discussions enrichissantes que nous avons pu avoir, merci à Yoann Fedor pour ta bonne humeur, je te souhaite bon courage pour ta thèse, à Susana
Peremarti pour ta gentillesse à toute épreuve, à Gladys Mirey, Elisa Boutet et Saleha Haschim pour votre
sympathie.
Je souhaite également remercier l’équipe IGC dans laquelle j’ai fait mes premiers pas à l’IPBS et au sein de laquelle j’ai passé de très bons moments. Un grand merci aux « O’Hara » , Aline, Fanny, Ludivine, Marielle et Sandrine, pour votre accueil si chaleureux dans un moment douloureux, pour leur soutien qui m’a permis de « recommencer » ma thèse dans de bonnes conditions et pour les soirées que nous avons partagées.
Merci à mes amis, précieuse soupape de décompression… Fanny, merci pour toutes ces journées que tu as égayées et pour cette « plaque » que l’on a partagée et que l’on partagera encore, en fait, un énorme merci, tout simplement, pour ton Amitié, Claire Labrune, merci pour ton humour et ces loulou-meeting internationaux ou nationaux mythiques, Fred, merci pour ta gentillesse et tous ces moments que nous avons partagés, tu a été pour moi un exemple d’organisation, de pugnacité et d’honnêteté, Claire
Labonde, merci d’avoir supporté toutes mes plaintes de fin de thèse et pour ton dynamisme
communicatif, Marine, Mika et Mathieu, merci pour tous ces moments euphorisants qui m’ont permis de m’évader et de me régaler (clin d’œil au banofee de Marine…), le club des « Albigeois », merci pour toutes ces bouffées d’oxygène et de m’avoir accueillie les bras ouverts dans le sud de la France et enfin,
Gaby et Hélène, merci pour cette amitié sans faille qui traverse les années et résiste à tous ces kilomètres
qui nous séparent désormais…
Je remercie également ma famille sans qui rien n’aurait été possible et notamment ma maman et ma
sœur qui m’ont offert un soutien inconditionnel et sans limite. Merci de m’avoir fait confiance même dans
les moments où mes choix semblaient plus qu’approximatifs et surtout merci d’avoir toléré et pardonné toutes mes sautes d’humeur, mes oublis et mon absence, trop prolongée, au cours des trois dernières années.
Enfin, merci à Benoît qui a eu la tâche difficile de partager ma vie pendant ces trois dernières années et qui s’est même risqué à emmenager avec une thésarde en dernière année. Merci pour ta patience, ton soutien, tes conseils toujours très avisés et objectifs, et bien sûr pour toute l’affection que tu m’as apportée tout au long de cette épreuve sans laquelle je n’aurai sans doute pas réussi, cette thèse est aussi la tienne.
SOMMAIRE
NTRODUCTION GENERALE
...
3
I. Les télomères ... 3
a. Rôle dans la protection du génome ... 3
b. Fonction : horloge biologique ? ... 4
II. Maintien de la séquence télomérique ... 8
a. La télomérase ... 8
- Historique ... 8
- Structure de la télomérase ... 8
- Régulation de l’activité télomérase ... 12
- Adressage au niveau des télomères ... 13
- Maladies associées aux télomères... 14
b. Le mécanisme ALT... 15
- Historique et présentation ... 15
- Mécanismes ... 17
c. Les TERRA : nouvelle voie dans la régulation des télomères ... 18
III. Maintien de la protection des télomères ... 20
a. Le « capuchon » télomérique ... 20 - Les protéines TRF1/TRF2 ... 21 - La protéine RAP1 ... 23 - La protéine TIN2 ... 25 - La protéine TPP1 ... 26 - La protéine POT1 ... 26
- Les autres protéines associées aux télomères ... 27
b. Implication des protéines du complexe shelterin dans la stabilité télomérique ... 29
Thèse Oriane BOMBARDE
2009
- Répression du signal « dommages à l’ADN » au niveau des télomères ... 30
PARTIE 1:
...
38
Etude des propriétés biochimiques et pharmacologique d’un nouveau ligand des
G-quadruplex
...
38
INTRODUCTION ... 39
I. Stratégies thérapeutiques ciblant la télomérase ... 40
a. hTERT ... 40
- Expression d’un dominant négatif de hTERT ... 40
- Inhibition de la transcription de hTERT ... 40
- « inactivation » de l’ARNm de hTERT ... 41
- Inhibition des modifications post-traductionnelles ... 41
- Inhibition de la translocation nucléaire ... 42
- Inhibition de son activité catalytique ... 42
b. hTR ... 42
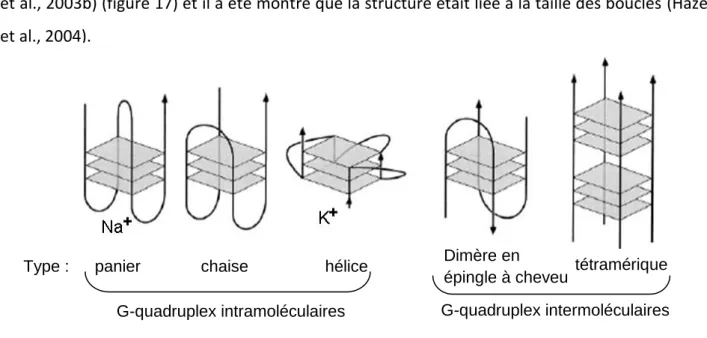
II. Les structures en G-quadruplex ... 44
a. Structure ... 44
b. Existence in vivo des G-quadruplex ... 46
c. Les protéines reconnaissant les G-quadruplex ... 47
- Les hélicases et topoisomérases ... 47
- Résolvases ... 48
- Nucléases ... 48
- Autres protéines fixant les G4 ... 49
d. Fonction des G-quadruplex ... 49
e. G-quadruplex aux niveaux des télomères ... 51
f. G-quadruplex au niveau d’autres régions dans le génome ... 51
- Les promoteurs de gènes ... 51
- Les régions « switch » des immunoglobulines ... 53
- Les régions répétées du rDNA et du centromère ... 53
III. Le télomère : une cible dans la thérapie contre le cancer ? ... 54
a. Stratégies ciblant les protéines associées aux télomères ... 55
b. Les G-quadruplexes : cibles anti-cancéreuses ? ... 55
MATERIEL et METHODES ... 39
Extraits CHAPS ... 61
Test TRAP ... 61
Test TRAPG4 ... 62
Test de croissance cellulaire à court terme ... 63
Test de croissance à long terme ... 63
Immunofluorescence anti-γH2AX ... 63
Analyse de la structuration du simple brin télomérique in vitro ... 64
Gel retard POT1-ADN télomérique ... 64
Extraction d’ADN génomique ... 65
Longueur de la longueur télomérique : TRF ... 65
Présence du simple brin télomérique ... 66
RESULTATS ... 62
1. Le ligand ID3-010 inhibe l’élongation par la télomérase in vitro par test TRAP ... 69
2. Effet du ligand ID3-010 sur la croissance cellulaire à court terme ... 72
3. Effet du ligand ID3-010 sur la croissance cellulaire à long terme ... 74
4. Analyse de la longueur télomérique dans les cellules traitées à long terme ... 75
5. Analyse des dommages provoqués par un traitement avec la molécule ID3-010 ... 76
6. Analyse de la présence du simple brin télomérique dans les cellules traitées à long terme ... 77
7. Structuration de l’extension 3’ d’ADN télomérique simple brin ... 78
8. Déplacement de la protéine POT1 par stabilisation des G4 in vitro ... 79
Thèse Oriane BOMBARDE
2009
PARTIE 2 :
...
82
Mécanismes de protection des télomères
...
82
INTRODUCTION ... 84
I. Les cassures double-brin de l’ADN ... 85
a. Origine exogène ... 85
- Les radiations ionisantes ... 85
- Les agents chimiques ... 86
b. Origine endogène ... 86
II. Les mécanismes de réparation des CDB ... 88
a. Réparation des CDB par recombinaison homologue ... 89
- Recombinaison homologue ... 89
- Réparation des CDB par Single-strand Annealing (SSA) ... 90
b. Réparation des cassures double brin de l’ADN par NHEJ ... 91
- Le mécanisme C-NHEJ ... 91
- Les voies alternatives de la NHEJ ... 99
III. Interaction fonctionnelle entre les télomères et les protéines de réparation et de signalisation ... 104
a. les protéines de C-NHEJ et Télomères ... 105
- l’hétérodimère KU... 105 - DNA-PKcs... 106 - DNA-LIGIV ... 107 - ARTEMIS ... 107 - XRCC4/CERNUNNOS-XLF ... 108 - PARP-1 et 2 ... 108 b. Le complexe MRN et Télomères ... 108
- Werner ... 110
- ATM ... 110
- ATR ... 111
RESULTATS ... 86
DISCUSSION CONCLUSIONS et PERSPECTIVES ... 152
1. Orientation des séquences télomériques : ... 155
2. L’activité kinase de la DNA-PKcs est-elle impliquée dans la protection des télomères ? ... 157
3. Microhomologies et fidélité de la réparation: ... 157
4. Fonction de la PARP-1 dans la B-NHEJ ... 159
5. Importance de la fonction de la protéine KU aux télomères ... 160
6. Pertinence de nos résultats par rapport aux données cellulaires ... 161
CONCLUSION GENERALE
...
163
Abréviations
aa : acides aminés
ADN : acide désoxyribonucléique
ADNc : acide désoxyribonucléique complémentaire ALT : Alternative lengthening of telomere
APB : Aternative PML Bodies ARN : acide ribonucléique
AT : syndrome d’Ataxia Telangiectasia ATM : Ataxia Telangiectasia Mutated ATR : ATM Rad3-Related protein
b : base
BLM: Bloom
B-NHEJ : Backup NHEJ
BRCA1 : Breast Cancer Associated Protein 1 BRCT: BRCA1-Carboxyl Terminal
c : cytosine
CDB : Cassure double brin de l’ADN CDK : cyclin dependant-kinase
CHAPS : 3-[3-(Cholamidopropyl)diméthylammonio]-1-propanesulfonate ChIP : Chromatine ImmunoPrecipitation
Chk : Checkpoint Kinase c-myc : myeloncytomastosis C-NHEJ : classical NHEJ D-loop : displacement loop
DNA-PK : DNA-dependent protein kinase DNA-PKcs : DNA-PK catalytic subunit dNTP: desoxynucleotide triphosphate EDTA: ethylenediamine tetra-acetic acid EGTA : ethylene glycol tetra-acetic acid ERCC : Excision repair cross-complementing Fen-1 : Flap endonuclease 1
FISH : fluorescence in situ hybridization
g : guanine
G4 : G-quadruplex
hEST1 : human Ever Shorter Telomere1 HSP : Heat Shock Protein
hTERT : human Telomerase Reverse Transcriptase hTR : human Telomerase RNA component
kb : kilobase
LIGIV : ligase IV
MDC1 : Mediator of DNA damage Checkpoint MEF: Mouse Embryonic Fibroblast
MMEJ: Microhomology-Mediated End-Joining MNase: Microccocus Nuclease
Mre11 : Meiotic Recombination 11 MRN : MRE11/RAD50/NBS1
Thèse Oriane BOMBARDE
2009
NHEJ : non-homologous end-joining p53 : Tumor protein 53 kDa
PARP : poly(ADP-ribose) polymerase pb : paire de bases
PCR: polymerase chain reaction PD : doublement de population PI-3K : phosphatidylinositol 3’kinase PKB : Protein Kinase B
PKC : Protein Kinase C
PML : Promyelocytic Leukemia PNK : Polynucleotide kinase POT1 : Protection Of Telomere 1 pRb : protéine du Rétinoblastome RH : recombinaison homologue RI : radiations ionisantes RPA : replication protein A SCE : Sister Chromatid exchange
SCID : Severe Combine Immunodeficiency shRNA : short hairpin RNA
siRNA : small interfering RNA SSA : Single-Strand Annealing SV40 : Simian Virus 40
SVF : sérun de veau fœtal
t : thymine
TBE : Tris-Borate-EDTA
TERRA : TElomeric Repeats containing RNA TIF : Telomere-dysfunction Induced foci TIN2 : TRF1-Interacting Nuclear factor 2 T-loop: telomeric loop
TRAP: Telomeric Repeat Amplification Protocol TRF1 : Telomeric Repeat-binding Factor 1 TRF2: Telomeric Repeat-binding Factor 2 TRFH: TRF Homology domain
UV: ultraviolet
WRN : protéine Werner
XRCC : X-ray Cross Complementing γH2AX : H2AX phosphorylée
1
Préambule
En France, l’apparition de nouveaux cas de cancers est d’environ 320 000 par an et en 2010, le cancer deviendra la première cause de mortalité dans le monde selon l’OMS. Dans le domaine de la recherche contre le cancer, les grands enjeux de la recherche fondamentale consistent d’une part à comprendre les mécanismes à l’origine des cancers et notamment les causes de l’instabilité génétique, et d’autre part à identifier des cibles pour la mise au point de nouveaux traitements.
Ces deux aspects, instabilité génétique et nouvelle cible thérapeutique, se retrouvent dans les études concernant les télomères. Les télomères sont les structures spécialisées qui protègent les extrémités chromosomiques. En effet, la fonction télomérique est doublement impliquée dans la formation des cancers : la déprotection des télomères conduit dans certains cas, à une forte instabilité chromosomique à l’origine de translocations et autres événements de fusions-cassures, mais également, le maintien de la longueur télomérique par l’enzyme spécialisée Télomérase est à l’origine de l’acquisition du potentiel de division illimité des cellules cancéreuses, indispensable à leur prolifération.
Une forte instabilité chromosomique peut conduire à la transformation d’une cellule saine en une cellule cancéreuse. Le maintien de la stabilité du génome est assuré par des mécanismes de surveillance et de réparation qui vont répondre à des attaques endogènes et exogènes altérant l’ADN. Parmi ces mécanismes, on retrouve notamment les mécanismes de réparation des cassures double brin de l’ADN, lésion la plus délétère du génome des cellules. Chez les mammifères, le mécanisme de réparation principal des cassures double brin est le mécanisme de jonction des extrémités non homologues (NHEJ : Non-Homologous End-Joining).
Le télomère est également impliqué dans l’instabilité chromosomique, et il est devenu l’objet de recherches importantes au cours des vingt dernières années. Les télomères sont composés d’ADN télomérique riche en G double brin suivi d’une extension 3’ simple brin et de protéines associées spécifiquement composant le complexe nommé « shelterin ». La stabilité des télomères a été associée à la formation d’une structure particulière appelée T-loop dans laquelle l’extrémité simple brin envahit le duplex télomérique, masquant l’extrémité du chromosome aux mécanismes de reconnaissance des cassures double brin. Plus récemment, d’autres mécanismes ont été impliqués dans la protection télomérique. En effet, les protéines associées spécifiquement au niveau des télomères jouent un rôle dans l’inhibition des mécanismes de
Thèse Oriane BOMBARDE
2009
2
détection des cassures double brin. D’autres protéines ont également un rôle dans la stabilité des télomères. De façon inattendue, les protéines clé du mécanisme NHEJ, KU et DNA-PKcs, sont également impliquées dans le maintien de la stabilité télomérique. En plus d’une interaction physique entre ces protéines et des protéines du complexe shelterin, leurs déplétions entrainent une déstabilisation des télomères. Comment les télomères sont normalement soustraits aux mécanismes de ligature des cassures double brin de l’ADN et par quels mécanismes sont-ils ligaturés dans certaines circonstances pathologiques sont deux questions abordées au cours de cette thèse.
La chirurgie, la radiothérapie, la chimiothérapie, l’hormonothérapie, l’immunothérapie, seules ou associées entre elles constituent les principaux traitements utilisés contre le cancer. Certains de ces traitements sont difficiles à supporter du fait des effets secondaires. En effet, les traitements chimiques sont dirigés contre des fonctions cellulaires impliquées dans la survie et la prolifération, atteignant les cellules cancéreuses mais également les cellules saines en forte prolifération telles que les cellules de la moelle osseuse. Or, la télomérase, une enzyme reverse transcriptase, possédant son propre ARN matrice est capable d’allonger la séquence télomérique et elle est absente dans la plupart des cellules somatiques. Ainsi, ces données font de la télomérase une cible intéressante dans les thérapies anti-cancéreuses. Pour bloquer l’action de la télomérase, plusieurs stratégies ont été proposées. L’une d’entre elles suggère de bloquer l’accès à son substrat en le stabilisant par une interaction entre des petites molécules et des structures particulières qui peuvent se former sur l’ADN télomérique. Le développement de ces molécules fait actuellement l’objet de recherches intenses afin de mettre au point une molécule spécifique ciblant le plus grand nombre de lignées cancéreuses et adaptable en pharmacologie. Cet aspect de recherche finalisée a aussi été abordé au cours de cette thèse.
Ce manuscrit contient d’abord, un résumé des études concernant la stabilité télomérique, dont les mécanismes de maintien de la longueur télomérique et les mécanismes par lesquels la protection télomérique est assurée. Ensuite, le manuscrit est divisé en deux grandes parties : une première partie est consacrée à l’étude des capacités d’une molécule originale à inhiber la télomérase en vue d’une application pharmacologique antitumorale et dans une deuxième partie sont abordées les relations fonctionnelles existant entre les mécanismes de réparation des cassures double brin de l’ADN et les télomères.
INTRODUCTION
GENERALE
Thèse Oriane BOMBARDE
2009
3
I. Les télomères
Les études de H.J. Muller sur les chromosomes de la Drosophile ont donné naissance au concept de télomère en 1938. Muller a montré que les extrémités des chromosomes interagissent rarement avec les extrémités issues de cassures de l’ADN radio-induites. Ainsi, il proposa que les extrémités des chromosomes possèdent une structure particulière appelé télomères du grec telos (fin) et mere (segment). Ce concept ne désignait pas seulement l’extrémité physique des télomères mais plutôt « un gène terminal avec une fonction particulière qui est ancré à l’extrémité », le télomère est alors défini comme une région stable, non -recombinogène.
a. Rôle dans la protection du génome
Dans les cellules eucaryotes les extrémités chromosomiques sont protégées de la dégradation, des fusions et de la recombinaison illégitime par un complexe nucléoprotéique appelé le télomère. Ainsi, de par son rôle prépondérant dans le maintien de la stabilité génomique, le télomère joue un rôle essentiel dans le maintien du pouvoir prolifératif (pour revue, (Greenberg, 2005)). D’autre part, le télomère est également impliqué dans l’organisation spatiale du noyau et la séparation des chromosomes pendant la division cellulaire (Kirk et al., 1997).
Chez les différentes espèces étudiées, la séquence télomérique est formée par la répétition en tandem de courts motifs d’ADN de 6 à 8 pb et dont l’un des brins est riche en guanine (G) (tableau 1).
Tableau 1 : Structure primaire des télomères dans différentes espèces (d’après Wellinger and Sen, 1997)
Protozoaires Tetrahymena T2G4 Oxytricha T4G4 Euplotes T4G4 Stylonychia T4G4 Trypanosoma T2AG3 Plasmodium T2[T/C]AG3 Champignons Neurospora T2AG3 Saccharomyces (TG)1-6TG2 Plantes Arabidopsis T3AG3 Nicotiana T3AG3 Invertébrés Ascaris T2AG2C Caenorhabditis T2AG2C Vertébré Homo sapiens T2AG3
4
De plus, chez tous les organismes étudiés, une extension 3’ simple brin, élongation du brin riche en G, a été mise en évidence (Wellinger and Sen, 1997). La conservation relative de la séquence et en particulier, la conservation de la structure peut être liée directement à la conservation de sa fonction.
Chez l’Homme, la séquence télomérique est formée par la répétition du motif 5’-TTAGGG-3’. La longueur de la partie double brin peut varier entre 5 et 15 kb (Moyzis et al., 1988) et elle présente une extrémité 3’ simple brin d’une taille d’environ 200 à 300 pb (Makarov et al., 1997)(figure 1).
Ces séquences d’ADN sont non seulement associées à des protéines spécifiques des télomères, les protéines du complexe nommé « shelterin » (de Lange, 2005) ou télosome (Xin et al., 2008) : les protéines TRF1, TRF2, POT1, Rap1, TPP1 et TIN2, mais également à d’autres protéines importantes pour sa stabilité. La plupart de ces protéines ont été identifiées pour une fonction autre que celle exercée au niveau des télomères et en particulier, dans les mécanismes de réparation des cassures de l’ADN.
b. Fonction : horloge biologique ?
En absence d’un mécanisme de maintien de la longueur télomérique, chaque division cellulaire entraîne un raccourcissement du télomère qui aboutit à terme à une entrée des cellules dans une étape finale de différenciation appelée sénescence réplicative. La sénescence réplicative a été définie à l’origine par les travaux de Hayflick qui a montré que des fibroblastes humains en culture avaient un pouvoir prolifératif limité (Hayflick and Moorhead, 1961). Ainsi, après une cinquantaine de doublements de population, les cellules rentrent dans un état de quiescence caractérisé par des modifications morphologiques et métaboliques telles qu’un cytoplasme plus grand et granulaire et une augmentation de l’activité β-galactosidase (Dimri et al., 1995; Hayflick, 1979).
Figure 1 : Structure primaire de l’ADN télomérique humain
La séquence de l’ADN télomérique humain est composée d’une région double brin de 5 à 15 kb et d’une extension 3’ simple brin de 200 à 300 b.
TTAGGGTTAGGGTTAGGG TTAGGGTTAGGG TTAGGGTTAGGGTTAG
AATCCCAATCCCAATCCC AATC 5’ 5’ 3’ 3’ chromosome 5 à 15kb 200 à 300b
Thèse Oriane BOMBARDE
2009
5
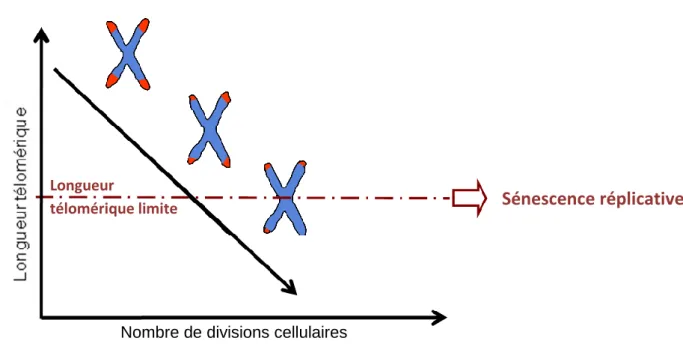
Le lien entre la sénescence cellulaire et la longueur télomérique a été proposé par Aleksei Matveevich Olovnikov. Dans ses travaux, il suggère que le raccourcissement télomérique correspond à une horloge interne qui régule le nombre de divisions cellulaires (figure 2) (Olovnikov, 1971).
Cette notion se base sur le problème de la réplication terminale qui a été évoqué par Watson en 1972 et qui résulte d’une perte d’ADN simple brin sur le brin indirect lors de la réplication alors que le brin direct peut être répliqué entièrement (Watson, 1972). En effet, la réplication s’effectue toujours dans le sens 5’-> 3’ à partir d’une amorce ARN qui est dégradée après avoir « fourni » l’extrémité 3’ libre, nécessaire aux ADN polymérases pour initier la polymérisation. (figure 3).
Figure 2 : le télomère = horloge biologique?
La taille télomérique diminue au fur et à mesure des divisions cellulaires. Lorsqu'ils ont atteint une taille télomérique limitante, les cellules entrent en sénescence réplicative.
Figure 3 : problème de la réplication terminale
Le modèle de réplication de l’ADN aboutit à une réplication totale du brin direct, un double brin à bouts francs alors que la réplication du brin indirect incomplète, un double-brin avec une extrémité 3’ sortante.
Longueur
télomérique limite Sénescence réplicative
6
Lors de l’entrée en sénescence, les cellules s’ « écartent » du cycle cellulaire au niveau de la transition G1/S (Goldstein, 1990) et entrent dans un stade appelé G0 caractérisé par des modifications physiologiques et métaboliques (Dimri et al., 1995). Les protéines p53/p21 et p16/pRb ont été impliquées dans l’induction de la sénescence (Shay et al., 1991). En effet, cette étude est basée sur l’immortalisation de fibroblastes humains par l’expression inductible d’oncogènes viraux tels que l’antigène T du virus SV40. Lorsque l’arrêt de l’expression de l’antigène T est induit, les cellules entrent en sénescence. Aussi, la transfection par un plasmide contenant l’antigène T sauvage est capable de restaurer la prolifération alors que les mutants ne contenant pas le domaine de fixation à pRb ou p53 n’en sont pas capables. Par la suite, d’autres études sont venues confirmer ce résultat. En effet, la quantité de protéine p53 est fortement augmentée dans les cellules sénescentes et son inactivation entraine une augmentation de l’espérance de vie des cellules (Itahana et al., 2001). L’une de ses cibles, la protéine p21 est également augmentée dans les cellules sénescentes et de la même façon que p53, son inactivation inhibe l’entrée en sénescence des cellules (Brown et al., 1997; Noda et al., 1994). De même, l’inactivation de la protéine pRb conduit à un prolongement de la vie cellulaire (Wei et al., 2003). On distingue la sénescence induite par le raccourcissement télomérique (la sénescence réplicative) de la sénescence induite par des stress environnants tels que le stress oxydatif, la sénescence extrinsèque (Ben-Porath and Weinberg, 2004). Ces deux mécanismes de sénescence ne sont toutefois pas indépendants l’un de l’autre, étant donné que les stress cellulaires peuvent aboutir à un raccourcissement télomérique (von Zglinicki, 2002).
Il a également été démontré que dans les cellules sénescentes, la protéine p53 est phosphorylée selon le profil observé lors de la réponse aux dommages de l’ADN (Webley et al., 2000). De plus, l’activité de la protéine ATM, impliquée dans la reconnaissance des dommages, est également élevée dans les cellules en sénescence (Herbig et al., 2004). En parallèle, l’équipe de SP. Jackson démontre que des fibroblastes humains sénescents présentent des marqueurs caractéristiques des cellules contenant des dommages à l’ADN (d'Adda di Fagagna et al., 2003). En effet, ils mettent en évidence dans les cellules sénescentes des foci γH2AX qui colocalisent avec des facteurs impliqués dans la réparation de l’ADN et dans les checkpoints : 53BP1, MDC1 et NBS. Cette étude montre également que les cellules sénescentes contiennent les formes activées des protéines kinases impliquées dans les checkpoints : Chk1 et Chk2.
Thèse Oriane BOMBARDE
2009
7
Toutes ces données indiquent que les cellules en sénescence présentent des caractéristiques moléculaires semblables à une activation des voies de reconnaissance des dommages ADN, ce qui est cohérent avec l’arrêt du cycle cellulaire observé en G1/S (Colman et al., 2000).
D’un autre coté, l’équipe de Titia de Lange démontre l’importance de la stabilité des télomères dans la stabilité génomique (van Steensel et al., 1998). En effet, l’expression d’un dominant– négatif de la protéine télomérique TRF2 dans des cellules de fibrosarcomes humains conduit à une instabilité chromosomique caractérisée par des fusions et des ponts anaphasiques. De plus, l’expression de la forme mutante de TRF2 conduit à un arrêt du cycle cellulaire qui possède les caractéristiques de l’entrée en sénescence. C’est également à partir des résultats de cette étude qu’est apparue l’idée que la structure du télomère plus que la longueur télomérique, est importante pour sa stabilité. En effet, les fusions chromosomiques s’effectuent entre des télomères ayant conservé les séquences télomériques.
Enfin, en 2003, l’immunoprécipitation de la chromatine dirigée contre γH2AX suivie d’une hybridation sur des puces à ADN représentant l’ensemble du génome, indique que les télomères seraient reconnus comme des dommages de l’ADN et que les télomères dysfonctionnels seraient impliqués dans l’induction de la sénescence (d'Adda di Fagagna et al., 2003). En parallèle, une autre équipe démontre que la sénescence induite par l’expression du dominant-négatif de TRF2 dans les fibroblastes humains est associée à l’apparition de foci contenant les facteurs de réponse aux dommages de l’ADN telles que 53BP1, γH2AX, ATM au niveau des télomères. De plus, la présence de ces foci est modulée par les kinases essentielles à la réponse des dommages à l’ADN : ATM, ATR et DNA-PKcs (Takai et al., 2003).
Ainsi, les télomères dysfonctionnels semblent être reconnus comme des cassures de l’ADN par la cellule et provoqueraient l’entrée en sénescence des cellules.
L’entrée en sénescence peut être « shuntée » par l’inactivation des protéines p53 et pRb (Itahana et al., 2004). En effet, les fibroblastes humains provenant de patients atteints du syndrome de Li-Fraumeni (hétérozygote pour la protéine p53) peuvent court-circuiter la sénescence lors d’une mutation ou de la perte de l’allèle sauvage p53 restant (Rogan et al., 1995) et l’inhibition de la protéine p53 par l’expression d’un dominant-négatif permet aux cellules humaines de contrecarrer l’entrée en sénescence (Bond et al., 1994). De plus, il a été montré grâce à l’expression de protéines p53 ou p16 par lentivirus dans des cellules sénescentes, que la protéine
8
p53 correspond à une première barrière conduisant l’entrée des cellules en sénescence et que p16 constitue une deuxième barrière à la prolifération illimitée des cellules humaines (Beausejour et al., 2003). Les cellules qui n’entrent pas en sénescence, atteignent alors une seconde phase caractérisée par une forte instabilité génomique conduisant à des cycles fusions-cassures au cours des divisions cellulaires. Cet état appelé crise cellulaire conduit dans la majorité des cas, à la mort cellulaire (Shay and Wright, 1989). Cependant, dans certains cas, cette instabilité génomique conduit à l’activation de mécanismes permettant la survie de la cellule tels que la ré-activation de la télomérase, aboutissant au maintien de la longueur télomérique et donc à une immortalisation cellulaire (Counter et al., 1992).
II. Maintien de la séquence télomérique
a. La télomérase
- Historique
En 1985, un laboratoire fait une découverte majeure, qui a permis à Elisabeth Blackburn et ses collaborateurs d’obtenir le Prix Nobel de Médecine 2009 : en effet, une enzyme capable d’ajouter des séquences TTGGGG in vitro sur une amorce simple brin synthétique est identifiée chez Tetrahymena thermophila (Greider and Blackburn, 1985): la télomérase. Dans cet organisme, 2.104 nouveaux télomères sont formés aux extrémités de minichromosomes au moment de la fragmentation du noyau. Afin de synthétiser tous ces télomères, l’activité enzymatique est donc très importante, ce qui a facilité sa purification. L’activité télomérase a ensuite été mise en évidence dans de nombreux autres organismes. En effet, grâce à un essai d’élongation in vitro avec des extraits cellulaires, une activité télomérase a été mise en évidence chez Oxytrichia, les Euplotes (Shippen-Lentz and Blackburn, 1989; Zahler and Prescott, 1988) et chez la levure (Kramer and Haber, 1993). Puis, elle a été mise en évidence chez l’Homme, d’abord dans les cellules tumorales HeLa (Morin, 1989), puis dans des leucocytes issus de personnes saines et de patients atteints de leucémie (Broccoli et al., 1995).
- Structure de la télomérase
La télomérase est un complexe ribonucléoprotéique fonctionnant comme une transcriptase inverse grâce à son propre ARN matrice qui lui permet de synthétiser de nouvelles répétitions télomériques (figure 4). Deux de ces sous-unités sont suffisantes pour reconstituer in vitro
Thèse Oriane BOMBARDE
2009
9
l’activité de la télomérase (Lustig, 1999; Masutomi et al., 2000) : ce sont la sous-unité protéique qui porte l’activité catalytique de la télomérase : hTERT chez l’Homme, EST2 chez la levure et l’ARN matrice : hTR chez l’Homme (codé par le gène hTERC) et TLC1 chez la levure.
La sous-unité catalytique : TERT
Tous les membres de la famille TERT contiennent les 7 motifs conservés de la transcriptase inverse du VIH dans leur région centrale (Nakamura et al., 1997). Comme les autres polymérases, la protéine TERT contient une triade catalytique très conservée dont la mutation détruit l’activité catalytique de la protéine (Lingner et al., 1997b). Récemment publiée, la structure cristallographique de Tribolium castaneum révèle un domaine structural en « main droite » caractéristique des polymérases, dans lequel les « doigts » et la « paume » sont composés des motifs transcriptase inverse et le « pouce » serait formé par le domaine C-terminal (Gillis et al., 2008). La région N-terminale de TERT contribue aux propriétés uniques de la télomérase telles que son association à la matrice ARN, la fixation d’autres composants protéiques et la modulation de sa processivité (Gillis et al., 2008; Jacobs et al., 2006) (pour revue (Autexier and Lue, 2006)).
La sous-unité ARN
La partie ARN a été clonée dans plusieurs organismes différents et montre une variabilité tant dans la longueur et la séquence, que dans la structure. Cependant, ils ont tous en commun une petite séquence matrice complémentaire des séquences télomériques ainsi que quatre domaines conservés au cours de l’évolution : le domaine pseudo-nœud, essentiel à son assemblage avec la sous-unité catalytique (Gilley and Blackburn, 1999), les domaines CR4-CR5 et Figure 4: Représentation schématique de la télomérase humaine (Smogorzewska et al., 2004)
La télomérase est constituée par une partie ARN codée par hTERC et une sous-unité protéique codée par hTERT. A elles-deux, elles permettent de reconstituer l’activité télomérase. Le complexe télomérase regroupe d’autres protéines telles que Est1 et la dyskérine.
10
CR7 qui sont tous les deux impliqués dans sa stabilisation, sa localisation cellulaire et son assemblage avec TERT, et le domaine à boîte H/ACA à l’extrémité 3’, impliqué dans sa maturation (Autexier and Lue, 2006). Chez l’Homme, hTR comporte 41 nucléotides dont 11 constituent la matrice pour la synthèse des séquences télomériques (Chen et al., 2000a) (figure 5).
L’ARN de la télomérase est transcrit par l’ARN polymérase II et il est stabilisé par son association avec un groupe de protéines impliquées dans l’accumulation des petits ARN nucléolaires (snoRNA) et les petits ARN des corps de Cajal (Collins, 2008) : les protéines GAR1, NOP10, NHP2 et la dyskérine (Mitchell et al., 1999) dont l’implication dans la maladie Dyskeratosis congenita a été démontrée.
Les autres composants du complexe télomérase
En plus de ces deux constituants, des études biochimiques et génétiques ont permis d’identifier d’autres sous-unités du complexe de la télomérase qui vont intervenir dans l’assemblage, la conformation et la localisation nucléaire de la télomérase (Beattie et al., 2001; Weinrich et al., 1997) (pour revue,(Cong et al., 2002)). Ces protéines sont très étudiées chez la levure S.cerevisiae. Les protéines Est1 et Est3 chez S.cerevisiae sont indispensables à l’élongation du télomère in vivo (Lendvay et al., 1996; Lundblad and Szostak, 1989). Cependant, des extraits préparés à partir de cellules ne possédant pas ces protéines contiennent une activité télomérase, leur attribuant un rôle de régulation (Lingner et al., 1997a). La protéine Cdc13 a été montrée comme se fixant au simple brin télomérique et elle interagit avec Est1 (Pennock et al., 2001).
Figure 5 : Structure de l’ARN de la télomérase humaine
L’ARN de la télomérase humaine est composé de trois domaines identifiés : en violet, le domaine CR4-5, impliqué dans la stabilisation de hTR, en rouge un domaine en pseudo-nœud, essentiel à son assemblage, une boite H/ACA impliquée dans sa maturation. En jaune est indiquée la séquence matrice qui sert à l’élongation télomérique.
Thèse Oriane BOMBARDE
2009
11
Deux homologues humains de la protéine Est1, EST1A et EST1B sont associés à la télomérase (Reichenbach et al., 2003; Snow et al., 2003). La protéine EST1A semble participer au maintien de l’intégrité du télomère en modulant l’accumulation de transcrits ARN aux télomères (Azzalin et al., 2007). Des analyses structurales suggèrent que l’homologue de Est3 serait la protéine TPP1 (Lee et al., 2008; Yu et al., 2008a), une protéine du complexe shelterin.
De plus, il a été montré que l’interaction avec des protéines chaperonnes telles que HSP90 et P23 permettait l’assemblage du complexe (Forsythe et al., 2001)(Tableau 2).
Mécanisme d’action
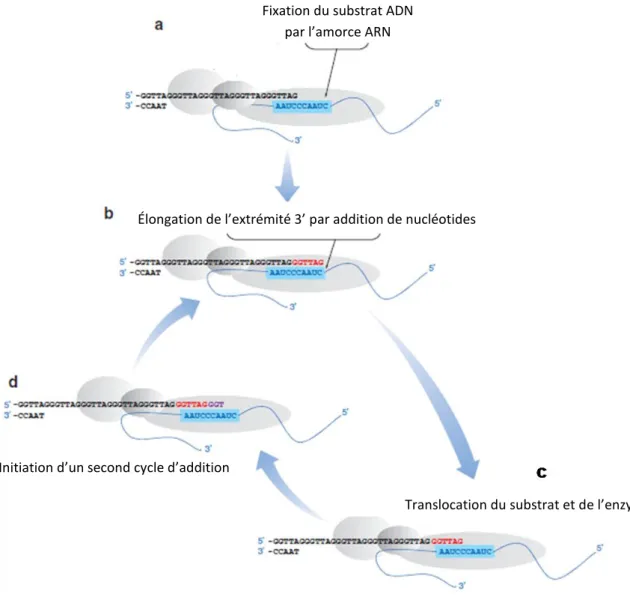
Le potentiel de division infini des cellules cancéreuses correspond à une immortalisation cellulaire et dépend d’un mécanisme d’allongement de la longueur télomérique. On en connait actuellement deux : la télomérase et un mécanisme dit « alternatif » (ALT : Alternative Lenghtening Telomere) basé sur la recombinaison homologue. L’allongement des télomères par la télomérase se déroule en trois étapes (figure 6): la reconnaissance de l’extrémité 3’, l’élongation de l’extrémité 3’ via la « rétro-transcription » de hTR et la translocation du complexe télomérase pour l’addition de plusieurs de répétitions.
Tableau 2 : Protéines impliquées dans le complexe de la télomérase (d’après Cong et al., 2002) Protéines région d'interaction fonction
associées à hTERT TEP1 aa 1-350, 601-927 inconnue P23/ p90 aa 1-195 assemblagee/ conformation 14-3-3 aa 1004-1132 localisation nucléaire associées à hTR REP1 nt 1-871 inconnue
hGAR1 domaine hTR H/ACA stabilité, maturation, localisation Dyskérine domaine hTR H/ACA stabilité, maturation, localisation
hNOP10 domaine hTR H/ACA inconnue
hNHP2 domaine hTR H/ACA stabilité, maturation, localisation C1/C1 nt 33-147 stabilité, maturation, localisation
La nt 1-205, 250-451 accessibilité aux télomères?
A1/UP1 nt 1-208 inconnue
hStau nt 64-222 accessibilité aux télomères?
12
- Régulation de l’activité télomérase
Chez l’Homme, la régulation de la télomérase s’exerce dans la plupart des types cellulaires par la régulation de la sous-unité hTERT. En effet, la sous-unité hTR est produite de façon basale dans la plupart des cellules somatiques alors que hTERT est quasi-absente (Feng et al., 1995; Shay and Wright, 2006). Ainsi, la transfection de cellules fibrosblastiques humaines par un vecteur portant l’ADNc de hTERT aboutit à leur immortalisation (Bodnar et al., 1998; Counter et al., 1998). Cependant, dans certains types cellulaires, c’est la transcription de hTR qui est limitante pour l’activité télomérase (Cairney and Keith, 2008). La régulation de hTERT se fait majoritairement au niveau transcriptionnel : en effet, le promoteur est soumis à divers mécanismes de régulations
Figure 6: modèle d’élongation par la télomérase
Une élongation de l’ADN télomérique par la télomérase nécessite plusieurs étapes:
a. La reconnaissance du substrat par la télomérase et l’hybridation de la matrice ARN au substrat. b. L’addition de nucléotides à l’extrémité 3’ télomérique se fait jusqu’à la fin de la matrice ARN c. Une translocation de la télomérase et le repositionnement de la matrice ARN de la télomérase
par rapport au substrat.
Élongation de l’extrémité 3’ par addition de nucléotides
Initiation d’un second cycle d’addition
Thèse Oriane BOMBARDE
2009
13
complexes tels que des interactions avec des activateurs transcriptionnels de type Ets1 et Ets2, Sp1… (Goueli and Janknecht, 2003; Greenberg et al., 1999; Kyo et al., 2000; Maida et al., 2002; Takakura et al., 1999; Yarden and Sliwkowski, 2001) ou des répresseurs (Crowe and Nguyen, 2001; Lin and Elledge, 2003; Oh et al., 1999). De plus, une régulation épigénétique a été mise en évidence : même si la méthylation ne semble pas être le facteur majoritaire (Dessain et al., 2000; Devereux et al., 1999), elle reste tout de même importante dans certaines lignées cellulaires (Bechter et al., 2002; Lopatina et al., 2003). De façon étonnante, l’hyperméthylation des histones pourrait même contribuer à une activation du promoteur de hTERT (Guilleret et al., 2002). D’autres modifications post-traductionnelles des histones seraient également impliquées puisqu’il a été observé une hyperacétylation des histones H3 et H4 dans des lignées télomérase-positives en plus de la méthylation de la lysine 20 de l’histone H3 (Atkinson et al., 2005). L’ARNm de hTERT est également soumis à un épissage alternatif (Hisatomi et al., 2003; Yi et al., 2001) et l’activité de la protéine est modulée par des phosphorylations (Mergny et al., 2002).
La transcription de l’ARN de la télomérase est également soumis à une régulation transcriptionnelle par interaction entre son promoteur et des facteurs transcriptionnels (Framson and Bornstein, 1993; Zhao et al., 2003; Zhao et al., 2005) et par des régulations épigénétiques (Atkinson et al., 2005).
- Adressage au niveau des télomères
L’activité de la télomérase au niveau des télomères est modulée en partie par son recrutement à l’extrémité chromosomique. Cependant, il faut différencier l’événement d’action de la télomérase et les moments où elle est retrouvée au niveau des télomères. Ces événements ont été les mieux caractérisés chez la levure S.cerevisiae. Est2 (homologue de hTERT) est associé de façon constitutive à l’ADN télomérique. La production d’ADN télomérique est forte en phase G1, diminue pendant la phase S, puis augmente de nouveau en phase S tardive. L’association en phase G1 est dépendante de l’interaction entre une boucle de 48 nucléotides de l’ARN de la télomérase avec la protéine Ku, une protéine intervenant dans la reconnaissance des cassures double brin de l’ADN, alors qu’elle est dépendante de la protéine Cdc13 en fin de phase S (Bianchi and Shore, 2008; Taggart et al., 2002). Contrairement à Est2, la protéine Est1 est associée aux télomères uniquement en fin de phase S et en G2 (Taggart et al., 2002). Il semble que la protéine Est2 soit séquestrée par son interaction via l’ARN TLC1 avec KU et au cours du cycle cellulaire, une série d’événements va conduire à un « recrutement productif » sur son site
14
d’action. Tout d’abord, l’expression de la protéine Est1 augmente quand les cellules entrent en phase S. Ensuite, lors du passage dans la phase S tardive, se produit un allongement de l’extension 3’ simple brin de façon télomérase-indépendante (Wellinger et al., 1993), permettant une augmentation de la fixation de Cdc13 (Taggart et al., 2002). Enfin la phosphorylation de Cdc13 par la kinase cycline-dépendante CDK1 facilite l’interaction avec Est1 (Li et al., 2009). En effet, Est1 s’associe à Cdc13 (Qi and Zakian, 2000) qui elle-même fixe directement le simple brin télomérique (Pennock et al., 2001). On peut donc supposer que le recrutement de la télomérase se fait via cette interaction. Cependant, un mutant de phosphorylation de Cdc13 réduit sans abolir totalement le recrutement ni l’activité de la télomérase (Li et al., 2009), ce qui suggère que des mécanismes additionnels interviennent dans cette régulation.
L’association de TERT chez les mammifères avec les télomères est également régulée en fonction du cycle cellulaire : elle est détectée en phase S uniquement (Tomlinson et al., 2006). La façon dont elle est recrutée au niveau des séquences télomériques est encore peu connue. Il a été montré que le domaine N-terminal de la télomérase était impliqué dans son recrutement au niveau des télomères. En effet, des mutations dans ce domaine rendent l’enzyme incapable d’allonger les télomères in vivo malgré la conservation de son activité catalytique (Armbruster et al., 2001). Or ces mutations peuvent être compensées par des fusions avec des protéines capables de lier directement le télomère (Armbruster et al., 2004). Plus récemment, il a été démontré que la télomérase interagissait avec une protéine du complexe télomérique « shelterin », la protéine TPP1, suggérant que cette interaction pourrait permettre son recrutement au niveau des télomères (Xin et al., 2007).
- Maladies associées aux télomères
L’activité télomérase, bien qu’étant absente dans la plupart des cellules somatiques, est indispensable pour assurer le renouvellement des cellules souches et la prolifération des populations cellulaires à renouvellement rapide telles que les cellules de la moelle osseuse. De ce fait, les altérations de la télomérase sont à l’origine de divers symptômes liés à l’épuisement prématuré des capacités réplicatives de certaines cellules. La dyskeratosis congenita, qui associe d’importants troubles des phanères, une leucoplasie muqueuse, une défaillance médullaire et des complications pulmonaires, est liée à l’altération du composant ARN de la télomérase (TERC), de la sous-unité catalytique (TERT) ou d’une protéine associée : la dyskérine (Mitchell et al., 1999). La forme autosomique dominante est due à une mutation du gène du composant ARN
lui-Thèse Oriane BOMBARDE
2009
15
même, alors qu’une autre forme liée à l’X est la conséquence des défauts d’une protéine intervenant dans son apprêtement (Shay and Wright, 2004). L’existence d’une aplasie médullaire dans la dyskeratosis congenita a conduit une équipe américano-canadienne à rechercher des anomalies de la télomérase dans certaines formes d’anémies aplastiques. Chez 124 malades testés, des mutations hétérozygotes de cinq types différents ont été détectées chez sept malades dans le gène codant pour le composant protéique de la télomérase (transcriptase inverse, TERT) (Fibbe, 2005; Yamaguchi et al., 2005). Aussi bien dans la dyskeratosis congenita que dans les observations récemment publiées de mutations de TERT associées à des anémies aplastiques, une corrélation existe entre les symptômes et le raccourcissement des télomères (Vulliamy et al., 2004).
Les patients atteints du syndrome de Werner souffrent de multiples signes de vieillissement prématuré (Opresko et al., 2003). Les cellules issues de ces patients se développent peu en culture et entrent en sénescence de façon prématurée. Or, ces phénotypes peuvent être compensés par l’expression de la sous-unité catalytique de la télomérase (Wyllie et al., 2000). Ainsi, le maintien de la longueur télomérique joue un rôle important dans la maladie. En effet, il a été démontré que la protéine WRN est impliquée dans la réplication du brin indirect au niveau des télomères (Crabbe et al., 2004).
Au contraire, une activation inadéquate de la télomérase dans les cellules somatiques, pouvant être la conséquence d’une forte instabilité génomique, est à l’origine de l’immortalisation cellulaire dans plus de 85 % des cancers, leur conférant un potentiel de prolifération illimité. Et il a été montré que l’immortalisation était un processus clé de l’oncogenèse (Hahn et al., 1999a). Dans cette étude, ils ont montré que l’expression ectopique de hTERT, de l’oncogène Ras et de l’antigène T du virus SV40 dans des cellules épithéliales ou des fibroblastes humains était suffisante pour créer des cellules tumorales. La compréhension du mécanisme de la télomérase est alors apparue d’un intérêt certain dans la recherche de cibles anti-cancéreuses.
b. Le mécanisme ALT
- Historique et présentation
Un mécanisme alternatif a été identifié chez la levure S.cerevisiae : en effet, des mutants pour la sous-unité ARN de la télomérase peuvent, rarement, activer spontanément une voie de recombinaison permettant de maintenir les séquences télomériques (Lundblad and Blackburn,
16
1993). Deux types de survivants ont été décrits : les mutants survivants I qui maintiennent leurs télomères en allongeant les séquences subtélomériques et les survivants de type II qui amplifient les séquences télomériques. Les survivants de type II possèdent des tailles de longueur télomérique très hétérogènes (Teng and Zakian, 1999). Ce mécanisme fait intervenir la voie de recombinaison dépendante de Rad52 (McEachern and Blackburn, 1996).
Chez l’Homme également ont été observées des cellules immortelles dépourvues d’activité télomérase : on parle de mécanisme alternatif de maintien de la longueur télomérique, appelé ALT (Alternative Lengthening Telomere). Le mécanisme ALT pourrait expliquer les 10-15 % de cellules cancéreuses n’ayant pas ré-activé la télomérase (Bryan et al., 1997; Bryan et al., 1995). Le phénotype ALT est présenté par des lignées cellulaires d’origine variée, immortalisées par le virus SV40. Il survient spontanément chez les patients atteints du syndrome de Li-Fraumeni, syndrome provoqué par une mutation germinale de p53. L’analyse des lignées tumorales ALT indique que la taille des télomères est très hétérogène (Lansdorp, 1997; Perrem et al., 2001), allant de 3 à 50 kb (Bryan et al., 1995; Grobelny et al., 2001; Murnane et al., 1994; Opitz et al., 2001). Le rapport entre la taille des télomères du bras p et ceux du bras q d’un même chromosome varie d’un facteur 100 alors que celui-ci atteint seulement 2 dans une lignée télomérase-positive (Perrem et al., 2001).
Les cellules ALT se caractérisent par la présence d’une structure subnucléaire appelée APB : Associated ALT PML Bodies. Ces corps sont appelés ainsi en comparaison des structures PML observées dans les noyaux de nombreuses cellules cancéreuses et dont on sait qu’elles sont impliquées dans divers processus cellulaires tels que l’inhibition de la croissance et l’induction de l’apoptose. Les APBs sont enrichis en une protéine PML associée à de l’ADN télomérique sous forme linéaire ou circulaire ainsi qu’à des protéines du complexe shelterin et des protéines impliquées dans les mécanismes de réparation et notamment la recombinaison (RAD51, RAD52, les protéines du complexe MRN, WRN, 53BP1, PARP2, ERCC1/XPF…) (Dantzer et al., 2004; Tarsounas et al., 2004; Wu et al., 2003; Wu et al., 2000b; Yeager et al., 1999; Zhu et al., 2003). Certaines études ont montré que l’hétérogénéité de la taille des télomères est corrélée à la fréquence des corps APB (Henson et al., 2005).
Le rôle précis de ces corps APBs n’est pas encore établi mais ces structures pourraient constituer une plateforme où l’ADN télomérique et les protéines nécessaires au mécanisme ALT seraient concentrés et/ou modifiés. De plus, l’exposition des cellules ALT à des agents génotoxiques
Thèse Oriane BOMBARDE
2009
17
favoriserait l’apparition de corps APBs et la séquestration d’ADN télomérique linéaire dans ces mêmes corps (Fasching et al., 2007).
- Mécanismes
Le mécanisme ALT peut s’appuyer sur différents types d’échanges de séquences télomériques. Les échanges entre chromatides sœurs
Les échanges de chromatides sœurs résultent de la réparation des cassures synthétisées pendant la réplication, par échanges de brins entre les chromatides sœurs. Il s’agit d’une réparation dite post-réplicative. Il a été suggéré que ces événements soient pris en charges par la recombinaison homologue (Sonoda et al., 1999). Une analyse détaillée de plusieurs lignées cellulaires révèle que les échanges post-réplicatifs entre deux télomères sont fréquents dans les cellules ALT. L’élongation des télomères suite à l’expression ectopique de la télomérase ou de POT1 n’induit qu’occasionnellement ces échanges (Londono-Vallejo et al., 2004), suggérant que les télomères longs ne suffisent pas à induire des échanges télomériques et que d’autres facteurs sont requis pour générer des échanges télomériques. Toutefois, l’augmentation des échanges ne correspond pas à une dérégulation globale de la recombinaison. En effet, les cellules ALT présentent autant d’échanges de chromatides sœurs génomiques que les cellules exprimant la télomérase (Bailey et al., 2004a). Ces échanges ne sont donc pas des marqueurs exclusifs du phénotype ALT. En effet, l’inhibition conjuguée de la télomérase et des gènes du système MMR (Mismatch Repair) induit l’émergence d’une population cellulaire similaire aux cellules ALT mais pourtant dépourvues de corps APBs, marqueur du phénotype ALT (Bechter et al., 2004).
Récemment, un autre modèle a été proposé. Des échanges inégaux entre les séquences télomériques de chromatides sœurs provenant de chromosomes différents permettaient d’allonger les télomères de chromatides différentes sans pour autant synthétiser d’ADN. Ainsi, les échanges inégaux généreraient des différences entre deux cellules filles proches de la sénescence provoquant l’entrée immédiate d’une cellule en sénescence (télomères raccourcis) tout en autorisant la poursuite de la prolifération de l’autre cellule fille (télomères allongés) (Bailey et al., 2004a).
Recombinaison inter-télomérique
La dynamique des télomères dans les cellules ALT suggère que les télomères sont maintenus par un processus de recombinaison (Murnane et al., 1994; Perrem et al., 2001). Des travaux révèlent la présence d’événements de recombinaison inter-télomériques dans des cellules humaines ALT.
18
Il a été montré qu’un télomère « marqué » par un plasmide, servait de matrice lors de l’amplification d’un autre télomère non « marqué ». Il a été observé jusqu’à 5 télomères marqués après 63 doublements de population; le mécanisme utilisé rappelait celui de la recombinaison. En revanche, lorsque le plasmide est intégré en position subtélomérique ou interstitielle, aucun événement de recombinaison inter-télomérique n’a été relevé (Dunham et al., 2000). De plus, l’étude de la jonction entre les régions subtélomériques et télomériques révèle qu’après l’activation du mécanisme ALT, des séquences télomériques ont été identifiées au sein des régions subtélomériques dégénérées. Cette insertion témoignerait de l’élongation des télomères par recombinaison au sein même de ces régions subtélomériques (Varley et al., 2002). Malgré une forte instabilité des régions mini-satellites dans les cellules ALT (Jeyapalan et al., 2005), aucune modification de la recombinaison n’a été observée à ces sites supposant que l’augmentation de la recombinaison homologue est restreinte aux télomères. Les résultats sont ainsi en accord avec l’existence d’une élongation des télomères basée sur la recombinaison dans les cellules ALT. Ainsi, l’extrémité 3’ simple brin envahirait la région double brin d’un autre télomère pour l’utiliser en tant que matrice et allonger significativement sa taille. La matrice copiée peut être linéaire, circulaire ou même télomérique (via la formation de la T-loop).
Contrairement à la télomérase exprimée de façon transitoire ou à un niveau basal dans certains types cellulaires, le mécanisme ALT est totalement absent dans les cellules normales. Des résultats tendent à indiquer qu’il existerait des éléments capables de réprimer ce mécanisme dans les cellules normales. En effet, lorsque l’on fusionne une cellule immortelle ALT avec une cellule normale, cela donne lieu à une cellule hybride sénescente qui perd son phénotype ALT (Perrem et al., 1999; Perrem et al., 2001). Plusieurs données suggèrent qu’il existe un contrôle génétique du mécanisme ALT mais les gènes régulateurs ne sont pas encore identifiés (Kumata et al., 2002; Nakabayashi et al., 1997; Ogata et al., 1993; Shigeeda et al., 2003).
c. Les TERRA : nouvelle voie dans la régulation des télomères
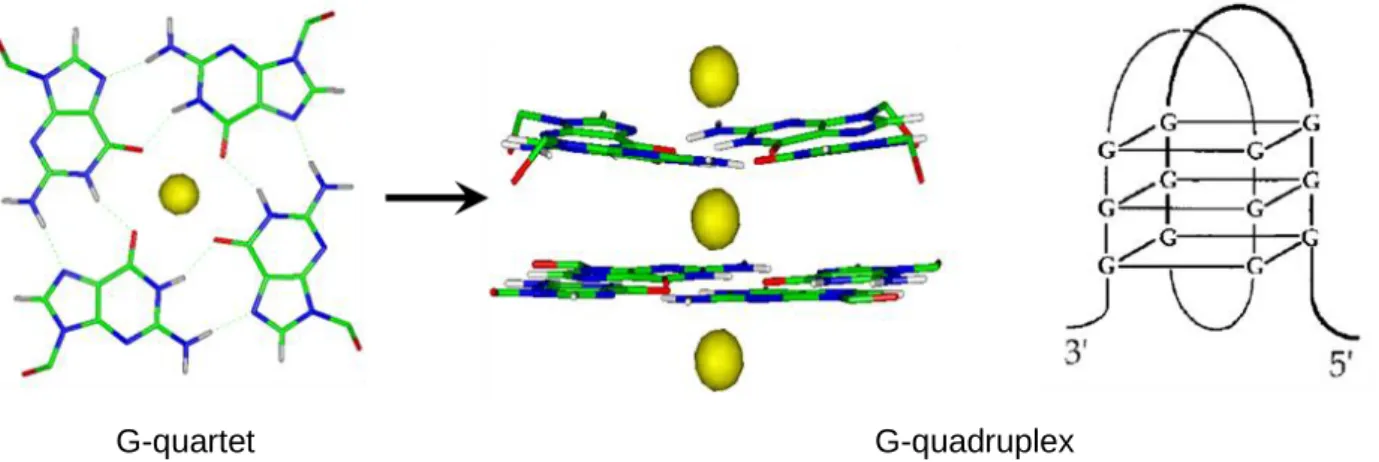
Le télomère a longtemps été considéré comme transcriptionnellement inactif. Or, récemment, des longs ARN non codants contenant des répétitions télomériques 5’-UUAGGG-3’ transcrits par l’ARN polymérase II ont été mis en évidence chez la souris, la levure S.cerevisaie, le poisson zèbre et chez l’Homme (Azzalin et al., 2007; Schoeftner and Blasco, 2008) : ils sont nommés TERRA (TElomeric Repeats containing RNA). Chez les mammifères, les TERRA ont une longueur comprise entre 100 pb et 9 kb et peuvent former des structures secondaires (telles que des G-quadruplex
Thèse Oriane BOMBARDE
2009
19
par exemple) avec les répétitions télomériques (Azzalin et al., 2007; Schoeftner and Blasco, 2008; Xu et al., 2008). Dans les cellules humaines, les TERRA sont la cible du système NMD (non-sense mediated RNA decay) (Azzalin et al., 2007) alors que chez la levure, c’est une exonucléase 5’->3’ qui régule leur niveau (Luke et al., 2008). On ne connait pas encore leur implication dans la régulation des télomères, mais, l’inactivation du système de dégradation des TERRA dans plusieurs organismes s’accompagne d’une perte télomérique (Azzalin et al., 2007; Luke et al., 2008).
Chez l’Homme, leur synthèse est régulée par des protéines de type SMG (Suppressors with Morphogenetic Defects in Genitalia). Le complexe SMG réprimerait l’association entre les molécules TERRA et la chromatine télomérique afin de protéger les extrémités des chromosomes d’éventuelles pertes de séquences. De façon importante, dans les cellules immortelles, la longueur moyenne des télomères est corrélée avec le taux de production cytoplasmique moyen des TERRA suggérant que la transcription d’un télomère peut varier en fonction de sa taille (Schoeftner and Blasco, 2008). Plusieurs données indiquent que ces molécules seraient impliquées dans la régulation négative de la télomérase : les TERRA sont indétectables chez les embryons de souris entre les jours 11,5 et 15,5, période de la gestation durant laquelle le maintien de la séquence télomérique nécessite une forte activité télomérase pour assurer les rapides divisions cellulaires. De plus, les TERRA s’accumulent dans les cellules des tissus adultes dans lesquelles la télomérase est inactive alors qu’un faible taux des TERRA est présent dans les cellules cancéreuses humaines, semblant refléter la nécessité d’une activité télomérase optimale (Schoeftner and Blasco, 2008). De plus, le contrôle de leur transcription durant le développement embryonnaire suggère que c’est un mécanisme régulé.
De nombreuses molécules TERRA sont observées dans les cellules ALT. La régulation de la transcription des télomères viserait à préserver l’intégrité du génome et plus particulièrement des extrémités des chromosomes.
Les TERRA ont été démontrés comme s’associant à la chromatine télomérique (Azzalin et al., 2007; Schoeftner and Blasco, 2008). Ce phénomène a déjà été décrit dans le mécanisme d’inactivation du chromosome X, ayant lieu dans les cellules de mammifères. En effet, un ARN non-codant appelé Xist (X inactivation specific transcript) interagit avec le chromosome X et favoriserait la régulation de mécanismes épigénétiques indispensables au mécanisme de compensation (Payer and Lee, 2008).
20
III. Maintien de la protection des télomères
a. Le « capuchon » télomérique
Aux séquences télomériques sont associées des protéines spécifiques appartenant au complexe shelterin (de Lange, 2005) ou « télosome » : on parle de « capuchon télomérique » (figure 7). Ces protéines sont localisées au niveau des télomères, sont abondantes aux télomères tout au long du cycle cellulaire et ont une fonction identifiée aux télomères (de Lange, 2005). Ces protéines protègent les extrémités chromosomiques de la reconnaissance par les systèmes de réponse aux dommages à l’ADN et régulent le maintien des télomères par la télomérase.
Les protéines du complexe shelterin ont été identifiées successivement au cours des 15 dernières années. Leur spécificité pour l’ADN télomérique est due à la reconnaissance du duplex télomérique par la protéine TRF1 (Telomeric Repeat binding Factor 1), première à être identifiée in vitro pour sa spécificité pour un oligonucléotide contenant les répétitions télomériques double brin TTAGGG (Chong et al., 1995) et par TRF2 (Telomeric Repeat binding Factor 2), identifiée par homologie de séquence par rapport à TRF1. La protéine POT1 (Protection Of Telomere 1), est la protéine du complexe shelterin la plus conservée et a été identifiée grâce à des études d’homologie de séquences chez les eucaryotes unicellulaires (Baumann and Cech, 2001). Elle lie la séquence télomérique simple brin. Des expériences de double-hybride dirigé contre les protéines TRF1 et TRF2 ont permis de mettre en évidence deux autres protéines du complexe shelterin : TIN2 et RAP1 (Kim et al., 1999; Li et al., 2000). Enfin, la protéine TTP1 (aussi appelée PTOP et PIP1) a été identifiée en tant que protéine partenaire de TIN2. Des expériences de
co-Figure 7 : représentation schématique du capuchon télomérique
Les protéines TRF1 et TRF2 interagissent avec le duplex télomérique, alors que la protéine POT1 interagit spécifiquement avec le simple brin télomérique. Les shelterins interagissent entre elles afin de former le « capuchon » télomérique.
Thèse Oriane BOMBARDE
2009
21
immunoprécipiations permettent d’isoler le complexe shelterin, suggérant qu’elles forment un complexe stable même en l’absence d’ADN télomérique (Liu et al., 2004a). Des sous-complexes existent au sein des protéines du complexe shelterin mais leur fonction exacte reste inconnue (Bae and Baumann, 2007; Liu et al., 2004a).
- Les protéines TRF1/TRF2
TRF1 et TRF2 partagent des domaines structuraux communs : le domaine TRF homology (TRFH) et un domaine C-terminal SANT-Myb de fixation à l’ADN, qui sont connectés par un domaine charnière flexible. L’extrémité N-terminale de TRF2 contient un domaine riche en Gly-Arg (GAR domain) référencé comme un domaine basique. Au contraire, la protéine TRF1 contient des acides aminés acides dans sa région N-terminale (figure 8). C’est le domaine SANT/Myb qui leur confère leur spécificité de fixation pour les séquences télomériques double brin : 5’-YTAGGGTTR-3’ (Hanaoka et al., 2005). La fixation sur l’ADN se fait sous la forme d’homodimères ou d’oligomères existant par l’intermédiaire du domaine TRFH. Cependant, les protéines TRF2 et TRF1 n’interagissent pas directement l’une avec l’autre (Fairall et al., 2001). Le mode de fixation multimérique de TRF1 et TRF2 améliore leur affinité pour l’ADN et est responsable de leur capacité à modifier l’architecture de l’ADN (Griffith et al., 1998; Stansel et al., 2001). En plus d’être un domaine de dimérisation, le domaine TRFH fonctionne comme une plateforme de recrutement pour d’autres protéines au niveau des télomères et malgré leur forte homologie, les domaines des protéines TRF1 et TRF2 sont incapables d’interagir l’une avec l’autre et recrutent des protéines accessoires différentes au niveau des télomères (Chen et al., 2008).
Figure 8 : structure primaire des protéines du complexe shelterin et leurs domaines d’interactions
(d’après Palm and de Lange, 2008) TPP1 POT1 TRF1 TRF2 TIN2 RAP1 Double brin télomérique Simple brin télomérique