HAL Id: dumas-01836404
https://dumas.ccsd.cnrs.fr/dumas-01836404
Submitted on 12 Jul 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Étude des métabolites liés à l’îlot pks chez les souches
urinaires de Escherichia coli
Camille Chagneau
To cite this version:
Camille Chagneau. Étude des métabolites liés à l’îlot pks chez les souches urinaires de Escherichia coli. Sciences pharmaceutiques. 2018. �dumas-01836404�
Université de Bordeaux
U.F.R. DES SCIENCES PHARMACEUTIQUES
2018 N°49
MEMOIRE
DU DIPLOME D’ETUDES SPECIALISEES DE BIOLOGIE MEDICALE
Tenant lieu de Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN PHARMACIE
Présenté et soutenu publiquement
Le 22 juin 2018 à Toulouse
Par
Camille CHAGNEAU
Née le 7 mai 1990 à Saint-Nazaire
ETUDE DES METABOLITES LIES A L’ILOT PKS
CHEZ LES SOUCHES URINAIRES DE ESCHERICHIA COLI
Directeur de thèse : Monsieur le Professeur Éric OSWALD
Jury :
Madame le Professeur Véronique DUBOIS
Monsieur le Professeur Éric OSWALD
Madame le Docteur Patricia MARTIN
Monsieur le Docteur Damien DUBOIS
Présidente
Assesseur
Assesseur
Assesseur
Université de Bordeaux
U.F.R. DES SCIENCES PHARMACEUTIQUES
2018 N°49
MEMOIRE
DU DIPLOME D’ETUDES SPECIALISEES DE BIOLOGIE MEDICALE
Tenant lieu de Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN PHARMACIE
Présenté et soutenu publiquement
Le 22 juin 2018 à Toulouse
Par
Camille CHAGNEAU
Née le 7 mai 1990 à Saint-Nazaire
ETUDE DES METABOLITES LIES A L’ILOT PKS
CHEZ LES SOUCHES URINAIRES DE ESCHERICHIA COLI
Directeur de thèse : Monsieur le Professeur Éric OSWALD
Jury :
Madame le Professeur Véronique DUBOIS
Monsieur le Professeur Éric OSWALD
Madame le Docteur Patricia MARTIN
Monsieur le Docteur Damien DUBOIS
Présidente
Assesseur
Assesseur
Assesseur
2
Remerciements
A Madame le Professeur Véronique Dubois, je vous remercie de l’intérêt que vous avez bien voulu porter à mon travail. Vous me faites l’honneur d’accepter la présidence de ce jury. Veuillez trouver ici l’expression de toute ma reconnaissance et de mon profond respect.
A Monsieur le Professeur Eric Oswald, je vous remercie d’avoir accepté de diriger ma thèse et de m’avoir guidée avec vos précieux conseils, suggestions et idées tout au long de ce travail et au-delà dans mon expérience de la recherche. Merci de m’exhorter chaque jour à aller plus loin ! Soyez assuré de toute ma gratitude.
A Madame le Docteur Patricia Martin, je te remercie d’avoir accepté de me co-encadrer durant la valorisation de ce travail sous forme de ma thèse d’exercice. Je te suis extrêmement reconnaissante de tes conseils, tes relectures, ta disponibilité et ta patience durant la partie expérimentale comme durant l’écriture de ce manuscrit. Un grand merci !
A Monsieur le Docteur Damien Dubois, je te remercie d’avoir bien voulu prendre part à ce jury de thèse. Merci également pour ton implication dans ma formation de future biologiste, ta disponibilité et pour tout ce que tu m’as appris.
A toute l’équipe 2 de l’IRSD : Jean-Phi, Priscilla, Laure, Nadège, Maryse, Michèle, Fred, Matteo, Marie, Fred, Pauline, Rachel, Claude, Nicolas… et j’en oublie ! Merci pour tout ce que vous m’avez appris, tous les échanges que nous avons pu avoir, votre implication dans la vie du labo. C’est vous qui m’avez donné le goût pour la recherche, reste à voir si c’était une bonne idée… ! Merci également aux personnes que j’ai rencontrées durant mes cours de master sous la direction de notre cher Philippe et qui m’ont permis de retourner avec le sourire à la fac : Laure, Lise, Sevan, Pierre et tous les autres ! Merci à Jérémy pour son aide lors de son stage de master 1. Merci également à Julien et Nicolas et les personnes de la plateforme de lipidomique sans qui les extractions et dosages de lipides n’auraient jamais pu être réalisées. Enfin je tiens à remercier plus particulièrement : Christophe, pour toute son aide lors de ma demande d’année recherche et tous ses conseils en amont de mon projet ; Laetitia, pour tous les moments passés ensemble durant ces 6 mois de stage… le bureau est toujours un peu vide sans toi… ; Clémence, pour sa collaboration et son aide dans notre pharaonique projet de collecte des souches et des urines l’été dernier, la réalisation des PCR (et merci aussi à Michèle !) et son investissement sans compter que ce soit au labo de recherche ou à l’hôpital : c’est un très grand plaisir de travailler avec toi !
Aux laboratoires où j’ai effectué mes différents stages d’internat, je vous remercie pour votre accueil, toujours chaleureux, et pour toutes les choses que vous m’avez apprises. En particulier, je tiens à saluer
3
le service de Bactériologie de Limoges qui m’a le premier donné l’envie de me tourner vers la bactériologie médicale ; le service de Parasitologie-Mycologie de Toulouse où j’ai effectué l’un de mes stages les plus passionnants ; et bien sûr le service de Bactériologie de Toulouse, où je suis si heureuse de revenir pour encore un semestre. Merci à l’ensemble des techniciens pour leur professionnalisme, leur implication continue dans ma formation et leurs qualités humaines qui sont indissociables d’un stage réussi. Merci aux biologistes pour le savoir qu’ils m’ont transmis et continuent à me transmettre ainsi que pour leur confiance et leur soutien.
A tous mes (très nombreux) co-internes qui ont supporté mon enthousiasme en stage durant tous ces semestres : Thomas, Batiste, Florent, Ana, Eve, Samuel A., Julien E., Louis-Tho, Alice-Anne, Shéshé, Jules, Julien G., JK, Lucie, Manu, Agnès, Cédric, Antho, Greg, Sarah Q., Catherine, Audrey, Laurie, Pauline, Damien, Elodie, Sam, Sarah B., Tristan, Ayman, Antoine, Nicolas, Caro, Aude, Hugo, Léa, Tiphaine, Noémie, Jean, Alizée, Maximen, Vuthy, Bastien, Céline, Emeline… et ceux que j’oublie probablement ! Et aussi aux internes qui ont eu la chance de ne pas partager les obligatoires mauvais moments d’élaboration de planning par exemple, mais uniquement les bons moments hors stage : Morgane, Bénichou, Karen, Marion, Thierry, Romain, Hélène, Hadrien... Merci pour ces supers moments, l’internat, même en 5 ans, passe beaucoup trop vite… !
A mes très belles rencontres de Limoges : Emilie, Caroline et Audrey : j’ai eu la chance de vous rencontrer et de vivre de très beaux moments avec vous ! Que de bons souvenirs ensemble à Condorcet et ailleurs !
A l’ensemble de mes colocataires qui auront marqué les premières années de ma vie d’interne, merci pour tous ces moments partagés. A tous ceux dont j’ai été la « maman Camille » du 33 et notamment Noémie (vraie maman à son tour… qui l’aurait cru !), papa Fred (l’homme de toutes les situations), Garliquette, Emily, Lucie… A ceux qui ont partagé mon quotidien à mon arrivée à Toulouse : Gwendoline, Cédric, Pierre-Yves (l’homme aux chaussures de DES comme à celles de foot brodées, un régal !), Célinette (pour tous les petits déjs en capuche, les coups du sort, les parties de Taboo couronnées d’une écrasante victoire en notre faveur… : merci pour tous ces moments authentiques que je ne pouvais vivre qu’avec toi !) !
Aux Aveyronnais que j’ai croisés durant ces années d’internat au cours de belles soirées : les Ruthénois, et notamment Laure, Laetitia et Simon ; les Genex et les Sébazacois : je vous remercie pour votre accueil d’emblée chaleureux !
A mes amies de la fac : Flora, Sandrine, Alba, Marine, Fanny, Elia et Lise. Merci pour toutes ces belles années à Nantes, nos souvenirs de TP et de soirées… même si la distance nous sépare, je suis heureuse qu’on passe de très bons moments lorsqu’on se revoit en week-end et j’espère que ça durera encore longtemps !
4
A mes amis de lycée : Fanny, Matou, Toutoune, Méla, Charchar, Guillaume, Gauthier, Kiki, Kéké, Romain, Max. Quel chemin nous avons tous fait depuis le bac… J’espère au final avoir réussi à vous convaincre de l’intérêt de travailler sur les bactéries du pipi et que vous n’êtes pas trop déçus de moi ! A ma petite Lilie, depuis près de 25 ans qu’on se connait, à la fois nos vies sont devenues complètement différentes et à la fois rien n’a changé… tu restes ma meilleure amie d’enfance.
A ma belle-famille, merci pour votre accueil et votre soutien. Même si je ne suis pas très « famille » et grands repas, c’est à chaque fois pour moi un grand plaisir de vous voir et de partager des moments avec vous. Merci de me faire me sentir comme chez moi quand je viens en Aveyron !
A ma famille, toujours présente durant mes longues études. Merci à mes parents qui m’ont toujours soutenue et voulu que je fasse ce qui me plaisait durant ces années. C’est aussi vous les premiers grâce à qui j’ai utilisé un microscope alors merci pour la curiosité scientifique que vous m’avez transmise ! Merci également pour votre compréhension lorsque j’ai choisi de partir un peu loin faire mon internat… je suis encore plus heureuse de revenir en week-end et en vacances (et j’ai maintenant aussi le droit de faire ma commande de menus !) ! Merci à ma sœur et mon frère, et leurs enfants qui grandissent trop vite, pour tous les bons moments passés ensemble même si je suis sans doute une tante qui a toujours du travail !
A Julien, celui qui m’a permis d’avoir toujours le sourire dans les bons comme les moins bons moments de ces cinq années d’internat ! Merci d’être toujours là pour moi et merci pour ta compréhension dans tous ces moments sacrifiés que je passe à travailler et non avec toi… Je t’aime.
5
Table des matières
Remerciements ... 2
Liste des annexes ... 8
Liste des tableaux ... 9
Liste des figures ... 10
Liste des abréviations ... 11
Partie I : Synthèse bibliographique………13
I) Urine et microbiote urinaire ... 13
II) Les infections urinaires ... 13
A) Définitions et aspects cliniques ... 13
1) Les colonisations bactériennes ou bactériuries asymptomatiques ... 13
2) Les infections urinaires symptomatiques ... 13
B) Epidémiologie ... 15
1) Importance en médecine humaine ... 15
2) Epidémiologie microbienne... 16
C) Physiopathologie des infections urinaires à Escherichia coli ... 17
1) Colonisation digestive préalable à l’infection urinaire ... 17
2) Déroulement de l’infection urinaire ... 18
3) Facteurs de virulence des E. coli urinaires ... 19
4) Les bactériuries asymptomatiques : particularités ... 25
5) Douleur dans les infections urinaires et bactériuries asymptomatiques ... 26
III) L’îlot pks ... 28
A) Présentation ... 28
1) Historique ... 28
2) Structure ... 28
3) Epidémiologie ... 28
B) Fonctionnement de la machinerie pks : état de l’art ... 29
C) Diversité des métabolites produits ... 32
1) La colibactine ... 32
2) Les aminolipides ... 36
D) Connexion avec d’autres îlots de pathogénicité ... 37
1) Les sidérophores ... 37
2) Les sidérophores – microcines ... 39
6
Partie II : Etude expérimentale ………40
I) Contexte : îlot pks et infections urinaires ... 40
A) Connaissances et enjeux ... 40
B) Objectifs de l’étude ... 40
C) Diversité et unité des souches bactériennes étudiées ... 41
II) Etude de la production des métabolites liés à l’îlot pks chez des souches urinaires de E. coli in vitro 42 A) Etude de la colibactine génotoxique ... 42
1) La production de colibactine par l’îlot pks permet d’induire la formation de ponts inter-brins de l’ADN chez des souches urinaires de E. coli... 42
2) L’activité génotoxique de type cassures double-brin chez la souche de bactériurie asymptomatique E. coli ABU83972 est supérieure à celle observée chez E. coli Nissle1917 ... 44
... 45
3) Conclusion ... 45
B) Etude de la production d’aminolipides chez les souches urinaires de E. coli ... 46
1) Les quantités du produit de clivage de la précolibactine en colibactine, le C14-Asn, sont différentes entre les souches étudiées ... 46
2) E. coli Nissle1917 et les souches urinaires produisent peu de C12-Asn-GABA ... 47
3) Un autre métabolite lipidique du GABA est produit : le C14-Asn-GABA ... 47
4) La production des métabolites liés à l’îlot pks dépend des conditions de culture utilisées in vitro 48 III) Etude de la production de métabolites liés à l’îlot pks in vivo ... 49
A) Introduction ... 49
B) Résultats ... 50
1) Sélection des patients ... 50
2) Recueil des échantillons ... 50
3) Caractéristiques des patients et échantillons inclus ... 51
4) Caractérisation des souches de E. coli retrouvées dans les ECBU ... 52
5) Dosage des aminolipides dans les urines ... 53
6) Conclusion ... 55
IV) Discussion ... 56
A) L’activité génotoxique de l’îlot pks varie en fonction des souches de E. coli in vitro ... 56
B) L’activité de l’îlot pks varie en fonction des conditions de culture in vitro ... 57
C) Du C14-Asn retrouvé dans les urines, premier témoin de la production de colibactine in vivo58 D) L’îlot pks : de nombreux impacts potentiels dans la physiopathologie des infections urinaires et bactériuries asymptomatiques ... 60
1) E. coli ABU83972 et les UPEC : implication dans les cancers des voies urinaires liée à l’îlot pks ? ... 60
7
V) Conclusions et perspectives ... 63
Bibliographie ... 64 Annexes ... 75
8
Liste des annexes
Annexe 1 : Liste des souches de E. coli utilisées dans cette étude ... 75
Annexe 2 : Données de matériel et méthode supplémentaires ... 76
A) Conditions de culture ... 76
B) Composition de l’urine artificielle utilisée dans cette étudee ... 76
C) Manipulation moléculaire des souches ... 77
D) Etude de la génotoxicité liée à la colibactine ... 78
1) Etude de la formation de ponts inter-brins de l’ADN... 78
2) Visualisation de γ-H2AX en In Cell Western ... 78
E) Extraction et dosage des métabolites lipidiques ... 79
F) Caractérisation des souches urinaires ... 79
1) Méthode utilisée pour la détermination du groupe phylogénétique ... 80
2) Méthode utilisée pour rechercher la présence de l’îlot pks ... 80
G) Analyse statistique ... 81
Annexe 3 : Récapitulatif des patients, ECBU, caractéristiques des souches et aminolipides retrouvés dans l’étude ... 82
9
Liste des tableaux
Tableau 1 : Caractéristiques des patients inclus dans cette étude et résultats de leur ECBU. ... 51
Tableau 2 : Liste des souches utilisées dans cette étude et références. ... 75
Tableau 3 : Composition de l’urine artificielle utilisée dans cette étude. ... 76
Tableau 4 : Liste des amorces utilisées pour la manipulation moléculaire des souches. ... 77
Tableau 5 : Liste des amorces utilisées pour les PCR déterminant les groupes phylogénétiques ... 80
10
Liste des figures
Figure 1 : Répartition des différents pathogènes isolés d’infections urinaires ... 16
Figure 2 : Résistance des E. coli aux antibiotiques ... 17
Figure 3 : Physiopathologie des infections urinaires ... 19
Figure 4 : Groupes phylogénétiques de E. coli ... 20
Figure 5 : Schématisation des pili de Type 1 et des pili Pap ou P-fimbriae ... 22
Figure 6 : Structure des sidérophores retrouvés chez E. coli ... 24
Figure 7 : Douleur inflammatoire dans l’infection urinaire ... 27
Figure 8 : L’îlot pks ... 28
Figure 9 : Biosynthèse de la colibactine et des différents intermédiaires de biosynthèse ... 30
Figure 10 : Différentes structures de colibactines proposées ... 32
Figure 11 : Conséquences cellulaires des dommages à l’ADN ... 34
Figure 12 : Précolibactine et produit de clivage C14-Asn ... 36
Figure 13 : Structure du C12-Asparagine-acide γ-amino-butyrique ... 37
Figure 14 : Connexion par les phosphopanthéthéinyl transférases entre îlot pks et sidérophores . ... 38
Figure 15 : Visualisation et quantification de la génotoxicité de type formation de ponts inter-brins 43 Figure 16 : Visualisation et quantification de la génotoxicité de type formation de cassures double-brin de l’ADN ... 45
Figure 17 : Concentration de C14-Asn sur des culots de cultures bactériennes en DMEM... 46
Figure 18 : Concentration de C12-Asn-GABA sur des culots de cultures bactériennes en DMEM . ... 47
Figure 19 : Concentration de C14-Asn-GABA sur des culots de cultures bactériennes en DMEM . ... 48
Figure 20 : Concentration de C14-Asn et C14-Asn-GABA sur des culots de cultures bactériennes en urine artificielle ... 49
Figure 21 : Détermination du groupe phylogénétique . ... 52
Figure 22 : Détermination de la présence de l’îlot pks ... 53
Figure 23 : Répartition des différents groupes phylogénétiques de E. coli retrouvés et fréquence de l’îlot pks chez les souches de cette étude. ... 53
Figure 24 : Quantités de C14-Asn retrouvées après extraction des aminolipides urinaires ... 54
11
Liste des abréviations
5HETE d8 : acide
5S-hydroxyeicosatétraénoïque deutéré A : adénylation
ABU : bactériurie asymptomatique ACP : acyl carrier protéine
ADN : acide désoxyribonucléique ARN : acide ribonucléique ARNm : ARN messager AT : acyltransférase
ATM : ataxia telangiectasia mutated
ATR : ataxia-telangiectasia and Rad3-related kinase
BCP : bromocrésol pourpre
BLSE : bêta-lactamase à spectre étendu C : condensation C12-Asn-GABA : C12-asparagine-acide γ-amino-butyrique Asn : N-myristoyl-D-Asparagine ou C14-Asparagine C14-Asn-GABA : C14-asparagine-acide γ-amino-butyrique
CDK : cyclines dépendantes kinases CHK : check-point kinase
CNF1 : facteur de nécrose cytotoxique 1 CUP : chaperone usher pathway
Cy : cyclisation DH : déshydratase
DMEM : Dulbecco's modified Eagle medium E : épimérase
ECBU : examen cytobactériologique des urines ECDC : European Center for Disease
prevention and Control
ECOR : E. coli collection of reference strains
ER : enoyl réductase
FANCD2 : protéine D2 de l’anémie de Fanconi Fur : ferric uptake regulator
GABA : acide γ-amino-butyrique GBS : Streptocoques du groupe B HBSS : Hank’s balanced salt solution HlyA : α-hémolysine
HPI : high pathogenicity island
HPLC : chromatographie liquide haute performanace
IgA : immunoglobuline A KR : kétoréductase KS : kétosynthase LB : milieu Luria-Bertani
LC-MS/MS : chromatographie liquide couplée à la spectrométrie de masse en tandem LPS : lipopolysaccharide
LtB4-d4 : leucotriène B4 deutéré LxA4-d5 : lipoxine A4 deutérée
MATE : multidrug and toxic compound extrusion
MeOH : méthanol
mGluR5 : récepteur métabotropique au glutamate 5
MLST : multilocus sequence typing MOI : multiplicity of infection MOPS tampon à base d’acide 3-(N-morpholino)propanesulfonique MRM : multiple reaction monitoring
MS/MS : spectrométrie de masse en tandem NRP : peptides non ribosomaux
12 ONERBA : Observatoire national de
l’épidémiologie de la résistance bactérienne aux antibiotiques
Ox : oxydase
Pap : pili associés aux pyélonéphrites PCP : peptidyl carrier protéine
PCR : réaction en chaîne par polymérase pIgR : récepteur aux immunoglobulines polyclonales
PK : polykétide
PK-NRP : polykétides-peptides non ribosomaux
PK-NRPS : polykétide-peptide non ribosomal synthase
PKS : polykétide synthase
PPTase : phosphopantéthéinyl transférase SASP : phénotype sécrétoire associé à la sénescence
SFU : signes fonctionnels urinaires SH : thioester
SPILF : Société de Pathologie Infectieuse de Langue Française
ST : sequence type TLR4 : Toll-like receptor 4
TRP : transient receptor potential UFC : unité formant colonie
UPEC : Escherichia coli uropathogènes wt : wild type
13
Partie I : Synthèse bibliographique
I) Urine et microbiote urinaire
Traditionnellement, l’urine était considérée comme un liquide normalement stérile et seul l’orifice urétral pouvait être contaminé par des bactéries en provenance du périnée colonisées par des populations polymicrobiennes. Cependant, comme dans d’autres sites longtemps considérés stériles, il semblerait qu’il existe également des communautés bactériennes physiologiques dans l’arbre urinaire, formant un microbiote urinaire (1). L’avènement de la biologie moléculaire a permis de mettre en évidence ces bactéries généralement non retrouvées en culture, soit parce qu’en trop faible quantité, soit parce que non cultivables, à tous les étages de l’arbre urinaire.
II) Les infections urinaires
A) Définitions et aspects cliniques
Les infections du tractus urinaire ou infections urinaires désignent la présence, symptomatique ou non, d’un germe anormal dans l’urine. Différentes catégories cliniques sont distinguées dans la littérature.
1) Les colonisations bactériennes ou bactériuries asymptomatiques
Elles correspondent à la présence d’une bactérie dans l’urine en l’absence de symptomatologie clinique. La bactérie doit être retrouvée dans un examen cytobactériologique des urines (ECBU) réalisé dans des conditions d’hygiène correcte. Le seuil de 105 UFC/mL (unité formant colonie) est
classiquement retenu pour les femmes enceintes et est étendu aux autres populations selon les recommandations américaines (2). En raison du risque de contamination par le microbiote intestinal, ces dernières recommandent par ailleurs la confirmation de la bactériurie asymptomatique chez la femme par un second ECBU mettant en évidence le même germe. La leucocyturie retrouvée ou non n’intervient ni dans la définition ni dans la décision de traitement.
Le dépistage et le traitement des bactériuries asymptomatiques sont indiqués à ce jour uniquement chez la femme enceinte et avant une chirurgie urologique invasive programmée (2,3).
2) Les infections urinaires symptomatiques
Elles sont généralement classées en fonction de leur localisation. On distingue ainsi classiquement les infections touchant les voies urinaires basses, dont les cystites ; des infections urinaires hautes ou pyélonéphrites qui atteignent le rein et de celles concernant les glandes annexes (prostatite).
14
D’autres dichotomies peuvent être utilisées dans la littérature. Ainsi les termes « compliquée » et « non compliquée » ou « simple » caractérisant l’infection peuvent être retrouvés, mais peuvent porter à confusion. L’infection compliquée peut en effet se référer à une susceptibilité particulière de l’hôte aux infections urinaires comme à la susceptibilité à une infection de déroulement plus sévère. D’autres classifications ont été proposées reposant à la fois sur des groupes de sévérité de l’infection à la présentation (de la cystite au choc uroseptique) et sur les facteurs d’hôte (facteurs de risque de récurrence ou de survenue ou d’infection grave décrits selon le système ORENUC) (4). Les recommandations françaises établies par la Société de pathologie infectieuse de langue française (SPILF) distinguent désormais les infections simples des infections susceptibles, mettant l’accent sur les facteurs d’hôte associés à un risque d’engendrer une infection plus grave (3). Les facteurs de risque de complication retenus sont : les anomalies organiques ou fonctionnelles de l’arbre urinaire, le sexe masculin, la grossesse, l’immunodépression grave, l’insuffisance rénale chronique sévère ou l’âge (sujets âgés définis par un âge de plus de 75 ans ou de plus de 65 ans fragile).
a) Les cystites aiguës
Les cystites aiguës correspondent à une inflammation de la vessie. On retrouve des signes fonctionnels urinaires (SFU): pollakiurie, impériosité mictionnelle, miction douloureuse, brûlures mictionnelles, en l’absence de fièvre et de douleurs lombaires ainsi que d’autres symptômes (notamment écoulement urétral chez l’homme ou signes vaginaux chez la femme) (5). Parfois, des signes moins spécifiques sont également retrouvés comme une pesanteur et/ou douleur au niveau du bas ventre ou encore une hématurie.
Le diagnostic clinique est plus délicat chez les jeunes enfants ou les personnes âgées notamment ayant des difficultés à communiquer. Parfois, seuls des changements de comportements ou des modifications de l’incontinence peuvent survenir, rendant le diagnostic différentiel avec les colonisations urinaires difficile (6,7).
Les cystites peuvent être récidivantes, en particulier chez la femme. Elles sont définies par la survenue durant 12 mois consécutifs d’au moins quatre épisodes de cystites (3).
b) Les pyélonéphrites aiguës
Les pyélonéphrites correspondent aux infections du bassinet et du parenchyme rénal (haut appareil urinaire).
Cliniquement, on retrouve une association de SFU (présents de manière non constante) avec des signes de l’atteinte tissulaire rénale : fièvre ; frissons ; douleurs des fosses lombaires le plus souvent unilatérales, spontanées ou provoquées par la palpation.
Des signes digestifs (nausées, vomissements, diarrhées…) accompagnent parfois ces signes voire prédominent initialement (3,8).
15
Il peut s’agir d’une infection grave. Des complications aiguës sont possibles comme une suppuration locale (abcès périrénal) ou la généralisation de l’infection en un sepsis grave voire un choc septique.
c) Les prostatites aiguës et infections urinaires masculines
Les prostatites aiguës correspondent à l’inflammation de la glande prostatique. Lorsque son origine est bactérienne, les manifestations cliniques typiques regroupent des SFU, un syndrome infectieux (fièvre, frissons, syndrome parfois pseudo-grippal), des douleurs pelviennes ou périnéales et une prostate douloureuse au toucher rectal. Parfois, une rétention aiguë d’urine est observée (9). Des complications sont possibles : locales avec abcès de prostate, ou générales avec un sepsis.
Toute infection urinaire masculine peut potentiellement atteindre la prostate. Jusqu’à il y a peu, toute infection urinaire chez l’homme était prise en charge comme une prostatite. Les recommandations françaises permettent aujourd’hui de moduler la prise en charge initiale des infections urinaires paucisymptomatiques chez l’homme pour lesquels l’atteinte prostatique est incertaine, mais non excluable de manière fiable cependant (3).
B) Epidémiologie
1) Importance en médecine humaine
Les infections urinaires sont des infections très courantes qu’elles soient communautaires ou nosocomiales ; il s’agit d’une des infections bactériennes les plus fréquentes. On estime qu’elles toucheraient 150 millions de personnes par an à travers le monde (10) et près d’une femme sur 2 (40%) y sera confrontée au cours de sa vie (11). En France, l’incidence annuelle s’élèverait à 4 à 6 millions de cas, soit 1 à 2% de l’activité des médecins généralistes, chiffre pouvant être sous-estimé, car le recueil n’est pas systématique (12). Ce sont des infections qui ont un coût non négligeable lié aux traitements et arrêts de travail. Aux États-Unis, le coût annuel est estimé entre 2,9 et 3,5 milliards de dollars (13,14). L’incidence est très élevée dans la population des femmes jeunes, y compris en bonne santé, et estimée de 0,5 à 0,7 épisode aigu par an (15). Ces épisodes sont fréquemment récurrents et source majeure d’inconfort et d’angoisse notamment, car liés à des situations favorisantes comme les rapports sexuels (16). D’autres populations sont également concernées par les infections urinaires. Ainsi la survenue de ces dernières augmente indéniablement avec l’âge (17). La présence de malformations ou d’anomalies du tractus urinaire est également un facteur prédisposant et parfois révélé par la survenue d’une infection urinaire en pédiatrie (18). Par ailleurs, les infections urinaires sont également très fréquentes chez les patients diabétiques ou immunodéprimés (19–22).
En milieu hospitalier, d’après l’enquête nationale de prévalence des infections nosocomiales et des traitements anti-infectieux en établissements de santé réalisée en France de mai à juin 2012 (23), les infections urinaires représentent 29,9% des infections nosocomiales, ce qui représente dans cette
16
étude 1,6% des patients hospitalisés touchés. Il s’agit du type d’infection le plus fréquent, souvent en lien avec la présence d’une sonde urinaire. Chaque jour de port d’une sonde urinaire augmenterait le risque de bactériurie de 3 à 10% (14). Le surcoût des infections urinaires nosocomiales serait estimé en France à environ 574 € par épisode (frais de laboratoire, d’explorations radiologiques, de chirurgie, d’antibiotiques), hors frais d’hospitalisation et coûts indirects (24).
2) Epidémiologie microbienne
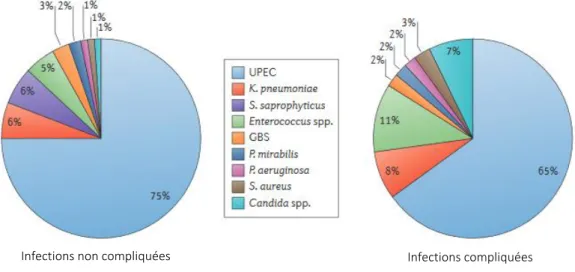
Les infections urinaires sont avant tout des infections bactériennes, les levures étant retrouvées plus rarement dans des contextes de colonisation sur matériel ou d’immunodépression. Les entérobactéries et plus précisément Escherichia coli sont les plus fréquemment isolées, mais d’autres espèces telles que Staphylococcus saprophyticus notamment chez la femme jeune ou encore Pseudomonas aeruginosa, suite par exemple à un traitement antibiotique large spectre, peuvent être rencontrées (Figure 1)(13).
Figure 1 : Répartition des différents pathogènes isolés d’infections urinaires. D’après (13). UPEC : E. coli uropathogènes. GBS : Streptocoques du groupe B
E. coli est isolée dans plus de 70% des infections communautaires (3) et dans près de 50% des infections nosocomiales en France ce qui en fait le premier germe retrouvé (23). Le réservoir naturel de ces E. coli uropathogènes (UPEC) est le tractus digestif. E. coli est en effet une des bactéries aéro-anaérobies facultatives prépondérantes du microbiote intestinal.
Les résistances aux antibiotiques de E. coli sont en augmentation en France et dans le monde entier que ce soit en ville ou à l’hôpital. De plus, il y a souvent des résistances associées à différentes classes d’antibiotiques, rendant la prise en charge de l’infection difficile avec le risque d’aboutir à des impasses thérapeutiques. On remarque une augmentation des souches de E. coli résistantes aux antibiotiques classiquement utilisés dans la prise en charge des infections urinaires, que ce soit en ville ou à l’hôpital. En établissements de santé, la résistance aux céphalosporines de 3ème génération a presque doublé de
17
2006 à 2012 (23). La résistance de E. coli aux antibiotiques est aussi présente en ville, comme le montre une étude du réseau ville-ONERBA (Observatoire National de l’Epidémiologie de la Résistance Bactérienne aux Antibiotiques) réalisée sur des bactéries issues d’infections urinaires (25). La proportion de souches productrices de BLSE (Bêta-lactamase à spectre étendu), et donc résistantes à plusieurs bêta-lactames, est estimée à 3,3%, proportion qui augmente avec l’âge.
D’après les données de l’ECDC (European Center for Disease prevention and Control), cette augmentation des résistances ne concerne pas seulement la France, mais bien toute l’Europe et le monde entier (Figure 2) (26).
De plus, les mécanismes de résistances aux différentes classes d’antibiotiques sont souvent associés, pouvant alors réduire drastiquement le panel des thérapeutiques utilisables notamment pour les infections compliquées. Le risque à terme est l’apparition de réelles impasses thérapeutiques, y compris pour des infections aussi banales et fréquentes que les infections urinaires. Il est donc aujourd’hui judicieux de développer des alternatives ciblant les facteurs de virulence des bactéries infectieuses pour en diminuer le pouvoir pathogène, tout en préservant le reste du microbiote. Ce type d’approche antivirulence a l’avantage d’induire une pression de sélection qui est moins associée au développement de résistances.
C) Physiopathologie des infections urinaires à Escherichia coli
1) Colonisation digestive préalable à l’infection urinaire
L’histoire naturelle de l’infection urinaire commence classiquement par une contamination périurétrale par un E. coli en provenance de l’intestin qui en est le réservoir, bien que la physiopathologie précise ne soit pas à ce jour bien connue. Une des étapes clés de la physiopathologie
Figure 2 : Résistance des E. coli aux antibiotiques. Proportion d’isolats de E. coli résistants aux céphalosporines de 3ème génération dans les pays participant au recueil de l’ECDC en 2004 (à gauche) et 2016 (à droite). D’après (European Centre for Disease Prevention and Control, 2017).
18
des infections urinaires serait donc avant tout la colonisation digestive préalable. La capacité des souches de E. coli uropathogènes à trouver sa place au sein du microbiote intestinal et à coloniser les muqueuses intestinales pourrait lui permettre également de mieux s’adapter au niveau de l’arbre urinaire (27). Les facteurs permettant une meilleure nutrition et croissance bactérienne au sein du tube digestif puis de l’urine, comme ceux impliqués dans l’adhésion voire dans la compétition inter-bactéries par la sécrétion de toxines peuvent jouer un rôle.
C’est très généralement un clone unique qui est responsable de l’infection (28). Le clone isolé dans une infection urinaire aiguë est quasi-systématiquement retrouvé au niveau des selles de manière concomitante et c’est généralement la souche prédominante de E. coli retrouvée au niveau de l’intestin à cet instant (29). Ce réservoir intestinal est particulièrement important dans les infections urinaires récurrentes. En effet, dans certains cas il s’avère que la souche uropathogène à l’origine des infections à répétition reste présente au niveau digestif. Dans d’autres cas de récurrences cependant, il semblerait qu’un nouveau clone de E. coli, retrouvé au niveau urinaire et digestif, ait réussi à s’implanter de manière efficace (30).
2) Déroulement de l’infection urinaire
Suite à la contamination périurétrale par les uropathogènes, il y a colonisation de l’urètre, grâce notamment à des facteurs d’adhérence, avant atteinte par les bactéries de la vessie (Figure 3). L’infection est donc généralement par voie ascendante des voies urinaires et les infections rénales par voie hématogène sont rares (septicémie à Staphylococcus aureus par exemple).
L’infection symptomatique de la vessie constitue la cystite. Les bactéries se multiplient en son sein grâce à certains facteurs de virulence leur permettant la survie dans ce milieu. Cette survie nécessite la mise en place de mécanismes de résistance aux défenses de l’hôte et de captation de nutriments nécessaires à la croissance bactérienne en parallèle (13).
Il peut y avoir ensuite ascension des bactéries jusqu’aux reins. L’infection de ces derniers notamment par des bactéries productrices de toxines va engendrer des dommages tissulaires importants. Cela constitue les pyélonéphrites. Du fait de la vascularisation importante de ces organes, en cas de lésion tissulaire, il est possible d’observer des bactériémies et/ou sepsis secondaires à des pyélonéphrites (31).
19
Figure 3 : Physiopathologie des infections urinaires, adaptée d’après (13). 1) Contamination de la zone périurétrale par un uropathogène en provenance de l’intestin. 2) Colonisation de l’urètre et migration vers la vessie. 3) Colonisation et invasion de la vessie, médiée par facteurs d’adhérence. 4) Infiltration par les polynucléaires neutrophiles. 5) Multiplication bactérienne et résistance aux défenses de l’hôte. 6) Formation de biofilm. 7) Dommages aux cellules épithéliales par production de toxines et protéases. 8) Ascension jusqu’aux reins. 9) Colonisation des reins. 10) Dommages aux tissus par les toxines bactériennes. 11) Bactériémie possible.
3) Facteurs de virulence des E. coli urinaires
La physiopathologie des infections urinaires fait intervenir à la fois des facteurs d’hôtes, rendant certaines catégories de population plus sujettes aux infections urinaires ainsi que certains comportements, mais également des facteurs bactériens expliquant une virulence accrue de certaines souches. Contrairement à d’autres E. coli pathogènes, les UPEC ne sont pas définis sur la présence d’un ou plusieurs facteurs de virulence en particulier, mais sur leur isolement dans l’urine d’un patient symptomatique au niveau urinaire (27). Il n’existe ainsi pas de profil type des UPEC : un portage au niveau digestif de souches potentiellement urovirulentes peut être observé sans apparition d’infection urinaire, preuve de l’importance de la susceptibilité de l’hôte. La survenue d’une infection peut être envisagée comme la rencontre entre un hôte de susceptibilité particulière et une bactérie de pathogénicité et d’adaptation correspondantes (27). Plus que la présence de gènes codant pour des facteurs de virulence, l’expression de ces gènes voire l’expression et la régulation de fonctions
20
conservées pourraient être primordiales (32). Cependant, certains facteurs de virulence sont tout de même volontiers retrouvés plus fréquemment chez des souches de E. coli isolées d’infections urinaires. Des mécanismes physiopathologiques clés sont impliqués (13) :
- L’adhérence aux épithéliums du tractus urinaire
- La production de toxines entraînant des dommages cellulaires
- Les facteurs permettant l’échappement à la réponse immunitaire de l’hôte - Les systèmes impliqués dans la croissance de la bactérie dans le milieu urinaire
Sans vouloir ni pouvoir être exhaustif, l’importance de certains facteurs de virulence dans la physiopathologie des infections urinaires va être approfondie dans cette partie suite à la présentation des groupes phylogénétiques impliqués.
a) Groupes phylogénétiques
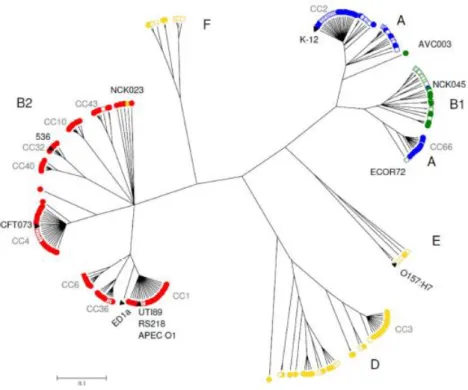
Les E. coli sont divisés en sept groupes phylogénétiques majeurs : A, B1, B2, C, D, E et F. Ces groupes phylogénétiques sont définis par typage de gènes de ménage des E. coli étudiés en MLST (pour multilocus sequence typing) et représentent donc la similarité de la partie constante du génome de E. coli ou core génome (33,34)(Figure 4).
Figure 4 : Groupes phylogénétiques de E. coli. Analyse phylogénétique par MLST de 161 souches isolées de bactériémies (cercles), 67 souches de la collection ECOR (E. coli collection reference strains)(carrés) et 7 souches de référence (triangles), définissant les 6 phylogroupes majoritaires, le groupe C ayant été décrit plus récemment. D’après (34).
Comme la plupart des E. coli pathogènes extra-intestinaux, les E. coli isolés d’infections urinaires appartiennent majoritairement au groupe phylogénétique B2 (35,36). On notera que certaines études
21
épidémiologiques chinoises montrent une prédominance de souches du groupe D, probablement liée à un particularisme régional (37–39).
Les souches du groupe phylogénétique B2 possèdent souvent des gènes codant pour des facteurs de virulence conférant un avantage dans la relation hôte-pathogène, notamment durant les infections urinaires. Par exemple, leur génome renferme des gènes codant pour des toxines entraînant des dommages tissulaires lors d’infections ou encore pour des systèmes de captation de nutriments perfectionnés pour favoriser leur croissance au détriment de l’hôte (notamment en fer). Ces souches sont associées à une pauci-clonalité au niveau digestif au moment de l’infection urinaire. Elles sont aussi plus fréquemment retrouvées au niveau digestif chez les femmes souffrant d’infections que celles n’en souffrant pas, laissant envisager un meilleur pouvoir de colonisation intestinale (29,40).
b) Les fimbriae
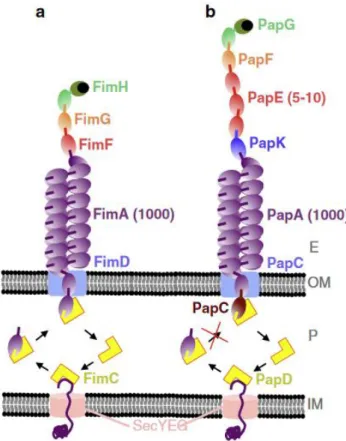
Un des éléments clés à chaque étape de l’infection urinaire est l’adhérence bactérienne aux épithéliums du tractus urinaire (13). Les pili et adhésines sont les acteurs majeurs impliqués.
Les chaperone usher pathway (CUP) pili sont une grande et importante famille de pili des bactéries à Gram négatif. Ils sont assemblés par un mécanisme particulier : « chaperone-usher » (ou apparié par les chaperones) qui leur a donné leur nom (pour revue voir (41)). Cette famille comprend deux pili de E. coli intéressants dans la colonisation urinaire et bien caractérisés : pili de Type 1 et pili associés aux pyélonéphrites (Pap). Ils possèdent à leurs extrémités distales des adhésines (FimH et PapG respectivement) qui reconnaissent des carbohydrates (Figure 5).
22
Figure 5 : Schématisation des pili de Type 1 (a) et des pili Pap ou P-fimbriae (b). Les assembleurs FimD et PapC sont représentés par des rectangles bleus au sein de la membrane externe (OM). Les chaperones FimC et PapD permettent l’assemblage. Sec YEG permet la translocation dans le périplasme (P). IM : membrane interne ; E : espace extracellulaire. D’après (42).
Les pili de Type 1 sont essentiels pour la colonisation de la vessie en modèle murin par leur reconnaissance des uroplakines mannosylées de l’urothélium (43). Ils permettent l’adhésion, mais également l’invasion des cellules urothéliales. Ils pourraient également être impliqués dans la colonisation digestive par les uropathogènes d’où un intérêt majeur (44), de même qu’un autre type de pili, les fimbriae F17-like, spécifiques des uropathogènes mais proches de pili F17 de souches pathogènes intestinales. Les pili de Type 1 sont présents à la fois chez des souches commensales digestives, mais également chez des souches isolées d’infections urinaires (45). Jusqu’à 100% des souches urinaires de certaines études portent le gène fimH (46). L’expression des pili de Type 1 est finement régulé par un système dit « inversion de phase » qui repose sur l’orientation du promoteur fimS, elle-même soumise à de nombreux facteurs bactériens ou environnementaux y compris durant l’infection urinaire (47). Notamment, bien que la croissance planctonique dans l’urine humaine diminue l’expression des pili de Type 1, cet effet est dépassé par une induction de l’expression de ces pili lors de l’attachement aux cellules épithéliales de la vessie (48).
Les pili Pap ou P fimbriae sont plus spécifiquement associés aux uropathogènes. Leur adhésine reconnaît les glycosphingolipides de l’épithélium rénal avec une spécificité dépendant de l’allèle du gène papG (papGI, papGII or papGIII) (49). Plus qu’un moyen d’adhésion aux cellules rénales, ils pourraient également contribuer à l’échappement à la réponse immune de l’hôte. Il a en effet été
23
démontré en modèle murin que, lors d’infections avec des E. coli porteurs de P fimbriae, les taux d’IgA (immunoglobuline A) dans l’urine étaient plus faibles, en lien avec une diminution de l’expression du transporteur d’IgA pIgR (récepteur aux immunoglobulines polyclonales) (50). On retrouve les gènes de l’opéron Pap de manière plus importante chez les souches de pyélonéphrites que de cystites ou de bactériuries asymptomatiques (46,51). De plus, de manière très intéressante, la sévérité de la pathologie urinaire induite par la souche semble liée à l’allèle de papG. En effet, PapGII est plus fréquemment retrouvée dans les souches de pyélonéphrites tandis que PapGIII est rencontrée préférentiellement dans les cystites (52,53).
c) L’hémolysine A (HlyA)
Les E. coli uropathogènes montrent également une certaine virulence en raison de la production de toxines. La production d’hémolysine A ou α-hémolysine (HlyA) est un exemple impliqué à la fois dans la formation de dommages cellulaires et d’évasion immune. Par oligomérisation en présence de calcium, HlyA s’intègre dans la membrane de la cellule de l’hôte et forme des pores (54). La lyse cellulaire consécutive peut promouvoir la croissance bactérienne par relargage de nutriments et de fer. Des études montrent également un impact non seulement sur les cellules urothéliales (exfoliation), mais également sur les macrophages (55). En induisant la protéolyse de facteurs clés de la signalisation cellulaire, HlyA peut altérer la réponse inflammatoire. Dans les communautés bactériennes intracellulaires observées en modèle murin, le gène hlyA est hautement exprimé (56). hlyA est plus souvent associé aux souches de pyélonéphrites que aux E. coli isolés dans les cystites ou bactériuries asymptomatiques (46,57).
d) Le facteur de nécrose cytotoxique 1 (CNF 1)
Le facteur de nécrose cytotoxique 1 (CNF1) est une autre toxine produite par certains uropathogènes. Chez les UPEC, le gène cnf1 codant pour cette toxine est systématiquement retrouvé associé à l’opéron hlyCABD. CNF1 est une cyclomoduline qui interagit avec la voie de signalisation des Rho-GTPases, impliquées dans la structure du cytosquelette et le cycle cellulaire (58). Les conséquences de l’exposition cellulaire à CNF1 peuvent être observées sur la phagocytose (augmentation de l’internalisation bactérienne) ou l’apoptose (voies de signalisation anti-apoptotiques induites) (59,60). Il en résulte une tendance à faciliter et prolonger la colonisation de l’arbre urinaire par le pathogène (13). Lors d’une bactériémie, CNF1 présenterait un effet pro-inflammatoire contrecarré par HlyA, auquel il est systématique associé, et qui exerce son effet toxique sur les cellules immunitaires (monocytes) (61). La présence du gène cnf1 est associée avec le groupe phylogénétique B2 des E. coli et plus fréquente dans les souches isolées d’urosepsis ou d’infections urinaires que dans les souches fécales (53,62).
24 e) Les sidérophores
Parce que le système immunitaire tend à séquestrer les métaux pour ralentir la croissance bactérienne, notamment au niveau de l’urine vésicale, des systèmes performants de captation du fer sont également considérés comme des facteurs de virulence des uropathogènes (63). Le fer est en effet essentiel à différents processus du métabolisme bactérien. Les mécanismes d’acquisition du fer sont souvent multiples chez les UPEC : transporteurs de fer ferreux, récepteurs membranaires à l’hème, sidérophores… (31,63).
Les sidérophores sont des chélateurs du fer. Ils capturent le fer ferrique couplé à des protéines telles que la transferrine puis s’attachent à un récepteur membranaire qui permet l’internalisation du complexe sidérophore-métal puis le relargage au niveau cytoplasmique. E. coli produit jusqu’à quatre types de sidérophores : la yersiniabactine, l’aérobactine, l’entérobactine et les formes glycosylées de cette dernière, les salmochélines (63). L’entérobactine est produite par tous les E. coli, contrairement aux salmochélines, l’aérobactine et la yersiniabactine qui appartiennent au répertoire variable et sont codées par des îlots de pathogénicité portés notamment par des souches du groupe B2 (répertoire le plus varié) comme les souches associées aux infections urinaires. Au contraire de l’entérobactine, la yersiniabactine, l’aérobactine et les salmochélines ne sont pas reconnues et neutralisées par la lipocaline-2 de l’hôte qui est sécrétée dans la réponse immune innée (63). D’un point de vue chimique il s’agit de métabolites secondaires de bas poids moléculaire qui appartiennent à deux grandes familles : (i) les hydroxamates pour l’aérobactine (ii) les peptides non ribosomaux (NRP) ou hybrides polykétides-peptides non ribosomaux (PK-NRP) pour les trois autres (Figure 6).
25
Les gènes impliqués dans la biosynthèse ou codant pour les récepteurs de ces sidérophores sont largement exprimés au sein du tractus urinaire lors d’une infection (66). Par ailleurs, l’aérobactine est plus volontiers associée à des souches provoquant des infections compliquées, comme des pyélonéphrites ou des prostatites qu’à des cystites (67).
4) Les bactériuries asymptomatiques : particularités
Des souches de E. coli peuvent aussi coloniser les voies urinaires sans pour autant entraîner une symptomatologie clinique : il s’agit des souches de bactériuries asymptomatiques (ABU pour asymptomatic bacteriuria). Elles vivent dans le tractus urinaire dans un mode de vie proche du commensalisme. Dans certains cas, leur élimination par traitement antibiotique augmente le risque de survenue et de récurrences d’infections urinaires symptomatiques (68). Elles auraient donc un rôle protecteur vis-à-vis des infections si bien que certaines souches sont considérées comme de véritables probiotiques.
Une souche en particulier a été très bien documentée, il s’agit de E. coli ABU83972, un véritable prototype d’ABU, devenu souche de référence. Cet E. coli a été isolé chez une fillette suédoise colonisée pendant trois années, sans ressentir de symptômes urinaires (69). E. coli ABU83972 possède des caractéristiques bien adaptées au système urinaire. En particulier, sa croissance dans l’urine est rapide, et, lorsqu’elle est mise en compétition in vitro avec des souches d’UPEC comme les E. coli CFT073 ou Nu14, elle surpasse largement l’uropathogène (70). En particulier, des systèmes de captation du fer (sidérophores et autres) semblent en jeu puisque lors de la colonisation de l’arbre urinaire humain par E. coli ABU83972 ils sont largement exprimés (71).
Le génome de E. coli ABU83972, comme de nombreuses souches cliniques de bactériuries asymptomatiques, comporte des gènes qui codent pour des facteurs de virulence impliqués dans les infections urinaires (par exemple : hly, cnf1, fimH…) (46,72). Cependant, dans un certain nombre de cas, les ABU se distinguent des UPEC par moins de virulence, soit en raison de l’absence de gène codant pour les facteurs de virulence des UPEC, soit en raison d’une faible expression de ces gènes ou de mutations ponctuelles. Par exemple, nombreuses sont les souches d’ABU non hémolytiques, à l’adhérence modifiée (mutations de papG par exemple) ou encore avec un O-antigène du lipopolysaccharide (LPS) tronqué, sans doute par évolution à partir d’une souche uropathogène (72– 74).
Les propriétés probiotiques de E. coli ABU83972 ou de E coli HU2117 (mutant de délétion ΔpapG de E. coli ABU83972) ont été reproduites chez l’Homme lors d’essais cliniques, afin de prévenir la survenue d’infections urinaires symptomatiques (75). L’inoculation intravésicale de ces souches chez des
26
patients avec des troubles de la fonction vésicale comme des vidanges incomplètes de la vessie permet une colonisation à long terme de l’arbre urinaire. La fréquence des infections urinaires symptomatiques est diminuée dans la plupart des études, bien que réalisées sur un petit nombre de sujets, sans apparition d’effets secondaires majeurs (76–80).
5) Douleur dans les infections urinaires et bactériuries asymptomatiques
Les mécanismes physiopathologiques induisant et diminuant la douleur au niveau urinaire suite à une infection sont actuellement mal connus. Les modèles d’étude animaux ne permettent qu’une approche partielle de cette sensation subjective, notamment par l’observation d’une allodynie qui est une hypersensibilité à un stimulus normalement non douloureux.
Durant les infections urinaires, la barrière vésicale pourrait perdre sa fonction, en raison d’une apoptose ou exfoliation des cellules urothéliales par exemple médiée par FimH lors de l’invasion par les bactéries, ou bien liée à la sécrétion de toxines bactériennes comme l’hémolysine. L’infection bactérienne est à l’origine d’une inflammation. Des composés (ATP, eicosanoïdes, cytokines, neuropeptides…), en provenance des cellules lysées et des leucocytes amenés par l’infection, peuvent activer les nocicepteurs présents dans le muscle lisse qui tapisse la paroi vésicale, mais également au niveau de la lamina propria voire en contact étroit avec l’urothélium (81). Ils peuvent induire une douleur par déclenchement directement de potentiels d’action neuronaux ou indirectement par diminution du seuil d’activation neuronal, les rendant plus sensibles (Figure 7). Il existe des récepteurs canaux ioniques (ou TRP pour transient receptor potential) sensibles à différentes substances ainsi qu’aux variations de température et qui vont entraîner la dépolarisation de la terminaison libre puis activer les canaux sodiques à l’origine de la transduction du signal. Au niveau de la vessie, dans le cas d’une inflammation liée à une infection, les médiateurs inflammatoires pourraient ainsi diminuer les seuils de douleur liée au remplissage vésical (81).
La douleur serait en partie médiée par le récepteur TLR4 (Toll-like receptor 4) (82) au LPS bactérien, présent sur les macrophages et entraînant leur activation, l’urothélium (83), mais également coexprimé avec TRPV1 (transient potential receptor vanilloide 1) sur des neurones nociceptifs (84). C’est le TLR4 des cellules non-hématopoïétiques qui serait en cause (85). La stimulation du récepteur TLR4 urothélial pourrait augmenter l’expression et la sensibilité de TRPV1 (86). TRPV1 est un récepteur TRP qui joue un rôle important dans l’augmentation de la sensibilité vésicale aux distensions dans un contexte inflammatoire (87). Par ailleurs, une étude a montré une implication d’un autre récepteur, mGluR5 (récepteur métabotropique au glutamate 5), dans le développement d’une hyperalgésie lors de la distension de la vessie au cours d’une infection à E. coli (88). Ces différents mécanismes pourraient également être impliqués dans la persistance de la douleur à distance de l’infection bactérienne.
27
Figure 7 : Douleur inflammatoire dans l’infection urinaire. Les composés en provenance de cellules lysées ou de leucocytes peuvent déclencher une douleur ou diminuer le seuil de déclenchement d’un signal douloureux. D’après (81).
Toutefois, les facteurs bactériens à l’origine de la douleur lors d’une infection urinaire sont mal connus. Ainsi, des études ont porté sur les mécanismes bactériens qui permettent d’expliquer l’apparition de douleur en modèle murin après une infection par un UPEC et non lors d’une colonisation par E. coli ABU83972. La douleur observée en modèle murin durant une infection est ainsi indépendante FimH, à l’origine de l’apoptose des cellules urothéliales (89). Dans cette même étude, l’inflammation ne semble pas différente durant une infection par une UPEC ou par E. coli ABU83972 et ne permet donc pas d’expliquer les différences en termes de douleur.
La variabilité de la réponse douloureuse pourrait être médiée par la variabilité du LPS bactérien, notamment de la partie glycosylée (O-antigène), tronquée chez E. coli ABU83972 contrairement à la plupart des UPEC (85). Rudick et al. ont ainsi étudié la douleur induite par des extraits de LPS de E. coli ABU83972 dans un modèle murin. Ces extraits n’entraînent pas de douleur dans ce modèle (au contraire d’extraits de LPS de l’UPEC E. coli Nu14) et même diminuent la douleur induite par une infection urinaire avec l’UPEC E. coli Nu14 lorsqu’ils sont administrés 24h après (89). L’hypothèse proposée par les auteurs est celle d’une compétition au niveau de TLR4.
28
III) L’îlot pks
A) Présentation
1) Historique
L’importante diversité des phénotypes et des pathologies observés est liée à la diversité génétique des souches de E. coli. Elle repose en particulier sur l’acquisition ou la perte de facteurs d’adaptation ou de virulence. Les gènes qui codent pour ces facteurs d’adaptation ou de virulence peuvent être portés par des éléments génétiques mobiles, comme les îlots génomiques. Certains îlots génomiques portent des îlots de pathogénicité qui regroupent un cluster de gènes impliqués dans la virulence.
En 2006, un nouvel îlot de pathogénicité a été décrit, l’îlot pks (90). Il a été découvert suite à la mise en évidence d’un phénotype de mégalocytose chez des cellules eucaryotes en culture infectées par certaines souches de E. coli et non expliqué par les toxines altérant le cycle cellulaire de l’hôte connues à cette époque. Les enzymes codées par les gènes de cet îlot correspondent à des enzymes impliquées dans une machinerie de biosynthèse de type polykétide-peptide non ribosomal synthase (PK-NRPS), d’où le nom îlot pks. Les effets observés lors de cette découverte ont été reliés à une génotoxine, nommée la colibactine, de nature PK-NRP. Par la suite, d’autres métabolites d’intérêt biologique ont été découverts lors d’études sur le rôle physiopathologique de l’îlot pks chez différentes souches bactériennes et le fonctionnement de la machinerie de biosynthèse codée par cet îlot.
2) Structure
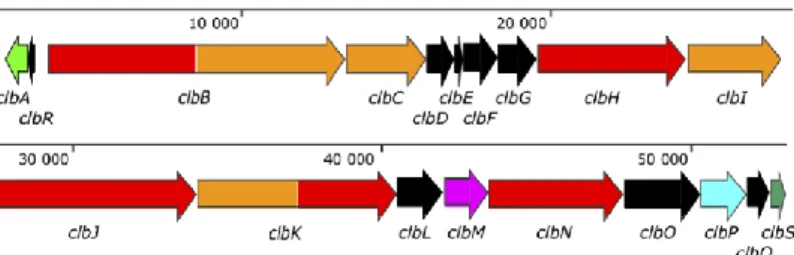
L’îlot pks est un îlot de pathogénicité de 54kb qui comporte 19 gènes qui codent pour différentes enzymes (Figure 8) (90,91). La plupart de ces enzymes sont impliquées dans une machinerie de biosynthèse de type mégasynthase.
3) Epidémiologie
Parmi les E. coli, l’îlot pks est retrouvé quasi exclusivement chez des souches du groupe phylogénétique B2, auquel appartient la majorité des souches d’UPEC (92). Il est hautement conservé. Il est également présent chez d’autres entérobactéries comme Klebsiella pneumoniae, Enterobacter aerogenes ou Citrobacter koseri (93). On retrouve également des analogues chez des espèces bactériennes du genre Pseudovibrio isolées d’éponges (94).
Figure 8 : L’îlot pks. L’îlot génomique pks comprend 19 gènes codant des PK-synthases (PKS), des NRP-synthases (NRPS), ou des hybrides PKS-NRPS, une phosphopantéthéinyl transférase (PPTase), des enzymes accessoires, une pompe à efflux, une peptidase périplasmique, et une protéine de résistance. D’après (91).
29
L’îlot pks est fréquemment associé à d’autres facteurs de virulence, étant présent chez des souches du groupe B2. La présence de l’îlot génomique pks est épidémiologiquement associée à un potentiel accru pour la bactérie de causer une bactériémie (92).
B) Fonctionnement de la machinerie pks : état de l’art
L’îlot pks code pour une machinerie de biosynthèse hybride de type PK-NRPS. Les polykétides synthases (PKS) et non-ribosomal peptides synthases (NRPS) sont deux types de machineries de biosynthèse fonctionnant selon une logique très proche qui s’apparente à celle d’une chaîne de montage d’usine (Figure 9).
Le métabolite PK-NRP principal issu de la PK-NRPS codée par l’îlot pks est la colibactine, produite initialement sous forme d’une prodrogue, la précolibactine. D’autres composés sont également relargués lors du fonctionnement de la machinerie de biosynthèse codée par cet îlot mais les études ont essentiellement porté sur l’élongation complexe à l’origine de la toxine (95–98).
La machinerie codée par l’îlot pks utilise comme monomères des acides aminés, des acides aryles (NRP) ou des acides organiques (PK), mais également des substrats moins conventionnels qui permettent de synthétiser des métabolites indépendamment des ribosomes. Les différents métabolites sont produits par élongation d’un oligomère avec ajout séquentiel et dans un ordre défini des monomères préalablement activés par différentes enzymes PKS et NRPS (99). La diversité des métabolites produits et l’originalité de la structure de la colibactine proviennent à la fois de la diversité des monomères utilisés et de leur agencement et modification.
30
Figure 9 : a) Biosynthèse de la colibactine et des différents intermédiaires de biosynthèse. Les deux voies possibles de la biosynthèse via ClbK sont représentées en bleu (A et B). Dans la voie A, une unité aminomalonyl-ACP (en rouge) est incorporée dans la molécule en cours d’élongation aboutissant à la formation du composé 10. Dans la voie B, cette étape n’existe pas, et aboutit directement à la synthèse des composés 8 et 9. b) Structures des différentes précolibactines proposées et reportées. D’après (96). Abréviations des noms de domaines : A, adenylation; ACP, acyl carrier protein; AT, acyltransferase; C, condensation; Cy, cyclization; DH, dehydratase; E, epimerase; ER, enoyl reductase; KR, ketoreductase; KS, ketosynthase; Ox, oxidase; PCP, peptidyl carrier protein.
La phosphopantéthéinyl transférase (PPTase) ClbA est indispensable à l’activation de la machinerie de biosynthèse. Elle est responsable de la thiolation post traductionnelle (apport d’un groupement terminé par une fonction thiol) des domaines et est codée par le gène clbA (90). C’est au niveau de ces domaines de thiolation (acyl carrier protein ACP et peptidyl carrier protein PCP) que va être fixé l’oligomère en cours d’élongation via la fonction SH (thioester) apportée (Figure 9).
La NRPS ClbN est ensuite la première enzyme à intervenir dans la synthèse de la colibactine. Il s’agit, comme la plupart des enzymes PK-NRPS, d’une enzyme comportant plusieurs domaines avec des fonctions différentes qui s’organisent sur le même modèle. Son domaine d’activation (adenylation A ou acyl transferase AT) lui permet de reconnaître et activer le monomère à ajouter, ici la L-asparagine. Grâce à la coopération des domaines de condensation (condensation C ou ketosynthase KS) et d’épimérisation accessoire (epimerase E), elle va permettre d’en obtenir le précurseur initial N-myristoyl-D-asparagine (ou C14-Asparagine ou C14-Asn) par acylation (100,101) (Figure 9). Il est
31
ensuite pris en charge par ClbB, la seconde mégasynthase active, et l’élongation se poursuit avec les enzymes NRPS, PKS et PK-NRPS CblC-H-I-J-K. Un motif cyclopropane est incorporé qui proviendrait de la S-adénosylméthionine fixée à un des domaines d’activation de ClbH (102,103). Un autre substrat est original, il s’agit de l’aminomalonyl. Il est formé à partir de L-sérine grâce à l’intervention des enzymes accessoires ClbD-E-F et d’un domaine activé de ClbH (104). C’est ensuite ClbG, une acyltransférase, qui transfère l’aminomalonyl aux différents modules PKS accepteurs potentiels de la machinerie (105). Selon son incorporation ou non par ClbK, différentes structures de précolibactines ont été proposées récemment par Li et al. (96) (Figure 9).
ClbQ est une thioestérase de type II. Ces enzymes ont normalement un rôle d’édition en enlevant les substrats non-conformes et les intermédiaires chargés de manière aberrante. Une fois libérés, les métabolites peuvent encore subir des modifications enzymatiques (99). Il n’y a aucun autre domaine thioestérase codé par l’îlot pks (90). ClbQ permettrait de diriger et contrôler le flux des différents intermédiaires ou précolibactines produits lors du fonctionnement de la machinerie de biosynthèse (95,96).
Cet équipement enzymatique est complété par une pompe d’efflux codée par clbM. Cette pompe périplasmique appartient à la famille des transporteurs MATE (Multidrug And Toxic compound Extrusion) et permettrait le transport de la colibactine du cytoplasme vers le périplasme (106,107). Le clivage de la précolibactine par ClbP, une peptidase périplasmique ancrée à la membrane, libère enfin le C14-Asn formé à la toute première étape de la biosynthèse (100,101,108,109).
Les mécanismes à l’origine du relargage extracellulaire de la colibactine « active » à partir du périplasme ne sont à ce jour pas connus. L’activation de la précolibactine en colibactine au niveau du périplasme et non du cytoplasme bactérien pourrait être un des mécanismes de protection du propre ADN (acide désoxyribonucléique) de la bactérie (110). L’îlot pks code également pour une protéine de résistance à la colibactine, ClbS, non nécessaire à l’activité génotoxique, mais qui protège les bactéries productrices de génotoxine de l’autotoxicité induite par cette dernière notamment grâce à une activité cyclopropane hydrolase (111,112).
La protéine ClbR possède un domaine de liaison à l’ADN sans qu’un rôle clair dans la régulation de l’expression de l’îlot pks soit aujourd’hui établi. Il subsiste deux gènes codant pour des enzymes dont le rôle dans la synthèse de la colibactine est mal connu : clbO, qui code pour une machinerie PKS et qui pourrait accepter un résidu aminomalonyl (96,104,110) et clbL, qui code pour une amidase d’après les données in silico, mais sans rôle jusque-là établi (90).
32
C) Diversité des métabolites produits
1) La colibactine
a) Eléments structuraux
Comme nous l’avons vu, la biosynthèse de la colibactine est complexe. Plus qu’une précolibactine, il existe en fait vraisemblablement des précolibactines de structure différente qui vont être clivées par ClbP. On ne connait aujourd’hui que des structures de précolibactines ou d’intermédiaire, la structure des colibactines étant déduite de ces dernières. La ou les colibactines génotoxiques sont en effet très réactives et probablement produites en faible quantité ce qui a tenu en échec pour le moment toute tentative d’isolement et d’élucidation structurale. L’ensemble des études des chimistes sont donc réalisées sur différents mutants de gènes de l’îlot pks (ΔclbP notamment, mais également ΔclbQ…) afin d’accumuler certains intermédiaires en amont des enzymes délétées et en déterminer la structure. Il faut donc garder à l’esprit que cette approche, pour l’instant la seule disponible, induit des biais importants dans l’élucidation structurale. En effet, il n’est pas impossible que l’interruption d’une des étapes de la biosynthèse perturbe le cheminement et l’élongation de l’oligomère et induise des « erreurs » ou redirige la biosynthèse vers des métabolites qui n’auraient normalement pas été produits, notamment grâce ou à cause de l’édition par ClbQ. De même, la persistance du C14-Asn chez un mutant ΔclbP pourrait entraîner des remaniements comme des cyclisations donnant lieu à des interprétations erronées (113).
Différents intermédiaires ont permis d’établir des hypothèses quant à la partie réactive de la colibactine. Un motif dit en « ogive » a été tout d’abord proposé (Figure 10 A.) (114). Ce cycle électrophile est similaire à celui retrouvé chez différents agents alkylants de l’ADN. De plus, le noyau bithiazole, confirmé chez différents mutants, est analogue aux motifs de certaines molécules aux propriétés intercalantes (bléomycine…) (105,114). Plus récemment, suite à la mise en évidence de l’incorporation possible d’un résidu aminomalonyl lors de la biosynthèse, une autre structure radicalement différente a été proposée (96). Le motif bithiazole pourrait disparaitre au profil d’un macrocyle, toujours avec des propriétés génotoxiques (96) (Figure 10 B.).
Figure 10 : Différentes structures de colibactines proposées. A. Structure avec cycle réactif en ogive. B. Structure avec macrocycle incorporant un résidu aminomalonyl (en rouge). D’après (95).
Noyau bithiazole Cycle spiro-cyclopropane en
« ogive »