Impact de l’homogénéisation partielle de la matière
grasse du lait et de l’homogénéisation haute
pression (HHP) du lait écrémé sur ses aptitudes à la
transformation fromagère
Mémoire
Marie-Pier B.Vigneux
Maîtrise en sciences et technologie des aliments
Maître ès sciences (M. Sc.)
Québec, Canada
Impact de l’homogénéisation partielle de la matière
grasse du lait et de l’homogénéisation haute
pression (HHP) du lait écrémé sur ses aptitudes à la
transformation fromagère
Mémoire
Marie-Pier B.Vigneux
Sous la direction de :
Yves Pouliot, directeur de recherche
Michel Britten, codirecteur de recherche
iii
Résumé
L’homogénéisation est un traitement mécanique qui par ses effets de cavitation, turbulence et cisaillement, modifie les propriétés des globules gras (GG) et si appliqué à de hautes pressions, diminue la taille des micelles de caséine. Ce projet visait à déterminer les effets de l’homogénéisation d’une portion de la matière grasse (MG) et de l’homogénéisation haute pression de la fraction maigre sur les aptitudes à la transformation fromagère du lait.
La MG laitière a été homogénéisée avant d’être utilisée en fabrication fromagère. L’homogénéisation a provoqué une diminution de la taille des GG et une augmentation de la charge protéique interfaciale. Toutefois, ces effets étaient moins marqués lorsque la teneur en gras était plus élevée au moment de l’homogénéisation. Les laits fromagers ont été standardisés avec des proportions de gras homogénéisé variant de 0 à 100%. Le module d’élasticité du caillé, 60 minutes après l’emprésurage, a augmenté avec la proportion de gras homogénéisé. De plus, l’humidité des fromages et la rétention lipidique ont également augmenté avec la proportion de gras homogénéisé. Cette étude propose de nouveaux leviers technologiques pouvant améliorer les rendements et contrôler la composition des fromages.
Du lait écrémé cru a été homogénéisé à quatre pressions différentes (0, 50, 100, 150 MPa) avec un ou trois passages dans la valve d’homogénéisation. Les laits homogénéisés ont été caractérisés et les propriétés fromagères ont été mesurées. La taille et le potentiel zêta des micelles de caséine ont diminué proportionnellement à la pression d’homogénéisation. Malgré ces effets sur les propriétés structurales des micelles de caséine, l’homogénéisation du lait écrémé n’a pas modifié ses aptitudes à la transformation fromagère. Cette conclusion s’applique toutefois à des pressions d’homogénéisation inférieures à 150 MPa et il serait pertinent d’évaluer l’impact de traitements plus sévères.
iv
Abstract
Homogenization is a mechanical treatment which by its effects of cavitation, turbulence and shear, modifies the properties of milk fat globules (MFG) and if applied at high pressures, decreases the size of casein micelles. This project aimed to determine the effects of the homogenization of a portion of the fat and of the high-pressure homogenization of the skim fraction on the cheesemaking properties of milk.
The milk fat was homogenized before being used in cheese making. The homogenization caused a reduction in the size of the MFG and an increase in the protein load. However, these effects were less pronounced when the fat content was higher at the time of homogenization. The cheese milks were standardized with proportions of homogenized fat varying from 0 to 100%. The storage modulus of the curd, 60 minutes after renneting, increased with the proportion of homogenized fat. In addition, cheese moisture and lipid retention also increased with the proportion of homogenized fat. This study proposes new technological approaches that can improve yields and control the composition of cheeses.
Raw skim milk was homogenized at four different pressures (0, 50, 100, 150 MPa) with one or three passes in the homogenization valve. The homogenized milks were characterized and the cheese properties were measured. The size and zeta potential of the casein micelles decreased with decreasingthe homogenization pressure. Despite these effects on the structural properties of the casein micelles, the homogenization of the skim milk did not alter its cheese processing properties. This conclusion, however, applies to homogenization pressures of less than 150 MPa and it would be pertinent to evaluate the impact of more severe treatments.
v
Table des matières
Résumé _______________________________________________________________ iii Abstract ______________________________________________________________iiv Liste des tableaux ________________________________________________________x Liste des figures ________________________________________________________ xi Liste des abréviations ___________________________________________________ xiii Remerciements _________________________________________________________ xv Avant-propos _________________________________________________________ xvi Introduction générale ___________________________________________________ 1 Chapitre 1 : Impact de l’homogénéisation du lait sur ses aptitudes à la transformation fromagère _____________________________________________________________ 3
1.1 États des connaissances : ________________________________________________ 3
1.1.1 La transformation du lait en fromage ____________________________________________ 3 1.1.1.1 La composition du lait ___________________________________________________ 3 1.1.1.1.1 Eau ________________________________________________________________ 4 1.1.1.1.2 Matière grasse _______________________________________________________ 5 1.1.1.1.2.1 Les globules gras _________________________________________________ 5 1.1.1.1.3 Protéines ___________________________________________________________ 6 1.1.1.1.3.1 Micelle de caséine ________________________________________________ 6 1.1.1.1.3.2 Protéines sériques ________________________________________________ 7 1.1.1.1.4 Glucides ____________________________________________________________ 8 1.1.1.1.4.1 Lactose _________________________________________________________ 8 1.1.1.1.5 Minéraux ___________________________________________________________ 8 1.1.1.1.6 Vitamines ___________________________________________________________ 9 1.1.1.2 La transformation du lait en fromage _______________________________________ 9 1.1.1.2.1 Rôles des constituants majeurs dans le fromage ____________________________ 9 1.1.1.2.1.1 Eau ____________________________________________________________ 9 1.1.1.2.1.2 Matière grasse ___________________________________________________ 9 1.1.1.2.1.3 Protéines ______________________________________________________ 10 1.1.1.2.1.4 Glucides _______________________________________________________ 11 1.1.1.2.1.5 Minéraux ______________________________________________________ 12 1.1.1.2.2 Les étapes de fabrication du fromage ___________________________________ 13 1.1.1.2.2.1 Coagulation du lait _______________________________________________ 13 Standardisation en matière grasse et en protéine du lait __________________________ 13 Ensemencement et maturation du lait _________________________________________ 14 Emprésurage (coagulation) _________________________________________________ 14 1.1.1.2.2.2 Égouttage ______________________________________________________ 15
vi
Décaillage (coupage), brassage et cuisson _____________________________________ 16 Soutirage _______________________________________________________________ 17 Salage _________________________________________________________________ 17 Pressage ________________________________________________________________ 17 1.1.1.2.2.3 Affinage _______________________________________________________ 18 1.1.2 Homogénéisation __________________________________________________________ 18 1.1.2.1 Généralités ___________________________________________________________ 18 1.1.2.2 Principe ______________________________________________________________ 19 1.1.2.3 L’impact de l’homogénéisation du lait sur ses aptitudes à la transformation fromagère
21
1.1.2.3.1 Homogénéisation conventionnelle du lait ________________________________ 21 1.1.2.3.1.1 Impact sur le globule gras _________________________________________ 21 1.1.2.3.1.2 Propriétés de coagulation du lait et de la crème homogénéisés __________ 23 Lait ____________________________________________________________________ 23 Crème _________________________________________________________________ 24 1.1.2.3.1.3 Fromages faits à partir de lait ou crème homogénéisés _________________ 24 Lait ____________________________________________________________________ 24 Crème _________________________________________________________________ 24 1.1.2.3.2 Homogénéisation haute pression (HHP) ou ultra haute pression d’homogénéisation (UHPH) 25
1.1.2.3.2.1 Augmentation de la température durant l’HHP et l’UHPH _______________ 25 1.1.2.3.2.2 Pasteurisation et stérilisation ______________________________________ 25 1.1.2.3.2.3 Réduction ou inactivation de l’activité enzymatique ____________________ 26 1.1.2.3.2.4 Impact sur la taille des micelles de caséine ___________________________ 26 1.1.2.3.2.5 Impact sur la taille des GG_________________________________________ 27 1.1.2.3.2.6 Propriétés de coagulation du lait écrémé et entier traités aux HHP et UHPH 28 Lait écrémé _____________________________________________________________ 28 Lait entier ______________________________________________________________ 28 1.1.2.3.2.7 Fromages produits à partir de lait homogénéisé aux HHP ou UHPH ________ 30 Lait entier ______________________________________________________________ 30
Chapitre 2 : Hypothèse et objectifs ________________________________________ 32 Chapitre 3 : Impact de l’homogénéisation partielle de la matière grasse du lait sur ses aptitudes à la transformation fromagère ___________________________________ 33
3.1 Résumé : ____________________________________________________________ 33 3.2 Introduction : ________________________________________________________ 34 3.3 Matériel et méthode : _________________________________________________ 36
3.3.1 Préparation des échantillons _________________________________________________ 36 3.3.2 Caractérisation des laits de référence __________________________________________ 37 3.3.2.1 Taille des globules gras __________________________________________________ 37 3.3.2.2 Potentiel zêta _________________________________________________________ 39 3.3.2.3 Profil d’écoulement ____________________________________________________ 39 3.3.2.4 Charge protéique ______________________________________________________ 40 3.3.3 Aptitudes à la transformation des laits fromagers _________________________________ 42
vii
3.3.3.1 Cinétique de coagulation ________________________________________________ 42 3.3.3.2 Cinétique de contraction ________________________________________________ 43 3.3.3.3 Fromages modèles à l’échelle laboratoire ___________________________________ 45 3.3.3.3.1 Composition et bilans de masse ________________________________________ 46
3.3.3.3.1.1 Teneur totale en protéine et en matière grasse des laits fromagers et lactosérums 46
3.3.3.3.1.2 Humidité ______________________________________________________ 46 3.3.3.3.1.3 Coefficients de rétention protéiques et lipidiques ______________________ 46 3.3.3.3.1.4 Calculs de rendements ___________________________________________ 47 3.3.3.3.1.5 Teneur en protéine et en matière grasse des fromages _________________ 47 3.3.3.3.2 Propriétés rhéologiques des fromages __________________________________ 47 3.3.3.3.2.1 Rhéologie des fromages __________________________________________ 47 3.3.4 Analyses statistiques ________________________________________________________ 48
3.4 Résultats et discussions : _______________________________________________ 50
3.4.1 Caractérisation des laits de référence __________________________________________ 50 3.4.1.1 Distribution de la matière grasse dans les laits standardisés ____________________ 50 3.4.1.1.1 Taille des globules gras et taux d’expansion de l’aire interfaciale _____________ 50 3.4.1.1.2 Profil d’écoulement __________________________________________________ 52 3.4.1.1.3 Charge protéique ___________________________________________________ 54 3.4.1.1.4 Profil protéique _____________________________________________________ 56 3.4.1.1.5 Potentiel zêta ______________________________________________________ 58 3.4.2 Aptitudes à la transformation fromagère des différents mélanges ___________________ 59 3.4.2.1 La cinétique de coagulation ______________________________________________ 59 3.4.2.1.1 Temps de prise (Tlag) ________________________________________________ 59 3.4.2.1.2 Vitesse maximale de formation du gel (Vmax) ____________________________ 60 3.4.2.1.3 Module d’élasticité du gel à 60 minutes (G’60) ____________________________ 60 3.4.2.2 La cinétique de contraction ______________________________________________ 63 3.4.2.2.1 La constante de vitesse _______________________________________________ 63 3.4.2.2.2 La fraction massique et l’humidité du caillé après 60 minutes ________________ 63 3.4.2.3 Les fromages modèles à l’échelle laboratoire ________________________________ 66 3.4.2.3.1 Composition et bilan de masse_________________________________________ 66 3.4.2.3.1.1 Composition des fromages ________________________________________ 66 3.4.2.3.1.2 Coefficients de rétention protéique et lipidique _______________________ 66 3.4.2.3.1.3 Rendements prédits réels et ajustés ________________________________ 67 3.4.2.3.2 Propriétés rhéologiques des fromages __________________________________ 70 3.4.2.3.2.1 Module d’élasticité (G’) ___________________________________________ 70 3.4.2.3.2.2 Tangente de l’angle de phase (tgδ) __________________________________ 70
3.5 Conclusion : _________________________________________________________ 72 3.6 Remerciements : _____________________________________________________ 73
Chapitre 4 : Impact de l’homogénéisation haute pression (HHP) du lait écrémé sur ses aptitudes à la transformation fromagère ___________________________________ 74
viii
4.2 Introduction : ________________________________________________________ 75 4.3 Matériel et méthode : _________________________________________________ 76
4.3.1 Préparation des échantillons _________________________________________________ 76 4.3.2 Propriétés physicochimiques des laits homogénéisés ______________________________ 77 4.3.2.1 Taille et potentiel zêta des micelles de caséine ______________________________ 77 4.3.2.2 Composition de la phase soluble des laits homogénéisés ______________________ 78 4.3.2.2.1 Teneur en protéines sériques et en caséines ______________________________ 78 4.3.2.2.1.1 Protéines sériques _______________________________________________ 79 4.3.2.2.1.2 Caséines _______________________________________________________ 79 4.3.2.2.1.3 Teneur en protéine totale dans les surnageants non acidifiés et acidifiés ___ 79 4.3.2.2.2 Calcium soluble _____________________________________________________ 80 4.3.2.2.3 Hydratation des culots de caséines _____________________________________ 80 4.3.3 Aptitudes à la transformation fromagère des laits homogénéisés ____________________ 80 4.3.3.1 Cinétique de libération du caséinomacropeptide (CMP) _______________________ 80 4.3.3.2 Cinétique de coagulation ________________________________________________ 81 4.3.3.3 Cinétique de contraction ________________________________________________ 83 4.3.3.4 Fromages modèles à l’échelle laboratoire ___________________________________ 84 4.3.3.4.1 Composition et bilan de masse_________________________________________ 84 4.3.3.4.2 Propriétés rhéologiques des fromages __________________________________ 84 4.3.4 Analyses statistiques ________________________________________________________ 84
4.4 Résultats et discussions : _______________________________________________ 85
4.4.1 Propriétés physicochimiques des laits homogénéisés ______________________________ 85 4.4.1.1 Taille et potentiel zêta des micelles de caséine ______________________________ 85 4.4.1.2 Caractérisation de la phase soluble et colloïdale des laits homogénéisés __________ 87 4.4.1.2.1 Phase soluble _______________________________________________________ 87 4.4.1.2.1.1 Calcium soluble _________________________________________________ 87 4.4.1.2.1.2 Protéines solubles _______________________________________________ 88 4.4.1.2.2 Phase colloïdale _____________________________________________________ 89 4.4.1.2.2.1 Hydratation des culots de caséines _________________________________ 89 4.4.2 Aptitudes à la transformation fromagère des différents laits écrémés ________________ 90 4.4.2.1 La cinétique de libération du CMP _________________________________________ 90 4.4.2.2 La cinétique de coagulation ______________________________________________ 91 4.4.2.3 La cinétique de contraction ______________________________________________ 92 4.4.2.4 Les fromages modèles à l’échelle laboratoire ________________________________ 93 4.4.2.4.1 Composition et bilan de masse_________________________________________ 93 4.4.2.4.2 Propriétés rhéologiques des fromages __________________________________ 94
4.5 Conclusion : _________________________________________________________ 94 4.6 Remerciements : _____________________________________________________ 95
Conclusion générale ____________________________________________________ 96 Références ___________________________________________________________ 98 Annexe 1 : Schéma de préparation des collets de gras pour l’analyse de la charge protéique ___________________________________________________________ 105
ix
Annexe 2 : Calcul du taux de récupération des collets de gras durant leur préparation lors de la méthode de la charge protéique _________________________________ 106
x
Liste des tableaux
Chapitre 1
Tableau 1 : Définitions et état physicochimique des constituants du lait adapté de Amiot et al. (2002).
Tableau 2 : Différenciation des types traitements à de hautes pressions.
Chapitre 3
Tableau 1 : Caractéristiques du lait NH (contrôle : standardisé à l’aide d’une crème à 40% de MG non homogénéisée) et du lait de référence H40 (standardisé à l’aide d’une crème homogénéisée à 40% de MG) et du lait de référence H3,5 (standardisé à l’aide de lait homogénéisé à 3,5% de MG).
Tableau 2 : Charge protéique interfaciale du lait NH (contrôle : standardisé à l’aide de crème à 40% de MG non homogénéisée) et du lait de référence H40 (standardisé à l’aide d’une crème homogénéisée à 40% de MG) et du lait de référence H3,5 (standardisé à l’aide de lait homogénéisé à 3,5% de MG).
Tableau 3 : Paramètres de coagulation des différents mélanges de laits. Tableau 4 : Composition et bilan des fromages modèles produits. Tableau 5 : Rhéologie des fromages modèles produits.
Chapitre 4
Tableau 1 : Cinétique de libération du CMP des laits homogénéisés. Tableau 2 : Cinétique de coagulation des laits homogénéisés.
Tableau 3 : Cinétique de contraction des laits homogénéisés. Tableau 4 : Composition et bilan des fromages modèles produits. Tableau 5 : Rhéologie des fromages modèles produits.
xi
Liste des figures
Chapitre 1
Figure 1: Schéma d’un GG natif.
Figure 2 : Schéma d’une micelle de caséine.
Figure 3 : Valve d’homogénéisation à deux étapes pour les produits laitiers : Écoulement du produit à partir de la pompe lors de la première et de la deuxième étape d’homogénéisation.
Figure 4 : Diagramme d’une valve d’homogénéisation. Figure 5 : Schéma de la valve d’homogénéisation.
Figure 6 : Processus qui se produisent dans une émulsion huile dans l’eau durant l’homogénéisation.
Chapitre 3
Figure 1 : Schéma de la préparation des laits de référence et des laits fromagers.
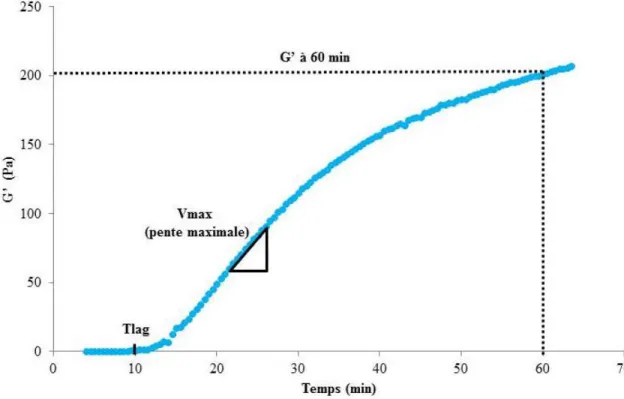
Figure 2 : Exemple de cinétique de coagulation du lait par la présure – évolution du module d’élasticité (G’) en fonction du temps.
Figure 3 : Exemple de cinétique de contraction des caillés à 38°C – évolution de la fraction massique du caillé.
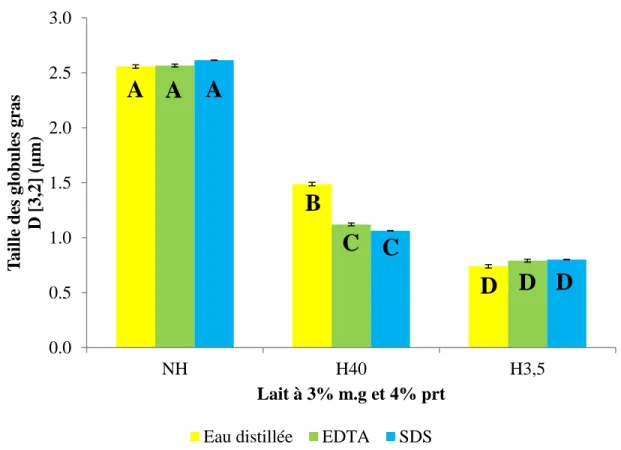
Figure 4 : Taille des GG du lait NH (contrôle : standardisé à l’aide d’une crème à 40% de MG non homogénéisée) et du lait de référence H40 (standardisé à l’aide d’une crème homogénéisée à 40% de MG) et du lait de référence H3,5 (standardisé à l’aide de lait homogénéisé à 3,5% de MG).
Figure 5 : Profil des protéines membranaires obtenues à partir du lait NH (contrôle : standardisé à l’aide de crème à 40% de MG non homogénéisée) et du lait de référence H40 (standardisé à l’aide d’une crème homogénéisée à 40% de MG) et du lait de référence H3,5 (standardisé à l’aide de lait homogénéisé à 3,5% de MG).
Figure 6 : Concentration interfaciale (mg de protéine/m2) en MFGM (jaune), caséines (vert) et protéines sériques (bleu) du lait NH (contrôle : standardisé à l’aide de crème à 40% de MG non homogénéisée) et du lait de référence H40 (standardisé à l’aide d’une crème homogénéisée à 40% de MG) et du lait de référence H3,5 (standardisé à l’aide de lait homogénéisé à 3,5% de MG).
Figure 7 : Effet de la proportion de gras homogénéisé sur le module d’élasticité des gels après 60 minutes de coagulation.
Figure 8 : Effet de la teneur en MG au moment de l’homogénéisation et de la proportion de gras homogénéisé sur les paramètres de contraction des caillés pendant la cuisson Figure 9 : G’ (module de fermeté) en fonction de l’humidité des fromages. Interaction de la teneur en MG au moment de l’homogénéisation et la proportion de gras homogénéisé.
Chapitre 4
Figure 1 : Schéma de préparation des laits homogénéisés à différentes pressions.
Figure 2 : Exemple de cinétique de libération du CMP – libération du CMP en fonction du temps.
xii
Figure 3 : Exemple de cinétique de coagulation du lait par la présure – évolution de la densité optique normalisée (DO/DO0) en fonction du temps.
Figure 4 : Effet de la pression d’homogénéisation du lait écrémé sur la taille (vert) et le potentiel zêta (bleu) des micelles de caséine.
Figure 5 : Effet de la pression d’homogénéisation sur la concentration en calcium de la phase soluble du lait écrémé.
Figure 6 : Effet de la pression d’homogénéisation sur la concentration en caséine dans la phase soluble du lait écrémé.
Figure 7 : Effet de la pression d’homogénéisation sur la concentration en protéine sérique dans la phase soluble du lait écrémé.
Figure 8 : Effet de la pression d’homogénéisation sur l’hydratation des culots de caséines dans la phase colloïdale du lait écrémé.
xiii
Liste des abréviations
c Constante de vitesse de libération du caséinomacropeptide CLHP Chromatographie Liquide Haute PerformanceCMP Caséinomacropeptide
DO Densité optique
DTT Dichlorodiphényltricloroéthane E3,5 Émulsion à 3,5% de matière grasse E40 Émulsion à 40% de matière grasse EDTA Éthylène diamine tétraacétique
FMC60 Fraction massique du caillé après 60 minutes de coagulation
G’ Module d’élasticité
GG Globule gras
H3,5 Lait homogénéisé à 3,5% de matière grasse H40 Lait homogénéisé à 40% de matière grasse HHP Homogénéisation haute pression
ICP-OES Spectroscopie de plasma à couplage inductif optique à émission k Constante de vitesse de contraction du caillé
MFGM Protéine membranaire des globules gras
MG Matière grasse
MPC Concentré de protéines de lait
NH Lait non homogénéisé
SDS Dodécylsulfate de sodium
SDS-PAGE Électrophorèse sur gel de polyacrylamide dodécylsulfate de sodium tgδ Tangente de l’angle de phase
Tlag Temps de prise
UHPH Ultra haute pression homogénéisation Vmax Vitesse de formation du gel
xiv
«Une personne qui n’a jamais commis d’erreurs n’a jamais tenté d’innover.» Albert Einstein
xv
Remerciements
Pour commencer, je voudrais remercier mon directeur de recherche, Yves Pouliot, de m’avoir donné l’opportunité de faire des études de deuxième cycle au sein de son équipe. Malgré la distance, il a toujours su répondre rapidement à mes interrogations. Je souhaite également remercier mon codirecteur, Michel Britten, pour son appui constant. Sa porte était toujours ouverte pour répondre à mes nombreuses questions, il était toujours présent pour m’aider.
Je souhaite aussi remercier mes collègues du Centre de Recherche et Développement de Saint-Hyacinthe (CRD Saint-Hyacinthe) et les assistantes de recherche, Hélène, Nathalie, Annie et les deux Sophie. Je remercie également Diane Gagnon pour son soutien durant les commandes de matériel et durant ma maîtrise. Je veux aussi remercier mon stagiaire, William Villeneuve pour son excellent travail durant son stage d’été. Cecim’a permis de compléter mon objectif deux en une session seulement malgré toutes les embûches avec l’écrémeuse, l’homogénéisateur et la charge protéique.
Je souhaite remercier Novalait inc., le Fond de Recherche du Québec et Technologies, le Ministère de l’Agriculture, des Pêcheries et de l’Alimentation du Québec d’avoir rendu possible ce projet grâce à leur soutien financier.
Pour finir, je remercie mes parents, Guylaine et Michel et mon conjoint, Tommy pour leur soutien constant durant ma maîtrise.
xvi
Avant-propos
Les recherches de ce mémoire de maîtrise portant sur l’effet de l’homogénéisation du lait sur ses aptitudes à la transformation fromagère ont été réalisées dans le cadre du projet sur l’impact des traitements mécaniques du lait financé par Novalait inc, le Fond de Recherche du Québec et Technologies et le Ministère de l’Agriculture, des Pêcheries et de l’Alimentation du Québec.
Le présent mémoire est composé de quatre chapitres. Le premier chapitre consiste en une revue de littérature portant sur la composition du lait, les étapes de fabrication fromagère et l’impact de l’homogénéisation du lait sur ses propriétés fromagères. Le deuxième présente l’hypothèse et les objectifs de recherche. Le troisième chapitre est rédigé sous forme d’article scientifique, en français et présente les travaux réalisés dans le cadre de l’objectif 1. Le quatrième présente les résultats de l’objectif 2.
Toutes les sections de ce mémoire et l’article scientifique ont été rédigés par Marie-Pier B.Vigneux qui est l’auteure principale. Elle a réalisé toutes les expérimentations de ce projet de recherche ainsi que l’analyse des résultats. Les autres auteurs de l’article sont les Drs Yves Pouliot et Michel Britten respectivement directeur et co-directeur de maîtrise. Ceux-ci ont supervisé ce travail de recherche et participé à l’élaboration des expériences, l’analyse des résultats ainsi qu’à la correction de ce mémoire et de l’article.
1
Introduction générale
Annuellement, 468 tonnes métriques de fromages sont produites au Canada (Statistique Canada, 2016). La productivité des entreprises est fortement liée aux rendements fromagers et divers leviers technologiques sont actuellement disponibles pour les augmenter dont l’enrichissement du lait et l’application de pré-traitements. Parmi ceux-ci, le chauffage du lait est un moyen bien connu pour augmenter la rétention protéique et l’humidité des fromages (St-Gelais and Tirard-Collet, 2002). Toutefois, l’utilisation de lait homogénéisé pour moduler les rendements et les caractéristiques des fromages a été peu étudiée.
En 1899, l’homogénéisateur a été inventé par Auguste Gaulin. Depuis ce temps, l’homogénéisation a été introduite dans l’industrie alimentaire et son utilisation n’a cessé d’évoluer. De nouveaux développements ont été conduits pour répondre aux exigences des consommateurs pour des produits aux textures lisses et stables à l’entreposage (Paquin, 1999). L’homogénéisation est un traitement mécanique pouvant réduire la taille des GG et modifier leur membrane par des effets de cavitation, turbulence et cisaillement. L’homogénéisation du lait comporte généralement deux étapes. La première sert à réduire la taille des GG et la seconde, à perturber les amas formés lors de la première étape (Hardham, 2000). L’homogénéisation est couramment utilisée pour réduire la taille des GG et pour accroître la stabilité des émulsions (Zamora and Guamis, 2014).
L’utilisation du lait entier homogénéisé dans la production de fromage a été peu étudiée. Quelques études ont rapporté une augmentation de la fermeté du gel lors de la coagulation du lait à la présure et une diminution de sa capacité de contraction (Peters, 1956, Green et al., 1983). De plus, une diminution des pertes de MG dans le lactosérum a été observée (Peters, 1956, Peters et al., 1958). Une des raisons pour laquelle le lait entier homogénéisé est très peu utilisé en fromagerie est l’apparition de défauts de texture pour certains fromages. Par exemple, lors de la production du Cheddar, le caillé est plus
2
cassant, difficile à manipuler et on enregistre de plus grandes pertes dans le lactosérum (Rao, 1985). L’utilisation de lait homogénéisé pour la production de fromage Mozzarella entraîne des problèmes d’étirement et les fibres se brisent plus rapidement (Lelievre et al., 1990). Toutefois, quelques auteurs ont observé que les défauts occasionnés par l’homogénéisation du lait étaient moins importants lorsque la crème homogénéisée était utilisée (Metzger and Mistry, 1994, Nair et al., 2000, Oommen et al., 2000).
Depuis quelques années, des homogénéisateurs de nouvelle génération peuvent être opérés à de hautes pressions (jusqu’à 400 MPa) (Zamora and Guamis, 2014). Quelques études ont été effectuées sur l’utilisation des ultra hautes pressions d’homogénéisation (UHPH) pour la pasteurisation et stérilisation du lait et la réduction ou l’inactivation de l’activité enzymatique. Aussi, quelques auteurs ont rapporté des temps de coagulation plus courts pour des laits écrémés (Sandra and Dalgleish, 2007, Lodaite et al., 2009) ou entiers (Zamora et al., 2007, Lodaite et al., 2009, Zamora et al., 2012b) traités aux UHPH. Par contre, peu d’études ont été effectuées sur l’effet de l’homogénéisation du lait écrémé sur les caractéristiques des caillés (rhéologie, synérèse) et des fromages (rendement, composition, rhéologie).
Ce projet de recherche vise à évaluer l’impact de l’homogénéisation d’une portion de la MG à des pressions conventionnelles (17,24 et 3,45 MPa) et l’homogénéisation de la fraction maigre à des hautes pressions (jusqu’à 150 MPa) sur les aptitudes du lait à la transformation fromagère. Les résultats obtenus pourront servir de point de départ pour des essais industriels dans le but d’aider les transformateurs à contrôler les rendements fromagers et la qualité des fromages.
3
Chapitre 1 : Impact de
l’homogénéisation du lait sur ses
aptitudes à la transformation
fromagère
1.1 États des connaissances :
Ce chapitre abordera la transformation du lait en fromage ainsi que l’homogénéisation du lait.
1.1.1 La transformation du lait en fromage
Dans cette section, la composition du lait, le rôle des constituants du lait lors de la production fromagère ainsi que les différentes étapes de cette fabrication seront discutés.
1.1.1.1 La composition du lait
Le lait est un aliment complexe composé d’une solution vraie, d’une solution colloïdale, d’une suspension colloïdale et d’une émulsion (Amiot et al., 2002, Chandan and Kapoor, 2011). Le tableau 1 résume les définitions et les compositions des différentes solutions ou suspensions du lait.
4
Tableau 1 : Définitions et état physicochimique des constituants du lait adapté de Amiot et al. (2002).
Solution vraie Suspension
colloïdale Solution colloïdale Émulsion Définitions «Une solution vraie est un mélange de substances liquides ou solides solubilisées, appelées solutés, dans un solvant liquide.» « Une suspension colloïdale est un mélange constitué d'une phase dispersée solide non solubilisée, présente sous forme de très
fines particules solides dans une phase dispersante liquide (S/L).» La solution colloïdale est un mélange similaire à la suspension colloïdale, mais elle s'applique lorsque les particules ont beaucoup d'affinité pour la phase aqueuse.
«Une émulsion consiste en un mélange d'une
phase dispersée non solubilisée, présente sous
forme de gouttelettes, dans une phase dispersante. Les matières
grasses et l'eau du lait forment une émulsion
huile dans l'eau.»
Constituants Glucides et
minéraux Micelles de caséine
Protéines
sériques Matière grasse
Les constituants majeurs du lait de vache sont l’eau (87,5%), la matière grasse (3,7%), les protéines (3,2%), les glucides (4,8%) et les minéraux (0,8%) (Amiot et al., 2002). Des constituants mineurs comme les enzymes et les vitamines sont également présents. Dans les prochains paragraphes, les principaux constituants du lait seront abordés.
1.1.1.1.1 Eau
L’eau est en proportion, le constituant le plus important du lait. Elle est un solvant permettant de solubiliser les glucides, les minéraux solubles ainsi que les colloïdes solubles (protéines sériques) (Amiot et al., 2002). Elle permet également de suspendre les colloïdes insolubles (micelles de caséine) et de disperser les matières grasses (Amiot et al., 2002).
5 1.1.1.1.2 Matière grasse
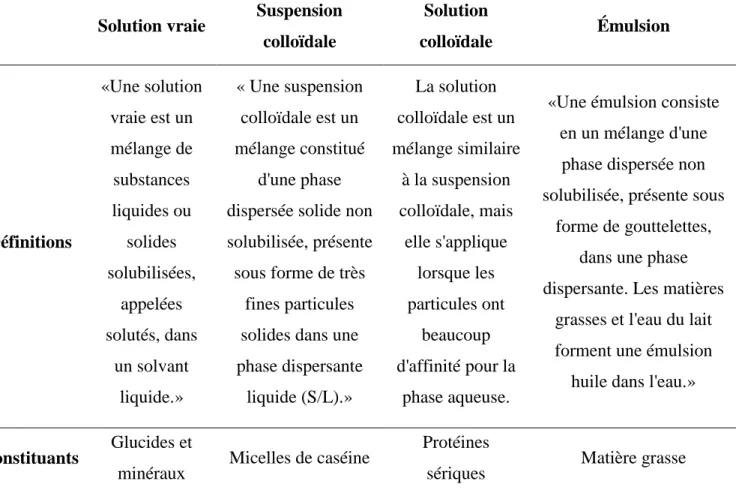
Les triglycérides, les phospholipides (lipides polaires) et la fraction insaponifiable constituent principalement les MG du lait (Amiot et al., 2002). Les triglycérides constituent à plus de 98% la masse des lipides et sont non polaires, n’ayant aucune activité interfaciale (Walstra, 2005f). Les phospholipides qui constituent majoritairement les lipides polaires sont actifs aux interfaces, car ils contiennent des groupes chargés (acides ou basiques) et forment les bicouches de la membrane des GG (Walstra, 2005f). La figure 1 montre la structure d’un GG natif.
1.1.1.1.2.1 Les globules gras
Les GG sont constitués d’une membrane (Pritchard and Kailasapathy, 2011), ainsi que de triglycérides (Walstra, 2005f). Ils sont synthétisés par les glandes mammaires (Walstra, 2005f). Plusieurs facteurs influencent la composition des GG comme la période de lactation, la race, l’espèce, et l’alimentation (Pritchard and Kailasapathy, 2011). De plus, le diamètre des GG varie entre 1 et 20 µm (Pritchard and Kailasapathy, 2011).
6 1.1.1.1.3 Protéines
Les protéines du lait se classent en deux groupes : les caséines (micelles) et les protéines sériques. Les caséines constituent 80% (Davies and Law, 1980, Lucey and Singh, 1997) des protéines totales du lait et précipitent sous l’action de la présure (Amiot et al., 2002) ou de l’acidification à un pH 4,6 (Lucey and Singh, 1997). Pour les protéines sériques, elles représentent 20% (Davies and Law, 1980, O'Mahony and Fox, 2013) des protéines totales du lait et se dénaturent sous l’effet de la chaleur (Amiot et al., 2002, Home and Banks, 2004, O'Mahony and Fox, 2013).
1.1.1.1.3.1 Micelle de caséine
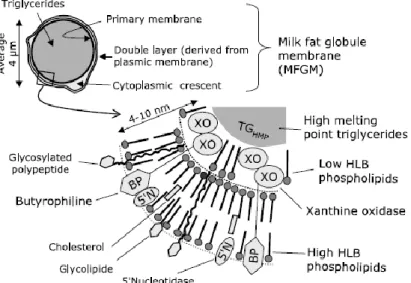
La micelle de caséine est composée de caséine-αs, β et κ. La caséine-κ est principalement à la surface, la caséine-β est surtout présente à l’intérieur et les caséine-αs sont trouvées partout dans la structure (Dalgleish and Corredig, 2012). La composition du lait a un impact sur la taille moyenne des micelles de caséine, mais en général, les diamètres varient de 150 à 200 nm (Dalgleish and Corredig, 2012). La structure de la micelle de caséine n’est pas parfaitement connue et il existe plusieurs hypothèses. Parmi celles-ci, l’hypothèse de l’agrégation des nanogroupes de protéine/phosphate de calcium a été retenue. Ces nanogroupes de protéine/phosphate de calcium interagissent entre eux et avec les caséines par des interactions non covalentes menant à la formation de micelles de caséine (Dalgleish, 2011). La figure 2 montre un modèle récent proposé pour la structure micellaire.
7
Figure 2 : Schéma d’une micelle de caséine. Les caséines-αs et -β (orange) sont liées aux nanogroupes de phosphate de calcium (sphères grises). La caséine-β (bleu) est liée par des liaisons hydrophobes à d’autres caséines et peut être libérée par le refroidissement. La paracaséine-κ (vert) et la chaîne de caséinomacropeptide (noir) forment la surface de la micelle (Dalgleish and Corredig, 2012).
Les micelles de caséine sont fortement hydratées et spongieuses (McMahon and Oommen, 2013). Le taux d’hydratation se situent entre 2-3 g d’eau par g de protéine, dépendant de la méthode de détermination utilisée (Horne, 2008).
1.1.1.1.3.2 Protéines sériques
Les protéines sériques incluent la β-lactoglobuline et l’α-lactalbumine qui sont les plus importantes et des protéines mineures telles la sérum albumine bovine (BSA), les immunoglobulines (Amiot et al., 2002, O'Mahony and Fox, 2013) et la lactoferrine (Amiot et al., 2002).
8 1.1.1.1.4 Glucides
Les glucides du lait sont majoritairement composés de lactose et de quelques autres sucres en concentration plus faible tels le glucose et le galactose (Amiot et al., 2002, Fox, 2009).
1.1.1.1.4.1 Lactose
Le lactose est un sucre réducteur et présent dans le lait de vache à une concentration de 4,8% (Amiot et al., 2002, Fox, 2009). Il participe à la coloration du fromage à pizza mozzarella par la réaction de Maillard (brunissement non enzymatique) (Amiot et al., 2002) qui est une réaction entre les protéines et le lactose (Walstra, 2005c).
1.1.1.1.5 Minéraux
Les minéraux (sels) jouent un rôle majeur dans plusieurs propriétés du lait. Ils sont essentiels à la formation et à la stabilité des micelles de caséine en plus de contribuer au pouvoir tampon acide-base du lait (Lucey and Horne, 2009). Les minéraux existent sous deux formes : sous forme de sels ionisés et solubles dans le sérum ou sous forme insoluble et liés à la structure micellaire (Amiot et al., 2002). Les principaux cations sont le calcium, le potassium, le sodium et le magnésium. Ils forment des sels avec les anions tels les phosphates, les citrates et les chlorures (Amiot et al., 2002, Walstra, 2005f, Lucey and Horne, 2009). Dans les micelles de caséine, le calcium, les citrates, le magnésium et les phosphates constituent la fraction minérale colloïdale (Amiot et al., 2002). Les minéraux influencent grandement la stabilité des protéines pendant les traitements comme le chauffage, la coagulation du lait à la présure, la texture de différents gels de protéine du lait, la texture et la fonctionnalité des fromages ainsi que la stabilité de l’émulsion de la MG (Lucey and Horne, 2009).
9 1.1.1.1.6 Vitamines
Les vitamines sont réparties en deux groupes soient les vitamines hydrosolubles (vitamine C et B) et les vitamines liposolubles (A, D, E et K) (Amiot et al., 2002, Pritchard and Kailasapathy, 2011). Lors de l’écrémage, la concentration en vitamines liposolubles du lait écrémé sera réduite, car elles sont associées aux MG (Amiot et al., 2002).
1.1.1.2 La transformation du lait en fromage
Dans la section suivante, le rôle des constituants majeurs dans la transformation du lait en fromage ainsi que les différentes étapes de production seront discutés.
1.1.1.2.1 Rôles des constituants majeurs dans le fromage 1.1.1.2.1.1 Eau
L’eau joue un rôle majeur sur la fermeté du fromage, qui diminue avec la quantité d’eau retenue dans le caillé pendant la production. De plus, l’eau a un impact sur la croissance des microorganismes, car elle est essentielle à leur survie et à leur croissance. Elle influence la vitesse de fermentation pendant la fabrication et le métabolisme microbien pendant l’affinage des fromages. L’activité enzymatique est proportionnelle à la teneur en eau des fromages. La durée de conservation des fromages dépend aussi de la teneur en eau. Finalement, l’eau a un impact économique important en influençant les rendements fromagers. Plus la teneur en eau des fromages est élevée, plus les rendements sont élevés (St-Gelais and Tirard-Collet, 2002).
1.1.1.2.1.2 Matière grasse
La MG véhicule les composés aromatiques liposolubles et contribue au développement des arômes ainsi que des saveurs dans les fromages (St-Gelais and Tirard-Collet, 2002). De plus, elle participe au transport des vitamines liposolubles (vitamine A, D, E et K) (St-Gelais and Tirard-Collet, 2002). Elle contribue à la formation de la structure d’un fromage (Home and Banks, 2004). Lorsque la concentration en MG augmente, la fermeté
10
du fromage diminue. La MG est finement distribuée dans le fromage et constitue des points de faiblesses dans la matrice protéique. Son rôle est de lubrifier la matrice de caséine sinon la structure du fromage est rigide (St-Gelais and Tirard-Collet, 2002). Lors de la cuisson des fromages, la MG passe à l’état liquide et contribue à la fonte. Elle protège aussi le fromage contre la dessiccation excessive pendant la cuisson. Également, les rendements fromagers sont influencés par la MG. La rétention des MG dans le caillé réduit les pertes dans le lactosérum et augmente les rendements (St-Gelais and Tirard-Collet, 2002).
1.1.1.2.1.3 Protéines
Ce sont les caséines qui produisent la matrice du fromage. Elles forment avec le phosphate de calcium colloïdal, des micelles de caséine stables (St-Gelais and Tirard-Collet, 2002, Walstra, 2005b). L’équilibre minéral des micelles de caséine est modifié par les changements de la température, du pH (Dalgleish and Law, 1988, Walstra, 2005f) et par l’ajout de sel (St-Gelais and Tirard-Collet, 2002). Le calcium affecte les caséines αs1 (Dalgleish and Parker, 1980), αs2 et β (Huppertz, 2013), mais la présure les affecte peu (St-Gelais and Tirard-Collet, 2002). Par contre, l’inverse se produit pour la caséine κ, sensible à la présure (St-Gelais and Tirard-Collet, 2002), mais pas à la présence de calcium (Huppertz, 2013). La transformation du lactose en acide lactique par les bactéries lactiques diminue le pH du lait (St-Gelais and Tirard-Collet, 2002, Chandan and Kapoor, 2011) et par conséquent, l’équilibre des micelles de caséine est déstabilisé par une dissociation du phosphate de calcium (O'Mahony and Fox, 2013). Elles coagulent lorsque le pH atteint le point isoélectrique (~4,6) (O'Mahony and Fox, 2013). Le caillé alors obtenu est de type lactique. Lorsque de la présure de veau (chymosine) est ajoutée, cette enzyme hydrolyse spécifiquement la caséine-κ qui stabilise toutes les autres caséines (αs1, αs2 et β) sous forme micellaire (St-Gelais and Tirard-Collet, 2002). À partir de ce moment, les micelles de caséine deviennent instables et en présence de minéraux, elles forment un réseau de caséine qui se gélifie pour former un caillé plus ou moins ferme. Ce caillé est de type présure (St-Gelais and Tirard-Collet, 2002). Selon le type de caillé produit (lactique ou présure), la caséine va retenir plus ou moins de MG, de minéraux,
11
d’eau et d’éléments solubles (St-Gelais and Tirard-Collet, 2002). De plus, les caséines (structure de base du fromage) contribuent à l’évolution de la texture du fromage durant l’affinage par leur dégradation enzymatique (St-Gelais and Tirard-Collet, 2002). Les caséines hydrolysées par les enzymes bactériens et les enzymes naturellement présents dans le lait en de plus petits constituants (peptides et acides aminés) participent également au développement de saveurs des fromages (St-Gelais and Tirard-Collet, 2002).
Les protéines sériques participent peu au développement de la structure ou des saveurs du fromage puisqu’elles sont solubles et éliminées durant l’égouttage du fromage (St-Gelais and Tirard-Collet, 2002). Les protéines sériques sont toutefois sensibles aux traitements thermiques (thermosensibles) (Pritchard and Kailasapathy, 2011, O'Mahony and Fox, 2013). Lorsque le lait de fromagerie est chauffé, une portion de protéines sériques est dénaturée et s’associe aux caséines par des ponts disulfures, hydrophobes et ioniques (McMahon and Oommen, 2013). Elles restent alors emprisonnées dans la matrice du fromage (St-Gelais and Tirard-Collet, 2002). Du moment que les caséines et les protéines sériques s’associent, la capacité de coagulation du lait à la présure est affectée négativement. De plus, les protéines sériques dénaturées retiennent une forte quantité d’eau. Ainsi, l’ajout de protéines sériques dénaturées au lait fromager permet d’augmenter l’humidité des fromages et les rendements (Mead and Roupas, 2001, Schenkel et al., 2011, Perreault et al., 2016). Par contre, l’ajout d’une trop grande quantité de cette protéine peut provoquer des défauts de texture sur les fromages (St-Gelais and Tirard-Collet, 2002).
1.1.1.2.1.4 Glucides
Le lactose en présence de lactase (β-galactosidase), est hydrolysé en deux monosaccharides : le glucose et le galactose (Walstra, 2005f). Ce sont des sources de carbone pour les bactéries productrices d’acide lactique (Walstra, 2005e). Lorsque le lactose est transformé en acide lactique durant la production fromagère, il provoque l’abaissement du pH et la coagulation du lait. Le lactose force également la
12
déminéralisation des micelles de caséines, favorise la synérèse du caillé et inhibe la croissance de certains microorganismes indésirables (St-Gelais and Tirard-Collet, 2002). Lors de l’étape d’égouttage, une importante quantité de lactose est éliminée dans le lactosérum. La présence de sucres résiduels dans le fromage peut provoquer des réactions non désirées pour certains fromages lorsqu’ils sont soumis à un traitement thermique intense comme la réaction de Maillard (brunissement non enzymatique) (St-Gelais and Tirard-Collet, 2002) qui se produit en présence de protéines (des composés amines; groupements NH2 libres) (Walstra, 2005c). De plus, le lactose résiduel est aussi responsable des problèmes de post-acidification des fromages.
1.1.1.2.1.5 Minéraux
Dans le lait, une partie des phosphates et des citrates de calcium et de magnésium se retrouvent sous forme colloïdale associée aux caséines (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). Environ 65% du calcium total se trouve sous forme colloïdale (Mietton et al., 1994) et la balance, sous forme de complexes solubles et d’ions libres (St-Gelais and Tirard-Collet, 2002). La stabilité des micelles de caséine dépend de l’équilibre entre les formes colloïdales et les formes solubles ioniques ou complexées (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). L’état des micelles de caséine est influencé par plusieurs facteurs tels que le pH, la température, la concentration de sodium, de calcium, de magnésium ou de citrate (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). La stabilité et le comportement technologique du lait sont influencés par l’état d’équilibre des formes calciques (St-Gelais and Tirard-Collet, 2002). Lors de la réfrigération du lait, une partie du phosphate de calcium colloïdal et une partie de la caséine-β sont solubilisées et provoquent une diminution de la taille des micelles de caséine et une augmentation de la stabilité de la dispersion colloïdale. Ceci allonge le temps de coagulation du lait (Mietton et al., 1994). Pour rétablir l’équilibre minéral, des ions de calcium sont ajoutés pour favoriser la restructuration des micelles de caséine (St-Gelais and Tirard-Collet, 2002).
13
1.1.1.2.2 Les étapes de fabrication du fromage
La fabrication fromagère comprend trois grandes étapes soient, la coagulation, l’égouttage et l’affinage. Ces trois principales étapes ainsi que les sous étapes du procédé de production fromagère seront expliquées.
1.1.1.2.2.1 Coagulation du lait
Lors de la coagulation du lait, deux types de caillés peuvent être produits : le caillé de type lactique (par voie acide) ou le caillé de type présure (par voie enzymatique). Pour le caillé de type lactique, un ferment et une petite quantité de présure sont ajoutés au lait (Lucey et al., 2000). La quantité de présure ajoutée varie de 1 à 5 mL pour 100 kg de lait (St-Gelais and Tirard-Collet, 2002) ou 0,2 à 10 mL par 1000 L de lait (Lucey, 2004). La coagulation dure 4 à 18 heures dans le but de laisser le temps à l’acidité de se développer et d’obtenir un caillé dont la capacité de contraction est faible (St-Gelais and Tirard-Collet, 2002). Pour le caillé de type présure, de 15 à 25 mL de présure sont ajoutés pour 100 kg (St-Gelais and Tirard-Collet, 2002, Chandan and Kapoor, 2011). Le temps nécessaire à la coagulation n’excède pas 60 minutes (St-Gelais and Tirard-Collet, 2002) et survient généralement entre 20 et 30 minutes après l’emprésurage (St-Gelais and Tirard-Collet, 2002, Chandan and Kapoor, 2011).
Standardisation en matière grasse et en protéine du lait
La standardisation du lait consiste à ajuster les teneurs en MG et en protéine ainsi qu’à ajouter du chlorure de calcium pour rectifier les effets de la réfrigération et des traitements thermiques du lait (St-Gelais and Tirard-Collet, 2002, Fox and McSweeney, 2004). Les teneurs en protéine et en MG varient durant l’année. Il est donc important d’ajuster le ratio prt/MG en fonction du fromage à produire (St-Gelais and Tirard-Collet, 2002, Bennett and Johnston, 2004) et principalement le ratio gras/caséine (Chandan and Kapoor, 2011).
14
Ensemencement et maturation du lait
Il existe deux types de maturation : une maturation froide et une maturation chaude. La maturation froide consiste à ensemencer le lait dès sa réception à des doses faibles de ferment lactique mésophile et de le laisser au repos à une température variant de 10 à 15°C pendant 12 à 18 heures (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). La maturation froide permet la régénération de la micelle de caséine, favorise l’activité fermentaire pendant la coagulation et l’égouttage (St-Gelais and Tirard-Collet, 2002). De plus, elle contrôle la prolifération des bactéries indésirables et pathogènes par l’action des bactéries lactiques (St-Gelais and Tirard-Collet, 2002). La maturation froide est principalement utilisée dans les fromages à pâtes molles (St-Gelais and Tirard-Collet, 2002). La maturation chaude se différencie par plusieurs facteurs : le taux d’inoculation est environ 10 fois plus élevé, sa température est comprise entre 20 et 40°C et dure 30 à 60 minutes (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). Lors des productions fromagères, la maturation chaude consiste habituellement à ajouter le ferment et le chlorure de calcium au lait à la température d’emprésurage (St-Gelais and Tirard-Collet, 2002). Lors de la maturation chaude, les bactéries ajoutées peuvent s’adapter à leur nouveau milieu (phase de latence) et les équilibres minéraux se rétablissent grâce à l’ajout du chlorure de calcium (St-Gelais and Tirard-Collet, 2002). De plus, cette étape permet de vérifier l’activité des bactéries lactiques et d’agir lorsque le lait est encore liquide (St-Gelais and Tirard-Collet, 2002). Lorsque le fromage est produit à partir d’un lait pasteurisé, il est primordial d’ajouter du chlorure de calcium pour faciliter la coagulation présure (St-Gelais and Tirard-Collet, 2002). La quantité de culture bactérienne est également importante pour atteindre le taux d’acidité optimal et pour contrôler l’humidité, le profil aromatique et la texture des fromages (Chandan and Kapoor, 2011).
Emprésurage (coagulation)
Lors de l’emprésurage, de la présure est généralement diluée dans l’eau avant d’être ajoutée (St-Gelais and Tirard-Collet, 2002). La présure d’origine animale (chymosine et un peu de pepsine) est la plus utilisée. Elle possède une activité très spécifique, car elle hydrolyse presqu’uniquement la caséine-κ (St-Gelais and Tirard-Collet, 2002, Home and
15
Banks, 2004, Walstra, 2005a, Dalgleish and Corredig, 2012). On observe deux phases pendant la coagulation du lait soient, la phase primaire (enzymatique) et la phase secondaire (agglomération) (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). La phase enzymatique correspond à l’hydrolyse de la caséine-k au niveau de la liaison PHE105 et MET106 par l’attaque de l’enzyme (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002, Home and Banks, 2004, Walstra, 2005a, Chandan and Kapoor, 2011). Dès lors, la chaîne peptidique se trouve coupée en deux segments inégaux : d’une part, le segment 1-105, la paracaséine-κ, qui reste liée aux caséines α et β et donc à la micelle de caséine devenue hydrophobe (insoluble) et d’autre part, le segment 106-169, le caséinomacropeptide (CMP), portion hydrophile (soluble) libéré dans le lactosérum (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002, Home and Banks, 2004). La libération du CMP entraîne une diminution importante de la charge électrostatique des micelles de caséine (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002, Home and Banks, 2004) et de leur degré d’hydratation (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). Ces conditions, combinées à une hydrophobicité accrue provoquent le début de la phase d’agglomération des caséines (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). Les micelles instables forment des liens hydrophobes entre les résidus non polaires et des ponts calciques entre les résidus chargés négativement (St-Gelais and Tirard-Collet, 2002). On estime que la phase d’agrégation débute lorsque le taux d’hydrolyse de la caséine-κ atteint 85 à 90% (Green et al., 1978, Dalgleish, 1979). De plus, les sites d’agglomération seraient uniformément répartis, conduisant ainsi à un réseau protéique très lâche emprisonnant la totalité de la phase aqueuse plutôt qu’un précipité (Payens, 1979). Le gel présure obtenu est formé à un pH relativement élevé. Il est donc fortement minéralisé, cohésif et doté d’une forte capacité de synérèse (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002).
1.1.1.2.2.2 Égouttage
L’égouttage est l’étape qui permet l’expulsion du lactosérum par la contraction du caillé. Ce phénomène biochimique et physicochimique s’appelle la synérèse (St-Gelais and Tirard-Collet, 2002). L’expulsion du lactosérum s’effectue par des phénomènes
16
physiques actifs (contraction du gel) et passifs (dus à la porosité et la perméabilité du gel) (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002).
Décaillage (coupage), brassage et cuisson
L’étape d’égouttage débute par le décaillage (coupage) du gel présure. Cette étape permet au lactosérum de se séparer du coagulum (St-Gelais and Tirard-Collet, 2002). Selon le fromage à produire, le gel est coupé en petits cubes entre 0,5 et 2,5 cm de côté (St-Gelais and Tirard-Collet, 2002, Chandan and Kapoor, 2011). L’augmentation de surface permet à une partie du lactosérum de se séparer rapidement du caillé à cause des effets de perméabilité ou de contraction du gel (St-Gelais and Tirard-Collet, 2002). Le drainage du lactosérum est influencé par la taille des grains de caillé (Dejmek and Walstra, 2004, Chandan and Kapoor, 2011). Pour les fromages à pâte ferme, on coupe les grains finement (0,5-1 cm) (St-Gelais and Tirard-Collet, 2002, Chandan and Kapoor, 2011) et pour les fromages à pâte molle, le coupage est plus grossier (2-2,5 cm) (St-Gelais and Tirard-Collet, 2002, Chandan and Kapoor, 2011).
Les grains de caillé se contractent rapidement après le coupage et ont tendance à s’agglomérer et sédimenter au fond du bassin lorsque l’acidification est très active (St-Gelais and Tirard-Collet, 2002). Le brassage continu des grains est nécessaire après les avoir laissés se raffermir pendant 10 à 15 minutes après le décaillage (St-Gelais and Tirard-Collet, 2002, Chandan and Kapoor, 2011). L’agitation améliore la synérèse du caillé (Dejmek and Walstra, 2004) et l’acidité permet une contraction/synérèse plus poussée (Chandan and Kapoor, 2011).
L’augmentation de la température (cuisson) est utilisée pour favoriser la contraction du gel (synérèse) (St-Gelais and Tirard-Collet, 2002). Durant la cuisson, la production d’acide se poursuit et le pH diminue favorisant davantage la synérèse du caillé (Chandan and Kapoor, 2011). Les caséines forment de nouvelles liaisons entre les acides aminés de nature hydrophobes sous l’effet de la chaleur (St-Gelais and Tirard-Collet, 2002). Selon le fromage à produire, les températures de cuisson pourront atteindre 37 à 55°C (Mietton
17
et al., 1994, St-Gelais and Tirard-Collet, 2002). Il est important de bien contrôler la température et le temps de cuisson pour atteindre les cibles d’humidité et de texture du fromage. L’augmentation de la température doit se faire graduellement pour éviter la formation d’une peau (coiffage) à la surface des grains (St-Gelais and Tirard-Collet, 2002). Lorsque ce phénomène se produit, le lactosérum est plus difficile à expulser et les grains resteront plus humides. Les premières cinq minutes de cuisson sont les plus importantes (St-Gelais and Tirard-Collet, 2002). Lors de celles-ci la température ne devrait jamais augmenter de plus d’un degré Celsius (St-Gelais and Tirard-Collet, 2002). De façon globale, une augmentation d’un ou deux degrés Celsius toutes les cinq minutes devrait être effectuée.
Soutirage
Le soutirage consiste à retirer le lactosérum après la cuisson du caillé lorsque le pH désiré est atteint (Chandan and Kapoor, 2011).
Salage
L’ajout du sel répond à plusieurs besoins. Il ralentit ou arrête l’acidification du caillé (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). Il prévient la déminéralisation excessive de la pâte et complète l’égouttage par effet osmotique(Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). Il contrôle également la prolifération des bactéries pathogènes ou nuisibles et sélectionne les microorganismes utiles à l’affinage (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002).
Pressage
Le pressage est l’étape finale de l’égouttage et donne la forme finale au fromage par l’expulsion du lactosérum et le renforcement de la soudure des grains (Mietton et al., 1994). Le caillé est placé dans des moules et une pression (1,5 à 40 kPa) est appliquée pendant une période variant de 2 à 24 heures, à une température demeurant entre 20 et 30°C (St-Gelais and Tirard-Collet, 2002). Pour favoriser le drainage de l’eau durant le pressage, l’acidité doit augmenter légèrement (St-Gelais and Tirard-Collet, 2002).
18 1.1.1.2.2.3 Affinage
L’affinage est l’étape où le développement des saveurs et des textures s’effectue par la transformation des substrats par les microorganismes et les enzymes présents dans le fromage (Mietton et al., 1994, St-Gelais and Tirard-Collet, 2002). Durant cette période, le contrôle de l’humidité de la salle d’affinage est primordial dans le but de limiter le dessèchement du fromage et de contrôler les microorganismes indésirables (St-Gelais and Tirard-Collet, 2002). De plus, le contrôle de la quantité d’oxygène dans les salles d’affinage permet la sélection des microorganismes (St-Gelais and Tirard-Collet, 2002). La température moyenne des salles d’affinage est de 10°C et peut varier selon le fromage produit (St-Gelais and Tirard-Collet, 2002).
1.1.2 Homogénéisation
Dans cette section, le principe de l’homogénéisation ainsi que les différences entre l’homogénéisation conventionnelle et l’HHP du lait seront abordés.
1.1.2.1 Généralités
L’homogénéisation est principalement utilisée pour stabiliser les émulsions en réduisant la taille des GG ce qui permet d’éviter le crémage durant l’entreposage des produits. En général, le traitement d’homogénéisation est appliqué en deux étapes. La première a pour but de réduire la taille des GG alors que la deuxième perturbe les amas qui se sont formés pendant la première étape (Hardham, 2000).
Les améliorations techniques ont permis le développement d’homogénéisateurs pouvant être opérés sur une large gamme de pression. Les traitements d’homogénéisation sont généralement classifiés selon la pression appliquée (tableau 2).
19
Tableau 2 : Différenciation des types de traitements à de hautes pressions.
Types Gamme de pression Type de
valve
Homogénéisation conventionnelle 14 à 70 MPa Dynamique
Homogénéisation Haute Pression (HHP) ou Ultra Haute Pression
d'Homogénéisation (UHPH)
Tout dépendant de la pression utilisée, la technologie est appelée différemment1
Dynamique HHP 150-200 MPa1
UHPH 350-400 MPa1 1
(Broyard and Gaucheron, 2015)
1.1.2.2 Principe
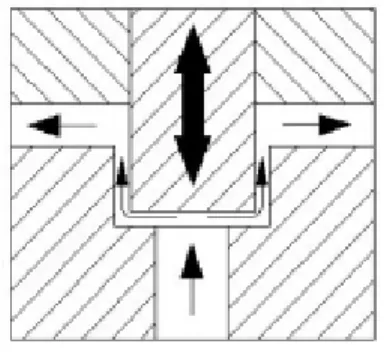
Tous les homogénéisateurs sont composés d’une pompe à haute pression qui force le liquide à passer par une étroite ouverture qui est appelée la valve d’homogénéisation. Lors du traitement d’homogénéisation, le liquide possède un haut potentiel d’énergie à l’entrée de la valve (Walstra, 2005d). Cette énergie est convertie en énergie cinétique (Walstra, 2005d). Tandis que la haute vitesse du liquide dans l’ouverture étroite de la valve conduit à d’intenses turbulences (Walstra, 2005d). Le temps de passage du liquide dans la valve est court (< 1 ms) et l’énergie cinétique du liquide est principalement dissipée sous forme d’énergie thermique (Walstra, 2005d). Dans le cas des émulsions, une faible quantité d’énergie cinétique est utilisée pour briser les GG (< 0,1%) et est convertie en énergie interfaciale (Walstra, 2005d). Les figures 3 à 5 montrent la structure d’une valve d’homogénéisation et son fonctionnement.
20
Figure 3 : Valve d’homogénéisation à deux étapes pour les produits laitiers : Écoulement du produit à partir de la pompe lors de la première et de la deuxième étape d’homogénéisation (Kutz, 2013).
Figure 4 : Diagramme d’une valve d’homogénéisation (Kutz, 2013).
21
1.1.2.3 L’impact de l’homogénéisation du lait sur ses aptitudes à la transformation fromagère
Dans cette section, l’impact de l’homogénéisation conventionnelle et les UHPH sur les aptitudes à la transformation fromagère seront abordés.
1.1.2.3.1 Homogénéisation conventionnelle du lait
L’homogénéisation conventionnelle est largement utilisée dans le domaine laitier pour réduire la taille des GG et stabiliser les émulsions (Zamora and Guamis, 2014).
1.1.2.3.1.1 Impact sur le globule gras
Lors de l’homogénéisation, les GG natifs du lait sont mécaniquement déformés. Initialement leur taille est comprise entre 1 et 10 µm et diminue jusqu’à moins de 1 µm (Hardham, 2000). Lors de l’homogénéisation, plusieurs processus surviennent simultanément. Les gouttelettes sont déformées et brisées (Figure 6- ligne 1) et par conséquent l’aire interfaciale totale est augmentée (Walstra, 2005d). Un agent tensio-actif (protéine) vient s’adsorber sur les gouttelettes pour couvrir les nouvelles surfaces (Figure 6- ligne 2) (Walstra, 2005d). Les gouttelettes nouvellement formées entrent en collision avec d’autres et se fusionnent (coalescence) si la charge de protéine en surface est encore faible (Figure 6- ligne 3) (Walstra, 2005d). Par contre, si la quantité de protéine adsorbée est suffisante, les collisions n’ont pas d’effet (Figure 6- ligne 4) (Walstra, 2005d).
22
Figure 6 : Processus se produisant dans une émulsion huile dans l’eau durant l’homogénéisation. Les gouttelettes sont représentées par de minces lignes et le matériel tensio-actif (protéines, par exemple) par d’épaisses lignes ainsi que de points (schématique non à l’échelle) (Walstra, 2005d).
Pour des pressions d’homogénéisation se situant de 6 à 30 MPa, tous les auteurs ont rapporté une diminution de la taille des GG (Green et al., 1983, Cano-Ruiz and Richter, 1997, Thomann et al., 2008, Zamora et al., 2012c) qui se traduit par une expansion de la surface totale des GG. Plusieurs auteurs ont étudié les changements de la membrane des GG après l’homogénéisation (Mulder and Walstra, 1974, Walstra, 2003c). Suite à l’homogénéisation, des protéines solubles (caséines et protéines sériques) sont adsorbées à la surface des GG et forment une nouvelle membrane (Oortwijn and Walstra, 1979, Walstra and Oortwijn, 1982, Walstra, 1983). Plusieurs auteurs ont quantifié et caractérisé les protéines adsorbées à la surface des GG. Certains auteurs ont rapporté des charges protéiques autour de 6-11 mg de protéine/m2 (Oortwijn and Walstra, 1979, McCrae et al., 1994, Tomas et al., 1994, Cano-Ruiz and Richter, 1997) alors que d’autres ont rapporté des charges protéiques nettement plus faibles, autour de 1-2 mg de protéine/m2 (Ye et al., 2002, Zamora et al., 2012a). La quantité de protéines adsobées à la surface des GG suite au traitement d’homogénéisation dépend de plusieurs facteurs soient, la concentration de