AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
Faculté de Médecine PARIS DESCARTES
Année 2017
N° 84
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Patientes à haut risque génétique suivies en IRM mammaire avant
et après annexectomie prophylactique : existe-t-il un lien
entre variation du rehaussement glandulaire et
survenue ultérieure d’un cancer du sein ?
Présentée et soutenue publiquement
le 9 juin 2017
Par
Cécile BERMOT
Née le 20 mai 1987 à Paris (75)
Dirigée par Mme Le Docteur Fabienne Thibault, radiologue
Jury :
M. Le Professeur Olivier Hélénon, PU-PH ……….. Président M. Le Professeur Nicolas Sellier, PU-PH
M. Le Professeur Cédric de Bazelaire, PU-PH
REMERCIEMENTS
A Monsieur le Professeur Olivier Hélénon,
Pour l’honneur que vous me faites de présider cette thèse.
Merci pour vos conseils pédagogiques et votre aide si précieuse tout au long de mon cursus.
A Madame le Docteur Fabienne Thibault,
Pour avoir accepté de diriger cette thèse et de m’avoir confié ce travail.
Tes compétences, ta passion de l'imagerie mammaire et surtout ta patience sont pour moi un modèle.
C’est un immense honneur pour moi d'avoir travaillé avec toi sur ce sujet si passionnant.
A Madame le Docteur Emmanuelle Fourme,
Pour m'avoir expliqué avec tant de ferveur, les modèles de risque et les bases génétiques de notre projet.
Merci d'avoir accepté de juger ce travail.
A Monsieur le Professeur Nicolas Sellier, Pour avoir accepté de juger ce travail de thèse.
Veuillez trouver ici l’expression de mes sincères remerciements et de mon profond respect.
A Monsieur le Professeur Cédric de Bazelaire,
Pour avoir accepté de juger ce travail de thèse et d’apporter à ce jury votre expertise en Veuillez trouver ici l’expression de mes sincères remerciements et de mon profond respect.
A Madame Marie-Christine Gallic,
Pour ton aide si précieuse, lors du recueil de données, et ton implication sans faille pour respecter les "dead-lines".
A mes maîtres d'internat:
Docteur Marc Molho, Docteur Pénélope Labauge, Docteur Yves Lopez, Professeur Elisabeth Dion, Docteur Christian Hubert, Docteur Marc Bintner, Docteur Hervé Brisse, Docteur Anne Tardivon, Docteur Caroline Malhaire, Docteur Sophie Gerber, Docteur Catherine Ala-eddine, Docteur Marie-Dominique Chancelier, Docteur Adel Hamrouni, Docteur Grégoire Bornet, et tous ceux que j'ai eu l'honneur de croiser durant ma formation.
A mes chères anatomopathologistes Versaillaises, Docteurs Baron, Glaser, Socha et Houille-Crépin, qui m'ont accueillie dans leur service avec tant de sympathie, et de joie de vivre. Je me souviendrai longtemps des séances de macro-karaoké-confidences!
A mes anciens co-internes, Chloé Bernard, Anaïs Dzigilewski, Rémi Duprès, Shaffey Elahee, Maxime Sitbon, Pierre Marsault, Marion Morel, Claire Malley, Vincent Gautheron, Antoine Dautruche et tous ceux dont j'ai croisé la route.
A tous les manipulateurs, aide-manipulateurs, techniciennes et secrétaires que j'ai rencontré.
A ma famille:
A mes grands-pères Pépé Edwin et Pépé Jacques, partis bien trop tôt et qui auraient été fiers et si heureux d'être aujourd'hui présents avec nous. Vous êtes avec moi, par le cœur et la pensée, je vous dédie ce travail.
A mes grands mères, Mémé Gina et Mémé Marcelle, mes supportrices de toujours, vous êtes pour moi un modèle vie, et je vous aime tant.
A Maman, qui m'a tantôt soutenue, tantôt portée, mais surtout inlassablement aimée. Merci pour tous les sacrifices que tu as fait pour nous.
A Jean-Marie, c'est toi qui m'a donné l'envie de faire ce métier, premier aveux d'une route déjà bien entamée. Merci de nous avoir élevées Sophie et moi comme tes enfants.
A Salomé et Sophie, mes deux soeurs adorées, avec lesquelles je retrouve mes 10 ans lorsque l'on est réunies! #sistalove
A Pierre et Lucie ma nièce préférée!!!
A mes oncles, Thierry, Jean-Pierre, Gérard tous plus drôles les uns que les autres.
A mes cousines et cousins: Laura, Julie, Alexandre, Thomas et Raphaël
A Anne et Jeff, dont les conseils m'ont été si utiles tout au long de mes études! Et surtout les cours particuliers d'anatomie!!!
A mon père.
A mes amis:
A Blandine, mon amie de toujours et pour toujours, ton soutien sans faille, et ton amitié me sont indispensables.
A Dianou, toi ma sous-colleuse de D4, devenue une amie sans laquelle je n'imagine pas vieillir. A nos quatre-cents coups!
A Nadia, mon amie de si bon conseil, dans toutes les situations de la vie. blanblan, diane, nadia, antoine
A mes amis rencontrés en conf, Lisou, Yoni, Vladus et Matthieu, à nos soirées, nos vacances, nos week-end et notre amitié.
A mes amis radiologues, que j'ai connu le premier jour d'internat: Annalu, Axou et sa malette de nantais, Lulu, Marilou, et Lucas. A nos week-end en sologne, et aux vidéos d'axel!
A mes amis internes de Poissy, qui depuis notre rencontre ont bien repeuplé la planète, Marie-Alice Novillo, Guillaume Grosseau, Arnaud Mailloux et Alex Hong.
Le seul dans ta catégorie, tu es unique et si important pour moi. Merci pour ton soutien dans mon travail, et au quotidien. Je t'aime de tout mon cœur, d'un amour inconditionnel, et inlassable.
SOMMAIRE
REMERCIEMENTS ...2
SOMMAIRE...5
LISTE DES ABREVIATIONS ...7
INTRODUCTION ...8
PARTIEI: PROBLEMATIQUE...10
1- Prédisposition génétique au cancer du sein ...10
2- Stratégies de réduction de risque ...11
3- L'IRM pour le dépistage des femmes à haut risque ...11
4- Analyse du parenchyme mammaire en IRM, potentiel en terme d'information pronostique et prédictive a) Information pronostique ...12
b) Information prédictive de la réponse au traitement ...12
PARTIE II: ETUDE: PATIENTES A HAUT RISQUE GENETIQUE SUIVIES EN IRM MAMMAIRE AVANT ET APRES ANNEXECTOMIE PROPHYLACTIQUE : EXISTE-T-IL UN LIEN ENTRE VARIATION DU REHAUSSEMENT GLANDULAIRE ET SURVENUE ULTERIEURE D’UN CANCER DU SEIN ?...14
I: METHODE ...14
1. Population ...14
2. Sélection des examens d'IRM ...15
3. Analyse des IRM ...16
4. Analyse statistique ...16
II: RESULTATS ...20
1. Résultats descriptifs de la population ...20
1.1 Caractéristiques de la population d'étude ...20
a) Données générales ...20
b) Caractéristiques au moment des IRM et de l'annexectomie ...20
c) Caractéristiques de rehaussement mammaire de fond et de densité sur les deux IRM ...20
a) Description ...21
b) Etude de survie ...22
2- Résultat des analyses statistiques du critère principal de jugement ...23
3- Résultat du critère secondaire de jugement ...24
PARTIE III: ...27
DISCUSSION ...27
1- Rehaussement glandulaire de fond et survenue d’un cancer du sein ...27
2- Densité glandulaire en IRM et cancer ...28
3- Statut (BRCA 1, BRCA 2, et haut risque sans mutation identifiée) et cancer ...29
4- Limites de l’étude ...29 5 - Perspectives ...31 CONCLUSION ...32 BIBLIOGRAPHIE ...33 ANNEXES ...39 RESUME ...42
LISTE DES ABREVIATIONS
BPE: Breast Parenchymal Enhancement (rehaussement mammaire de fond) RR: Risque Relatif
IRM: Imagerie par Résonance Magnétique BRCA: BReast CAncer
BIRADS: Breast Imaging Reporting And Data System IC: Intervalle de confiance
INTRODUCTION
Avec 54000 nouveaux cas par an en France, le cancer du sein est le cancer le plus fréquent de la femme. Dans 90 à 95% des cas, ces cancers surviennent de façon sporadique [1]. Dans 5 à 10% des cas, il existe une prédisposition génétique qui confèrent aux patientes porteuses de ces mutations, un important risque cumulé sur la vie de développer un cancer du sein à un âge de survenue plus jeune (comparativement aux patientes saines). De plus ces patientes mutées développent souvent plusieurs cancers du sein [2, 3-9].
Les patientes à haut risque génétique sont des femmes ayant hérité d'une mutation génétique délétère. Les mieux connues sont les mutations BRCA1 et BRCA2. Dans certains cas, aucune mutation n'est identifiée, mais un niveau de risque élevé est établi, et la patiente est classée "à risque", sur ses antécédents personnels ou familiaux, notamment à l'aide de modèles de risques, comme les scores d'Eisinger et de Claus [10 et annexe].
L'enjeu pour ces patientes, est d'avoir une stratégie de dépistage fiable. Cela passe par un suivi rapproché et plus précoce que dans la population générale. Il est conseillé qu’elles débutent la surveillance 5 ans avant l'apparition du cas index [2]. Le suivi clinique est bisannuel jusqu'à 30 ans. Après 30ans, on ajoute un dépistage annuel par imagerie qui comporte une mammographie couplée à une échographie et une IRM mammaire [2].
Dans une stratégie de réduction de risque, des interventions chirurgicales prophylactiques sont proposées: mastectomie bilatérale, ou annexectomie prophylactique.
Chez les femmes à haut risque, l'utilisation de l'IRM mammaire a transformé la performance du dépistage par rapport au dépistage par mammographie seule [11, 12]. L'IRM repose sur l'emploi de séquences d'acquisitions dynamiques après injection de produit de contraste.
Un des éléments à analyser sur les IRM acquises après injection, est le rehaussement glandulaire de fond (dénommé Breast Parenchymal Enhancement - BPE par les auteurs anglophones). Initialement, celui-ci était décrit afin de rechercher un rehaussement potentiellement masquant, rendant moins précise l'interprétation [13]. Mais plusieurs équipes ont observé que certains facteurs pouvaient modifier l'aspect et l'intensité de ce rehaussement
ménopause, les traitements hormonaux, ou l'annexectomie prophylactique [14-18]. En outre, la chimiothérapie et la radiothérapie diminuent le rehaussement glandulaire de fond après traitement [19-21].
Des études plus récentes se sont intéressées aux liens possibles entre le BPE et le développement d’un cancer du sein. Particulièrement, les études de Deleo MJ [15] et Wu S [22] sur des séries respectives de 55 et 50 patientes avec mutation BRCA ayant eu une annexectomie bilatérale prophylactique, suggèrent qu'il existe un lien entre un rehaussement glandulaire élevé et la survenue de cancer du sein après annexectomie prophylactique.
La susceptibilité de la glande mammaire à réagir aux modifications hormonales, comme celles du cycle menstruel, de la ménopause ou de la privation hormonale par annexectomie, pourrait jouer un rôle sur l'efficacité de cette annexectomie prophylactique [23-26]. Ainsi, le rehaussement glandulaire de fond pourrait être un élément à prendre en compte dans la stratification du risque après annexectomie, en tant que biomarqueur du cancer du sein.
L’objectif de ce travail est de mieux caractériser, chez les femmes à haut risque génétique, le rehaussement de fond de la glande mammaire (BPE) en tant que facteur de risque potentiel de survenue d' un cancer du sein après annexectomie prophylactique.
PARTIE I: PROBLEMATIQUE
1- Prédisposition génétique au cancer du sein:
Le plus souvent, le cancer du sein survient de façon sporadique, sans histoire familiale de cancer du sein. Dans 5 à 10 % des cas, la survenue d'un cancer est en lien avec une prédisposition génétique familiale [2]. Certaines mutations familiales prédisposantes ont été découvertes, notamment les mutations BRCA 1 et BRCA 2 [3-6, 27-28]. Les gènes BRCA1 et BRCA2 sont des gènes suppresseurs de tumeur, siégeant respectivement sur le chromosome 17q et 13q12.3. Leur transmission est autosomique dominante, mais la pénétrance de la maladie est incomplète [7].
Les patientes porteuses des mutations BRCA1 ou BRCA2 ont un risque cumulé de développer un cancer du sein à l'âge de 70 ans, 5 à 7 fois plus élevé que la population générale (57 à 65% pour BRCA1 et 45 à 78% pour BRCA2. Ces patientes développent également des cancers à un âge plus jeune (âge moyen 42.5 ans et 46.8 ans pour BRCA1 et BRCA2 respectivement) [11]. En outre elles présentent également un risque cumulé sur la vie important de développer un cancer de l'ovaire (24% pour BRCA1 et 8% pour BRCA2, versus 1% pour la population générale) [6, 29]. En outre, chaque famille possède un profil génétique de mutation propre (avec une altération différente de l’allèle en fonction des familles) recherché par le test génétique. Voici pourquoi il est nécessaire de connaître le cas index avant toute recherche de mutation dans le reste de la famille. Mais chez certaines patientes à haut risque familial (avec plusieurs cas de cancers au premier degré, ou survenus à un âge jeune) il n'est pas identifié de mutation. Une recherche négative ne signifie pas que les allèles sont indemnes. Il est recommandé que ces patientes sans mutation identifiée bénéficient d'un suivi rapproché, et du même dépistage que les patientes avec une mutation prouvée [30].
Plusieurs scores ont été conçus, afin de déterminer le risque en fonction des antécédents familiaux, et adapter la stratégie de dépistage. Le score d'Eisinger permet d’identifier les familles pouvant justifier d'une consultation d'oncogénétique (cf annexe). Différents modèles, comme celui de Claus [10], permettent une estimation du risque de cancer du sein et de l'ovaire [9]. C'est d'ailleurs le modèle de Claus qui a été choisi par l'Institut Curie pour caractériser la cohorte FAR.
2- Stratégies de réduction de risque:
La mastectomie bilatérale prophylactique est l'un des traitements chirurgicaux proposés. L'annexectomie bilatérale prophylactique permet quant à elle de diminuer significativement le risque de survenue d'un cancer du sein. Selon la méta-analyse de Rebbeck publiée en 2009, [31] une annexectomie prophylactique bilatérale permet en moyenne une réduction de risque de 50% de survenue de cancer du sein pour des patientes présentant une mutation BRCA1 ou BRCA2. Cette réduction peut être expliquée par la privation hormonale [32-35].
3- L'IRM pour le dépistage des femmes à haut risque:
L'utilisation de l'IRM dans le dépistage de ces patientes à haut risque génétique ou familial a transformé la performance de ce dépistage par rapport au dépistage mammographique seul. Le niveau de risque, à partir duquel l'adjonction de l'IRM au dépistage conventionnel par mammographie et échographie est préconisé, varie selon les pays. En Angleterre, la NHS préconise un dépistage par IRM à partir de l'âge de 30 ans, pour des patientes ayant une mutation retrouvée, ou un risque à 10 ans supérieur à 8% de développer un cancer du sein après 30 ans, ou encore un risque à 10 ans supérieur à 20 % chez les patientes de plus de 40 ans [36]. Les américains recommandent d'ajouter un suivi annuel par IRM à partir de 30 ans pour des patientes dont le risque cumulé sur la vie de développer un cancer du sein est supérieur à 20-25% [37]. Enfin, le système de santé Australien, recommande pour ces femmes à haut risque une surveillance clinique régulière et un examen annuel par mammographie, IRM ou échographie, mais l'âge de début et la méthode dépistage par imagerie ne sont pas formellement énoncés [38].
En France, chez les femmes à haut risque familial indemnes, on recommande de débuter une surveillance annuelle 5 ans avant l'âge de l'apparition du cancer index. De 20 à 30 ans, il est recommandé d'effectuer une surveillance clinique rapprochée tous les 6 mois.
Après l'âge de 30 ans, il a été établi par les instances nationales [29, 30], que pour les patientes à haut risque génétique, il est indispensable de réaliser en plus du bilan mammo-échographique, un dépistage annuel par IRM avec injection de produit de contraste.
La sensibilité du couple mammographie et IRM atteint 94% versus 39% pour la sensibilité de la mammographie seule dans le dépistage des femmes à risque [39, 40]. D'autres études montrent également que la sensibilité de la mammographie dans ces population est trop faible,
et que de meilleurs résultats sont obtenus en ajoutant une IRM mammaire annuelle dans leur suivi [12, 41].
4- Analyse du parenchyme mammaire en IRM, potentiel en terme d'information pronostique et prédictive:
Depuis une vingtaine d'années, l'IRM est utilisée comme un outil diagnostique. Elle apparaît de plus en plus comme un outil capable de recueillir des informations à valeur pronostique et prédictive.
a) Information pronostique:
Plusieurs paramètres se sont révélés être en lien avec un sur-risque de cancer du sein, ou une survie diminuée.
Des informations morphologiques, comme la taille de la lésion et le nombre de lésions, sont mieux analysés par l'IRM, et permettent une meilleure stratification du pronostique [42]. Un autre critère morphologique, à prendre en compte, est le type de rehaussement tumoral après injection de produit de contraste. En effet, une prise de contraste tumorale en cocarde, a été corrélée à un sur-risque de mortalité [43, 44].
D'autre part, il a été montré par plusieurs équipes, et notamment par King et al., dans une cohorte de 1275 patientes suivies par IRM mammaire annuelle, dont le niveau de risque de développer un cancer du sein n'était pas précisé, qu'une densité fibro-glandulaire élevée en IRM était associée à un nombre plus important de cancer du sein (risque relatif de 2.3 à 5.1 pour des seins denses versus peu denses) [45, 46]. Ces mêmes auteurs montrent qu'un rehaussement mammaire de fond élevé serait corrélé à un sur-risque de cancer, indépendamment de la densité (risque relatif de 3 à 10).
Parallèlement, Van der Velden et al. montrent que chez des patientes ayant déjà présenté un cancer du sein (ayant pour caractéristique d'exprimer des récepteurs hormonaux mais pas HER2), les patientes présentant un rehaussement mammaire de fond du sein indemne controlatéral le plus élevé, avaient un sur-risque de développer un deuxième cancer [21].
Le rehaussement mammaire de fond pourrait être un élément de prédiction de la réponse au traitement. En effet, Mousa et al. ont montré que le rehaussement mammaire de fond diminuait avec la prise de tamoxifène, et ré augmentait à l'arrêt, avec un effet transitoire [19, 47].
A notre connaissance, aucune étude n'a encore été effectuée afin de rechercher si les patientes dont le BPE ne diminue pas sous tamoxifène, récidivent plus que les autres.
PARTIE II
ETUDE: PATIENTES A HAUT RISQUE GENETIQUE SUIVIES EN IRM MAMMAIRE AVANT ET APRES ANNEXECTOMIE PROPHYLACTIQUE : EXISTE-T-IL UN LIEN ENTRE VARIATION DU REHAUSSEMENT GLANDULAIRE ET SURVENUE ULTERIEURE D’UN CANCER DU SEIN ?
I: METHODE
Notre étude a été approuvée par le comité de recherche clinique de notre établissement (CRI Institut Curie).
1- Population :
L'institut Curie possède une base de données institutionnelle (base "femme à risque") de 1641 patientes, permettant d'enregistrer et de suivre les femmes à haut risque de cancer du sein et de l'ovaire, sur l'histoire familiale ou l'identification d'une mutation prédisposante [48]. Nous avons sélectionné de manière rétrospective, à partir de cette base, les 581 patientes ayant eu une annexectomie prophylactique. Parmi elles, nous avons identifié 282 patientes, ayant eu une IRM mammaire de dépistage avant et après annexectomie prophylactique, qu’elles soient indemnes ou suivies après un cancer du sein. Ces femmes présentaient une mutation BCRA1, une mutation BRCA2, ou un antécédent personnel ou familial de cancer du sein à un âge précoce sans mutation identifiée. Le risque de survenue d'un cancer du sein était calculé selon le modèle de Claus [10], et la patiente était considérée à haut risque à partir du seuil de 40% de risque cumulé sur la vie de développer un cancer du sein [48]. Ces patientes ont été prises en charge dans notre centre entre 2003 et 2013.
Les patientes étaient exclues si elles avaient eu un cancer bilatéral en raison de l’effet potentiel de la radiothérapie sur le rehaussement mammaire, ou si elles avaient eu une mastectomie bilatérale curative ou prophylactique avant la deuxième IRM (n=26). Ces exclusions ont abouti à une cohorte de 258 patientes, parmi lesquelles les deux examens d'IRM mammaire avant et après annexectomie étaient exploitables chez 146 femmes.
Figure 1 : Diagramme de flux de sélection des patientes.
Les informations cliniques suivantes ont été recueillie: existence d'un cancer du sein avant la première IRM, âge et statut ménopausique à l'annexectomie, survenue d'un nouveau cancer du sein après annexectomie (tableau 1 en annexe).
2- Sélection des examens d'IRM :
Nous avons choisi de retenir les IRM post-annexectomie, avec un recul d’au moins un mois par rapport à la chirurgie. En effet, plusieurs équipes ont déjà montré qu'il existait des
variations de rehaussement glandulaire de fond sur un cycle menstruel, ce qui suggère qu’il n’est pas nécessaire d’attendre plus longtemps après l’annexectomie pour voir d’éventuelles modifications de ce critère [18, 24].
Les examens provenaient de l’Institut Curie (en majorité) et d’autres centres. Les examens étaient réalisés en procubitus, avec une antenne sein dédiée, et tous incluaient au minimum des séquences axiales T1 sans suppression de graisse, une acquisition dynamique 3D ou 2D dans le plan axial et des soustractions d'images.
3- Analyse des IRM :
Le rehaussement glandulaire de fond et la densité mammaire ont été comparés avant et après annexectomie prophylactique.
Deux radiologues (sénior et junior) en consensus, ont analysé les IRM avant (IRM1) et après (IRM2) annexectomie prophylactique. Ces IRM étaient affichées côte à côte sur une station de lecture du PACS, ce qui permettait une comparaison des deux examens. La densité mammaire et le rehaussement de fond étaient catégorisés successivement sur l’IRM 1 puis sur l'IRM 2. Tout antécédent éventuel de cancer du sein avec traitement conservateur était connu, l'analyse portant dans ce cas sur le sein controlatéral indemne.
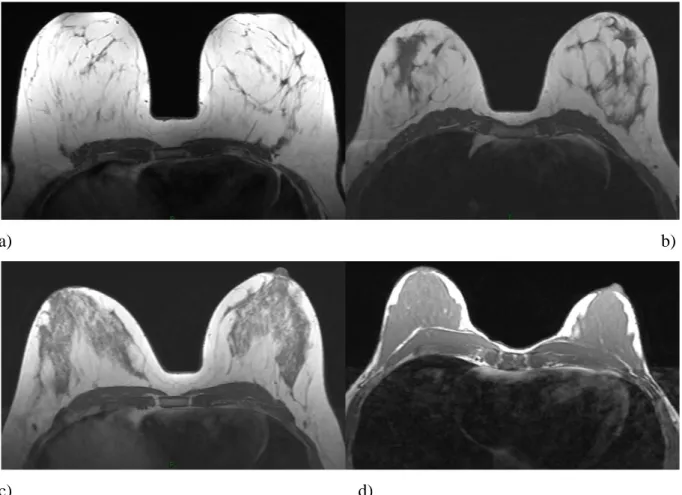
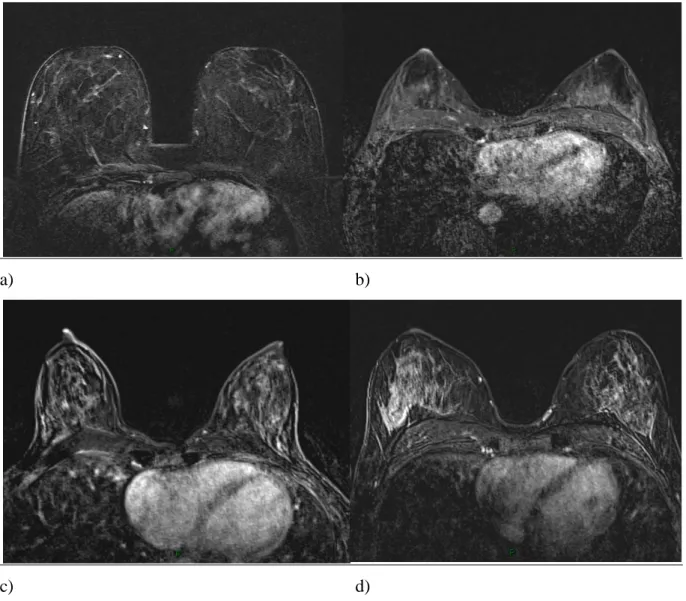
La densité mammaire était analysée sur une séquence axiale T1 sans suppression de graisse, et classée selon les catégories BIRADS IRM [13]: sein graisseux (1), densité fibro-glandulaire éparse (2), sein dense et hétérogène (3), sein extrêmement dense (4) (Figure 2). Le rehaussement glandulaire de fond a été apprécié qualitativement sur la séquence dynamique après injection et soustraction (séquence sans injection soustraite de la 3ème séquence après injection (acquise 1 minute 30 à 2 minutes après injection)). Lorsque les séquences de soustraction n'étaient pas interprétables (environ 5% des cas), nous nous référions aux séquences T1 FAT SAT sans injection et à la 3ème séquence T1 FAT SAT après injection, afin de classer le rehaussement. Le rehaussement était classé selon les catégories BIRADS IRM [13] : minime (A), faible (B), modéré (C) et intense (D) (Figure 3).
4- Analyse statistique :
Une analyse descriptive de l’échantillon d’étude a été effectuée. Les variables qualitatives ont été décrites par leur fréquence et pourcentage, et les variables quantitatives par leur moyenne et écart-type.
Les facteurs identifiés a priori comme pouvant avoir un impact sur le « développement d’un cancer du sein » étaient les suivants : mutation BRCA, âge à l’annexectomie, variation de la densité et variation du rehaussement.
Le délai entre la date de l’annexectomie et la date de survenue ultérieure d’un cancer du sein, ou la date de dernières nouvelles pour les patientes indemnes de cancer a été étudié par la méthode de Kaplan-Meier. Les courbes de survie, pour les variables pouvant avoir un impact sur la survenue d'un cancer, ont été comparées par le test du log-rank.
Dans une seconde approche, les caractéristiques IRM des patientes ayant présenté un cancer après annexectomie et les caractéristiques IRM des femmes indemnes ont été comparées à l’aide du test de Wilcoxon.
Tous les tests statistiques ont été réalisés au risque de première espèce de 5%, avec un intervalle de confiance fixé à 95%. L’ensemble des analyses ont été conduites à l’aide du logiciel R 3.3.2.
a) b)
c) d)
Figure 2: Densité mammaire sur séquences axiales T1 avant injection de produit de contraste. a) Sein graisseux: BIRADS 1
b) Densité fibro-glandulaire éparse: BIRADS 2 c) Sein dense: BIRADS 3
a) b)
c) d)
Figure 3: Rehaussement mammaire sur séquences dynamiques après injection de produit de contraste (séquences sans injection, soustraite de la 3ème séquence après injection).
a) Rehaussement minime: BIRADS A b) Rehaussement faible: BIRADS B c) Rehaussement modéré: BIRADS C d) Rehaussement intense: BIRADS D
II: RESULTATS
1- Résultats descriptifs de la population:(Tableau 1 en annexe) 1.1 Caractéristiques de la population d'étude:
a) Données générales:
Comme décrit dans la méthode, notre population d'étude comportait 146 patientes à haut risque, familial ou génétique, de cancer du sein. L'âge moyen des femmes était de 48.3 ans. Le délai moyen de suivi était de 5.2 ans après l'annexectomie.
Parmi ces patientes, 84 étaient porteuses de la mutation BRCA1 (57.5%), 29 de la mutation BRCA2 (19.9%) et 33 patientes n'avaient pas de mutation identifiée (22.6%). Quatre-vingt-onze patientes, (62.3%) de notre échantillon présentaient un antécédent de cancer du sein avant annexectomie.
b) Caractéristiques au moment des IRM et de l'annexectomie:
Sur les 146 patientes, 25 ont réalisé une annexectomie prophylactique avant l'âge de 40 ans, 71 entre 40 et 50 ans, et 50 patientes après 50 ans.
Dans les données disponibles, 97 patientes étaient ménopausées au moment de l'annexectomie, 36 étaient encore en période d'activité génitale, et nous n'avions pas de renseignement pour 13 patientes. Le délai moyen entre l'annexectomie et la deuxième IRM était de 8.075 mois (écart-type: 4.88).
c) Caractéristiques du rehaussement glandulaire de fond et de la densité mammaire sur les deux IRM:
Catégorie BIRADS n=146 % Rehaussement à l'IRM1 A 46 31.5 B 50 34.2 C 33 22.6 D 17 11.6 Rehaussement à l'IRM2 A 76 52.1 B 55 37.7 C 14 9.6 D 1 0.7 Densité à l'IRM1 1 27 18.5 2 30 20.5 3 42 28.8 4 47 32.2 Densité à l'IRM2 1 31 21.2 2 34 23.3 3 44 30.1 4 37 25.3
Tableau 2 : Rehaussement mammaire de fond et densité glandulaire sur la première et la deuxième IRM. Répartition par catégories BIRADS
1.2Patientes ayant eu un cancer après annexectomie:
a) Description (tableau 4 en annexe):
Dans notre population, 26/146 patientes ont développé un cancer du sein après annexectomie, soit 17.8%. Le délai moyen de survenue après annexectomie était de 2.4 ans, et l'âge moyen de survenue de 45.8 ans. Treize de ces vingt-six patientes avaient déjà eu un premier cancer du sein avant l'annexectomie prophylactique.
Parmi les 26 patientes ayant développé un cancer du sein après chirurgie prophylactique, 16 présentaient une mutation BRCA1 (61.5%), 7 une mutation BRCA2 (26.9%), et 3 patientes n'avaient pas de mutation identifiée (11.5%).
Les caractéristiques de rehaussement et de densité mammaire sur les IRM avant et après chirurgie prophylactique sont présentées dans le tableau ci-dessous (tableau 3):
Catégorie BIRADS n (26) % Rehaussement à l'IRM1 A 3 11.5 B 9 34.6 C 10 38.5 D 4 15.4 Rehaussement à l'IRM2 A 12 46.2 B 10 38.5 C 4 15.4 D 0 0 Densité à l'IRM1 1 1 3.8 2 4 15.4 3 11 42.3 4 10 38.5 Densité à l'IRM2 1 1 3.8 2 6 23.1 3 14 53.8 4 5 19.2
Tableau 3 : Rehaussement mammaire de fond et densité glandulaire chez les patientes ayant développé un cancer du sein après annexectomie. Répartition par catégories BIRADS
b) Etude de survie
Nous avons effectué une analyse de survie selon la méthode de Kaplan-Meier pour chaque sous-groupe (mutation BRCA1, BRCA2 ou haut risque sans mutation identifiée). Il ressort de notre échantillon que les patientes avec mutation BRCA2 et BRCA1 avaient plus de chance de développer un cancer du sein après annexectomie que les patientes sans mutation identifiée. Les courbes de survie sont présentées ci-dessous (Figure 4):
Figure 4: Survie selon le statut BRCA1, BRCA2 ou Haut risque sans mutation identifiée (HR). Analyse selon la méthode de Kaplan-Meier.
2-Résultat des analyses statistiques du critère principal de jugement:
L'objectif principal de notre étude était d'étudier chez des patientes à haut risque génétique, la variation du rehaussement mammaire de fond en IRM avant et après annexectomie, et de rechercher un lien entre cette variation et la survenue d'un cancer du sein après annexectomie. Aucune patiente n'a présenté un rehaussement mammaire majoré lors de la deuxième IRM. Les patientes ayant un rehaussement glandulaire diminué sur la deuxième IRM n'avaient pas un risque moindre de développer un cancer du sein après annexectomie, comparativement aux patientes dont le rehaussement était stable entre les deux IRM (RR 2.19, IC 95% [1-4.77]). La même analyse a été effectuée, en excluant les patientes ayant un rehaussement initial de type A (ne pouvant donc pas chuter après annexectomie). Le résultat est inchangé (RR 1.6, IC 95% [0.68-3.79]).
Nous avons également retrouvé que les patientes présentant initialement un rehaussement mammaire de fond de type C, avaient un risque relatif statistiquement significatif de 3.92 de développer un cancer du sein après annexectomie (IC 95% [1.07-14.3], p< 0.05), comparativement aux patientes avec un rehaussement initial de type A.
cancer du sein. Pour ce faire, nous avons coté le rehaussement en A=1, B=2, C=3 et D=4. D'après le test de Wilcoxon, le rehaussement glandulaire moyen initial s’est avéré significativement différent entre les deux groupes, avec 2.58 dans le groupe avec cancer versus 2.05 dans le groupe sans cancer (p=0.01). La diminution du rehaussement est effective dans les deux groupes, et il n'existe pas de différence significative entre les rehaussements lors de la deuxième IRM pour les deux groupes (1.69 pour le groupe cancer et 1.57 pour le groupe sans cancer après annexectomie, p=0.41) (Figure 5):
Figure 5: Rehaussement glandulaire de fond moyen sur l'IRM 1 et l'IRM 2 pour chacune des catégories avec ou sans cancer développé après annexectomie.
3- Résultat du critère secondaire de jugement:
L'objectif secondaire de notre travail, était de rechercher un lien entre la densité mammaire initiale à l'IRM, et la survenue d'un cancer du sein après annexectomie.
Aucune patiente n'a présenté une densité mammaire plus élevée après annexectomie prophylactique qu'avant cette intervention.
Comparativement aux femmes avec une faible densité mammaire initiale (catégorie 1 de BIRADS), les femmes avec une densité mammaire initiale élevée et hétérogène (catégorie 3 de BIRADS) avaient un risque relatif de 8.28 de développer un cancer du sein après annexectomie (IC 95% [1.07-64.21] p<0.05).
Cancer après annexectomie
La densité moyenne en IRM avant et après annexectomie a été calculé dans les deux groupes de patientes, ayant respectivement développé ou non après annexectomie, un cancer du sein (test de Wilcoxon). Pour ce faire, nous avons coté la densité en valeur absolue (de 1 à 4, parallèlement à la catégorie BIRADS). Après avoir réalisé un test de Wilcoxon, nous retrouvons une différence significative entre la densité initiale chez les patientes avec et sans cancer après annexectomie, respectivement 3.15 versus 2.66 (p=0.05).
La variation de la densité entre les deux IRM, n'a pas montré de différence significative (Figure 6):
Figure 6: Densité mammaire moyenne initiale sur l'IRM 1 pour chacune des catégories avec ou sans cancer développé après annexectomie.
a) b) c) Rehaussement mammaire avant annexectomie prophylactique
d) e) f) Rehaussement mammaire avant annexectomie prophylactique
g) h)
Rehaussement mammaire avant et après annexectomie prophylactique
Figure 7: Exemple de variation de rehaussement mammaire avant et après annexectomie prophylactique chez une même patiente, passant d'un rehaussement de type BIRADS D à BIRADS A, avec conservation d'une densité élevée.
a)et d) Séquences axiales T1 avec suppression de graisse, sans injection
b)et e) Séquences axiales T1 avec suppression de graisse, au temps précoce de l'injection c)et f) Séquences axiales soustraites
PARTIE III
DISCUSSION:
1- Rehaussement glandulaire de fond et survenue d’un cancer du sein:
Dans cette étude, nous avons recherché un lien entre la variation du rehaussement mammaire en IRM, et la survenue d’une cancer du sein après annexectomie chez des patientes à haut risque génétique. Nous n'avons pu objectiver un tel lien statistique, avec la méthode qualitative d'analyse que nous avons utilisée, y compris après exclusion des femmes ayant un rehaussement minimal dès la première IRM.
Dans l’étude de Wu et al.[22], portant sur une population de 50 patientes mutées BRCA1 ou BRCA2, et dont l'objectif était de rechercher un lien entre la variation du BPE avant et après annexectomie et la survenue d'un cancer du sein, les patientes ayant développé un cancer du sein après annexectomie avaient, sur la deuxième IRM, une moindre diminution du rehaussement glandulaire que les patientes indemnes. Ces auteurs ont réalisé leur étude à l'aide de logiciels de segmentation semi-quantitative, permettant une analyse plus précise que l'analyse visuelle que nous avons utilisé pour stratifier le BPE. Une tendance inverse, mais non significative, a été observée dans notre population: dans le groupe des patientes avec cancer, le rehaussement glandulaire moyen après annexectomie est passé de 2.58 à 1.69 (-34.5%), versus 2.05 à 1.57 (-23.4%) dans le groupe sans cancer. Nous n'avons pas d'explication pour ce résultat.
Il n'y a pas à notre connaissance d'autres équipes qui aient travaillé sur l'existence d'un lien entre la variation du BPE avant et après annexectomie, et la survenue d'un cancer du sein après annexectomie chez des patientes à haut risque génétique ou familial de cancer du sein .
En revanche, notre analyse a objectivé une corrélation significative entre survenue d’un cancer après annexectomie et rehaussement mammaire initial élevé. Ces données rejoignent en partie les résultats de DeLeo et al [15], qui portaient sur 55 patientes BRCA1 ou BRCA2, chez qui on recherchait un effet de l' annexectomie prophylactique sur le BPE. Leur stratification du BPE était visuelle, comme dans notre étude. Dans leur étude, les patientes mutées BRCA 1 ou BRCA 2 qui développaient un cancer du sein après annexectomie avaient
patientes restant indemnes. Néanmoins les auteurs n'ont pas spécifiquement regardé la variation du BPE.
Dontchos et al. [49] ont rapporté un lien entre un rehaussement glandulaire élevé et la survenue d'un cancer du sein. Ils disposaient d'une population à haut risque de 487 femmes (mutées BRCA1 ou 2, ou avec un risque cumulé de cancer du sein sur la vie supérieur à 20%) ayant eu une IRM mammaire annuelle, sans préciser si les patientes avaient eu ou non une annexectomie prophylactique. Ils recherchaient chez ces patientes un lien entre le BPE et la survenue d'un cancer du sein. Soixante dix huit pour cent des patientes de leur étude ayant développé un cancer du sein avaient une densité mammaire sur la dernière IRM avant la découverte du cancer, modérée ou élevée (classement BIRADS visuel qualitatif, C ou D).
Les résultats de l'étude de King V[45], portant sur une population de 1275 femmes suivies de façon annuelle par IRM mammaire, dont le niveau de risque de développer un cancer du sein n'est pas précisé, et qui cherchaient un lien entre le BPE et la survenue d'un cancer du sein, montrent que les patientes ayant développé un cancer du sein, avaient un BPE plus important que les patientes indemnes (classification BIRADS visuelle qualitative).
2- Densité glandulaire en IRM et cancer:
Nous avons mis en évidence que les femmes ayant une densité mammaire élevée en IRM avant annexectomie présentaient un sur-risque de développer un cancer du sein après annexectomie.
Nos résultats sont en accords avec ceux de King V et al. [45] qui avaient trouvé, sur une population de 1275 patientes, à large échelle de risque, suivies annuellement en IRM, que les femmes développant un cancer du sein avaient régulièrement une densité mammaire plus importante que des patientes indemnes, indépendamment d'une annexectomie prophylactique (cet évènement n'étant pas précisé par les auteurs).
Dans l’étude présente, nous avons également recherché s'il existait une variation significative de densité mammaire en IRM après annexectomie. Nous n'en avons pas trouvé . Ces constatations sont probablement dues au fait que le temps écoulé entre l'annexectomie et la deuxième IRM ait été court (médiane de 8 mois), et que la densité n'ait pas eu le temps de décroitre. En effet, la densité mammaire, diminue progressivement avec la privation
beaucoup plus lentement que le rehaussement glandulaire après la ménopause [16]. Des variations importantes du rehaussement mammaire de fond au cours même du cycle menstruel ont été mises en évidence par Chen [17] ce qui suggère qu'une privation hormonale brutale comme l'annexectomie, peut avoir un effet rapide sur le BPE. C'est la raison pour laquelle le délai minimum choisi dans notre étude entre l'annexectomie et la deuxième IRM était d'un mois. Si nous avions choisi des IRM plus éloignées de la date de l'annexectomie, nous aurions peut-être pu observer une diminution de la densité mammaire après l'annexectomie. Price et al. [14], dont l'objectif principal était de rechercher l'impact de l'annexectomie prophylactique sur le BPE et la densité mammaire, montrent dans leur étude que plus la date de la deuxième IRM est éloignée de l'annexectomie bilatérale prophylactique, plus la diminution de la densité mammaire en IRM est importante. Ils montrent également que plus les deux IRM sont espacées, plus la densité mammaire diminue sur la deuxième IRM.
3- Statut (BRCA 1, BRCA 2, et haut risque sans mutation identifiée) et cancer:
Dans la présente population, 19% des patientes mutées BRCA1, 24% des BRCA2 et 10% des patientes à haut risque sans mutation identifiée ont développé un cancer du sein. Cette
différence n’est pas significative (Pearson chi-sq=2.595, p=0.273), mais cela pourrait simplement résulter du fait que l'échantillon est trop petit.
Néanmoins, ces résultats suggèrent que les patientes sans mutation identifiée feraient moins de cancer que les patientes BRCA1 ou 2. Il est montré que les patientes BRCA1 et 2
développent souvent plusieurs cancers [50]. Il est difficile de trouver des données applicables en terme de risque à nos patientes sans mutation identifiée. En effet, elles ont été incluses dans cette base en raison de leurs antécédents familiaux, ou personnels, et non sur un
génotype précis. Dans la littérature, les femmes à risque sans mutation identifiée, représentent des populations très hétérogènes en fonction des études, avec un niveau de risque cumulé de cancer du sein souvent différent en fonction des auteurs, ce qui rend les comparaisons difficiles.
4- Limites de l’étude:
Cette étude ne permet pas d'affirmer qu'il existe un lien entre la variation du rehaussement mammaire après annexectomie en IRM et la survenue ultérieure d’un cancer du sein. Ceci pourrait être lié au fait que notre population d'étude est restreinte, et que le nombre
D'autre part, au sein même de la population choisie, 22.6% des patientes sélectionnées étaient à haut risque, sans mutation identifiée. Comme nous l'avons déjà précisé, ces patientes
pourraient peut-être avoir un risque de développer un cancer du sein moins élevé que les patientes BRCA1 ou BRCA2, en raison de l'hétérogénéité du risque cumulé chez ces patientes (incluses à partir d'un risque cumulé supérieur à 40%).
La validité externe de nos résultats, ne peut s'appliquer qu'à une population de femmes à haut risque de cancer du sein, avec ou sans mutation identifiée, suivie de façon annuelle par IRM mammaire et ayant eu une annexectomie prophylactique. En effet c'est chez ces patientes que nous avons montré qu'un BPE élevé avant annexectomie, conférait un sur-risque de
développer un cancer sein, après annexectomie.
Une des limites de notre étude peut provenir de la méthode d'analyse utilisée. En effet, la cotation du BPE et de la densité glandulaire en IRM a été réalisé de manière subjective et qualitative (à l'aide de la classification visuelle BIRADS). Notre étude aurait été plus précise, si nous avions utilisé des logiciels de segmentation automatisés 3D, pour calculer la densité et le rehaussement mammaire en IRM de façon quantitative, comme l'ont fait Schmitz et Van der Velden [51], [21], ou des logiciels semi-automatisés comme les ont utilisés Wu et Chen [22] [17]. L'utilisation de ces logiciels nous aurait permis de nous affranchir du biais de subjectivité des lecteurs.
De plus l'effectif de la population étudiée est assez restreint, et le nombre de cancers retrouvés après annexectomie d'autant plus. Ceci ne nous a pas permis de tester plusieurs facteurs à la fois, en réalisant des analyses multivariées. Nous n'avons pu, toujours en raison d'un faible effectif, réaliser des analyses en sous-groupe en fonction de l'existence ou non d'un cancer du sein avant annexectomie prophylactique. Ceci nous aurait permis d'étudier si un antécédent personnel de cancer du sein avant annexectomie et donc de traitement pouvait jouer sur la survenue d'un nouveau cancer après annexectomie.
Enfin, nous n'avons analysé que la première IRM mammaire disponible après annexectomie. L'analyse des IRM successives après annexectomie mettrait certainement en évidence une variation de la densité glandulaire dont on pourrait rechercher si elle est en lien avec la survenue d'un cancer après annexectomie.
5- Perspectives:
Il serait intéressant de réaliser une étude similaire sur un effectif plus large, de façon
multicentrique et prospective afin d'augmenter la puissance statistique, en s'affranchissant des biais de sélection.
Il serait également intéressant de réaliser une étude prospective chez des patientes à haut risque avec un BPE élevé, traitées de façon préventive par Tamoxifène, et ainsi de rechercher si la diminution du BPE par l'intermédiaire de ce traitement aurait un effet sur la survenue de cancer du sein.
D'autre part, sur plusieurs des IRM mammaires que nous avons lues, que ce soit avant ou après annexectomie, on découvrait des cancers du sein. Or l'effet hormonal d'un cancer du sein sur le micro-environnement mammaire n'est pas connu, et il pourrait influer sur le BPE. Il serait donc intéressant de reprendre chez des patientes a haut risque suivies par IRM mammaire, les IRM précédant la découverte du cancer du sein, et de regarder s'il existe ou non une modification du BPE.
Des études supplémentaires sont nécessaires pour affirmer qu'il existe un lien biologique entre BPE et survenue d'un cancer du sein, et ainsi pouvoir expliquer comment le BPE peut être utilisé comme véritable biomarqueur du cancer du sein.
CONCLUSION
L'objectif de notre étude était de rechercher un lien entre la variation du rehaussement mammaire en IRM après annexectomie prophylactique, et la survenue d'un cancer du sein chez des patientes à haut risque génétique. Ce lien n'a pu être objectivé. En revanche, un sur-risque est apparu lorsque les patientes présentaient un rehaussement mammaire de fond initialement élevé avant annexectomie. La recherche actuelle concernant l'influence des facteurs biologiques, histologiques et hormonaux sur le rehaussement mammaire en IRM et la signification des variations de ce rehaussement devrait dans l'avenir permettre de mieux cerner la valeur pronostique et prédictive potentielle de ce paramètre (utilisé seul ou en association à d'autres facteurs).
BIBLIOGRAPHIE
1.Scheuner MT, McNeel TS, Freedman AN. Population prevalence of familial cancer and
common hereditary cancer syndromes: The 2005 California Health Interview Survey.
Genet Med. 2010;12((11)):726–35.
2.http://www.google.fr/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&ved=0ahUKE
wit0Pe8sr_TAhWDWRoKHUyYABcQFggkMAA&url=http%3A%2F%2Fwww.e-cancer.fr%2Fcontent%2Fdownload%2F84924%2F866279%2Ffile%2Fpec_risque_ma mmaire_ovarien_inca.pdf&usg=AFQjCNGs4w3oPJ8nSpRgZzWz0yovpYL2eQ
3.Antoniou AC, Gayther SA, Stratton JF, Ponder BAJ, Easton DF. Risk models for familial
breast and ovarian cancer. Genet Epidemiol (2000) 18:173–190
4.Antoniou AC, Pharoah PDP, McMullen G, Day NE, Ponder BAJ, Easton DF. Evidence for
further breast cancer susceptibility genes in addition to BRCA1 and BRCA2 in a population based study. Genet Epidemiol(2001) 21:1–18
5.Claus EB, Schildkraut J, Iversen ES Jr, Berry D, Parmigiani G. Effect of BRCA1 and
BRCA2 on the association between breast cancer risk and family history. J Natl Cancer
Inst (1998) 90:1824–1829
6. A. Antoniou& al. Average risks of breast and ovarian cancer associated with BRCA1
or BRCA2 mutations detected in case series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet. 2003 May; 72(5): 1117–1130.
7. Risch HA, McLaughlin JR, Cole DE, Rosen B, Bradley L, Fan I, Tang J, Li S, Zhang S,
Shaw PA, Narod SA. Population BRCA1 and BRCA2 mutation frequencies and cancer
penetrances: a kin-cohort study in Ontario, Canada. J Natl Cancer Inst. 2006 Dec
6;98(23):1694-706.
8.
9. De Pauw A., Stoppa-Lyonnet D., Andrieu N., Asselain B. Estimation du risque de cancer
du sein: intérêt et limites des modèles de calcul de risque. Imagerie de la Femme 2014. 24,
97-104.
10. Elizabeth B. Claus, Ph.D., Neil Risch, Ph.D., and W. Douglas Thompson, Ph.D.
Autosomal dominant inheritance of early-onset breast cancer implications for risk prediction. Cancer 1994
11. Phi XA, Houssami N, Obdeijn IM, et al. Magnetic resonance imaging improves breast
screening sensitivity in BRCA mutation carriers age ≥ 50 years: evidence from an individual patient data meta-analysis. J Clin Oncol. 2015, 33:349–356
12. E Warner, H Messersmith, P Causer , et al. Systematic review: Using magnetic
resonance imaging to screen women at high risk for breast cancer. Ann Intern Med 148:
671– 679,2008
13. American College of Radiology BI-RADS Committee .Breast imaging reporting and
data system. 4th ed. Reston, Va : American College of Radiology , 2003
14.Price ER, Brooks JD, Watson EJ, Brennan SB, Comen EA, Morris EA. The impact of
bilateral salpingo-oophorectomy on breast MRI background parenchymal enhancement and fibroglandulartissue. EurRadiol. 2014 Jan;24(1):162-8.
15. DeLeo MJ 3rd, Domchek SM, Kontos D, Conant E, Chen J, Weinstein S. Breast MRI
fibroglandular volume and parenchymal enhancement in BRCA1 and BRCA2 mutation carriers before and immediately after risk-reducing salpingo-oophorectomy. AJR Am J
Roentgenol. 2015 Mar;204(3):669-73.
16.King V, Gu Y, Kaplan JB, Brooks JD, Pike MC, Morris EA. Impact of menopausal
status on background parenchymal enhancement and fibroglandular tissue on breast MRI. EurRadiol. 2012 Dec;22(12):2641-7.
17.Chen JH, Chen WP, Chan S, Yeh DC, Su MY, McLaren CE. Correlation of endogenous
hormonal levels, fibroglandular tissue volume and percent density measured using 3D MRI during one menstrual cycle. AnnOncol. 2013 Sep;24(9):2329-35
18. Kajihara M, Goto M, Hirayama Y, Okunishi S, Kaoku S, Konishi E, Shinkura N. Effect
of the menstrual cycle on background parenchymal enhancement in breast MR imaging.
MagnReson Med Sci. 2013 Mar 25;12(1):39-45. Epub 2013 Mar 11.
19. Mousa NA, Eiada R, Crystal P, Nayot D, Casper RF. The effect of acute aromatase
inhibition on breast parenchymal enhancement in magnetic resonance imaging: a prospective pilot clinical trial. Menopause. 2012 Apr;19(4):420-5.
20. Chen JH, Yu HJ, Hsu C, Mehta RS, Carpenter PM, Su MY. Background parenchymal
enhancement of the contralateral normal breast: association with tumor response in breast cancer patients receiving neoadjuvant chemotherapy. TranslOncol. 2015
Jun;8(3):204-9.
21. Van der Velden BH, Dmitriev I, Loo CE, Pijnappel RM, GilhuijsKG. Association
between parenchymal enhancement of the contralateral breast in dynamic contrast-enhanced MR imaging and outcome of patients with unilateral invasive breast cancer.
Radiology. 2015 Sep;276(3):675-85.
22. Wu S, Weinstein SP, DeLeo MJ 3rd, Conant EF, Chen J, Domchek SM, Kontos D.
Quantitative assessment of background parenchymal enhancement in breast MRI predicts response to risk-reducing salpingo-oophorectomy: preliminary evaluation in a cohort of BRCA1/2 mutation carriers. Breast Cancer Res. 2015 May 19;17:67.
23 .Pfleiderer SO ,Sachse S , Sauner D , et al. Changes in magnetic resonance
mammography due to hormone replacement therapy. Breast Cancer Res 2004 ; 6 ( 3 ):
R232 – R238 .
24 .Kuhl CK ,Bieling HB , Gieseke J , et al . Healthy premenopausal breast parenchyma
in dynamic contrast-enhanced MR imaging of the breast: normal contrast medium enhancement and cyclical-phase dependency. Radiology 1997 ; 203 ( 1 ): 137 – 144 .
25 .Delille JP ,Slanetz PJ , Yeh ED , Kopans DB ,Halpern EF , Garrido L . Hormone
replacement therapy in postmenopausal women: breast tissue perfusion determined with MR imaging—initial observations . Radiology2005 ; 235 ( 1 ): 36 – 41 .
26 . Müller-Schimpfl e M ,Ohmenhaüser K , Stoll P ,Dietz K , Claussen CD . Menstrual
cycle and age: influence on parenchymal contrast medium enhancement in MR imaging of the breast. Radiology 1997 ; 203 ( 1 ): 145 – 149 .
27. Anglian Breast Cancer Study Group Prevalence and penetrance of BRCA1 and BRCA2
in a population based series of breast cancer cases. Br J Cancer (2000) 83:1301–1308
28.Anton-Culver H, Cohen PF, Gildea ME, Ziogas A Characteristics of BRCA1 mutations
in a population-based case series of breast and ovarian cancer. Eur J Cancer (2000)
36:1200–1208
29.
http://www.e-cancer.fr/Patients-et-proches/Les-cancers/Cancer-du-sein/Facteurs-de-risque/Predispositions-genetiques
30.
http://www.has-sante.fr/portail/jcms/c_1741602/fr/cancer-du-sein-quel-depistage-selon-vos-facteurs-de-risque-questions-/-reponses#toc_4
31.Rebbeck TR, Kauff ND, Domchek SM. Meta-analysis of risk reduction estimates
associated with risk-reducing salpingo-oophorectomy in BRCA1 or BRCA2 mutation carriers. J Natl CancerInst2009; 101 : 80-7
32. Brinton LA, Schairer C, Hoover RN, Fraumeni JF Jr. Menstrual factors and risk of
breast cancer. Cancer Invest 1988;6:245-254
33. Schairer C, Persson I, Falkeborn M, Naessen T, Troisi R, Brinton LA. Breast cancer risk
associated with gynecologic surgery and indications for such surgery. Int J Cancer
1997;70:150-154
34. Parazzini F, Braga C, La Vecchia C, Negri E, Acerboni S, Franceschi S. Hysterectomy,
oophorectomy in premenopause, and risk of breast cancer. Obstet Gynecol
1997;90:453-456
35. Fisher B, Costantino JP, Wickerham DL, et al. Tamoxifen for prevention of breast
cancer: report of the National Surgical Adjuvant Breast and Bowel Project P-1 Study. J
Natl Cancer Inst 1998;90:1371-1388
37. Saslow D. & al. ACS guidelines for breast screening with MRI as an adjunct to
mammography. CA Cancer J Clin 2007. 57, 75-89
38.
https://canceraustralia.gov.au/sites/default/files/publications/nbocc-bog-2010-web-a4-printable_504af02a673fd.pdf
39. Sardanelli F. MRI Recommendation EUSOMA. WG_EJC 2010
40. Wellings E, Vassiliades, Abdalla. Breast cancer screening for high-risk patientes of
different ages and risk- Which modality is the most effective? Cureus 8(12)-e945
41. S McLaughlin, EA Mittendorf, RJ Bleicher , et al. The 2013 Society of Surgical
Oncology Susan G. Komen for the Cure Symposium: MRI in breast cancer—Where are we now?Ann Surg Oncol 21: 28– 36,2014
42. Gilles R, Guinebretière JM, Toussaint C, et al. Locally advanced breast cancer:
contrast-enhanced subtraction MR imaging of response to preoperative chemotherapy.
Radiology. 1994;191:633–638
43.Lee SH, Cho N, Kim SJ, Cha JH, Cho KS, Ko ES, Moon WK. Correlation between high
resolution dynamic MR features and prognostic factors in breast cancer. Korean J
Radiol. 2008 Jan-Feb;9(1):10-8.
44. Alexander M. Th. Schmitz & al. Association between rim enhancement of breast
cancer on dynamic contrast-enhanced MRI and patient outcome: impact of subtype.
Breast Cancer Res Treat (2014) 148:541–551
45. King V, Brooks JD, Bernstein JL, Reiner AS, Pike MC, Morris EA. Background
parenchymal enhancement at breast MR imaging and breast cancer risk. Radiology.
2011 Jul;260(1):50-60.
46. Kim MY, Choi N, Yang JH, Yoo YB, Park KS. Background parenchymal
enhancement on breast MRI and mammographic breast density: correlation with tumour characteristics. ClinRadiol. 2015 Jul;70(7):706-10.
47. Pike MC, Pearce CL Mammographic density, MRI background parenchymal
48. Pascale This, Anne de la Rochefordiere , Alexia Savignoni& al. Breast and ovarian
cancer risk management in a French cohortof 158 women carrying a BRCA1 or BRCA2 germline mutation: patient choices and outcome. Familial Cancer (2012) 11:473–482
49. Dontchos BN, Rahbar H, Partridge SC, Korde LA, Lam DL, Scheel JR, Peacock S, Lehman CD. Are qualitative assessments of background parenchymal enhancement,
amount of fibroglandular tissue on MR images, and mammographic density associated with breast cancer risk? Radiology. 2015 Aug;276(2):371-80.
50. Culver JO, MacDonald DJ, Thornton AA, Sand SR, Grant M, Bowen DJ, Burke H, Garcia N, Metcalfe KA, Weitzel JN. Development and evaluation of a decision aid for BRCA
carriers with breast cancer. J Genet Couns. 2011 Jun;20(3):294-307.
51. Schmitz KH, Williams NI, Kontos D&al. Dose-response effects of aerobic exercise on
estrogen among women at high risk for breast cancer: a randomized controlled trial.
ANNEXES
Tableau 1: Caractéristiques de la population d’étude n (146) % Statut BRCA1 84 57.5 BRCA2 29 19.9 HR 33 22.6 Ménopausée à l'annexectomie Non 36 27.1 Oui 97 72.9 ? 13 Age à l'annexectomie <=40 25 17.1 >50 50 34.2 40-50 71 48.6 Rehaussement à l'IRM1 A 46 31.5 B 50 34.2 C 33 22.6 D 17 11.6 Rehaussement à l'IRM2 A 76 52.1 B 55 37.7 C 14 9.6 D 1 0.7 Variation du rehaussement A initial 46 31.5 Diminution 57 39 Stable 43 29.5 Densité à l'IRM1 1 27 18.5 2 30 20.5 3 42 28.8 4 47 32.2 Densité à l'IRM2 1 31 21.2 2 34 23.3 3 44 30.1 4 37 25.3 Cancer avant annexectomie Non 55 37.7 Oui 91 62.3 Cancer après annexectomie Non 120 82.2 Oui 26 17.8
Tableau 4: Caractéristiques des patientes ayant eu un cancer après annexectomie n (26) % Statut BRCA1 16 61.5 BRCA2 7 26.9 HR 3 11.5 Ménopausée à l'annexectomie Non 9 36 Oui 16 64 ? 1 Age à l'annexectomie <=40 7 26.9 >50 4 15.4 40-50 15 57.7 Rehaussement à l'IRM1 A 3 11.5 B 9 34.6 C 10 38.5 D 4 15.4 Rehaussement à l'IRM2 A 12 46.2 B 10 38.5 C 4 15.4 Variation du rehaussement A initial 3 7.7 Diminution 15 57.7 Stable 8 34.8 Densité à l'IRM1 1 1 3.8 2 4 15.4 3 11 42.3 4 10 38.5 Densité à l'IRM2 1 1 3.8 2 6 23.1 3 14 53.8 4 5 19.2 Cancer avant annexectomie Non 13 50 Oui 13 50
Patientes à haut risque génétique suivies en IRM mammaire avant et après annexectomie
prophylactique: existe-t-il un lien entre variation du rehaussement glandulaire et survenue ultérieure d’un cancer du sein ?
Résumé
Objectif: L'objectif de notre étude était d'évaluer la variation du rehaussement mammaire de fond en IRM avant
et après annexectomie prophylactique chez des patientes à haut risque génétique, et d'établir s'il existait ou non un lien entre cette variation et la survenue d'un cancer du sein après annexectomie.
Méthode: Cent-quarante-six patientes à haut risque, ayant bénéficié d'une annexectomie prophylactique, et
ayant une IRM pré et post-chirurgie ont été inclues. Deux radiologues (sénior et junior), ont coté en consensus et de façon rétrospective le rehaussement mammaire successivement sur la première puis la deuxième IRM en différents types A, B, C ou D, selon la classification BIRADS. La variation de rehaussement a ensuite été corrélée à la survenue d'un cancer du sein après annexectomie.
Résultats: Les patientes qui avaient un rehaussement glandulaire de fond diminué n' avaient pas un moindre
risque de développer un cancer du sein comparativement aux patientes dont le rehaussement était stable entre les deux IRM (RR 2.19, IC 95% [1-4.77]). En revanche, les patientes présentant un rehaussement mammaire de fond initial modéré de type C, avaient un risque relatif statistiquement significatif de 3.92 de développer un cancer du sein après annexectomie (IC 95% [1.07-14.3], p< 0.05), comparativement aux patientes avec un rehaussement type A.
Conclusion: Nous n'avons pas mis en évidence de lien entre la variation du rehaussement mammaire de fond en
IRM avant et après annexectomie prophylactique et la survenue d'un cancer du sein. Il semble néanmoins qu'un rehaussement initial élevé soit à risque de favoriser le développement d'un cancer du sein après annexectomie chez ces patientes à haut risque génétique.
Mots clés: IRM, cancer du sein, rehaussement glandulaire de fond, annexectomie prophylactique, BRCA1,
BRCA2.
Women with high genetic risk followed by MRI before and after salpingo-oophorectomy: is there a link between the change of breast parenchymal enhancement and the developpement of breast cancer after this surgery?
Abstract
Objective: The purpose of our study, was to estimate the change of BPE on contrasted MRI before and after
reduction-risk salpingo-oophorectomy in high genetic risk women, and to determine if this change was associated with breast cancer after this surgery.
Methodes: A hundred and forty-six high genetic risk women who underwent reduction-risk
salpingo-oophorectomy and who had MRI before and after surgery were included. Two radiologists (senior and junior), determined in consensus, and retrospectively the BPE on the first and the second MRI, using BIRADS classification. The change of the BPE was associated with breast cancer after reduction-risk salpingo-oophorectomy.
Results: Our study didn't show low-risk for patients for whom the BPE decreased, versus for whom BPE was
constant (RR 2.19, CI 95% [1-4.77]). On the other hand, patients with high "type C" initial BPE, had an over-risk of delopping breast cancer after salpingo-oophorectomy (RR 3.92, CI 95% [1.07-14.3], p< 0.05), comparing to patients with initial "type A" BPE.
Conslusions: We didn't found a statistical link between the change of BPE before and after reduction-risk
salpingo-oophorectomy, and breast cancer occurence. But it seems however that a high initial BPE further breast cancer after salpingo-oophorectomy, in these high genetical risk population.
Keywords:MRI, breast cancer, BPE, reduction-risk salpingo-oophorectomy, BRCA1, BRCA2.
Université Paris Descartes Faculté de Médecine Paris Descartes
15, rue de l’Ecole de Médecine 75270 Paris cedex 06