EFFET DES IMMUNOGLOBULINES
INTRAVEINEUSES SUR LES LYMPHOCYTES B
MÉCANISMES D'ACTION ET
RÉCEPTEURS IMPLIQUÉS
Thèse présentée
à la Faculté des études supérieures de l'Université Laval dans le cadre du programme de doctorat en Biochimie pour l'obtention du grade de Philosophiae doctor (Ph.D.)
DEPARTEMENT DE BIOCHIMIE ET DE MICROBIOLOGIE FACULTÉ DES SCIENCES ET DE GÉNIE
UNIVERSITÉ LAVAL QUÉBEC
2010
Le plasma récupéré des dons de sang est utilisé pour produire annuellement plusieurs milliers de kg de préparations thérapeutiques d'immunoglobulines pour injection intraveineuse (IglV) qui sont utilisées pour le traitement de patients souffrant d'immunodéficiences primaires ou secondaires. Depuis quelques années, de très fortes doses d'IglV sont également utilisées pour traiter un nombre croissant de maladies autoimmunes, augmentant grandement les risques de pénurie de ce produit pour lequel il n'existe à l'heure actuelle aucun substitut. Il a été rapporté que le traitement in vitro des lymphocytes B humains aux IgPV induit une baisse de leur prolifération ainsi qu'une augmentation de la sécrétion d'IgG. Mes travaux de thèse ont porté sur l'étude des mécanismes par lesquels les IglV agissent sur les lymphocytes B.
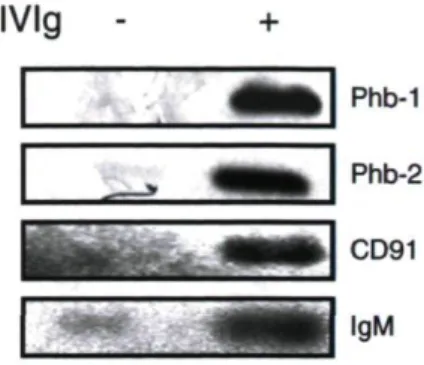
Dans un premier temps, nous avons utilisé une approche d'immunoprecipitation suivie d'analyses par spectrométrie de masse afin d'identifier les molécules ciblées par les IgPV à la surface des lymphocytes B. Comme prévu, nous avons identifié plusieurs protéines membranaires ou associées à la membrane plasmique telles que le CD91, les molécules du CMH I et II ainsi que les prohibitines 1 et 2. Cependant, des protéines strictement intracellulaires ont aussi été identifiées, telles que l'endoplasmine et le LYST (Lysosomal-trafficking regulator). Ces résultats nous ont permis de démontrer que les IglV étaient internalisées de manière spécifique et spontanée par les lymphocytes B activés in vitro et par les cellules myéloïdes dans le sang total.
L'identification de molécules impliquées dans le processus de la présentation antigénique, comme les complexes majeurs d'histocompatibilité (CMH) I et II, nous a conduit à émettre l'hypothèse que les IgPV pouvaient interférer avec ce processus. À l'aide d'un système in vitro de présentation antigénique dépendant du CMH H, nous avons démontré que les IglV inhibaient la présentation d'antigène dépendante et indépendante du récepteur antigénique (BCR). Il a aussi pu être établi que cet effet n'était pas dû à une modulation du niveau de CMH II exprimé à la surface des lymphocytes B ni dépendant du récepteur inhibiteur pour la partie constante des IgG, le FcyRIIb. Nous avons donc proposé un mécanisme dépendant de l'interaction avec des protéines intracellulaires impliquées dans le processus de la présentation antigénique afin d'expliquer cet effet des IglV.
Par la suite, à l'aide d'une lignée cellulaire déficiente pour l'expression du CD91, il nous a été possible de démontrer l'implication de ce récepteur dans l'internalisation spontanée des IglV. De plus, nous avons observé que le traitement aux IglV induit une phosphorylation de la partie intracellulaire du CD91 sur la tyrosine 4507. Nos résultats suggèrent aussi que le CD91 pourrait permettre la transcytose des IglV à travers la barrière hémato-encéphalique.
En résumé, mes travaux de thèse ont identifié le CD91 comme étant impliqué dans le processus d'internalisation spontanée des IglV et suggèrent que cette internalisation est impliquée dans un nouvel effet des IglV sur les lymphocytes B : l'inhibition de la présentation antigénique.
Abstract
The plasma recovered from blood donation is used to produce several thousands of kg of therapeutic preparation of immunoglobulins (IVIg) every year, to treat patients suffering from primary or secondary immunodeficiencies. In recent years, high doses of IVIg are also used to treat a growing number of autoimmune diseases, greatly increasing the risk of shortage of this product, for which there is currently no substitute. It was reported that in vitro treatment of human B cells with IVIg induces a decrease in their proliferation and increases their secretion of IgG. My thesis work focused on studying the mechanisms by which IVIg act on B cells.
Initially, we used an immunoprecipitation approach followed by analysis by mass spectrometry to identify the molecules targeted by IVIg on the surface of B cells. As expected, we identified several membrane proteins or associated with the plasma membrane such as CD91, MHC molecules I and II and prohibitin 1 and 2. However, strictly intracellular proteins have also been identified, such as endoplasmin and LYST (Lusosomal-trfficking regulator). These results led us to demonstrate that IVIg are internalized specifically and spontaneously by activated B cells in vitro and by myeloid cells in whole blood.
The identification of molecules involved in the process of antigen presentation, as major histocompatibility complex (MHC) I and II, led us to hypothesize that PVIg interfered with this process. Using an in vitro system of MHC II antigen presentation, we showed that IVIg inhibited the B cell receptor-dependent and independent antigen presentation. We also demonstrated that this effect was not due to a modulation in the level of MHC II expressed on the surface of B cells or dependent on the inhibitory receptor for the constant region of IgG, the FcyRIIb. We therefore proposed that IVIg inhibit antigen presentation by interacting with intracellular proteins involved in this process.
Subsequently, using a cell line deficient for the expression of CD91, we were able to demonstrate the involvement of this receptor in the spontaneous internalization of IVIg. Furthermore, we observed that treatment with IVIg induces phosphorylation of the intracellular part of CD91 on tyrosine 4507.
spontaneous internalization of IVIg and suggests that this internalization is involved in a new effect of IVIg on B cells, namely the inhibition of antigen presentation.
Avant-propos
Je tiens à remercier ma directrice de recherche la Dre Renée Bazin pour sa confiance et son soutien tout au long de mes études graduées.
Je veux aussi remercier les membres de mon comité aviseur, le Dr André Darveau (codirecteur), la Dre Sonia Néron et le Dr Real Lemieux pour tous les précieux conseils dont ils m'ont fait part et pour toutes les discussions scientifiques que nous avons eues, ainsi que le Dr Yves Biais pour la pré-lecture de ce travail.
Je remercie également Héma-Québec et tout le personnel du département de recherche et développement pour m'avoir permis d'effectuer mes travaux dans un environnement dynamique et stimulant. Je remercie plus particulièrement les membres de mon équipe de recherche : Éric Aubin, Patrick Trépanier, Isabelle St-Amour, Lauriane Padet, Isabelle Paré, Tony Tremblay et Chantai Roberge pour leur aide précieuse.
Merci aux membres de ma famille et à mes amis qui ont contribué à leur façon à la réalisation de mes travaux grâce à leur soutien quotidien.
Finalement, je veux remercier Héma-Québec, le CRSNG et le FQRNT pour le soutien financier de mes travaux.
direction dans laquelle nous allons que nous n 'allons dans aucune direction.
Résumé « Abstract iv Avant-propos vi
Table des matières viii Liste des tableaux xi Liste des figures xii
Liste des abréviations xiii 1 Introduction /
1.1 Le système immunitaire 1
1.1.1 L'hématopoïèse 1
1.1.2 L'immunité innée 1
1.1.3 Le développement des lymphocytes 2
1.1.3.1 Lymphocytes T 3
1.1.3.2 Lymphocytes B 6 1.1.4 Les immunoglobulines 9 1.1.5 Les récepteurs pour la partie constante des immunoglobulines 9
1.1.6 La présentation antigénique 10 1.1.6.1 Le CMH de classe 1 10 1.1.6.2 Le CMH de classe II 13 1.1.6.3 Les lymphocytes B comme cellules présentatrices d'antigène 14
1.2 L'auto-immunité 15 1.2.1 Classification 15 1.2.2 Causes de l'auto-immunité 16 1.2.2.1 Prédispostion génétique 16 1.2.2.2 Facteurs environnementaux 16 1.2.2.3 Infections microbiennes 17 1.2.3 Débalancement des profils Thl/Th2 et Thl7/T régulateur 18
1.2.4 Traitements 19 1.3 Les immunoglobulines pour injection intraveineuse (IglV) 20
1.3.1 Méthode de production 20 1.3.2 Utilisation et problématique 20
1.3.2.1 Utilisation des IglV dans les maladies neurologiques ayant une composante
auto-immune 22 1.3.3 Effets secondaires 22 1.3.4 Mécanismes d'action des IglV dans les maladies auto-immunes 23
1.3.4.1 Mécanismes FcyR dépendants 23
1.3.4.2 Mécanismes FcyR indépendants 24
1.3.4.2.1 Implication des anticorps anti-idiotypiques 24 1.3.4.2.2 Effet des IglV sur l'immunité innée 25 1.3.4.2.3 Effet des IglV sur l'immunité adaptative 26
1.4 Hypothèses et objectifs 29 2 Internalisation spontanée des IglV et interaction avec des protéines intracellulaires
révélées par une analyse protéomique des cibles des IglV sur les lymphocytes B humains. 30
2.1 Résumé 31 2.2 Abstract 33 2.3 Introduction 34 2.4 Materials and methods 36
2.4.1 B cells 36 2.4.2 Immunoprecipitation 37
2.4.3 Protein separation and mass spectrometry analysis 37
2.4.4 Western blot 37 2.4.5 Analysis of extra- and intracellular IVIg 38
2.4.6 Quantification of extracellular and internalized IVIg 39
2.5 Results 40 2.5.1 LC/MS identification of IVIg targets 40
2.5.2 Spontaneous internalization of IVIg inside living cells 41
2.5.3 Mechanism of IVIg internalization 42 2.5.4 IVIg internalization in whole blood 43
2.6 Discussion 45 2.7 Acknowledgements 48
2.8 Figures legends 49
2.9 Figures 51 3 Inhibition par les immunoglobulines intraveineuses (IglV) de la présentation
antigénique médiéepar les lymphocytes B 58
3.1 Résumé 59 3.2 Abstract 61 3.3 Introduction 62 3.4 Materials and methods 64
3.4.1 Animals and cells 64 3.4.2 Antigen presentation assay 64
3.4.3 Cytometry analyses 65 3.4.4 Statistical analysis 66
3.5 Results 67 3.5.1 Effect of IVIg on the BCR-dependent and independent antigen presentation 67
3.5.2 MHC class II surface expression 68 3.5.3 Role of FcyRIIb in the effect of IVIg on antigen presentation 69
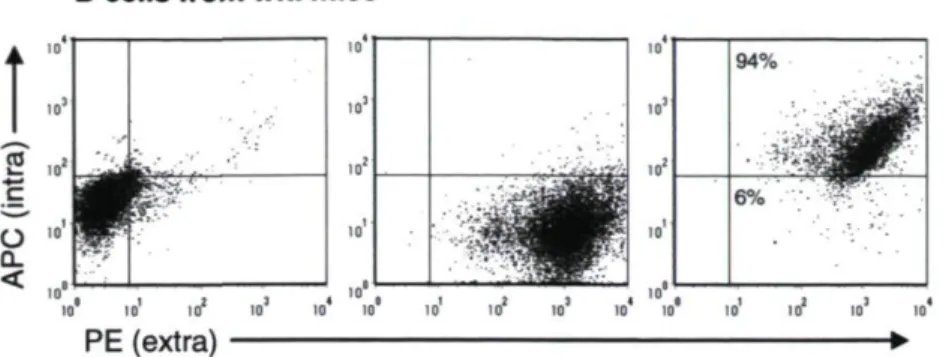
3.5.4 Spontaneous internalization of IVIg inside mouse B cells 69
3.6 Discussion 70 3.7 Acknowledgments 73
3.8 Figures legends 74
3.9 Figures 76 4 L'interaction entre les IglV et la low-density lipoprotein receptor-related protein 1
(LRP1) permet la transcytose des IVIg et l'induction de la phosphorylation de LRP1. ...80
AA Résumé 81 4.2 Abstract 83
4.4 Materials and methods 86 4.4.1 Cells and reagents 86 4.4.2 Analysis of extra- and intracellular IVIg 86
4.4.3 Analysis of LRP1 phosphorylation 87 4.4.4 In vitro model of transcytosis 88
4.5 Results 89 4.5.1 IVIg endocytosis by MEF-1 cells 89
4.5.2 Induction of LRP1 phosphorylation by IVIg 90
4.5.3 In vitro transcytosis of IVIg 91
4.6 Discussion 92 4.7 Acknowledgement 95
4.8 Figures legends 96
4.9 Figures 97 5 Rôle des prohibitines dans l'effet des I g l V sur les lymphocytes B humains 100
5.1 Introduction 100 5.2 Matériel et méthodes 104
5.2.1 Lymphocytes B et T 104 5.2.2 Immunoprecipitation 104 5.2.3 Détection de la phbl par immunobuvardage et analyse de la phosphorylation de la phb2 105
5.2.4 Analyse de la phosphorylation d'ERKl et 2 par immunobuvardage 105
5.2.5 Réactivité des IglV contre la phbl 106 5.2.6 Transfection des cellules de la lignée DB avec un miRNA contre la phbl 107
5.2.7 Préparation d'un clone exprimant un shRNA dirigé contre la phbl 107
5.3 Résultats 109 5.3.1 L'interaction IgIV-phbl ne dépend pas du stade de différenciation des lymphocytes B,
mais requiert un métabolisme actif 109 5.3.2 L'interaction IgIV-phbl chez les cellules de la lignée Jurkat 111
5.3.3 Rôle de la phbl dans la voie d'induction de la phosphorylation d'ERKl-2 113
5.4 Discussion 116 6 Conclusions 118
6.1 Nouvelles cibles thérapeutiques potentielles identifiées 118
6.1.1 La présentation antigénique 119
6.1.2 LeCD91 120 6.1.3 Les phbl et 2 122 6.2 Développement d'un substitut aux IglV 122
7 Bibliographie 124
Tableau 1-1 Caractéristiques des réponses Thl, Th2 , Thl7 et T régulatrice 5 Tableau 1-2 Consommation annuelle d'IglV au Québec entre 1987 et 2009 21 Tableau 2-1 Proteins identified as target of PVIg on resting and CD40-activated human B
Figure 1.1 Développement des lymphocytes T 4 Figure 1.2 Mécanismes d'induction de la tolérance 8 Figure 1.3 Développement des lymphocytes B 8 Figure 1.4 Assemblage du CMH de classe I et chargement des peptides 12
Figure 1.5 Assemblage du CMH de classe II et chargement des peptides 14 Figure 2.1 Confirmation of the LC/MS identified proteins by Western blot 51 Figure 2.2 Biotinylated IVIg are detected on the surface of resting and CD40-activated B
cells but only inside CD40-activated B cells 52 Figure 2.3 IVIg are spontaneously internalized in RPMI 8226 cells 53
Figure 2.4 PVIg are internalized following an FeyR- and BCR-independent pathway 54 Figure 2.5 Internalization of human serum albumin by CD40-activated B cells 55
Figure 2.6 IVIg can penetrate living cells in whole blood 56 Figure 3.1 Effect of PVIg on B cell-mediated antigen presentation 76
Figure 3.2 Effect of PVIg on the expression of MHC II molecules 77 Figure 3.3 Role of the inhibitory FcyRIIb on the PVIg-mediated inhibition of antigen
presentation 78 Figure 3.4 Internalization of IVIg and HSA in activated B cells 79
Figure 4.1 LRPl-mediated IVIg internalization 97 Figure 4.2 Induction of LRP1 Tyr4507 phosphorylation by PVIg 98
Figure 4.3 In vitro transcytosis of IVIg 99 Figure 5.1 Structure et assemblage des phbl et 2 101
Figure 5.2 Modèle du rôle des phb dans l'induction de la phosphorylation d'ERKl et 2 .103 Figure 5.3 Interaction IgIV-phbl en fonction de la lignée lymphocytaire, de l'expression
d'un BCR et du stade de différenciation 110 Figure 5.4 L'interaction IgPV-phbl dépend d'un métabolisme actif 111
Figure 5.5 L'activation des cellules de la lignée Jurkat par la PHA permet l'interaction
IgIV-phbl 112 Figure 5.6 Absence d'induction de l'expression d'un partenaire à l'interaction IgPV-phb par
la PHA chez les cellules de la lignée Jurkat 113 Figure 5.7 Blocage partiel de l'induction de la phosphorylation d'ERK 1-2 par un anticorps
Liste des abréviations
AD : Alzheimer disease
ADN : acide désoxyribonucléique APC : Allophycocyanine
APRIL : a proliferation-inducing ligand ARN : acide ribonucléique
AP : amyloïde bêta
BAFF : B cell Activating Factor BAP : BCR associated protein BBB : blood brain barrier
BCR : B cell receptor, récepteur de la cellule B
BSA : bovine serum albumin, albumine sérique bovine CD : cluster de différenciation
CLIP : class II invariant chain peptide
CMH : complexe majeur d'histocompatibilité CNS : central nervous system
CPA : cellule présentatrice d'antigène CTGF : connective tissue growth factor DO : densité optique
ELISA : enzyme-linked immunosorbent assay ERK : extracellular signal-regulated kinases FAS : apoptosis stimulating fragment
FBS : fetal bovin serum, sérum fétal bovin
FcR : récepteur pour la partie constante des immunoglobulines FcRn : récepteur Fc néonatal
FcaR : récepteur pour la partie constante des IgA FcyR : récepteur pour la partie constante des IgG FceR : récepteur pour la partie constante des IgE FITC : isothiocyanate de fluorescéine
GRP94 : glucose-regulated protein 94 HLA : human leukocyte antigen HRP : horseradish peroxidase HSA : human serum albumin IFN-y : interferon y
IglV : immunoglobulines intraveineuses IL : interleukine
ITP : thrombocytopenic immune IVIg : intravenous immunoglobulin
LC-MS : Liquid chromatography-mass spectrometry LRP1 : low-density lipoprotein receptor-related protein 1 LYST : lysosomal-trajficking regulator
MHC : major histocompatibility complex miRNA : micro RNA
PDGF : platelet-derived growth factor PE : phycoérythrine
PHA : phytohémagglutinine Phb : prohibitine
PIR A : paired immunoglobulin-like receptor A RAP : receptor-associated protein
RNA : ribonucleic acid RT : room temperature shRNA : short hairpin RNA
SIGN-R1: specific intercellular adhesion molecule-grabbing non-integrin Rl siRNA : small interfering RNA
TAP: transporter associated with antigen processing TCR : T cell receptor, récepteur de la cellule T TGF : transforming growth factor
TLR : Toll like receptor, récepteur similaire au récepteur Toll TNF : tumor necrosis factor
1.1 Le système immunitaire
1.1.1 L'hématopoïèse
Le système hématopoïétique est entièrement généré à partir de cellules souches pluripotentes que l'on retrouve dans la moelle osseuse. Ces cellules ont la capacité de se diviser et de pouvoir donner naissance à tous les autres types de cellules du système hématopoïétique par le processus de différenciation. Le système hématopoïétique se divise en deux grands embranchements, soit lymphoïde et myéloïde, qui ont chacun une cellule progénitrice pouvant donner naissance à tous les types de cellules retrouvés dans leur embranchement respectif. Ainsi, le progéniteur myéloïde peut donner naissance aux granulocytes, aux macrophages, aux mégacaryocytes et aux erythrocytes alors que le progéniteur lymphoïde peut donner naissance aux lymphocytes T et B ainsi qu'aux cellules NK. Les cellules dendritiques ont la particularité de pouvoir émerger à la fois à partir de la branche lymphoïde et de celle myéloïde1.
1.1.2 L'immunité innée
La première défense de l'organisme contre les microorganismes est la peau qui constitue une barrière physique qu'ils ne peuvent pas traverser. Cependant, les microorganismes peuvent pénétrer dans le corps humain lorsqu'il y a des lésions au niveau de la peau ou par d'autres voies d'entrée comme le tractus gastro-intestinal, le tractus génital, les yeux, les oreilles et les voies respiratoires. Par la suite, plusieurs facteurs physico-chimiques servent aussi de ligne de défense; pH acide (estomac), flux d'air (voies respiratoires), peptides antibactériens ainsi que la compétition avec la flore normale pour les nutriments. Un des premiers éléments de l'immunité innée à être activé à la suite d'une infection bactérienne ou virale est le système du complément. D peut être activé par la voie classique (complexe anticorps-antigène), la voie de la lectine liant le mannose (protéine
ou viraux) ou encore par la voie alterne (liaison directe du complément à la surface du pathogène). Dans tous les cas, la cascade d'activation du complément va mener au recrutement de cellules du système immunitaire, à l'opsonisation du pathogène et à sa destruction par le complexe d'attaque membranaire. Les phagocytes (macrophages et neutrophiles) participent aussi de manière importante à la réponse innée. Ds possèdent des récepteurs qui vont reconnaître des structures conservées à la surface des microorganismes, comme le mannose, qui leur permettent de procéder à l'ingestion et à la destruction du pathogène1. Une famille importante de ces récepteurs est la famille des TLR (récepteur
similaire au récepteur Toll). Les TLR sont exprimés à la fois chez les cellules du système inné et adaptatif. Ils reconnaissent diverses structures des pathogènes comme le lipopolysacharide ou l'ARN double brin. Par la suite, les macrophages et les cellules dendritiques vont procéder à l'activation du système immunitaire adaptatif par un processus appelé présentation antigénique. En plus de ce type de récepteur, les cellules de l'immunité innée possèdent des récepteurs pour des molécules du soi qui se retrouvent en circulation seulement lorsqu'il y a mort cellulaire par nécrose. Ces récepteurs servent à donner des signaux qui vont activer les cellules du système immunitaire inné et servent à informer l'organisme de la présence d'un danger .
1.1.3 Le développement des lymphocytes
Les lymphocytes B et T sont les seules cellules du système immunitaire à posséder un récepteur spécifique à l'antigène, appelé récepteur de la cellule B (BCR) et récepteur de la cellule T (TCR) respectivement, et qui ont la capacité de conserver une mémoire des antigènes ayant préalablement été reconnus comme faisant partie d'un danger pour l'organisme. Ces lymphocytes constituent la base de l'immunité acquise. Le BCR est une immunoglobuline de surface, composée de deux chaînes lourdes et de deux chaînes légères et associées à des protéines qui vont permettre la transmission du signal (Iga et IgP) lorsque l'antigène est lié au récepteur. Quand à lui, le TCR est un hétérodimère composé d'une chaîne a et d'une chaîne P ou d'une chaîne y et d'une chaîne 8. Les lymphocytes B peuvent reconnaître un antigène soluble alors que les lymphocytes T doivent reconnaître leur
complexe majeur d'histocompatibilité (CMH) I ou II1.
1.1.3.1 Lymphocytes T
Les lymphocytes T vont compléter leur différenciation à l'extérieur de la moelle osseuse, dans le thymus, où vont apparaître les deux grandes catégories de lymphocytes T, soit auxiliaire (CD4+) et cytotoxique (CD8+). Au départ, la cellule progénitrice des
lymphocytes T est dite double négative (CD4" et CD8 ). La majorité des cellules progénitrices vont s'engager dans la voie a :p. Elles procèdent dans un premier temps au réarrangement du gène codant pour la chaîne p. Si un réarrangement productif est obtenu, la chaîne P va s'associer avec une chaîne substitutive appelée pTa pour former un pré-TCR et s'ensuivra une ronde de prolifération. Les cellules parvenues à ce stade vont devenir doubles positives (CD4+ et CD8+) et par la suite procéder au rearrangement du gène codant
pour la chaîne a. Une fois toutes ces étapes accomplies, les thymocytes immatures garderont seulement l'expression du CD4 ou du CD8 (simple positif). Les thymocytes immatures vont ensuite subir deux étapes de sélection très importantes. Dans un premier temps, la sélection positive permet de maintenir en vie seulement les thymocytes capables d'interagir avec les molécules du CMH du soi alors que la sélection négative élimine toutes les cellules qui présentent une trop forte réactivité envers des antigènes du soi. La figure 1.1 résume les différentes étapes du développement des lymphocytes T. Ce n'est qu'une fois toutes ces étapes accomplies que les lymphocytes T vont quitter le thymus et patrouiller l'organisme. Les lymphocytes T auxiliaires vont permettre l'activation efficace d'autres cellules du système immunitaire, comme les lymphocytes B ou les macrophages, alors que les lymphocytes T cytotoxiques vont tuer les cellules avec lesquelles ils interagissent à la suite de la reconnaissance de l'antigène spécifique à leur TCR. Les molécules CD4 et CD8 sont des corécepteurs qui permettent la liaison avec les molécules du CMH de classe I pour le CD8 et celles de classe II pour le CD43.
Weak recognition of class I MHC + peptide
item Double- Pre-T / 'r iA ^ W i
Stem cell negative (CD4-CD8-) Pro-T cell cell Double positive (CD4+CD8+ immature Tcell [ \ ^ ^ No recog ^ ^ ^ MHC + p< \ ^ ^ | Strong re No recognition of MHC + peptide^
0
ecognition of either class I or class II MHC-i- peptide/ Tcell Mature CD8+ Tcell Apoptosis Apoptosis Positive selection Positive selection Failure of positive selection ("death by neglect") Negative selectionFigure 1.1 Développement des lymphocytes T
Tirée de Basic Immunology : function and disorders of the immune system, 3e édition,
cytokines qu'ils sécrètent à la suite de leur activation. Ceux de type Thl sécrètent de l'interféron y (IFN-y), de l'IL-2, de l'EL-12, de l'IL-18 et du TNF-p et sont principalement impliqués dans la réponse aux pathogènes intracellulaires4. Quand à elles, les cellules de
type Th2 sécrètent principalement de l'EL-4, de l'IL-5, de l'IL-6, de l'IL-10 et de l'IL-13. Elles sont impliquées dans la réponse humorale contre des parasites4. On retrouve aussi des
cellules de type Thl7 qui combattent les pathogènes extracellulaires et sécrètent de l'IL-17. Finalement, les cellules T régulatrices sont caractérisées par l'expression du marqueur CD25 et du facteur de transcription FoxP3 et sécrètent de l'IL-10 et du TGF-p4'5. Le
tableau 1-1 résume les caractéristiques de ces types de lymphocytes T auxiliaires. Il est à noter que d'autres types de lymphocytes T existent.
Tableau 1-1 Caractéristiques des réponses Thl, Th2 , Thl7 et T régulatrice
Propriétés Th1 Th2 Th-17 T régulateur
Signaux importants pour l'orientation vers
ce type de réponse IL-12etlFN-y
IL-4 et faible reconnaissance du TCR TGF-p, IL-1 et IL-23 TGF-p et forte reconnaissance du TCR Cytokines sécrétées IL-2, IL-12, IL-18, IFN-y et TNF-3 IL-4, IL-5, IL-6, IL-10et IL-13 IL-17 IL-10 et TGF-p Facteur de
transcription activé T-bet et STAT44
STAT 6 et
GATA34 ROR-yt4 FoxP3 Effet sur l'activité des
macrophages Activation Inhibition Activation Inhibition Pathogènes ciblés Intracellulaire Parasite Extracellulaire Aucun Implication dans
l'auto-immunité Rôle effecteur
Parfois rôle régulateur, parfois rôle
activateur
Rôle effecteur Rôle régulateur Implication dans les
Les étapes de développement indépendantes de l'antigène des lymphocytes B se font dans la moelle osseuse jusqu'au stade dit de lymphocyte B mature et naïf. C'est à cet endroit que la cellule pro-B va procéder au réarrangement des gènes codant pour les chaînes lourde et légère. Dans un premier temps, la cellule progénitrice procède au réarrangement des gènes codant pour la chaîne lourde. Un réarrangement productif permet l'expression à la surface d'un récepteur pré-B composé de la chaîne lourde et d'une chaîne légère substitutive ainsi que le passage au stade de pré-B. La cellule pré-B va procéder à une ronde de prolifération puis au réarrangement des gènes codant pour sa chaîne légère, ce qui permet l'expression d'un IgM complet, caractéristique du stade de lymphocytes B immatures6'7. C'est à ce stade que les cellules ayant un BCR réactif contre des structures de
soi présentes dans la moelle osseuse sont éliminées par apoptose afin d'éviter des réactions auto-immunes8. L'épissage alternatif permet l'expression combinée à la surface de la
cellule B d'un IgM et d'un IgD.
Une fois toutes ces étapes accomplies, la cellule B mature peut migrer vers la périphérie où elle va patrouiller jusqu'à la rencontre éventuelle de son antigène. Un autre niveau de régulation existe afin d'éviter des réactions auto-immunes contre les structures du soi présentes à l'extérieur de la moelle osseuse, il s'agit de l'anergie. Une cellule devenue anergique ne pourra plus répondre à une stimulation par son antigène. Cela peut se faire par des moyens intrinsèques : diminution de l'expression du BCR, augmentation de l'expression de récepteurs inhibiteurs (par exemple le CD5 et CTLA4), augmentation de l'expression de phosphatases (SHP1, SHIP), ou encore par des moyens extrinsèques : absence de cosignaux d'activation (CD 154, B7, BAFF (B cell Activating Factor), IL-7)9.
La figure 1.2 résume les différents mécanismes possibles d'induction de l'anergie. Dans la majorité des cas, un lymphocyte B mature ne rencontrera jamais l'antigène pour lequel il est spécifique et finira par mourir par apoptose. Les lymphocytes B qui rencontrent l'antigène qui leur est spécifique poursuivent leur développement par la phase dite dépendante de l'antigène qui a lieu dans les organes lymphoïdes secondaires. Afin de pouvoir être correctement activé, le lymphocyte B a besoin de recevoir des signaux de costimulation d'un lymphocyte T auxiliaire10. Ces signaux sont à la fois membranaires (par
activées migrent vers les follicules et prolifèrent pour former des centres germinatifs. En plus des lymphocytes B en prolifération, des lymphocytes T auxiliaires sont retrouvés en périphérie du centre germinatif et des cellules dendritiques folliculaires sont retrouvées à l'intérieur même du centre germinatif. Ces cellules ont pour rôle respectif de fournir les signaux de coactivation et de présenter les antigènes aux lymphocytes B . C'est aussi à cette étape qu'ont lieu les réactions de commutation isotypique et d'hypermutation somatique. L'hypermutation somatique a pour but d'augmenter l'affinité du BCR envers l'antigène qu'il reconnaît. Des mutations sont introduites au hasard dans la partie variable des gènes de chaîne lourde et de chaîne légère et les lymphocytes B présentant un BCR avec la plus forte affinité pour l'antigène sont sélectionnés alors que les autres sont éliminés par apoptose12. La commutation isotypique permet l'expression d'IgGl, 2, 3 ou 4
(chez l'humain), IgAl ou 2, ou d'IgE par le lymphocyte B à la suite d'un réarrangement de la section du gène codant pour la partie constante de la chaîne lourde. Le type d'immunoglobuline obtenu dépend de la nature des cosignaux reçus par le lymphocyte B, eux-mêmes fonction de la nature de l'antigène. Selon l'intensité et la nature des signaux reçus, le lymphocyte B peut devenir un lymphocyte B mémoire ou un plasmocyte (cellule sécrétrice d'anticorps à durée de vie longue). Les cellules B mémoires ainsi produites retournent patrouiller l'organisme afin de pouvoir enclencher une réponse rapide en cas de réinfection par le même pathogène alors que les plasmocytes vont migrer vers la moelle osseuse où ils sécrètent une grande quantité d'anticorps spécifiques de forte affinité13'14. La
SeKant«en / ^ ^ N
Extnnstcally regulated Lymphocyte
Phosphatases (SHPX SHIP)
Ubiquitin ligases (CBL, GRAIL ITCH, ROQUN) Regulation by:
Limiting survival factors ( BAFF, IL-7)
Limiting costimuli (CD40L. TLR ligands. B7 molecules) Active suppression
Limiting innate inflammatory mechanisms
Figure 1.2 Mécanismes d'induction de la tolérance
Tirée de : Cellular and genetic mechanisms of self tolerance and autoimmunity. Goodnow, Sprent, Fazekas de St Groth et Vinuesa. Nature, vol 435 (2), p. 590 (2005).
Pre-BCR Mature BCR Pro BCR V ~ } - Vp*-* I Surrogate P — V,S M * * Cilnex.nB ir k J<ha-ns ISM
Ë
B220*CD9J-ê-ë—è
Pro-B cell Pre-B cell Immature B ce». TlBcel T2Bcell MitureBcell\ / CD
IS
Pre-plasma/ pUvna ceil B220* CD95 CD1Ï8"-" MemoryFigure 1.3 Développement des lymphocytes B
Tirée de: B-cell anergy: from transgenic models to naturally occuring anergic B cells? Cambier, Gauld, Merrell et Vilen. Nature Reviews Immunology, vol 7, p. 633-643 (2007).
Les immunoglobulines sont composées de deux chaînes lourdes et de deux chaînes légères reliées entre elles par des ponts disulfures. Chacune des chaînes possède une région variable servant à la reconnaissance de l'antigène. La région constante des chaînes lourdes détermine la classe d'immunoglobulines. Les chaînes lourdes sont aussi glycosylées à divers endroits selon la classe d'immunoglobuline. Les différentes classes d'immunoglobulines ont des fonctions différentes ainsi qu'une localisation différente dans le corps humain. Ainsi, les IgG sont les immunoglobulines principalement retrouvées dans le sang et sont responsables de l'opsonisation des pathogènes et activent le système du complément et les cellules NK à divers niveaux selon la sous-classe'. Les IgM ont la particularité de former des pentamères, ce qui leur permet d'activer de façon très efficace le système du complément. Les IgA sont principalement retrouvées dans les muqueuses et la salive et peuvent former des dimères. Les IgE permettent la sensibilisation des mastocytes, qui possèdent des récepteurs pour la partie constante des IgE, et ainsi participer à une défense contre les parasites. De plus, ils forment la classe d'anticorps principalement responsable des réactions allergiques.
1.1.5 Les récepteurs pour la partie constante des immunoglobulines
Plusieurs types de cellules du système immunitaire possèdent des récepteurs pour la partie constante des immunoglobulines (FcR). Ces récepteurs sont regroupés en famille selon la classe d'immunoglobuline qu'ils vont reconnaître (FcyR pour les IgG, FcaR pour l'IgA et FCER pour l'IgE). Ces récepteurs peuvent transmettre des signaux activateurs
directement (FcyRIIa) ou par l'intermédiaire de la chaîne commune gamma (FcaR, FceR, FcyRI, III et IV) ou inhiber les signaux transmis par d'autres récepteurs (FcyRIIb)1.
La présence d'un sucre dans la région constante des IgG est nécessaire pour leur fixation aux FcyR. De plus, ces récepteurs vont présenter une plus forte affinité pour les IgG monomériques (FcyRI) ou les complexes immuns d'IgG (FcyRII, lH et TV). Le FcyRIV
a été identifié chez la souris et ne possède pas d'équivalent connu chez l'humain, à ce jour15.
Le FcaR est exprimé à la surface des macrophages, neutrophiles et des éosinophiles alors que le FceR est exprimé par les mastocytes, basophiles et les éosinophiles. L'expression de chaque FcyR varie selon le type de cellules. Par exemple, les macrophages vont exprimer la totalité des FcyR alors que les lymphocytes B vont exprimer seulement le FcyRIIb1.
1.1.6 La présentation antigénique
La présentation antigénique est l'élément clé qui permet l'activation du système immunitaire adaptatif par le système immunitaire inné. Ce sont les molécules du CMH qui permettent la présentation de peptides antigéniques à la surface des cellules. La majorité des cellules du corps humain expriment le CMH de classe I à leur surface alors que seules les cellules présentatrices d'antigènes (CPA) (les cellules dendritiques, les macrophages, les lymphocytes B et, tout dernièrement ajoutés à cette liste, les basophiles16 et les
lymphocytes T yô17) expriment le CMH de classe II. Les molécules du CMH de classe I
permettent la présentation de peptides de 8 à 10 acides aminés principalement d'origine endogène alors que les molécules du CMH de classe II permettent la présentation de peptides de 13 acides aminés et plus, d'origine exogène1. De plus, un procédé appelé
présentation croisée permet la présentation de peptide d'origine exogène par le CMH de classe I18.
1.1.6.1 Le CMH de classe I
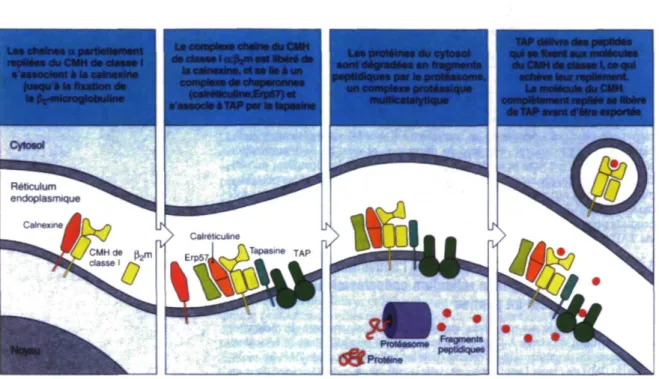
Les peptides chargés sur le CMH de classe I proviennent de la dégradation de protéines par le protéasome dans le cytoplasme de la cellule. Ils sont transportés dans le reticulum endoplasmique par la protéine TAP et c'est à cet endroit qu'ils se fixent aux molécules du CMH de classe I. La molécule de CMH de classe I est composée d'une chaîne a et de la P2-microglobuline et son assemblage a lieu dans le reticulum endoplasmique. Cette étape est sous le contrôle de protéines chaperonnes comme la calnexine, la calréticuline et Erp57. Le repliement du CMH de classe I est complété
seulement lorsqu'un peptide se fixe dans sa niche ce qui permet la dissociation du complexe CMH peptide des protéines chaperonnes. Par la suite, le complexe CMH I-peptide est transporté vers la surface de la cellule via l'appareil de Golgi. La figure 1.4 illustre les mécanismes d'assemblage et de chargement du CMH de classe I. Ainsi, le CMH de classe I permet la reconnaissance par le système immunitaire des pathogènes intracellulaires, comme les virus19. La reconnaissance d'un complexe CMH I-peptide par
un lymphocyte T cytotoxique entraîne la mort de la cellule cible par apoptose. Cela se fait par la libération de perforine et de granzyme contenues dans les granules du lymphocyte T cytotoxique ainsi que par la sécrétion de cytokines telles que l'interféron y (IFN-y), le TNF a et le TNF p. L'IFN-y a pour effet d'augmenter l'expression du CMH de classe I et des molécules impliquées dans le chargement des peptides sur ce dernier. Ce mécanisme permet d'augmenter la probabilité qu'une cellule infectée par un pathogène intracellulaire puisse présenter des peptides provenant du pathogène en question et qu'elle puisse être reconnue par un lymphocyte T cytotoxique comme étant infectée. Certains pathogènes intracellulaires vont bloquer l'expression en surface du CMH de classe I afin d'échapper au système immunitaire. Cependant, un autre mécanisme permet d'éliminer ces pathogènes. En effet, l'absence de molécules du CMH de classe I à la surface d'une cellule entraîne l'activation des cellules NK qui libèrent le contenu de leurs granules et induisent la mort par apoptose de la cellule cible.
i du CMH de classe I lusqu a la fixation da la iVmicroglobohne La da la calnexine. et aa l a i un complexe de chaperonnes icalretJculine.Erp57)el s associe a TAP par la tapasine
Les protéines du cytosol «ont dégradées an fragments peptidiques par le protéasome,
un complexe protéaaique multicatalytique
Figure 1.4 Assemblage du CMH de classe I et chargement des peptides
Tirée de : Immunobiologie. Janeway, Travers, Walport et Shlomchick. Édition de Boeck, p. 160 (2003).
1.1.6.2 Le CMH de classe II
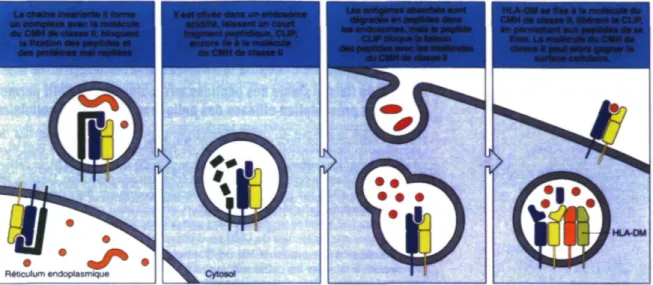
La molécule du CMH de classe II est un hétérodimère composé d'une chaîne a et d'une chaîne p. Tout comme la molécule du CMH de classe I, elle est synthétisée dans le reticulum endoplasmique où elle se retrouve associée avec la chaîne invariante Li et la calnexine, qui a un rôle de chaperonne. Le rôle de la chaîne invariante Li est d'empêcher la liaison de peptides d'origine endogène au CMH de classe II. La chaîne invariante Li a aussi pour fonction de diriger les molécules du CMH de classe II vers des endosomes à pH acide une fois que l'assemblage de toutes les chaînes du complexe CMH H-chaîne invariante est complété et que la calnexine est libérée. Une fois rendue dans un endosome à pH acide, la chaîne invariante Li est clivée, laissant seulement un fragment peptidique, appelé CLIP, dans la niche peptidique du CMH de classe II. La molécule HLA-DM vient alors se fixer au CMH de classe II et permet la libération du peptide CLIP et le chargement d'un peptide antigénique. La molécule du CMH de classe II ayant fixé un peptide antigénique peut alors migrer vers la surface de la cellule. La figure 1.5 représente les mécanismes d'assemblage et de chargement du CHM de classe II. Chaque type de CPA possède divers moyens pour procéder à la capture des antigènes. Les macrophages procèdent par phagocytose alors que les cellules dendritiques peuvent l'accomplir par phagocytose et par macropinocytose. Dans le cas des lymphocytes B, l'antigène est capturé de façon très spécifique et efficace par le BCR20. Une fois l'antigène ingéré par la CPA, il est dirigé vers un endosome à pH acide où
il est clivé en fragments peptidiques par des proteases acides. Lorsqu'un complexe CMH Il-peptide est reconnu par un lymphocyte T auxiliaire, il en résulte l'activation de la CPA à la fois induitente par des signaux membranaires (CD 154, B7) et des signaux solubles (IL-4, IL-2).
-Monta -te j i s e N. Moquent la nxatton d»« p r : ' -.. t. et
des protéines mal repHées du CMH de clesse U
Figure 1.5 Assemblage du CMH de classe II et chargement des peptides
Tirée de : Immunobiologie. Janeway, Travers, Walport et Shlomchick. Édition de Boeck, p. 165 (2003).
1.1.6.3 Les lymphocytes B comme cellules présentatrices d'antigène
La présentation d'antigène par les lymphocytes B est une étape cruciale pour leur activation. En effet, elle permet à un lymphocyte B ayant reconnu l'antigène pour lequel il est spécifique de recevoir des signaux d'activation d'un lymphocyte T CD4+. L'activation
du lymphocyte B par le CD 154 augmente la capacité des lymphocytes B à présenter des antigènes par le CMH de classe II21. Cette activation permet aux lymphocytes B de
présenter des antigènes aussi efficacement que les cellules dendritiques22. De plus, la
capture de l'antigène par le BCR permet une présentation par le CMH de classe II environ deux fois plus rapide que lorsque l'antigène est capturé par pinocytose23.
1.2 L'auto-immunité
Dans certaines situations, il arrive que le système immunitaire adaptatif ne fasse plus efficacement la discrimination entre le soi et le non soi. Il en résulte une réponse immunitaire contre un antigène du soi, ce qui peut poser des problèmes sérieux à la santé de l'individu. L'objectif d'une réponse immune est l'élimination de l'antigène. Dans une réponse immune normale, cela revient à l'élimination du pathogène. Par contre, lorsque l'antigène est un antigène du soi (autoantigène), l'élimination complète de l'antigène est impossible. D en résulte une réponse prolongée et un état chronique d'inflammation, appelé maladie auto-immune, qui peut parfois être mortelle. D y a présentement plus d'une centaine de maladies auto-immunes différentes répertoriées chez l'humain et elles touchent de 5 à 10 % de la population mondiale. Dans les pays industrialisés, les maladies auto-immunes représentent la troisième cause de mortalité et de morbidité après les maladies cardiaques et le cancer24.
1.2.1 Classification
Les maladies auto-immunes peuvent être classées selon le mécanisme causant les dommages. D peut s'agir d'anticorps dirigés contre des antigènes présents à la surface des cellules, notamment dans la thrombocytopenic immune (FTP) où la présence d'anticorps dirigés contre la gpllb/nia entraîne la destruction des plaquettes sanguines et par conséquent des problèmes de coagulation. Dans d'autres situations, la maladie peut être due à la présence de complexes immuns, comme dans le lupus érythémateux disséminé où la présence d'anticorps contre des structures nucléaires (ADN, histones, etc.) et des ribosomes entraînent la formation de complexes immuns. Finalement, le mécanisme effecteur de la maladie auto-immune peut être la présence de cellules T cytotoxiques autoréactives. Dans le cas du diabète insulinodépendant, des cellules T cytotoxiques vont détruire les cellules P du pancréas. Il est aussi possible de classer les maladies auto-immunes selon que la réaction est limitée à un organe (diabète insulinodépendant : pancréas) ou systémique (lupus érythémateux disséminé : peau, reins, cerveau, etc.). Plusieurs facteurs peuvent contribuer au développement d'une maladie auto-immune : les prédispositions génétiques, les facteurs environnementaux ainsi que les infections microbiennes. Dans la majorité des cas, c'est
l'association de plusieurs facteurs de prédisposition qui mène au développement de la maladie.
1.2.2 Causes de l'auto-immunité
1.2.2.1 Prédispostion génétique
Il existe plusieurs prédispositions génétiques pouvant conduire au développement d'une maladie auto-immune. Certaines sont associées au chromosome X et vont engendrer une plus forte prédisposition chez les femmes , comme c'est le cas pour le lupus érythémateux disséminé, alors que d'autres se retrouvent chez l'ensemble de la population. Des mutations entraînant le mauvais fonctionnement ou la perte d'expression de récepteurs inhibiteurs sont connues pour augmenter les risques de développer certains types de maladies auto-immunes. À l'inverse des mutations menant à l'augmentation de l'activité ou de l'expression de récepteurs activateurs causent une prédisposition à certaines maladies auto-immunes26. La duplication du gène codant pour le TRL7 (un récepteur activateur
reconnaissant l'ARN) en est un bon exemple. Cette duplication conduit à l'apparition de lymphocytes B autoréactifs contre des antigènes nucléaires27. Les gènes du CMH sont aussi
associés à plusieurs prédispositions pour une grande variété de maladies auto-immunes (syndrome de Goodpasture, diabète insulinodépendant de type I, arthrite rhumatoïde, pemphigus vulgaire, etc.)28'29. L'explication la plus plausible est que certains alleles des
molécules du CMH vont lier plus fortement certains peptides du soi et ainsi permettre de briser la tolérance et de déclencher une réponse immune contre ces peptides. Certains polymorphismes au niveau des récepteurs pour la partie constante des IgG (FcyR) sont aussi associés avec un risque accru de développement d'une maladie auto-immune et peuvent aussi affecter l'efficacité de certains traitements30.
1.2.2.2 Facteurs environnementaux
Pour certaines maladies auto-immunes, les facteurs environnementaux jouent un rôle de premier plan dans le développement même de la maladie ou dans l'apparition de certains symptômes. La majorité des patients atteints du syndrome de Goodpasture, qui développent une hémorragie pulmonaire, fument la cigarette. La caractéristique de cette
maladie est la présence d'anticorps dirigés contre le collagène de type IV présent sur toutes les membranes basales de l'organisme. En situation normale, les anti-collagènes de type IV n'ont pas accès au collagène de type IV que l'on retrouvent dans les alvéoles pulmonaires. Cependant, la fumée de cigarette induit une inflammation dans les poumons, ce qui endommage les capillaires alvéolaires et expose ainsi le collagène de type IV aux autoanticorps, ce qui conduit à une hémorragie pulmonaire1.
L'utilisation d'hormones en thérapie de remplacement a aussi été associée à un risque plus élevé de développer une cirrhose biliaire primaire31. De plus, l'exposition à
certains agents chimiques que l'on retrouve dans la nourriture, l'eau ou les détergents maison pourrait aussi induire une rupture de la tolérance envers le soi. Le mécanisme d'action probable de ces produits est qu'ils induisent des changements dans la structure de certaines protéines du soi en s'y liant ou en induisant leur agrégation, ce qui entraîne une réponse immunitaire contre ces protéines32.
1.2.2.3 Infections microbiennes
Bien que les mécanismes de tolérance du soi puissent être brisés en absence d'infection microbienne, il est connu que ces dernières peuvent conduire à l'apparition de maladies auto-immunes ou encore augmenter leurs symptômes33. Cependant, il ne s'agit
pas nécessairement d'une réaction immédiate. Ainsi, une infection survenue à l'enfance pourrait mener au développement d'une maladie auto-immune, une fois rendu à l'âge adulte34. Un bon exemple de l'implication des infections dans le développement des
maladies auto-immunes est l'infection par Helicobacter pylori qui peut mener à plusieurs réactions inflammatoires dont l'inflammation continue du colon et 1'ITP35. Le mimétisme
moléculaire est l'hypothèse la plus souvent avancée afin d'expliquer l'implication des pathogènes dans le développement des maladies auto-immunes et serait une des explications possibles par lesquelles H. pylori induit la sécrétion d'anticorps réactifs contre des structures portées par les plaquettes. En effet, les anticorps retrouvés chez des patients atteints d'ITP seraient réactifs à la fois contre la protéine CagA de H. pylori et certaines protéines retrouvées à la surface des plaquettes36. D'autres études ont montré que certaines
souches de H. pylori peuvent se lier au facteur von Willebrand et induire l'agrégation des plaquettes. L'activation du système immunitaire par l'infection entraînerait la destruction
des agrégats de plaquettes et par le fait même la présentation d'antigènes plaquettaires, ce qui induirait la sécrétion des anticorps autoréactifs pathogènes37. Dans certains cas, le
traitement de l'infection à H. pylori entraîne un augmentation du compte des plaquettes en circulation , ce qui illustre bien l'implication de ce microorganisme dans l'ITP.
Les superantigènes viraux pourraient aussi contribuer au développement de maladies auto-immunes par l'activation de cellules autoréactives qui, autrement, seraient devenues anergiques. Ainsi, l'activation de lymphocytes T autoréactifs par le superantigène IDDMK( 1,2)22 du retrovirus HERV pourrait être une cause du diabète de type I39.
Paradoxalement, les infections microbiennes en général pourraient protéger contre le développement des maladies auto-immunes. L'hypothèse de l'hygiène a été émise pour la première fois en 1989 par Strachan qui a suggéré que l'augmentation de la prévalence des maladies auto-immunes soit liée à une diminution des maladies infectieuses et à l'augmentation de l'hygiène40. Cela expliquerait pourquoi la majorité des maladies
auto-immunes, comme le diabète de type I, la sclérose en plaque ou les réactions inflammatoires de l'intestin, ont connu une forte augmentation de leur incidence au cours de la deuxième moitié du 20e siècle4.
1.2.3 Débalancement des profils Thl/Th2 et Thl7/T régulateur
Une caractéristique observée à la fois chez des patients souffrant de maladie auto-immune et dans des modèles animaux de ces maladies est qu'il y a un débalancement dans le profil des réponses des lymphocytes T auxiliaires. Comparés à ceux des individus sains, les profils de type Thl et Thl7 sont surreprésentés relativement aux profils Th2 et T régulateur chez les individus malades. Ainsi, les lymphocytes T auxiliaires avec des profils effecteurs et activateurs des phagocytes seraient présents en nombre plus élevé et ne pourraient plus être contrôlés par les lymphocytes T auxiliaires avec des profils ayant des fonctions régulatrices, présents en nombre trop peu élevé. De plus, un débalancement du profil Thl/Th2 vers Th2 serait impliqué dans le développement de réactions allergiques.
Les causes de ces débalancements ne sont toujours pas bien comprises mais incluraient à la fois des facteurs génétiques et environnementaux4'5.
1.2.4 Traitements
Lorsque des facteurs environnementaux ou des infections microbiennes sont directement en cause dans le développement de la maladie auto-immune, le retrait du facteur environnemental ou le traitement de l'infection peut mener à une amélioration de l'état du patient. De façon plus générale, les maladies auto-immunes sont traitées avec des drogues (corticostéroïde, etc.) qui vont induire un état anti-inflammatoire généralisé41. Dans
la grande majorité des cas, les maladies auto-immunes connaissent des épisodes chroniques. Ainsi les patients doivent obtenir un traitement à chaque épisode de la maladie. Cependant, il arrive que le traitement avec des drogues anti-inflammatoires ne parvienne pas à améliorer l'état du patient. Chez les patients atteints d'ITP réfractaire à tout autre traitement, il est possible de procéder à une mesure plus extrême : l'ablation de la rate. Par contre, même une telle mesure n'est pas efficace dans tous les cas. L'utilisation des immunoglobulines intraveineuses (IglV) est de plus en plus répandue pour le traitement d'une multitude de maladies auto-immunes bien que leur utilisation ne soit approuvée que pour un nombre restreint d'applications. Très souvent, les IglV sont utilisées de manière simultanée avec d'autres drogues anti-inflammatoires comme les corticostéroïdes.
1.3 Les immunoglobulines pour injection intraveineuse (IglV)
1.3.1 Méthode de production
Les IgPV sont obtenues à partir du fractionnement industriel du plasma de milliers de donneurs de sang et sont principalement constitués d'IgG monomériques. On retrouve aussi des agrégats d'IgG (de 1 à 10 % selon la préparation42) et des traces d'IgM et d'IgA.
Chaque année, plus de 23 millions de litres de plasma sont fractionnés dans le monde pour obtenir divers produits de fractionnement en plus des IglV : facteur VIII, facteur Von Willebrand, albumine, fibrinogène, etc4 . La première étape du fractionnement du plasma
afin d'obtenir des IglV est habituellement une étape de précipitation à l'éthanol. À partir du surnageant ainsi obtenu, des étapes de chromatographie par échange d'ions et de précipitation au polyethylene glycol sont réalisées. Finalement, des étapes visant l'inactivation de virus comme la pasteurisation ou la nanofiltration sont réalisées. Le rendement habituellement obtenu est de 3,5 à 4,5 grammes d'IgG par litre de plasma43.
Ainsi, les IglV représentent un mélange très hétérogène d'IgG dont la spécificité comprend l'ensemble des pathogènes auxquels la population des donneurs, dont le plasma a été utilisé, a été exposée44.
1.3.2 Utilisation et problématique
Avant 1981, les IgPV étaient utilisées seulement de façon préventive pour aider les personnes souffrant d'immunodéficiences primaire ou secondaire à combattre les infections; l'objectif étant de fournir une source externe d'anticorps à des personnes qui ne peuvent en produire par elles-mêmes. Dans ces cas, le traitement consiste en une dose mensuelle d'IgPV ajustée selon la sévérité du déficit, allant jusqu'à 0,6 g/kg de poids corporel. Par la suite, il a été démontré que les IgPV pouvaient aussi avoir un effet bénéfique dans le traitement de maladies auto-immunes. La première observation de l'effet immunosuppresseur des IgPV a été réalisée en 1981 chez des enfants souffrant d'ITP45.
Depuis, les IgPV sont utilisées dans une multitude de maladies auto-immunes et ce, dans la majorité de celles-ci, sans qu'il n'y ait d'étude contrôlée démontrant leur efficacité46. De
plus, la dose utilisée pour le traitement de ces maladies ( 1 à 2g/kg de poids corporel) est plus importante que celle pour les immunodéficiences. Cela a pour conséquence une augmentation constante de la demande en IgPV par les hôpitaux (voir tableau 1-2 pour la consommation au Québec, qui représente environ 25 % de la consommation au Canada). Présentement, une étude clinique est en cours pour évaluer l'efficacité des IgPV dans le traitement de la maladie d'Alzheimer47 et d'autres études ont montré que le traitement aux
IglV réduit le risque de développer cette maladie48. Un effet bénéfique des IglV comme
traitement complémentaire à la trithérapie pour les patients atteints du virus de l'immunodéficience humaine (VIH)-l a aussi été démontré par une étude clinique49. Dans
ce cas, la combinaison des IglV à la trithérapie permettrait de diminuer le réservoir de cellules CD4+ infectées par le virus. L'utilisation possible à plus grande échelle des IglV
dans des maladies telles que 1'Alzheimer ou le traitement du VIH causerait une forte augmentation de la demande pour ce produit et pourrait mener à une pénurie. Cette problématique est d'autant plus importante que les mécanismes d'action par lesquels les IglV induisent un état anti-inflammatoire ne sont toujours pas clairement compris.
Tableau 1-2 Consommation annuelle d'IglV au Québec entre 1987 et 2009 Année Consommation (q) Augmentation
1987-1988* 31 053 1988-1989* 42 473 36,8% 1989-1990* 56 642 33,4% 1990-1991* 73 828 30,3% 1991-1992* 107 570 45,7% 1992-1993* 143 030 33,0% 1993-1994* 184 420 28,9% 1994-1995* 215 546 16,9% 1995-1996* 267 019 23,9% 1996-1997* 325 885 22,0% 1997-1998* 338 479 3,9% 1998-1999* 426 443 26,0% 1999-2000** 515 761 20,9% 2000-2001** 616 534 19,5% 2001-2002** 694 889 12,7% 2002-2003** 775 961 11,7% 2003-2004** 851 690 9,8% 2004-2005** 899 240 5,6% 2005-2006** 967 740 7,6% 2006-2007** 1 000 435 3,4% 2007-2008** 1 097 226 9,7% 2008-2009** 1 222 840 11,4%
Source : rapport annuel de Héma-Québec 2008-2009. * Indique une distribution assurée par la Croix-Rouge et ** indique une distribution assurée par Héma-Québec.
1.3.2.1 Utilisation des IglV dans les maladies neurologiques ayant une composante auto-immune
Il est intéressant de noter que les IglV sont de plus en plus utilisées pour traiter des maladies neurologiques ayant une composante auto-immune. Certaines de ces maladies touchent le système nerveux périphérique (polyradiculonévrite inflammatoire démyélinisante chronique, syndrome de Guillain Barré, neuropathie motrice multifocale, etc.50) et d'autres touchent le système nerveux central (myasthénie et maladie
d'Alzheimer50). Dans le cas des maladies touchant le système nerveux périphérique, les
mécanismes d'action des IglV sur les composantes innées et adaptatives du système immunitaire peuvent expliquer les effets bénéfiques qui sont observés. Par contre, la barrière hémato-encéphalique bloque normalement l'accès des cellules du système immunitaire au système nerveux central. Afin d'expliquer les effets immunomodulateurs des IglV qui sont tout de même observés dans ces maladies, il a été avancé que, contrairement aux IgG endogènes, les IgPV seraient en mesure de franchir la barrière hémato-encéphalique51. La présence d'IglV dans le cerveau de souris à la suite de leur
injection intraveineuse a déjà été observée et serait augmentée s'il y a présence de dommage à la barrière hémato-encéphalique induite par les conditions d'inflammation52. La
présence du FcRn à la barrière hémato-encéphalique a été rapportée et permettrait la sortie des IgG du système nerveux central53. Par contre, les mécanismes par lesquels les IgPV
seraient transportées à travers la barrière hémato-encéphalique vers le système nerveux central demeurent inconnus.
1.3.3 Effets secondaires
Le traitement aux IglV est considéré comme étant très sécuritaire. Le procédé de fractionnement du plasma comprend des étapes visant l'inactivation de virus qui auraient pu ne pas être détectés à l'étape de dépistage à la suite d'un don de sang54. L'étape de
précipitation à l'éthanol est connu pour inactiver le VIH55 et le traitement au
tri(n-butyl)phosphate inactive le virus de l'hépatite C56. Les effets secondaires les plus fréquents
musculaires. Ces effets indésirables sont souvent associés à la vitesse d'infusion des IglV et disparaissent lorsqu'elle est diminuée . Des complications plus sévères ont été observées, quoique moins fréquemment. Par exemple, les préparations d'IgPV contenant du sucrose comme agent stabilisateur ont été associées à un risque de défaillance rénale58. Ce risque
diminue grandement lorsque les patients sont bien hydratés et que la vitesse d'infusion n'est pas trop élevée57. Les préparations d'IglV contenant un titre élevé d'anticorps
reconnaissant les antigènes des groupes sanguins A ou B sont associées avec un risque de réaction d'hémolyse chez les patients ayant un groupe sanguin A, B ou AB59. D a été
observé que, chez des patients souffrant d'immunodéficience primaire, un changement de préparation d'IglV (soit par le changement de compagnie ou le changement dans la méthode de préparation par la même compagnie) est aussi associé avec un risque plus élevé de réaction adverse60.
1.3.4 Mécanismes d'action des IglV dans les maladies auto-immunes
1.3.4.1 Mécanismes FcyR dépendants
De par la nature même des FcyR , il est logique de penser qu'ils peuvent être en partie impliqués dans l'effet anti-inflammatoire des IglV. Des travaux ont suggéré que les IgPV peuvent bloquer ces récepteurs, prévenant l'activation des macrophages61 et des
neutrophiles . De plus, il est démontré que les IgPV peuvent réduire l'expression des récepteurs activateurs FcyRI, FcyRIIa, FcyRIII et FcyRPV63"65 dans certains modèles
d'auto-immunité, ainsi qu'augmenter l'expression du récepteur inhibiteur FcyRIIb sur les macrophages66 et les lymphocytes B67. Dans un modèle d'ITP murin, la liaison des IgPV au
FcyRIII sur les cellules dendritiques induirait l'augmentation de l'expression du FcyRIIb et cette augmentation serait due à la liaison des IgPV au récepteur SIGN-R169 par la fraction
sialylée des IglV. L'implication du FcyRIIb dans l'effet thérapeutique des IglV dans le modèle murin d'ITP demeure controversée66'70. D'un autre côté, la liaison des IgPV au
FcyRIII indurait une dégranulation non productive des cellules NK en absence de cellules cibles, ce qui entraînerait une réduction des fonctions de ces cellules ce qui limiterait ainsi leur capacité à causer du dommage à l'organisme71. D'autre part, chez les femmes aux
élevé de cellules NK, le traitement aux IgPV permettrait une grossesse normale et serait accompagné par une diminution du nombre de cellules NK dans le sang périphérique72.
Enfin, chez les patients souffrant du syndrome de Kawasaki, le traitement aux IglV entraînerait une augmentation de l'activité des cellules NK dans le sang périphérique73.
Chez les macrophages et les monocytes, le traitement aux IglV inhiberait l'activation du facteur de transcription NF-kappaB74 ainsi que l'activation de ces cellules
(mesuré par le niveau d'expression de CXCL9, CXCL10 et d'IRF-1) en les rendant réfractaires à l'activation par l'interféron-y en diminuant, de manière dépendante du FcyRIII75, l'expression d'une sous-unité du récepteur de cette cytokine.
D'autres modèles ont mis en évidence l'implication du récepteur Fc néonatal (FcRn) dans l'effet des IglV. Le FcRn est un récepteur qui lie les IgG et les protège du catabolisme en les empêchant d'être dirigés vers les endosomes acides et en les retournant dans la circulation sanguine. C'est grâce à cette activité du FcRn que la demi-vie des IgG en circulation est très supérieure à celle des autres protéines plasmatiques76. L'injection
d'IgPV entraîne une forte augmentation de la concentration en IgG dans le sang, ainsi les IgPV viendraient saturer le FcRn, ce qui augmenterait le catabolisme de tous les IgG, y compris celui des autoanticorps pathologiques77.
1.3.4.2 Mécanismes FcyR indépendants
1.3.4.2.1 Implication des anticorps anti-idiotypiques
La présence d'anti-idiotypes dans les IglV leur permettrait aussi d'agir sur les lymphocytes B par l'intermédiaire de leur BCR. Ce mécanisme sera discuté plus en détail dans la section portant sur l'effet des IglV sur l'immunité adaptative. De plus, selon certaines études, les anti-idiotypes pourraient neutraliser les anticorps pathologiques causant la maladie78'79. Ainsi, dans un modèle murin de lupus érythémateux, l'injection de
la fraction des IglV reconnaissant la partie variable d'anti-ADN provenant de patients souffrant de lupus est capable de prévenir l'apparition des symptômes chez les souris où la maladie est induite80. Cependant, l'implication des anti-idiotypes dans l'induction des effets
anti-inflammatoires des IglV semble varier selon les modèles. En effet, selon une autre étude, l'implication des anti-idiotypes dans l'effet bénéfique des IglV dans un modèle
murin d'ITP serait à exclure puisque l'activité biologique des IgPV a été atribuée entièrement à leur partie Fc81.
Les IglV contiennent aussi des anticorps capables d'interagir avec d'autres protéines présentes en circulation que les IgG ainsi qu'avec des structures présentes à la surface des cellules. Les conséquences de ces interactions sont expliquées plus en détail dans les sections portant sur l'effet des IglV sur les cellules de l'immunité innée et adaptative.
1.3.4.2.2 Effet des IglV sur l'immunité innée
Dans des maladies auto-immunes où il y a accumulation de dépôts de complexes immuns, notamment dans l'arthrite rhumatoïde, le système du complément peut être activé et participer à la destruction des tissus. Il a été démontré que les IglV peuvent neutraliser certaines composantes du complément . Ainsi de façon générale, les IglV n'empêcheraient pas l'activation du système du complément mais limiteraient les dommages causés par ces composantes et la cascade d'activation s'ensuivant83.
Les IglV ont aussi des effets sur l'ensemble des cellules constituant le système immunitaire inné. Dans un premier temps, la présence d'anticorps reconnaissant le CD40 dans les IglV induirait la maturation des cellules dendritiques84. Les IglV affecteraient
aussi le profil des cytokines sécrétées par les cellules dendritiques, diminuant leur capacité à sécréter la cytokine proinflammatoire IL-12 et augmentant leur sécrétion d'IL-10, qui a une activité anti-inflammatoire85. Certaines études ont montré que les IglV modulent
l'expression de molécules de costimulation et du CMH de classe II à la surface des cellules dendritiques86. Par contre, une autre étude semble indiquer que ce n'est pas le cas87. Les
résultats inverses de modulation de l'expression du CMH de classe II obtenus par Bayry et al. et Aubin et al. peuvent s'expliquer par un temps d'incubation des cellules en présence d'IglV différent (respectivement cinq jours et un jour). Ainsi, des conditions expérimentales différentes pourraient influencer notre interprétation des mécanismes d'action des IglV.
Les IglV pourraient aussi induire la mort des neutrophiles et des éosinophiles humains par la présence d'anticorps dirigés contre les Siglec 8 et 9, des lectines liant les
acides sialiques88'89. Ces observations pourraient expliquer la baisse du nombre de
neutrophiles qui est parfois observée chez des patients à la suite d'un traitement aux IglV90.
1.3.4.2.3 Effet des IglV sur l'immunité adaptative
Les effets bénéfiques des IglV durent régulièrement plus longtemps que la demi-vie des IgG qui sont injectées. Une étude clinique a démontré chez des patients atteints d'ITP que le traitement aux IgPV était accompagné d'une baisse du niveau d'autoanticorps pathologiques91. Cette baisse était visible sur plusieurs mois et ne peut donc pas être
expliquée simplement par une augmentation du catabolisme des autoanticorps, ce qui suggère que les IglV modifient des éléments de la réponse immunitaire adaptative. Une baisse du niveau d'autoanticorps dirigés contre les desmoglines 1 et 3 a aussi été observée chez des patients souffrant de pemphigus deux semaines après un traitement aux IglV alors que le niveau de quatre anticorps non pathologiques était augmenté92. Ces observations
viennent renforcer l'idée que les effets des IglV se font sentir préférentiellement sur les cellules autoréactives.
Les IglV contiennent des anticorps dirigés contre diverses structures qui leur permettent d'interagir aussi avec les lymphocytes T et B (BCR, TCR, CD4, CMH de classe I et II, FAS, CD5, etc.)85. Il a été rapporté que les IglV inhibent les fonctions des
lymphocytes T activés par des agents mitogènes, comme la phytohémagglutinine (PHA)93.
Cependant, des résultats de notre laboratoire ont mis en évidence qu'il s'agirait plutôt d'une neutralisation de la PHA par les IgPV et non d'un effet direct sur les lymphocytes T (Lauriane Padet, Héma-Québec, Québec, communication personnelle). La présence d'anti-FAS (CD95) dans les IgPV a été impliquée dans l'induction de la mort par apoptose des lymphocytes in vitro94.
Un effet des IglV de plus en plus étudié est l'induction de l'augmentation du nombre de lymphocytes T régulateurs ainsi que l'accroissement de leurs fonctions (sécrétion d'IL-10 et de TGF-P). Ces effets ont été démontrés dans un modèle murin expérimental d'encéphalomyélite auto-immune95. De plus, lorsque les souris ont été
sur le développement de la pathologie. Ces résultats ont été confirmés en partie chez l'humain, où les IglV induisent in vitro une augmentation du TGF-P, de l'IL-10 et de FoxP3 chez les lymphocytes T CD4 purifiés . Une étude clinique a aussi mis en évidence une augmentation du nombre de T régulateurs chez des patients traités aux IglV49.
Cependant, cette étude n'était pas réalisée dans un contexte d'auto-immunité, ce qui ne nous permet pas de conclure sur l'induction de cette augmentation des T régulateurs par les IglV dans le traitement de l'auto-immunité. Cependant, une autre étude a démontré que lors d'un épisode de Guillain Barré, le nombre de lymphocytes T régulateurs en circulation chez les patients est diminué et qu'il retourne à la normale après un traitement aux IglV97. De
façon intéressante, une étude a montré que les IglV se lient plus fortement aux cellules T régulatrices qu'aux cellules T effectrices95, ce qui renforcit l'idée que les principaux effets
que les IglV exercent sur les lymphocytes T seraient dus à leur action sur la population de lymphocytes T régulateurs. D'ailleurs, le rôle des lymphocytes T régulateurs dans le contrôle de l'inflammation cadre bien avec les effets anti-inflammatoires des IglV.
Plusieurs effets des IglV sur les lymphocytes B ont été rapportés : diminution de la prolifération, augmentation de la sécrétion d'IgG98 et diminution de la sécrétion d'IgE99.
Pour ce qui est de la diminution de la sécrétion d'IgE, le mécanisme d'action des IglV serait indépendant du FcyRIIb1 . Le principal mécanisme d'action des IglV sur les
lymphocytes B impliquerait la présence d'anticorps anti-idiotypiques qui interagissent avec le BCR101 et conduirait à une modulation de leur activité. C'est en fait l'hypothèse avancée
par le groupe de la Dre Sonia Néron (Héma-Québec, Québec, Canada) qui a mis en évidence que les IglV induisent une augmentation de la phosphorylation des kinases ERK 1 et 2 spécifiquement chez les lymphocytes B IgG+102. Cette interaction entre les
anti-idiotypes présents dans les IglV et le BCR pourrait induire des signaux qui, en bout de ligne, modifient de manière significative le répertoire de lymphocytes B. De plus, le groupe de la Dre Sonia Néron a mis en évidence que l'induction de la phosphorylation d'ERKl-2 avait lieu sans l'implication du FcyRIIb. Par contre, il semblerait que l'exposition, à la fois in vivo et in vitro, des lymphocytes B murins aux IglV mène à une augmentation de l'expression du FcyRIIb à la surface de ces cellules67. Mis ensemble, ces résultats suggèrent
que les signaux induits chez les lymphocytes B par les IglV ne nécessitent pas la présence du FcyRIIb mais induiraient son expression. En plus d'une action potentielle directe sur les
lymphocytes B, les IglV pourraient aussi agir indirectement sur les lymphocytes B en neutralisant des cytokines importantes pour leur développement comme BAFF et A P R E J (a
proliferation-inducing ligand) . D en résulterait une compétition entre tous les lymphocytes B pour ces cytokines qui éliminerait (de façon non sélective) les lymphocytes B autoréactifs, puisque ceux-ci dépendent de façon plus importante de ces cytokines pour leur survie104. Des niveaux plus élevés de BAFF ont aussi été observés chez des patients
souffrant de maladies auto-immunes comparativement aux niveaux retrouvés chez des personnes saines, ce qui contribuerait à la production d'autoanticorps105. Les femmes ayant
des problèmes d'avortements récurrents spontanés présentent une baisse du nombre de lymphocytes B en circulation à la suite du traitement aux IglV, ce qui illustre les effets in vivo du traitement aux IglV sur les lymphocytes B106.