DE RABAT N° d’ordre: 2740
THÈSE DE DOCTORAT
Présentée par
Younes BELMAMOUNI
Discipline : Chimie
Spécialité : Physico-chimie des matériaux céramiques nanocomposites
Contribution à l’élaboration et à la caractérisation de biocéramiques
nanocomposites à base d’hydroxyapatite substituée en silicium / nanotubes
de carbone multiparois
Soutenue le 06 décembre 2014
Membres de jury :
Président :
M. El Mokhtar ESSASSI Professeur à la Faculté des Sciences de Rabat
Examinateurs:
M. Redouane MOUSSA Professeur à la Faculté des Sciences Aïn Chock de Casablanca
M. Abdallah ZRINEH Professeur à la Faculté des Sciences de Rabat
M. Abdesselam DAOUDI Professeur à la Faculté des Sciences Aïn Chock de Casablanca
M. Khalil El MABROUK Professeur à l’UniversitéEuro - Méditerranéenne, Fès
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tel +212 (0) 37 77 18 34/35/38, Fax : +212 (0) 37 77 42 61, http://www.fsr.ac.ma
Les travaux de recherches qui font l’objet de ce mémoire ont été réalisées dans le cadre d’une convention entre l’Université Mohammed V de Rabat et la Fondation MAScIR (Moroccan Foundation for Advanced Science, Innovation and Reseach).
Mes remerciements s’adressent en premier lieu à Monsieur le Professeur El Mokhtar
ESSASSI, chargé de recherche au sein du groupe Argile Composites et Nanocomposites à
Mascir- Nanotech et Directeur du Laboratoire de Chimie Organique Hétérocyclique au sein de la Faculté des Sciences Rabat, de m’avoir accordé sa confiance et de m’avoir confié ce travail de recherche. Je vous remercie pour votre patience et pour les nombreux conseils ainsi que toutes les connaissances scientifiques que vous m’avez fait partager.
Je souhaite exprimer ma sincère gratitude à Monsieur Khalil ELMABROUK, Professeur à l’Université Euro-Méditerranéenne de Fès, pour sa disponibilité, sa compréhension et la clairvoyance scientifique dont il a fait preuve durant ces dernières années. Il a été un maître et un ami et rien ne pourra traduire en mots ma profonde reconnaissance.
Je tiens à remercier Monsieur Abdallah ZRINEH, Professeur à la Faculté des Sciences de Rabat, pour l’intérêt qu’il a porté à ce travail en acceptant de participer au jury en tant que rapporteur.
J’aimerais adresser mes remerciements à Monsieur Redouane MOUSSA, Professeur à la Faculté des Sciences Aïn Chock de Casablanca, pour avoir accepté d’examiner ce travail de thèse.
Je tiens à exprimer mes remerciements à Monsieur Abdesselam DAOUDI, Professeur à la Faculté des Sciences Aïn Chock de Casablanca, pour avoir bien voulu se joindre à cet honorable jury en tant que rapporteur.
J’adresse également mes sincères remerciements à Monsieur le Professeur José M.F.
Ferreira, Chef du Département Ingénierie des Céramiques et des Verres à l’Univérsité
d’Aveiro au Portugal, pour sa collaboration et les conseils dont il m’a fait bénéficier au cours de nombreuses discussions.
J’aimerais aussi adresser mes remerciements aux membres de l’équipe plateforme de la Fondation MAScIR, qui ont contribué à cette thèse.
cette thèse, avec qui travailler fut un grand honneur.
Je voudrais remercier vivement mes amis : Abdelilah Aboulayt, Walid Amer, Othmane Amadine, Tarik Ajjammouri, Hicham Abououalid, Zakaria Laghfour, Younes Essamlali,
Abderrazak Slimani, Abdelkrim Iraoui et El Mehdi Mekhzoum.
Je ne peux clore ce chapitre sans remercier ma famille qui m’a soutenu moralement tout au long de mes études.
HA Hydroxyapatite
n-HA Hydroxyapatite nanopoudre
SixHA Hydroxyapatite silicatée
n-SixHA Hydroxyapatite silicatée nanopoudre
TCP Phosphate tricalcique
β-TCP Phosphate tricalcique β
Ca Calcium
P Phosphore
Si Silicium
Cmc Concentration micellaire critique
CTAB Bromure d'hexadécyltriméthylammonium
SDS Sodium dodécyl sulfate
NTCs Nanotubes de carbone
MWNTs Nanotubes de carbone multiparois
SWNTs Nanotubes de carbone monoparoi
c-MWNTs Nanotubes de carbone multiparoi bruts
f-MWNTs Nanotubes de carbone multiparoi fonctionnalisés
o-MWNTs Nanotubes de carbone multiparoi oxydés
r-MWNTs Nanotubes de carbone multiparoi réduits
s-MWNTs Nanotubes de carbone multiparoi silanisés
TEOS Tétraethoxysilane
MEC Matrice extra-cellulaire
tpm Tours par minute
T Température de la réaction
t Durée de la réaction
ATG Analyse thermogravimétrique
MET Microscope électronique à transmission
EDX Analyse semi-qualitative par spectrométrie à dispersion d'énergie
IRTF Spectroscopie infrarouge à transformée de Fourrier
BET Théorie Brunauer, Emett et Teller
BJH Méthode Barrett, Joyner et Halenda
ICP-AES Spectrométrie d'émission atomique à couplage induit par torche plasma.
SBF Fluide biologique simulé
wt % Pourcentage massique
Introduction générale ... 10
Chapitre I : Synthèse bibliographique ... 15
I. Le tissu osseux ... 16
I.1. Les types d’os ... 16
I.2. Architecture des os ... 18
I.3. Composition du tissu osseux ... 19
I.4. Processus de remodelage osseux ... 22
II. Biomatériaux ... 24
II.1. Substituts osseux d’origine naturelle ... 25
II.2. Biomatériaux artificiels ... 26
III. Les phosphates de calcium en substitution osseuse ... 30
IV. L’hydroxyapatite ... 32
IV.1. Méthode de synthèse ... 32
IV.2. Structure et propriétés ... 34
IV.3. Applications ... 37
V. L’hydroxyapatite substituée ... 39
V.1. Intérêt des substitutions dans l’hydroxyapatite ... 39
V.2. Effets de la substitution sur les propriétés de l’hydroxyapatite ... 39
VI. L’hydroxyapatite silicatée ... 43
VI.1. Conception de biocéramiques d’hydroxyapatite silicatée ... 43
VI.2. Renforcement de l’hydroxyapatite et de l’hydroxyapatite silicatée ... 46
VII. Les nanotubes de carbone ... 48
VII.1. Structure et propriétés ... 48
VII.2. Méthodes de synthèse ... 50
VIII. Céramiques composites hydroxyapatite /nanotubes de carbone ... 51
VIII.1. Méthode d’élaboration ... 51
VIII.2. Propriétés mécaniques ... 53
VIII.3. Propriétés biologiques ... 57
Introduction ... 61
I. Synthèse hydrothermale des poudres ... 62
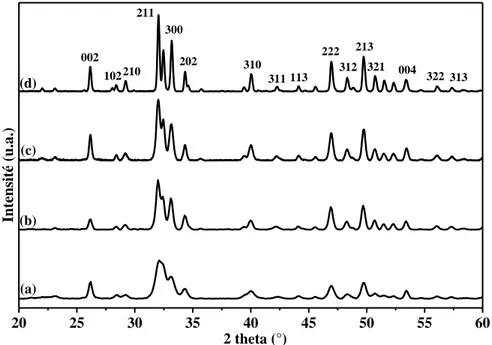
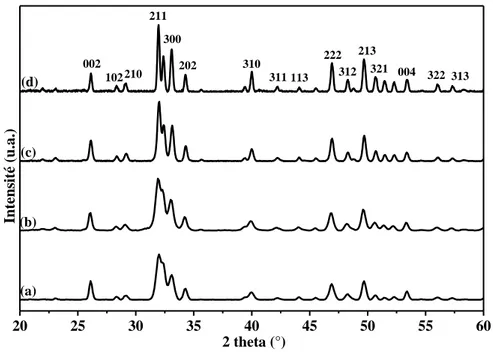
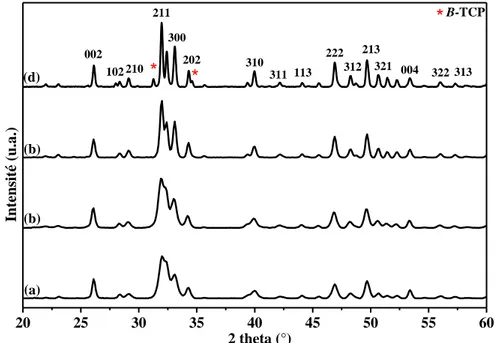
II. Caractérisation des poudres brutes de synthèse ... 65
II.1. Analyses structurales ... 65
II.1.1. Technique de caractérisation ... 65
II.1.2. Résultats et discussions ... 67
II.2. Analyses spectroscopiques ... 73
II.2.1.Technique de caractérisation ... 73
II.2.2. Résultats et discussions ... 74
II.3. Analyse chimique élémentaire ... 77
II.3.1.Technique de caractérisation ... 77
II.3.2. Résultats et discussions ... 78
II.4. Morphologie et caractéristiques physiques ... 79
II.4.1. Morphologie des poudres ... 79
II.4.2. Evaluation des surfaces spécifiques et distribution de taille des pores ... 83
II.5. Analyse thermogravimétrique ... 89
II.5.1. Technique de caractérisation ... 89
II.5.2. Résultats et discussions ... 89
Conclusion ... 91
Chapitre III : Evaluation des propriétés mécaniques et biologiques des céramiques à base d’hydroxyapatite silicatée ... 93
Introduction ... 94
I. Elaboration des matériaux céramiques n-SixHA ... 95
II. Caractérisation des matériaux céramiques ... 95
II.1. Caractérisation physique des matériaux céramiques n-SixHA ... 95
II.1.1. Mesure de densité ... 95
II.1.2. Evaluation des propriétés mécaniques ... 96
II.1.3. Résultats et discussions ... 97
II.2. Etude des céramiques n-SixHA en milieu acellulaire ... 100
II.2.1. Technique de caractérisation acellulaire ... 100
Chapitre IV : Etude de la consolidation de l’hydroxyapatite silicatée par des nanotubes
de carbone oxydés ... 114
Introduction ... 115
I. Elaboration des céramiques composites ... 116
I.1. Purification et fonctionnalisation des nanotubes de carbone ... 116
I.2. Préparation de la matrice nanocomposites n-Si0.8HA/o-MWNTs ... 117
II. Techniques de caractérisation ... 117
II.1. Caractérisation des nanotubes de carbone ... 117
II.2. Caractérisation des matériaux céramiques composites ... 118
III. Résultats et discussions ... 119
III.1. Caractérisation des poudres n-Si0.8HA ... 119
III.2. Caractérisation des nanotubes de carbone ... 120
III.3. Caractérisation des céramiques composites n-Si0.8HA/o-MWNTs ... 124
Conclusion ... 134
Chapitre V : Etude des propriétés mécaniques et biologiques des céramiques phosphocalciques renforcées par des nanotubes de carbone silanisés ... 135
Introduction ... 136
I. Elaboration des céramiques composites ... 137
I.1. Silanisation des nanotubes de carbone ... 137
I.2. Préparation des matrices nanocomposites ... 138
II. Techniques de caractérisation ... 138
II.1. Caractérisation des nanotubes de carbone ... 138
II.1.1. Analyse spectroscopique ... 138
II.1.2. Analyse de morphologie ... 139
II.1.3. Analyse thermogravimétrique ... 140
II.2. Caractérisation des matériaux céramiques composites ... 140
II.2.1. Analyse structurale ... 140
II.2.2. Evaluation des propriétés mécaniques ... 140
III.1. Caractérisation des nanotubes de carbone ... 141
III.2. Caractérisation des céramiques composites ... 145
III.2.1. Composite céramique à base d’hydroxyapatite n-Si0.0HA ... 145
III.2.2. Composite céramique à base d’hydroxyapatite silicatée n-Si0.8HA ... 153
Conclusion ... 161 Conclusion générale ... 164 Perspectives ... 166 ANNEXE ... 167 Lexique ... 174 Références Bibliographiques ... 176
Introduction générale
Le squelette osseux est un tissu vivant, qui est en perpétuel renouvellement (10% par an). Ce processus de remodelage est nécessaire au maintien de la masse osseuse et à la conservation des propriétés mécaniques de l’os ainsi qu’à la cicatrisation des fractures.
Dans certaines situations, comme les pertes osseuses qui sont dues à certaines maladies telles que l’ostéoporose ou bien, suite à une exérèse tumorale, le mécanisme naturel mis en œuvre pour la réparation osseuse n’est plus suffisant. En conséquence un apport de matière extérieur devient indispensable pour le traitement du traumatisme. Pour remédier à ce problème les chirurgiens font appel à l’usage de biomatériaux. Le domaine des biomatériaux est aujourd’hui en plein essor et les travaux de recherche qui en découlent se sont orientés vers la médecine régénérative des tissus. Il s’agit de développer des matériaux à caractères ostéoinducteurs, capables de supporter le processus de la régénération osseuse.
Grâce à leur similarité chimique avec le composant minéral de l'os, les céramiques à base d’Hydroxyapatite de formule chimique Ca10(PO4)6(OH)2 sont parfaitement biocompatibles et représentent des substituts osseux de choix en chirurgie réparatrice, en orthopédie et en odontologie.
Les céramiques à base d’hydroxyapatite sont capables d’accueillir la repousse osseuse par invasion vasculaire et cellulaire, mais leur faible caractère d’ostéoinduction constitue une limite à une intégration rapide de l’implant au niveau du site hôte.
D’autre part ces céramiques sont caractérisées par des propriétés mécaniques assez médiocres (faible ténacité et faible résistance à la flexion), qui limitent leurs applications biomédicales au niveau des endroits soumises à une forte sollicitation mécanique.
Pour apporter à l’hydroxyapatite un caractère ostéoinducteur et améliorer son comportement bioactif, une des méthodes actuellement à l’étude consiste à modifier sa composition chimique pour se rapprocher de celle de la partie minérale du tissu osseux.
Sachant que la structure de l’hydroxyapatite permet une grande variété de substitution. De telles modifications affectent la réactivité de la surface de l’hydroxyapatite, ce qui influence son comportement dans le milieu biologique. Plusieurs substitutions ioniques au sein de la structure apatitique ont été mises en œuvre et c’est le cas des apatites silicatées.
L’élément silicium (Si) représente 0,05% de la masse corporelle. Cet élément joue un rôle essentiel dans la formation et à la calcification osseuse ainsi qu’à la prévention de l'ostéoporose.
Grâce aux évaluations biologiques qui ont témoigné d’une amélioration de la bioactivité, un intérêt croissant a été porté au dopage de l’hydroxyapatite par le silicium. Cependant, l’incorporation du silicium dans la structure de l’hydroxyapatite n’a pas été sans conséquences, puisque de forts affaiblissements, au niveau des résistances mécaniques, ont été aussi observés.
Pour cette raison, l'amélioration des propriétés mécaniques de l'hydroxyapatite et de l’hydroxyaptite silicatée s’avère d’une importance extrême afin d’améliorer leurs performances pour des applications à long terme et dans des endroits de fortes charges mécaniques.
Plusieurs approches ont été adoptées afin d’améliorer les propriétés mécaniques des biocéramiques à base d’hydroxyapatite. Ces méthodes comprennent essentiellement l'usage de matériaux de renfort à base de métaux et d’alliages métalliques ou bien de polymères. Cependant de telles approches ont nécessité l’usage de grandes quantités d’agents de renfort, ce qui avait une incidence négative sur la biocompatibilité de l’hydroxyapatite.
Un agent de renfort idéal est celui qui permettra des améliorations significatives des propriétés mécaniques d’une matrice donnée sans détériorer sa bioactivité.
Les nanotubes de carbone possèdent des propriétés mécaniques exceptionnelles qui pourraient leurs conférer la potentialité de renforcer les matrices phosphocalciques sans altérer le caractère de biocompatibilité.
C’est dans ce contexte que s’inscrivent les travaux présentés dans ce mémoire.
Lors de ce projet nous sommes partis du principe qu’une bonne maîtrise de la synthèse des poudres d’hydroxyapatite silicatée à l’échelle nanométrique, pourrait permettre la maîtrise de ses propriétés à l’échelle micrométrique et par la suite à l’échelle macrométrique. De même, un usage de poudres nanométriques permettra une meilleure densification du matériau céramique et par conséquent des propriétés mécaniques améliorées. Ensuite, nous avons procédé à l’étude du renforcement des céramiques phosphocalciques par usage de nanotubes de carbone oxydés. Ensuite nous avons essayé d’améliorer davantage l’interface entre ces nanotubes de carbone et les matrices étudiées, par établissement de liaisons covalentes, capables d’assurer un bon transfert de charge lors de l’application d’une contrainte mécanique. Dans cette optique nous avons examiné les effets de l’usage d’un agent de couplage matrice/agent de renfort, sur les capacités des nanotubes de carbone à renforcer les céramiques phosphocalciques.
Cette thèse débutera avec un chapitre introductif sous forme d’une étude bibliographique, qui rappelle le mode de fonctionnement du tissu osseux, ainsi que les principaux biomatériaux
céramiques utilisés en chirurgie réparatrice. Après avoir présenté les principales biocéramiques phosphocalciques utilisées en chirurgie réparatrice, l’intérêt du silicium sur le comportement biologique de l’hydroxyapatite est développé. Enfin, une dernière partie décrit l’état de l’art des céramiques composites renforcées par des nanotubes de carbone.
La synthèse et la caractérisation des nanopoudres d’hydroxyapatites silicatées ont fait l’objet du second chapitre.
L’étude des effets du silicium sur les propriétés mécaniques et biologiques des céramiques à base des nanopoudres d’hydroxyapatite silicatée a fait l’objet du troisième chapitre.
Le quatrième chapitre a pour objectif d’évaluer l’influence de l’usage de nanotubes de carbone comme agents de renfort, sur les propriétés mécaniques de la matrice n-Si0.8HA. Enfin, le dernier chapitre a été consacré à l’étude des effets de l’usage du silane comme agent de couplage, sur les propriétés mécaniques des biocéramiques phosphocalciques renforcées par des nanotubes de carbone.
15
Chapitre I : Synthèse bibliographique
16
Chapitre I : Synthèse bibliographique
La synthèse bibliographique de ce manuscrit comprend quatre parties. La première partie de ce chapitre est destinée à décrire l’architecture du tissu osseux, ses fonctions ainsi que son processus de renouvellement. Dans un second temps, les principaux biomatériaux seront détaillés avant de présenter les phosphates de calcium rencontrés en chirurgie réparatrice. La troisième partie de ce chapitre est consacrée à la description des propriétés de l’hydroxyapatite et ses substitutions et aborde plus particulièrement l’hydroxyapatite silicatée. La dernière partie expose les propriétés des nanotubes de carbone, ainsi que les principaux résultats des travaux réalisés sur les composites céramiques hydroxyapatite / nanotubes de carbone, dans le but d’améliorer les propriétés mécaniques des biocéramiques.
I. Le tissu osseux
Le tissu osseux est un système vivant complexe. Il s’agit d’un tissu conjonctif, qui comporte des cellules qui baignent dans une matrice osseuse : la matrice extracellulaire. Le tissu osseux est un tissu dur, qui confère au corps humain trois fonctions :
La fonction mécanique : grâce à sa capacité à supporter des contraintes mécaniques, le tissu osseux assure la mobilité du corps et sert de support pour le soutien corporel physique des tissus mous du corps, ainsi que la protection des organes.
La fonction métabolique : le tissu osseux est un tissu vivant constamment remodelé, ce qui permet la libération et le stockage des sels minéraux. Il assure le contrôle du métabolisme phosphocalcique puisqu’il renferme 99 % du calcium total et environ 85 % du phosphore total de l’organisme.
La fonction hématopoïétique: les os abritent dans leurs espaces médullaires, la moelle hématopoïétique, dont les cellules souches sont à l’origine des trois lignées de cellules sanguines. Les cellules stromales de la moelle osseuse fournissent un support structural et fonctionnel aux cellules hématopoïétiques relatif à la formation des trois lignées des cellules sanguines.
I.1. Les types d’os
La forme des os est très variée et dépend de leurs fonctions ainsi que de leur situation dans le corps. Il existe quatre variétés anatomiques d’os (Figure I-1) : les os longs, les os courts, les os plats et les os irréguliers.
17
Les os longs tels que le tibia, le fémur et le radius (Figure I-2) sont constitués d’un corps; la diaphyse, et de deux extrémités; les épiphyses.
La diaphyse est constituée d’une couche épaisse et dense de tissu osseux : corticale. Elle est creusée par le canal médullaire, remplie de moelle osseuse jaune lipidique et entourée d’une membrane : le périoste, qui est riche en vaisseaux nourriciers qui participent au processus d’ossification. Les épiphyses (aux deux extrémités) sont formées d’une couche d’os compact contenant de l’os spongieux empli de moelle rouge hématopoïétique. Les épiphyses sont recouvertes de cartilage articulaire. Diaphyse et épiphyse sont reliées par une zone qui est le siège de la croissance osseuse: la métaphyse.
Figure I-1: Classification des os [1]
Les os courts (les os du poignet et de la rotule) sont formés d’un noyau d’os spongieux entouré d’une corticale, constituée d’une fine couche d’os compact. Ces os comprennent plusieurs surfaces articulaires.
Os plat
Os long
Os irrégulier Os court
18
Les os plats (l’os pariétal, le sternum et les côtes) sont composés de deux couches d’os compact qui enferment une couche de tissu osseux spongieux.
Figure I-2 : Coupe partielle d’un os long [1]
I.2. Architecture des os
Selon la partie considérée de l’os, on distingue deux formes de structures osseuses : l’os spongieux et l’os compact (Figure I-3).
L’os spongieux (trabéculaire) constitue la zone interne de l’os. Il est constitué d’un lacis tridimensionnel de spicules ou trabécules de tissu osseux, délimitant un labyrinthe d’espaces interconnectés, qui est occupé par de la moelle osseuse et des vaisseaux (Figure I-3(a)). L’os spongieux est riche en cellules conjonctives adipeuses et en éléments sanguins. Il est essentiellement localisé dans les os courts et plats (sternum, ailes iliaques) ainsi que dans les épiphyses des os longs.
L’os cortical (Figure I-3(b)) représente la partie dure du tissu osseux. Il forme un manchon plus ou moins épais, qui est localisé au niveau de la partie périphérique de l’os. L’os cortical est constitué d’unités appelées ostéons ou systèmes de Havers. Les ostéons sont des lamelles osseuses cylindriques organisées autour du canal de Havers, qui contient des capillaires sanguins et des filets nerveux amyéliniques. Cette disposition confère à l’os cortical un
Diaphyse Epiphyse Métaphyse Epiphyse Métaphyse Cartilage articulaire Moelle osseuse rouge
Endoste Ligne épiphysaire Périoste Canal médullaire Artère nourricière Cartilage articulaire
19
maximum de résistance mécanique. L’os cortical posséde une structure dense, qui lui confère des résistances mécaniques nettement supérieures à celle de l’os spongieux.
Du point de vue métabolique, l’os spongieux est biologiquement plus actif et subit des processus de remodelage plus fréquemment que l’os cortical. Pendant le processus du remaniement permanent de l’os, il y’a formation de l’os spongieux en premier lieu, qui est ensuite dégradé et remplacé par l’os compact.
1) Ostéoïde
2) Ostéoblastes actifs
3) Ostéoblastes inactifs (cellules de revêtement) 4) Trabeculae
5) Espaces de moelle contenant des cellules hématopoïétiques 6) Ostéoclastes (dans la lacune de Howship)
7) Ostéocytes
8) Lamelles concentriques d’osteon (système de Havers) 9) Artère nourricière
10) Maillage de moelle
11) Trabécules dans le canal médullaire
12) Branches artériolaires centrale d’artère nourricière 13) Branche artériolaire périphérique d’artère nourricière 14) Artère nourricière
15) Lamelles périphérique sous-périostée externe 16) Périoste
17) Lamelles interstitielle
18) Lamelles concentriques d’osteon (système de Havers) 19) Capillaires dans les canaux de Havers
20) Capillaires dans les canaux de Volkmann 21) Veine
22) artère nourricière
Figure I-3 : Structure d’un fémur humain, d’os spongieux (a) et d’os cortical (b) [2,3]
I.3. Composition du tissu osseux
I. 3. 1. La matrice extracellulaire
La matrice extracellulaire du tissu osseux est définie comme étant un matériau composite constitué d’une partie minérale (69 % en poids), de 20% de matière organique et de 9 % d'eau, en plus de protéines et de polysaccharides [4].
1 2 3 7 6 5 4 9 8
15
16
17
18
19
20
21
14 12 11 10 13 15 16 17 18 19 20 21(a)
(b)
20 I. 3. 1. a. La phase organique de la matrice extracellulaire
La matrice organique est composée de fibres de collagène de type I. Le collagène est une glycoprotéine fibreuse rigide, en forme de tresse à trois brins. Les collagènes ont une longueur de 300 nm et un diamètre de 5 nm et sont organisés sous forme de fibres parallèles au sein de couches superposées. Cette alternance de l’orientation des fibres de collagène confère au tissu osseux un aspect lamellaire, une bonne flexibilité et une ténacité élevée (Figure I-2(b)).La partie organique du tissu osseux comprend aussi des protéines non collagéniques telles que les glycoprotéines (ostéonectine, ostéopontine, sialoprotéine, fibronectine), des protéines contenant des résidus d’acide glutamique carboxylé (ostéocalcine), des phosphoprotéines, des phospholipides, des protéoglycanes et des facteurs de croissance [5]. Ces protéines facilitent l’adhésion des cellules osseuses à la matrice et favorisent la liaison matrice minérale / collagène [6].
I. 3. 1. b. La phase minérale de la matrice extracellulaire
La phase minérale du tissu osseux est essentiellement constituée d’une apatite mal cristallisée, dont la formule chimique est la suivante:
Ca8,3(PO4)4,3(CO3)1,0(HPO4)0,7(CO3, OH)0,3 [7]
C’est une apatite déficitaire en calcium, partiellement substituée par des ions hydrogénophosphate (HPO42-) et carbonate (CO32-), dont la composition varie selon les espèces, la localisation du tissu, le régime alimentaire et l'âge (puisque la teneur en ions carbonate augmente avec l’âge) [8].
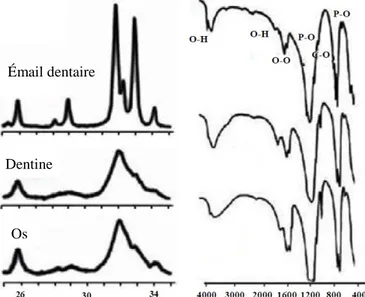
Figure I-4 : Spectres de diffraction des rayons X et spectres infrarouges d’un émail dentaire,
d’une dentine et de l’os [9] Émail dentaire
Dentine
21
Elle contient aussi de nombreux ions en substitution, tels les ions sodium, potassium, fluorure, magnésium, strontium et chlorure [10].
Du point de vue morphologique, les cristaux d’apatite osseuse sont organisés sous forme d’aiguilles de 20 à 40 nm de longueur [11] et disposés d’une façon périodique entre les fibrilles de collagène [12], de manière que l’axe des aiguilles de l’apatite soit aligné parallèlement aux fibres de collagène.
I.3.2. La matrice cellulaire
Deux catégories de cellules osseuses coexistent dans le tissu osseux [13]: la lignée ostéoblastique et la lignée ostéoclastique. La première est constituée de préostéoblastes, d’ostéoblastes matures, d’ostéocytes et de cellules bordantes. Les cellules de la lignée ostéoblastique agissent de manière coordonnée pour la synthèse de nouvelles matrices osseuses lors du processus du remodelage osseux. Les ostéoclastes contribuent à la résorption du tissu osseux ancien.
I.3.2.a. La lignée ostéoblastique
Les préostéoblastes sont des cellules issues de la division de cellules souches dérivées du mésenchyme. Elles sont localisées au niveau de la moelle de l’os trabéculaire. Ces cellules se différencient en ostéoblastes et expriment la phosphatase alcaline, qui est essentielle à la minéralisation de l’os.
Les ostéoblastes matures sont des cellules mononuclées de 20 à 30 μm de diamètre [1]. Il s’agit de cellules ostéoformatrices cubiques, alignées perpendiculairement le long de la surface interne et externe du tissu osseux. Les ostéoblastes matures sont responsables de la synthèse des constituants organiques (protéines) de la matrice extracellulaire (MEC).
Après initiation de la calcification et déposition de la MEC, trois devenirs sont envisageables pour les ostéoblastes:
La transformation en ostéocytes. Ces cellules sont reliées entre elles et avec les cellules de la surface osseuse par des extensions de la membrane cytoplasmique et entourent complètement la matrice extracellulaire (MEC). Les ostéocytes assurent le maintien des activités cellulaires quotidiennes du tissu osseux, par échange d’agents de nutritions et de déchets avec le sang.
La mise au repos progressive sous la forme d’une couche de cellules bordantes, capables de redevenir des ostéoblastes actifs. Ces cellules possèdent une activité
22
métabolique très réduite. Ils sont arrangés en forme aplatie, allongée et tapissent les surfaces osseuses.
La mort cellulaire programmée ou apoptose.
I.3.2.b. La lignée ostéoclastique
Les ostéoclastes sont des cellules issues de la fusion de préostéoclastes. Ces derniers sont formés à partir de cellules souches hématopoïétiques de la moelle osseuse. Les ostéoclastes sont des cellules plurinuclées très volumineuses (20 à 100 μm de diamètre). Ils sécrètent des enzymes lysosomiales et des acides, qui digèrent les protéines et les minéraux de la matrice osseuse, détruisant ainsi l’os et formant des lacunes de résorption. Les ostéoclastes sont très mobiles et capables de se déplacer à la surface des travées osseuses (d’un site de résorption à l’autre) et à l’intérieur des lacunes de résorption qu’ils créent.
I.4. Processus de remodelage osseux
L’os est en perpétuelle évolution au cours de la croissance et pendant le remodelage osseux. Le remodelage osseux est un processus continu de renouvellement du tissu osseux, par lequel un nouveau tissu osseux remplace un ancien. Il permet le maintien de la masse osseuse, la réparation des fractures et la conservation des propriétés mécaniques du squelette osseux ainsi que leur adaptation aux contraintes [14].
Pendant le processus de remodelage l’ancien tissu osseux est résorbé par les ostéoclastes puis remplacé par un nouveau tissu osseux, formé par des ostéoblastes. Le cycle de remodelage dure environ quatre mois chez l’adulte et se divise en quatre étapes distinctes (Figure I-5): la phase d’activation, la phase de résorption puis la phase de réversion et enfin la phase de formation.
I. 4. 1. La phase d’activation
La phase d’activation se manifeste au niveau d’une surface osseuse inactive et recouverte de cellules bordantes. Ces dernières empêchent l’accès des ostéoclastes à la matrice extracellulaire. Cette phase est initiée sous l’effet d’une stimulation hormonale, qui provoque une fusion des préostéoclastes, pour former les ostéoclastes ainsi qu’une rétraction de cellules bordantes. Cette rétraction permet l’accès des ostéoclastes néoformés pour adhérer à la matrice osseuse. Les ostéoblastes présents sur le site, sécrètent de l’ostéopontine qui favorise l’ancrage des ostéoclastes sur la matrice extracellulaire.
23 Figure I-5: Schéma de la dynamique du remodelage osseux [15]
I. 4. 2. La phase de résorption
Les ostéoclastes actifs se fixent aux protéines de la matrice osseuse et initient la phase de résorption. La résorption s’effectue en deux étapes successives: la dissolution de la phase minérale et la dégradation de la matrice organique.
La partie minérale de l’os est dissoute sous l’effet de l’acidité des ions H+
sécrétés par des ostéoclastes. L’acidité du milieu provoque une activation enzymatique des ostéoclastes et favorise la dissolution des cristaux d’apatite, permettant ainsi la création de lacunes et la mise à nue de la matrice organique.
La matrice organique est dégradée sous l’action enzymatique du contenu des ostéoclastes. Les constituants organiques de la matrice extracellulaire sont digérés par les enzymes phosphatases acides, métalloprotéinases et cathepsines. La durée de la phase de résorption est comprise entre une et deux semaines.
I. 4. 3. La phase d’inversion
Lorsque la formation de lacunes de résorption est achevée, les ostéoclastes libèrent des facteurs de croissance qui activent le recrutement des préostéoblastes, avant de mourir par apoptose. Les ostéoclastes sont ensuite remplacés par des cellules macrophages qui lissent le
Tissu osseux Tissu osseux Tissu osseux Tissu osseux Tissu osseux Tissu osseux Tissu osseux 1 7 6 5 4 3 2 Formation Activation Formation Inversion Résorption Résorption Cellules bordantes Préostéoclastes Ostéoclastes Ostéoblastes
24
fond des lacunes. Ces derniers sont riches en ostéopontine, qui activerait les ostéoblastes lors de la phase de formation.
I. 4. 4. La phase de formation
La phase de formation comprend deux étapes : la production d’une matrice extracellulaire pour combler les lacunes de résorption suivie de sa minéralisation.
Lorsque la phase de résorption est achevée, les cellules de la ligne cémentante présentes au fond des lacunes, se divisent et se différencient en ostéoblastes .Ces ostéoblastes sécrètent une nouvelle matrice collagénique nommée tissu ostéoïde. Il s’agit d’un tissu non minéralisé et structuré par les fibres de collagène. La vitesse d’apposition de la matrice par les ostéoblastes est de 2 à 3 μm par jour.
Dans une seconde étape les ostéoblastes matures procèdent à la consolidation du tissu néoformé par un processus de minéralisation. Lors de cette phase les ions calcium et phosphate situés au niveau du milieu extracellulaire se lient au niveau du cytoplasme des cellules ostéoblastiques, pour former un complexe phosphocalcique. Ce dernier est déposé au niveau des espaces interfibrillaires du collagène de la matrice osseuse, sous forme de cristaux d’apatite biologique. La phase de formation s’étale sur une durée de deux mois et demi. A l’issue de la formation osseuse, une partie des ostéoblastes meurt par apoptose, l’autre partie se transforme en ostéocytes qui restent piégés au niveau de la matrice osseuse.
II. Biomatériaux
Le tissu osseux est parfois sujet d’un ensemble de traumatismes, qui altèrent son fonctionnement normal. A côté des fractures et de la fragilité osseuse causée par des maladies comme l'ostéoporose, la perte osseuse constitue le problème majeur des tissus osseux. Ces pertes peuvent se produire à différents endroits, suite à différents traumatismes. Elles peuvent aussi résulter de diverses interventions chirurgicales destinées à l’élimination des tumeurs cancéreuses ou bien de foyers infectieux.
Afin de reconstruire les défauts osseux et restaurer les fonctions mécaniques et biologiques des tissus endommagés, on fait appel à l’usage des biomatériaux.
Les biomatériaux ont été définis en 1986, lors de la Conférence de Chester de la Société
Européenne des Biomatériaux, comme étant des matériaux non vivants utilisés dans un
25
possèdent un large domaine d’application chirurgicale, allant de la chirurgie cardiaque, à la chirurgie ophtalmologique, passant par la chirurgie maxillo-faciale et orthopédique.
Le marché mondial des biomatériaux a été estimé à 115,4 milliards de dollars en 2008 et devrait être de 252,7 milliards de dollars en 2014. La plus grande partie de ce marché appartient aux biomatériaux orthopédiques [16].
La greffe de biomatériaux constitue un moyen pour renforcer les os fragilisés, pour combler les vides, pour mettre à niveau l’intégrité du squelette osseux et pour favoriser le processus de la réparation osseuse. Un substitut osseux peut être d’origine naturelle ou bien artificielle.
II.1. Substituts osseux d’origine naturelle
On distingue plusieurs types de greffes osseuses : l’autogreffe, l’allogreffe et la xénogreffe.
II.1.1. L’autogreffe
L’autogreffe est une procédure au cours de laquelle le greffon est prélevé sur le patient lui-même. La crête iliaque constitue le site de prélèvement le plus fréquemment choisi, puisqu’il offre un accès facile à une bonne qualité d’os spongieux. Vue la complexité de la structure du tissu osseux, il s’avère clairement que l’autogreffe constitue la solution optimale pour la greffe osseuse, en terme de propriétés ostéoinductives et ostéoconductrice du greffon [17]. Toutefois cette procédure présente de sérieux inconvénients. L’autogreffe offre une quantité limitée et insuffisante de greffon, qui est parfois de qualité médiocre lorsque le patient est âgé ou bien atteint d’une maladie osseuse telle que l’ostéoporose. Puisqu’elle implique une seconde incision pour la récolte de tissu de remplacement, l’autogreffe s'accompagne aussi de douleurs à long terme et nécessite une durée de guérison supplémentaire au niveau du site donneur [18,19].
II.1.2. L’allogreffe
L’allogreffe est une méthode de greffe osseuse dont le greffon est fourni par une autre personne. Cette procédure présente l’inconvénient d’une disponibilité limitée, en raison des règlements juridiques et religieux établis au niveau de quelques pays.
D’autre part, l’allogreffe présente aussi des risques de rejet, sous l’effet de réactions du système immunitaire [20] et pourrait aussi constituer un facteur d’infection virale [21].
Les risques de transmission de maladies virales peuvent être éliminés par chauffage, congélation, stérilisation par rayonnement γ ou bien par lyophilisation [22]. Mais l’ensemble de ces traitements, entraine aussi un affaiblissement significatif de leurs capacités biologiques
26
et une détérioration de leurs propriétés mécaniques, initialement présents dans le tissu osseux de l'allogreffe.
II.1.3. La xénogreffe
La xénogreffe est réalisée à l’aide d’un greffon d’origine animale. Cette procédure présente aussi des risques de rejet et d'infection [23]. Toutefois il est possible de traiter les xénogreffons pour éviter ces inconvénients, mais la greffe ne présente alors aucune cellule vivante et par conséquent elle n'offre aucun avantage biologique (ostéoinduction et ostéconduction) par rapport aux biomatériaux artificiels.
II.2. Biomatériaux artificiels
Il n’existe aucun matériau artificiel capable de mimer effectivement les fonctions de l'os naturel. Le recours à l’usage de biomatériaux artificiels, pour la réparation de tissus osseux, constitue une bonne alternative aux substituts osseux naturels, puisqu’il présente l’avantage de l’absence de tout risque d’infection virale ou bien de rejet, avec une disponibilité non-limitée.
On compte annuellement, environ 2.2 millions d’opérations de greffe osseuse [24], à l’échelle internationale, dont seulement 10% sont réalisées à l’aide d’implants à base de biomatériaux artificiels.
Les biomatériaux sont destinés à être implantés dans un organisme vivant et seront donc en contact avec des tissus et/ou des fluides biologiques. La réussite d’un biomatériau à l’intégration biologique sous forme de substitut osseux, dépend des interactions physico-chimiques qu’il établit avec le milieu biologique environnant.
Pour être toléré par l’organisme, un biomatériau doit être biocompatible, afin d’éviter de déclencher toutes réactions inflammatoires, toxiques ou bien de réponses immunitaires. D'un point de vue mécanique, les substituts osseux synthétiques doivent avoir une résistance similaire à celle du tissu remplacé [25]. Il doit aussi être en mesure de former une interface stable avec le tissu naturel environnant, puisque l’existence de micromouvements de l'implant pourrait provoquer une intégration médiocre, ainsi que la formation de débris, entrainant des réactions inflammatoires [26-27].
D’après Osborn [28], les biomatériaux artificiels peuvent être classés en fonction de leur réactivité par rapport à l’organisme en matériau bioinerte, bioactif, biorésorbable et non-résorbable. Les biomatériaux artificiels actuellement utilisés, ou bien ceux qui sont en cours
27
de développement, comprennent des polymères, des métaux, des alliages métalliques, des verres et des céramiques.
Le choix de la nature d’un implant se fait en fonction de ses propriétés chimiques, biologiques et mécaniques qui doivent correspondre aux critères imposés par la demande.
Le tableau I.1 regroupe les principales classes de biomatériaux avec leurs applications médicales.
Tableau I.1: Classification de biomatériaux [22,29]
Groupe Matériaux Domaine d’application
Métaux et
alliages
Alliages chrome-cobalt Implants articulaires, implants dentaires Titane Ti-6Al-V4 Implants articulaires et dentaires, plaques et
vis d’ostéosynthèse, pacemaker, élément de chirurgie reconstructive
Acier inoxydable 316L Plaques et vis d’ostéosynthèse, agrafes diverses, implants articulaires
Alliages nickel-chrome et nickel-titane
Réparation dentaire
Polymères
Polyéthylène Sutures, chirurgie faciale et dentaire,
tendons, prothèses de hanches et genoux Polyméthylméthacrylate
(PMMA)
Ciment orthopédique
Verres et
biocéramiques
Phosphates de calcium Implants orthopédiques, ciments, chirurgie maxillo-faciale, comblement osseux
Alumine Al2O3 Prothèses articulaires, ongles, têtes et cotyles pour prothèses de hanches, osselets de l'oreille moyenne
Zircone ZrO2 Prothèses articulaires, ongles, têtes et cotyles pour prothèses de hanches, osselets de l'oreille moyenne, implants dentaires
Bioverres Implants orthopédiques et dentaires, disques
vertébraux, prothèses de genoux
II.2.1. Polymères
Certains polymères présentent de grandes ressemblances avec les composants organiques du corps humain, comme le collagène, ce qui leur confère de bonnes aptitudes à établir des liaisons avec les polymères tissulaires. La plupart des polymères possèdent un comportement ductile, ce qui permet leur usinage sous diverses formes de biomatériaux polymériques.
28
On distingue trois grandes catégories de biomatériaux à base de polymères: les polymères fonctionnels, les polymères résorbables et les polymères adhésifs.
Les polymères fonctionnels sont des polymères susceptibles d’établir des fonctions chimiques à l’interface avec le tissu vivant, ce qui permet de créer des interactions avec les ostéoblastes et par conséquent favoriser la croissance osseuse.
Les polymères résorbables sont des polymères qui permettent de combler des vides et se dégradent progressivement au niveau du corps humain, au fur et à mesure de la réparation tissulaire osseuse [30].
Les polymères adhésifs sont des polymères qui sont dotés d’une bonne biocompatibilité et qui sont utilisés pour la suture, la cicatrisation des blessures ainsi que la fixation des implants orthopédiques.
Il existe plusieurs inconvénients qui limitent l’usage des polymères sous forme de biomatériaux:
L’instabilité au rayonnement gamma lors de la stérilisation,
La réactivité avec certains types de médicaments,
Les risques associés aux additifs et aux produits organiques issus de la dégradation in
vivo.
II.2.2. Métaux et alliages métalliques
Il existe un ensemble de métaux et d’alliages métalliques qui sont utilisés sous forme de prothèses en orthopédie. L’intérêt de leur usage, dans ce domaine, réside au niveau de leurs propriétés mécaniques intéressantes. Les matériaux métalliques les plus utilisés sont les aciers inoxydables, les alliages cobalt-chrome ou le titane et ses alliages [31].
La sélection d’un métal parmi d’autres dépend de sa résistance à la corrosion et de ses propriétés mécaniques. Cependant, ces matériaux présentent encore des problèmes mal résolus :
Le relargage d’éléments métalliques, dû aux interactions entre les protéines et le métal,
Les réactions immunitaires et réactions d'hypersensibilité,
Les phénomènes de frottements et les problèmes de débris qui en résultent.
Le revêtement des implants métalliques par des céramiques biocompatibles permet d’améliorer leur biocompatibilité et de minimiser ces problèmes; cependant cette solution est
29
limitée par les problèmes de délaminations, qui se manifestent au niveau de l’interface implant métallique / revêtement céramique.
II.2.3. Biocéramiques
Les céramiques représentent les matériaux les plus biocompatibles avec le tissu osseux. Il s’agit de matériaux durs, mais aussi fragiles, qui sont dotés de faibles densités et de bonnes stabilités dans les milieux corrosifs. En raison de leur excellente biointégration, les biocéramiques sont essentiellement utilisées en tant que substituts osseux en chirurgie orthopédique, maxillo-faciale et plastique. Ils sont commercialisés sous forme de céramiques denses ou à porosité variable, sous forme de ciments, ou bien sous forme de revêtements d’implants métalliques. Selon le type et la forme du défaut à combler, le site d'implantation et les contraintes mécaniques, les chirurgiens ont à leur disposition différents types de biocéramiques. Selon leur mécanisme d'action et leur réactivité vis-à-vis du corps humain, les matériaux biocéramiques sont regroupés en trois grandes catégories : les biocéramiques inertes, les biocéramiques résorbables et les biocéramiques bioactives [32].
Les céramiques inertes sont des céramiques biologiquement inactives, dotées d’une grande stabilité dans le milieu physiologique. Leur inertie par rapport aux tissus environnants leur offre une bonne biocompatibilité, qui empêche la manifestation de toutes réactions immunitaires ou bien inflammatoires.
Les liaisons établies entre les céramiques inertes et le tissu osseux se font par accroche mécanique via une fine capsule fibreuse située autour de l’implant [32].
Les biocéramiques bioinertes les plus utilisées sont l’alumine Al2O3 et la zircone ZrO2. Leur principal champ d’applications est le remplacement articulaire, plus particulièrement la prothèse de hanche.
Les biocéramiques résorbables sont des céramiques qui possèdent une importante solubilité dans les milieux physiologiques. Ces biocéramiques se dégradent progressivement dans l’organisme et sont lentement remplacés par du tissu naturel endogène. Ce processus de dégradation semble être le plus idéal pour le processus de réparation osseuse, mais cela peut nuire à l'intégrité mécanique de l’implant, ainsi qu’à la stabilité de l'interface tissu / biocéramique. Les deux biocéramiques biorésorbables les plus connues sont le plâtre de Paris (CaSO4, 2H2O) et le phosphate tricalcique béta β-TCP (Ca3(PO4)2).
Le terme biocéramiques bioactives est utilisé pour désigner les céramiques qui favorisent le processus de réparation tissulaire sans subir une dégradation. Le caractère bioactif de ces matériaux est essentiellement dû à leur faible solubilité de surface. Ce caractère leur permet
30
de se lier directement au tissu osseux sans formation d'une interface fibreuse et promouvoir in
situ le phénomène de germination des phosphates de calcium à partir des fluides biologiques.
Ce type d’implant est destiné à rester intact dans le corps à long terme. Les céramiques bioactives comprennent les verres bioactifs, les vitrocéramiques bioactifs et l’hydroxyapatite.
III. Les phosphates de calcium en substitution osseuse
Les phosphates de calcium sont des substituts osseux de choix en chirurgie orthopédique et maxillo-faciale. Cet intérêt réside au niveau de leur composition chimique, qui est voisine de celle de la partie minérale de l’os humain. Cette particularité leur confère des propriétés intéressantes en termes de bioactivité et de biocompatibilité [33]. Ce sont des matériaux ostéoconducteurs, puisqu’ils ont la propriété de favoriser la repousse osseuse, par invasion vasculaire et cellulaire à partir du tissu osseux receveur. Par contre, ils ne sont pas ostéoinducteurs, car ils n’ont pas la capacité d’induire la formation de matière osseuse en site extra osseux. Les phosphates de calcium possèdent d’excellentes affinités à se lier au tissu osseux. Leurs implantations ont démontré l’établissement de fortes liaisons entre les cristaux de l’implant et ceux de la partie minérale du tissu osseux [34]. Cette liaison est tellement forte, que pendant les essais mécaniques, la rupture apparaît dans le tissu osseux et non pas au niveau de l’interface os/implant [35].
Les phosphates de calcium sont adaptés sous différentes formes, pour être utilisé dans de nombreuses applications biomédicales [36]:
La reconstruction osseuse,
Le remplacement de l'os (les petits os et les os de l'oreille moyenne),
Le revêtement de prothèses métalliques (de hanche et de genou),
Le support de médicaments (antibiotiques, substances médicamenteuses anticancéreuses et facteurs de croissance).
Le tableau I.2 regroupe les différents phosphates de calcium disponibles sur le marché des biomatériaux.
Les phosphates de calcium les plus utilisés pour le biomédical sont le phosphate tricalcique β (TCP) et l’hydroxyapatite. Le choix d’un phosphate de calcium dépend de ses propriétés à savoir sa bioactivité et sa vitesse de résorption.
31 Tableau I.2:Classification des phosphates de calcium et leurs applications biomédicales
[37-39]
Nom et formule chimique Abréviation Type de matériaux et utilisation
Hydroxyapatite Ca10(PO4)6(OH)2
HA ou bien HAP
Céramiques, dépôt plasma, composites, support de médicaments Apatite non stœchiométrique ns-HA
s-HAP
Dépôt à basse température, composites, support de médicaments β phosphate tricalcique
Ca3(PO4)2
β TCP Céramiques, composites, ciments osseux, dépôt plasma, support de médicaments Phosphate dicalcique
dihydraté CaHPO4, 2H2O
DCPD Ciments osseux
Phosphate dicalcique anhydre CaHPO4
DCPA Ciments osseux
Phosphate octocalcique Ca8(PO4)4(HPO4)2, 5H2O
OCP Ciments osseux
Phosphate tétracalcique Ca4(PO4)2O
TTCP Ciments osseux
Phosphate de calcium amorphe
ACP Ciments osseux, support de médicaments,
dépôt à basse température
Derrière la fluoroapatite, l’hydroxyapatite constitue le matériau le plus stable en milieu physiologique, alors que le phosphate tricalcique β (TCP) est considéré comme étant le matériau le plus résorbable parmi la famille des phosphates de calcium. L’hydroxyapatite est aussi la plus répandue et la moins chère parmi les composés phosphatés destinés aux applications biomédicales.
32
IV. L’hydroxyapatite
IV.1. Méthode de synthèse
La synthèse de l’hydroxyapatite est réalisée selon plusieurs voies, regroupées en deux familles: la synthèse en phase solide et la synthèse par voie humide. Cette dernière comprend la précipitation, la synthèse hydrothermale et la méthode sol-gel.
IV.1.1. La synthèse en phase solide
L’élaboration de l’hydroxyapatite en phase solide consiste en un traitement thermique d’un mélange homogène de précurseurs finement broyés. Ce type de synthèse est réalisé sous atmosphère humide à une température de 1050 °C. Les réactions de synthèse sont les suivantes :
2 Ca3(PO4)2 + Ca4P2O9 + H2O Ca10(PO4)6(OH)2 3Ca3(PO4)2+ CaO Ca10(PO4)6(OH)2
Ce type de synthèse donne lieu à des produits stœchiométriques et bien cristallisés mais, de faibles surfaces spécifiques [40-43].
IV.1.2. La synthèse par voie humide IV.1.2.1. La précipitation
La synthèse de l’hydroxyapatite par précipitation consiste à faire réagir une solution aqueuse contenant un précurseur de calcium avec une solution aqueuse contenant un précurseur de phosphore. Cette réaction est réalisée sous pression atmosphérique, à des températures modérées (25 - 60 °C) et sous un control rigoureux du pH du milieu réactionnel.
10 Ca(OH)2 + 6 H3PO4 Ca10(PO4)6(OH)2 + 18 H2O 6 (NH4)2HPO4+10 Ca(NO3)2, 4H2O + 8NH4OH
Ca10(PO4)6(OH)2 + 20 NH4(NO3) + 20 H2O
La synthèse par précipitation constitue la méthode la plus simple et la moins coûteuse pour l’élaboration de grandes quantités d’hydroxyapatite. Cependant l’hydroxyapatite préparée par
33
cette méthode n’est pas stœchiométrique (déficitaire en Ca) et faiblement cristallisée. Le rapport molaire de Ca/P varie de 1,50 à 1,67 et la formule chimique générale est :
Ca10-x(HPO4)x(PO4)6-x(OH)2-x avec 0≤ x ≤1 [44].
IV.1.2.2. La synthèse hydrothermale
La synthèse hydrothermale peut être définie comme étant une synthèse par précipitation, qui est réalisée sous une température (au-dessus de 100 °C) et une pression (> 1atm) élevées. Elle est réalisée dans un milieu fermé permettant une élévation de la température sans évaporation de l’eau. Cette méthode permet l’obtention de poudres fines et homogènes d’hydroxyapatite bien cristallisée [45-47].
IV.1.2.4. La méthode sol-gel
La synthèse par voie sol-gel consiste en la formation d’un « sol » par hydrolyse d’un alcoxy métallique en hydroxyle métallique, selon l’équation suivante:
M-OR + H2O M-OH + R-OH
Ensuite, le sol polymérise par réaction de condensation, pour donner lieu à des matériaux denses de type M-O-M.
M-OH + M-OR M-O-M + R-OH M-OH + H-O-M M-O-M + H2O
M: un métal de degré d’oxydation n, OR: un groupement alcoxyde
La synthèse est réalisée par mélange de solutions alcooliques de nitrate de calcium Ca(NO3)2,4H2O et de triéthylphosphite (TEP).
Ce procédé est réalisé à basse température et nécessite une agitation vigoureuse, une longue durée d’hydrolyse, ainsi qu’un contrôle rigoureux du pH du milieu réactionnel [48-50].
Cette méthode permet l’obtention d’une hydroxyapatite stœchiométrique, pure, fine et homogène.
Néanmoins, l’application de la méthode sol-gel pour la synthèse de l’hydroxyapatite reste limitée par le coût élevé des précurseurs de phosphates.
Récemment, plusieurs travaux de recherche se sont orientés vers l’usage d’agents structurants pour la régulation de la taille et de la forme des particules de l’hydroxyapatite [51-54].
34
Ces travaux font intervenir l’usage de tensioactifs lors de la préparation de l’hydroxyapatite. Plusieurs surfactants ont été testés, à savoir, le cétyltriméthylammonium (CTAB), le polyvinylpyrrolidone (PVP), le dodécylsulfate de sodium (SDS), le dioctylsulfosuccinate de sodium (AOT), le dodécyl de phosphate (DP), le polyoxyéthylène éther de nonylphénol 5 (NP5), et le NP12 (polyoxyéthylène éther de nonylphénol 12), le polyoxyethylene (TX-100) et le polysorbate 80 (Tween 80).
Ces études, ont montré que l’usage de surfactants a permis de générer des poudres d’hydroxyapatite de taille nanométrique avec une porosité calibrée ou hiérarchisée (micro-, méso- et macro-pores), dotées de surfaces spécifiques élevées, et d’une parfaite homogénéité de morphologie et de taille de particules [55-58].
IV.2. Structure et propriétés
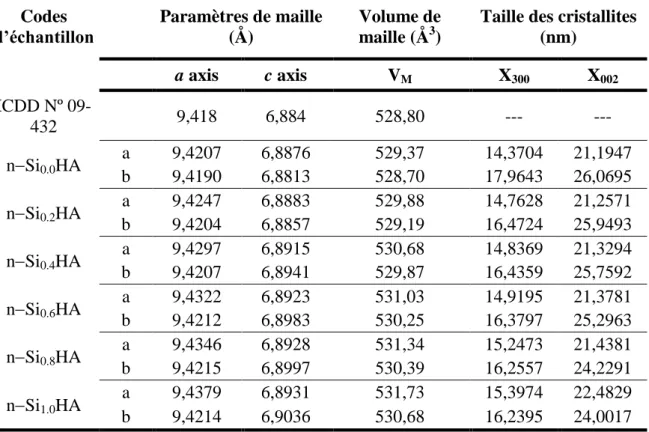
L’hydroxyapatite phosphocalcique (HA), de formule chimique Ca10(PO4)6(OH)2, fait partie de la famille cristallographique des apatites qui présentent la formulation générique Me10(XO4)6(Y)2; Me représente un cation divalent, XO4 un groupement anionique trivalent et Y un anion ou un groupement ionique monovalent. L’hydroxyapatite stœchiométrique est définie par un rapport molaire Ca/P égal à 1,67 et une densité de 3,156. A basse température, l’hydroxyapatite stœchiométrique pure cristallise dans un système monoclinique de groupe d’espace P21/b [59]. Cependant, à partir d’une température de 250 °C, il y a un phénomène de désordre des ions hydroxyle qui provoque une transition de phase cristalline de l’hydroxyapatite pour cristalliser dans un système hexagonal, appartenant au groupe d’espace
P63/m et dont les paramètres de maille a, c et β ont pour valeurs respectives 9,432 Å, 6,881 Å et 120°, avec un volume totale de la maille de 530,14 Å3 [60-62]. La structure cristallographique de l’hydroxyapatite (figure I-6) est formée par deux couches horizontales de tétraèdres PO4, situées à z=1/4 et z=3/4. Les groupements phosphates sont organisés sous forme d’un empilement hexagonal, qui définit deux types de tunnels (figure I-6), parallèles à l’axe c (perpendiculaires au plan (001)). Ces tunnels sont occupés par des ions calcium. Le premier type de tunnel coïncide avec l’axe ternaire de la structure. Il est de petit diamètre (environ 2,5 Å), occupé par des ions calcium notés CaI, qui sont au nombre de 4 par maille, entourés par neuf atomes d’oxygène des groupements phosphate PO4. Le second type de tunnel, dont l’axe coïncide avec l’axe sénaire hélicoïdal du réseau, contient les ions hydroxyde OH-et le reste des cations Ca2+ notés CaII, soit six cations par maille, entourés de six atomes d’oxygène des tétraèdres PO4-. Les cations type CaII forment des triangles
35
équilatéraux à des côtes z = ¼ et ¾ décalés de 60° autour de l’axe sénaire hélicoïdal. La taille de ce type de tunnel (3 - 4,5Å) confère à l’hydroxyapatite de bonnes affinités d’échange d’ions et de fixation de petites molécules (O2, H2O, glycine) [63,64].
Ainsi l’une des principales caractéristiques de la structure apatitique est d’admettre un grand nombre de substitutions sans déstabiliser sa structure cristallographique [65].
Figure I-6: Schéma d’une maille élémentaire d’hydroxyapatite [66]
Figure I-7: Projection perpendiculaire au plan (001) d’une maille élémentaire
d’hydroxyapatite [66]
L’hydroxyapatite est faiblement soluble dans l’eau distillée, soluble dans les solutions acides et insoluble dans les solutions alcalines. La solubilité de l’hydroxyapatite dépend d’un ensemble de paramètres : le rapport Ca/P, le dégrée de cristallinité, les dimensions des cristallites, le taux de porosité et le degré de frittage.
36
L’hydroxyapatite constitue derrière la fluoroapatite le phosphate de calcium le plus stable et le moins soluble dans le milieu sous-cutané (0,1mg/an) [67], avec des produits de solubilité Ks = 3,05 10-59 (mol.L-1) à 25 °C et Ks = 4,7 10-59 (mol.L-1) à 37 °C [68].
Vu que la consolidation des poudres d’hydroxyapatite sous forme de biocéramique nécessite un traitement thermique, il est essentiel de connaitre son comportement en fonction de la température. En effet la stabilité thermique de l’hydroxyapatite dépend principalement du rapport Ca/P. L’hydroxyapatite excédentaire (Ca/P>1,67), présente une stabilité thermique jusqu’à une température de 900°C, avant de se dégrader selon la réaction suivante:
Ca10(PO4)6(OH)2 900°C 3Ca3(PO4)2+ CaO+H2O
L’hydroxyapatite déficitaire est thermiquement stable jusqu’à une température de 850°C, avant décomposition en Ca4P2O9 et β-TCP (qui se transforme en α-TCP):
Ca10(PO4)6(OH)2 900°C 2Ca3(PO4)2 + Ca4P2O9+H2O
Par contre l’hydroxyapatite stœchiométrique cristallisée présente une structure assez stable et sa décomposition thermique n’intervient qu’à des températures très élevées (1000 °C - 1360 °C). La décomposition de l’hydroxyapatite se manifeste par une perte graduelle des groupements hydroxyle –OH, pour donner lieu à l’oxyapatite (OAP) selon la réaction réversible suivante :
Ca10(PO4)6(OH) 2 1000-1360 °C Ca10 (PO4)6(OH) 2-2XOX + xH2O
Cette réaction est réversible et l’hydratation de l’OAP est immédiate, sous atmosphère saturée en vapeur d’eau à 900°C.
Un chauffage de l’oxyapatite à des températures supérieures à 1360 °C provoque aussi sa décomposition en phosphate tricalcique α et en phosphate tétracalcique (TTCP), selon une réaction réversible:
Ca10(PO4)6(OH) 2-2XOX T>1360 °C Ca4(PO4)2O + 2α Ca3(PO4)2 + (1-x) H2O La composition chimique de l’hydroxyapatite dépend aussi de la vitesse du chauffage lors du frittage. Ce dernier, avec une grande vitesse, permet d’assurer les meilleurs propriétés mécaniques pour l’hydroxyapatite; cependant, une vitesse de chauffage supérieure à 10°C/min, favorise sa décomposition en phase secondaire [69].
37
Les propriétés mécaniques de l’hydroxyapatite dense dépendent considérablement de la qualité de l’hydroxyapatite poudre et de la méthode de consolidation. En comparaison avec les propriétés mécaniques de l’os, l’hydroxyapatite dense est dotée d’une excellente résistance à la compression, qui est quatre fois supérieure à celle de l’os cortical. Cependant, sa résistance à la flexion, sa ténacité ainsi que sa résistance à la fatigue dans un milieu physiologique (coefficient de Weibull n = 12<20), sont assez médiocres [70]. L’hydroxyapatite possède un module de Young très élevé, capable de causer un phénomène de ‟stress shielding‟. Ce dernier se manifeste lorsqu’un tissu osseux est en contact avec un implant de module élastique très élevé. En effet l’implant assure la portée de charges mécaniques et cause un remodelage du tissu osseux par un autre tissu plus fragile. Le ‟stress shielding‟ est responsable de la rupture au niveau de l’interface implant/tissu osseux.
Les propriétés mécaniques de l’hydroxyapatite dense ne correspondent pas à celles de l'os naturel. En conséquence elles n’autorisent pas des usages cliniques dans des endroits de fortes charges mécaniques et limite ses applications sous forme de revêtement d’implants métalliques.
TableauI.3: Propriétés mécaniques de l’os [71] et de l’hydroxyapatite dense
Os cortical Os spongieux Hydroxyapatite dense
Résistance à la flexion (MPa) 50-150 10-20 17-75 [72-74]
Résistance à la compression (MPa)
100-230 2-12 430-920 [75-77]
Module de Young 7-25 0.5-4 108-117 [76]
Ténacité (MPa/m2) 2-12 ND * 1 [75,76,78]
* Non disponibles dans la littérature
IV.3. Applications
En raison d'une grande similitude avec l’apatite biologique, l’hydroxyapatite est largement utilisée sous forme de granules ou de pièces céramiques pour le comblement de vides osseux [32]. Elle est aussi utilisée en orthopédie, sous forme de revêtement de prothèses articulaires métalliques afin de combiner son caractère de biocompatibilité avec les propriétés mécaniques des implants métalliques. Un revêtement à base d’hydroxyapatite permet d'améliorer la
38
fixation de la prothèse sur le tissu osseux et de réduire la libération d'ions métalliques à partir de l'alliage de l'implant vers l'organisme vivant [79-81]. Cependant les implants métalliques recouverts d’hydroxyapatite, possèdent une durée de vie moyenne de 10-15ans [82], au bout de laquelle il y a manifestation de phénomènes de délamination au niveau de l’interface implant/revêtement, conduisant, ainsi, à l’apparition de fissures au niveau du revêtement et formation de débris. Ce dernier provoque des inflammations au niveau du site de l’implantation, et rend indispensable le recourt à des opérations chirurgicales, pour le remplacement des implants métalliques épuisés. Vus l’âge et l’état de santé de certains patients, ce type d’opération devient parfois impossible à réaliser.
En oto-rhino-laryngologie, l’hydroxyapatite est utilisée pour la réalisation de prothèse de reconstruction ossiculaire, pour remplacement des trois os de l’oreille (marteau, enclume et étrier).
L’hydroxyapatite a été aussi utilisée comme phase stationnaire en chromatographie liquide, pour la séparation des acides nucléiques, des protéines et d'autres composés biologiques [83-86] et comme support de catalyseurs [87,88].
Grâce à ses capacités d’échanges ioniques, l’hydroxyapatite est utilisée comme agent de décontamination d’éléments toxiques contenus dans les eaux polluées [89].
Figure I-8: Prothèse de hanche orthopédique revêtue par l’hydroxyapatite
39
V. L’hydroxyapatite substituée
V.1. Intérêt des substitutions dans l’hydroxyapatite
L’une des principales caractéristiques de l’hydroxyapatite est sa capacité à admettre un grand nombre d’ions en substitution dans chaque site de son réseau, tout en conservant la stabilité de sa structure. Cette propriété permet d’envisager la synthèse de nouveaux matériaux pour de nombreuses applications dans des domaines variés. Bien que sa composition chimique soit similaire à celle des apatites biologiques naturelles, la bioactivité de l’hydroxyapatite reste relativement limitée. Dans le cadre des travaux d’amélioration des propriétés biologiques de l’hydroxyapatite in vivo, plusieurs approches de développement sont actuellement à l’état de recherche. L’incorporation de différents ions dans la structure de l’hydroxyapatite par substitution, constitue l’une des méthodes qui pourrait ajuster la composition chimique de l’hydroxyapatite synthétique à celle de l’os naturel et par conséquent mimer ses propriétés physicochimiques in vivo.
V.2. Effets de la substitution sur les propriétés de l’hydroxyapatite
Chaque groupement ionique, présent au niveau de la structure de l’hydroxyapatite, est susceptible d’être remplacé en substitution par un autre groupement ionique de même valence ou de valence différente. L’introduction de nouveaux ions influence les propriétés physico-chimiques et biologiques de l’hydroxyapatite. A l’exception de la substitution des ions hydroxyde (OH-) par les ions fluor (F-), qui génère une augmentation de la cristallinité de la structure et une réduction de la solubilité de l’hydroxyapatite, l’incorporation de nouveaux groupements ioniques dans la structure de l’hydroxyapatite engendre une modification des paramètres de la maille cristalline, un changement de la forme et de la taille des cristallites, une baisse de la cristallinité, une diminution de la stabilité thermique et une augmentation de la solubilité [90,91].
Le tableau I.4 regroupe des exemples de substitutions dans la structure de l’hydroxyapatite par des éléments présents dans la phase minérale de l’os.
Le magnésium, sous forme ionique, est un élément essentiel au métabolisme minéral du squelette osseux. La baisse de magnésium provoque une diminution de l’activité ostéoblastique et ostéoclastique, l’arrêt de la croissance osseuse et la fragilisation du tissu osseux [93].
Comparée à l’hydroxyapatite, les apatites substituées au magnésium présentent d’excellentes propriétés biologiques, mises en évidence par une amélioration significative de l’adhérence des ostéoblastes et une favorisation du processus de minéralisation des tissus osseux [94,95].