PRÉVALENCE ET DÉTECTION DE LA DÉPRESSION,
PROFIL NEUROPSYCHIATRIQUE ET IMPACT D’UNE
MÉDICATION PRO-COGNITIVE CHEZ LE SUJET ÂGÉ
ATTEINT DE DÉMENCE DE TYPE ALZHEIMER OU
D’UNE DÉMENCE APPARENTÉE ET DEMEURANT EN
CENTRE D’HÉBERGEMENT À QUÉBEC
Mémoire
Jean-François Côté
Maîtrise en épidémiologie-épidémiologie clinique
Maître ès sciences (M.Sc.)
Québec, Canada
iii
Résumé
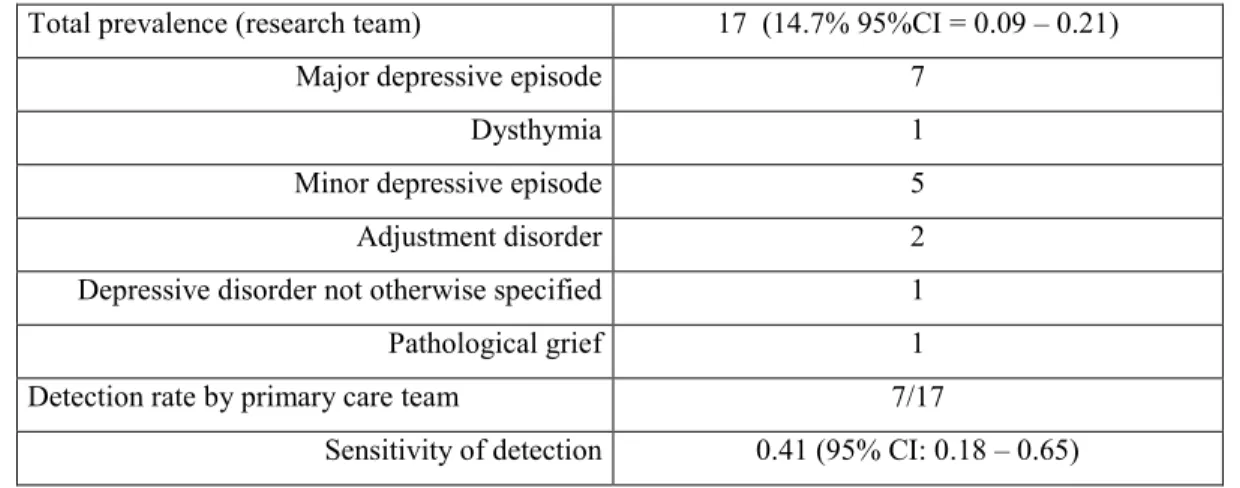
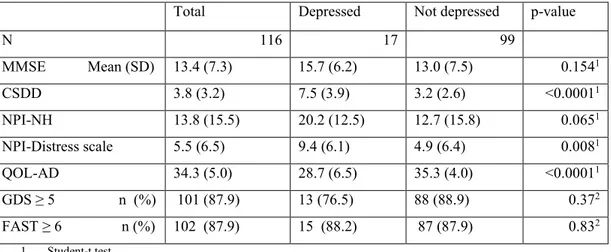
La dépression compliquant la démence est un trouble sous-diagnostiqué, ces deux diagnostics étant étroitement liés. Cette étude transversale a évalué la prévalence de la dépression chez les patients en centre d’hébergement souffrant de démence, et la sensibilité de la détection de ce trouble par les équipes traitantes en première ligne. Le profil clinique était obtenu à l’aide de l’échelle de la dépression dans la démence de Cornell, l’inventaire neuropsychiatrique, une entrevue clinique structurée pour le DSM-IV, l’échelle de la qualité de vie dans la maladie d’Alzheimer et l’examen de Folstein. Parmi les 116 sujets de l’étude, 17 cas de dépression furent identifiés, dont 7 détectés par l’équipe traitante. Les sujets déprimés avaient une qualité de vie inférieure, et leurs soignants plus de détresse. Ainsi, la dépression compliquant la démence chez les patients en centre d’hébergement demeure un trouble peu diagnostiqué, à l’impact négatif sur la qualité de vie des patients.
v
Abstract
Depression is an underdiagnosed complication of dementia, both disorders sharing some manifestations. The aim of this cross-sectional observational study was to examine the prevalence of depression among nursing home residents suffering from dementia, and to evaluate the sensitivity of detection of this disorder by the primary care team. Clinical profiles were assessed using the Cornell Scale for Depression in Dementia, the Structured Clinical Interview for DSM-IV, the Neuropsychiatric Inventory, the Quality of life in Alzheimer’s Disease Scale and the Mini Mental State Examination. Among 116 residents from 10 nursing homes, 17 cases of depression were diagnosed, from which only 7 had been detected by the clinical staff. Depression cases had a significantly poorer quality of life and a worse score on the NPI-NH distress scale. Overall, this study reveals that depressive syndromes are under-diagnosed in nursing homes residents and have a negative impact on quality of life of patients
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des abréviations ... xi
Avant-propos ... xiii
Introduction ... 1
Chapitre 1 ... 3
1. État des connaissances ... 4
1.1 La démence ... 4
1.2 Troubles neuropsychiatriques compliquant la démence ... 9
1.3 Dépression et démence en centre d’hébergement ... 18
1.4 Commentaires sur l’état des connaissances ... 20
2. Objectifs et hypothèses ... 22
2.1 Objectifs principaux ... 22
2.2 Objectifs secondaires ... 22
2.3 Hypothèses ... 22
3. Pertinence du projet ... 24
Chapitre 2 : Étude réalisée ... 25
1. Outils de mesures utilisés ... 27
2. Article prévu pour le Canadian Journal of Psychiatry ... 30
Conclusion ... 49
Bibliographie ... 59
Annexes ... 71
Annexe 1 : Centres d’hébergement inclus dans l’étude et nombre de lits ... 72
Annexe 2 : Échelles de mesure utilisées ... 73
Annexe 3 : Formulaire de consentement utilisé ... 105
Annexe 4 : Répartition des antidépresseurs et antipsychotiques utilisés (N=116) et effet d’un diagnostic de dépression sur l’utilisation des psychotropes ... 109
Annexe 5 : Profil neuropsychiatrique de l’échantillon et impact de la médication sur le profil neuropsychiatrique ... 110
ix
Liste des tableaux
Tableau 1 : Critères diagnostiques d’un épisode dépressif majeur, et
critères diagnostiques provisoires de la dépression compliquant la
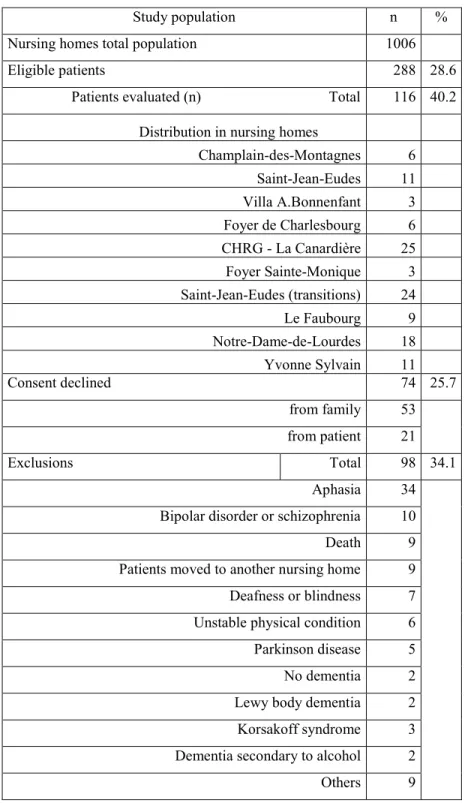
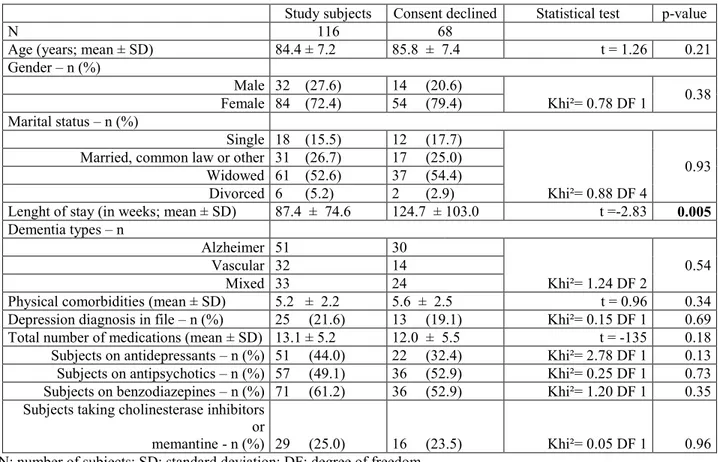
maladie d’Alzheimer…..………..……….14 Tableau 2 : Study population, nursing homes and flow of subjects...36 Tableau 3 : Demographic and clinical profiles of study subjects and subjects
who declined consent...38 Tableau 4: Depressive syndromes detected by the study team, and detection
rate of the primary care team……… ..……..39 Tableau 5 : Study scales scores according to depression status as detected
xi
Liste des abréviations
ADDTC : Alzheimer Disease Diagnostic and Treatment Centers
APOE : Apolipoprotéine ε
ßAPP : Protéine précurseure de la ß-Amyloïde
CHSLD: Centre d’hébergement et de soins de longue durée
DSM-IV-TR : Diagnostic and Statistical manual of Mental Disorders, Fourth Edition, Text Revision
ES: Effect Size (taille d’effet)
FAST : Functional assessment staging
GDS : Global deterioration scale
IChE (ChEI): Inhibiteur de la cholinesterase (Cholinesterase inhibitor)
IMAO: Inhibiteur de la monoamine oxydase
MDS-RAI 2.0: Minimum Data Set, Resident Assessment Instrument
NINDS-AIREN : National Institute of Neurological Disorders and Stroke – Association Internationale pour la recherche et l’enseignement en neurosciences NPI-NH: Neuropsychiatric Inventory, Nursing Home version
QOL-AD: Quality of Life in Alzheimer’s Disease
SCPD: Symptômes comportementaux et psychologiques compliquant la
xiii
Avant-propos
Ce mémoire de maîtrise est le fruit du travail d’une équipe de recherche, dans laquelle Jean-François Côté a été le chercheur et l’auteur principal. Il a complété la revue de la littérature et rédigé le protocole qui fut ensuite corrigé par l’équipe de direction de recherche. Il a rencontré les équipes de soins en centres d’hébergement pour obtenir leur accord à une participation à l’étude et a obtenu tous les consentements auprès des sujets et de leur famille. Il a, par la suite, participé à la collecte des données (révision de dossiers et entrevues), et procédé aux analyses statistiques et à la rédaction de l’article et du mémoire, qui furent corrigés et bonifiés par l’équipe de direction.
L’équipe de direction était composée de Carol Hudon, PhD (neuropsychologue, Centre de recherche de l’Institut universitaire en santé mentale de Québec, Québec) comme directeur, et des co-directeurs suivants : François Rousseau, MD (gérontopsychiatre, Institut universitaire en santé mentale de Québec, Québec), Nadine Gagnon, MD (gérontopsychiatre, Institut universitaire en santé mentale de Québec, Québec) et Alexandre Bureau, PhD (biostatisticien, Centre de recherche de l’Institut universitaire en santé mentale de Québec, Québec). Tous ont contribué au processus d’élaboration du protocole, à la lecture critique de la revue de littérature, du protocole et de l’article et ont participé aux rencontres de supervision de l’étudiant en cours de processus.
L’équipe était complétée de collaboratrices qui ont participé à l’évaluation des sujets, la collecte de données et la révision des dossiers, sans être impliquées toutefois dans la rédaction de ce document: Catherine Touchette, MD (gérontopsychiatre, Hôpital de l’Enfant-Jésus, Québec), Julie McNicoll, MD (gérontopsychiatre, Hôtel-Dieu-de-Lévis, Lévis), Mylène Fillion, MD (pédopsychiatre, Centre de Pédopsychiatrie de Québec, Québec) et Johanne Duguay, BSc (infirmière, Institut universitaire en santé mentale de Québec, Québec). Au moment de l’étude, Dre Touchette, Dre McNicoll et Dre Fillion étaient médecins-résidents en psychiatrie.
L’article inséré dans le mémoire n’a pas encore été soumis pour publication, mais une soumission à la Revue canadienne de psychiatrie est envisagée.
1
La gérontopsychiatrie du XXIe siècle se fera de plus en plus dans la communauté. La diminution du nombre de lits disponibles en centre hospitalier et l’intensification des soins en première ligne font en sorte que les centres d’hébergement sont en voie de devenir les nouveaux hôpitaux psychiatriques pour personnes âgées. C’est dans ce contexte qu’est en cours un processus d’organisation des services de consultation-liaison en gérontopsychiatrie pour les centres d’hébergement de la ville de Québecdesservis par l’Institut universitaire de santé mentale de Québec. Ce processus propose l’instauration d’un guichet unique d’accès aux services interdisciplinaires.
Plusieurs des résidents des centres d’hébergement sont atteints d’un trouble psychiatrique, les plus fréquents étant la démence et la dépression (Streim, 2005), qui sont comorbides chez 15 à 25% des patients (Peskind, 2003), alors que la prévalence de la dépression chez les patients atteints de la maladie d’Alzheimer varie de 20 à 50% (Zubenko et al., 2003). Or, il est fréquent (jusqu’à 65% des cas) que le diagnostic de dépression ne soit pas détecté chez le sujet atteint de démence, ce qui peut provoquer une atteinte fonctionnelle plus importante (Kales et al., 2005) et être à l’origine d’un traitement inadéquat. Il importe de souligner qu’un groupe d’experts a proposé des critères spécifiques au diagnostic de dépression dans la maladie d’Alzheimer (Olin et al., 2002), mais ceux-ci ne font pas encore consensus (Vilalta-Franch et al., 2006; Verkaik et al, 2009).
L’étude réalisée dans ce mémoire s’inscrit dans un processus exploratoire pour l’optimisation du soutien à la première ligne en santé mentale gériatrique. Elle avait comme objectif principal d’évaluer la prévalence de la dépression chez le sujet atteint de démence vivant en centre d’hébergement, ainsi que la capacité de la première ligne à dépister ce trouble. En plus de donner un état de la situation actuelle chez une population peu étudiée jusqu’à maintenant, cette étude visait aussi à sensibiliser les cliniciens à l’importance du dépistage et du traitement de la dépression associée à la démence, pour améliorer ultimement le fonctionnement et la qualité de vie des individus atteints.
3
1. État des connaissances
Pour bien comprendre la problématique du trouble dépressif majeur compliquant la démence, il est nécessaire de s’intéresser à la démence en général, et plus particulièrement à la démence de type Alzheimer, à la démence vasculaire et à la démence mixte qui sont l’objet de la présente étude. Il importe aussi d’élaborer sur les troubles psychiatriques compliquant les divers types de démence, en mettant l’accent sur le trouble dépressif majeur. Finalement, des considérations concernant les connaissances sur la situation des patients vivant en centre d’hébergement seront présentées.
1.1 La démence
Le terme démence est un terme général s’appliquant à de nombreuses maladies avec des physiopathologies différentes, mais dont la voie d’expression commune est la présence de troubles cognitifs. Au Canada, en 2010, plus de 500 000 personnes étaient atteintes de démence et plus de 110 000 nouveaux cas ont été répertoriés (Société Alzheimer du Canada, 2011; Étude canadienne sur la santé et le vieillissement, 2007). Selon le DSM-IV-TR, le diagnostic de démence implique la présence d’une atteinte de la mémoire épisodique (capacité d’apprendre de nouvelles informations ou capacité de rappeler des informations déjà apprises), ainsi qu’une atteinte d’au moins un autre domaine cognitif. L’atteinte de ces autres domaines peut concerner le langage (par ex. aphasie), la représentation mentale des gestes moteurs (apraxie), la reconnaissance des objets (agnosie), l’orientation (conscience de soi en relation avec son environnement et les autres), l’attention (sélective, partagée, soutenue) ou les fonctions exécutives (flexibilité mentale, génération de stratégies, inhibition, abstraction, planification, organisation) (APA, 2000). Devant un tableau de démence, le diagnostic différentiel doit se faire, en particulier, entre une démence de type Alzheimer, une démence vasculaire ou mixte, la démence à corps de Lewy, les démences sous-corticales, la démence frontotemporale, le delirium, les troubles cognitifs secondaires à l’alcool (syndrome de Wernicke-Korsakoff), une condition médicale (comme par exemple l’hypothyroïdie, le diabète de type 2, l’hydrocéphalie à pression normale), ou encore des maladies psychiatriques (trouble bipolaire, schizophrénie, trouble dépressif). Les démences ont, en général, une évolution chronique et sont sans traitement curatif. Les parties qui suivent s’attarderont à la 5
5 démence de type Alzheimer, la démence vasculaire et la démence mixte, qui sont les formes les plus fréquentes et qui se voient souvent compliquées par un état dépressif.
1.1.1 Démence de type Alzheimer
a) Épidémiologie
La démence de type Alzheimer est la plus fréquente des démences, expliquant 50 à 60% des cas1 (Chertkow, 2008; Étude canadienne sur la santé et le vieillissement, 2007; Feldman et al., 2008). L’âge en est le principal facteur de risque. Son incidence double approximativement à tous les cinq ans à partir de 65 ans, ce qui donne des prévalences de 5% chez les 65 ans et plus, 25% chez les 80 ans et plus et 50% chez les 95 ans et plus (Helmer et al., 2006; Morris et al., 2006; Olin et al., 2002). Au Canada, en 2010, plus de 300 000 personnes étaient atteintes de ce type de démence (Societe Alzheimer du Canada, 2011). La survie médiane est de 4,2 années pour les hommes et 5,7 années pour les femmes (Morris et al., 2006), après que le diagnostic ait été établi.
b) Critères diagnostiques et présentation clinique
La démence de type Alzheimer a un début insidieux et une évolution progressive et chronique. L’atteinte de la mémoire épisodique est la plupart du temps le premier des symptômes (Spar & La Rue, 2006). Sur le plan international, dans une perspective de recherche, les critères de la démence de type Alzheimer ont été révisés et permettent notamment de qualifier le diagnostic de probable ou possible (McKhann et al., 2011). Pour poser un diagnostic de démence de type Alzheimer probable, en plus de répondre aux critères généraux de démence, il est requis que le début ait été insidieux et qu’il y ait eu une détérioration nette des fonctions cognitives. La présentation peut être amnésique ou non amnésique (langagière, visuospatiale ou exécutive). De plus, le niveau de certitude d’un diagnostic de démence de type Alzheimer peut être considéré plus élevé s’il y a présence d’un déclin cognitif lors d’évaluations cognitives subséquentes, si le patient est connu porteur d’une mutation génétique causant la maladie d’Alzheimer, ou s’il y a des marqueurs
1 Les prévalences peuvent varier selon la population étudiée, l’âge des sujets de l’échantillon, l’utilisation ou non de biomarqueurs et l’inclusion des cas présentant une pathologie mixte ou non.
biologiques de la pathophysiologie de la maladie d’Alzheimer (dosage d’amyloïde B42 et de protéine tau dans le liquide céphalorachidien, ou imagerie fonctionnelle démontrant une accumulation d’amyloïde dans le cerveau ou une diminution du métabolisme dans les lobes temporaux et pariétaux.)
Néanmoins, le diagnostic définitif de la maladie d’Alzheimer ne peut se faire qu’en histopathologie et repose sur la présence de plaques séniles (dépôts extracellulaires de substance β-amyloïde) et d’écheveaux neurofibrillaires (filaments cytosquelettiques intracellulaires anormaux en raison de la phosphorylation de la protéine Tau) (St George-Hyslop, 2000). Le dépistage peut se faire à l’aide de l’examen de l’état mental de Folstein (Folstein et al., 1975), mais une évaluation neuropsychologique exhaustive est souvent utile pour identifier la nature et la sévérité des déficits cognitifs (Feldman et al., 2008)
À ce jour, le diagnostic de démence de type Alzheimer demeure clinique. Les examens de laboratoire recommandés servent surtout à éliminer des causes de démences secondaires (formule sanguine, bilan ionique, glycémie, bilan lipidique, fonction thyroïdienne, bilan hépatique, dosage de la vitamine B12 et des folates, dépistage du VIH et de la syphilis, électrocardiogramme, radiographie pulmonaire, et pour certains patients, imagerie cérébrale et ponction lombaire) (Feldman et al., 2008).
c) Génétique et physiopathologie
La génétique peut être impliquée dans la survenue de la maladie d’ Alzheimer (St George-Hyslop, 2000). Les parents du premier degré d’un sujet en étant atteint ont 38% de risque d’en souffrir eux aussi (St George-Hyslop, 2000). Pour 2 à 10% des cas, la transmission se fait selon un mode autosomal dominant, et la maladie est alors habituellement plus précoce (St George-Hyslop et al., 1990; St George-Hyslop, 2000; Tandon et al., 2000). Trois gènes seraient impliqués dans ces cas : le gène de la protéine précurseuse de β-amyloïde (βAPP) sur le chromosome 21, le gène préséniline 1 sur le chromosome 14 et le gène préséniline 2 sur le chromosome 1.
Pour sa part, le gène de l’apolipoprotéine ε (APOE) augmente le risque de maladie d’Alzheimer à début tardif, en fonction d’autres déterminants génétiques et environnementaux (St George-Hyslop, 2000). L’allèle E2 serait protecteur, E3 serait neutre
7 et E4 augmenterait le risque (1 allèle augmente le risque de 2,5 fois et 2 allèles de 12 à 15 fois) (Spar & La Rue, 2006).
Au niveau de la neuropathologie, les plaques séniles et les faisceaux neurofibrillaires entraînent une dégénérescence granulo-vacuolaire, d’abord au niveau de l’hippocampe (lobe temporal), puis aux niveaux frontaux et pariétaux (Sadock & Sadock, 2005; Spar & La Rue, 2006; St George-Hyslop, 2000). Il y a perte des neurones cholinergiques du noyau basal de Meynert, en plus des neurones sérotoninergiques du raphé et noradrénergiques du locus
coeruleus (Spar & La Rue, 2006).
d) Traitement
Il n’existe pas de traitement curatif pour la maladie d’Alzheimer. Par contre, certains traitements existent afin de ralentir la progression symptomatique de la maladie. Pour les cas de démence de degré léger à modéré, les inhibiteurs de la cholinestérase sont recommandés (donepezil, rivastigmine et galantamine), mais leurs bénéfices sont modestes, permettant de décaler la progression de la maladie d’environ un an chez certains patients (Courtney et al., 2004; Doody et al., 2001), alors que d’autres n’en bénéficient pas. Pour les patients atteints de la démence Alzheimer de degré modéré à grave, le traitement recommandé est la mémantine (Herrmann & Gauthier, 2008; Morris et al., 2006; Smith et al., 2006).
Certaines mesures non pharmacologiques, comme l’exercice physique, l’entraînement cognitif (taille de l’effet de 0,47 selon une méta-analyse) (Sitzer et al., 2006), la thérapie de réminiscence (Pittiglio, 2000) et la formation des aidants à l’accompagnement de personnes souffrant de démence peuvent aussi aider à améliorer le statut fonctionnel des patients (Doody et al., 2001; Teri et al., 2003). Une approche thérapeutique multifactorielle est donc souhaitable.
1.1.2 Démence vasculaire
a) Épidémiologie
La démence vasculaire explique environ 5 à 10% des cas de démence (Gorelick et al., 2011; Morris et al., 2006). La prévalence de ce type de démence doublerait elle aussi à tous les cinq
ans ; elle est de 2,2% chez les individus de 70 ans et plus, et de 16,3% chez les 80 ans et plus (Spar & La Rue, 2006).
b) Diagnostic
En plus d’inclure comme critères diagnostiques l’atteinte de la mémoire et d’au moins un autre domaine cognitif, le DSM-IV-TR ajoute comme caractéristiques essentielles la présence de signes et symptômes neurologiques focaux et des preuves de maladie vasculaire cérébrale pour poser le diagnostic de démence vasculaire (APA, 2000). Entre autres, l’imagerie cérébrale pour cette maladie permet de mettre en évidence des accidents vasculaires cérébraux, des lacunes et des hyperintensités de la matière blanche.
D’autres critères existent afin d’évaluer la présence de démence vasculaire, chaque algorithme donnant par contre une prévalence différente de cette démence (Chui et al., 2000). Parmi ces propositions de critères se retrouvent ceux de la National Institute of Neurological
Disorders and Stroke – Association Internationale pour la Recherche et l'Enseignement en Neurosciences (NINDS-AIREN), ceux de l’Alzheimer Disease Diagnostic and Treatment Centers (ADDTC) et la cotation de l’échelle modifiée d’Hachinski. Cette dernière échelle
attribue 1 ou 2 points aux éléments suivants : début soudain (2), détérioration en paliers (1), plaintes somatiques (1), incontinence émotionnelle (1), hypertension artérielle (1), accidents vasculaires cérébraux (2), signes (2) et symptômes (2) neurologiques focaux. Un score de 4 et moins suggère une démence de type Alzheimer alors qu’en score de 7 ou plus suggère une démence vasculaire. Un score intermédiaire suggère une démence mixte (Rosen et al., 1980).
c) Physiopathologie
La démence vasculaire est causée par l’accumulation de lésions vasculaires cérébrales, que ce soient des infarctus, des lacunes, de la sclérose ou des lésions de la matière blanche. Ces lésions peuvent être occasionnées par un événement thrombotique ou par un événement embolique. Que ces lésions soient symptomatiques ou non, elles peuvent contribuer à l’apparition d’une démence (Gorelick et al., 2011; Spar & La Rue, 2006).
9
d) Traitement
Le traitement de la démence vasculaire est d’abord la correction des facteurs de risques vasculaires : exercice physique et saines habitudes de vie, traitement de l’hypertension artérielle, du diabète et de la dyslipidémie, et anticoagulothérapie en cas de fibrillation auriculaire. Les troubles cognitifs peuvent être améliorés par l’utilisation d’inhibiteurs de la cholinestérase, même lorsqu’il ne s’agit pas d’un tableau de démence mixte (Gorelick et al., 2011; Morris et al., 2006).
1.1.3 Démence mixte
La démence mixte consiste en la présence, chez un même individu, des processus physiopathologiques à la fois de la démence de type Alzheimer et de la démence vasculaire. Certains auteurs la définissent ainsi : « Déclin cognitif suffisant pour entraîner une atteinte du fonctionnement indépendant résultant de la coexistence des pathologies de la maladie d’Alzheimer et de la maladie vasculaire cérébrale, documentée par des critères cliniques ou l’imagerie» (Langa et al., 2004). De 25 à 45% des cas de maladie d’Alzheimer présentent aussi des lésions vasculaires telles que documentées à l’évaluation neuropathologique, et presque tous les cas de démence vasculaire présentent des plaques séniles et des écheveaux neurofibrillaires (Spar & La Rue, 2006). Le traitement peut impliquer à la fois les inhibiteurs de la cholinestérase et/ou la mémantine, en plus d’un contrôle optimal des facteurs de risque de maladie vasculaire (Langa et al., 2004).
1.2 Troubles neuropsychiatriques compliquant la démence
Des symptômes neuropsychiatriques, tant psychologiques que comportementaux, compliquent la démence dans plus de 90% des cas (International Psychogeriatric Association, 2010; Lyketsos et al., 2003; Lyketsos & Olin, 2002). Ces symptômes incluent, par exemple, la psychose, l’anxiété, la dépression, l’agitation ou l’errance (Landerville et al., 2005). Lorsqu’ils surviennent, ils compliquent l’état du patient, nuisent à sa qualité de vie, précipitent son placement en établissement de soins de longue durée et détériorent sa relation avec ses proches (Lyketsos & Lee, 2004). Ces tableaux complexes, variables et évolutifs nécessitent une prise en charge adaptée, individualisée, souple et multidimensionnelle (pharmacologique, non pharmacologique, systémique, environnementale, etc.)
Les approches non pharmacologiques ou psychosociales du traitement des symptômes comportementaux et psychologiques compliquant la démence (SCPD) s’inscrivent dans trois paradigmes psychologiques pour expliquer le changement de comportement : 1) l’apprentissage (renforcement d’un comportement quand les soignants donnent de l’attention au patient); 2) les besoins insatisfaits (les comportements inappropriés surviennent quand un besoin du patient n’est pas satisfait par les soignants); et 3) le seuil de stress (la démence réduit la capacité d’un individu à tolérer le stress, entraînant des comportements inappropriés) (O'Connor et al., 2009a). Ces approches sont une composante incontournable du traitement des SCPD. Les interventions peuvent se répartir en différentes catégories (Cohen-Mansfield, 2001) : interventions sensorielles (musique, massage, bruit blanc, stimulation sensorielle), contacts sociaux (interaction un-à-un, zoothérapie, présence simulée), thérapie comportementale (thérapie cognitive, renforcement, gestion des stimuli), entraînement du personnel, activités (extérieures, physiques), interventions environnementales (zone d’errance, environnement naturel ou environnement à faibles stimuli), interventions médicales (luminothérapie, gestion de la douleur, aide auditive et retrait des contentions). Ces interventions ne doivent pas être vues comme applicables à tous les SCPD, mais sont en général plutôt ciblées pour un comportement particulier, à un moment particulier.
Les études portant sur les traitements psychosociaux des SCPD, bien que multiples, sont en général petites, mal conçues et mal rapportées (Cohen-Mansfield, 2001; Livingston et al., 2005). Dans une revue systématique de la littérature portant sur les approches psychosociales du traitement des troubles du comportement chez des sujets atteints de démence (agitation, agression, désinhibition), O’Connor et al. ont identifié 25 études répondant à leurs critères de qualité (patients avec démence et troubles du comportement, comparaison avec un autre traitement, randomisation, 10 participants ou plus, mesures cognitives et comportementales, analyses statistiques et bonne fiabilité inter-juges). De ces 25 études, 11 ont démontré que l’intervention évaluée avait un effet supérieur à la condition contrôle. Les traitements avec taille d’effet modérée ou importante incluaient : l’aromathérapie (taille d’effet (ES) = 0,71), l’éducation de soignants centrée sur les habiletés (ES = 0,62), les bains au lit (ES = 1,15) et la musique (ES = 1,19) (O'Connor et al., 2009a). Le même groupe a aussi fait une revue systématique de la littérature portant sur les approches psychosociales du traitement des symptômes psychologiques de la démence (anxiété, dépression, retrait, apathie, irritabilité,
11 délire et hallucinations). Des 12 études identifiées remplissant leurs critères d’inclusion, six ont démontré une efficacité supérieure à la condition de contrôle pour atténuer les symptômes psychologiques. Les interventions avec une taille d’effet modérée étaient la musique (ES = 0,75) et la thérapie récréationnelle (ES = 0,54) (O'Connor et al., 2009b).
D’autres revues de littérature arrivent à des conclusions essentiellement similaires, malgré quelques variations dans les résultats rapportés attribuables à des critères d’inclusion différents (Ayalon et al., 2006; Kong et al., 2009; Livingston et al., 2005). En général, les thérapies comportementales et l’éducation des soignants donnent des résultats durables, alors que d’autres interventions, notamment la musique, ont des effets bénéfiques momentanés mais qui ne durent pas au-delà de la période de traitement. L’activité physique et la luminothérapie ont également montré un potentiel thérapeutique intéressant.
Sur le plan pharmacologique, il est important d’ajuster le traitement pour stabiliser les symptômes prédominants. Les antipsychotiques atypiques (olanzapine, quetiapine, risperidone) ont une utilisation répandue dans le traitement des symptômes neuropsychiatriques de la démence (Edell & Tunis, 2001; Fujikawa et al., 2004; Herrmann & Lanctot, 2007; Sink et al., 2005; Sutor, 2002), et plus particulièrement pour les symptômes psychotiques, l’agitation et l’agressivité. La Société américaine de gériatrie et l’Association américaine de psychiatrie gériatrique, dans leurs lignes directrices, recommandent d’ailleurs les antipsychotiques atypiques comme traitement de première intention des troubles comportementaux compliquant la démence (American Geriatric Society and American Association for Geriatric Psychiatry, 2003). Cependant, une étude récente incluant 421 patients et comparant ces trois antipsychotiques au placebo chez des sujets atteints de démence et de symptômes comportementaux n’a pu démontrer de différence significative entre les traitements actifs et le placebo pour ces problématiques. De fait, les effets secondaires de ces médicaments dépassaient les effets bénéfiques (Schneider et al., 2006). Cependant, face à des tableaux d’agitation importante et de dangerosité (pour le patient ou les autres), lorsqu’un patient ne répond pas aux approches non pharmacologiques le recours aux antipsychotiques est souvent inévitable (Haw et al., 2008). Il faut cependant transmettre à la famille les raisons en justifiant l’emploi et les risques associés (Salzman et al., 2008). Il sera important par la suite de tenter de retirer l’antipsychotique après 3 mois de stabilité. Par
ailleurs, les inhibiteurs de la cholinestérase peuvent eux aussi améliorer ces symptômes (Cummings et al., 2006), tout comme la mémantine (Bullock, 2006; Smith et al., 2006).
Les sections qui suivent s’attarderont spécifiquement au trouble dépressif compliquant la démence, le désordre psychologique le plus fréquent chez cette population et étant l’objet de cette recherche.
1.2.1 Trouble dépressif majeur compliquant la démence
a) Épidémiologie
Jusqu’à 50% des patients atteints de démence présenteront à un moment de leur évolution des symptômes dépressifs, dont 20-25% de dépression majeure (Burns et al., 1990; Landerville et al., 2005; Lyketsos & Lee, 2004; Lyketsos & Olin, 2002; Sadock & Sadock, 2005; Tatsch et al., 2006). L’incidence de la dépression chez cette clientèle serait de 6% à un an selon certains auteurs (Lyketsos et al., 2003). Chez les sujets atteints de démence grave, la prévalence peut atteindre 50% (Zubenko et al., 2003). La dépression est plus fréquente en association avec la démence de type vasculaire que dans la maladie d’Alzheimer, alors que cette dernière est plus souvent associée à des symptômes psychotiques (International Psychogeriatric Association, 2010; Lyketsos et al., 2000b). Une étude comparative a décelé une prévalence de 8% de dépression dans la démence d’Alzheimer, et de 19% dans la démence vasculaire (Ballard et al., 2000). Une autre étude rapporte que la dépression est 4,4 fois plus fréquente dans la démence vasculaire (Hargrave et al., 2000). Toutes ces données concernant la dépression compliquant la démence mises ensemble suggèrent qu’il s’agit d’un des troubles psychiatriques les plus fréquents chez le sujet âgé.
b) Critères diagnostiques et présentation clinique
La dépression survenant chez une personne âgée non démente, bien que partageant les mêmes critères diagnostiques (Tableau 1), présente certaines particularités la distinguant de la dépression chez les individus adultes, ce qui la rend plus difficile à détecter. La cohorte actuelle de personnes âgées est moins portée à rapporter des symptômes affectifs, parfois camouflés en des plaintes somatiques. L’atteinte de l’estime et la culpabilité sont moins fréquentes, tandis que les caractéristiques mélancoliques et psychotiques peuvent l’être davantage (Conn et al., 2006). Les patients présentant une dépression à début tardif, i.e. un
13 premier épisode dépressif après 60 ans, ont moins d’antécédents familiaux de dépression, et la résonance magnétique cérébrale a plus de chance de démontrer de l’atrophie sous-corticale (élargissement des ventricules latéraux) et des anomalies de la substance blanche (Alexopoulos et al., 1999). La dépression à début tardif surviendra fréquemment dans le contexte d’une autre maladie physique (accident vasculaire cérébral, maladie de Parkinson, maladie d’Alzheimer, cancer, infarctus du myocarde, etc.) (Mulsant & Ganguli, 1999). De plus, chez la personne âgée, il n’est pas rare que la dépression ne se manifeste qu’avec peu de symptômes, mais avec néanmoins un impact fonctionnel bien réel (Blazer, 2003).
Lorsque la dépression survient chez un sujet atteint de démence, le défi diagnostique est grand. En fait, seulement 35% des patients ayant le double diagnostic seraient adéquatement diagnostiqués et traités (Cohen et al., 2003; Kales et al., 2005). Divers facteurs contribuent à cet état de fait. D’abord, certains symptômes se chevauchent : perte d’intérêt, trouble de la concentration, ralentissement psychomoteur, fragmentation du sommeil et modification des habitudes alimentaires (Landreville et al., 2005). Il arrive donc que des symptômes dépressifs soient associés aux manifestations primaires de la démence, entraînant une détection sous-optimale du diagnostic de la dépression. De plus, avec la progression de la démence, les atteintes du langage peuvent venir compromettre la capacité du sujet à exprimer sa détresse, ses changements d’humeur, ou ses pensées négatives (culpabilité, désespoir, désir de mort) (Conn et al., 2006; Olin et al., 2002). Par ailleurs, il faut se méfier, en tant que clinicien, de l’âgisme qui pourrait inciter à banaliser la présence de symptômes dépressifs chez un sujet âgé présentant des atteintes cognitives.
Bien que certains auteurs soutiennent que les critères standards de dépressions majeure et mineure, tels que décrits dans le DSM, conviennent au diagnostic de la dépression compliquant la démence (chez 670 patients avec maladie d’Alzheimer, 26% de cas de dépression majeure ont été identifiés) (Starkstein et al., 2005), une équipe d’experts a développé des critères diagnostiques de la dépression compliquant la maladie d’Alzheimer (Olin et al., 2002) afin d’aider la recherche sur la comorbidité entre la maladie d’Alzheimer et la dépression ainsi que sur son traitement. Ces critères demandent la présence de 3 symptômes plutôt que 5 pour poser le diagnostic de dépression, parlent de diminution des affects positifs liés aux contacts sociaux plutôt que d’anhédonie (qui se distingue moins bien
de l’apathie pouvant se voir dans la démence sans dépression), ajoutent le retrait social et l’irritabilité (car fréquemment rencontrés chez les individus souffrant de démence et de dépression) et enlèvent les troubles de concentration (car s’expliquent par la démence même en l’absence de dépression). Le Tableau 1 présente les critères diagnostiques du DSM-IV et ceux proposés par Olin et ses collaborateurs.
Il va sans dire que la variabilité des critères diagnostiques entraîne une variabilité de la prévalence estimée pour ce trouble. Une étude transversale observationnelle a d’ailleurs illustré ceci en évaluant la prévalence de la dépression chez 491 sujets avec maladie d’Alzheimer probable, en utilisant cinq échelles : ICD-10 (4,9%), Cambridge Examination
for Mental Disorder (9,8%), DSM-IV (13,4%), critères provisoires d’Olin et al. (27,4%) et
Inventaire neuropsychiatrique (NPI; 43,7%) (Vilalta-Franch et al., 2006).
c) Physiopathologie de la dépression compliquant la démence
L’association du trouble dépressif et des troubles cognitifs peut se faire de façon bidirectionnelle. Certains sujets âgés peuvent avoir un premier épisode dépressif, lequel s’accompagne de troubles cognitifs qui parfois évolueront vers une démence, alors que d’autres ne développeront les symptômes dépressifs qu’après la survenue des troubles cognitifs.
Le syndrome dans lequel les symptômes cognitifs apparaissent lors de l’épisode dépressif se nomme «pseudo-démence dépressive». Les symptômes cognitifs touchent alors principalement les habiletés visuo-spatiales, les fonctions exécutives, et la vitesse de traitement de l’information (O'Brien, 2005). Comparativement aux patients ayant une maladie d’Alzheimer, ces patients ont tendance à répondre par «Je ne sais pas» lorsque leur cognition est évaluée, à exagérer leurs déficits et à présenter des performances inégales aux tests cognitifs (Spar & La Rue, 2006). Bien que ce trouble soit considéré comme une démence réversible, plus de 70% des patients présentant un épisode de pseudo-démence évolueront dans les années suivantes vers une démence (Saez-Fonseca et al., 2007). Ainsi, le terme «pseudo-démence dépressive» est de plus en plus critiqué et tend à disparaître du vocabulaire des cliniciens (O'Brien, 2005).
15
Tableau 1. Critères diagnostiques d’un épisode dépressif majeur et critères provisoires de
la dépression compliquant la maladie d’Alzheimer
Critères diagnostiques d’un épisode dépressif majeur (APA, 2000)
A. Au moins 5 des symptômes suivants doivent avoir été présents pendant une même période de deux semaines et avoir présenté un changement par rapport au fonctionnement antérieur; au moins un des symptômes est soit (1) une humeur dépressive, soit (2) une perte d’intérêt ou de plaisir.
(1) Humeur dépressive présente pratiquement toute la journée, presque tous les jours, signalée par le sujet ou observée par les autres.
(2) Diminution marquée de l’intérêt ou du plaisir pour toutes ou presque toutes les activités pratiquement toute la journée, presque tous les jours.
(3) Perte ou gain de poids significatif en l’absence de régime, ou diminution ou augmentation de l’appétit presque tous les jours.
(4) Insomnie ou hypersomnie presque tous les jours.
(5) Agitation ou ralentissement psychomoteur presque tous les jours.
(6) Fatigue ou perte d’énergie presque tous les jours.
(7) Sentiment de dévalorisation ou culpabilité excessive ou inappropriée presque tous les jours.
(8) Diminution de l’aptitude à penser ou à se concentrer ou indécision presque tous les jours. (9) Pensées de mort récurrentes, idées suicidaires récurrentes sans plan précis ou tentative de suicide ou plan précis pour se suicider.
B. Les symptômes ne répondent pas au critère d’épisode mixte.
C. Les symptômes induisent une souffrance cliniquement significative ou une altération du fonctionnement social, professionnel ou dans d’autres domaines importants.
D. Les symptômes ne sont pas imputables aux effets physiologiques directs d’une substance ou d’une affection médicale générale.
E. Les symptômes ne sont pas mieux expliqués par un deuil.
Critères diagnostics provisoires de la dépression compliquant la maladie d’Alzheimer (Olin et al., 2002) A. Trois ou plus des critères suivants ont été présents pendant la même période de 2 semaines et représentent un changement du fonctionnement antérieur. Au moins 1 des symptômes est soit : 1) humeur dépressive ou 2) perte de plaisir ou d’affect positif. Note : Ne pas inclure les symptômes qui selon le jugement clinique, sont clairement dus à une affection médicale autre que la maladie d’Alzheimer, ou sont des résultats directs de symptômes démentiels non associés à l’humeur (p.ex., perte de poids à cause d’une incapacité à manger).
(1) Humeur dépressive cliniquement significative (déprimé, triste, désespéré, découragé, larmoyant) (2) Diminution des affects positifs ou du plaisir en réponse aux contacts sociaux et aux activités usuelles (3) Retrait ou isolement social
(4) Perte d’appétit (5) Trouble du sommeil
(6) Changements psychomoteurs (agitation ou ralentissement)
(7) Irritabilité
(8) Fatigue ou perte d’énergie
(9) Sentiments de ne rien valoir, d’être sans espoir, culpabilité excessive ou inappropriée
(10) Pensées récurrentes de mort, idéation, plan ou tentative de suicide
B. Tous les critères sont rencontrés pour le diagnostic de maladie d’Alzheimer.
C. Les symptômes causent une détresse cliniquement suffisante ou dérangent le fonctionnement.
D. Les symptômes ne surviennent pas exclusivement pendant un delirium.
E. Les symptômes ne sont pas dus à l’effet direct d’une substance.
F. Les symptômes ne s’expliquent pas mieux par une dépression majeure, une maladie affective bipolaire, un deuil, une schizophrénie, un trouble schizo-affectif, un trouble psychotique associé à la maladie d’Alzheimer, des troubles anxieux ou troubles associés aux substances.
Une atteinte cognitive significative lors d’un premier épisode dépressif à début tardif doit faire suspecter une démence à venir. Certains auteurs soutiennent même que la dépression à début tardif pourrait être un prodrome de la démence (Jean et al., 2005; Mulsant & Ganguli, 1999; Schweitzer et al., 2002; van et al., 1999), en raison de la fréquence plus élevée de troubles cognitifs associés, d’une atrophie cérébrale plus importante et du nombre plus élevé de lésions de la matière blanche. Le fait d’avoir présenté un épisode dépressif majeur dans le passé, même isolé, serait aussi un facteur de risque pour développer plus tard la maladie d’Alzheimer (Andersen et al., 2005; Green et al., 2003; Ownby et al., 2006; Saczynski et al., 2010).
D’un point de vue neurobiologique, la principale hypothèse expliquant l’association entre la dépression et la maladie d’Alzheimer est une perte des neurones produisant la sérotonine dans le raphé dorsal et une perte des neurones produisant la noradrénaline dans le locus
coeruleus, et ce par le même processus physiopathologique entraînant la perte des neurones
cholinergiques du noyau de Meynert (Lyketsos & Lee, 2004). Par ailleurs, l’augmentation du risque de démence, chez les patients ayant antérieurement vécu des épisodes dépressifs, s’expliquerait par une atteinte de l’hippocampe par l’hyperactivation de l’axe hypothalamo-hypophyso-surrénalien lors de la dépression (Lupien et al., 2005; Magri et al., 2006; O'Brien et al., 1996; Peskind, 2003; Rapp et al., 2006).
Il semble que l’introspection du sujet atteint de démence et réalisant qu’il est atteint d’une maladie chronique ne soit pas déterminante dans la survenue de la dépression (Lyketsos & Lee, 2004), mais l’atteinte fonctionnelle l’est (Holtzer et al., 2005). La génétique donne une susceptibilité augmentée, mais les résultats concernant l’apolipoprotéine ε4 sont contradictoires (Lyketsos et al., 2003; Lyketsos & Lee, 2004). Une étude rétrospective de résonance magnétique a démontré que les patients avec dépression et démence avaient plus de lésions périventriculaires et du raphé pontique, mais ces lésions étant fréquentes, leur utilité comme facteur prédictif d’évolution est limitée (Baldwin et al., 2000).
Certains auteurs ont aussi soulevé l’hypothèse que la résistance à l’insuline, entraînant un métabolisme anormal du glucose au niveau cérébral, serait le lien entre la démence et la dépression (Rasgon & Kenna, 2005). D’autres ont noté des anomalies du système gabaergique comme explication aux symptômes dépressifs compliquant la démence
(Garcia-17 Alloza et al., 2006; Lanctot et al., 2007). Une quantité insuffisante du transporteur de la sérotonine au niveau préfrontal a aussi été envisagée comme facteur causal, mais une étude n’a pu démontrer de différence entre les sujets souffrant de la maladie d’Alzheimer et les contrôles (Thomas et al., 2006).
Dans le cas de la démence vasculaire, la forte prévalence de dépression serait associée à l’atteinte de structures sous-corticales (Gorelick et al., 2011). La maladie athérosclérotique affectant la matière blanche (leucoaraïose) ou des lacunes affectant les noyaux gris centraux ont été associés à la survenue de symptômes dépressifs à l’âge avancé, souvent accompagnés d’atteintes exécutives et d’un ralentissement de la vitesse de traitement de l’information.
Lorsque la démence est mixte, il y alors combinaison des physiopathologies menant aux atteintes cognitives, mais également au syndrome dépressif.
d) Conséquences de la comorbidité
La dépression compliquant la démence a un impact négatif pour le patient et ses proches. Les patients ayant le double diagnostic de démence et de dépression ont en général une atteinte fonctionnelle plus importante (perte d’autonomie), sont plus souvent placés en centre d’hébergement de longue durée (Kales et al., 2005; Kopetz et al., 2000) et présentent plus d’agressivité (Datto et al., 2002), entraînant une plus grande dysfonction sociale (Landreville et al., 2005). La dépression est aussi associée à une aggravation des symptômes cognitifs (Kales et al., 2005; Lyketsos & Olin, 2002; Shim & Yang, 2006). En fait, l’humeur serait le principal facteur prédictif de l’évaluation de la qualité de vie faite par le patient (Hoe et al., 2006). Plus la démence est sévère et plus la dépression influence négativement le fonctionnement (Fitz & Teri, 1994).
e) Traitement
La survenue d’un état dépressif comme complication d’un syndrome démentiel est lourde de conséquences pour le patient, ses proches et son environnement (Snowden et al., 2003). Cependant, la dépression compliquant la démence demeure un trouble réversible si un traitement approprié est initié (Conn et al., 2006). Une meilleure détection de la dépression chez le sujet atteint de démence permettrait donc de mettre en place un traitement qui aura
un impact clinique significatif: la résolution de la dépression, en plus de soulager le patient de symptômes pénibles, permet d’améliorer ses problèmes cognitifs, ralentit sa perte d’autonomie fonctionnelle et diminue les symptômes dépressifs rencontrés chez les soignants (Landreville et al., 2005).
Les traitements reconnus de la dépression compliquant la maladie d’Alzheimer incluent la psychothérapie, les antidépresseurs et l’électroconvulsivothérapie. Certains recommandent d’abord, en cas de symptômes dépressifs légers, de traiter avec un inhibiteur de la cholinestérase et du soutien psychothérapeutique, en plus de suivre l’évolution des symptômes (Morris et al., 2006). Parmi les interventions non pharmacologiques, la thérapie cognitivo-comportementale et les activités récréatives sont parmi les plus efficaces (Snowden et al., 2003).
Sur le plan pharmacologique, la première ligne de traitement (Conn et al., 2006; Herrmann & Lanctot, 2007; Morris et al., 2006) est sensiblement la même que dans le traitement de la dépression en général et plusieurs molécules ont été étudiées dans le traitement de la dépression compliquant la démence: inhibiteurs de la recapture de la sérotonine (sertraline (Lyketsos et al., 2000a; Lyketsos et al., 2003; Magai et al., 2000), citalopram (Nyth et al., 1992) , fluoxetine (Taragano et al., 1997), paroxetine (Katona et al., 1998) et escitalopram (Rao et al., 2006)), venlafaxine (Oslin et al., 2003), mirtazapine ou bupropion (Conn et al., 2006; Morris et al., 2006). Les antidépresseurs tricycliques et les inhibiteurs de la mono-amine oxydase (IMAO), bien que pouvant être efficaces, ont plus d’effets secondaires, entre autres de type anticholinergique, lesquels sont néfastes sur le plan cognitif (Borson et al., 2002; Edell & Tunis, 2001; Lyketsos & Olin, 2002; Starkstein et al., 2005; Thorpe & Groulx, 2001).
L’électroconvulsivothérapie doit être envisagée pour la dépression réfractaire au traitement ou très sévère (Rao & Lyketsos, 2000).
1.3 Dépression et démence en centre d’hébergement
Le centre de soins de longue durée est un contexte particulier d’évaluation de la problématique de la dépression compliquant la démence. Les ressources y sont moindres qu’en centre hospitalier et la stabilité des ressources professionnelles est variable. Les
19 résidents qui y arrivent sont généralement jugés stables médicalement, mais peuvent avoir vécu une période d’hébergement de transition de durée variable. Pour eux, il s’agit la plupart du temps du dernier lieu qu’ils habiteront, circonstance pouvant s’accompagner de nombreuses adaptations : séparation du conjoint, départ de la maison, perte de nombreux biens matériels, perte relative de l’intimité et de l’indépendance (Conn et al., 2006).
Les troubles neuropsychiatriques y sont évidemment très fréquents (Streim, 2005). De 60 à 80% des résidents de centre de soins de longue durée souffrent de démence (International Psychogeriatric Association, 2010; Payne et al., 2002). Comme corolaire, au Canada, 50% des patients atteints de démence vivent en centre d’hébergement (Societe Alzheimer du Canada, 2011).
L’enjeu de la dépression y est aussi significatif, notamment en raison du risque augmenté de dépression chez les sujets atteints de troubles cognitifs, mais aussi à cause des différents facteurs de stress accompagnant l’arrivée en centre d’hébergement et de soins de longue durée (CHSLD). La prévalence de la dépression compliquant la démence y varie de 23 à 54% (Kales et al., 2005). Or, le risque de mortalité serait augmenté de 59% chez les patients atteints de dépression comparativement à ceux qui ne le sont pas (Peskind, 2003). Les résidents ne sont par ailleurs pas exempts des autres conséquences de cette comorbidité déjà évoquées.
Il est généralement recommandé de procéder au dépistage de l’état dépressif à l’arrivée en CHSLD, et de façon épisodique par la suite (Conn, 2006; American Geriatric Society, 2003). Lorsque ce n’est pas fait, le diagnostic n’est posé et un traitement mis en place que dans 25 à 35% des cas (Cohen et al., 2003; Kales et al., 2005). Dans les établissements où le diagnostic de la dépression est fait de façon systématique, la prévalence de cette condition diminue pendant la première année (à l’admission 19,9%, à 6 mois 6% et à un an 4,5%), démontrant qu’un diagnostic et un traitement appropriés de la dépression permettent une réduction de cette problématique (Payne et al., 2002). L’utilisation d’outils structurés pour le dépistage de la dépression améliore sa détection (Teresi et al., 2001). Divers outils peuvent être utilisés : Minimum Data Set, Échelle de dépression gériatrique de Yesavage, l’échelle de Cornell de la dépression dans la démence (CSDD) ou l’échelle du Centre des études épidémiologiques de la dépression (CES-D) (Conn et al., 2006; Greenberg et al., 2004).
Actuellement, à Québec, les centres d’hébergement n’utilisent pas de façon systématique, ni même de façon occasionnelle, ces outils de dépistage. Or, la détection systématique de la dépression à l’arrivée en centre d’hébergement améliorerait non seulement le diagnostic, mais également la prise en charge des patients, avec référence à un psychiatre, ajustements pharmacologiques et diminution subséquente des symptômes (Cohen et al., 2003).
Des lignes directrices canadiennes (Conn et al., 2006) et américaines (American Geriatric Society and American Association for Geriatric Psychiatry, 2003) existent concernant le traitement de la dépression compliquant la démence chez les patients en centre d’hébergement. Les interventions non pharmacologiques (thérapie de support, thérapie cognitivo-comportementale individuelle et de groupe, activités récréatives structurées, réminiscence) sont recommandées en premier lieu ou en combinaison à la médication. Le traitement pharmacologique recommandé inclut les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), la venlafaxine, la mirtazapine et le bupropion. L’usage des antidépresseurs tricycliques est à éviter en raison du profil d’effets secondaires. Encore à ce jour, les connaissances disponibles ne permettent pas de statuer sur l’efficacité ou l’inefficacité des inhibiteurs de la cholinestérase dans le traitement des symptômes psychologiques, notamment dépressifs, compliquant la démence (Gauthier et al., 2012).
L’usage de psychotropes chez la clientèle en centre d’hébergement doit cependant être adéquatement supervisé et il est pertinent de réévaluer épisodiquement la pertinence de chaque traitement. L’usage de benzodiazépines à long terme est généralement à proscrire en raison des risques de dépendance, de chute ou de confusion. En raison du risque accru de mortalité et d’événements vasculaires chez les patients atteints de démence, les antipsychotiques devraient, si possible, être sevrés après 3 mois de stabilité (Ballard et al., 2009). Ils requièrent aussi un suivi du profil métabolique. Finalement, lors de la prise d’antidépresseur, la démarche, le rythme cardiaque, la natrémie et l’humeur sont à surveiller (Blazer, 2003).
1.4 Commentaires sur l’état des connaissances
La dépression compliquant la démence (de type Alzheimer, vasculaire ou mixte) apparaît comme un trouble psychiatrique très fréquent chez la personne âgée, avec une association
21 neurobiologique plausible. Malheureusement, ce syndrome psychiatrique est souvent mal diagnostiqué, ce qui empêche l’amorce d’un traitement adéquat avec impact clinique significatif. Cette problématique, assez bien étudiée dans la population âgée vivant dans la communauté, a peu été explorée en centre d’hébergement, malgré la forte prévalence rapportée.
Bien que la clientèle des CHSLD de Québec soit croissante et s’alourdisse, le dépistage de la dépression chez les patients atteints d’un syndrome démentiel n’est pas fait de façon systématique. Il y a donc lieu de s’interroger sur la capacité de la première ligne de détecter la dépression chez le sujet atteint de démence en centre d’hébergement, tout en considérant le profil neuropsychiatrique plus global de ces patients et leur pharmacothérapie psychiatrique. De plus, si un outil de dépistage se démarquait quant à sa capacité de bien identifier les patients souffrant de dépression, il pourrait alors être considéré d’en recommander un usage plus systématique dans le suivi de ces patients.
D’ailleurs, les lignes directrices canadiennes de la Coalition pour la santé mentale des aînés, et l’Association internationale de psychogériatrie (IPA) dans son document sur les symptômes comportementaux et psychologiques de la démence, soulignent la pertinence de poursuivre la recherche sur la problématique des symptômes psychologiques compliquant la démence, et ce dans divers milieux, notamment les centres d’hébergement. La Coalition souligne que la qualité de soins des patients atteints de démence en CHSLD est un problème mondial à explorer, notamment par rapport aux enjeux touchant les ressources et les aménagements en CHSLD, le dépistage inefficace des troubles dépressifs et l’usage inadéquat des psychotropes (Conn et al., 2006). De son côté, l’IPA identifie comme pistes de recherche futures la qualité de vie des patients souffrant de démence et de symptômes psychologiques en lien avec différents paramètres dont l’environnement, le rapport coût-bénéfice de l’usage de la médication puisque la prévalence croissante de la démence entrainera aussi une explosion des coûts associés, et l’évaluation de l’incidence et de la prévalence des symptômes psychologiques de la démence dans différents types de démence et dans différents milieux de soins (International Psychogeriatric Association, 2010).
2. Objectifs et hypothèses
2.1 Objectifs principaux
- Établir la prévalence du trouble dépressif majeur dans la population des sujets âgés atteints de démence vivant dans des centres d’hébergement desservis par l’équipe de gérontopsychiatrie de l’Institut universitaire en santé mentale de Québec.
- Établir la sensibilité de la détection de ce trouble par les intervenants de l’équipe soignante.
2.2 Objectifs secondaires
- Comparer les prévalences de dépression obtenues en fonction des échelles de symptômes utilisées (soient celle du DSM-IV-TR, celle des critères provisoires suggérée par Olin et al(Olin et al., 2002), l’échelle de dépression dans la démence de Cornell ou l’Inventaire neuropsychiatrique).
- Évaluer l’utilité d’un outil de dépistage de la dépression compliquant la démence (Cornell Scale
for Depression in Dementia) chez cette clientèle, i.e. déterminer le nombre de cas qui auraient été
dépistés si son utilisation était systématique.
- Évaluer la prévalence des symptômes neuropsychiatriques chez cette population et l’impact de l’utilisation d’un inhibiteur de la cholinestérase (ou de la mémantine), des antidépresseurs et des antipsychotiques sur le profil neuropsychiatrique et sur la qualité de vie des sujets, en fonction de la présence ou non d’un état dépressif.
- Évaluer l’impact de la symptomatologie dépressive sur le fardeau des soins.
2.3 Hypothèses
L’hypothèse de départ est que la prévalence de la dépression chez cette population soit de 15% (Peskind, 2003; Zubenko et al., 2003), et qu’elle n’ait pas été détectée par l’équipe soignante dans 20% des cas (Kales et al., 2005).
Il est par ailleurs supposé qu’il y ait jusqu’à 20% de variation de prévalence selon l’outil de dépistage utilisé (Vilalta-Franch et al., 2006), et que l’échelle de Cornell soit la plus sensible et spécifique au diagnostic de dépression compliquant la démence. De plus, les critères provisoires de la dépression compliquant la démence de type Alzheimer suggérés par Olin et al. devraient
23 identifier un nombre comparable de cas de dépression que l’usage des critères de dépressions majeure et mineure du DSM IV (Starkstein et al., 2005).
Finalement, il est escompté que des symptômes neuropsychiatriques soient prévalents chez plus de 50% des sujets, qu’ils soient plus prévalents chez les sujets atteints de dépression, et que l’usage de psychotropes ait un effet bénéfique modeste mais significatif sur leur prévalence (International Psychogeriatric Association, 2010). Il est escompté que la présence d’un syndrome dépressif aura un impact négatif sur le fardeau des soins imposé aux soignants (Cummings, 1997).
3. Pertinence du projet
Cliniquement, le trouble dépressif compliquant la démence chez les patients en centre d’hébergement est un problème fréquent, mais peu étudié jusqu’à maintenant. Or, il s’agit d’une population qui sera croissante dans les prochaines années et mieux la connaître sera nécessaire pour mieux adapter les soins qui seront offerts. De plus, il s’agit d’un diagnostic fréquemment omis, ce qui est déplorable puisqu’il est démontré qu’un traitement a un impact significatif sur l’état de ces patients. Ainsi, si cette étude démontre un écart significatif entre le diagnostic de la dépression par les intervenants et les investigateurs, à l’avantage de ces derniers, les intervenants pourront être sensibilisés à cette réalité et les patients bénéficieront de soins améliorés.
De façon plus globale, il peut être escompté que cette étude pourra par la suite avoir un impact sur les patients futurs des centres d’hébergement investigués, puisque les soignants auront été sensibilisés à l’importance du dépistage de la dépression chez le sujet atteint de démence.
Pour un résident qui se destine à la gérontopsychiatrie, cette étude comporte aussi de nombreux avantages. Elle évalue deux des maladies les plus fréquemment rencontrées dans cette population, initie à différents outils diagnostiques et se déroule en centre d’hébergement, endroit ou une majorité des patients suivis se retrouveront éventuellement.
25
Ce chapitre présente à la Section 2 l’article découlant de cette recherche et dont la soumission à la Revue canadienne de psychiatrie est prévue. La méthodologie de la recherche et ses principaux résultats y sont présentés. Auparavant, la Section 1 présente une description des outils de mesure utilisés pour cette recherche.
27
1. Outils de mesures utilisés
a) Examen mental de Folstein (MMSE) (Folstein et al., 1975)
L’examen de Folstein (annexe 2a) est un des tests cognitifs les plus utilisés et les mieux connus dans le contexte de la démence. Il sert de test de dépistage pour la démence et est complété par des questions adressées directement au patient. Il comporte 17 items couvrant l’orientation (temps et lieu), les mémoires immédiate et différée, l’attention, le calcul, les habiletés visuoconstructives et les praxies. Le maximum de points à obtenir est de 30, et le seuil pour la démence est de 24/30 (Lorentz et al., 2002). Il faut prévoir une dizaine de minutes pour son administration (Lorentz et al., 2002). Cet examen servira à mieux préciser le degré d’atteinte cognitive des sujets de l’étude.
b) Inventaire neuropsychiatrique, version pour centres d’hébergement (NPI-NH) (Cummings, 1997)
L’inventaire neuropsychiatrique (annexe 2b) a été développé spécifiquement pour les patients atteints de démence, afin d’évaluer chez eux les symptômes suivants : délires, hallucinations, agitation, dysphorie, anxiété, apathie, irritabilité, euphorie, désinhibition, comportements moteurs aberrants, troubles des comportements nocturnes, appétit et anomalies alimentaires. Chaque item a une question de dépistage et des sous-questions en cas de réponse positive. Chaque item est également évalué en termes de fréquence (allant de 1 : occasionnel, à 4 : très fréquent), sévérité (allant de 1 : léger, à 3 : sévère) et degré de détresse produite chez le soignant (allant de 0 : pas du tout, à 6 : extrêmement). Le NPI doit être complété avec le soignant. Il est généralement employé pour démontrer l’impact d’une médication procognitive sur les symptômes comportementaux (Cummings, 1997). Une version pour les patients en centre d’hébergement existe et sa fiabilité et sa validité ont été démontrées et sa constance interne est de 67% (Lange et al., 2004; Wood et al., 2000). La principale utilité de cette échelle dans la présente étude sera d’évaluer objectivement l’impact de l’inhibiteur de la cholinestérase ou de la mémantine sur les symptômes comportementaux des patients, en plus de servir d’outil de comparaison dans le dépistage de la dépression puisqu’il s’agit d’une des sous-échelles de ce questionnaire. Administré au soignant, le NPI-NH n’exigera pas la participation directe du patient.
c) Échelle de Cornell pour la dépression compliquant la démence (CSDD) (Lam et al., 2005; Alexopoulos et al., 1988)
L’échelle de Cornell (annexe 2c) a été développée spécifiquement pour évaluer l’intensité des symptômes dépressifs chez un patient atteint de démence. Elle doit être complétée avec le patient et son soignant. Elle comporte 19 items, chacun quantifié de 0 (absent), à 2 (sévère). Le seuil indiquant une dépression chez un patient atteint de démence est de 6. À ce seuil, elle présente une sensibilité de 93% et une spécificité de 97% (Korner et al., 2006). Elle a une fiabilité interjuge de 67% et une constance interne de 84% (Alexopoulos et al., 1988). Son utilisation permettra d’étoffer le diagnostic de dépression posé et d’évaluer quelle proportion des patients déprimés aurait été identifiée si cet outil avait été utilisé par l’équipe soignante.
d) Entrevue Clinique structure pour le DSM-IV (SCID-IV )(First et al., 1994)
L’entrevue clinique structurée pour le DSM-IV (annexe 2d) a été conçue afin d’émettre un diagnostic valable en fonction des critères du DSM. Elle comporte plusieurs sections en fonction des différents syndromes, et chaque critère est passé en revue, les questions devant être posées étant déjà formulées. Il est possible de n’utiliser que les sections pertinentes au diagnostic étudié. L’utilisation de cet outil permettra de poser le diagnostic de trouble dépressif majeur et des autres syndromes dépressifs selon le DSM-IV.
e) Échelle de détérioration globale et évaluation du niveau fonctionnel (GDS/FAST) (Auer & Reisberg, 1997)
Cette échelle (annexe 2e) donne une idée globale du niveau d’évolution de la démence du sujet. Elle comporte sept niveaux couvrant l’étendue allant du vieillissement normal jusqu’aux derniers stades de la maladie. Cette échelle a servi à préciser le degré d’atteinte des patients de l’étude.
f) Échelle de la qualité de vie dans la maladie d’Alzheimer (QOL-AD) (Hoe et al., 2006; Logsdon et al., 2002)
Cette échelle d'évaluation de la qualité de vie associée à la démence (annexe 2f) implique un bref questionnaire avec le patient et l'aidant. Elle est composée de 13 items à évaluer qui sont cotés de 1 (mauvais) à 4 (excellent). La cote totale obtenue implique de multiplier par 2 la cote obtenue pour le patient, de l'additionner à celle obtenue avec l'aidant et de diviser par 3 la somme pour donner plus d'importance à la perception du patient. La consistance interne
29 de l'échelle est bonne (Cronbach's alpha = 0,88). La validité interne a été évaluée comme acceptable en comparaison avec d'autres instruments d'évaluation semblables. Les résultats d'évaluation de qualité de vie avec les patients et les aidants ont été corrélés et un degré modéré d'atteinte cognitive ne compromettrait pas la fiabilité ou la validité de l'instrument. La version française de cette échelle a été utilisée.
31
Prevalence and detection of depression, neuropsychiatric profile and impact of medication on neuropsychiatric symptoms in elderly nursing home patients with
Alzheimer’s disease and related dementias
Jean-François Côté, MD, Centre hospitalier de l’Université Laval, Québec
François Rousseau, MD, Institut universitaire en santé mentale de Québec, Québec Nadine Gagnon, MD, Institut universitaire en santé mentale de Québec, Québec
Alexandre Bureau, PhD, Centre de recherche de l’Institut universitaire en santé mentale de Québec and Université Laval, Québec
Catherine Touchette, MD, Hôpital de l’Enfant-Jésus, Québec Julie McNicoll, MD, Hôtel-Dieu-de-Lévis, Lévis, Québec Mylène Fillion, MD, pQuébec
Johanne Duguay, BSc, Institut Universitaire en Santé Mentale de Québec, Québec Carol Hudon, PhD, Centre de recherche de l’Institut universitaire en santé mentale de Québec and Université Laval, Québec
Correspondance : Jean-François Côté, MD CHUL, CHUQ 2705, boul. Laurier Québec, Québec G1V 4G2 Tel : 418 654-2177 fax : 418 654-2716 Email : jean-francois.cote.17@ulaval.ca