UFR de Biologie et Sciences de la Nature
Année 2000 N° attribué par la bibliothèque
T H E S E
Pour l'obtention du Diplôme de Docteur de l'Université Paris 7 Spécialité: PHYSIOLOGIE ET PHYSIOPATHOLOGIE DE LA NUTRITION HUMAINE présentée par
Marc FORETZ
Titre de la thèse:Rôle du facteur de transcription SREBP-1c dans l'activation
transcriptionnelle des gènes de la glycolyse et de la lipogenèse
par l'environnement glucidique dans le foie
Soutenue publiquement le 29 juin 2000
Devant le jury composé de:
Pr. Bernard PORTHA Président
Dr Bernard THORENS Rapporteur
Dr. Sophie VAULONT Rapporteur
Dr. Robert BAROUKI Examinateur
2 Mes remerciements vont à Monsieur Bernard Portha qui m'a fait l'honneur de présider cette thèse.
J'adresse mes plus sincères remerciements à Madame Sophie Vaulont et à Monsieur Bernard Thorens pour avoir accepté avec gentillesse d'être les rapporteurs de cette thèse.
Je remercie également Monsieur Robert Barouki pour avoir accepté de participer au jury de cette thèse.
J'exprime ma profonde gratitude à Monsieur Pascal Ferré pour m'avoir accueilli dans son laboratoire. Ses compétences scientifiques m'ont été d'un grand enseignement durant la réalisation de ce travail.
J'exprime ma reconnaissance à Fabienne Foufelle pour avoir dirigé efficacement ces quatre années de travail riches en enseignement et passionnantes. Je la remercie également pour avoir relu avec attention la partie introduction de ce manuscrit.
Je remercie Alain Ktorza de m'avoir orienté vers le laboratoire de Pascal Ferré.
Tous mes remerciements vont aussi à tous les membres de l'unité INSERM U465 pour leur accueil chaleureux et leur disponibilité.
Je remercie Joëlle Morin et Josette Boillot pour m'avoir initié à la culture primaire des hépatocytes.
Je remercie chaleureusement Muriel Boizard, Isabelle Hainault et Sophie Turban pour leur amitié durant ces années de thèse.
Merci à mes parents pour m'avoir permis de poursuivre sans contraintes de choix et de durée toutes ces années d'études.
Enfin, je tiens à avoir une pensée pour toutes les personnes (enseignants, parents, amis, connaissances, auteurs ...) qui ont su exalter mon goût pour les sciences de la vie et de la nature.
4
AVANT-PROPOS
Au cours de ce travail de thèse, nous avons étudié les mécanismes cellulaires et moléculaires de la régulation transcriptionnelle des gènes impliqués dans le métabolisme glucidique et lipidique dans le foie. Nos études nous ont conduit à nous intéresser à différents aspects de cette régulation. Dans ce mémoire, nous avons choisi de focaliser notre propos sur la régulation transcriptionnelle des gènes hépatiques par l'insuline et le glucose. Dans la partie introduction nous ferons le point sur les connaissances actuelles concernant cette régulation, puis nous rapporterons et discuterons nos résultats sur l'implication du facteur de transcription SREBP-1c dans les effets géniques de l'insuline seule et de l'insuline en présence du glucose. Les résultats que nous avons acquis sur les autres aspects du contrôle des gènes du métabolisme glucidolipidique seront abordés dans la partie introduction et les publications correspondantes sont présentées en annexe à la fin du manuscrit.
TABLE DES MATIERES
Liste des figures et des tableaux ... p11 Liste des abréviations ... p15 INTRODUCTION ... p17 Première partie: L'homéostasie glucidique dans le foie ... p18 I. Régulation de la glycémie ... p18 II. Régulation de l'utilisation et de la production du glucose par le foie ... p20 1/ Transport du glucose dans l'hépatocyte ... p20 2/ La glycolyse et la gluconéogenèse ... p22 a/ Glucokinase ... p22 -Concept de senseur du glucose ... p22 -Rôle de la glucokinase dans la sécrétion d'insuline par les cellules ß du pancréas ... p24 -Glucokinase et diabète ... p26 -Régulation à court terme ... p28 -Régulation à long terme ... p31 -Rôle de la glucokinase dans le contrôle du métabolisme glucidique hépatique ... p31 b/ L-pyruvate kinase ... p32 -Régulation à court terme ... p32 -Régulation à long terme ... p33 Régulation hormonale et nutritionnelle in vivo et ex vivo ... p33 c/ Phosphoénolpyruvate carboxykinase ... p34 -Régulation hormonale et nutritionnelle du gène de la PEPCK ... p34 -Facteurs cis- et trans-régulateurs ... p35 3/ La lipogenèse... p36 a/ Rôle de lipogenèse ... p36 b/ Sites de la lipogenèse ... p37 c/ Vue globale de la lipogenèse ... p37 d/ Contrôle de la lipogenèse ... p39 e/ Régulation de la biosynthèse des acides gras ... p40 !/ Acétyl-CoA carboxylase ... p40
6 -Régulation à court terme ... p40 -Régulation à long terme ... p41 ß/ Synthase des acides gras ... p41 -Régulation hormonale et nutritionnelle de la transcription du gène de la FAS ... p42
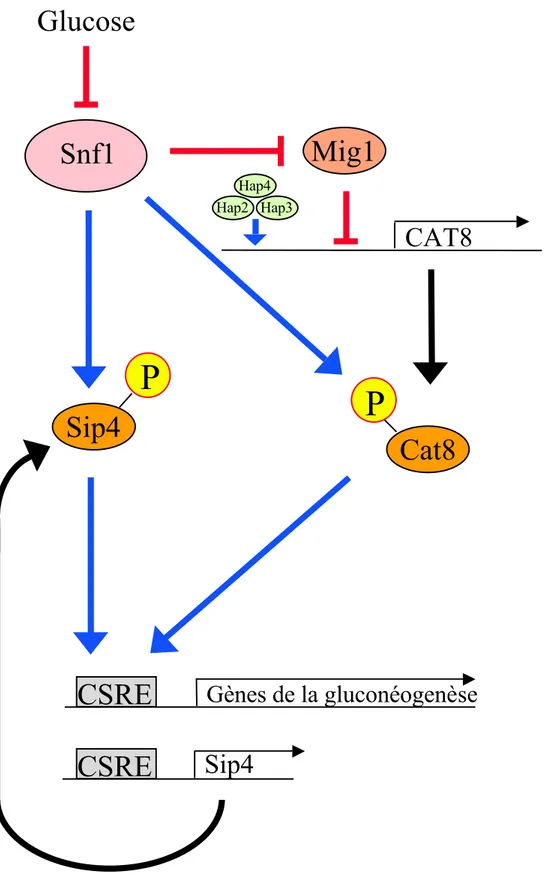
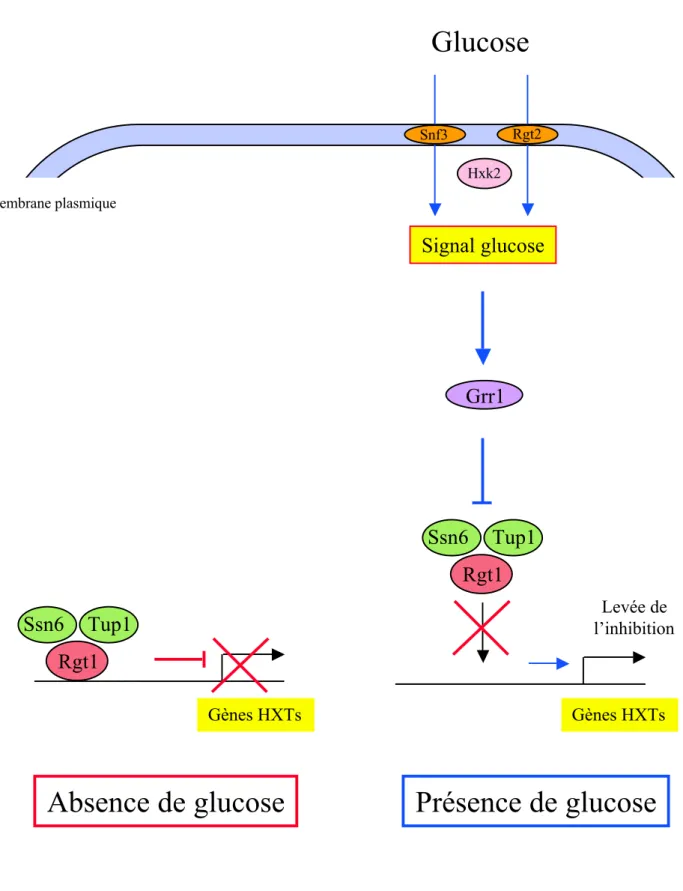
In vivo dans le foie ... p42 In vitro dans des cellules en culture ... p42 "/ Protéine S14 ... p43 -Régulation hormonale et nutritionnelle in vivo et ex vivo ... p44 4/ Conclusion ... p44 Deuxième partie: Régulation transcriptionnelle par le glucose ... p46 I. Régulation transcriptionnelle par le glucose chez la levure ... p46 1. Répression transcriptionnelle par le glucose ... p46 a/ La protéine kinase Snf1 ... p46 b/ Régulation de l'activité de Snf1 par phosphorylation ... p47 c/ Régulation du répresseur transcriptionnel Mig1 par la protéine kinase Snf1 ... p47 d/ Régulation des activateurs transcriptionnels Cat8 et Sip4 par la protéine kinase Snf1 ... p49 e/ Protéine kinase dépendante de l'AMP ... p51 Structure et distribution tissulaire ... p51 Régulation de l'activité AMPK ... p51 Rôle physiologique de l'AMPK ... p52 2. Induction transcriptionnelle par le glucose ... p53 II. Régulation transcriptionnelle par le glucose chez les mammifères ... p55 1. Introduction ... p55 2. Rôle de GLUT2 dans la réponse transcriptionnelle au glucose dans le
foie ... p56 3. Rôle de l'insuline et de la glucokinase ... p57 4. Le(s) métabolite(s) signal de la réponse au glucose ... p59 5. L'éléments cis- et trans-régulateurs de la réponse au glucose ... p61 a/ L-pyruvate kinase ... p61
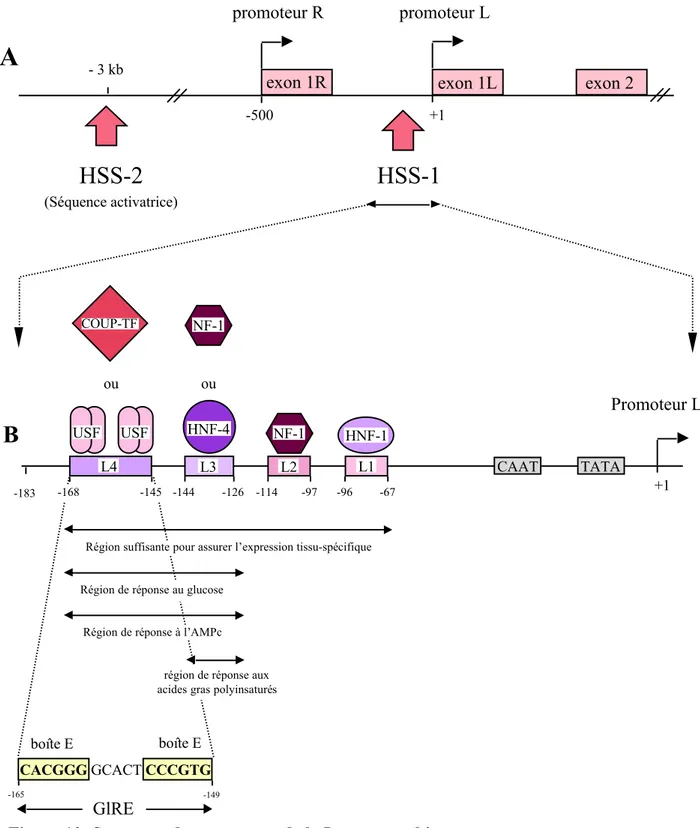
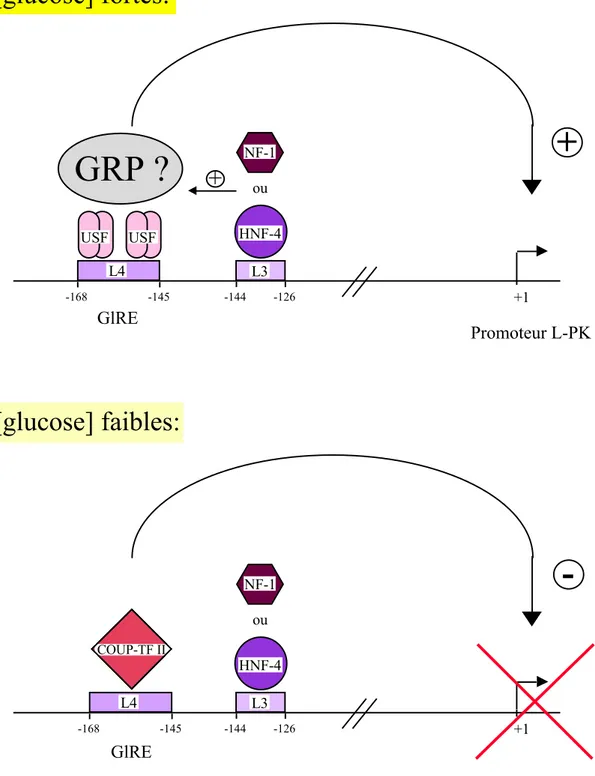
-Eléments cis- et trans-régulateurs du promoteur du gène de la L-PK dans le foie ... p61 -Eléments cis-régulateurs de la réponse au glucose ... p64 -Rôle d'USF dans la réponse au glucose ... p65 -Rôle de COUP-TFII dans la réponse au glucose ... p67
-Facteurs auxiliaires de la réponse au glucose ... p67 -Autres facteurs transactivateurs du gène L-PK ... p69 b/ Protéine S14 ... p69 -Eléments cis-régulateurs du promoteur du gène S14 ... p69 -Eléments cis- et trans-régulateurs de la réponse au glucose du gène S14 ... p70 c/ Synthase des acides gras ... p73 -Eléments cis- et trans-régulateurs de la réponse au glucose du gène FAS ... p73 d/ Acétyl-CoA carboxylase ... p76 e/ Autres gènes du métabolisme glucidolipidique activés par le glucose p79 -Glut2 ... p79 -Glucose-6-phosphatase ... p79 -ATP citrate lyase ... p80 -Glycérol-3-phosphate acyltransférase ... p80 -Récepteur au glucagon ... p80 -Aldolase B, stéaroyl-CoA désaturase et lipase hormono-sensible p81 f/ Gènes inhibés par le glucose ... p81
-PEPCK ... p81 -Aspartate aminotransférase ... p82 6/ Conclusion ... p83 Troisième partie: Régulation transcriptionnelle par l'insuline ... p84 I. Voies de signalisation de l'insuline et régulation transcriptionnelle ... p84 a/ Phosphatidylinositol 3-kinase-PKB/Akt ... p84 b/ Mécanisme d'activation de la PKB/Akt par la PI 3-kinase ... p85 c/ Gènes contrôlés par l'insuline via la voie de la PI 3-kinase ... p85 II. Inhibition transcriptionnelle par l'insuline ... p86 III. Activation transcriptionnelle par l'insuline ... p90 a/ Glucokinase ... p90 b/ Synthase des acides gras ... p91 c/ Glycéraldéhyde-3-phosphate déshydrogénase ... p92 IV. Conclusion ... p93
Quatrième partie: SREBP, un facteur de transcription contrôlant l'expression des gènes du métabolisme du cholestérol et des acides gras ... p94
8 I. Introduction ... p94 II. Structure et activité transcriptionnelle des facteurs SREBP ... p95 1. Structure protéique de SREBP ... p95 2. Les gènes SREBP ... p97 3. Caractéristiques de la partie transcriptionnellement active de SREBP .... p99 a/ Structure de la partie facteur de transcription de SREBP ... p99 b/ Sites de liaison à l'ADN de SREBP ... p99 c/ Co-facteurs transcriptionnels de SREBP ... p101
-Co-facteurs activateurs Sp1 et NF-Y ... p101 -Co-facteur activateur CREB ... p105 -Facteur inhibiteur YY1 ... p106 -Co-activateur CBP ... p108 III. Activation de SREBP par protéolyse ... p110 1. Cascade d'activation de SREBP par protéolyse ... p110 2. Acteurs de l'activation protéolytique de SREBP ... p112 a/ La protéine SCAP, un senseur du cholestérol ... p112 b/ La protéase S2P ... p116 c/ La protéase S1P ... p119 IV. Régulation et rôle des différentes isoformes de SREBP dans le foie ... p121 1/ Régulation nutritionnelle et hormonale de SREBP dans le foie ... p122 a/ Cholestérol ... p122 b/ Jeûne et réalimentation hyperglucidique ... p122 c/ Diabète et insuline ... p123 d/ Acides gras polyinsaturés ... p125 e/ Conclusion ... p125 2/ Surexpression des différentes isoformes de SREBP dans le foie de souris transgéniques ... p126
a/ Conséquences globales de la surexpression des différentes isoformes de SREBP: Gènes cibles de SREBP ... p126 b/ Conséquences de la surexpression de chacune des isoformes SREBP dans le foie de souris transgéniques ... p129 !/ SREBP-1a ... p129 #/ SREBP-1c ... p129 "/ SREBP-2 ... p130 c/ Conclusion ... p130 3/ Invalidation des gènes SREBP chez la souris ... p132 a/ Délétion du gène SREBP-1 ... p132 b/ Délétion du gène SREBP-2 ... p132 V. Conclusion ... p133
RESULTATS EXPERIMENTAUX ... p134 Introduction ... p135 Présentation du travail ... p136 Résultats ... p138 I. Régulation nutritionnelle et hormonale de l'expression du gène SREBP-1c dans le foie et dans des hépatocytes en culture primaire ... p138 a/ Régulation nutritionnelle de l'expression du gène SREBP-1c dans le foie p138 b/ Effet des hormones pancrétiques sur l'expression du gène SREBP-1c dans des hépatocytes en culture primaire ... p138 II. Construction de vecteurs adénoviraux pour étudier le rôle de SREBP-1c dans l'activation des gènes de la glycolyse et de la lipogenèse par l'insuline et le glucose ... p141 III. Rôle du facteur de transcription SREBP-1c dans activation transcriptionnelle du gène de la glucokinase par l'insuline ... p146 IV. Rôle du facteur de transcription SREBP-1c dans l'activation transcriptionnelle des gènes de la glycolyse et de la lipogenèse par l'insuline et le glucose ... p151 V. Effet de SREBP-1c sur l'expression du gène PEPCK ... p158 Publication 1 ... p160 Publication 2 ... p170
DISCUSSION ... p177 -Régulation de l'expression et de l'activité de SREBP-1c par l'insuline dans le foie p178 -Le facteur SREBP-1c coordonne l'expression des gènes de la glycolyse et de la lipogenèse dans le foie en réponse à l'état nutritionnel et hormonal ... p183 -Le facteur SREBP-1c est le médiateur de l'insuline dans l'activation transcriptionnelle du gène de la glucokinase ... p185
10 -Le facteur SREBP-1c est impliqué dans l'activation transcriptionnelle des gènes dépendants de l'insuline et du glucose ... p186 -Inhibition de l'expression du gène PEPCK par SREBP-1c ... p193
CONCLUSION ET PERSPECTIVES ... p195 REFERENCES BIBLIOGRAPHIQUES ... p200 ANNEXE ... p229 Publication 3 ... p230 Publication 4 ... p236 Publication 5 ... p243 Publication 6 ... p249 RESUME ... p256 ABSTRACT ... p257
Liste des figures et des tableaux
INTRODUCTION
Figure 1: Représentation schématique du contrôle de la glycémie par le foie ... p19 Figure 2: Représentation schématique des voies de la glycolyse et de la gluconéogenèse dans le foie ... p21 Figure 3: Le glucose-6-phosphate: un métabolite au carrefour du métabolisme glucidique dans le foie ... p23 Figure 4: Représentation schématique du rôle senseur de la glucokinase dans l’homéostasie glucidique ... p25 Figure 5: Mécanisme de régulation à court terme de l’activité de la glucokinase et de sa localisation cellulaire par la protéine régulatrice GKRP ... p29 Figure 6: Représentation schématique de la lipogenèse dans le foie ... p38 Figure 7: Représentation schématique du mécanisme de répression transcriptionnelle par le glucose chez la levure ... p48 Figure 8: Représentation schématique de l’activation des gènes de la gluconéogenèse en absence de glucose chez la levure ... p50 Figure 9: Représentation schématique du mécanisme d’induction par le glucose des gènes HXTs codant pour des transporteurs d’hexose chez la levure ... p54 Figure 10: Structure du promoteur de la L-pyruvate kinase ... p63 Figure 11: Régulation du gène de la pyruvate kinase hépatique par le glucose p68 Figure 12: Structure du promoteur de la protéine S14 ... p71 Figure 13: Structure du promoteur du gène de la synthase des acides gras ... p74 Figure 14: Régions de réponse au glucose et au cholestérol sur le promoteur PII du gène de l’acétyl-CoA carboxylase ... p77
12 Figure 15: Modèle d’inhibition transcriptionnelle par l’insuline ... p88 Figure 16: Représentation schématique des domaines structuraux des protéines SREBP-1a, -1c et -2 humaines ... p96 Figure 17: Représentation schématique de la structure membranaire de la forme précurseur de SREBP ... p96 Figure 18: Structure du gène SREBP-1 chez l’homme ... p98 Figure 19: Rôle de l’acide aminé 320 du domaine basique de SREBP dans la spécificité de liaison à l’ADN ... p100 Tableau I: Comparaison des sites de liaison fonctionnels de SREBP présents dans différents gènes contrôlés par SREBP ...p102 Figure 20: Localisation des sites de liaison transcriptionnellement actifs de SREBP et de ses co-activateurs sur différents gènes contrôlés par SREBP ...
p104
Figure 21: Modèle de l’inhibition du promoteur du gène du récepteur aux LDL par le facteur YY1 ... p107 Figure 22: Modèle de l’inhibition du promoteur du gène de l'HMG-CoA synthase par le facteur YY1 ... p107 Figure 23: Modèle d’activation transcriptionnelle du promoteur du gène du récepteur aux LDL par SREBP, Sp1 et CBP ... p109 Figure 24: Etapes de la libération protéolytique contrôlée par le cholestérol de SREBP des membranes du RE/Golgi vers le noyau ...
p111
Figure 25: Structure membranaire de la protéine SCAP ... p113 Figure 26: Comparaison des protéines membranaires contenant un domaine senseur du cholestérol ... p115 Figure 27: Structure membranaire de la protéase S2P ... p117 Figure 28: Structure protéique de la protéase S1P ... p120
Tableau II: Régulation nutritionnelle et hormonale des différentes isoformes de SREBP dans le foie ... p124 Figure 29: Gènes contrôlés par SREBP dans le foie ... p127 Tableau III: Conséquences de la surexpression de la forme mature de SREBP-1a, -1c ou -2 dans le foie de souris transgéniques sur la synthèse hépatique du cholestérol et des acides gras et sur l'expression des gènes impliqués dans ces deux voies métaboliques ... p130 RESULTATS
Figure 30: Régulation nutritionnelle de l'expression du gène SREBP-1c dans foie chez le rat adulte ... p139 Figure 31: Effets de l'insuline et du dibutyryl-AMPc sur l'expression du gène SREBP-1c dans des hépatocytes en culture ... p139 Figure 32: Effet d'inhibiteurs de différentes voies de signalisation de l'insuline sur l'expression du gène SREBP-1c ... p140 Figure 33: Représentation schématique de l’effet de la surexpression d’une forme dominante négative de SREBP-1c sur l’activité du SREBP-1c endogène ... p142 Figure 34: Infection d'hépatocytes en culture primaire avec des titres croissants d'un adénovirus recombinant contenant le gène de la "green fluorescent protein" contrôlé par le promoteur CMV ... p143 Figure 35: Représentation schématique des différentes étapes de la construction d'un adénovirus recombinant ... p144 Figure 36: Une forme dominante négative de SREBP-1c diminue l'expression du gène de la glucokinase dans des hépatocytes en culture de rats adulte ... p147 Figure 37: Une forme dominante positive de SREBP-1c induit l'expression du gène glucokinase dans des hépatocytes en culture de rats adultes en absence d'insuline ... ... p147
14 Figure 38: Effet de la forme dominante positive SREBP-1c 403 sur l'activité du promoteur proximal hépatique du gène de la glucokinase ... p148 Figure 39: Etude de la liaison de SREBP-1c 403 sur la boîte E du le promoteur hépatique du gène glucokinase par des expériences de retard sur gel ... p149 Figure 40: Effet d'une forme dominante négative de SREBP-1c sur l'expression de gènes impliqués dans la glycolyse et dans la lipogenèse dans des hépatocytes de rats en culture ... p152 Figure 41: Effet de la forme dominante positive de SREBP-1c en présence de fortes concentrations de glucose sur l'expression des gènes FAS et S14 dans des hépatocytes de rats adultes en culture primaire ... p152 Figure 42: Comparaison des effets de la forme dominante positive de SREBP-1c en présence d'une faible ou d'une forte concentration de glucose sur l'expression des gènes FAS et S14 dans des hépatocytes en culture de rats adultes ... p153 Figure 43: Infection d'adipocytes en culture primaire avec un adénovirus recombinant contenant le gène de la "green fluorescent protein" contrôlé par le promoteur CMV ... p155 Figure 44: Effet de la forme dominante positive de SREBP-1c en présence d'une faible ou d'une forte concentration de glucose sur l'expression des gènes FAS et S14 dans des adipocytes en culture primaire de rats adultes ... p156 Figure 45: Effet de la forme dominante positive et de la forme dominante négative de SREBP-1c sur l'expression basale ou stimulée par l'AMPc du gène PEPCK dans des hépatocytes de rats en culture primaire ... p159 DISCUSSION - CONCLUSION et PERSPECTIVES
Figure 46: Mécanismes de régulation établis ou potentiels de l’activité transcriptionnelle de SREBP-1c par l’insuline ... p182 Figure 47: Rôle de SREBP-1c dans l’activation transcriptionnelle des gènes de la glycolyse et de la lipogenèse dans le foie ... p197
Liste des abréviations
aa acide(s) aminé(s)
ACC acétyl-CoA carboxylase
Ad adénovirus
ADD1 adipocyte determination and differenciation-dependent factor 1
ADN acide désoxyribonucléique
ADNc ADN complémentaire
ADP adénosine diphosphate
AGPI acides gras polyinsaturés
AMP adénosine monophosphate
AMPc AMP cyclique
AMPK protéine kinase dépendante de l'AMP
AMPKK AMPK kinase
ApoCIII apolipoprotéine CIII
ARC activator-recruited cofacteur
ARN acide ribonucléique
ARNm ARN messagers
AspATc aspartate aminotransférase cytosolique
ATP adénosine triphosphate
bHLH-LZ basic helix-loop-helix leucine zipper
C/EBP CCAAT/enhancer-binding protein
CAT chloramphénicol acétyl transférase
CBP CREB-binding protein
CHO chinese hamster ovary
ChoRE carbohydrate response element
CKII caséine kinase II
CMV cytomégalovirus
COUP-TFII chicken ovalbumin upstream factor II
CPTI carnitine-palmitoyl-CoA transférase I
CRE cAMP response element
CREB cAMP response element-binding protein
CRU cAMP response unit
DBI/ACBP diazepam-binding inhibitor/acyl-CoA-binding protein
DBP D-binding protein
DN dominant négatif
DNID diabète non insulino-dépendant
F1P fructose-1-phosphate
F2,6P fructose-2,6-diphosphate
F6P fructose-6-phosphate
FAS fatty acid synthase
G6Pase glucose-6-phosphatase
G6PDH glucose-6-phosphate déshydrogénase
GAPDH glycéraldéhyde-3-phosphate déshydrogénase
GFP green fluorescent protein
GK glucokinase
GKRP glucokinase regulatory protein
GlRE glucose response element
GLUT glucose transporter
GPAT glycérol-3-phosphate acyltransférase
16
GRP glucose-regulated proteins
GRU glucocorticoid response unit
HMG-CoA 3-hydroxy-3-méthylglutaryl coenzyme A
HNF-1 hepatocyte nuclear factor-1
HNF-4 hepatocyte nuclear factor-4
HSS site hypersensible à la DNase I
IGFBP insulin-like growth factor binding protein-1
IPF1 insulin promoter factor-1
IRE insulin response element
IRS insulin response sequence
IRS-1 insulin receptor substrat 1
kb kilo bases
kda kilo daltons
L-PK pyruvate kinase hépatique
LDL low density lipoprotein
MAP kinase mitogen-activated protein kinase
MODY maturity-onset diabetes of the young
NADPH nicotinamide adénine dinucléotide phosphate forme réduite
NES nuclear export signal
NF1 nuclear factor 1
NLS nuclear localization signal
pb paire(s) de base
PDK phosphoinositide-dependent protein kinase
PEPCK phosphoénolpyruvate carboxykinase
PH pleckstrin homology domain
PI 3-kinase phosphatidylinositol 3-kinase
PIP3 phosphatidylinositol (3,4,5)-triphosphate
PKA protéine kinase dépendante de l'AMPc
PKB/Akt protéine kinase B
RE réticulum endoplasmique
RXR retinoid X receptor
S14 protéine spot 14
S1P site-1 protease
S2P site-2 protease
SCAP SREBP cleavage-activating protein
SCD stéaroyl-CoA désaturase
SRE sterol regulatory element
SREBP sterol regulatory element-binding protein
SV40 simian virus 40
SVF sérum de veau foetal
T 3 triiodothyronine
TAF TATA box-binding protein-associated factors
T A T tyrosine aminotransférase
TR thyroid hormone receptor
TRE thyroid hormone response element
USF upstream stimulatory factor
VLDL very low density lipoprotein
18
INTRODUCTION
Première partie
L'homéostasie glucidique dans le foie
I. Régulation de la glycémie
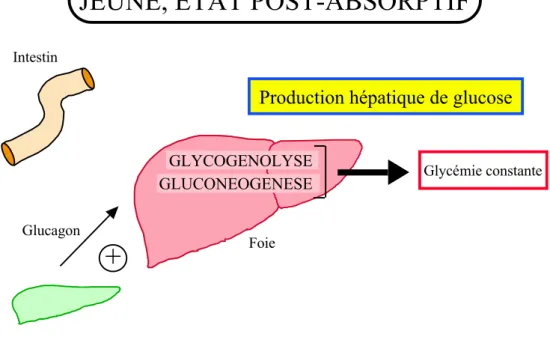
Chez les mammifères, en dépit de grandes variations dans l'apport et l'utilisation du glucose, la glycémie est maintenue relativement constante. Chez un individu normal après une nuit de jeûne, la concentration périphérique en glucose sanguin est de 0,80 g/l et cette concentration augmente à 1,20 g/l environ après les repas. Un certain nombre de tissus dépendent quasi-exclusivement du glucose pour leurs besoins énergétiques comme le cerveau, les hématies, la médulla surrénale et la rétine. Cela implique l'existence d'une régulation précise de la glycémie afin d'économiser le glucose pour les organes dépendants de ce substrat. Le foie joue un rôle majeur dans le contrôle de la glycémie. C'est le seul organe capable de capter et de libérer du glucose en réponse à des signaux hormonaux et nutritionnels. Sa localisation anatomique lui confère un statut particulier: c'est le premier organe à recevoir le glucose absorbé par l'intestin et les hormones pancréatiques sécrétées dans la veine porte. La production et l'utilisation de glucose sont ajustées précisément à chaque instant en particulier par les hormones pancréatiques insuline et glucagon. Au niveau hépatique, le glucagon agit en stimulant la production de glucose, alors que l'insuline freine la production de glucose et favorise l'utilisation du glucose et sa mise en réserve sous forme de glycogène et d'acides gras. A jeun, lorsque la concentration en glucose plasmatique est à son niveau le plus bas et que la concentration en glucagon est augmentée, le foie produit du glucose à partir de deux voies métaboliques. Dans un premier temps, la glycogénolyse permet la production de glucose à partir du glycogène hépatique stocké en période absorptive puis la gluconéogenèse, permet la synthèse de glucose à partir de précurseurs tels que le lactate, le glycérol et les acides aminés glucoformateurs. Au contraire, après l'absorption d'un repas riche en glucides, les concentrations sanguines en glucose et en insuline sont fortement augmentées. Dans ces conditions, le foie capte une partie du glucose
GLYCOGENOGENESE GLYCOLYSE LIPOGENESE Tissu adipeux Glycémie constante Intestin VLDL Pancréas
+
InsulineCaptage hépatique du glucose
Foie Glycémie constante GLYCOGENOLYSE GLUCONEOGENESE Intestin Pancréas Glucagon
+
FoieProduction hépatique de glucose
REGIME HYPERGLUCIDIQUE, ETAT ABSORPTIF
JEUNE, ETAT POST-ABSORPTIF
20 pour le stocker sous forme de glycogène par la voie de la glycogénogenèse, l'excès est transformé en lactate par la glycolyse et utilisé pour la synthèse de triglycérides (figure 1).
II. Régulation de l'utilisation et de la production du glucose par le foie
1/ Transport du glucose dans l'hépatocyteDans l'hépatocyte, l'entrée ou la sortie du glucose entre le cytosol et la circulation sanguine selon que le foie utilise ou produit du glucose est réalisée par diffusion facilitée à travers la membrane plasmique grâce au transporteur bidirectionnel GLUT2. Le sens du flux de glucose dépend de l'état nutritionnel et hormonal. GLUT2 appartient à la famille des transporteurs de glucose membranaire GLUT (pour GLUcose Transporter) caractérisés par 12 domaines transmembranaires (Olson & Pessin, 1996). GLUT2 est exprimé principalement dans le foie et les cellules ß des îlots de Langerhans du pancréas endocrine mais aussi dans l'intestin, le rein et certaines régions de l'hypothalamus (Leloup et al., 1994; Thorens, 1996). GLUT2 se distingue des autres isoformes de transporteurs GLUT par sa faible affinité pour le glucose (Km élevé d'environ 17 mM) et son caractère non insulino-dépendant; ceci permet un transport du glucose non saturé aux concentrations physiologiques de glucose atteignant le foie (environ 5-10 mM). Ce transport non limitant du glucose à travers la membrane plasmique est important pour le maintien de l'homéostasie glucidique en permettant à l'hépatocyte et à la cellule ß pancréatique d'avoir un reflet immédiat des variations de la glycémie. Le domaine C-terminal intracytoplasmique de GLUT2 semble lui conférer ses caractéristiques cinétiques (Vmax et Km élevés pour le glucose). En effet, en remplaçant la partie C-terminale du transporteur de glucose GLUT1 à forte affinité pour le glucose (Km faible d'environ 1-3 mM) par celle de GLUT2, on obtient un transporteur chimérique aux caractéristiques proches de celles de GLUT2 (Katagiri et al., 1992).
Dans l'hépatocyte, GLUT2 est indispensable pour permettre un équilibre entre les concentrations en glucose du cytosol et du milieu extracellulaire. Dans des hépatocytes isolés de souris dépourvues de gène GLUT2, Guillam et al. ont montré que le transporteur de glucose GLUT2 est nécessaire pour le captage du glucose mais pas pour son relarguage lorsque ces cellules sont incubées en conditions gluconéogéniques (Guillam et al., 1997). Ces auteurs suggèrent
Figure 2: Représentation schématique des voies de la glycolyse et de la gluconéogenèse dans le foie. Abréviations: GLUT2, transporteur de glucose; Glu-6-Pase, glucose-6-phosphatase; 6PF-1kinase, 6
phosphofructo-1-kinase, Fru-1,6-P2ase, fructose-1,6-diphosphatase, 6PF-2-K/Fru-2,6-P2ase,
6-phosphofructo-2-kinase/fructose-2,6-diphosphatase; L-PK, pyruvate kinase hépatique; PEPCK, phosphoénolpyruvate kinase; Fru-1-K, fructose-1 kinase; Fru-6-P, fructose-6-phosphate; Fru-1,6-P2, fructose-1,6-diphosphate; Fru-2,6-P2, fructose-2,6-diphosphate; PEP, phosphoénolpyruvate; OAA, oxalo-acétate; Fru-1-P, fructose-1-phosphate. Les régulations positives ou négatives des activités enzymatiques par les effecteurs allostériques (Fru-6-P, Fru-1P, Fru-2,6-P2, Fru-1,6-P2) sont indiquées par les symboles + et -, respectivement. (D’après Vaulont et al., 1994).
GLUT2 Fru-1,6-P2ase G6Pase Glucose Fru-6-P Fru-1,6-P2 Lactate PEP Pyruvate OAA Glucokinase 6PK-1-kinase L-PK PEPCK Fru-2,6-P2
G
L
Y
C
O
L
Y
S
E
Glucose-6-phosphate -+ -+ Fructose Fructose Fru-1-P Fru-1-K +G
L
U
C
O
G
E
N
O
G
E
N
E
S
E
AMPc PKA + Insuline + Sang Hépatocyte Glucagon Sang Hépatocyte Récepteur au glucagon Récepteur à l’insuline 6PF-2-K / Fru-2,6-P6PF-2-K / 2ase22 qu'en absence de GLUT2, le glucose produit par les hépatocytes serait sécrété par un mécanisme de transport vésiculaire (Guillam et al., 1998).
Dans le foie, l'expression du gène GLUT2 est diminuée au cours du jeûne et augmentée après un repas hyperglucidique (Thorens et al., 1990; Tiedge & Lenzen, 1995). Dans des hépatocytes isolés de rat, l'expression du gène GLUT2 est induite par le glucose (Asano et al., 1992) et abolit par l'AMPc (Rencurel et al., 1997). L'insuline inhibe transitoirement l'expression du gène GLUT2 in vivo et dans des hépatocytes isolés (Postic et al., 1993).
2/ La glycolyse et la gluconéogenèse
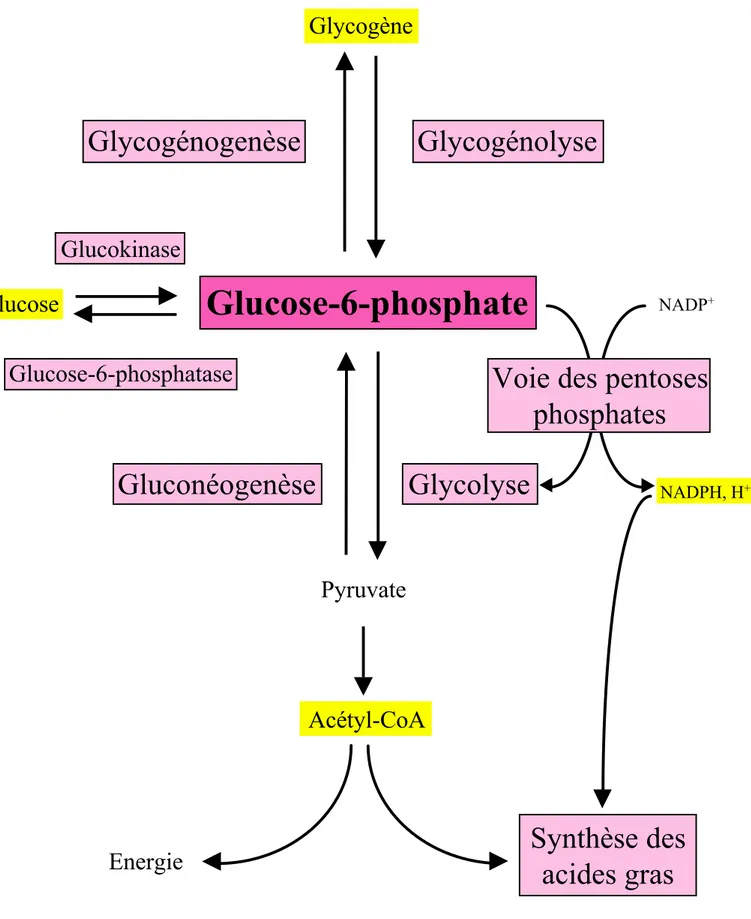
La glycolyse et la gluconéogenèse ont plusieurs étapes enzymatiques communes qui catalysent des réactions réversibles. Toutefois, ces deux voies métaboliques possèdent trois réactions opposées et irréversibles à l'origine de trois cycles métaboliques où s'exerce une régulation coordonnée dirigeant le flux dans un sens ou dans l'autre. Ces trois cycles sont: le cycle glucose/glucose-6-phosphate, le cycle fructose-6-phosphate/fructose-1,6-diphosphate et le cycle pyruvate/phosphoénolpyruvate. Ces cycles sont respectivement catalysés par les enzymes suivantes: glucokinase/glucose-6-phosphatase, 6-phosphofructo-1-kinase/ fructose-1,6-diphosphatase et L-pyruvate kinase/phosphoénolL-pyruvate carboxykinase (figure 2).
Dans les paragraphes suivants, nous nous limiterons à exposer les propriétés des enzymes hépatiques dont nous avons étudié la régulation au niveau génique, c'est-à-dire la glucokinase, la L-pyruvate kinase et la phosphoénolpyruvate carboxykinase.
a/ Glucokinase Concept de senseur du glucose:
La réaction de phosphorylation du glucose en glucose-6-phosphate joue un rôle central dans l'utilisation du glucose par le foie (figure 3). En effet, cette réaction est commune à la glycolyse, la glycogénogenèse et la voie des pentoses phosphates permettant respectivement la synthèse de lactate, du glycogène et du NADPH. Par conséquent, toute variation de l'activité de phosphorylation du glucose en glucose-6-phosphate entraînera des modifications du flux de ces différentes voies métaboliques par effet de masse.
Glucose-6-phosphate
Glycogénolyse
Glycogénogenèse
Glycolyse
Gluconéogenèse
Pyruvate
Acétyl-CoA
Synthèse des
acides gras
NADPH, H+ NADP+Glycogène
Glucose
Glucokinase
Figure 3: Le glucose-6-phosphate: un métabolite au carrefour du métabolisme glucidique dans le foie.
Voie des pentoses
phosphates
Glucose-6-phosphatase
24 Dans l'hépatocyte et la cellule ß pancréatique, la phosphorylation du glucose est catalysée principalement par la glucokinase ou hexokinase de type IV. Cette hexokinase possède des propriétés enzymatiques particulières par rapport aux autres hexokinases présentes dans ces cellules. La plus remarquable est sa faible affinité pour le glucose (Km d'environ 12 mM versus 0,1-0,001 pour les autres hexokinases). Cette enzyme contrairement aux autres hexokinases n'est pas inhibée par son produit de réaction, le glucose-6-phosphate, et son activité présente une courbe de saturation sigmoïde avec un point d'inflexion proche de la glycémie normale (5 mM glucose) (Iynedjian, 1993). Ces caractéristiques lui confèrent la capacité de répondre rapidement à des variations de concentrations intracellulaires en glucose par des modifications de son activité. Par ailleurs, les capacités de transport de glucose par GLUT2 étant 100 fois plus importantes aux capacités de phosphorylation du glucose par la glucokinase, la synthèse du glucose-6-phosphate devient l'étape limitante dans l'utilisation du glucose. Ces caractéristiques permettent à la glucokinase d'agir comme un senseur du glucose dans l'hépatocyte et les cellules ß du pancréas en modulant la synthèse de glucose-6-phosphate destiné à la glycolyse ou à la synthèse de glycogène en fonction de la glycémie (Matschinsky et al., 1993) (figure 4).
Ainsi, en période post-absorptive lorsque la glycémie est basse, les caractéristiques cinétiques de la glucokinase empêchent le foie d'utiliser le glucose au profit d'autres tissus comme le cerveau qui en dépendent.
Le rôle clé de la glucokinase dans le contrôle de l'homéostasie glucidique par le foie a été confirmé par la surexpression de la glucokinase dans des hépatocytes isolés et dans des cellules d'hépatome (O'Doherty et al., 1996; Valera & Bosch, 1994) ainsi que dans le foie de souris transgéniques (Ferré et al., 1996a; Hariharan et al., 1997; Niswender et al., 1997b).
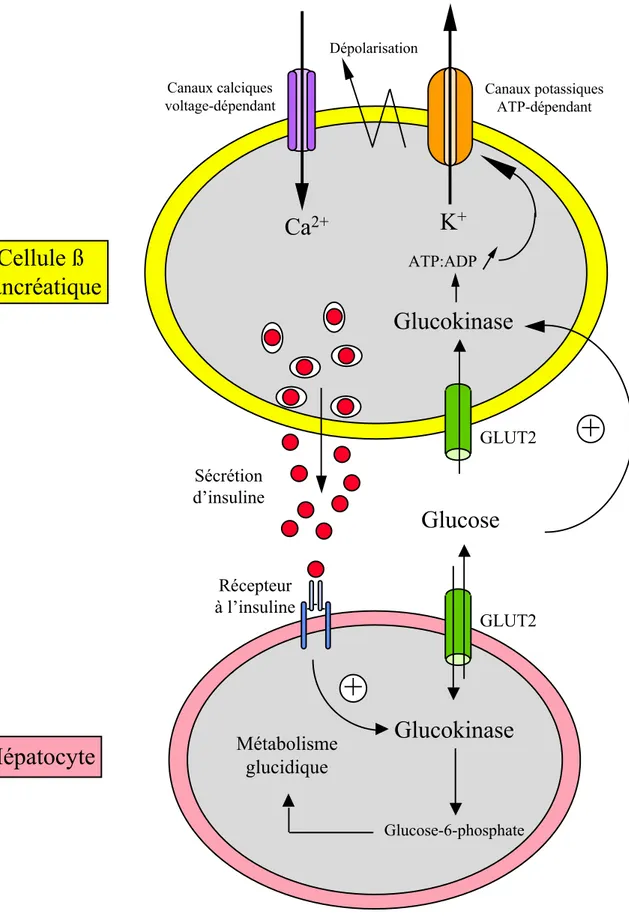
Rôle de la glucokinase dans la sécrétion d'insuline par les cellules ß du pancréas:
La sécrétion d'insuline par les cellules ß du pancréas en réponse à une augmentation de la glycémie est couplée au métabolisme du glucose. Le glucose entre dans la cellule par le transporteur GLUT2 de façon non limitante puis est phosphorylé par la glucokinase avant d'être catabolisé via la glycolyse et le cycle de Krebs. L'ATP formé au cours de ces réactions entraîne une augmentation du rapport ATP/ADP intracellulaire provoquant la fermeture de
Cellule ß
pancréatique
Hépatocyte
Glucose
Glucokinase
K
+Ca
2+ Glucose-6-phosphate Métabolisme glucidique+
Glucokinase
+
ATP:ADP GLUT2 GLUT2 Sécrétion d’insuline Récepteur à l’insuline Canaux potassiques ATP-dépendant Canaux calciques voltage-dépendantFigure 4: Représentation schématique du rôle senseur de la glucokinase dans l’homéostasie glucidique.
L’expression du gène de la glucokinase est induite par le glucose dans les cellules ! du pancréas tandis que dans le foie, elle est induite par l’insuline indépendamment de la présence de glucose. La glucokinase pancréatique intervient dans la régulation de la sécrétion de l’insuline et la glucokinase hépatique stimule le métabolisme glucidique dans le foie (glycolyse, voie des pentoses phosphates, glycogénogenèse).
26 canaux potassiques ATP-dépendants. La fermeture de ces canaux génère une dépolarisation de la membrane plasmique et active l'ouverture de canaux calciques voltage-dépendants aboutissant à l'entrée massive d'ions calcium extracellulaires dans la cellule. Finalement, cet influx d'ions calcium stimule l'exocytose de granules dans lesquels est stockée l'insuline libérant ainsi l'hormone dans la circulation via la veine porte. Cette sécrétion d'insuline est proportionnelle à l'entrée du glucose dans la cellule et de fait à la glycémie (figure 4).
Ce rôle critique de senseur du glucose de la glucokinase dans la sécrétion de l'insuline par la cellule ß pancréatique a été confirmé par plusieurs arguments expérimentaux. Par exemple, l'expression constitutive de l'hexokinase de levure qui possède une faible affinité pour le glucose dans les cellules ß de souris transgéniques entraîne une augmentation de la sécrétion basale d'insuline et une hypoglycémie (Epstein et al., 1992). Inversement, chez la souris l'invalidation fonctionnelle du gène de la glucokinase dans les cellules ß entraîne un diabète sévère suivi de la mort des souriceaux homozygotes quelques jours après la naissance (Bali et al., 1995; Grupe et al., 1995; Postic et al., 1999; Terauchi et al., 1995).
Glucokinase et diabète:
Le diabète non insulino-dépendant (DNID) est une affection métabolique fréquente caractérisée par une détérioration de la sécrétion d'insuline en réponse au glucose et par une résistance à l'insuline des tissus cibles de cette hormone, incluant une production de glucose hépatique exagérée à jeun. Ces deux défauts contribuent au développement d'une hyperglycémie en période post-absorptive. L'étiologie du DNID implique des facteurs génétiques et environnementaux. Le DNID est considéré comme une maladie multigénique, cependant il existe quelques rares formes de DNID monogéniques.
Le rôle central de la glucokinase dans l'utilisation du glucose dans l'hépatocyte et dans la cellule ß a conduit à l'hypothèse que des mutations du gène de la glucokinase entraînant une altération de l'activité de l'enzyme pourraient être impliquées dans le diabète. Chez l'homme, la localisation chromosomique du gène de la glucokinase (7p13) (Matsutani et al., 1992; Nishi et al., 1992) et la caractérisation de plusieurs microsatellites polymorphes (Matsutani et al., 1992; Nishi et al., 1992; Tanizawa et al., 1992) ont permis de montrer une liaison du gène de la glucokinase avec certaines formes familiales
de DNID (Froguel et al., 1992), appelées MODY (Maturity-Onset Diabetes of the Young). Le MODY se caractérise par une transmission autosomale dominante et monogénique, et par un développement précoce du diabète (avant 25 ans). L'analyse du gène de la glucokinase chez des familles atteintes de MODY a permis d'identifier des mutations ponctuelles dans des régions importantes pour l'activité de l'enzyme. A ce jour, plus de 80 mutations différentes ont été rapportées dans le gène de la glucokinase à l'origine de MODY (Blanché et al., 1997; Velho et al., 1997). Les effets de quelques unes de ces mutations sur l'activité de la glucokinase ont été analysés par expression de protéines mutantes dans un système bactérien (Gidh-Jain & al, 1993; Takeda et al., 1993). Toutes les protéines mutantes étudiées ont une Vmax et/ou une affinité pour le glucose diminuées. Les conséquences cliniques de ces mutations chez les patients atteints de MODY sont: une altération de la sécrétion d'insuline en réponse au glucose par les cellules ß (Velho et al., 1992), une diminution de la synthèse de glycogène et une augmentation de la gluconéogenèse dans le foie (Velho et al., 1996).
L'invalidation fonctionnelle du gène de la glucokinase dans le foie et/ou dans les cellules ß du pancréas ont permis d'obtenir des modèles animaux de DNID de type MODY (chez les animaux hétérozygotes GK+/-) (Bali et al., 1995;
Grupe et al., 1995; Postic et al., 1999; Terauchi et al., 1995). Ces modèles ont été utilisés pour comprendre la physiopathologie de ce type de diabète. Récemment, une stratégie cre-loxP permettant d'éliminer spécifiquement l'expression de la glucokinase dans le foie ou dans les cellules ß pancréatiques a été utilisée chez la souris pour déterminer le rôle respectif de cette enzyme dans ces deux tissus (Postic et al., 1999). Les résultats obtenus confirment le rôle crucial de la glucokinase dans la sécrétion d'insuline par les cellules ß et son absence est la principale cause de l'hyperglycémie dans le MODY. L'absence d'expression de la glucokinase restreint au foie a permis de montrer que la glucokinase hépatique joue également un rôle direct dans l'établissement de l'hyperglycémie dans le MODY.
Chez des souris transgéniques traitées à la streptozotocine, la surexpression de la glucokinase au niveau hépatique prévient l'apparition d'un diabète alors que chez des souris sauvages la streptozotocine provoque une hyperglycémie sévère (Ferré et al., 1996b). Chez les souris sauvages diabétiques, l'expression de la glucokinase hépatique est très faible, la glycolyse et la synthèse de glycogène sont diminuées alors que la gluconéogenèse est augmentée dans le foie. Par contre, chez les souris transgéniques surexprimant
28 la glucokinase traitées à la streptozotocine, le foie conserve sa capacité à utiliser le glucose (glycolyse, glycogénogenèse) et à bloquer la production de glucose (gluconéogenèse). Il en résulte que la glycémie de ces animaux transgéniques reste normale. De même dans des hépatocytes isolés de rats Zucker diabétiques et obèses, le métabolisme du glucose, en particulier la glycolyse et la synthèse de glycogène, est altéré mais la surexpression de la glucokinase par l'utilisation d'un adénovirus recombinant restaure l'utilisation et le stockage du glucose dans ces cellules (Seoane et al., 1999). Ces observations soulignent une nouvelle fois l'importance de la glucokinase hépatique au cours du diabète.
Le MODY représente 5 à 10 % des diabètes. Le gène impliqué dans le MODY le plus fréquent est celui de la glucokinase qu'on appelle aussi MODY2, il représente en France environ 60 % des familles MODY. L'étude génétique des familles MODY a aussi montré l'implication de gènes codant pour des facteurs de transcription dans ce type de diabète (Froguel, 1999; Velho & Froguel, 1998). Une mutation du gène codant le facteur HNF-1! (Hepatocyte Nuclear Factor 1 alpha) est responsable de la forme MODY3, HNF-1! est un facteur de transcription homéotique exprimé en particulier dans le foie et le pancréas endocrine (Yamagata et al., 1996a). La forme MODY1 est due à une mutation du gène HNF-4! (Hepatocyte Nuclear Factor 4 alpha) qui code pour un facteur de transcription appartenant à la superfamille des récepteurs nucléaires (Yamagata et al., 1996b). Enfin, récemment d'autres gènes MODY codant également pour des facteurs de transcription ont été décrits. C'est le cas d'HNF-1ß, un facteur d'hétérodimérisation d'HNF-1 (Horikawa et al., 1997); et d'IPF1 (Insulin Promoter Factor 1), un facteur de transcription spécifique de l'îlot de Langerhans impliqué dans le développement du pancréas (Stoffers et al., 1997).
Régulation à court terme:
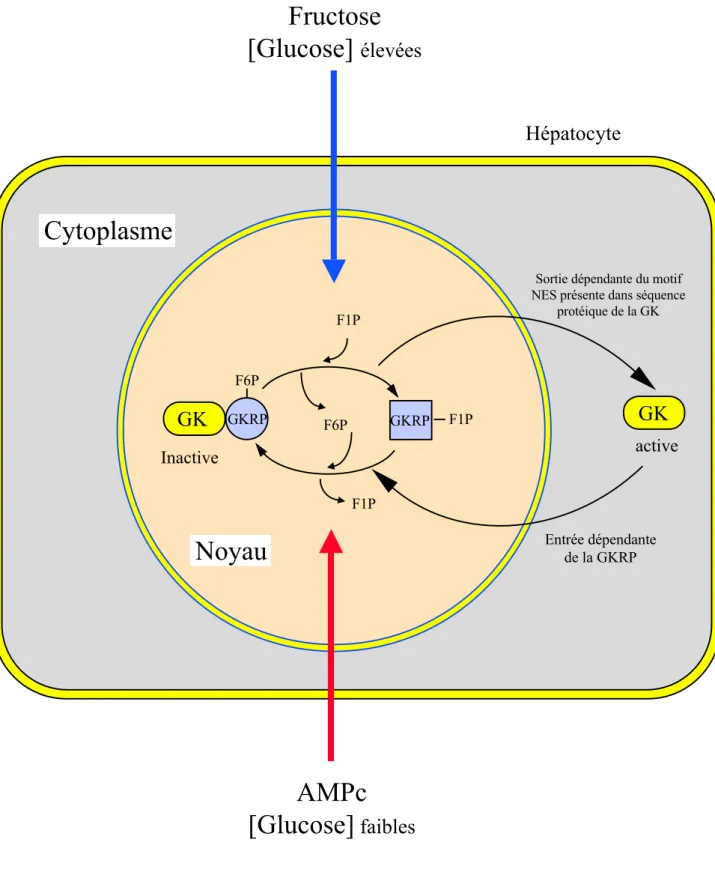
Dans le foie, l'activité de la glucokinase est contrôlée à court terme par une protéine régulatrice de 62 kda capable de lier le fructose-6-phosphate (F6P) et le fructose-1-phosphate (F1P) au niveau d'un même site (Van Schaftingen et al., 1994). La liaison avec le F6P permet à cette protéine de lier la glucokinase et d'inhiber son activité. Lorsque le F1P vient remplacer le F6P, la protéine régulatrice libère la glucokinase levant ainsi son inhibition (figure 5). Ce mécanisme permet d'expliquer l'effet stimulateur du fructose sur la phosphorylation du glucose observé depuis longtemps dans les hépatocytes (Clark et al., 1979). A l'état post-absorptif, le fructose étant absent de la
Figure 5: Mécanisme de régulation à court terme de l’activité de la glucokinase et de sa localisation cellulaire par la protéine régulatrice GKRP.
La protéine régulatrice GKRP (glucokinase regulatory protein) est présente dans le noyau. En présence d’AMPc ou de faibles concentrations en glucose, la protéine GKRP lie le fructose-6-phosphate (F6P) et forme un complexe avec la glucokinase (GK). La GK est alors séquestrée dans le noyau et est inactive. L’entrée de la GK dans le noyau est dépendante de la GKRP. En présence de fructose ou de fortes concentrations en glucose, la protéine GKRP lie le fructose-1-phosphate (F1P) et le complexe GKRP/GK se dissocie. La GK est alors transloquée vers le cytoplasme où elle est active. La sortie de la GK du noyau est dépendante d’une séquence d’exportation nucléaire (NES) présente dans la protéine GK.
GK GKRP GKRP F6P F1P Inactive F6P F1P F1P GK active
Fructose
[Glucose]
élevéesAMPc
[Glucose]
faiblesSortie dépendante du motif NES présente dans séquence
protéique de la GK Entrée dépendante de la GKRP
Noyau
Cytoplasme
Hépatocyte30 circulation sanguine, le niveau basal de F6P inhibe la glucokinase via la protéine régulatrice dans le foie. Après un repas contenant du fructose et du glucose, le fructose arrivant au foie est rapidement phosphorylé en F1P par la fructokinase. Ce F1P abolit l'inhibition exercée par la protéine régulatrice sur la glucokinase, ce qui a pour conséquence une augmentation de l'utilisation du glucose par l'hépatocyte.
La protéine régulatrice de la glucokinase (GKRP) est également responsable de la localisation intracellulaire de la glucokinase qui varie en fonction des conditions métaboliques et hormonales. La GKRP est exprimée exclusivement dans le noyau des hépatocytes (Brown et al., 1997b; de la Iglesias et al., 1999). En présence d'AMPc ou de faibles concentrations en glucose, la glucokinase est séquestrée dans le noyau par la GKRP. En présence de fortes concentrations en glucose ou en présence de fructose, le complexe glucokinase/GKRP se dissocie et la glucokinase est transloquée vers le cytoplasme tandis que la GKRP reste dans le noyau (Brown et al., 1997b; de la Iglesias et al., 1999) (figure 5). La glucokinase ne possède pas de séquence d'adressage nucléaire NLS (Nuclear Localization Sequence) propre. Dans un système cellulaire hétérologue dépourvu de glucokinase et de GKRP (cellules HeLa), il a été montré que l'entrée de la glucokinase dans le noyau est dépendant de la présence de la GKRP (Shiota et al., 1999). L'exportation de la glucokinase après dissociation avec la GKRP du noyau vers le cytoplasme est due à la présence d'un signal d'exportation nucléaire NES riche en leucines présent au niveau de la séquence protéique de la glucokinase (300-ELVRLVLLKLV-310) (Shiota et al., 1999). Le rôle de cette séquestration nucléaire reste inconnu, cependant il a été suggéré que ce mécanisme pourrait augmenter la demi-vie de la glucokinase en la protégeant de la dégradation protéolytique en période post-absorptive. Cette hypothèse a récemment été confirmée par l'invalidation du gène de la GKRP chez des souris (Farrelly et al., 1999).Chez ces animaux GKRP-/-, l'absence de la protéine GKRP entraîne une diminution parallèle des quantités et de l'activité de la glucokinase hépatique, indiquant que la GKRP protège la glucokinase de la dégradation. Cette séquestration nucléaire de la glucokinase pourrait également permettre de minimiser le cycle futile glucose/glucose-6-phosphate à jeun (Brown et al., 1997b).
Régulation à long terme:
Le gène de la glucokinase est contrôlé par deux promoteurs alternatifs séparés par 35 kb, celui en amont est spécifique des cellules ß pancréatiques et l'autre en aval est spécifique du foie (Postic et al., 1995). La présence de deux promoteurs spécifiques permet une régulation différentielle dans ces deux tissus. L'isoforme pancréatique diffère de l'isoforme hépatique par les 15 acides aminés N-terminaux.
Dans le foie, l'expression de la glucokinase est contrôlée par l'état nutritionnel. A jeun, l'expression de la glucokinase est effondrée et la réalimentation avec un régime hyperglucidique entraîne une rapide et massive accumulation des ARNm glucokinase (Iynedjian, 1993). Dans l'hépatocyte, la transcription du gène de la glucokinase est induite par l'insuline tandis que le glucagon via l'AMPc inhibe cette transcription, cet effet est dominant sur celui de l'insuline (Iynedjian, 1993). L'induction par l'insuline nécessite une synthèse protéique. Dans l'hépatocyte, le glucose ne semble pas moduler l'expression de la glucokinase (Matsuda et al., 1990; Nouspikel & Iynedjian, 1992) contrairement à la cellule ß du pancréas, où l'expression de la glucokinase est contrôlée positivement par le glucose (Tiedge & Lenzen, 1995; Tiedge et al., 1999). La triiodothyronine est capable également d'induire l'expression de la glucokinase dans l'hépatocyte (Narkewicz et al., 1990).
En résumé, l'insuline joue un rôle essentiel dans l'activation transcriptionnelle du gène de la glucokinase au niveau du foie. Les données concernant les éléments cis-et trans-régulateurs du gène glucokinase seront détaillés dans la 3éme partie de l'introduction.
Rôle de la glucokinase dans le contrôle du métabolisme glucidique hépatique: La glucokinase par ses caractéristiques enzymatiques et sa position au carrefour des différentes voies du métabolisme glucidique (figure 3) contrôle par effet de masse le flux de la glycolyse, de la voie des pentoses phosphates, de la glycogénogenèse et de la lipogenèse. La glucokinase a également un effet direct sur la régulation du métabolisme glucidique. Le glucose-6-phosphate produit par cette enzyme est capable par des mécanismes allostériques d'activer la glycogénogenèse (Seoane et al., 1996; Wera et al., 1996). De plus, le glucose est capable en présence ou en absence d'insuline de moduler la transcription de plusieurs gènes impliqués dans l'homéostasie glucidique soit de façon positive ou soit de façon négative. Or, la phosphorylation du glucose en
glucose-6-32 phosphate par la glucokinase est une étape indispensable à sa fonction d'effecteur transcriptionnel. Les gènes activés par le glucose en présence d'insuline sont impliqués dans la glycolyse et la lipogenèse, c'est le cas par exemple du gène de la L-pyruvate kinase, de la protéine S14, de l'acétyl-CoA carboxylase et de la synthase des acides gras. Le gène de la PEPCK qui fait partie de la gluconéogenèse est inhibé par le glucose indépendamment de la présence d'insuline. L'effet du glucose sur ces gènes sera détaillé au cours de cette introduction.
b/ L-pyruvate kinase
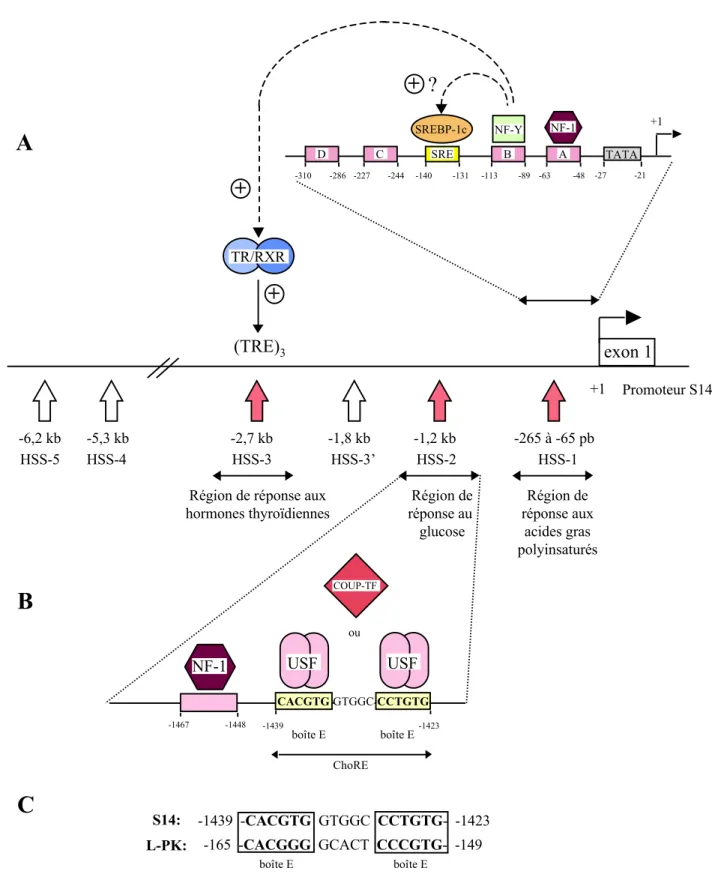
La pyruvate kinase (EC 2.7.1.40) catalyse la dernière étape de la glycolyse en transformant le phosphoénolpyruvate en pyruvate. Chez les mammifères, la pyruvate kinase existe sous quatre isoformes différentes appelées M1, M2, L et R (Yamada & Noguchi, 1999a). L'isoforme M1 est présente dans le muscle squelettique, le coeur et le cerveau; l'isoforme M2 est présente chez le foetus et la plupart des tissus adultes. L'isoforme L est exprimée principalement dans le foie mais elle est aussi présente dans le rein, l'intestin grêle et les cellules ß pancréatiques. L'isoforme R (ou L') est restreinte aux érythrocytes. Les isoformes M1/M2 et L/R sont codées par deux gènes différents, PKM et PKL respectivement. Le gène PKL contient 12 exons et 11 introns (Noguchi et al., 1987). Le premier exon (exon R) et le second exon (exon L) codent pour les séquences 5'-non codantes et N-terminales qui sont spécifiques des isoformes R et L respectivement. Les autres exons sont communs aux deux isoenzymes. Les isoformes R et L sont produites à partir du gène PKL via des promoteurs tissu-spécifiques situés devant les exons R et L (figure 10). Ces deux promoteurs sont espacés de 500 pb (Cognet et al., 1987; Noguchi et al., 1987). Le promoteur L contient une boîte TATA en position -26 pb et une boîte CAAT dégénérée en position -49 pb.
Régulation à court terme:
L'activité de la pyruvate kinase hépatique (L-PK) est contrôlée par des effecteurs allostériques et par des modifications covalentes par phosphorylation/déphosphorylation. La L-PK est activée par le fructose-6-phosphate et inhibée par l'alanine et l'ATP. Le glucagon via l'AMPc stimule la phosphorylation de la L-PK par la protéine kinase A pour inhiber son activité,
alors que l'insuline active la L-PK par activation de protéines phosphatases qui vont déphosphoryler cette enzyme (Assimacopoulos-Jeannet & Jeanrenaud, 1990).
Régulation à long terme:
Régulation hormonale et nutritionnelle in vivo et ex vivo:
In vivo, la transcription du gène de la L-PK est contrôlée par le statut hormonal et nutritionnel. Chez l'animal à jeun, l'expression de la L-PK dans le foie est faible, par contre après un repas hyperglucidique la transcription du gène de la L-PK est fortement augmentée (Vaulont et al., 1986). De même, chez des rats diabétiques ou après une injection de glucagon, l'expression de la L-PK diminue dramatiquement alors que l'administration d'insuline à des rats diabétiques augmente l'accumulation des ARNm L-PK (Munnich et al., 1984; Noguchi et al., 1985). Le glucagon agit en inhibant la transcription et en augmentant la vitesse de dégradation des ARNm L-PK (Vaulont et al., 1986). Une surrénalectomie et une thyroïdectomie diminue l'expression de la L-PK (Munnich et al., 1984). Les hormones thyroïdiennes et glucocorticoïdes augmentent la stabilité des ARNm mais n'ont pas d'effet sur la transcription (Vaulont et al., 1986). Un régime contenant du fructose induit beaucoup plus rapidement l'expression de la L-PK qu'un régime contenant du glucose (Munnich et al., 1987). Enfin, l'expression du gène de la L-PK est diminuée dans le foie de rats nourris avec un régime riche en carbohydrates contenant des acides gras polyinsaturés, tels que l'acide eicosapentaénoïque ou l'acide docosahexaénoïque (Jump et al., 1994; Liimatta et al., 1994).
Dans l'hépatocyte isolé, l'insuline et le glucose ensemble stimulent la transcription du gène de la L-PK et augmentent fortement la stabilité des ARNm L-PK. Séparément ces deux facteurs sont incapables d'exercer leur effet inducteur. La cycloheximide, un inhibiteur de la synthèse protéique bloque cette activation (Decaux et al., 1989). Le glucagon via l'activation de la protéine kinase A par l'AMPc inhibe de façon dominante l'activation par l'insuline et le glucose (Decaux et al., 1989). De même, l'activation de la protéine kinase dépendante de l'AMP (AMPK) inhibe la transcription du gène de la L-PK dans des hépatocytes en culture primaire (Leclerc et al., 1998).
34 En résumé dans le foie, le glucose et l'insuline jouent un rôle majeur dans l'induction du gène de la L-PK tandis que l'AMPc est responsable de son inhibition. Le mécanisme d'activation transcriptionnel du gène L-PK par le glucose et l'insuline sera étudié en détail dans la 2ème partie de cette introduction.
c/ Phosphoénolpyruvate carboxykinase
La phosphoénolpyruvate carboxykinase cytosolique (PEPCK) (EC 4.1.1.32) catalyse l'étape limitante de la gluconéogenèse hépatique permettant la conversion de l'oxaloacétate en phosphoénolpyruvate. Aucune modification covalente ou allostérique pouvant contrôler à court terme l'activité de la PEPCK n'a été décrite. Seule la balance entre la synthèse et la dégradation de l'enzyme détermine le niveau d'activité de la PEPCK. La PEPCK a une demie-vie très courte de 6-8h (Hopgood et al., 1973). La régulation de la PEPCK se situe essentiellement à un niveau transcriptionnel.
Régulation hormonale et nutritionnelle du gène de la PEPCK
La transcription du gène PEPCK est activée au cours du jeûne et inhibée par un régime hyperglucidique. Dans le foie, les principaux facteurs hormonaux qui augmentent l'expression du gène de la PEPCK sont le glucagon via l'AMPc, les glucocorticoïdes et les hormones thyroïdiennes alors que l'insuline inhibe de façon dominante cette expression (Granner et al., 1983). Les effets opposés de l'AMPc et de l'insuline sont l'axe de régulation majeur de cette expression. L'AMPc stabilise les ARNm de la PEPCK (Hod & Hanson, 1988). Les variations du niveau de transcription du gène PEPCK sont très rapides. Par exemple, l'injection d'AMPc à des rats nourris avec un régime hyperglucidique augmente de 10 fois l'expression du gène de la PEPCK en 20 min. (Iynedjian & Hanson, 1977). Au contraire, l'addition d'insuline à des cellules d'hépatome inhibe en 30 min. la transcription du gène de la PEPCK de moitié (Granner et al., 1983).
Les glucocorticoïdes ont un effet direct et rapide (30 min.) sur la transcription du gène de la PEPCK dans des cellules d'hépatome (Sasaki et al., 1984) et in vivo (Lamers et al., 1982). Dans l'hépatocyte isolé, ces hormones à des concentrations physiologiques n'auraient pas d'effet direct sur l'expression du gène PEPCK mais aurait essentiellement un effet permissif sur l'induction par le glucagon (Runge et al., 1991). Les glucocorticoïdes agissent également à un
niveau post-transcriptionnel en stabilisant les ARNm de la PEPCK (Petersen et al., 1989).
Les hormones thyroïdiennes augmentent la transcription du gène de la PEPCK chez des animaux thyroïdectomisés (Loose et al., 1985). Dans la lignée d'hépatome HepG2, il a été montré que la triiodothyronine (T3) a un effet synergique sur l'activation de la transcription par l'AMPc (Giralt et al., 1991).
Facteurs cis- et trans-régulateurs:
L'étude du promoteur du gène de la PEPCK chez des souris transgéniques a permis de montrer que la région -460 à +73 pb contient les séquences tissu-spécifiques cruciales pour l'expression de ce gène dans le foie ainsi que les différents éléments de la réponse hormonale et nutritionnelle (McGrane et al., 1988; McGrane et al., 1990). L'analyse de cette séquence a permis de localiser les éléments de réponse à l'AMPc, aux glucocorticoïdes, aux hormones thyroïdiennes, à l'acide rétinoïque et à l'insuline (Hanson & Reshef, 1997; Lemaigre & Rousseau, 1994). Ce fragment contient également les séquences permettant l'expression spatiale de la PEPCK dans le foie restreinte aux cellules périportales, et son expression au cours du développement (McGrane et al., 1990).
L'activation du promoteur PEPCK par les glucocorticoïdes et l'AMPc implique des unités de réponse hormonale constituées de plusieurs éléments cis associés à différents facteurs de transcription (Hanson & Reshef, 1997). L'unité de réponse aux glucocorticoïdes (GRU) contient deux sites de liaison pour le récepteur aux glucocorticoïdes (GRE) et quatre éléments accessoires capables de fixer les facteurs auxiliaires HNF-4, HNF-3, COUP-TF et C/EBPß. L'unité de réponse à l'AMPc (CRU) comprend un site CRE (cAMP Regulatory Element) capable de fixer in vitro différents facteurs, tels que CREB, C/EBP, DBP (D-binding protein) ou AP1 (Fos/Jun). L'activation maximale du promoteur PEPCK par l'AMPc requière l'élément cis P3(I) capable de lier des membres de la famille C/EBP. L'action des différents composants des unités de réponse aux glucocorticoïdes, à l'AMPc et aux hormones thyroïdiennes est coordonnée par la protéine CBP (CREB-binding protein) pour stimuler la transcription du gène de la PEPCK (Leahy et al., 1999).
L'inhibition du gène PEPCK par l'insuline et le glucose sera développée dans les deux parties suivantes de l'introduction.
36 3/ La lipogenèse
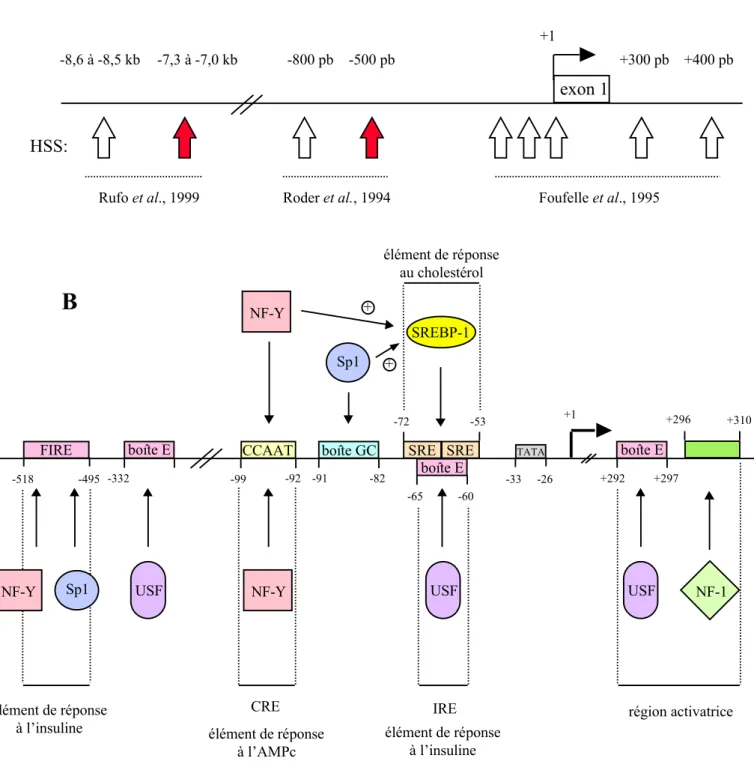
La lipogenèse au sens large ou voie de biosynthèse des lipides est la voie métabolique qui permet la synthèse de novo de triglycérides à partir du glucose ou d'un de ces dérivés, tels que le lactate et le pyruvate. La lipogenèse au sens strict correspond à la biosynthèse d'acides gras saturés, comme l'acide palmitique, à partir de l'acétyl-CoA, du NADPH comme équivalent réduit et d'ATP. Les réactions de la synthèse d'acides gras de novo sont catalysées par deux enzymes, l'acétyl-coenzyme A carboxylase (ACC) et la synthase des acides gras (FAS pour "Fatty Acid Synthase").
a/ Rôle de lipogenèse
Chez les animaux supérieurs, la capacité de mise en réserve du glucose sous forme de glycogène étant très limitée, l'un des rôles principaux de la lipogenèse est de transformer le glucose ingéré en excès par rapport aux besoins caloriques immédiats en acides gras. Ces acides gras sont estérifiés avec le glycérol-3-phosphate pour former les triglycérides que le tissu adipeux peut accumuler en grande quantité, constituant ainsi des réserves énergétiques importantes. Cette fonction est particulièrement importante chez les animaux hibernants ou migrateurs, ou effectuant de longues périodes de jeûne. L'avantage des triglycérides comme molécules énergétiques de réserve par rapport au glycogène est leur haut rendement énergétique. Les triglycérides mettent en réserve six fois plus d'énergie que le glycogène car ils sont anhydres et plus réduits.
La lipogenèse joue également un rôle structural et fonctionnel important puisqu'elle fournit des acides gras entrant dans la composition de la bicouche lipidique des membranes cellulaires. Les acides gras interviennent aussi dans certaines modifications post-traductionnelles (myristoylation, palmitoylation, isoprénylation...). La fixation d'un acide gras sur certaines protéines permet à celles-ci de s'ancrer dans les membranes. Après modification les acides gras peuvent également servir de signal de transduction intracellulaire (diacyl glycérol...) ou bien de signal extracellulaire (prostaglandines, leucotriènes...).
b/ Sites de la lipogenèse
La lipogenèse a lieu dans tous les tissus, mais elle est particulièrement intense dans le foie, dans les tissus adipeux blancs et bruns et dans la glande mammaire allaitante des animaux supérieurs. Cependant, l'intensité de la lipogenèse dans ces tissus varie en fonction des espèces. Chez les rongeurs, la lipogenèse a lieu à la fois dans le foie et le tissu adipeux de façon à peu près équivalente. Chez le porc, le cobaye ou les ruminants, elle s'effectue surtout dans le tissu adipeux. Au contraire chez les oiseaux, la lipogenèse a lieu exclusivement dans le foie. De même chez l'homme, il semble que la lipogenèse soit principalement hépatique (Hellerstein et al., 1996).
Outre son rôle énergétique, dans d'autres organes la synthèse des acides gras intervient dans des fonctions mécaniques ou structurales. Par exemple au niveau de la peau, la synthèse d'acides gras joue un rôle important dans le maintien de la perméabilité de la barrière de l'épiderme. Au niveau des poumons, la biosynthèse des acides gras intervient dans la production du surfactant. Au niveau du système nerveux, la synthèse des acides gras par les cellules gliales est importante dans la myélinisation des axones.
c/ Vue globale de la lipogenèse
Au cours de l'absorption d'un régime hyperglucidique, le glucose ingéré en excès est mis en réserve sous forme de glycogène de manière limitée, et le glucose restant est orienté vers la synthèse de novo d'acides gras libres, qui une fois estérifiés en triglycérides sont stockés dans le tissu adipeux blanc. La figure 6 résume l'ensemble des voies métaboliques impliquées dans la lipogenèse, permettant la synthèse de triacylglycérol à partir du glucose. Le glucose entre dans la cellule par diffusion facilitée grâce aux transporteurs de glucose GLUT. Dans le foie, le glucose est transporté par l'isoforme GLUT2 et dans le tissu adipeux par l'isoforme GLUT4. (Olson & Pessin, 1996). Dans la cellule, le glucose emprunte la voie de la glycolyse pour aboutir à la formation du pyruvate. La première étape de la glycolyse permettant la phosphorylation du glucose en glucose-6-phosphate est catalysée par l'hexokinase II dans l'adipocyte et par la glucokinase (hexokinase IV) dans l'hépatocyte. Le pyruvate entre dans la mitochondrie pour être transformé en acétyl-CoA par la pyruvate déshydrogénase, puis est converti en citrate pour être transporté vers le cytoplasme. Dans le cytoplasme, le citrate est reconverti en acétyl-CoA par
Figure 6: Représentation schématique de la lipogenèse dans le foie.
Les principales étapes de la synthèse des triglycérides et du NADPH à partir du glucose sont représentées. Les gènes des enzymes encadrées sont induits par un régime riche en glucides chez le rat ou la souris. Sont également induits mais pas indiqués sur le schéma: Les gènes de la 6-phosphofructo-2 kinase/fructo-2,6-diphosphatase, l’acyl-CoA synthase et la protéine S14. Abréviations: GLUCOSE-6-Pase, glucose-6-phosphatase; G-6-PDH, glucose-6-phosphate déshydrogénase; 6-PGDH, 6-phosphogluconate déshydrogénase; 6PF-1-K, 6-phosphofructo-1-kinase; ApoE, apolipoprotéine E; G3P, glycéraldéhyde-3-phosphate; DHAP, dihydroxyacétone phosphate; PEP, phosphoénolpyruvate; OAA, oxaloacétate; VLDL, very low density lipoprotein. (Adapté de Towle et al., 1997)
glucose GLUT2 glucose GLUCOKINASE GLUCOSE-6-Pase glucose-6-P fructose-6-P fructose-1,6-P G3P DHAP PEP pyruvate malate malate
pyruvate acétyl-CoA OAA
citrate citrate acétyl-CoA malonyl-CoA palmitoyl-CoA ATP-CITRATE LYASE ACETYL-CoA CARBOXYLASE
SYNTHASE DES ACIDES GRAS
oléoyl-CoA stéaroyl-CoA STEAROYL-CoA DESATURASE Triacylglycérol glycérol-3-P GLYCEROL-PHOSPHATE ACYLTRANSFERASE 6-P-gluconate ribulose-5-P xylulose-5-P G-6-PDH 6-PGDH NADP+ NADP+ NADP+ NADPH NADPH NADPH NAD+ NADH VLDL ApoE 6PF-1-K ALDOLASE
L-PYRUVATE KINASE ENZYME MALIQUE
NADPH
NADP+
sang
Mitochondrie
l'ATP citrate lyase. L'acétyl-CoA est ensuite utilisé comme substrat pour la synthèse d'acides gras par l'ACC et la FAS. La FAS utilise le NADPH comme équivalent réduit pour la synthèse de palmitate. Le NADPH est généré par l'enzyme malique et par la voie des pentoses phosphates au cours des réactions catalysées par la glucose-phosphate déshydrogénase et la 6-phosphogluconate déshydrogénase. Les acides gras ainsi formés peuvent être allongés et désaturés avant d'être estérifiés avec le glycérol-3-phosphate par la glycérol-3-phosphate acyltransférase pour former les triglycérides. Dans le foie, ces triacylglycérols sont associés à des lipoprotéines pour être transportés sous forme de VLDL vers les tissus périphériques, en particulier le tissu adipeux.
d/ Contrôle de la lipogenèse
La quantité et la qualité des substrats énergétiques fournis par l'alimentation étant variable, la synthèse d'acides gras et de triglycérides est finement contrôlée par le statut hormonal et nutritionnel. Ainsi, l'état nutritionnel de l'organisme est un facteur de contrôle essentiel de la lipogenèse dans le foie et le tissu adipeux. La consommation d'un régime riche en glucides stimule la lipogenèse, au contraire le jeûne ou la consommation d'un régime riche en lipides et pauvre en glucides inhibe cette voie métabolique. En plus de fournir des substrats lipogéniques, l'absorption d'un repas hyperglucidique modifie les concentrations plasmatiques des hormones pancréatiques (insuline et glucagon). L'insuline qui augmente au cours d'un repas hyperglucidique contrôle positivement la lipogenèse. Au contraire, le glucagon qui augmente au cours du jeûne inhibe la synthèse des acides gras. Ainsi, le modèle animal à jeun versus animal à jeun renourri avec un régime hyperglucidique est utilisé pour obtenir une activité lipogénique minimale et maximale respectivement, afin d'étudier les variations d'expression des gènes codant pour les enzymes de cette voie métabolique.
La figure 6 montre l'ensemble des gènes impliqués dans la synthèse des triglycérides à partir du glucose induits par le passage d'un état à jeun à l'absorption d'un régime hyperglucidique. Dans la majorité des cas, cette induction résulte d'une augmentation de la transcription de ces gènes.
De nombreux gènes impliqués dans la biosynthèse des triglycérides subissent une régulation nutritionnelle et hormonale. Dans les paragraphes