Nouveaux marqueurs pronostiques dans la sténose
aortique à bas débit
Thèse
Abdellaziz Dahou
Doctorat en médecine expérimentale
Philosophiae Doctor (Ph. D.)
Québec, Canada
Nouveaux marqueurs pronostiques dans la sténose
aortique à bas débit
Thèse
Abdellaziz Dahou
Sous la direction de :
Philippe Pibarot, directeur de recherche
Marie-Annick Clavel, codirectrice de recherche
III
Résumé
La sténose aortique (SA) est la valvulopathie la plus fréquente dans les pays industrialisés. La SA avec bas débit cardiaque n’est pas une condition rare. Environ 5-10% des patients ayant une SA sévère présentent un état de bas débit cardiaque avec fraction d’éjection ventriculaire gauche (FEVG) diminuée (<50%; c.-à-d. bas débit classique), et environ 10-25% présentent une SA à bas débit (SABD) malgré la présence d’une FEVG préservée (>50%; c.-à-d. bas débit paradoxal). La présence d’un faible débit cardiaque s’accompagne souvent d’un bas gradient avec une petite aire valvulaire aortique (AVA) ce qui peut fausser l’évaluation de la sévérité de la sténose et conduire à une mauvaise décision thérapeutique. Deux principaux défis se posent chez ces patients afin de guider le traitement : le premier est de différentier une SA vraiment sévère (SAVS) d’une SA pseudo-sévère (SAPS) et le deuxième est de quantifier avec précision les dommages myocardiques pour mieux stratifier le risque. Malheureusement, les paramètres traditionnels dérivés de l’échocardiographie de repos ou de stress qui sont utilisés pour évaluer la sévérité de la SA et la fonction cardiaque sont loin d’être optimaux. Par conséquent, la quantification de la sévérité de la maladie et la prise en charge thérapeutique peuvent être inappropriées dans une proportion non négligeable de ces patients.
L’objectif général de ce projet de doctorat est de déterminer quels sont, parmi les
facteurs échocardiographiques, électrocardiographiques, et sanguins ceux qui permettent de mieux préciser la sévérité de la SA et l’atteinte myocardique et prédire de façon indépendante la survenue de morbidité et mortalité. Le but ultime est d’améliorer les algorithmes de stratification du risque et de décision thérapeutique chez ces patients.
IV
Abstract
Aortic stenosis (AS) is the most common valvular heart disease in developed countries. Low-flow AS is not uncommon. Approximately, 5 to 10 % of patients with severe aortic stenosis have a low cardiac output with impaired left ventricular ejection fraction (LVEF<50%; i.e. classical low-flow), and about 10-25% have a low-flow AS despite preserved LVEF (> 50%, i.e. paradoxical low-flow). The presence of a low cardiac output is often accompanied by a low gradient and small aortic valve area (AVA) and can thus distort the assessment of AS severity and lead to non-adequate therapeutic decision. Two main challenges are posed by these patients. The first is to differentiate a truly severe AS from a pseudo-severe AS, i.e. a failing left ventricle unable to fully open valve slightly or moderately stenotic. This distinction is crucial because the aortic valve replacement will be beneficial only in the case of true-severe AS, according to the literature. The second challenge is to accurately quantify myocardial damage to better stratify the risk. Unfortunately, traditional parameters derived from rest or stress echocardiography that are used to assess the severity of AS and myocardial dysfunction are not adequate in low flow state. Therefore, quantification of the disease severity and the ensuing therapeutic management may not be appropriate in a large proportion of these patients
The general objective of this doctoral project is to determine which of the
echocardiographic, electrocardiographic, and blood biomarkers will allow us to better assess severity of AS and myocardial impairment and independently predict morbidity and mortality.The ultimate aim is to improve the algorithms of risk stratification and the therapeutic decision making in these patients.
V
Table des matières
Résumé ... III Abstract ... IV Liste des abréviations et des sigles ... X Dédicace ... XII Avant-propos ... XIII
Introduction ... 1
Chapitre 1 : La sténose aortique ... 3
1.1. Épidémiologie ... 3
1.2. Pathophysiologie ... 3
1.2.1 Pathogenèse de la sténose aortique calcifiante ... 4
1.2.2 Le retentissement sur la fonction cardiaque ... 8
1.2.3 Les facteurs de risque ... 11
1.3. Diagnostic et évaluation ... 13
1.3.1 Manifestations cliniques ... 13
1.3.2 Électrocardiogramme (ECG) ... 14
1.3.3 Échographie-Doppler cardiaque ... 16
1.3.4 Mesure de la calcification valvulaire par tomographie ... 19
1.3.5 Cathétérisme cardiaque ... 20
1.3.6 Autres méthodes ... 21
1.3.7 Biomarqueurs sanguins ... 22
1.4. Traitement ... 24
Chapitre 2 : La sténose aortique à bas débit et bas gradient... 26
2.1 SA à bas débit, bas gradient avec basse fraction d’éjection : le bas-débit – bas gradient classique ... 28
2.1.1 Difficultés diagnostiques et défis ... 29
2.1.2 Pronostic des patients porteurs d’une sténose aortique à bas débit avec fraction d’éjection abaissée ... 47
2.1.3 Amélioration de la stratification du risque ... 53
2.1.4 Prise en charge thérapeutique ... 56
2.1.5 Conclusion ... 58
2.2 La sténose aortique à bas débit, bas gradient avec fraction d’éjection préservée : le bas-débit paradoxal ... 60
VI
2.2.1 Pathophysiologie ... 60
2.2.2 Présentation clinique et échocardiographique ... 62
2.2.3 Diagnostic de sévérité de la SA ... 64
2.2.4 Pronostic des patients avec SABD paradoxal ... 68
2.2.5 Traitement... 69
2.2.6 Conclusion ... 70
Chapitre 3 : Hypothèses et objectifs ... 71
3.1 Objectifs ... 72
3.2 Hypothèses ... 73
Chapitre 4: article 1 ... 74
Tricuspid Regurgitation Is Associated With Increased Risk of Mortality in Patients With Low-Flow Low-Gradient Aortic Stenosis and Reduced Ejection Fraction ... 74
4.1 RÉSUMÉ ... 75 4.2 ABSTRACT ... 77 4.3 INTRODUCTION ... 79 4.4 METHODS ... 79 4.4.1 Study protocol ... 79 4.4.2 Clinical data ... 80 4.4.3 Doppler-Echocardiography ... 80 4.4.4 Statistical Analysis ... 80 4.5 RESULTS ... 81 4.5.1 Patient characteristics ... 81
4.5.2 Impact of tricuspid regurgitation on mortality ... 83
4.5.3 Impact of tricuspid regurgitation on 30-day mortality in patients treated by AVR ... 91
4.6 DISCUSSION ... 92
4.6.1 TR and late outcomes in LF-LG AS ... 92
4.6.2 TR and 30-day mortality in LF-LG AS ... 93
4.6.3 Clinical implications ... 94 4.6.4 Study limitations ... 94 4.7 CONCLUSION ... 95 4.8 Acknowledgments ... 95 4.9. Sources of Funding ... 95 4.10 Disclosure ... 95
VII
Chapitre 5: article 2 ... 96
Right Ventricular Longitudinal Strain for Risk Stratification in Low-Flow, Low-Gradient Aortic Stenosis With Low Ejection Fraction ... 96
5.1 Résumé: ... 97 5.2 ABSTRACT ... 99 5.3 INTRODUCTION ... 101 5.4 METHODS ... 101 5.4.1 Study protocol: ... 101 5.4.2 Clinical data: ... 102 5.4.3 Doppler-Echocardiography: ... 102
5.4.4 Longitudinal strain measurements: ... 102
5.4.5 Study Endpoints: ... 103
5.4.6 Statistical Analysis: ... 103
5.5 RESULTS ... 104
5.5.1 Patient characteristics ... 104
5.5.2 Survival according to rest RVLS ... 107
5.5.3 Survival according to stress RVLS ... 110
5.6 DISCUSSION ... 114
5.6.1 Rest RVLS and outcomes in low LVEF, LF-LG AS ... 114
5.6.2 Stress RVLS and outcomes in low LVEF, LF-LG AS ... 115
5.6.3 Clinical implications ... 115 5.6.4 Study limitations ... 116 5.7 CONCLUSION ... 116 5.8 Acknowledgments ... 116 5.9 Sources of Funding ... 117 5.10 Disclosure ... 117 Chapitre 6: article 3 ... 118
B-Type Natriuretic Peptide and High-Sensitivity Cardiac Troponin for Risk Stratification in Low Flow, Low Gradient Aortic Stenosis ... 118
6.1 RÉSUMÉ ... 119
6.2 ABSTRACT ... 120
6.3 INTRODUCTION ... 121
6.4 METHODS ... 121
VIII
6.4.2 Clinical data ... 122
6.4.3 Doppler echocardiography ... 122
6.4.4 Measurement of BNP and hsTnT plasma levels ... 122
6.4.5 Statistical analysis ... 123
6.5 RESULTS ... 123
6.5.1 Patient characteristics ... 123
6.5.2 Comparison of baseline characteristics according to BNP and hsTnT plasma levels 124 6.5.3 Relationship between BNP and hsTnT ... 124
6.5.4 Relationship between blood biomarkers and parameters of LV function, remodeling and AS severity ... 128
6.5.5 Outcomes according to BNP and hsTnT plasma levels... 128
6.6 DISCUSSION ... 134
6.7 Clinical Implications ... 135
6.8 Study Limitations and Strengths ... 136
6.9 CONCLUSION ... 137 6.10 Acknowledgments ... 137 6.11 Sources of Funding ... 137 6.12 Disclosure ... 137 6.13 PERSPECTIVES ... 138 Chapitre 7: article 4 ... 139
Relationship Between QT Interval and Outcome in Low-Flow, Low-Gradient Aortic Stenosis With Low Left Ventricular Ejection Fraction ... 139
7.1 RÉSUMÉ ... 140 7.2 ABSTRACT ... 142 7.3 INTRODUCTION ... 143 7.4 METHODS ... 143 7.4.1 Study protocol ... 143 7.4.2 Clinical data ... 144 7.4.3 Electrocardiogram ... 144 7.4.4 Doppler-Echocardiography ... 144 7.4.5 Blood Biomarkers ... 145 7.4.6 Statistical Analysis ... 145 7.5 RESULTS ... 146 7.5.1 Patient characteristics ... 146
IX
7.5.2 Patients’ characteristics according to QTc interval ... 149
7.5.3 Correlation between QTc and parameters of LV function and blood biomarkers ... 149
7.5.4 Association between QTc and mortality ... 150
7.6 DISCUSSION ... 155
7.7 Study limitations ... 156
7.8 CONCLUSION ... 156
7.9 Sources of Funding ... 157
7.10 Conflict of Interest Disclosures ... 157
Chapitre 8: article 5 ... 158
Impact of AVR on LV Remodeling and Function in Paradoxical Low-Flow, Low-Gradient Aortic Stenosis With Preserved LVEF ... 158
8.1 RÉSUMÉ ... 159
8.2 ABSTRACT ... 161
8.3 LETTER TO THE EDITOR ... 163
8.4 Sources of Funding ... 165
8.5 Disclosures ... 165
Chapitre 9: discussion ... 166
9.1 Le ventricule droit, un déterminant majeur du pronostic chez les patients avec SABD classique ... 167
9.2 Intérêt des biomarqueurs sanguins pour la stratification du risque ... 171
9.3 L’ECG, un outil simple pour la stratification du risque ... 173
9.4 Réponse ventriculaire gauche au RVA chez les patients avec SABD paradoxal ... 175
Chapitre 10 : conclusion et perspectives ... 179
X
Liste des abréviations et des sigles
AVA : Aire Valvulaire AortiqueAVAproj : Aire Valvulaire Aortique Projetée à débit normal AVC : Calcification de la Valve Aortique
BD : Bas Débit
BNP : Peptide Natriurétique de Type B
DLG/DLVG : Déformation Longitudinale Globale du Ventricule Gauche DLVD : Déformation Longitudinal du Ventricule Droit
DPP : Disproportion Patient-Prothèse ΔP : Gradient de Pression
ESD : Échocardiographie de Stress à la Dobutamine FEVG : Fraction d’Éjection du Ventricule Gauche MG : Gradient Moyen
PAC : Pontage Aorto-Coronarien Q : Débit transvalvulaire moyen
RVA : Remplacement Valvulaire Aortique RT : Régurgitation Tricuspide
SA : Sténose Aortique
SABD : Sténose Aortique à Bas Débit SAVS : Sténose Aortique Vraiment Sévère SAPS : Sténose Aortique Pseudo-Sévère
TACO : Tomographie Axiale Commandée par Ordinateur TAVI : Implantation Transcathéter de Valve Aortique VA : Valve aortique
VD : Ventricule Droit VE/VÉ: Volume d’Éjection
VEi/VÉi : Volume d’éjection indexé VG : Ventricule Gauche
XI
AS: Aortic Stenosis AVA: Aortic Valve Area
AVAproj: Projected Aortic Valve Area at a normal transvalvular flow rate AVC: Aortic Valve Calcification
AVR: Aortic Valve Replacement BNP: B-type Natriuretic Peptide CAD: Coronary Artery Disease
COPD: Chronic obstructive Pulmonary Disease DASI: Duke Activity Status Index
DSE: Dobutamine Stress Echocardiography ΔP: Gradient
GLS: Global Longitudinal Strain
hsTnT: High-sensitivity Cardiac Troponin T LF-LG: low-flow, low-gradient
LV: Left Ventricle
LVEF: Left Ventricular Ejection Fraction LVLS: Left Ventricular Longitudinal Strain MG: Mean Gradient
NYHA: New-York Heart Association PPM: Patient-Prosthesis Mismatch ROC: Receiver operating characteristic RV: Right Ventricle
RVLS: Right Ventricular Longitudinal Strain SV: Stroke Volume
SVi: Stroke Volume index
TAVI: Transcatheter Aortic Valve Implantation TOPAS: True Or Pseudo Severe Aortic Stenosis TR: Tricuspid Regurgitation
XII
Dédicace
À mes chers parents pour leur aide et leur soutien depuis toujours; À mon épouse Rihab et mes enfants Yacine et Imrane pour leur accompagnement et les bons moment passés ensembles;
À mes frères et sœurs; À toute ma famille et mes amis…
XIII
Avant-propos
Les travaux de recherche inclus dans cette thèse de doctorat ont été effectués au centre de recherche de l’Institut Universitaire de Cardiologie et de Pneumologie de Québec (IUCPQ), dans le laboratoire d’échocardiographie et de Valvulopathie dirigé par le Dr. Philippe Pibarot. Elle inclut 10 chapitres tous écrit par le Dr. Dahou et dont cinq d’entre eux sont des articles originaux évalués par les pairs.
Le premier article présenté dans cette thèse de doctorat est intitulé: «Tricuspid
Regurgitation Is Associated With Increased Risk of Mortality in Patients With Low-Flow Low-Gradient Aortic Stenosis and Reduced Ejection Fraction ». Il a été publié
dans la revue «JACC : Cardiovascular Interventions» en 2015. L’étudiant est le premier auteur. Son rôle fut de participer au devis de l’étude, de recruter les patients, de gérer les visites et d’assurer le suivi pour les patients de Québec, de collecter et de contrôler les données des autres centres, de gérer les données, de les analyser, de les interpréter, d’en présenter les résultats et d’écrire le manuscrit. Il était supervisé par son directeur de recherche, le Dr. Philippe Pibarot et de sa codirectrice, Dr. Marie Annick Clavel. Les autres co-auteurs ont contribué à la collecte de données dans leurs centres respectifs et l’amélioration de la version finale du manuscrit par leurs suggestions et commentaires constructifs.
Le deuxième article est intitulé: «Right ventricular longitudinal strain for risk
stratification in low-flow, low-gradient aortic stenosis with low ejection fraction» et
il a été publié dans la revue «Heart» en 2016. L’étudiant est le premier auteur. Son rôle fut de participer au devis de l’étude, de recruter les patients, de gérer les visites et d’assurer le suivi pour les patients de Québec, de collecter et de contrôler les données des autres centres, de gérer les données, de les analyser, de les interpréter, d’en présenter les résultats et d’écrire le manuscrit ainsi que de répondre aux reviseurs. Toutes les mesures de la déformation myocardique du ventricule droit, mesure principale dans cette étude, étaient effectuées par l’étudiant, supervisé par son directeur de recherche, le Dr. Philippe Pibarot. Les autres co-auteurs ont contribué à la collecte de données dans leurs centres
XIV
respectifs et l’amélioration de la version finale du manuscrit par leurs suggestions et commentaires constructifs.
Le troisième article est intitulé: «B-Type Natriuretic Peptide and High-Sensitivity
Cardiac Troponin for Risk Stratification in Low Flow, Low Gradient Aortic Stenosis». Il a été accepté pour une publication dans la revue «JACC : Cardiovascular
Imaging» en 2017 et l’étudiant en est le premier auteur. Son rôle fut de participer au
devis de l’étude, la collecte et l’analyse de données ainsi que l’écriture de l’article et la réponse aux réviseurs. Outres les mesures échocardiographiques standards, l’étudiant a effectué les mesures de la déformation longitudinale du ventricule gauche. À chacune de ces étapes, l’étudiant était supervisé par son directeur de recherche, le Dr. Philippe Pibarot. Les auteurs co-auteurs ont participé à la collecte de données et l’amélioration de la version finale du manuscrit.
Le quatrième article est intitulé: «Relationship Between QT Interval and Outcome in Low-Flow, Low-Gradient Aortic Stenosis With Low Left Ventricular Ejection Fraction». Il a été publié dans la revue «Journal of American Heart Association» en
2016 et l’étudiant est le premier auteur et l’investigateur principal de cette étude. Il a
participé au devis de l’étude, la collecte et l’analyse de données, l’interprétation des résultats et il a écrit la première version de l’article et la réponse aux reviseurs. Il était supervisé par son directeur le Dr. Philippe Pibarot. Tous les co-auteurs ont contribué à la collecte des données et/ou la révision critique de l’article.
Le cinquième article est intitulé : «Impact of AVR on LV Remodeling and Function in
Paradoxical Low-Flow, Low-Gradient Aortic Stenosis With Preserved LVEF» et il a
été publié dans la revue «JACC : Cardiovascular Imaging» en 2017 et l’étudiant en est le premier auteur. Il a participé au devis de l’étude, la collecte et l’analyse de données, l’interprétation des résultats et il a écrit la première version de l’article et la réponse aux reviseurs. Outre les mesures échocardiographiques de base, l’étudiant a effectué l’analyse de la déformation longitudinale du VG, une des principales données présentées dans cet
XV
article. Il était supervisé par son directeur le Dr. Philippe Pibarot. Tous les co-auteurs ont contribué à la collecte des données et/ou la révision critique de l’article.
1
Introduction
Les maladies valvulaires cardiaques occupent une place importante, aussi bien en pratique clinique quotidienne qu’en recherche clinique et fondamentale. Ceci se reflète sur le nombre de publications scientifiques ainsi que sur le développement des guides de pratique en rapport avec cette thématique.
La sténose aortique (SA) est la valvulopathie la plus fréquente et troisième cause de morbi-mortalité liée aux pathologies cardiovasculaires (1). L’épidémiologie de cette valvulopathie a beaucoup évolué, notamment dans les pays industrialisés. La cause la plus fréquente de SA dans ces pays est la dégénérescence fibro-calcifiante qui touche avec prédilection le sujet âgé. Sa prévalence est en constante augmentation.
La calcification valvulaire a été longtemps considérée comme un processus similaire à l’athérosclérose mais il y a de plus en plus d’évidence qu’il existe des différences majeures au niveau de la pathogenèse de ces 2 pathologies, même si elles ont en commun plusieurs facteurs de risque. Le développement de la calcification valvulaire s’étend sur une longue période avant de causer une sténose sévère, et les patients peuvent rester longtemps asymptomatiques même en présence de SA sévère. Cependant, l’apparition de symptômes ou de dysfonction cardiaque est associée à un mauvais pronostic en l’absence de remplacement valvulaire aortique.
Le diagnostic de la maladie et de sa sévérité repose essentiellement sur l’écho-Doppler cardiaque. La part du cathétérisme cardiaque et des autres techniques d’imagerie est marginale et est réservée pour les cas difficiles.
Le seul traitement curatif à l’heure actuelle est le remplacement de la valve malade par une prothèse valvulaire (2,3). À côté de la chirurgie standard à cœur ouvert, seul traitement de la SA pendant plusieurs décennies, l’arrivé au début des années 2000 de techniques moins invasives de remplacement valvulaire par cathéter (TAVR ou TAVI) représente une percée majeure dans ce domaine (4,5).
La plupart des patients avec SA se présentent avec un débit cardiaque normal. Cependant, une proportion non négligeable de patients peuvent se présenter avec un bas débit
2
cardiaque ce qui pose des défis majeurs à la fois pour le diagnostic et la prise en charge thérapeutique.
La SA à bas débit (SABD) ne se limite plus qu’aux patients avec fraction d’éjection abaissée. La description en 2007 de la SABD malgré une fraction d’éjection préservée (dite SA à bas débit paradoxal) a changé la face de la sténose aortique.
3
Chapitre 1 : La sténose aortique
1.1. Épidémiologie
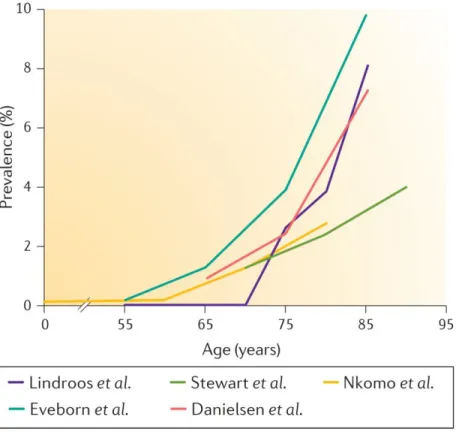
La sténose aortique (SA) est la valvulopathie la plus fréquente dans les pays industrialisés, et le troisième problème cardiaque après la maladie coronaire et l’hypertension artérielle (6). Elle est directement responsable de 85000 remplacements valvulaires aortiques (RVA) par année en Amérique du nord avec 15000 décès par année (1). La SA calcifiante représente de loin l’étiologie la plus fréquente (1,7,8). La sclérose aortique est la phase initiale de la maladie qui précède la calcification et elle est caractérisée par l’épaississement des feuillets de la valve aortique avec début de calcification sans aucune obstruction hémodynamique à l’écoulement du flux sanguin (vélocité maximale <2 m/s) (8). La prévalence de la sclérose aortique augmente avec l’âge. Dans les pays industrialisés, elle est estimée à 25% à partir de 65 ans et peut aller jusqu’à 50% à partir de 85 ans (1,7). Cependant, la prévalence de la SA est largement inférieure à celle de la sclérose. En effet, des données récentes montrent que la proportion de patients avec sclérose aortique qui progressent vers une SA n’est que de 1.8-1.9% par année (9), avec une prévalence de 15-20% approximativement au cours de l’évolution complète de la maladie (8). La prévalence de SA est estimée à 0.4% dans la population générale, 1.7% à partir de 65 ans et 3.4 % en moyenne à partir de 75 ans (Figure 1-1) (10). Les études épidémiologiques prévoient une augmentation de celle-ci en rapport avec le vieillissement de la population.
1.2. Pathophysiologie
La SA calcifiante, dite dégénérative, est caractérisée par des remaniements fibro-calciques conduisant à un épaississement et une diminution de la mobilité des feuillets de la valve aortique conduisant ainsi à une obstruction progressive de la valve et donc un
4
obstacle à l’éjection du sang par le ventricule gauche (VG) (1,8). Le degré de l’obstruction valvulaire et son retentissement sur la fonction cardiaque est un élément clé dans l’apparition des symptômes et la survenue de complications. (1,8,11,12).
Figure 1-1 : prévalence de la sténose aortique en fonction de l’âge dans plusieurs populations. Reproduit avec permission d’après(1).
1.2.1 Pathogenèse de la sténose aortique calcifiante
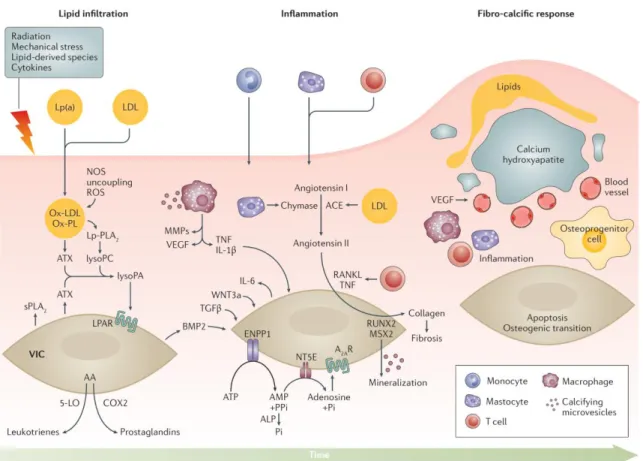
Pendant longtemps, la SA a été considérée comme un processus passif de déposition de calcium dans la valve, mais il y a de plus en plus d’évidences cliniques, histopathologiques et moléculaires qui démontrent qu’il s’agit d’un processus actif impliquant le dysmétabolisme lipidique, l’inflammation, et la calcification (1,8,13,14) (Figure 1-2). Il s’agit aussi d’une maladie multifactorielle qui partage en grande partie les facteurs de risque de l’athérosclérose. Les lésions histologiques les plus souvent rencontrées sont la fibrose et la calcification.
5
1.2.1.1. Infiltration, oxydation lipidique et inflammation
Plusieurs cellules et cytokines inflammatoires sont présentes au sein des valves atteintes de SA (15-19). Des études récentes suggèrent que l’infiltration de la valve par les lipoprotéines joue un rôle important dans le développement de l’inflammation chronique au niveau de la valve qui précède la minéralisation pathologique de celle-ci (20) (Figure 1-2).
Figure 1-2 : pathogenèse de la sténose aortique calcifiante. Reproduit avec permission d’après (1).
En effet, cette inflammation pourrait induire une transition ostéoblastique des cellules interstitielles de la valve aortique (VICs) qui semblent jouer un rôle crucial dans la minéralisation de la valve aortique (1,21). Des études histologiques ont montré la présence de plusieurs lipoprotéines [ApoB, apoE, apoA1 et apo(a)] dans des valves
6
aortiques explantées chirurgicalement pour sténose aortique (22). De plus, il y avait une association entre le niveau de LDL oxydés (Ox-LDL) et le degré d’inflammation et le remodelage fibro-calcique des valves de SA explantées (23,24). Des travaux in vitro ont montré que les OxLDL et les phospholipides oxydés (OxPL) favorisent la calcification de cellules vasculaires isolées (25). Les OxPL circulants sont essentiellement transportés par la lipoprotéine(a) [(Lp (a)] (26). Ils ont une teneur élevée en lysophosphatidylcholine. L'autotaxine (ATX) est une enzyme qui transforme la lysophosphatidylcholine en (lysoPC) acide lysophosphatidique (lysoPA). L'ATX est transportée dans la valve aortique par la Lp (a) et elle est également sécrétée par les VICs. L’interaction ATX-lysoPA favorise l'inflammation et la minéralisation de la valve aortique (21) et pourrait représenter une nouvelle cible thérapeutique dans la SA.
Des études récentes ont montré que le gène LPA codant pour la Lp(a) est potentiellement associé à la genèse de SA calcifiée (27-29). De plus, les niveaux plasmatiques de Lp(a) et Ox-PL étaient indépendamment associés à une progression plus rapide de la SA calcifiante (30). Ensemble, ces données suggèrent que la Lp(a) favorise l’accumulation des Ox-PL dans la valve aortique qui pourrait déclencher une réponse ostéogénique.
1.2.1.2 La fibrose valvulaire
Classiquement, la calcification est considérée comme le déterminant majeur de la sténose dans la SA dite calcifiante. Cependant, les études montrent qu’il existe une fibrose étendue de la valvule aortique chez l'homme (31) et les souris avec SA "calcifiante" (14). L’enzyme de conversion de l’angiotensine (ACE) ainsi que la chymase sont surexprimées dans les valves de SA calcifiante et entrainent la production d’angiotensine II (32,33). De plus, les patients avec SA calcifiante ont un taux plasmatique élevé d’angiotensine II, qui corrèle avec l’expression valvulaire de TNF et IL-6 (34). L’angiotensine II est un puissant activateur de la voie NF-kB qui entraine une importante réponse fibrotique sur des cellules isolées. Chez la souris, l’administration d’angiotensine II entraine la fibrose de la valve aortique (35). Dans un modèle de lapin hypercholésterolémique, l’administration de l’Olmesartan, un antagoniste du récepteur de l’angiotensine II (ARA), prévient l’épaississement de la valve aortique que ces lapins développent normalement (36). Des études cliniques rétrospectives ont montré que l’administration d’ARA sont
7
associés à un remodelage fibro-calcifiant ainsi qu’une progression moins rapide de la SA comparativement à l’administration des inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) (37,38). Il est possible qu’une quantité substantielle d’angiotensine II soit produite localement dans la valve aortique par une chymase, et dont l’effet est bloqué par les ARA mais non pas par les IECA.
1.2.1.3 La minéralisation
Des études récentes sur les mécanismes qui contribuent à la calcification valvulaire assumaient que la calcification ectopique de la valve est essentiellement voire même exclusivement un processus actif qui ressemble à celui observé dans l’os. Cependant, il semble y avoir plusieurs mécanismes par lesquels le nodule de calcium se forme et se développe dans la valve de SA calcifiante. Premièrement, la calcification pourrait se développer par un processus semblable à celui observé dans l’os. Environ 15-20% des valves de patients atteints de SA calcifiante présentent une évidence de matrice osseuse, incluant des cellules ostéoïdes, une matrice de collagène hautement organisée, des cellules de type ostéoclastes multinucléées et des poches médullaires (39). Un deuxième mécanisme possible est l’accumulation de dépôts amorphes de calcium. Ici, les nodules de calcium ont typiquement une ultrastructure cristalline avec toutefois absence de cellules vivantes au sein du nodule de calcium lui-même (39,40). La nécrose cellulaire et l’apoptose sont les mécanismes classiques de formation et d’expansion de dépôts amorphes de calcium (14,40). In vitro, TNF-ß induit une apoptose caspase-dépendante et la formation de nodules calcifiés, et TGF-ß est nettement augmenté dans les valves humaines calcifiées. Un troisième mécanisme possible est la minéralisation active de la valve par des cellules qui expriment des gènes ostéogéniques mais dont la régulation est fondamentalement différente de la formation osseuse squelettique (41-44). Les mécanismes exacts de l’initiation et la progression de la calcification in vivo ainsi que la part de chaque mécanisme ne sont pas encore claires.
8
1.2.2 Le retentissement sur la fonction cardiaque
1.2.2.1 Remodelage ventriculaire gauche et fibrose myocardique
La sténose de la valve aortique représente un obstacle au flux sanguin entrainant une augmentation progressive de la pression dans le VG durant la systole. Cette surcharge de pression liée à l’obstacle valvulaire peut être aggravée par la présence d’hypertension artérielle concomitante. Pour vaincre cette surcharge de pression, le VG s’adapte en augmentant l’épaisseur de ses parois; c’est hypertrophie ventriculaire gauche (HVG) (Figure 1-3). En effet, cette hypertrophie secondaire à l’augmentation de la postcharge a pour but de maintenir un stress pariétal constant et préserver la performance du VG, selon la loi de Laplace : Stress pariétal=pr/2th où p= pression ventriculaire gauche, r =rayon
VG et th=épaisseur de la paroi du VG). Ainsi, une augmentation de la pression dans la
cavité ventriculaire gauche (p) est contrebalancée par une augmentation de l’épaisseur de la paroi du VG (th) pour maintenir niveau normal de stress pariétal (7).
Cependant, l’HVG s’accompagne de fibrose myocardique et devient à la longue délétère. En effet, l’hypertrophie de myocytes s’accompagne d’une prolifération du tissu interstitiel avec accumulation progressive des fibres de collagène à l’origine de fibrose diffuse, qui est au moins en partie réversible suite au remplacement valvulaire aortique (45). Elle s’accompagne d’un réseau vasculaire non adéquat entrainant une réduction de la densité capillaire. L’HVG conduit à une diminution de la densité capillaire, et l’augmentation de la pression transmurale contribue à l’augmentation des résistances vasculaires. Ces résistances vasculaires ont pour conséquence une réduction de la réserve de flux coronaire (46,47) qui représente l’augmentation du flux coronaire pour satisfaire la demande myocardique en oxygène en réponse à la demande de l’organisme, notamment à l’effort, d’où l’apparition d’ischémie et de symptômes. La répétition de ce phénomène aboutit à l’apoptose de cardiomyocytes et au développement de fibrose focale de remplacement, dite cicatricielle (12,45). Ce type de fibrose survient essentiellement dans la région sous-endocardique et à mi-paroi ventriculaire et elle est généralement irréversible après diminution de la pression intra VG par un remplacement valvulaire aortique (45,48). Une étude récente a montré que la diminution de la réserve de flux coronaire n’est pas liée aux anomalies de la microcirculation mais plutôt à un couplage cardio-coronaire anormal (49). Les résistances vasculaires étaient similaires entre les
9
contrôles et le patients avec SA. D’autres études sont nécessaires pour confirmer ce résultat.
Figure 1-3 : physiopathologie du remodelage et de la dysfonction ventriculaire gauche causés par la surcharge de pression due à la sténose aortique. Reproduit avec permission d’après (1).
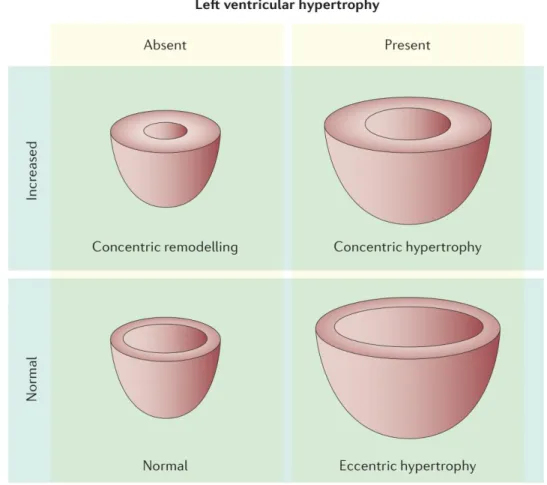
Différents patron de remodelage VG en réponse à l’obstruction valvulaire peuvent être rencontrés. Il peut s’agir de remodelage concentrique, hypertrophie concentrique ou encore hypertrophie excentrique (1,50) (Figure 1-4).
Mise à part la sévérité de la SA, plusieurs d’autres facteurs peuvent influencer cette réponse adaptative, incluant l’âge, le sexe, des facteurs génétiques, métaboliques, la présence de maladie coronaire et l’hypertension artérielle (51-54). Pour un même degré de sténose aortique, les femmes ont tendance à développer plus de remodelage concentrique ou d’hypertrophie concentrique que les hommes (51). L’obésité, le syndrome métabolique ainsi que le diabète prédisposent au développement de plus d’HVG concentrique en présence de SA (52,53). Parmi les patients avec SA, le
10
remodelage ou l’hypertrophie concentrique ont été associés à une plus mauvaise fonction VG et un risque plus élevé d’évènements cardiovasculaires et de décès comparativement à une géométrie normale du VG ou une HVG excentrique (50,55-57). Les données d’une récente étude (50) suggèrent que l’HVG concentrique est associée à un risque plus élevé de mortalité chez les femmes mais pas chez les hommes. D’autres études sont nécessaires pour confirmer ce résultat ainsi que pour élucider les mécanismes pouvant expliquer cette différence hommes-femmes concernant l’impact de l’HVG concentrique sur la mortalité.
Figure 1-4 : différents types de remodelage ventriculaires rencontrés dans la SA. Reproduit avec permission d’après (58).
11
1.2.2.2 La dysfonction VG
La dysfonction diastolique ventriculaire gauche survient tôt dans la SA et s’aggrave avec la progression de la sévérité de la sténose et la fibrose myocardique (12,59,60). À un stade plus avancé de la maladie, l’augmentation de pressions de remplissage VG conduit à l’apparition d’hypertension pulmonaire secondaire et à la dyspnée (61,62). La fonction systolique globale du VG telle que mesuré par la fraction d’éjection du VG (FEVG) reste longtemps préservée, car l’hypertrophie des parois VG permet de maintenir un stress pariétal relativement normal. La baisse de la FEVG ou du débit cardiaque survient tard au cours de l’évolution de la maladie et elle est souvent précédée par l’apparition de symptômes (Figure 1-3).
Même en présence de FEVG préservée, une bonne proportion de patients avec SA peuvent présenter une baisse de la fonction systolique longitudinale du VG telle que mesurée par la déformation myocardique (« Strain ») ou le déplacement de l’anneau mitral, avec toutefois une fonction radiale et circonférentielle préservée (63-68). En effet, il existe 3 couches de fibres myocardiques. La plus interne est la couche sous-endocardique dont les fibres sont orientées longitudinalement et qui assurent le raccourcissement du VG en systole. C’est pourquoi on assiste à la dysfonction longitudinale précocement en rapport avec l’ischémie et la fibrose myocardique qui atteignent la région sous-endocardique en premier lieu et de façon plus prononcée (69-71).
1.2.3 Les facteurs de risque
1.2.3.1 Anomalie congénitale de la valve aortique
La bicuspidie est l’anomalie congénitale la plus fréquente. Sa prévalence est 1-2% environ dans la population générale (7). La plupart des patients avec une bicuspidie aortique développent une pathologie de la valve aortique, le plus souvent une sténose (72-74). Cette dernière survient plus précocement dans la vie du patients; environ 2 décennies plus tôt comparativement à une sténose qui touche une valve aortique tricuspide (7). Elle représente près de la moitié des valves aortiques explantées chirurgicalement à cause de SA calcifiante (72).
12
1.2.3.2 Facteurs de risque acquis
Il s’agit des facteurs de risque rencontrés également dans la maladie coronaire. L’âge est un facteur de risque puissant puisque il s’agit d’une pathologie du sujet âgé par excellence, à l’exception des cas de SA compliquant une anomalie congénitale (bicuspidie essentiellement) qui surviennent plus tôt dans la vie. Les autres facteurs incluent : le sexe masculin, l’hypertension artérielle, le tabagisme, l’obésité, le syndrome métabolique, le diabète et l’élévation de la Lp(a) (27,75-78). Certains facteurs ont été associés avec la progression de la sténose aortique. L’âge avancé, la sévérité de la sténose et de la calcification au moment du diagnostic, le tabagisme, l’hypertension artérielle (systolique surtout), l’obésité, le syndrome métabolique, l’insuffisance rénale, l’hyperparathyroïdie secondaire, une Lp(a) plus élevée, et une activité Lp-PLA2 augmentée, sont tous des facteurs associés à une progression plus rapide de la sténose aortique (30,38,79-86).
1.2.3.3 Facteurs de risque génétiques
Plusieurs études suggèrent qu'une composante génétique est impliquée dans le développement de SA calcifiante associée à des valves aortiques bicuspides ou tricuspides (27,73,87,88). Plusieurs gènes : NOTCH 1, GATA 5, RUNX2, CACNA1C… ont été identifiés. Cependant, les différentes études en questions avaient comme limitation une faible taille d’échantillon (73). Une étude récente incluant un grand nombre de patient avec un modèle de randomisation mendélienne, a permis d’identifier un polymorphisme d’un nucléotide (SNP : rs10455872) au niveau du gène LPA [qui code pour la Lp(a)] comme seul SNP significativement associé à la présence de calcification valvulaire et de SA calcifiante clinique (27). Des études ultérieures ont confirmé ce résultat et ont également montré une association entre l’augmentation des taux plasmatique de Lp(a) et la prévalence de SA, et la nécessité de remplacement valvulaire aortique dans la population générale (28-30). À la lumière de ces données, l’abaissement des taux plasmatiques Lp(a) pourrait être une cible thérapeutique prometteuse, notamment pour ralentir la progression de la SA.
Une autre étude utilisant une randomisation mendélienne a montré une forte association entre la disposition génétique d’avoir un LDL élevé et la présence de calcification
13
valvulaire aortique et de SA (89). Cependant, des études randomisées antérieures n’avait pas montré de bénéfice sur le ralentissement de la progression de la SA avec la réduction intensive de LDL par les statines (90-92). Il est probable que l’élévation de LDL joue un rôle dans l’initiation de la maladie et non pas dans sa progression.
1.3. Diagnostic et évaluation
1.3.1 Manifestations cliniques
La SA est souvent découverte à l’occasion de l’apparition d’un souffle cardiaque systolique, de type éjectionnel qui irradie aux vaisseaux du cou. L’abolition du deuxième bruit cardiaque a été classiquement décrite comme étant en faveur d’une sténose sévère et qui reflète une valve immobile. L’apparition des symptômes est plus tardive. Leur apparition est associée à un mauvais pronostic en l’absence de traitement (7,11) (Figure 1-5). Ils surviennent tout d’abord à l’effort puis au repos. Il s’agit typiquement de dyspnée d’effort, angor d’effort ou de syncope à l’effort. Il faut noter que les symptômes ne sont pas spécifiques et ne sont pas toujours faciles à évaluer chez le sujet âgé peu ou pas actif et qui a tendance à s’adapter à sa limitation. Une proportion non négligeable de patients (environ un patient sur 3) qui se disent asymptomatiques développement des symptômes lors d’un test à l’effort (93-95).
14
Figure 1-5 : survie des patients avec sténose aortique (SA) selon les symptômes. La courbe grise représente l’histoire naturelle de la maladie selon la conceptualisation initiale par Ross et Braunwald en 1968 (11) où l’étiologie de la SA était principalement la maladie rhumatismale. La courbe noire représente l’histoire naturelle de la maladie chez les patients avec SA calcifiante. Reproduit avec permission d’après (11).
1.3.2 Électrocardiogramme (ECG)
L’ECG n’est pas indiqué pour l’évaluation de la SA mais il est généralement réalisé en routine lors de l’examen initial. Les anomalies électrocardiographiques qui peuvent être rencontrées dans la SA ne sont pas spécifiques. Il peut s’agir de signes d’HVG, de troubles du rythme (fibrillation auriculaire,…) ou de conduction (de type bloc de branche gauche complet ou incomplet, bloc auriculo-ventriculaire) ou encore de troubles de la repolarisation (96-99). Ces derniers (troubles de la repolarisation) peuvent être en rapport avec la présence d’ischémie liée ou non à une obstruction coronaire, mais aussi en rapport avec la fibrose myocardique. Des études récentes ont montré que la présence de troubles de la repolarisation (sous-décalage du segment ST et asymétrie de l’onde T) dans les dérivations latérales («ECG strain» des anglophones) est associée avec la présence de
15
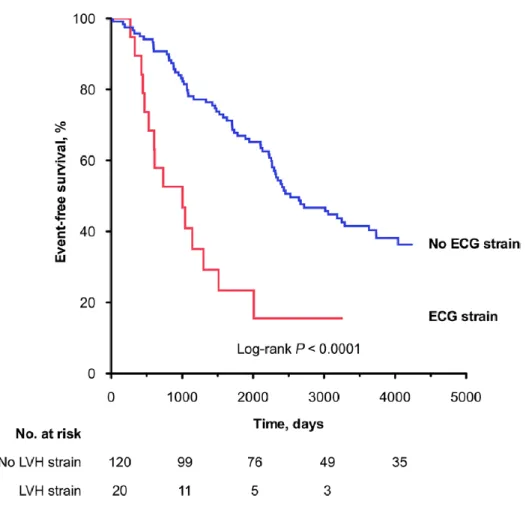
fibrose myocardique focale mesurée par histologie (Figure 1-6) ou par imagerie par résonnance magnétique [IRM] (rehaussement tardif au gadolinium) et la sévérité de fibrose diffuse (volume extracellulaire par IRM). De plus, sa présence était un prédicteur indépendant de survenue d’évènements cardiovasculaires, à savoir RVA ou décès de cause cardiovasculaire (98,99) (Figure 1-7). D’autres études suggèrent que la durée et la morphologie du QRS sont associées à la survenue d’évènements cardiovasculaires chez les patients ayant une SA sévère asymptomatique (97).
Figure 1-6 : ECG et biopsie cardiaque chez 2 patients atteints de SA sévère. L’ECG du patient (A) montre des signes d’HVG associés à la présence de troubles de la repolarisation (sous-décalage du segment ST et asymétrie de l’onde T) dans les dérivations latérales. L’ECG du patient (B) montre des signes d’HVG sans anomalies de repolarisations. Le patient B a une masse VG indexée plus importante (169 g/m2 vs 81 g/m2), troponine plasmatique plus élevée (8.4 vs 2.5 ng/L) et une fibrose myocardique plus extensive à la fois sur l’IRM et sur les coupes histologiques. Reproduit avec permission d’après Shah et al. (99).
16
Figure 1-7 : Survie selon la présence ou non de troubles de la repolarisation (« ECG strain »). Reproduit avec permission d’après Shah et al.(99).
1.3.3 Échographie-Doppler cardiaque
C’est l’examen d’imagerie clé pour le diagnostic de la maladie. Il permet d’examiner l’anatomie et la morphologie de la valve, la sévérité de la sténose aortique, le remodelage et le retentissement sur la fonction cardiaque. Cet examen non invasif a remplacé le cathétérisme cardiaque pour le diagnostic et le suivi des patients. La plupart des patients avec SA sont référés pour une échocardiographie suite à la découverte d’un souffle cardiaque ou de symptômes. Classiquement, la SA était classée en 3 stades (SA légère, modérée ou sévère) selon la sévérité hémodynamique. Cependant, les dernières recommandations américaines sur le diagnostic et la prise en charge des maladies
17
valvulaires ont introduit le concept de stades de progression de la maladie basés sur l’anatomie et l’atteinte valvulaire, la sévérité hémodynamique, le retentissement sur la fonction systolique VG et la présence ou non de symptômes (3). Tous ces éléments, mis à part les symptômes, sont évalués par échographie-Doppler cardiaque. L’échocardiographie transthoracique (ETT) est suffisante chez la plupart des patients. Cependant, d’autres modalités d’imagerie comme l’échographie transoesophagienne (ETO), la tomographie axiale assistée par ordinateur (TACO) et l’IRM peuvent être nécessaires pour définir l’anatomie de la valve et la sévérité de la sténose chez les patients peu ou pas échogènes et ceux qui présentent des paramètres hémodynamiques de sévérité de la SA discordants.
1.3.3.1 Anatomie et morphologie de la valve aortique
L’échocardiographie permet d’évaluer l’anatomie de la valve aortique (bicuspidie vs.
valve aortique tricuspide, normale), l’aspect et la mobilité des feuillets. L’évaluation semi-quantitative de la sévérité de la calcification par échocardiographie a une reproductibilité modeste mais permet tout de même de suspecter la présence de sténose sévère lorsque la valve est épaissie et fortement calcifié, peu ou pas mobile. Des études antérieures ont montré que la sévérité de la calcification valvulaire par échocardiographie était associé à la sévérité hémodynamique et la survenue d’évènements cardiovasculaires (décès ou RVA pour apparition de symptômes) chez les sujets âgés avec SA calcifiante (100).
1.3.3.2 Sévérité hémodynamique de la SA
Les différentes modalités d’échographie-Doppler cardiaque permettent d’évaluer la sévérité hémodynamique de l’obstruction valvulaire. Les paramètres les plus utilisés sont la vélocité maximale du jet transvalvulaire (Vmax), le gradient moyen (GM) et l’aire valvulaire aortique (AVA). Un examen complet doit inclure toutes les incidences incluant la vue parasternale droite et/ou suprasternale. Thaden et al. ont montré dans une étude récente incluant 100 patients atteints de SA que la valeur maximale de Vmax était obtenue sur la vue parasternale droite chez 50% des patients, contre 39% sur les vues apicales (101). Dans des conditions de débit normal, la sténose sévère est définie par la
18
présence d’une Vmax >4 m/s ou un GM >40 mmHg et une AVA <1 cm2
(ou <0.6 cm2/m2 quand elle est indexée à la surface corporelle) (2,3) (Table 1-1).
Sclérose aortique SA légère SA modérée SA sévère SA très sévère Vmax (m/s) < 2.0 2-2.9 3-3.9 ≥4 ≥5 GM (mmHg) - <20 20-39 ≥40 ≥60 AVA (cm2) - - <1.5 ≤1.0 - AVAi (cm2/m2) - - - ≤0.6 -
Table : 1-1 : critères échocardiographiques de sévérité hémodynamiquue de la sténose aortique. SA : sténose aortique, Vmax : vélocité maximale du jet transvalvulaire, GM gradient moyen, AVA et AVAi : aire valvulaire aortique absolue et indexée pour la surface corporelle, respectivement. Reproduit avec permission d’après (3).
En cas de bas débit cardiaque (VES<35 ml/m2, débit transvalvulaire <200 ml/s, index cardiaque<3 L/min/m2) (102-105), l’évaluation de la sévérité de la SA est plus complexe en raison de la discordance entre le GM (<40 mmHg), en faveur d’une sténose non-sévère et l’AVA (<1cm2) en faveur d’une sténose sévère. D’autres tests diagnostiques
sont souvent nécessaires pour confirmer la sévérité de la SA. Il s’agit essentiellement de l’échocardiographie de stress à la dobutamine (chez les patients avec SA à bas débit [SABD] et FEVG abaissée; c.à.d. SABD classique) ou à l’exercice (patients avec SABD et FEVG préservée; c.à.d. SABD paradoxal), et la mesure de la calcification de la valve aortique par tomographie. Cette situation est discutée en détails dans le chapitre 2 sur la SA à bas débit. Les autres causes de discordance AVA-gradient incluent : i) les erreurs de mesures (surtout le diamètre de la chambre de chasse du VG [CCVG]; ii) l’inconsistance dans les valeurs-seuils d’AVA et gradient utilisés dans les guides de pratique pour définir une sténose sévère (2,3). En effet, le seuil de 1 cm2 d’AVA pour définir une SA sévère ne correspond pas exactement à 40 mmHg mais plutôt à 30-35 mmHg (7,106); iii) patient(e) de petite taille (peut surestimer la sévérité de la sténose lorsque l’AVA n’est pas indexée); iv) la SA à bas gradient avec débit normal dont 50% des sténoses seraient sévères. Le bas gradient serait lié au moins en partie à la diminution à la compliance artérielle (107) (108). Dans l’ensemble, au moins un patient sur 3 environ peut se présenter avec une discordance AVA-gradient (106,109,110).
19
1.3.3.3 Retentissement sur le ventricule gauche
L’échocardiographie permet de préciser le type de remodelage ventriculaire (Figure 1-4), l’importance de l’HVG en calculant la masse VG, et le retentissement sur la fonction VG (111). L’évaluation du retentissement de la SA sur la fonction VG est important pour stratifier le risque et orienter la décision thérapeutique. Le paramètre échographique couramment utilisé est la FEVG. Elle peut être calculée par la méthode de Simpson (méthode de sommation des disques) ou la méthode Teicholz, ou estimée visuellement (111-113). La FEVG est le seul paramètre de fonction systolique mentionné dans les guides de pratique (2,3). Cependant, plusieurs études ont montré les limites de la FEVG notamment en présence de remodelage concentrique du VG et/ou de régurgitation mitrale où les dommages myocardique sont souvent sous-estimés (68,70,114-117). D’autres mesures plus sensibles permettent de détecter la dysfonction VG infra-clinique bien avant la baisse de la FEVG ou l’apparition des symptômes. La mesure de la déformation myocardique (ou strain), et notamment la déformation longitudinale, pourrait être utile notamment chez les patients asymptomatiques (63,65,118-121) (Voir chapitre 2, SA à bas débit).
1.3.4 Mesure de la calcification valvulaire par tomographie
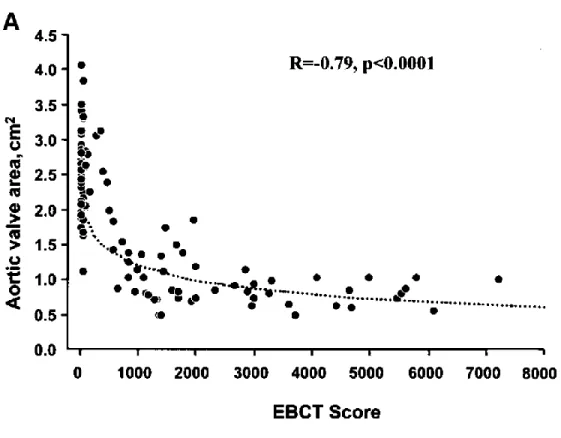
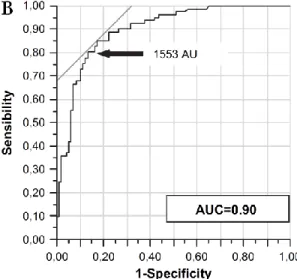
La tomographie axiale assistée par ordinateur (TACO) peut être particulièrement utile lorsque la sévérité de la sténose ne peut pas être confirmée par l’échographie-Doppler. En effet, la calcification valvulaire est la lésion principale rencontrée chez la plupart des patients avec SA fibro-calcifiante et sa quantification est indépendante du débit cardiaque. Plusieurs études ont montré que la sévérité de la calcification valvulaire corrèle avec la sévérité hémodynamique de la sténose (110,122-124). De plus, le score de calcification valvulaire était un prédicteur indépendant de la mortalité (125). Cependant, il est important de noter, que pour un même degré de sévérité hémodynamique, les femmes ont moins de calcification que les hommes (110,123,126). Ainsi, un score calcique >2000 UA chez les hommes et >1200 chez les femmes s’avère le plus précis pour identifier une sténose sévère (110). Cette différence selon le sexe persiste même après indexation du score calcique pour la taille de l’anneau aortique (c.à.d. densité calcique) (110). Ceci pourrait être lié en partie à un remaniement fibrotique des feuillets
20
de la valve aortique plus important chez les femmes que chez les hommes (126,127). Par ailleurs, chez les sujets jeunes (<50 ans) avec anomalie congénitale de la valve aortique (bicuspidie), le score calcique peut sous-estimer la sévérité de la sténose (128). Dans cette dernière étude, certains patients avaient une sténose sévère avec peu ou pas de calcification valvulaire.
Figure 1-8 : Mesure de la calcification valvulaire aortique (flèche) par tomographie. AV : valve aortique; AU : unité d’Agatston.
1.3.5 Cathétérisme cardiaque
Cette méthode invasive doit être réservée pour les cas discordants où l’échocardiographie et les autres tests non invasifs ne permettent pas de confirmer la sévérité de la sténose et chez les patients pour lesquels le diagnostic final peut changer la décision thérapeutique.
21
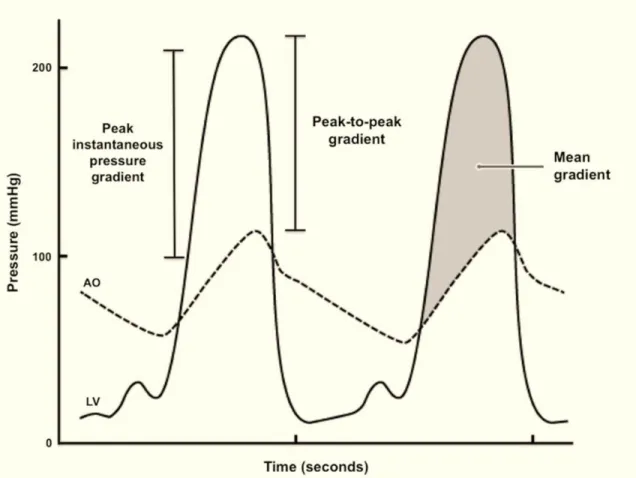
Figure 1-9 : évaluation de la sévérité de la sténose aortique par cathétérisme cardiaque. Ao : courbe de pression aortique; LV : courbe de pression ventriculaire gauche. Tiré de : https://www.google.ca/search?q=peak+to+peak+gradient&source=lnms&tbm=isch&sa=X&ved= 0ahUKEwi_lK_w4p_VAhVEbz4KHaVcBAMQ_AUIBigB&biw=1366&bih=612#imgdii=IevuEhp0FKzA IM:&imgrc=WzEGoGW7GH8hVM: 1.3.6 Autres méthodes 1.3.6.1 IRM cardiaque
Des études ont montré que l’IRM cardiaque peut être utile chez les patients avec SA (31,129). Elle permet d’évaluer la sévérité de la sténose et les dommages myocardiques et pourrait permettre également la caractérisation de la composition valvulaire (calcium, fibrose, etc…). Cependant cette analyse tissulaire de la valve aortique n’est pour l’instant possible que sur des valves explantées à cause du mouvement très rapide de la valve (31). L’analyse du myocarde est quant à elle possible. La détection et la quantification de la
22
fibrose myocardique à la fois focale et diffuse est un aspect très important de cette technique vu son intérêt pronostique (45,48,66,130-133). La perfusion de gadolinium permet d’objectiver la fibrose focale (rehaussement tardif) alors que les séquences T1 (« T1 mapping ») permet de quantifier la fibrose diffuse (45). Cependant, l’examen est limité par son coût et son accessibilité. De plus, les techniques de quantification de la fibrose diffuse restent à valider (45,134).
1.3.6.2 Imagerie de fusion ou méthode hybride
Pour surmonter les difficultés de mesures du diamètre et de la surface de la chambre de chasse VG (CCVG), certain investigateurs ont proposé une approche hybride dans laquelle la surface de la CCVG est mesurée par une technique 3D (TACO, IRM ou échocardiographie 3D), et les vélocités de CCVG et transvalvulaire sont mesurées par Doppler (135-138). Cependant, cette méthode n’a pas démontré sa supériorité sur l’AVA calculé par échographie-Doppler concernant la corrélation avec le gradient et la prédiction de devenir clinique des patients (136). De plus, cette approche semble surestimer l’AVA (135,139). Or, la valeur-seuil de 1 cm2
dans les guides de pratique pour définir une SA sévère est basée sur l’AVA mesurée par échographie-Doppler et elle a été largement validée par des données de devenir clinique (décès ou RVA pour symptômes). Cependant, ce seuil n’est pas forcement transposable à d’autres méthodes. À cet effet, une étude récente a montré que le meilleur seuil d’AVA mesurée par méthode hybride (TACO-Doppler) pour prédire le devenir clinique des patients était de 1.2 cm2 et non pas de 1 cm2 comme avec l’échocardiographie-Doppler (136).
1.3.7 Biomarqueurs sanguins
Il y a peu d’études portant sur l’intérêt des biomarqueurs sanguins dans la sténose aortique. Ces derniers peuvent être particulièrement utiles pour identifier les patients avec une sténose sévère asymptomatique qui pourraient bénéficier d’un RVA précoce et pour la stratification du risque de manière générale.
23
1.3.7.1 Peptide natriurétique de type B (BNP)
Le BNP est essentiellement secrété par le VG en réponse à l’augmentation du stress mécanique (stress pariétal) dû à la surcharge de pression ou de volume (140,141). On distingue 2 formes : 1) le BNP proprement dit qui est la forme active avec une demi-vie très courte, et 2) le NT-proBNP qui est inactif avec une demi-vie plus longue et des concentrations plus élevées que le BNP. Même si le BNP peut être utile pour la stratification du risque dans la SA (142-146), des limitations quant à son utilisation existent. Il existe en effet une importante variabilité dans les valeurs-seuil rapportés pour l’identification des patients à haut risque. Ceci peut être expliqué au moins en partie par le fait que ce biomarqueur, comme beaucoup d’autres biomarqueurs, n’est pas spécifique à la sténose aortique et son niveau plasmatique peut être influencé par les comorbidités associées comme l’hypertension artérielle, la maladie coronaire, l’obésité et l’insuffisance rénale, mais aussi par l’âge et le sexe du patient, (141,147). Pour surmonter cette limitation, les auteurs d’une récente étude ont proposé l’utilisation du ratio d’activation du BNP (valeur de BNP mesurée/valeur maximale de BNP attendue pour l’âge et le sexe du patient). Le ratio du BNP était un prédicteur puissant de mortalité dans la sténose aortique indépendamment de la sévérité de la SA et les comorbidités, y compris chez les patients asymptomatiques (147).
Par ailleurs, une étude récente a montré que le taux de BNP mesuré au pic de l’exercice était associé à la survenue des symptômes et la nécessité d’effectuer un RVA durant le suivi chez les patients avec SA sévère asymptomatique (148).
1.3.7.2 Troponine ultrasensible
La troponine est une protéine structurelle qui joue un rôle dans la régulation de la contraction des cardiomyocytes. Elle est formée de 3 sous-unités T, I et C. La troponine T et I sont spécifiques du myocarde. Les nouvelles techniques de dosage de la troponine cardiaque, dites « hypersensibles », permettent de détecter des quantités infimes de troponine avec une sensibilité et une spécificité élevées (141,149,150).
La troponine cardiaque est un puissant marqueur pronostique dans la maladie coronaire ainsi que dans différentes pathologies cardiaques (149-154). Cependant, peu de données sont disponibles sur l’intérêt de la troponine cardiaque dans la sténose aortique. Dans
24
l’étude par Chin et al. (154), les concentrations plasmatiques de troponine I ultrasensible étaient associées au degré d’HVG mesurée par IRM, la sévérité de la fibrose myocardique mesurée par IRM (rehaussement tardif au gadolinium) et la survenue d’évènements cardiovasculaire (RVA ou décès). Une étude antérieure incluant un faible nombre de patient avec SA avait montré que l’élévation de la troponine T ultrasensible était un marqueur d’HVG et de mauvais pronostic (155). D’autres études sont nécessaires pour préciser le rôle de le troponine ultrasensible dans la stratification du risque et la prise en charge des patients atteints de SA.
D’autres biomarqueurs sanguins émergents qui reflètent la souffrance myocardique
et/ou l’extension de fibrose myocardique comme le récepteur soluble de l’interleukine (sST2), la Galectine-3 ou encore la protéine épididymaire humaine de type 4 (HE4) ont été étudié dans le cadre d’insuffisance cardiaque et pourraient retrouver un intérêt dans la SA (141,156-158). Cependant, leur rôle exact et leur intérêt en pratique clinique reste à démontrer
1.4. Traitement
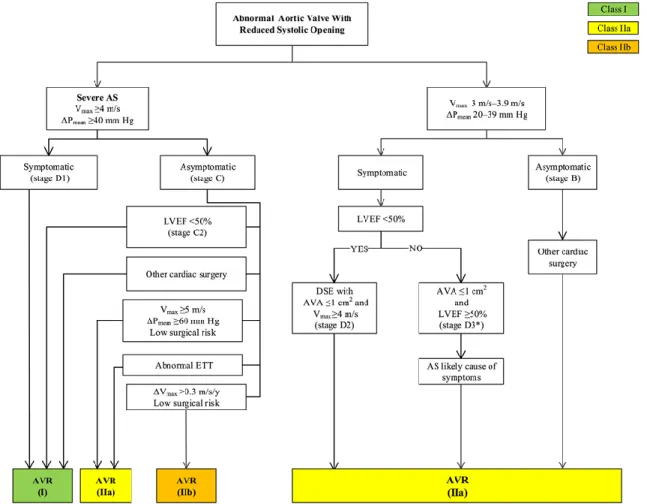
Le seul traitement disponible est le remplacement de la valve aortique malade par une prothèse. Le RVA est indiqué lorsque la SA est sévère avec présence de symptômes ou de dysfonction cardiaque (2,3). Chez les patients asymptomatiques avec FEVG préservée, plusieurs critères existent pour effectuer un RVA précoce afin d’éviter l’apparition de dysfonction VG, incluant une SA très sévère (Vmax ≥5 m/s) si le risque chirurgical est faible, un test à l’exercice anormal (une diminution de la tolérance à l’exercice ou une chute de la pression artérielle) ou lorsque une autre chirurgie cardiaque est prévue (3) (Figure 1-10). Deux techniques de remplacement valvulaire aortique existent actuellement. La chirurgie standard à cœur ouvert et le RVA transcatheter (TAVR ou TAVI). Même si la chirurgie standard reste la référence, le TAVI a gagné beaucoup de terrain. Depuis son introduction en pratique clinique, il y a une dizaine d’année pour le traitement des patients inopérables, le TAVI a beaucoup évolué. Il est
25
désormais l’alternative à la chirurgie standard chez les patients à haut risque, et il a été récemment approuvé aux États-Unis pour le traitement des patients avec SA sévère symptomatique et risque intermédiaire suite aux résultats très favorables avec la valve SAPIEN-3 (159,160). Des études cliniques sont en cours pour évaluer son efficacité et sa sécurité comparativement à la chirurgie pour le traitement des patients avec SA sévère symptomatique et bas risque chirurgical (Étude Partner 3). La prise en charge des patients avec SA à bas débit est développée à part (voir chapitre 2).
Figure 1-10 : indications du remplacement valvulaire aortique chez les patients avec SA. Reproduit avec permission d’après Nishimura et al.(3).
26
Chapitre 2 : La sténose aortique à bas
débit et bas gradient
27
Même si la majorité des patients ayant une SA se présentent avec un débit cardiaque normal, la SA avec bas débit cardiaque n’est pas rare. Environ 5-10% des patients ayant une SA sévère présentent un état de bas débit cardiaque avec fraction d’éjection ventriculaire gauche (FEVG) diminuée (<50%; c.-à-d. bas débit classique), et environ 10-25% présentent une SA à bas débit (SABD) malgré la présence d’une FEVG préservée (>50%; c.-à-d. bas débit paradoxal). La présence d’un faible débit cardiaque peut fausser l’évaluation de la sévérité de la sténose et conduire à une mauvaise décision thérapeutique. En effet, tous les paramètres de sévérité de la sténose aortique sont dépendants du débit (Q), et plus particulièrement le gradient transvalvulaire, car ce dernier est fonction carré du débit selon l’équation : Gradient=Q2
/(K x AVA2) où K est
une constante et AVA est l’aire valvulaire aortique. Ainsi, le bas débit s’accompagne souvent d’un bas gradient (<40 mmHg) en faveur d’une sténose non sévère avec une petite aire valvulaire aortique (AVA<1 cm2) en faveur d’une sténose sévère. Deux principaux défis se posent chez ces patients afin de guider le traitement: le premier est de différentier une SA vraiment sévère (SAVS) d’une SA pseudo-sévère (SAPS). Cette dernière est le résultat d’un ventricule gauche défaillant qui est incapable d’ouvrir complètement une valve légèrement ou modérément sténosée. Cette distinction est cruciale car le remplacement valvulaire est bénéfique seulement dans le cas de SA vraiment sévère selon les preuves disponibles à ce jour. Le deuxième défi est de quantifier avec précision les dommages myocardiques pour mieux stratifier le risque. Malheureusement, les paramètres traditionnels dérivés de l’échocardiographie de repos ou de stress qui sont utilisés pour évaluer la sévérité de la SA et la fonction cardiaque sont loin d’être optimaux. Par conséquent, la quantification de la sévérité de la maladie et la prise en charge thérapeutique peuvent être inappropriées dans une proportion non négligeable de ces patients.
Les deux entités de SA à bas débit mentionnées ci-dessus ont en commun le bas débit mais ont des différences majeures sur le plan physiopathologique, la présentation clinique ainsi que pour la prise en charge. Elles seront donc développées séparément.
28
2.1 SA à bas débit, bas gradient avec basse fraction
d’éjection : le bas débit, bas gradient classique
La SA à bas débit et bas gradient (SABD) avec diminution de la fraction d’éjection du ventricule gauche (FEVG) peut être rencontrée chez 5-10% des patients avec SA sévère (161,162). Elle est définie par la combinaison d’une aire valvulaire aortique (AVA) compatible avec une sténose sévère (AVA≤1.0 cm2
ou AVA indexée ≤0.6 cm2/m2), un gradient transvalvulaire aortique moyen bas (<40 mmHg) et une FEVG diminuée (<50 %), avec un état de bas débit (volume d’éjection systolique indexé <35 mL/m2
ou index cardiaque <3.0 L/min/m2) (102-105). Cependant, le débit transvalvulaire ne dépend pas seulement du volume d’éjection mais aussi du temps d’éjection, certains auteurs ont proposé de définir le bas débit comme un débit transvalvulaire moyen <200 ml/s (163,164). Cette situation de bas débit peut être le résultat de la SA elle-même, situation dans laquelle la baisse de la FEVG serait : i) la conséquence de la surcharge hémodynamique exercée par la valve aortique sévèrement sténosée sur le VG (165), ou ii) la conséquence d’une cardiomyopathie d’origine ischémique ou non ischémique concomitante à une sténose aortique. Le défi majeur dans cette condition est de faire la distinction entre une SA vraiment sévère (SAVS) qui est donc responsable au moins en partie de la baisse de la fraction d’éjection et du bas débit cardiaque, d’une SA pseudo-sévère (SAPS) concomitante à une cardiomyopathie sous-jacente responsable du bas débit. Cette distinction est cruciale à la fois pour le pronostic et la prise en charge thérapeutique. Les patients avec SAVS vont bénéficier du remplacement valvulaire aortique (RVA) alors que ceux avec SAPS pourraient ne pas en bénéficier. Le pronostic des patients avec SAVS est catastrophique en l’absence de RVA avec un taux de mortalité pouvant dépasser 50% à 2 ans, et le bénéfice du RVA, même s’il permet d’améliorer la survie chez ces patients, demeure limité par une mortalité péri-opératoire élevée, allant de 6 à 33% dépendamment de la présence ou l’absence de réserve de flux (anciennement, réserve contractile) et des comorbidités associées (102,143,161,166-175). Ceci est vraisemblablement dû au fait que la sélection des patients à opérer et ceux à ne pas opérer en se basant sur les critères utilisés en pratique (à la fois ceux pour définir la