Caractérisation des isoformes de la protéine
SPAM1 (Sperm Adhesion Molecule 1) et
identification de ses partenaires d’interactions dans
les spermatozoïdes
Mémoire
Andrée-Anne Saindon
Maîtrise en biologie cellulaire et moléculaire
Maître ès sciences (M. Sc.)
Québec, Canada
Caractérisation des isoformes de la protéine
SPAM1 (Sperm Adhesion Molecule 1) et
identification de ses partenaires d’interactions dans
les spermatozoïdes
Mémoire
Andrée-Anne Saindon
Sous la direction de :
Résumé
Sperm Adhesion Molecule 1 (SPAM1) est une protéine spermatique possédant une activité hyaluronidase dans son domaine N-terminal, contribuant à la dispersion des cellules du cumulus entourant l’ovocyte. Elle possède aussi une capacité de liaison à la zone pellucide (ZP) dans son domaine C-terminal. Nos études précédentes chez le taureau ont démontré la présence de deux isoformes potentielles de SPAM1 de ~70 et 80 kDa. Ces mêmes études ont permis d’émettre l’hypothèse que ces deux isoformes de SPAM1 ont des domaines C-terminaux différents, des origines différentes (testicule ou épididyme) et sont localisées dans la région acrosomale ou post-acrosomale du spermatozoïde. Puisque le domaine C-terminal est impliqué dans les interactions spermatozoïdes-ZP, nous voulions caractériser les deux domaines C-terminaux afin de mieux connaître le rôle de SPAM1 dans les interactions entre les gamètes. Deux transcrits de Spam1 ont été trouvés dans les tissus testiculaires et épididymaires. Ces transcrits possèdent une identité dans leur séquence nucléotidique en 3’ de la région codante, mais diffèrent par la présence ou l’absence de 90 nucléotides (exon 3 du gène Spam1). Nous avons identifié PH-20, une homologue potentielle de SPAM1 chez l’espèce bovine. Puisque SPAM1 et PH-20 sont similaires en N-terminal, notre anticorps dirigé contre la portion N-terminale de SPAM1 pourrait, théoriquement, reconnaître PH-20. Pour confirmer ceci, nous avons tenté de produire une protéine recombinante PH-20, mais sans succès. Nous voulions déterminer si SPAM1 fait partie d’un complexe multiprotéique impliqué dans les interactions spermatozoïdes-ZP, tel que rapporté chez l’humain. Nos résultats suggèrent que SPAM1 est associée aux protéines d’ancrage AKAPs, retrouvées majoritairement au niveau de la gaine fibreuse du flagelle des spermatozoïdes. La caractérisation des isoformes de SPAM1, de son homologue PH-20, ainsi que des complexes multiprotéiques dont fait partie SPAM1 sont importantes afin d’approfondir nos connaissances sur le rôle de SPAM1 dans les interactions entre les gamètes.
Abstract
Sperm Adhesion Molecule 1 (SPAM1) is a sperm protein that has a hyaluronidase activity in its N-terminus, aiding in the dispersal of the cumulus cells surrounding the egg. It also has a zona pellucida (ZP) binding activity in its C-terminus. Our previous studies showed that there are two potential SPAM1 isoforms that have a molecular weight of ~70 and 80 kDa in the bovine species. From these studies, we hypothesized that these two SPAM1 isoforms had different C-terminal domains, different origins (testis or epididymis) and were localised in the acrosomal or post-acrosomal regions of spermatozoa. Seeing as it is the C-terminal domain that is involved in ZP binding, we aimed to characterize the two C-terminal domains in order to better understand SPAM1’s role in gamete interactions. Although the 3’ nucleotide sequences were identical, two Spam1 transcripts varying by the presence or absence of 90 nucleotides (exon 3 of the Spam1 gene) were found in both testicular and epididymal tissues. During our studies, we also identified PH-20, a potential SPAM1 homolog. In order to determine if PH-20 is one of the two potential SPAM1 isoforms that is recognized by our antibody directed against the N-terminal domain, we attempted the production of a PH-20 recombinant protein, without success. We also sought to determine if SPAM1 is part of a multimeric protein complex involved in spermatozoa-ZP interactions, as reported in humans. Our results suggest that SPAM1 is associated with AKAPs, which are anchoring proteins abundantly found in the fibrous sheath of sperm flagella. Characterizing the SPAM1 isoforms, its homolog PH-20, as well as the multimeric protein complexes SPAM1 is part of, are important in order to better understand SPAM1’s role in gamete interactions.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... ix
Remerciements ... x Avant-propos ... xi Chapitre 1 Introduction ... 1 1.1 Le testicule ... 1 1.1.1 La spermatogenèse ... 4 1.2 Le spermatozoïde ... 5 1.2.1 La tête ... 6 1.2.1.1 Le noyau ... 7 1.2.1.2 L’acrosome ... 8 1.2.2 Le flagelle ... 8 1.3 La maturation épididymaire ... 10
1.4 Transit des spermatozoïdes dans le tractus reproducteur femelle... 13
1.4.1 Capacitation ... 14
1.4.2 Hyperactivation ... 16
1.4.3 Réaction acrosomale ... 17
1.4.4 Interactions entre les gamètes ... 19
1.4.4.1 Interaction spermatozoïde-cumulus oophorus ... 19
1.4.4.2 Interaction spermatozoïde-zone pellucide ... 21
1.4.4.3 Interaction spermatozoïde-ovocyte ... 22
1.5 Hyaluronidases ... 23
1.5.1 PH-20/SPAM1 : les débuts ... 24
1.5.2 SPAM1 : Bos taurus ... 25
1.6 Problématique ... 27
1.6.1 Hypothèse ... 28
1.6.2 Objectifs ... 28
Chapitre 2 Two Spam1 transcript variants are expressed in bovine testis and epididymis, but they fail to explain the two isoforms found in ejaculated spermatozoa ... 30
2.1 Résumé ... 30
2.2 Abstract ... 32
2.3 Introduction ... 33
2.4 Materials and Methods ... 35
2.5 Results ... 42
2.6 Discussion ... 49
2.7 References ... 53
Chapitre 3 PH-20 : une homologue de SPAM1 présente dans les spermatozoïdes de taureaux ? ... 57
3.1 Introduction ... 57
3.3 Résultats ... 67
3.4 Discussion ... 72
3.5 Références ... 75
Chapitre 4 Les partenaires d’interactions de SPAM1 ... 77
4.1 Introduction ... 77
4.2 Matériels et méthodes ... 80
4.3 Résultats ... 86
4.4 Discussion ... 93
4.5 Références ... 98
Chapitre 5 Discussion générale ... 102
Bibliographie ... 108
Liste des tableaux
Tableau 3-1 Séquences des amorces utilisées pour les amplifications de Ph-20. ... 61 Tableau 4-1 Protéines identifiées par LC-MS/MS après immunoprécipitation avec
l’anticorps C-terminal. ... 90 Tableau 1 Liste complète des protéines identifiées dans les échantillons non-fixés et fixés
Liste des figures
Figure 1-1 Structure générale du testicule. ... 2
Figure 1-2 Section d’une coupe transversale d’un tubule séminifère. ... 3
Figure 1-3 Structures principales du spermatozoïde mammifère mature. ... 5
Figure 1-4 Formes de la tête des spermatozoïdes chez diverses espèces. ... 6
Figure 1-5 Ultrastructure d’une coupe du flagelle du spermatozoïde de mammifère. ... 9
Figure 1-6 Anatomie du système reproducteur de la femme... 14
Figure 1-7 Patrons de la motilité activée et hyperactivée des spermatozoïdes chez différentes espèces. ... 16
Figure 1-8 Les différents stades de la réaction de l’acrosome des spermatozoïdes. ... 18
Figure 1-9 Les composantes du complexe cumulus-ovocyte (CCO). ... 19
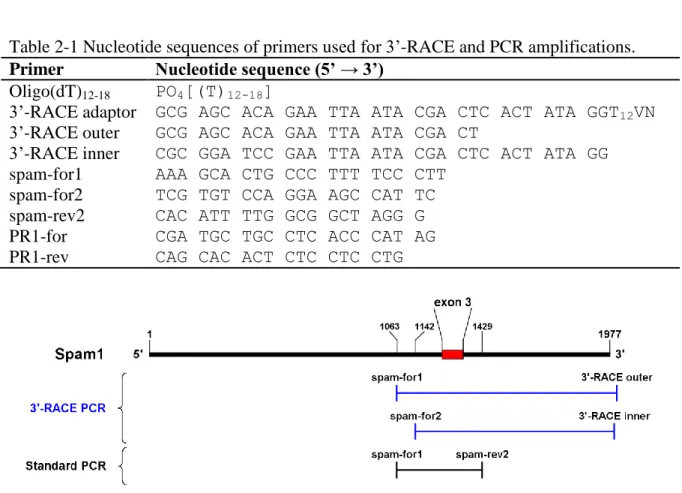
Figure 2-1 Location of the primers used for 3’-RACE and standard PCR along the Spam1 transcript. ... 37
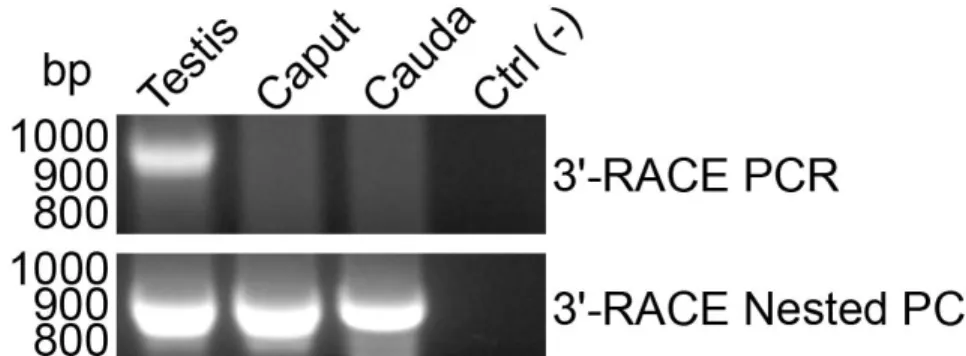
Figure 2-2 3’-RACE PCR amplifications of the 3’ region of the Spam1 transcript. ... 43
Figure 2-3 Deduced amino acid sequences from testis, caput, and cauda amplifications of the 3’ region of Spam1. ... 44
Figure 2-4 Amplification of the Spam1 and Protamine 1 transcripts in tetraploid (4N; primary spermatocytes) and haploid (1N; spermatids) cells. ... 45
Figure 2-5 Immunodetection of SPAM1 isoforms following 2D gel electrophoresis. ... 46
Figure 2-6 Immunodetection of deglycosylated SPAM1. ... 47
Figure 2-7 Peptide coverage of SPAM1 following chymotrypsin digestion and LC-MS/MS analysis. ... 48
Figure 3-1 Alignement du peptide immunogène de p60vsrc, PH-20 et SPAM1. ... 58
Figure 3-2 Localisation des amorces utilisées le long du transcrit putatif Ph-20. ... 61
Figure 3-3 Carte du vecteur d’expression pET-16b. ... 62
Figure 3-4 Comparaison des séquences protéiques de SPAM1 et PH-20. ... 68
Figure 3-5 Schématisation des caractéristiques potentielles de la protéine prédite PH-20. . 69
Figure 3-6 Amplification du transcrit Ph-20 dans les tissus testiculaires et épididymaires bovins. ... 70
Figure 3-7 Coloration à l’argent des protéines des fractions des étapes d’expression et de purification de PH-20rec. ... 71
Figure 3-8 Immunobuvardage des fractions de l’expression et de la purification de la protéine recombinante PH-20rec. ... 71
Figure 4-1 Immunodétection des complexes obtenus après différentes conditions de fixation et de solubilisation. ... 87
Figure 4-2 Complexes multiprotéiques dont SPAM1 fait partie. ... 88
Figure 4-3 Immunodétection des complexes formés par SPAM1 après immunoprécipitation. ... 89
Figure 4-4 Alignement des séquences des domaines de dimérisation et d’arrimage (DD) des protéines interagissant avec AKAP3 et AKAP4. ... 91
Figure 4-5 Immunobuvardage des complexes formés avec AKAP3 et AKAP4. ... 91
Liste des abréviations
3’-RACE L’amplification rapide des extrémités de l’ADNc en 3’ ACRBP Protéine de liaison à l’acrosine (Acrosin Binding Protein) ADAM A disintegrin and metalloproteinase
AKAP Protéine d’ancrage des kinases dépendantes de l’AMPc AMPc Adénosine monophosphate cyclique
ARSA Arylsulfatase A
ATP Adénosine triphosphate
CCO Complexe cumulus-ovocyte
CRISP Protéine sécrétoire riche en cystéines (Cysteine-rich secretory protein)
DTT Dithiothreitol
FS Gaine fibreuse (fibrous sheath) GPI Glycosylphosphatidylinositol GSTM3 Glutathion s-transférase mu 3
HA Acide hyaluronique
HSPA2 Protéines de choc thermique A2 (Heat Shock Protein A2) IAM Membrane interne de l’acrosome (Inner acrosomal membrane) IP3 Inositol-1,4,5-triphosphate
MMP2 Métallo-protéase de la matrice
OAM Membrane externe de l’acrosome (Outer acrosomal membrane) ODF Fibres denses externes (Outer dense fibers)
OXPHOS Phosphorylation oxydative PI3K Phosphatidylinositol-3-kinase
PIP2 Phosphatidylinositol-1,4-bisphosphate
PI-PLC Phospholipsase C spécifique à la phosphatidylinositol
PKA Protéine kinase A
SACY Adénylyl cyclase atypique soluble SPAM1 Sperm Adhesion Molecule 1
TM Transmembranaire
Remerciements
En 2012, j’ai fait le choix de retourner aux études pour poursuivre mon intérêt dans les sciences pures. Mon baccalauréat en microbiologie comportait une option de stage après la deuxième année d’études. En ne m’imaginant jamais dans un laboratoire, j’ai posé ma candidature pour un stage… en laboratoire! Étant ouverte quant au choix du domaine, j’ai commencé mon stage dans le laboratoire du Dr. Pierre Leclerc en reproduction. J’ai vite été piquée par la recherche et par le domaine de la reproduction! Pour ceci, je tiens à remercier Pierre Leclerc d’avoir éveillé en moi l’intérêt en recherche. Merci d’avoir vu mon potentiel et de m’avoir offert une très belle expérience de travail dans ton laboratoire!
J’aimerais aussi remercier Catherine Lachance. Même si notre temps ensemble n’a duré que quelques mois, tu étais présente pour répondre à mes mille-et-une questions de débutant en laboratoire, merci! Serge Goupil : grand, noctambule… et ressource indispensable. Un gros merci pour l’aide concernant les techniques de laboratoire et les nombreuses discussions sur SPAM1! Je tiens aussi à remercier Loïze Maréchal, qui était, pendant deux ans, ma complice en laboratoire. J’ai beaucoup apprécié ton amitié et nos petites pauses thés. J’aimerais souligner l’aide de Christine Légaré concernant les nombreux conseils pour la production de la protéine recombinante PH-20, merci!
Un immense merci à mon amoureux, Pierre Gagnon. Ton appui continuel pendant mon retour aux études au baccalauréat et ensuite à la maîtrise était important et pour ça, je suis très reconnaissante. Enfin, un gros merci à ma famille et mes amis pour avoir soutenu ma décision de retourner aux études et les nombreux mots d’encouragement en cours de route.
Merci infiniment à vous tous, sans oublier toutes les autres personnes qui ont fait partie de mon parcours à la fois académique et personnel!
Avant-propos
Ce mémoire regroupe principalement les résultats de recherche obtenus pendant mes deux années en maîtrise, mais aussi une partie des résultats de mon temps au laboratoire du Dr. Pierre Leclerc comme stagiaire. Le premier chapitre fait un bref survol de ce qui est connu sur la spermatogenèse et la structure du spermatozoïde, ainsi que sur la maturation des spermatozoïdes et de leur transit dans le tractus génital femelle. Les évènements précédant la fécondation seront aussi discutés. Ce chapitre termine en présentant les différentes hyaluronidases connues chez les spermatozoïdes, avec une attention particulière sur SPAM1, la protéine d’intérêt de mon projet de maîtrise. Le deuxième chapitre porte sur mes résultats principaux obtenus concernant les transcrits et les isoformes de la protéine SPAM1. Il est écrit sous forme d’article, car il est en préparation pour la soumission à un journal scientifique. J’ai (AAS) réalisé l’ensemble des expériences et la préparation des figures. L’analyse des résultats a été faite par AAS et mon directeur, Dr. Pierre Leclerc (PL). La première version de l’article a été rédigée par AAS, alors que la révision a été complétée en collaboration avec PL. Le projet a initialement été conçu par PL. En cours de route, selon certains résultats obtenus, plusieurs projets secondaires ont découlés, mais n’ont malheureusement pas pu être complétés avant la fin de ma maîtrise. En ayant obtenu beaucoup de résultats prometteurs, les chapitres trois et quatre sont consacrés à ces projets secondaires. Le chapitre 3 discute d’une homologue potentielle de SPAM1, nommée PH-20, et sa détection possible par nos anticorps contre SPAM1. Le chapitre 4 présente les complexes multiprotéiques dont SPAM1 ferait partie. Le mémoire termine au chapitre 5 avec la discussion générale, qui incorpore les données obtenues dans le contexte des connaissances actuelles et comporte les perspectives de recherche sur la protéine SPAM1.
Chapitre 1
Introduction
1.1 Le testicule
Le système reproducteur mâle a pour but ultime de produire et transporter des spermatozoïdes aptes à la fécondation de l’ovocyte dans le système reproducteur femelle. Il est constitué de plusieurs organes travaillant ensemble, dont le scrotum, les testicules, les épididymes, les vas deferens, les vésicules séminales, les glandes bulbouréthrales, la prostate, l’urètre et le pénis. Les spermatozoïdes sont produits dans les testicules et résultent d'un processus de prolifération, de division et de différenciation cellulaire nommé la spermatogenèse. Suivant ce processus, les spermatozoïdes sont progressivement relâchés dans la lumière des tubules séminifères pour se retrouver dans l’épididyme par l’intermédiaire du rete testis et les canaux efférents. À ce stade, les spermatozoïdes sont immotiles et immatures. C’est lors de leur séjour dans les différents segments de l’épididyme que les spermatozoïdes deviennent matures et acquièrent leur motilité. Les spermatozoïdes matures résident dans la queue de l’épididyme jusqu’à l’éjaculation. L’éjaculation permet le contact des spermatozoïdes avec les sécrétions de la prostate, des vésicules séminales et de la glande bulbo-urétrale. Une fois dans le tractus génital femelle, les spermatozoïdes subissent de nombreux changements physico-chimiques, connus sous le nom de capacitation, tout en poursuivant leur trajet périlleux vers l’ovule.
Le testicule, la gonade masculine, est localisé à l’extérieur du corps de l’homme dans le scrotum. Ceci est par opposition à l’ovaire, la gonade féminine, qui se retrouve dans la cavité abdominale de la femme. Le positionnement particulier de cet organe a été attribué à la nécessité d’une température plus basse, par rapport à ce qui est retrouvé dans la cavité abdominale, pour une spermatogenèse fonctionnelle (Crew, 1922). La tunica albuginea, un dense tissu conjonctif, recouvre le testicule et protège les multiples structures fragiles, dont les tubules séminifères, qui composent le testicule. Chaque tubule est enroulé sur lui-même
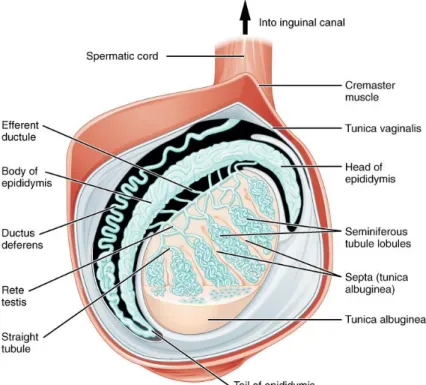
formant un lobule et chaque lobule, séparé par un septum, est connecté au rete testis pour ainsi faire le pont entre le testicule et l’épididyme (Figure 1-1).
Figure 1-1 Structure générale du testicule. Les tubules séminifères sont regroupés en lobules, qui sont eux séparés par des septa. Le tout est recouvert de la tunica albuginea, un tissu conjonctif (OpenStax College, 2017).
La spermatogenèse se produit dans l’épithélium des tubules séminifères. L’épithélium séminifère est composé d’un seul type de cellules somatiques, les cellules de Sertoli, et de différents types de cellules germinales (Hess et de Franca, 2009). Les cellules de Sertoli sont surtout connues pour la forme de leur noyau, leurs prolongations cytoplasmiques et leurs associations intimes avec les cellules germinales (França et al., 2016). Ces cellules polarisées assurent le développement des cellules germinales en fournissant à ceux-ci des micronutriments au travers de la barrière hémato-testiculaire (Sylvester et Griswold, 1994). Puisque les gamètes mâles sont produits dès la puberté, après la maturation du système immunitaire et de l’établissement de la reconnaissance du soi, la barrière hémato-testiculaire constitue un élément crucial pour la production appropriée des spermatozoïdes. La barrière, formée par les jonctions serrées entre les cellules de Sertoli ainsi qu’entre la lame basale et les cellules de Sertoli, établit un environnement immunitaire privilégié pour
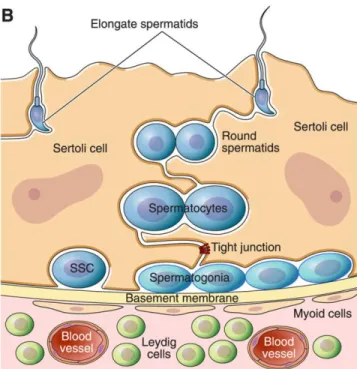
les cellules germinales (Fijak et Meinhardt, 2006; Mital et al., 2011). La Figure 1-2 démontre les différentes composantes de l’épithélium séminifère, ainsi que les gamètes mâles en différentes phases de différenciation.
Figure 1-2 Section d’une coupe transversale d’un tubule séminifère. Les jonctions serrées (tight junctions) entre les cellules de Sertoli et la membrane basale (basement membrane) entourant le tubule, aident à former la barrière hémato-testiculaire. Les gamètes, en différentes phases de différenciation, sont démontrés : les cellules souches (SSC;
spermatogonial stem cell), les spermatogonies, les spermatocytes et les spermatides ronds
et en phase d’élongation. Les cellules de Leydig se retrouvent dans le tissu interstitiel. Schéma de Oatley et Brinster (2012).
Un autre type de cellule de grande importance se retrouvant dans le testicule est la cellule de Leydig. Ces cellules font partie du tissu interstitiel, c’est-à-dire le tissu qui se situe entre les tubules séminifères (Figure 1-2). L’enzyme 3β-hydroxystéroïde déshydrogénase, qui est responsable de transformer, entre autres, l’androstenediol en testostérone, a été retrouvée dans les cellules interstitielles du testicule (Wattenburg, 1958). Depuis, il est connu que les cellules de Leydig sont de grandes productrices de la testostérone, en réponse à l’hormone lutéinisante. Tous ces types cellulaires de l’épithélium séminifère, le lieu de la spermatogenèse, ainsi que les cellules des tissus environnants, travaillent de concert pour la production des spermatozoïdes fonctionnels.
1.1.1 La spermatogenèse
Afin d’obtenir une cellule haploïde hyperspécialisée, le gamète mâle doit subir plusieurs étapes de transformation. L’ensemble de ces transformations, nommé la spermatogenèse, peut être divisé en trois grandes phases : la phase proliférative, la phase méiotique et la phase de différenciation.
La première phase implique la prolifération des cellules germinales diploïdes : les spermatogonies. Les spermatogonies peuvent être classées selon leur apparence, soit de type A ou de type B, et ce, chez plusieurs espèces dont le rat, l’homme et le taureau. Il existe certaines variations dans le classement selon l’espèce. Par exemple, chez l’homme, le type A peut être divisé en deux sous-types : pâle (Ap) et foncé (Ad). C’est la spermatogonie de type Ap qui entre en mitose pour donner une cellule qui conserve son état de spermatogonie de type A et une cellule qui se transforme en spermatogonie de type B. Ceci assure une population constante de cellules qui se renouvèlent et se divisent. La spermatogonie de type B est la cellule qui se transforme en spermatocyte primaire, qui poursuit à la deuxième phase de la spermatogenèse (Clermont, 1972).
La deuxième phase, la phase méiotique, est caractérisée par la recombinaison du matériel génétique par les chromosomes homologues et par la réduction de la ploïdie des spermatocytes. Les spermatocytes primaires, issues des spermatogonies B, subissent une première division méiotique pour donner des spermatocytes secondaires. La deuxième vague de division méiotique transforme les spermatocytes secondaires en spermatides ronds (Clermont, 1972). À la fin de la phase méiotique, une spermatogonie de type B diploïde et ayant 46 chromosomes (2n, 2c) produira quatre spermatides haploïdes avec 23 chromatides (1n, 1c) (Cohen et Holloway, 2015).
La dernière phase, la phase de différenciation, est aussi connue comme la spermiogenèse. Le nombre d’étapes de la spermiogenèse varie selon les espèces. Par exemple, chez le rat, elle comprend 14 étapes de transformation. Pendant cette dernière phase, les spermatides ronds subissent de très grands changements morphologiques,
donnant naissance au spermatozoïde. Les changements caractéristiques de la spermiogenèse sont : la formation de l’acrosome, la condensation du noyau, la réorganisation du cytoplasme et des organelles et l’élongation du flagelle. La durée totale de la spermatogenèse varie aussi d’espèce en espèce (Clermont, 1972). Chez le taureau, la durée est d’environ 54 jours (Hochereau et al., 1964).
1.2 Le spermatozoïde
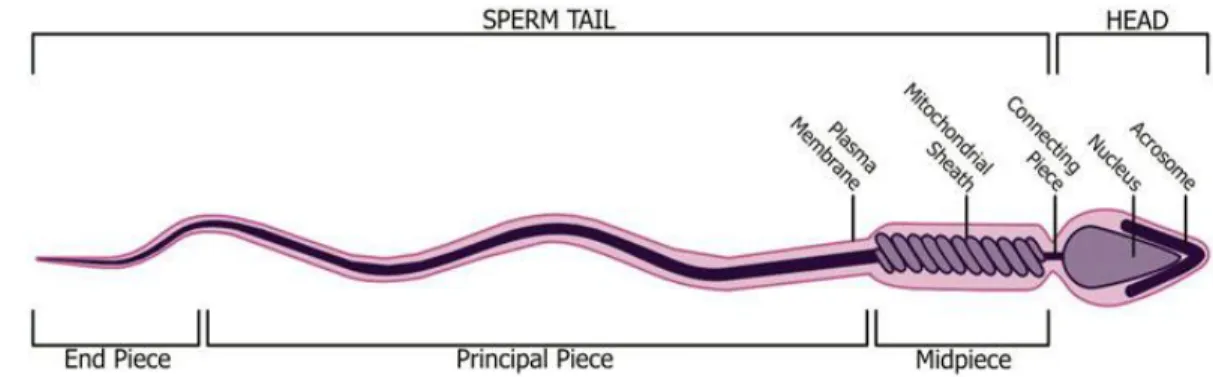
Le gamète mâle a été visualisé pour la première fois par le néerlandais Antoine van Leeuwenhoek, en 1677. Cet homme passionné par la microscopie décrivit cette cellule comme ayant un corps rond et une queue de cinq à six fois la longueur du corps (Karamanou et al., 2010). Bien évidemment, depuis ce temps, nous en savons considérablement plus au sujet de la structure complexe du spermatozoïde. Le spermatozoïde est une cellule hyperspécialisée et bien compartimentée, et peut être divisé en deux grandes parties : la tête et le flagelle. Le flagelle peut être subdivisé en trois pièces : intermédiaire, principale, et terminale (Figure 1-3). Alors que les fonctions de la fécondation soient confinées à la tête du spermatozoïde, la motilité est prise en charge par le flagelle (Buffone et al., 2012).
.
Figure 1-3 Structures principales du spermatozoïde mammifère mature. La tête, qui contient l’acrosome et le noyau, est attachée au flagelle par la pièce connectrice (cou). Le flagelle est composé de la pièce intermédiaire (qui comprend la couche mitochondriale), la pièce principale (la plus longue portion du spermatozoïde) et la pièce terminale. Figure de Borg et al. (2010).
La tête du spermatozoïde est essentiellement composée du noyau et de l’acrosome et a pour fonction de féconder l’ovocyte. Le noyau contient l’information génétique haploïde très compactée, alors que la région acrosomale comprend la vésicule acrosomale. Cette dernière contient une multitude d’enzymes et autres constituants qui participent à la pénétration du cumulus oophorus et à la liaison et la pénétration de la zone pellucide de l’ovocyte. Le flagelle est responsable de la motilité du spermatozoïde en le propulsant à travers les diverses sections du tractus génital femelle et du cumulus oophorus pour atteindre l’ovocyte.
1.2.1 La tête
La forme de la tête du spermatozoïde est caractéristique et varie grandement selon les espèces. La Figure 1-4 démontre les différentes formes que peuvent avoir les têtes des spermatozoïdes. Elle peut être falciforme (en crochet) comme chez le rat et la souris, ou elle peut plutôt être en forme de spatule comme chez l’humain et le taureau (Kojima, 1966; Eddy, 2003).
Figure 1-4 Formes de la tête des spermatozoïdes chez diverses espèces. La tête du spermatozoïde est falciforme chez plusieurs rongeurs et plutôt en forme de spatule chez l’humain, le lapin et le cobaye. Figure de Eddy (2003).
1.2.1.1 Le noyau
Il est connu depuis la fin du 19e siècle que des nucléohistones sont présentes dans les noyaux des cellules testiculaires immatures, alors que des nucléoprotamines sont présentes dans les spermatozoïdes matures (Alfert, 1956). Nous savons maintenant que la majorité des histones, auxquelles l’ADN est enroulé, sont remplacées par des protamines chez la plupart des mammifères, tels que la souris (Kleene et al., 1985), le taureau (Coelingh et al., 1972), et chez des plantes (Reynolds et Wolfe, 1978), vers la fin de la spermiogenèse. Les protamines seraient alors présentes chez les spermatides pendant les dernières étapes de la différenciation (Alfert, 1956). Le matériel génétique des spermatozoïdes matures se trouve dans un état très condensé grâce à la présence des protamines. Chez la plupart des mammifères étudiés, la majorité des histones sont d’abord remplacées par des protéines de transition pendant la phase d’élongation des spermatides. En fait, seulement entre 1 à 15% des histones demeurent liées à l’ADN chez les spermatozoïdes de mammifères (Sillaste et al., 2017). Vers la fin de la spermiogenèse, les protamines sont synthétisées et se lient à l’ADN haploïde, remplaçant les protéines de transition (Wouters-Tyrou et al., 1998). Il existe deux gènes pour les protamines chez les mammifères, Prm1 et Prm2. Alors que le gène encodant la protamine 1 (P1) est transcrit et traduit dans les spermatides de tous les mammifères étudiés, le gène encodant la protamine 2 (P2) n’est transcrit et traduit que chez quelques mammifères. Par exemple, les spermatides des souris et des humains contiennent les protamines P1 et P2 et chez les taureaux, on ne retrouve que la protamine 1 (Balhorn, 2007).
Bien que la raison absolue pour la condensation ne soit pas connue, il a été suggéré qu’elle rend la tête du spermatozoïde plus hydrodynamique, permettant un passage plus efficace dans le tractus génital femelle, notamment pendant la pénétration de la zone pellucide de l’ovocyte. Une deuxième hypothèse est que la condensation de l’ADN par les protamines permet de protéger l’ADN contre les dommages physiques et chimiques (Braun, 2001). Finalement, une étude menée par Kierszenbaum et Tres (1975) a démontré que la présence des protamines concorde avec l’arrêt de la transcription dans les spermatozoïdes de souris. La condensation de l’ADN par les protamines pourrait alors jouer un rôle dans
l’arrêt de la transcription dans les spermatides en phase d’élongation et possiblement dans la protection de l’ADN et de l’efficacité du transit dans le tractus reproducteur femelle.
1.2.1.2 L’acrosome
L’acrosome est délimité par une membrane ayant une section interne faisant face au noyau (membrane interne de l’acrosome; IAM) et une section externe faisant face à la membrane plasmique (membrane externe de l’acrosome; OAM) (Florman et Fissore, 2015). L’acrosome, qui est essentiellement une vésicule exocytotique, possède deux grandes fonctions : la première étant la liaison et la pénétration de la zone pellucide et la deuxième étant de permettre l’interaction du spermatozoïde avec l’œuf. L’acrosome contient une multitude de protéines, relarguées pendant la réaction de l’acrosome, qui participent à la liaison et la pénétration de la zone pellucide de l’ovocyte (Foster et Gerton, 2016). La réaction de l’acrosome ainsi que les évènements qui la déclenche seront discutés plus en détail à la section 1.4.3.
1.2.2 Le flagelle
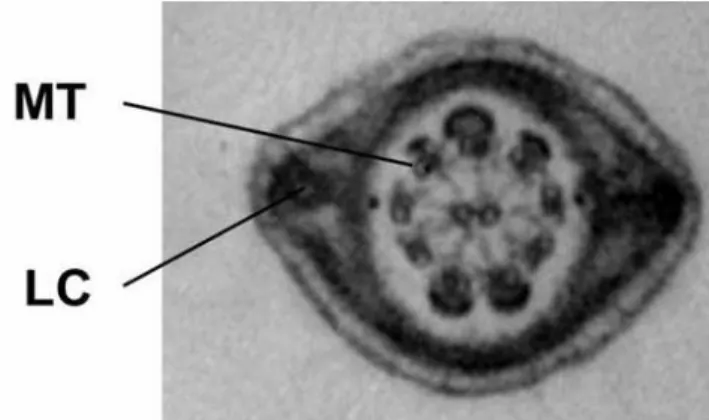
Le flagelle du spermatozoïde est la pièce qui permet le déplacement de ce dernier. Le flagelle est composé de diverses structures dont l’axonème. L’axonème est organisé en paires de microtubules dans un arrangement 9 + 2 ou neuf paires périphériques et une paire centrale, qui se retrouve sur toute sa longueur (Figure 1-5).
Le flagelle est capable de courber grâce aux paires de microtubules externes et des « bras » de dynéine. Brièvement, avec l’aide des protéines motrices de dynéine, qui dépendent de l’ATP et le Mg2+
, les paires de microtubules glissent l’une par rapport à l’autre (cisaillement), ce qui génère les courbures (Lindemann et Lesich, 2016).
Figure 1-5 Ultrastructure d’une coupe du flagelle du spermatozoïde de mammifère. La coupe du flagelle de la souris, visualisée par microscopie électronique à transmission, représente une section de la pièce principale. L’axonème est composé de 9 + 2 paires de microtubules (MT). Les colonnes latérales (LC; lateral columns) de la gaine fibreuse sont démontrées (Lindemann et Lesich, 2016).
La seule partie du spermatozoïde qui contient des mitochondries est la pièce intermédiaire du flagelle. Les mitochondries sont enveloppées autour de l’axonème, formant une gaine mesurant environ 11 μm chez les spermatozoïdes bovins (Saacke et Almquist, 1964). Les fibres denses externes (ODF; outer dense fibers) sont des structures accessoires du flagelle du spermatozoïde et sont chacune associées à une paire de microtubules externe. Ces ODF, composées de matériau ressemblant à la kératine, s’étendent le long de la pièce intermédiaire et une portion de la pièce principale du flagelle (Eddy, 2003; Lindemann et Lesich, 2016). Le deuxième type de structure cytosquelettique du flagelle est la gaine fibreuse (FS; fibrous sheath). La gaine fibreuse entoure les ODF dans la région de la pièce principale. La FS est un site d’ancrage pour protéines impliquées dans les réactions métaboliques, rendant cette structure importante pour les processus tels que la glycolyse (Fenderson et al., 1988; Welch et al., 2000; Eddy et al., 2003). La FS est constituée en grande partie par les protéines d’échafaudage ou d’ancrage cAMP-dependent
protein kinase anchoring proteins (AKAPs; protéines d’ancrage des kinases dépendantes de
l’AMPc). En étant capable de se lier aux sous-unités régulatrices de la protéine kinase dependante de l’AMPc (PKA), les AKAPs sont impliquées dans diverses voies de signalisation dans la pièce principale du flagelle (Carrera et al., 1994; Eddy et al., 2003). La région où la gaine fibreuse termine marque le début de la pièce terminale, qui ne contient que l’axonème (Fawcett, 1975).
Bien évidemment, le spermatozoïde requiert beaucoup d’énergie pour effectuer ses déplacements vers l’ovocyte. Cependant, la voie métabolique favorisée par le spermatozoïde pour la production de son ATP n’est toujours pas élucidée. Il est connu que la production d’ATP par phosphorylation oxydative (OXPHOS) soit plus efficace que par la glycolyse (Alberts et al., 2008). Par contre, il y a des résultats contradictoires en ce qui concerne l’efficacité de diffusion de l’ATP produite par l’OXPHOS (dans la pièce intermédiaire) le long du flagelle. Puisque la gaine fibreuse de la pièce principale est associée aux enzymes impliquées dans la glycolyse, cette voie est aussi à considérer comme pouvant produire l’énergie nécessaire pour la motilité (du Plessis et al., 2015). Jusqu’à maintenant, il est encore incertain si la motilité du spermatozoïde est alimentée par la production d’ATP par l’OXPHOS, la glycolyse, une combinaison des deux (du Plessis et al., 2015) ou est tout simplement dépendant des nutriments disponibles dans l’environnement dans lequel les spermatozoïdes se trouvent.
1.3 La maturation épididymaire
Une fois relâchés de l’épithélium séminifère, les spermatozoïdes sont emportés vers le rete testis et les canaux efférents pour ensuite amorcer leur séjour dans l’épididyme, l’organe accolé au testicule (Figure 1-1). L’épididyme est composé d’un seul tubule enroulé sur lui-même, mesurant environ 5 m chez l’humain et jusqu’à environ 50 m chez les gros animaux domestiques, comme le taureau (Bedford, 1994). Le transit épididymaire par le spermatozoïde humain prend en moyenne de deux à quatre jours et, chez la plupart des animaux, le transit peut prendre une à deux semaines (Bedford, 1994; Belleannée et al., 2012). Malgré le fait que l’épididyme est composé d’un seul tubule, il peut être divisé en trois grandes sections : la tête, le corps, et la queue (Figure 1-1).
Pendant un certain temps, l’épididyme était éclipsé par l’intérêt aux composantes des testicules et était considéré comme étant uniquement un réservoir pour les spermatozoïdes. Cependant, le chercheur Myers-Ward (1897) suggéra, suivant ses observations microscopiques des coupes épididymaires chez l’humain, que les cellules de l’épididyme auraient une fonction sécrétoire sustentant les spermatozoïdes. Au courant des années 1960,
l’importance de l’épididyme pour la maturation des spermatozoïdes a été révélée par diverses expériences chez le lapin. Ces expériences évaluaient la capacité fécondante des spermatozoïdes suite à leur maturation dans différents niveaux de l’épididyme ou dans l’utérus (Bedford, 1967; Orgebin-Crist, 1967).
À la fin de la spermatogenèse, le spermatozoïde sort du testicule possédant une bonne morphologie, mais il est immotile et incapable de féconder l’ovocyte (Dacheux et Dacheux, 2014). Pendant les dernières phases de la spermiogenèse, l’arrêt de la transcription a été démontré (Kierszenbaum, 1975). En ce qui concerne la traduction, certaines études ont démontré l’absence de la production des protéines alors que d’autres, notamment chez les taureaux et les souris, ont démontré la présence de la biosynthèse protéique par les ribosomes mitochondriaux (Premkumar et Bhargava, 1972; Bragg et Handel, 1979). Cependant, puisque le spermatozoïde est incapable de féconder l’ovocyte à ce stade, il doit nécessairement subir des changements subséquents le rendant apte à la fécondation. Ces changements n’impliqueraient pas la transcription ni la traduction des gènes de son noyau, d’où la notion de la maturation épididymaire.
La motilité spermatique est acquise pendant le séjour dans l’épididyme. Chez le taureau, environ 40% des spermatozoïdes se trouvant dans le corps de l’épididyme ont la capacité d’être motiles et alors que ce pourcentage augmente à environ 80% dans la portion proximale de la queue de l’épididyme (Acott et Carr, 1984). Pour ce qui est du pouvoir fécondant, les expériences effectuées chez le lapin par les chercheurs Bedford (1967) et Orgebin-Crist (1967) ont démontré que les spermatozoïdes retrouvés dans la tête de l’épididyme étaient incapables de féconder les ovocytes. Les spermatozoïdes retrouvés dans le milieu ou la partie distale du corps de l’épididyme pouvaient féconder les ovocytes, mais le pourcentage d’ovocytes fécondés par ceux-ci variait grandement, entre 13 à 57% (Bedford, 1966). Finalement, en utilisant les spermatozoïdes provenant de la queue de l’épididyme, le pourcentage d’ovocytes fécondés augmentait drastiquement à 97% (Bedford, 1966). En autres mots, la fertilité des spermatozoïdes, basée sur le pourcentage des ovocytes fécondés par eux, augmente selon la distance parcourue le long de l’épididyme. Il était devenu évident dès les années 1960 que les spermatozoïdes
nécessitaient l’environnement épididymaire pour acquérir à la fois leur motilité et leur capacité à féconder.
Les spermatozoïdes subissent de nombreux changements physiologiques et biochimiques au cours de leur transit dans l’épididyme. L’environnement épididymaire est très dynamique et change selon le segment. Un des changements notables est la réabsorption du fluide testiculaire à la sortie des spermatozoïdes du testicule, dans les canaux efférents. En effet, entre 50 et 90% du fluide est réabsorbé grâce aux aquaporines, ce qui concentre les spermatozoïdes (Da Silva et al., 2006). De plus, la concentration intracellulaire de plusieurs constituants change pendant le transit. Par exemple, la concentration de l’AMPc intracellulaire est plus forte chez les spermatozoïdes de la queue de l’épididyme que ceux de la tête de l’épididyme (Hoskins et al., 1974). Ce changement peut être attribué par la fluctuation de la concentration du HCO3− et du Ca2+ du fluide épididymaire, contribuant ainsi à l’activation de la phosphorylation et de la motilité (Dacheux et Dacheux, 2014). D’autres modifications importantes impliquent la modification de la membrane plasmique des spermatozoïdes. Pendant le transit, il existe un échange de protéines et de molécules du spermatozoïde au fluide épididymaire et l’inverse (Bedford, 2015). Chez plusieurs espèces, dont le taureau (Frenette et Sullivan, 2001), certaines protéines peuvent même être acquises par l’intermédiaire des épididymosomes. Les épididymosomes sont des microvésicules hétérogènes contenant des protéines internes ou externes, et avec ou sans ancre glycosylphosphatidylinositol (GPI) (Sullivan et al., 2007). Enfin, il y a eu plusieurs avancées en termes de techniques facilitant l’étude « −omique » (transcriptomique, génomique, protéomique, etc.), ce qui permet une meilleure compréhension de ce qu’il se passe à la plus petite échelle. Une étude par Jelinsky et al. (2007) a démontré qu’il y a un changement de la régulation des gènes à différents niveaux de l’épididyme. Dans un segment particulier, certains gènes sont régulés positivement alors que ces mêmes gènes sont régulés négativement dans le segment suivant. Ceci renforce la notion que l’épididyme offre un environnement de maturation dynamique aux spermatozoïdes.
1.4 Transit des spermatozoïdes dans le tractus reproducteur
femelle
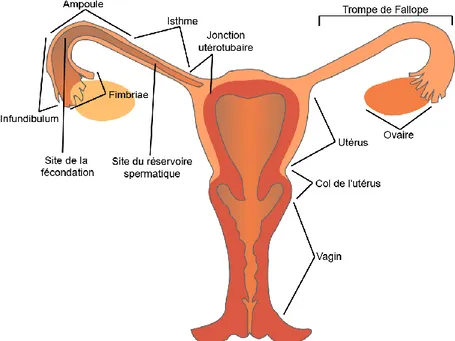
Une fois stockés dans la queue de l’épididyme, les spermatozoïdes quiescents attendent l’éjaculation pour atteindre leur but ultime : « livrer le génome mâle haploïde à l’œuf afin de commencer le développement embryonnaire » (Buffone et al., 2012). Au moment de l’éjaculation, les spermatozoïdes passent par le vas deferens, où ils sont mélangés avec les diverses sécrétions de la prostate et des vésicules séminales et sortent par l’urètre. À cause de la présence du HCO3− dans ces sécrétions, ceci change le pH environnant et active la motilité des spermatozoïdes (Hamamah et Gatti, 1998). Le mélange des spermatozoïdes avec les sécrétions prostatiques et séminales se nomme la semence, ou le sperme. L’environnement vaginal dans lequel les spermatozoïdes se trouvent est acide (pH ~5) (Suarez et Pacey, 2006). Afin de minimiser l’exposition à ces conditions sévères, bien que le pH basique de la semence puisse neutraliser le pH vaginal, il est favorable que le dépôt se fasse près du col de l’utérus, comme chez l’humain, ou même dans l’utérus, comme chez l’espèce porcine (Suarez et Pacey, 2006). La Figure 1-6 démontre l’anatomie du système reproducteur de la femme.
Il est à noter que ce ne sont pas tous les spermatozoïdes éjaculés qui se rendent jusqu’à l’ovocyte. Le système reproducteur femelle prouve être un chemin périlleux qui comprend différentes composantes agissant comme des barrières, laissant seulement une faible proportion des spermatozoïdes se rendre jusqu’au site de la fécondation. Après le dépôt, les spermatozoïdes doivent franchir le col, s’il y a lieu, où ils rencontrent la première barrière : le mucus cervical. Il est suggéré que le mucus sélectionne les spermatozoïdes qui ont une bonne morphologie et une motilité supérieure, par rapport à ceux qui auraient plutôt un profil morphologique anormal ne leur permettant pas de franchir le col de l’utérus (Suarez et Pacey, 2006). Ceux qui passent le col sont aidés à traverser l’utérus par les contractions utérines. Rendus à la jonction utérotubaire, les spermatozoïdes sont mis à l’épreuve à nouveau par des barrières anatomiques ou mucosales, selon l’espèce (Suarez et Pacey, 2006). Chez la vache, l’isthme est très étroit et comporte plusieurs replis qui peuvent servir de barrière et/ou servant à la formation d’un réservoir de spermatozoïdes (Figure 1-6) (Hunter et Wilmut, 1983; Yániz et al., 2000). Le réservoir est maintenu par les interactions
entre les spermatozoïdes et l’épithélium de l’oviducte jusqu’à la capacitation des spermatozoïdes (Suarez et Pacey, 2006).
Figure 1-6 Anatomie du système reproducteur de la femme. Les spermatozoïdes franchissent le col de l’utérus et l’utérus pour ensuite traverser la jonction utérotubaire et s’installer dans l’isthme en attendant l’œuf. Figure modifiée, tirée du site
https://commons.wikimedia.org/wiki/File:Female_reproductive_system_-_anterior_view.svg
1.4.1 Capacitation
Le concept de la capacitation a été décrit pour la première fois indépendamment par deux chercheurs dans les années 1950. Sans avoir d’évidences directes, Chang (1951) et Austin (1951) ont suggéré que les spermatozoïdes devaient subir des changements physiologiques à l’intérieur du tractus génital femelle afin de pouvoir féconder l’ovocyte, puisqu’ils se retrouvent généralement dans l’oviducte avant l’ovulation. Depuis, les études extensives ont révélé que la capacitation est un processus très complexe (Hernández-González et al., 2006; Arcelay et al., 2008; Krapf et al., 2010; Visconti et al., 2011). Elle peut être décrite comme étant l’ensemble des changements physiologiques, moléculaires et cellulaires subis par les spermatozoïdes dans le tractus génital femelle permettant la fécondation (Salicioni et al., 2007).
Les spermatozoïdes sont exposés à de nombreux changements biochimiques pendant leur trajet partant du système reproducteur mâle jusqu’au système reproducteur femelle. Dans l’épididyme, les spermatozoïdes sont exposés à des concentrations faibles des ions Na+ et HCO3− et des concentrations fortes de K+ (Levine et Marsh, 1971). Le faible pH dans l’épididyme est créé par un échange des ions H+
et HCO3− par l’épithélium de l’épididyme, contribuant au maintien de la quiescence des spermatozoïdes (Levine et Marsh, 1971; Acott et Carr, 1984; Shum et al., 2009). Cependant, suivant l’éjaculation, les concentrations auxquelles les spermatozoïdes sont exposés dans le plasma séminal de Na+ et de HCO3− sont élevées tandis que celles du K+ sont diminuées (Visconti et al., 1999). Rendus dans l’oviducte, les spermatozoïdes sont exposés à une forte concentration de bicarbonate (Maas et al., 1977). L’alcalinisation intracellulaire du spermatozoïde promeut l’entrée du bicarbonate du milieu oviductal créant des seconds messagers dépendant du pH intracellulaire ou du HCO3
−
(Zeng et al., 1996). Le bicarbonate peut lier l’enzyme adénylyl cyclase atypique soluble (SACY), ce qui l’active. L’enzyme SACY est impliquée dans l’augmentation de la concentration intracellulaire de l’AMPc et de l’activation de la PKA (Chen et al., 2000). Chez la souris et l’homme, suivant l’activation de la PKA par l’augmentation de la concentration d’AMPc, plusieurs protéines sont phosphorylées sur le résidu tyrosine, déclenchant diverses voies de signalisation (Visconti et al., 1995; Leclerc et al., 1996).
Les changements physiologiques associés avec la capacitation incluent le remodelage membranaire des spermatozoïdes. Le remodelage constitue des changements dans la composition et la distribution des lipides (Cross, 2004). Chez la quasi-totalité des cellules mammifères, les lipides de la membrane plasmique peuvent être ordonnés en radeaux lipidiques, formant des microdomaines, grâce à la présence du cholestérol. Ces radeaux, constitués de lipides et de protéines, sont associés à des protéines transmembranaires ou ayant des ancres GPI, et à des tyrosines kinases (Simons et Ikonen, 1997). Le regroupement de ces molécules dans les radeaux facilite la transduction des signaux (Zajchowski et Robbins, 2002). Pendant la capacitation, il y a une sortie du cholestérol, grâce à des accepteurs de stérol dans le milieu utérin (Davis, 1982), provoquant une fluidité membranaire et un influx intracellulaire du calcium (Cohen et al., 2016). Finalement, la
capacitation semble diminuer l’affinité des spermatozoïdes pour l’épithélium de l’oviducte. Le changement de la composition membranaire permet le relâchement graduel des spermatozoïdes du « réservoir » de l’oviducte pour leur permettre d’être déplacés vers l’ovocyte au niveau de l’ampoule où a lieu la fécondation (Lefebvre et Suarez, 1996).
1.4.2 Hyperactivation
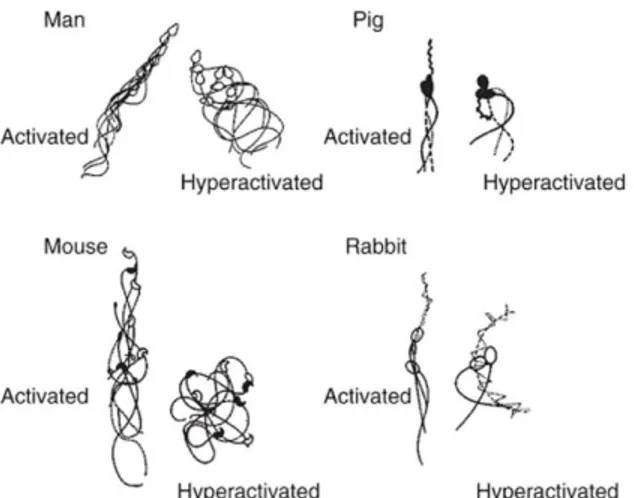
L’hyperactivation des spermatozoïdes dépend d’abord de l’alcalinisation du milieu intracellulaire et des ions calciques. Le pH alcalin intracellulaire découle, en partie, de l’entrée des ions bicarbonate pendant la capacitation (Yanagimachi, 1982; White et Aitken, 1989; Buffone et al., 2012). La source primaire du Ca2+ est le calcium extracellulaire, importé par les canaux calciques du type CatSper (Kirichok et al., 2006). La deuxième source de calcium chez les spermatozoïdes provient des réserves intracellulaires situées à la base du flagelle et dans l’acrosome (Ho et Suarez, 2001; Herrick et al., 2005). Avant la capacitation, les spermatozoïdes motiles présentent un battement flagellaire rapide et relativement symétrique aboutissant à un trajet plutôt linéaire. Lorsque les spermatozoïdes sont hyperactivés, le battement flagellaire a une plus grande amplitude et devient plus vigoureux et asymétrique. Le mouvement latéral de la tête des spermatozoïdes peut aussi être observé (Figure 1-7) (Florman et Ducibella, 2006).
Figure 1-7 Patrons de la motilité activée et hyperactivée des spermatozoïdes chez différentes espèces. La motilité activée permet un déplacement plutôt linéaire. Les battements du flagelle pendant l’état hyperactivé ont une plus grande amplitude et sont plus vigoureux et asymétriques. Figure de Florman et Ducibella (2006).
Il est suggéré que l’hyperactivation peut assister les spermatozoïdes à rompre leur interaction avec l’épithélium de l’oviducte (tel que mentionné à la section précédente) leur permettant d’être dirigés vers l’ovocyte. De plus, l’hyperactivation s’avère nécessaire pour d’abord aider le spermatozoïde à traverser le mucus qui est présent dans l’oviducte, et pour générer la force nécessaire afin pénétrer le cumulus oophorus et la zone pellucide de l’ovocyte (Suarez, 2008). Les hyaluronidases participent aussi à la pénétration des couches entourant l’ovocyte et seront discutées en détail à la section 1.5. Une fois capacités et hyperactivés, les spermatozoïdes sont prêts à entreprendre la dernière étape, la réaction de l’acrosome, les préparant pour féconder l’ovocyte.
1.4.3 Réaction acrosomale
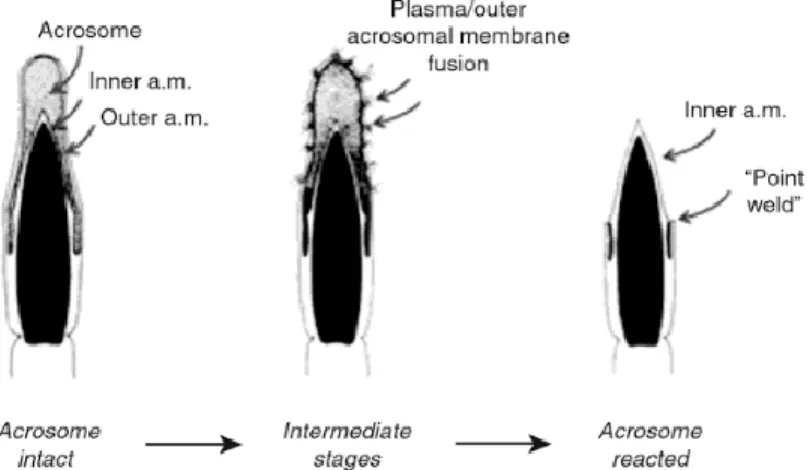
L’acrosome, l’organelle recouvrant une grande portion de la tête du spermatozoïde (Figure 1-3; Figure 1-4; Figure 1-8), est essentiel pour la fécondation. Le contenu de l’acrosome a été associé aux fonctions d’adhésion et de pénétration de la zone pellucide par le spermatozoïde (Kim et al., 2001). La réaction de l’acrosome est un évènement exocytotique qui relargue le contenu acrosomal dans le milieu extracellulaire. Cette réaction graduelle procède par la fusion des membranes plasmiques et externes de l’acrosome créant de multiples pores, ainsi exposant la membrane interne de l’acrosome, qui est continue avec ce qui reste de la membrane plasmique du spermatozoïde (Figure 1-8) (Florman et Fissore, 2015; Belmonte et al., 2016). Le processus de l’évènement sécrétoire chez le spermatozoïde diffère de celui des cellules somatiques. Par exemple, chez certaines cellules somatiques, les vésicules et leurs contenus relâchés sont recyclés ou endocytés afin d’être sécrétés à nouveau. Puisque le spermatozoïde n’a qu’un seul acrosome, la réaction de l’acrosome est un évènement unique et donc irréversible (Belmonte et al., 2016).
Figure 1-8 Les différents stades de la réaction de l’acrosome des spermatozoïdes. À la gauche, l’acrosome du spermatozoïde est intact (a.m. : acrosomal membrane). Ensuite, la fusion des membranes plasmique et externe de l’acrosome libère le contenu acrosomal. L’exposition de la membrane interne de l’acrosome est une marque d’un acrosome réacté. Figure de Floorman et Ducibella (2006).
Pour que la fusion des membranes et le relâchement du contenu acrosomal se produisent, il doit y avoir un ou plusieurs éléments déclencheurs. En fait, plus d’un élément est proposé d’initier la réaction acrosomale. La glycoprotéine ZP3 de la zone pellucide de l’ovocyte est connue pour stimuler la réaction de l’acrosome (Bleil et Wassarman, 1983). Un autre déclencheur est la progestérone, une hormone stéroïdienne synthétisée par les cellules du cumulus oophorus (McNatty et al., 1980; Osman et al., 1989). Cette hormone possède des récepteurs sur la membrane plasmique des spermatozoïdes (Blackmore et Lattanzio, 1991; Sabeur et al., 1996; Shah et al., 2003) et peut agir comme chimioattractant pour les spermatozoïdes (Jaiswal et al., 1999). ZP3 et la progestérone agissent en stimulant l’augmentation rapide du calcium libre provenant du flagelle jusqu’à la tête du spermatozoïde par l’intermédiaire des canaux calciques CatSper, et aussi une augmentation du pH intracellulaire (Florman et al., 1989; Meizel et al., 1997; Ren et Xia, 2010; Strünker et al., 2011). La zone pellucide peut aussi activer la phospholipase C, qui hydrolyse le PIP2, afin de produire l’IP3 et le diacyglycérol, des composantes impliquées dans les évènements exocytotiques de l’acrosome (Roldan et Shi, 2007). Ces évènements incluent la libération du calcium de l’acrosome par l’activation des récepteurs IP3 (Walensky et Snyder, 1995). En aval de l’augmentation accrue de Ca2+
intracellulaire, il y a implication des voies de signalisation qui incluent la PI3K. Chez les systèmes somatiques, la voie PI3K a été
associée aux processus d’exocytose (Florman et al., 2008). Une fois que la réaction de l’acrosome est complétée, le spermatozoïde est prêt à féconder l’ovocyte.
1.4.4 Interactions entre les gamètes
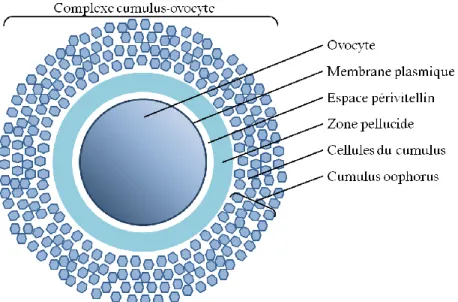
Le complexe cumulus-ovocyte (CCO) est composé de l’ovocyte secondaire (arrêté en métaphase II) et est entouré par la zone pellucide et les cellules du cumulus, formant le cumulus oophorus (Figure 1-9) (Huang et Wells, 2010).
Figure 1-9 Les composantes du complexe cumulus-ovocyte (CCO). Le CCO est composé de l’ovocyte, la zone pellucide, l’espace périvitellin et les cellules du cumulus, formant le cumulus oophorus.
1.4.4.1 Interaction spermatozoïde-cumulus oophorus
Les cellules du cumulus représentent une sous-population des cellules de la granulosa produites vers la fin de la folliculogenèse (Zhuo et Kimata, 2001). La communication entre les cellules du cumulus et l’ovocyte se fait par l’intermédiaire de projections cellulaires qui traversent la zone pellucide et qui forment des jonctions lacunaires avec l’ovocyte (Albertini et al., 2001). Avant l’ovulation, il y a une hausse de gonadotropines qui stimulent la production d’acide hyaluronique (HA) par les cellules du cumulus. Ceci contribue à la formation de la matrice extracellulaire entre les cellules du cumulus et résulte en l’expansion du cumulus oophorus (Salustri et al., 1989; Huang et Wells, 2010). La matrice
est composée de protéoglycanes, formés par des protéines et des glycoaminoglycanes (GAG). Le GAG majoritaire du cumulus oophorus est l’acide hyaluronique, composé de disaccharides d’acide D-glucuronique et de N-acétyl-D-glucosamine (Russell et Salustri, 2006). Par contre, l’acide hyaluronique est le seul GAG qui n’est pas associé à une protéine centrale (Stern, 2003).
Afin de féconder l’ovocyte, la première couche du CCO que le spermatozoïde doit franchir est le cumulus oophorus. Une expérience par Hong et al. (2004) a démontré que le pourcentage de spermatozoïdes ayant une morphologie, une capacitation et un acrosome réacté normaux était plus élevé après passage dans le cumulus oophorus qu’après le passage dans un milieu contrôle. Ceci suggère que le cumulus oophorus pourrait avoir un rôle dans la sélection de spermatozoïdes de meilleures qualités (Rijsdijk et Franken, 2007; Hong et al., 2009). Deux mécanismes de pénétration du cumulus oophorus par les spermatozoïdes sont proposés. La première est la force mécanique générée par l’état hyperactivé du spermatozoïde (Suarez et al., 1991). Les mouvements du spermatozoïde sont plus vigoureux lors de l’hyperactivation et pourraient permettre le déplacement de la matrice extracellulaire du cumulus oophorus ainsi forgeant un trajet pour le spermatozoïde. La deuxième est la dispersion du cumulus par l’activité enzymatique hyaluronidase retrouvée chez le spermatozoïde (Lin et al., 1994). La protéine PH-20, ou SPAM1, possède une activité hyaluronidase et est capable d’hydrolyser l’acide hyaluronique dans la matrice extracellulaire du cumulus oophorus. Par contre, des expériences utilisant des souris avec une invalidation du gène Ph-20/Spam1 ont démontré que ces souris étaient toujours fertiles et que leurs spermatozoïdes pouvaient toujours pénétrer le cumulus oophorus, mais avec un certain délai par rapport aux spermatozoïdes contrôles (Baba et al., 2002). D’autres hyaluronidases ont été trouvées chez le spermatozoïde, exposant une redondance de ces protéines, ce qui pourrait expliquer pourquoi les spermatozoïdes sans PH-20/SPAM1 maintiennent leur pouvoir fécondant (Miller et al., 2006; Kimura et al., 2009). Il y a d’autres protéines qui possèdent une activité de digestion du cumulus, tel que l’arylsulfatase A (Dudkiewicz, 1984; Wu et al., 2007). Il est probable que les spermatozoïdes utilisent la force mécanique et la digestion, où plus d’un type protéique réaliserait la digestion, pour pénétrer le cumulus oophorus, plutôt qu’un seul mécanisme.
1.4.4.2 Interaction spermatozoïde-zone pellucide
La prochaine interaction entre le spermatozoïde et le gamète femelle est la liaison et la pénétration de la zone pellucide (ZP). La zone pellucide est une matrice acellulaire, composée de glycoprotéines sulfatées et d’acide hyaluronique, qui est synthétisée par l’ovocyte pendant le développement du follicule (Bleil et Wassarman, 1980a; Dandekar et Talbot, 1992). Selon l’espèce animale, la matrice extracellulaire est composée de trois à quatre glycoprotéines nommées ZP1, ZP2, ZP3 et ZP4. Chez l’espèce murine on retrouve ZP1, ZP2 et ZP3 (Bleil et Wassarman, 1980a) et chez l’espèce bovine on retrouve ZP2, ZP3 et ZP4, où Zp1 n’est qu’un pseudogène (Noguchi et al., 1994; Goudet et al., 2008).
Des études ont démontrés que la glycoprotéine ZP3 peut induire la réaction de l’acrosome suite à sa liaison par les spermatozoïdes (Bleil et Wassarman, 1980b). Ceci était central au dogme disant que les spermatozoïdes ayant un acrosome intact se liaient à ZP3, induisant la réaction de l’acrosome, ce qui permettait une liaison secondaire avec ZP2 pour ensuite mener à la pénétration (Bleil et al., 1988). Cependant, une expérience récente a contesté ce modèle. Il a été démontré que la réaction de l’acrosome chez la plupart des spermatozoïdes de la souris survient dans le cumulus oophorus, avant la liaison à la ZP (Jin et al., 2011). Cette découverte met en question le modèle courant où il y a une liaison primaire faible entre le spermatozoïde et la ZP. Le contact avec ZP3 de la ZP déclenche la réaction acrosomale menant à une liaison secondaire forte entre la membrane interne de l’acrosome du spermatozoïde réacté et la glycoprotéine ZP2 de la ZP (Gupta et al., 2012). Cette liaison secondaire impliquerait des protéines telles que SPAM1 (Hunnicutt et al., 1996). Il y a donc encore des clarifications à faire concernant l’ordre des différents évènements précédant la fécondation.
Plusieurs modèles de la pénétration de la zone pellucide ont été proposés. La force mécanique générée par le battement du flagelle du spermatozoïde a été présentée, mais a été rejetée puisque la force est insuffisante pour la pénétration (Green, 1988). Le deuxième modèle suggéré comme moyen de passage des spermatozoïdes est la lyse de la matrice formée par les glycoprotéines de la ZP. Plusieurs candidats pour la digestion de la ZP existent. Un des candidats est l’acrosine, une protéase présente dans l’acrosome et sur la
membrane interne de l’acrosome (Ohmura et al., 1999; Ferrer et al., 2012). Cependant, des invalidations du gène encodant cette protéine ont démontré que les spermatozoïdes murins étaient tout de même capables de pénétrer la zone pellucide (Yamagata et al., 1998). Le prochain candidat est MMP2, qui fait partie de la famille des protéinases pouvant dégrader les composantes de la matrice extracellulaire chez les cellules somatiques (Werb, 1997). Cette métallo-protéase de la matrice, qui est produit sous une forme inactive pro-MMP2, est aussi connue sous le nom de gélatinase A et se situe sur la IAM. Ferrer et al. (2012) ont démontré que l’acrosine et MMP2 co-localisaient et pouvaient ensemble jouer un rôle dans la pénétration de la zone pellucide. Le troisième candidat est le protéasome 26S du spermatozoïde. Il a été démontré que ce protéasome était capable de reconnaître et dégrader les protéines ubiquitinilées de la ZP chez la souris (Zimmerman et al., 2011) et des protéines recombinantes ubiquitinilées de la ZP chez l’humain (Saldívar-Hernández et al., 2015). Il se peut aussi, comme le passage au travers du cumulus oophorus, que les spermatozoïdes utilisent une combinaison de mécanismes pour pénétrer la zone pellucide.
1.4.4.3 Interaction spermatozoïde-ovocyte
Une fois la ZP traversée, le spermatozoïde se retrouve dans l’espace périvitellin (Figure 1-9). La dernière étape que franchit le spermatozoïde est la pénétration de l’ovocyte. Ceci se fait en deux étapes : la liaison et la fusion avec la membrane de l’œuf. L’œuf possède une membrane plasmique ayant une région plutôt lisse, où sont situés les chromosomes en métaphase et le premier globule polaire, et une région riche en microvillosités. Les spermatozoïdes se lient et fusionnent aux régions ayant les microvillosités (Primakoff et Myles, 2007). Bien que la réaction de l’acrosome expose la membrane interne de l’acrosome, ce n’est pas cette membrane qui interagit avec la membrane plasmique de l’œuf. Ce sont le segment équatorial et la région post-acrosomale de la tête du spermatozoïde qui fusionnent avec la membrane de l’œuf (Florman et Ducibella, 2006). Plusieurs types de protéines sont proposés comme médiateurs des interactions entre les gamètes. Sur le spermatozoïde, il y a les protéines de la famille CRISP (Cysteine-rich secretory protein), originalement nommés DE (Cameo et Blaquier, 1976). Ces protéines épididymaires agissent via des interactions avec des sites complémentaires sur l’ovocyte pour la fusion spermatozoïde-ovocyte (Cohen et al., 2011). Une deuxième
famille de protéines aurait un rôle dans les interactions spermatozoïde-ovocyte, nommée ADAM (A disintegrin and metalloprotease) (Evans, 2002). Les ADAMs sont des protéines transmembranaires ayant des domaines métalloprotéase et disintégrine, suggérant qu’elles ont des activités protéolytiques et d’adhésion cellulaire (Primakoff et Myles, 2000). Récemment, une protéine spermatique essentielle pour la fusion spermatozoïde-ovocyte chez la souris et l’humain a été trouvée. La protéine IZUMO, faisant partie de la superfamille d’immunoglobulines, est localisée sur la membrane interne de l’acrosome. L’invalidation de ce gène rend les souris stériles. Bien que les spermatozoïdes Izumo−/− puissent se lier à la membrane plasmique de l’ovocyte, ils sont incapables de fusionner avec cette dernière (Inoue et al., 2005). Le partenaire d’IZUMO retrouvé chez le gamète femelle est JUNO, une protéine avec une ancre GPI, anciennement nommée Folate receptor 4 (Folr4). Les souris femelles avec une invalidation de ce gène sont infertiles. De plus, il est suggéré que la disparition de JUNO après la fusion est impliquée dans le blocage de la polyspermie (Bianchi et al., 2014). Une fois que la fusion spermatozoïde-ovocyte est terminée, le matériel génétique mâle et femelle peut se réunir pour former le zygote et déclencher le développement d’un nouvel être.
1.5 Hyaluronidases
Depuis les années 1940, il est proposé que les hyaluronidases ont un rôle dans la fécondation, et plus précisément dans la dispersion des cellules du cumulus oophorus par leur capacité d’hydrolyser l’acide hyaluronique (Hechter et Hadidian, 1947). Il y a cinq gènes encodant pour des hyaluronidases chez la souris et six chez l’humain (Csoka et al., 2001; Martin-Deleon, 2011). Étant donné que les hyaluronidases sont nombreuses chez les spermatozoïdes des mammifères et que l’invalidation de l’un ou l’autre n’affecte pas la fertilité des souris, il est soupçonné que les hyaluronidases auraient des fonctions redondantes et compensatrices (Miller et al., 2006). Par exemple, les souris ayant une délétion du gène encodant PH-20 (SPAM1) retiennent leur fertilité, mais une dispersion plus lente des cellules du cumulus par les spermatozoïdes est observée (Baba et al., 2002; Kim et al., 2005). À la lumière de ces résultats, il a été suggéré que plusieurs hyaluronidases existent et seraient capables de disperser les cellules du cumulus oophorus assurant la pénétration de celui-ci pour permettre le contact entre le spermatozoïde et la ZP.
Cependant, une étude a démontré que l’arylsulfatase A pouvait disperser le cumulus, car l’inhibition des hyaluronidases avec l’apigénine avait comme effet une dispersion lente du cumulus, sans affecter la fertilité des souris (Wu et al., 2007). Ceci démontre que d’autres protéines pouvant disperser le cumulus existent, comme l’arylsulfatase A, ce qui renforce le concept de redondance pour le processus de la dispersion du cumulus.
1.5.1 PH-20 (SPAM1) : les débuts
L’hyaluronidase la mieux caractérisée chez plusieurs espèces est SPAM1, anciennement connue sous le nom PH-20, et dont fait l’objet de ce mémoire. Dans les années 1980, des expériences utilisant des préparations de membranes de spermatozoïdes de cobayes ont été faites afin de produire des anticorps monoclonaux. Les anticorps ont été criblés selon la reconnaissance des régions du spermatozoïde. Sept anticorps reconnaissaient la région post-acrosomale (PH; posterior head), dont PH-20, le 20e clone (Primakoff et Myles, 1983). Toujours chez le cobaye, une population de PH-20 se situe dans la région post-acrosomale, mais après la réaction acrosomale, elle migre pour rejoindre une deuxième population sur la membrane interne de l’acrosome (Myles et Primakoff, 1984; Cowan et al., 1987; Cowan et al., 1991). Suivant la découverte de la relocalisation de cette protéine avant et après la réaction acrosomale, Primakoff et al. (1985) ont proposé que PH-20 ait un rôle dans les interactions spermatozoïde-zone pellucide. Lorsque les spermatozoïdes ayant subi la réaction de l’acrosome sont incubés avec les anticorps contre la région C-terminale de PH-20, une inhibition de la liaison des spermatozoïdes à la zone pellucide est observée, démontrant que le domaine C-terminal de PH-20 serait impliqué dans les interactions spermatozoïde-ZP (Primakoff et al., 1985; Myles et al., 1987; Hunnicutt et al., 1996). Ceci a exposé un rôle potentiel dans l’immunocontraception. Malgré le succès de la contraception utilisant PH-20 purifiée chez le cobaye, l’immunisation des lapins et des souris avec la protéine recombinante PH-20 n’a pas été efficace comme méthode de contraception (Primakoff et al., 1988b; Pomering et al., 2002; Hardy et al., 2004). À la lumière de ce problème chez ces espèces, l’intérêt pour cette protéine dans la contraception a depuis beaucoup diminué.
En 1993, une homologie a été découverte entre l'hyaluronidase du venin d’abeille et le domaine N-terminal de la protéine PH-20 (Gmachl et Kreil, 1993). En sachant que l’acide hyaluronique est un composé majeur du cumulus oophorus, il était particulièrement intéressant de déterminer si PH-20 possédait en fait une activité hyaluronidase qui pouvait participer à la dispersion des cellules du cumulus. Des essais enzymatiques ont révélé que PH-20 de plusieurs espèces avait bel et bien une activité hyaluronidase soit au pH 4 ou 7 ou aux deux (Lin et al., 1994; Cherr et al., 1996; Hunnicutt et al., 1996; Sabeur et al., 1997; Morin et al., 2005). La protéine PH-20 possède donc deux fonctions : une activité hyaluronidase et une capacité de liaison à la zone pellucide (Hunnicutt et al., 1996), ce qui a suscité à nouveau un intérêt pour cette protéine, mais surtout pour son rôle dans les interactions entre les gamètes mâles et femelles. Des homologues du gène PH-20 ont été trouvés par Southern Blot chez plusieurs mammifères, dont la souris, le rat, le hamster, le lapin, l’humain, le singe et le taureau (Lathrop et al., 1990). Des orthologues de PH-20 ont ensuite été trouvés chez la souris (Thaler et Cardullo, 1995), le rat (Hou et al., 1996), l’homme (Sabeur et al., 1997), le taureau (Lalancette et al., 2001) et autres mammifères, indiquant la conservation de PH-20 parmi les espèces. PH-20 a un poids moléculaire entre 53 et 68 kDa, selon les espèces, et est ancrée à la membrane plasmique par une ancre GPI (Primakoff et al., 1988a; Phelps et al., 1988; Lathrop et al., 1990; Gmachl et al., 1993; Thaler et Cardullo, 1995; Jones et al., 1995; Hou et al., 1996; Sabeur et al., 1997; Seaton et al., 2000). De plus, PH-20 chez le cobaye possède de nombreux sites de glycosylation et plusieurs résidus cystéines, ce qui suggère qu’il y aurait plusieurs ponts disulfures participant au repliement de la protéine et contribuant à l’activité hyaluronidase (Lathrop et al., 1990; Li et al., 2002).
1.5.2 SPAM1 : Bos taurus
Au courant des années 1990, la nomenclature de PH-20 a changé à SPAM1 (Sperm Adhesion Molecule 1), mais ces deux termes sont encore utilisés de façon interchangeable chez plusieurs espèces. Chez ces espèces, que le terme PH-20 ou SPAM1 soit utilisé, le gène de la protéine est Spam1. La distinction importante à faire chez Bos taurus est que les gènes Spam1 (NCBI Gene ID : 353352) et Ph-20 (NCBI Gene ID : 509761) existent et encodent différentes protéines. De ce fait, dans de ce mémoire, en se référant au taureau,