Exposition prénatale aux sous-produits de
chloration de l’eau, polymorphismes des gènes du
cytochrome P450 et le risque de retard de
croissance intra-utérin
Mémoire
N’vyssan Samuella Germaine Bonou
Maîtrise en épidémiologie
Maître ès sciences (M. Sc.)
Québec, Canada
Exposition prénatale aux sous-produits de
chloration de l’eau, polymorphismes des gènes du
cytochrome P450 et le risque de retard de
croissance intra-utérin
Mémoire
N’vyssan Samuella Germaine Bonou
Sous la direction de :
Alexandre Bureau, directeur de recherche
Patrick Levallois, codirecteur de recherche
iii
Résumé
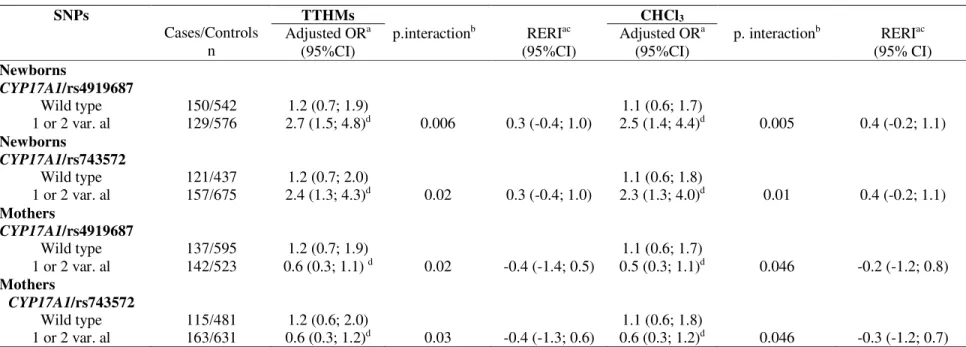
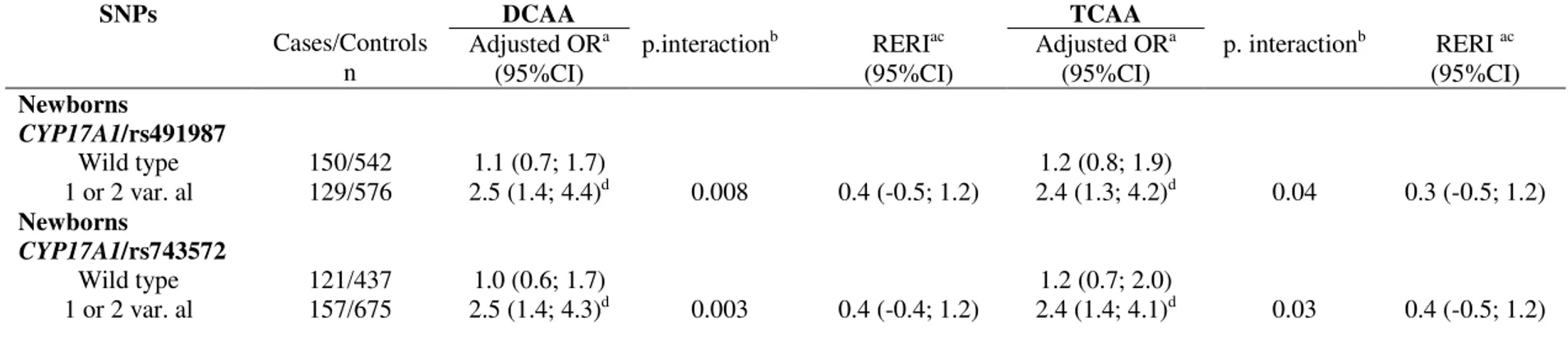
La susceptibilité génétique modulerait le risque de retard de croissance intra-utérin (RCIU) associé à l’exposition prénatale aux sous-produits de chloration de l’eau (SPCs). Sur un échantillon de 1432 paires mère-enfant provenant d’une étude cas-témoins populationnelle menée dans la région métropolitaine de Québec (Canada), nous avons étudié l’association entre certains polymorphismes nucléotidiques (SNPs : single nucleotide polymorphisms) des gènes du cytochrome P450, CYP1A2, CYP2A6, CYP2D6 et CYP17A1 chez les paires mère-enfant et le RCIU défini comme le petit poids de naissance pour l’âge gestationnel (PPAG <10e percentile). Nous avons ensuite évalué l’effet modifiant des SNPs
de ces gènes sur l’association entre l’exposition maternelle aux SPCs, trihalométhanes (THMs) et acides haloacétiques (AHAs), durant le troisième trimestre de grossesse et le PPAG. L’ADN fut extrait des cellules sanguines ou salivaires. Les SNPs furent sélectionnés par l’outil Tagger et furent génotypés par le système Sequenom MassARRAY. Les analyses furent effectuées à l’aide de modèles de régression logistique multiple ajustés pour les facteurs de risque du RCIU. Des interactions positives ont été rapportées entre l’exposition aux trihalométhanes totaux (TTHMs), aux cinq espèces des AHAs règlementées et les allèles rs4919687 A et rs743572 G du gène CYP17A1 chez l’enfant sur le PPAG, tandis que chez la mère, des interactions négatives ont été observées entre l’exposition aux TTHMs et les allèles rs4919687 A et rs743572 G du gène CYP17A1. Cependant, ces interactions perdaient leur significativité statistique après correction pour l’utilisation de tests multiples. Il y a certaines évidences, bien que faibles, de l’existence d’un potentiel effet modifiant des allèles du gène CYP17A1 sur l'association entre l’exposition aux SPCs et le PPAG. De prochaines études ayant une plus grande taille d’échantillon permettront de valider ou non ces résultats.
Abstract
Some epidemiological studies suggest that genetic susceptibility modulates chlorination by-products (CBPs) effects on fetal growth. In a sample of 1432 mother-child pairs came from a population-based case-control study conducted in Quebec City area (Canada), we assessed the association between single nucleotide polymorphisms (SNPs) in CYP1A2, CYP2A6, CYP2D6 and CYP17A1 mother or foetus genes on intra-uterine growth restriction (IUGR) defined as small for gestational age (SGA< 10th percentile). Further, we evaluated
the interaction between maternal exposure to trihalomethanes (THMs) or haloacetic acids (HAAs) during the third trimester and SNPs in CYP1A2, CYP2A6, CYP2D6 and CYP17A1 mother or foetus genes. DNA was extracted from blood or saliva cells. Tag SNPs were selected by Tagger tool and the Sequenom’s MassARRAY system was used for SNPs genotyping. Analysis were performed by unconditional logistic regression with control of known risk factors of IUGR. Positive interactions were found between exposure to total trihalomethanes (TTHMs) and five regulated HAAs species and neonate carrying CYP17A1 rs4919687 A or rs743572 G alleles on SGA, whereas negative interactions were found between TTHMs exposure and mother carrying CYP17A1 rs4919687 A or rs743572 G alleles. However, after correction for multiple testing, reported interactions became non statistically significant. There is some evidence, albeit weak, of a potential modification of effect of the association between CBPs exposure and SGA by SNPs in CYP17A1 gene. Further larger-scale studies are needed to validate these observations
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations ... xv
Remerciements ... xvii
Avant-propos ... xx
INTRODUCTION ... 1
CHAPITRE 1 — REVUE DE LA LITTÉRATURE ... 3
1. RETARD DE CROISSANCE INTRA-UTÉRIN (RCIU) ... 3
1.1. Caractéristiques du RCIU... 3 1.1.1. Définition du RCIU ... 3 1.1.2. Classification du RCIU ... 4 1.2. Épidémiologie du RCIU ... 4 1.2.1. Prévalence et conséquences ... 4 1.2.2. Étiologie du RCIU ... 6
2. SOUS-PRODUITS DE CHLORATION DE L’EAU (SPCs) ... 10
2.1. Formation des SPCs dans l’eau potable ... 10
2.2. Classification et règlementation des SPCs : trihalométhanes (THMs) et acides haloacétiques (AHAs) ... 10
2.3. Études toxicologiques et épidémiologiques des SPCs sur le développement fœtal ... 12
3. SUSCEPTIBILITÉ GÉNÉTIQUE AU RCIU LORS D’EXPOSITION MATERNELLE AUX SPCs ... 15
3.1. Processus de détoxification : biotransformation des xénobiotiques ... 16
3.2. Études de susceptibilité génétique au RCIU lors d’exposition maternelle aux SPCs ... 17
4. GÈNES DU CYTOCHROME P450 CANDIDATS POUR UNE ÉTUDE D’INTERACTION GÈNE-ENVIRONNEMENT DANS LE RISQUE DE RCIU LORS D’EXPOSITION PRÉNATALE AUX SPCs ... 21
4.1. Gènes du cytochrome P450 de la phase I de biotransformation des xénobiotiques et effet de leurs polymorphismes sur la détoxification ... 22
4.1.1. Isoenzymes du cytochrome P450 : CYP1A2, CYP2A6 et CYP2D6 ... 22
4.1.2. Effet des polymorphismes des gènes des enzymes du cytochrome P450 de la phase I de biotransformation des xénobiotiques sur le processus de détoxification . 24 4.2. Cytochrome CYP17A1 intervenant dans la biosynthèse des hormones stéroïdiennes ... 26
4.2.1. Rôle du cytochrome CYP17A1 dans la stéroïdogenèse ... 26
4.2.3. Études d’interaction entre des expositions environnementales et les
polymorphismes du gène CYP17A1 dans le risque de RCIU ... 28
5. ÉPIDÉMIOLOGIE GÉNÉTIQUE : GÉNÉTIQUES DES POPULATIONS ... 29
5.1. Notion de diversité génétique : polymorphisme nucléotidique SNP ... 29
5.2. Équilibre d’Hardy Weinberg ... 30
5.3. Déséquilibre de liaison ... 31
5.4. Interaction gène-environnement ... 33
5.4.1. Définition statistique... 33
5.4.2. Stratégie d’analyse d’une interaction gène-environnement... 35
5.4.2.1. Études conventionnelles ... 35
5.4.2.2. Études non conventionnelles ... 39
CHAPITRE 2 — HYPOTHÈSES, OBJECTIFS ET MÉTHODOLOGIE ... 41
2.1 HYPOTHÈSES ... 41
2.2 OBJECTIFS ... 41
2.3 MÉTHODOLOGIE ... 42
2.3.1. Population d’étude ... 42
2.3.1.1. Devis et description de la population d’étude ... 42
2.3.1.2. Définition des cas et des témoins ... 44
2.3.2. Collecte des données ... 44
2.3.2.1. Collecte des données relatives aux nouveau-nés et aux mères ... 44
2.3.2.2. Évaluation de l’exposition prénatale aux SPCs : doses internes des trihalométhanes (THMs) et des acides haloacétiques (AHAs) ... 45
2.3.2.2.2. Estimation de la concentration des THMs et des AHAs dans l’eau du robinet des résidences des participantes ... 47
2.3.2.2.3. Évaluation des doses internes ingérées des THMs et des AHAs ... 48
2.3.2.2.4. Évaluation des doses internes multiroutes des THMs ... 49
2.3.2.3. Informations génétiques ... 50
2.3.2.3.1. Prélèvements biologiques et extraction d’ADN ... 50
2.3.2.3.2 Sélection des polymorphismes nucléotidiques (SNPs) des gènes d’intérêts ... 51
2.3.2.3.3. Génotypage des polymorphismes nucléotidiques (SNPs) des gènes d’intérêt ... 51
2.3.3. Définition opérationnelle des variables indépendantes ... 54
2.3.3.1. Variables d’exposition aux sous-produits de chloration de l’eau ... 54
2.3.3.2. Variables génétiques ... 54 2.3.3.3. Les covariables ... 55 2.3.4. Plan d’analyse ... 55 2.3.4.1. Analyses préliminaires ... 55 2.3.4.2. Analyses principales ... 56 CHAPITRE 3 — RÉSULTATS ... 59 3.1. RÉSUMÉ ... 60 3.2. Abstract ... 61
3.3. Prenatal exposure to drinking-water chlorination by-products, cytochrome P450 gene polymorphisms and small-for-gestational-age neonates ... 63
4.1 INTERPRÉTATION DES RÉSULTATS ... 102
4.2. VALIDITÉ INTERNE DE L’ÉTUDE ... 105
4.3. VALIDITÉ EXTERNE DE L’ÉTUDE ... 109
RÉFÉRENCES ... 111
ANNEXES ... 121
ANNEXE 1 : Questionnaire administré durant la l’entrevue téléphonique. ... 122
ANNEXE 2 : Contrôle de qualité des analyses des concentrations des trihalométhanes (THMs) et des acides haloacétiques (AHA5). ... 158
ANNEXE 3 : Modèle spatio-temporel de l’estimation de la concentration des SPCs (THMs et AHAs) dans l’eau du robinet des résidences des participantes ... 160
ANNEXE 4 : Facteurs de correction des différents traitements d’eau appliqués aux concentrations de THMs et AHAs utilisées pour estimer les doses absorbées par ingestion. ... 163
ANNEXE 5 : Formulaires de consentement ... 167
ANNEXE 6 : Déséquilibre de liaison (DL) dans l’échantillon ... 187
Liste des tableaux
Tableau 1 : Facteurs de risque du RCIU ... 9 Tableau 2 : Normes et recommandation des THMs et AHAs au Canada et aux
États-Unis ... 12
Tableau 3 : Études de susceptibilité génétique au RCIU lors d’exposition maternelle
aux trihalométhanes (THMs) et aux acides haloacétiques (AHAs) ... 19
Tableau 4 : Tableau 2x4 de l’effet conjoint et des effets individuels du facteur
environnemental (E) et génétique (G) dans une étude cas-témoins ... 36
Tableau 5 :Limites de détection des trihalométhanes et des acides haloacétiques .... 158 Tableau 6 : limites de quantification des trihalométhanes et des acides haloacétiques
... 158
Tableau 7 : Corrective factors applied to concentrations of trihalomethanes (THMs) to
estimate their ingestion according to type of water handling or devices ... 163
Tableau 8 : Correction factors applied to estimate haloacetic acids (HAAs) ingestion
to type of water handling or devices ... 164
Tableau 9 : Puissance pour détecter chez la mère, une interaction entre l’allèle G de
rs743572 du gène CYP17A1 (fréquence=0,4) et l’exposition au TTHM en considérant un effet dominant de l’allèle et α=0,05 ... 192
Tableau 10 : Puissance pour détecter chez l’enfant, une interaction entre l’allèle G de
rs743572 du gène CYP17A1 (fréquence=0,4) et l’exposition au TTHM en considérant un effet dominant de l’allèle et α=0,05 ... 192
Tableau 11 : Puissance pour détecter chez la mère, une interaction entre l’allèle G de
rs743572 du gène CYP17A1 (fréquence=0,4) et l’exposition au TTHM en considérant un effet dominant de l’allèle et α=0,002 ... 192
Tableau 12 : Puissance pour détecter chez l’enfant, une interaction entre l’allèle G de
rs743572 du gène CYP17A1 (fréquence=0,4) et l’exposition au TTHM en considérant un effet dominant de l’allèle et α=0,002 ... 193
Tableau 13 : Puissance pour détecter chez la mère, une association entre les génotypes
de l’allèle G de rs743572 du gène CYP17A1 (fréquence=0,4) et le PPAG en
considérant une absence d’association chez l’enfant (RC1=RC2=1) et α=0,05 ... 194
Tableau 14 : Puissance pour détecter chez la mère, une association entre les génotypes
de l’allèle G de rs743572 du gène CYP17A1 (fréquence=0,4) et le PPAG en
Liste des figures
Figure 1: Mécanisme potentiel de biotransformation et de bioactivation des SPCs par les
isoenzymes CYP1A2, CY2A6 et CYP2D6 conduisant au RCIU. ... 25
Figure 2: Rôle de l’enzyme CYP17A1 dans la biosynthèse de stéroïdes sexuels. ... 27
Figure 3: Coefficient de corrélation entre les SNPs du gène CYP17A1. ... 187
Figure 4: Coefficient de corrélation entre les SNPs du gène CYP2A6. ... 188
Liste des abréviations
AHAs : Acides haloacétiques
AHA5 : Somme des 5 AHAs (acides chloro—,bromo —,dichloro—,dibromo —
,trichloroacétiques)
AHA9 : Somme des 9 AHAs (AHA5 + acides
bromochloro-,bromodichloro,dibromochloro-,tribromo-acétiques)
BDCM : Bromodichlorométhane CF: Chloroforme
CNV : Copy number variation DBCM : Dibromochlorométhane DCAA : Acide dichloroacétique ddl : Degré de liberté
dNTP : Mélange des quatre désoxyribonucléotides (dATP, dGTP, dCTP, dTTP). IC 95 % : Intervalle de confiance à 95 %
IMC : Indice de masse corporelle PN : Poids de naissance
PPAG : Petit poids pour l’âge gestationnel PPN : Petit poids de naissance
RC : Rapport de cotes
RCIU : Retard de croissance intra-utérin
RERI : Excès de risque relatif (Relative Excess Risk of Interaction)
RFLP : Polymorphisme de longueur de fragment de restriction (restriction fragment length
polymorphism)
SNP : Polymorphisme nucléotidique (single nucleotide polymorphism) SPCs : Sous-produit de chloration de l’eau
TCAA : Acide trichloracétique THMs : Trihalométhanes
THMBr : Trihalométhanes bromés TTHM : Trihalométhanes totaux
Remerciements
Je remercie sincèrement mon directeur, monsieur Alexandre Bureau et mon codirecteur, monsieur Patrick Levallois d’avoir cru en mes capacités à réaliser de la recherche scientifique et de m’avoir donné l’opportunité de réaliser ce projet si enrichissant. Ils ont su créer un cadre de travail agréable et propice à l’apprentissage. Merci pour votre disponibilité, vos encouragements et votre compréhension qui m’ont aidé à affronter toutes les épreuves et à mener à bien ce projet de maîtrise.
Je désire également remercier madame Sylvie Marcoux et monsieur Robert Tardiff qui étaient les co-investigateurs de l’étude initiale (Levallois et al., 2012) portant sur l’association entre l’exposition maternelle aux SPCs durant la grossesse et le RCIU. Robert Tardif a été responsable de l’estimation des doses internes des SPCs. Je remercie aussi mesdames, Mariona Bustamante pour l’aide à la sélection des SNPs, Catherine Gonthier, coordonnatrice de la collecte des données des prélèvements biologiques, Christelle Legay pour la campagne d’échantillonnage de l’eau et l’analyse des concentrations des SPCs dans les prélèvements, Nathalie Bernard pour l’extraction d’ADN et Sylvie Desjardins pour le génotypage des SNPs à la plateforme de génotypage du CHU de Québec.
Je tiens aussi à témoigner ma reconnaissance à monsieur Yves Giguère pour sa contribution à l’étude par l’octroi des données de la banque génétique de sa cohorte (Giguere et al., 2015) et sa participation à l’article inclus dans ce mémoire. Je remercie également monsieur Manuel Rodriguez pour l’élaboration de la stratégie d’échantillonnage des SPCs et l’estimation de leur concentration dans l’eau du robinet des résidences des participantes.
Je remercie monsieur Molière Nguile-Makao, stagiaire postdoctoral de M. Alexandre Bureau dont je tiens à souligner la contribution dans la programmation statistique, ainsi que les infirmières et les techniciennes de recherche qui ont participé au recrutement des participantes de l’étude et à l’extraction des données de leurs dossiers médicaux.
Je remercie tout le personnel de l’Institut national de santé publique du Québec (INSPQ) pour le chaleureux accueil durant ma période de stage et pour les partages enrichissants durant les clubs de lecture.
Je tiens également à remercier toutes ces personnes chères à mon cœur, mon frère Rémy, sa femme Jennifer, mes adorables neveux Noah et Jade, mes merveilleux amis et toute ma famille élargie pour leurs encouragements et soutien tout au long de mes études.
Finalement, j’aimerais remercier particulièrement mes parents, René et Assétou Bonou, grâce à qui j’ai pu réaliser des études universitaires. Malgré la distance, vous n’avez cessé d’être un soutien sans faille à mon égard. Vous êtes des parents merveilleux et ma source d’inspiration. Merci pour vos sacrifices, vos encouragements, vos conseils et votre amour.
Avant-propos
Le présent mémoire de maîtrise en épidémiologie a été réalisé sous la direction de M. Alexandre Bureau et la codirection de M. Patrick Levallois – tous deux professeurs au département de médecine sociale et préventive de la Faculté de médecine de l’Université Laval. M. Bureau est aussi affilié à l’axe de recherche en neurosciences cliniques et cognitives de l’Institut universitaire en santé mentale de Québec. M. Levallois est aussi médecin-conseil à la direction de la santé environnementale et de la toxicologie de l’Institut national de santé publique du Québec (INSPQ) et il est membre de l’axe de Santé des Populations et de Pratiques Optimales en Santé du Centre de recherche du CHU de Québec. Le mémoire est composé d’une introduction, d’un chapitre 1 présentant la revue de littérature visant à situer le cadre conceptuel de l’étude et sa pertinence, d’un chapitre 2 énonçant les hypothèses et objectifs de recherche et décrivant la méthodologie, d’un chapitre 3 présentant les résultats de l’étude dans un article intitulé : << Prenatal exposure to drinking-water chlorination by-products, cytochrome P450 gene polymorphisms and risk of intra-uterine growth restriction >>, d’un chapitre 4 présentant une discussion portant sur l’interprétation des résultats et sur leur validité et d’une conclusion.
Le présent projet avait pour objectif d’évaluer, sur un échantillon de la région métropolitaine de Québec (Canada), l’effet direct de certains polymorphismes des gènes du CYP450 sur le risque de RCIU, puis d’étudier leur effet modifiant sur l’association entre l’exposition maternelle aux SPCs et le risque de RCIU. Dans le cadre de ce projet, j’ai été responsable de la revue de littérature, de l’extraction des résultats du programme d’analyse d’interaction multiplicative réalisé par M. Nguile-Makao. J’ai également programmé les analyses d’interaction additive et les analyses d’associations, puis j’ai interprété tous les résultats obtenus. J’ai aussi été responsable de la rédaction de l’article inclus dans ce mémoire dont je suis le premier auteur. L’article a été soumis à la revue Reproductive Toxicology en novembre 2016 puis resoumis en mai 2017 avec certaines corrections suggérées par les réviseurs de la revue. Les coauteurs de cet article sont : mon directeur de recherche, M.
Alexandre Bureau, Ph.D, mon codirecteur M. Patrick Levallois, M.D , M. Yves Giguère, Ph.D, professeur au département de biologie moléculaire, biochimie médicale et pathologie de la Faculté de médecine de l’Université Laval et affilié à l’axe de reproduction, santé de la mère et l’enfant du Centre de recherche du CHU de Québec, ainsi que M. Manuel Rodriguez, Ph.D, professeur au Centre de recherche en aménagement et développement de la faculté d’aménagement, d’architecture, d’art et de design de l’Université Laval.
Les résultats de ce projet de recherche ont été présentés sous forme d’affiche au 25e
congrès annuel de l’International Genetic Epidemiology Society (IGES) qui s’est déroulé à Toronto du 24 au 26 octobre 2016.
INTRODUCTION
La désinfection au chlore fut une des réussites majeures du 20e siècle en termes
d’assainissement de l’eau et de santé publique. Elle permit de réduire considérablement la propagation des maladies infectieuses d’origine hydrique (Cutler & Miller, 2005). La plupart des usines de traitement de l’eau potable utilisent une forme de chlore comme désinfectant (Santé Canada, 2009). Cependant, la chloration de l’eau engendre des sous-produits (SPCs) dont les trihalométhanes (THMs) et les acides haloacétiques (AHAs) sont les plus abondants en concentration (Richardson et al. 2007). Après leur découverte dans les années 1970, les SPCs ont soulevé un intérêt à cause de leurs propriétés carcinogènes sur la base desquelles ils ont été réglementés dans les pays d’Amérique du Nord et plusieurs autres pays à travers le monde (Gouvernement du Québec, 2016; US-EPA, 2010). Plus récemment en 1992 apparaissent les premières préoccupations au sujet des effets des SPCs sur le développement fœtal (Kramer et al., 1992). Cependant ces préoccupations restent controversées. Certaines études épidémiologiques et toxicologiques soulèvent la possibilité d’une association entre l’exposition maternelle aux SPCs durant la grossesse et la restriction de croissance fœtale (Nieuwenhuijsen et al. 2000; Tardiff et al., 2006; Grellier et al. 2010; Villanueva et al., 2015) tandis que d’autres études suggèrent une absence d’association (Villanueva et al., 2011; Patelarou et al., 2011). Les résultats sont ambigus et les mécanismes biologiques de toxicité des SPCs sont peu connus (Nieuwenhuijsen et al., 2009).
Un ensemble de preuves certifiant l’existence d’une relation exposition-effet reposant sur un mécanisme dont la plausibilité biologique est avérée offrirait un argument en faveur de la causalité selon les critères d’Austin Bradford Hill (Hill, 1965). Certaines études ont montré qu’une variété de facteurs génétiques influenceraient le développement fœtal (Yamada et al., 2015; Infante-Rivard, 2007; Sharma, Sharma, & Shastri, 2016). La variation génétique pourrait expliquer partiellement l’inconsistance des résultats de l’association entre l’exposition aux SPCs et le RCIU, et donnerait une piste potentielle sur le mécanisme de toxicité des SPCs qui conduirait au RCIU.
À ce jour, peu d’études ont exploré le rôle des caractéristiques génétiques dans le risque de RCIU associé à l’exposition aux SPCs (Infante-Rivard, 2004; Danileviciute et al., 2012; Levallois et al., 2016; Kogevinas et al., 2016). Les polymorphismes des enzymes des phases I et II du métabolisme de biotransformation des xénobiotiques ont été principalement étudiés. Les enzymes du cytochrome P450 (CYP450) des familles 1-3 métabolisent les réactions d’oxydation de la phase I de biotransformation des xénobiotiques dont elles constituent une étape limitante (Ingelman-Sundberg 2001). La littérature suggère que les isoenzymes du CYP450, CYP1A2, CYP2A6 et CYP2D6 interviendraient dans le métabolisme des SPCs (Allis et al., 2002 ; Zhao et Allis, 2002 ; Baker et al., 2008). En outre, les SPCs pourraient interférer dans la biosynthèse des hormones sexuelles stéroïdiennes (Zeng et al., 2013) qui sont d’une grande importance pour le développement fœtal. Les polymorphismes du gène CYP17A1 dont l’isoenzyme CYP17A1 est impliquée dans la biosynthèse des hormones stéroïdiennes auraient un effet direct sur le RCIU (Yamada et al., 2004).
Notre étude avait pour but d’étudier l’association entre les polymorphismes des gènes CYP1A2, CYP2A6, CYP2D6 et CYP17A1 et le risque de RCIU, et d’évaluer l’effet modifiant de ces polymorphismes sur l’association entre l’exposition maternelle aux SPCs durant la grossesse et le RCIU.
L’étude s’inscrit dans la perspective d’une meilleure caractérisation des mécanismes biologiques qui causeraient le RCIU lors d’exposition maternelle aux SPCs. Elle permet en outre, d’identifier les mères ayant des prédispositions génétiques d’accoucher d’un enfant ayant un RCIU lors d’exposition aux SPCs. L’identification de ces mères vulnérables serait un argument pour une meilleure règlementation des SPCs et l’implantation de mesures préventives en santé publique protégeant ce groupe de femmes à risque.
CHAPITRE 1 — REVUE DE LA LITTÉRATURE
1. RETARD DE CROISSANCE INTRA-UTÉRIN (RCIU)
1.1. Caractéristiques du RCIU
1.1.1. Définition du RCIU
Le retard de croissance intra-utérin (RCIU) se définit par l’incapacité du fœtus d’atteindre son potentiel génétique de croissance ou par une déviation de sa trajectoire attendue de croissance en raison d’un mécanisme pathologique (Ego, 2013). Le diagnostic de RCIU s’établit sur une interprétation de la biométrie fœtale lors d’une série d’échographies espacées, et sur une interprétation clinique. En effet, les modalités du diagnostic lors d’examens échographiques se basent sur une série de mesures de paramètres biométriques in utero tels que le diamètre bipariétal, le périmètre crânien et abdominal et la taille du fémur en fonction de l’âge gestationnel (Platz & Newman, 2008). Cette interprétation échographique est accompagnée d’une interprétation clinique faisant référence aux différentes pathologies diagnostiquées au Doppler (examen médical échographique) et à l’oligoamnios (déplétion du liquide amniotique) (Ego, 2013; Lausman et al., 2013).
En raison de la complexité du diagnostic du RCIU et à défaut d’avoir les mesures biométriques du fœtus, la majorité des études épidémiologiques utilisent le petit poids de naissance pour l’âge gestationnel (PPAG) comme indicateur du RCIU. En pratique, un enfant PPAG est défini comme un nouveau-né dont le poids de naissance est inférieur à un certain seuil de poids de naissance d’une courbe de référence nationale ou spécifique à la région de l’étude. Ces courbes de référence décrivent la distribution du poids de naissance en fonction de l’âge gestationnel, du sexe de l’enfant et parfois de l’ethnicité. Le seuil du 10e percentile
1.1.2. Classification du RCIU
Le RCIU peut être symétrique ou asymétrique. Le RCIU est dit symétrique lorsqu’il touche de manière homogène les paramètres biométriques de croissance du fœtus. Il apparait aux stades précoces du développement fœtal et est généralement associé à des anomalies génétiques (Vrachnis et al., 2006). Le RCIU asymétrique prédomine sur le paramètre de croissance abdominale. Il est le plus prévalent et compte pour environ 70-80 % des cas (Platz & Newman, 2008). Le RCIU asymétrique apparait plus tard dans la grossesse particulièrement durant le troisième trimestre (Sharma, Shastri, Farahbakhsh, & Sharma, 2016). Il est fréquemment associé à l’insuffisance utéroplacentaire ou à différents facteurs extrinsèques à la grossesse (Hendrix & Berghella, 2008; Sharma, Shastri, et al., 2016). Le troisième trimestre de grossesse est particulièrement considéré comme une période durant laquelle la croissance fœtale est sensible aux influences environnementales (Wright et al., 2003).
1.2. Épidémiologie du RCIU
1.2.1. Prévalence et conséquences
Le RCIU est une complication de grossesse représentant un lourd fardeau de santé publique. De façon générale, le 10e percentile d‘une courbe de référence sélectionne 10% des
enfants PPAG à la naissance lorsque la population d’étude est identique à celle ayant servi à construire la courbe de référence (Ego, 2013). Puisque les courbes de référence diffèrent selon les régions, il est difficile de réaliser de grandes études comparatives des fréquences du PPAG (Gaudineau, 2013). Dans ce contexte, il est intéressant d’étudier le pourcentage de l’issue petits poids de naissance (PN) qui est indépendant du choix d’une courbe de référence et qui correspondant aux enfants dont le poids de naissance est inférieur à 2500 g, sans ajustement sur l’âge gestationnel (OMS, 1992). L’Organisation mondiale de la Santé (OMS)
et l’agence de l'Organisation des Nations unies consacrée à l'amélioration et à la promotion de la condition des enfants (UNICEF) estiment qu’environ 20 millions d’enfants dans le monde naissent PN chaque année (UNICEF & OMS, 2004).
Au Canada, le nombre de PPAG pour 100 naissances vivantes était en moyenne de 8,4 cas durant les années 1988 à 1997 (Santé Canada, 2000). Entre 2001 et 2010, la prévalence de PPAG a oscillé de 7,8 % à 8,3 % et s’est établie à sa plus haute valeur de 8,3 % en 2010 (Public Health Agency of Canada, 2013). L’Alberta, la Nouvelle-Écosse et le Québec étaient les provinces canadiennes les plus affectées avec des prévalences respectives de PPAG d’environ 8,8 %, 8,5 % et 8,3 % dans la période de 2006 à 2010 (Public Health Agency of Canada, 2013). Cette relative stabilité de la prévalence du PPAG depuis 1988 au Canada et les hautes prévalences à travers le monde dénote que le RCIU demeure une préoccupation d’actualité.
Modéré ou sévère, le RCIU peut avoir de graves conséquences sur la santé infantile. Il est à l’origine d’incapacités qui à court ou long terme auront des répercussions non seulement sur l’enfant, mais aussi sur sa famille, les systèmes de soins et la société. Le RCIU est un facteur de risque élevé de morbidité et mortalité périnatale (Gardosi et al., 2013). Il est associé à diverses déficiences et handicaps postnataux dont les troubles du neuro-développement incluant la fonction motrice, cognitive et exécutive (Wang et al., 2016), des difficultés d’apprentissage lors de la scolarisation (Larroque et al., 2001; Takeuchi et al., 2016) et des troubles comportementaux tels que l’agressivité, l’impatience et l’inattention (Takeuchi et al., 2017). Les fœtus avec un RCIU naissent plus précocement (35 vs 38 semaines) avec un taux de mortalité plus élevé (8 % vs 1 %), un risque accru de complications périnatales (24,4 % vs 1,0 %) et un retard de croissance à long terme (21,2 % vs 7,4 %) (von Beckerath et al., 2013). Une étude canadienne réalisée dans 24 unités de soins intensifs néonatals montre que les enfants PPAG auraient un risque plus élevé de pathologies rénales sévères, de dysplasie de broncho-pulmonaire et auraient une période prolongée hospitalisation en soins intensifs sous assistance respiratoire (Qiu et al., 2012). De plus, les risques de césarienne prophylactique et d’induction du travail avant la 37e semaine de
grossesse sont augmentés en cas de suspicion anténatale de RCIU respectivement de 23,8 % et 21,1 % (Gaudineau, 2013).
De nombreuses pathologies chroniques à l’âge adulte sont également associées au RCIU. Parmi ces pathologies se comptent les maladies cardiovasculaires, l’hypertension artérielle (Gascoin & Cipierre, 2015), le diabète de type 2 et l’obésité (Varvarigou, 2010). Au regard des lourdes conséquences qu’engendre le RCIU, il est important d’identifier les facteurs de risque de cette maladie.
1.2.2. Étiologie du RCIU
Le RCIU est une pathologie multifactorielle dont l’étiologie est complexe. Les multiples facteurs de risque sont interconnectés et peuvent affecter de façon concomitante la croissance fœtale (Gaudineau, 2013). La croissance fœtale dépend à la fois du potentiel génétique de croissance et de facteurs relatifs à l’unité fœto-placentaire qui sont eux-mêmes influencés par l’environnement maternel (Cox & Marton, 2009).
Le potentiel de croissance fœtal est déterminé par un ensemble de gènes hérités des parents qui détermineront les conditions optimales de croissance durant la grossesse et la taille du nourrisson à sa naissance. En effet, le risque de RCIU varie en fonction de l’origine ethnique. Par rapport aux Caucasiennes, le risque d’accoucher d’un enfant atteint de RCIU semble augmenter pour les mères asiatiques et afro-américaines d’un facteur de 2 à 3 (Gaudineau, 2013). En général, des études ont montré une certaine hérédité du PPAG/RCIU suggérant l’implication de facteurs génétiques dans la physiopathologie de la maladie (Ananth et al., 2009; La Batide-Alanore et al., 2002).
Le développement fœtal dépend de différentes hormones thyroïdiennes, hypophysaires, placentaires et surrénales chez la mère et l’enfant (Fowden & Forhead, 2013; Murphy et al., 2006). Il dépend également de nombreuses enzymes impliquées dans des voies métaboliques influençant directement ou indirectement le développement fœtal. Des polymorphismes des gènes maternels, fœtaux ou placentaires codant pour ces différentes hormones ou enzymes pourraient affecter la croissance fœtale (Infante-Rivard, 2007; Saenger & Reiter, 2012;
Sharma, Sharma, et al., 2016). Environ, un tiers des causes du RCIU seraient d’origine génétique et les deux tiers restants seraient relatifs à l’environnement maternel ou fœtal (Sharma, Shastri, et al., 2016).
L’insuffisance placentaire est la cause généralement associée à la plupart des cas de RCIU. Elle provient de dommages vasculaires ou d’une atrophie du placenta qui s’accompagnent d’un déficit en apport d’oxygène et en nutriments indispensables pour une croissance du fœtus (Abule et al., 2016; Cetin & Antonazzo, 2009). Certains facteurs de risque maternels peuvent favoriser l’insuffisance placentaire notamment diverses pathologies entrainant une diminution du volume sanguin utéroplacentaire. Ces pathologies incluent les troubles hypertensifs, particulièrement la prééclampsie, le diabète avec affection vasculaire et les maladies rénales chroniques comme l’insuffisance rénale (Hendrix & Berghella, 2008). D’autres facteurs de risque maternels sont liés à la consommation de substances toxiques durant la grossesse telles que le tabac, l’alcool et les drogues (Sharma, Shastri, et al., 2016), ou à des conditions et pathologies occasionnant une réduction en apport d’oxygène telles que les hautes altitudes, une altération quantitative ou qualitative de l’hémoglobine et des affections pulmonaires (Hendrix & Berghella, 2008; Kozuki, Lee, & Katz, 2012).
Les faibles conditions socio-économiques et les maladies chroniques pourraient occasionner une insuffisance nutritionnelle chez la mère durant sa grossesse qui pourrait également entrainer le RCIU (Romo et al., 2009). La malnutrition maternelle aurait pour conséquences un faible indice de masse corporel (IMC) et un faible gain de poids durant la grossesse qui conduirait à une baisse de la fonction et du développement placentaire et un déficit d’apport nutritionnel au fœtus (Belkacemi et al., 2010). En général, un statut anthropométrique insuffisant (taille < 145 cm, insuffisance pondérale) chez la mère est lié à une restriction de croissance (Han et al., 2011; Kozuki et al., 2015).
Les caractéristiques maternelles telles que les âges extrêmes, la primiparité et une grande multiparité sont aussi des facteurs de risque du PPAG/RCIU. La fréquence du PPAG se trouverait triplée pour un âge maternel de plus de 35 ans en comparaison aux mères se situant dans la tranche d’âge de 20 à 30 ans et le risque serait majoré avec l’avance d’âge
particulièrement au-delà de 40 ans (Gaudineau, 2013). La primiparité et la grande multiparité (> 8 enfants) sont associées à des fréquences plus élevées de PPAG en comparaison à la multiparité comprise entre 2 et 4 enfants avec des RC respectifs de 1,9 (IC 95 % :1,8-2,0) et 1,7 (IC 95 % :1,1-2,5) (Gaudineau, 2013; Shah, 2010).
Les causes fœtales comptent pour environ 20 % des cas de RCIU (Thompson et al., 2012). Les facteurs de risques fœtaux sont généralement des anomalies génétiques et des malformations et infections congénitales (Hendrix & Berghella, 2008). Plus fréquemment dans les pays en voie de développement, les infections virales, bactériennes ou parasitaires transmises par la mère seraient à l’origine du RCIU. Parmi ces infections se compte : le VIH, le paludisme, la rubéole, la toxoplasmose, le cytomégalovirus, l’herpès et la syphilis (Ergaz et al., 2005). Les infections entrainent des carences nutritionnelles (liées aux symptômes diarrhées, perte d’appétit, etc.) et de l’inflammation qui accroissent le risque de RCIU (Cox & Marton, 2009).
Une proportion notable des cas de RCIU est due à des expositions environnementales. De nombreux produits nocifs se retrouvent dans l’air, l’eau, les sols et les aliments. L’exposition maternelle à des produits environnementaux toxiques aurait une influence négative sur la biométrie fœtale (Amiri & Turner-Henson, 2016; Hanke et al., 2004). Ces produits nocifs seraient associés à une baisse de la prolifération cellulaire du cordon ombilical (Novack et al., 2016), perturberaient la fonction endocrinienne des ovaires (Patel et al., 2015) et induiraient de l’inflammation et du stress oxydatif qui endommagerait l’ADN des cellules (Moller et al., 2014).
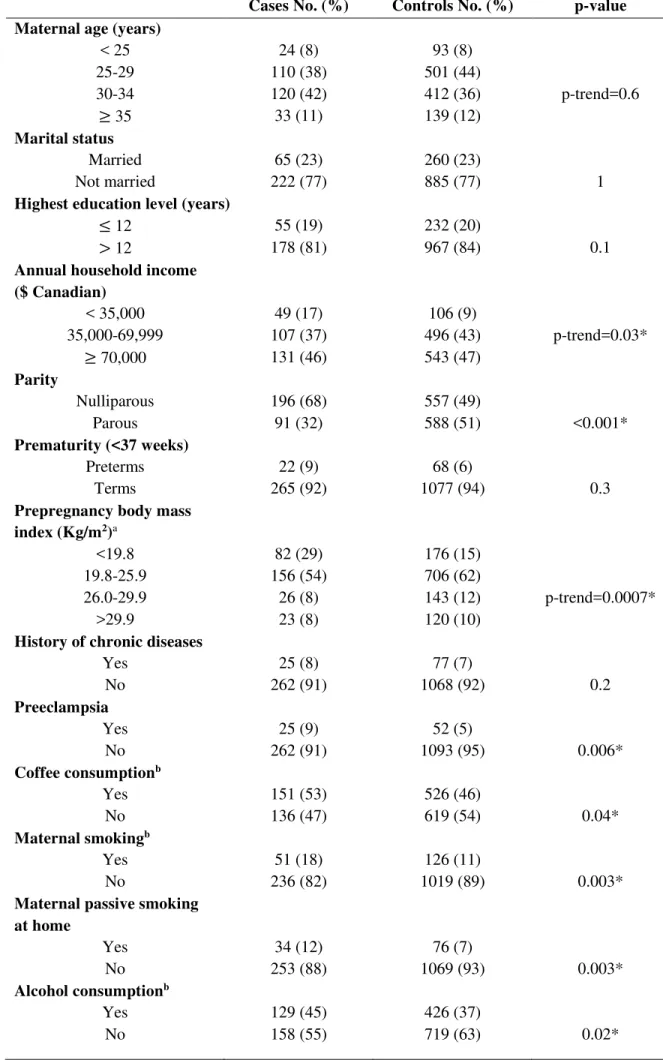
La désinfection de l’eau de consommation engendre des sous-produits qui peuvent possiblement affecter le développement fœtal (Grellier et al., 2010; Villanueva et al., 2015). Dans la section suivante, nous présenterons les sous-produits de chloration de l’eau (SPCs) et leur rôle dans le RCIU. Le tableau 1 résume les principaux facteurs de risque du RCIU.
Tableau 11 : Facteurs de risque du RCIU
Facteurs fœtaux1, 2,3 Anomalies chromosomiques (10 à 20 %)2: Trisomies 21, 18, 13…
Infections congénitales (5 à 10 %)transmises par la mère2
Malformations congénitales Grossesse multiple
Sexe fœtal
Facteurs maternels1, 2,3 Caractéristiques maternelles
• Âges extrêmes : <16 ans et > 35 ans
• Origine ethnique (asiatique, afro-américaine)
• Taille et poids maternels : Indice de masse corporel (IMC) < 18,5 kg/m2 • Faible poids de naissance de la mère
• Faible gain de poids durant la grossesse • Primiparité et grande multiparité
• Faible intervalle entre les grossesses : < 18 mois
• Antécédents d’accouchement d’enfants atteints du PPAG Malnutrition
Maladies chroniques
Troubles hypertensifs (20 à 30 %)2 : Prééclampsie • Maladies cardiovasculaires
• Diabète prégestationnel avec vasculopathie • Maladies rénales
• Troubles hématologiques : anémie • Maladies auto-immunes
• Hypoxémie
Infections : Toxoplasmose, paludisme, rubéole, VIH, Herpes, syphilis
Consommations de produits toxiques : tabagisme actif et passif, alcoolisme, drogues, caféine
Pathologies
placentaires1,2,3 • Décollement du placenta Insuffisance placentaire
• Infection et inflammation du placenta • Infarctus du placenta
• Placenta circumvallata • Mosaïque placentaire
• Thrombophilie liée à une pathologie utéroplacentaire • Angiome placentaire
Facteurs environnementaux
et sociaux • Localisation géographique : haute altitude
1, 2
• Exposition à des substances environnementales toxiques : • Irradiation1
• Pesticides5
• Faibles conditions socio-économiques2 • Conditions de travail4
o Stress au travail
o Prolongement du temps de travail (heures, jour et mois) durant la grossesse o Longue station debout durant les heures de travail
o Nombre d’heures de sommeil
Influence génétique • Gènes de la voie du métabolisme de biotransformation des xénobiotiques : Cytochromes P4506,9, Glutathion S-transférases (GSH)6
• Gènes de la biosynthèse stéroïdienne : CYP17A17
• Gènes de la voie du métabolisme de la thrombophilie,8 : MTHFR, PAI-1,
Facteur XIII
• Gènes de la voie métabolique de l’artériosclérose ou de la dysfonction vasculaire6 : APOE, PON, ACE
• Gène de la voie métabolique de la résistance à l’insuline6,8: IGF-1
Facteurs de risque du RCIU présentant une plus grande force de preuve.
Le tableau 1 est un récapitulatif de certaines études de synthèse portant sur les facteurs de risque du RCIU : 1Sankaran & Kyle, 2009 ; 2Hendrix &
Berghella, 2008 ; 3Gaudineau, 2013 ; 4Romo et al., 2009 ; 5Chand et al., 2014 ; 6Infante-Rivard, 2007 ; 7Yamada et al., 2004 ; 8Sharma, Shastri, et al.,
2. SOUS-PRODUITS DE CHLORATION DE L’EAU (SPCs)
2.1. Formation des SPCs dans l’eau potable
Le chlore est le désinfectant hydrique le plus utilisé au monde en raison de son faible coût et de son efficacité. Le chlore a la capacité de tuer ou d’inactiver les microorganismes communément présents dans l’eau. Toutefois, le chlore réagit avec la matière organique naturelle dissoute tels les acides humiques et fulviques ainsi que les ions bromures présents dans l’eau brute (Eish & Wells, 2006; S. W. Krasner, 2009). Les contaminants halogénés qui en résultent se nomment sous-produits de chloration (SPCs).
Les premiers SPCs mis en évidence ont été les trihalométhanes (THMs) (Bellar & Lichtenberg, 1974; Rook, 1974) suivis des acides haloacétiques (AHAs) (Krasner et al., 1989). Parmi près de 600 sous-produits de désinfection identifiés à ce jour, les THMs et AHAs sont les sous-produits dont les concentrations sont les plus élevées dans l’eau (Richardson et al. 2007; S. W. Krasner, 2009).
2.2. Classification et règlementation des SPCs : trihalométhanes (THMs) et acides haloacétiques (AHAs)
Les trihalométhanes (THMs) sont des composés dérivant du méthane (CH4). Ils sont
constitués d’un atome de carbone lié à des halogènes étant du chlore, du brome ou la combinaison des deux éléments.
Les THMs communément mesurés dans l’eau sont : • Le chloroforme (CHCl3) : CLF
• — les trihalométhanes bromés (THMBr)
o Le chlorodibromométhane (CHClBr2) : DBCM o Le bromoforme (CHBr3) : BRF
Le chloroforme est le principal THM mesuré dans l’eau potable et représente le plus souvent, près de 90 % en poids de tous les THMs. Cependant en fonction du pH de l’eau brute et de sa teneur en ions bromure, la proportion en chloroforme dans l’eau peut diminuer en favorisant la formation des THMs bromés (THMBr) (Mills et al., 1998). La teneur totale en THMs est représentée par le sigle TTHM qui indique la somme des quatre THMs.
Les acides haloacétiques (AHAs) sont des composés dérivant de l’acide acétique (CH3CO2H). Ils sont également composés des halogènes chlore et/ou brome. Les sigles
AHA5 et les AHA9 représentent les teneurs totales en acides haloacétiques. Les (AHA5) regroupent les cinq AHAs assujettis à une concentration maximale de contaminants en vertu de la Safe drinking Water Act américaine (Hrudey 2008). Ces cinq AHAs sont les suivants : • L’acide chloroacétique (ClCH2COH) : CAA
• L’acide dichloroacétique (CHCl2CO2H) : DCAA • L’acide trichloracétique (CCl3CO2H) : TCAA • L’acide bromoacétique (BrCH2CO2H) : BAA • L’acide dibromoacétique (CHBr2CO2H) : DBAA
Quatre AHAs combinent les halogènes chlorés et bromés (acides bromochloroacétique, bromodichloroacétique, dibromochloroacétique, tribromoacétique). Les AHA9 regroupent tous les AHAs chlorés et bromés en incluant les AHA5 précédemment énumérés.
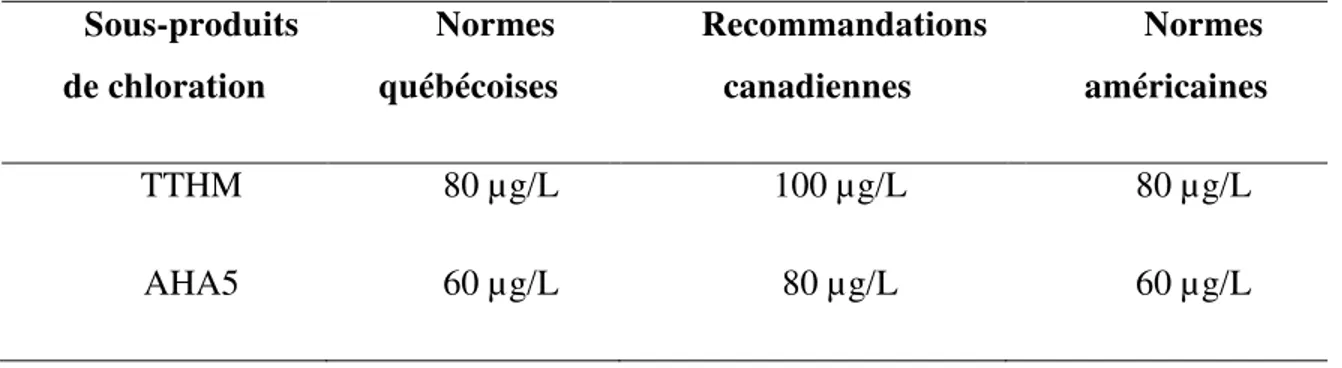
La United States Environmental Protection Agency des États-Unis (US-EPA) réglemente les THMs depuis 1979. Elle a proposé de fonder la réglementation des 4 THMs (TTHM) sur une moyenne annuelle maximale établie sur un an qui a été officiellement adoptée par le Canada en 1996 (Hrudey 2008). La concentration annuelle maximale des AHAs a été fixée ultérieurement pour le groupe des AHA5 (CAA, DCAA, TCAA, BAA et DBAA) aux États-Unis et au Canada (Hrudey 2008). Au Canada, la règlementation de l’eau potable est sous la juridiction des provinces (Dunn et al., 2014), les limites pour les THMs et AHAs proposées par l’État canadien ne sont donc que des recommandations. Le Québec est l’une des rares
provinces canadiennes à avoir adopté des limites pour les TTHM et AHA5 différentes de celles recommandées par le Canada (Gouvernement du Québec, 2016).
Tableau 22 : Normes et recommandation des THMs et AHAs au Canada et aux États-Unis
Sous-produits de chloration Normes québécoises Recommandations canadiennes Normes américaines TTHM 80 µg/L 100 µg/L 80 µg/L AHA5 60 µg/L 80 µg/L 60 µg/L
2.3. Études toxicologiques et épidémiologiques des SPCs sur le développement fœtal
Plusieurs revues systématiques (Graves et al., 2001; Tardiff et al., 2006; Nieuwenhuijsen et al., 2000; Bove et al., 2002; Nieuwenhuijsen et al., 2009; Villanueva et al., 2015) et une méta-analyse (Grellier et al., 2010) ont suggéré des effets possibles des SPCs sur la croissance fœtale.
Des revues systématiques (Nieuwenhuijsen et al., 2000; Graves et al., 2001; Tardiff et al., 2006) ont présenté une synthèse des études toxicologiques des effets des SPCs sur le développement fœtal de rongeurs (souris, rats). Ces études ont révélé qu’une exposition à de fortes doses de THMs induisait une réduction du poids fœtal et du taux de survie à cause de plusieurs effets toxiques engendrés par ces produits chez la mère et le fœtus (Nieuwenhuijsen et al., 2000). D’autres études toxicologiques portant essentiellement sur le chloroforme ont
2Les valeurs guides des THMs et AHAs proviennent des références suivantes: (Hrudey,2008 ; Gouvernement
suggéré une restriction du développement fœtal accompagnée d’une réduction de la taille fœtale et du poids de naissance des rongeurs traités à de fortes doses. Toutefois, ces observations n’avaient pas été constatées avec les THMs bromés (THMBr) : bromoforme, BDCM et CDBM (Graves et al. 2001). Les effets toxiques des SPCs observés chez les animaux constituent une anticipation de leurs effets possibles sur l’humain. Cependant dans le contexte expérimental, les effets nocifs des SPCs observés chez les animaux apparaissaient à de fortes doses auxquelles il est peu probable que les humains soient exposés. De plus, les données toxicologiques soulignent l’absence d’une relation dose-réponse (Graves et al., 2001 ; Tardiff et al., 2006).
Dans les années 1992 apparaissent les premières études épidémiologiques des effets des SPCs sur le développement fœtal (Kramer et al., 1992). À ce jour, l’ensemble des études épidémiologiques traitant l’association entre l’exposition aux SPCs et différentes issues de grossesse ont été récapitulées dans la revue de Graves (Graves et al., 2001), sa version révisée en 2006 (Tardiff et al., 2006) et dans des revues plus récentes (Nieuwenhuijsen et al., 2009 ; Villanueva et al., 2015). Ces revues ont suggéré avec un certain niveau de preuve, l’existence d’une association positive entre l’exposition maternelle aux SPCs et le PPAG/RCIU. Elles stipulent néanmoins que ces preuves restent minces.
Dans la méta-analyse de Grellier (Grellier et al., 2010), huit études ont été incluses pour estimer un indice d’association global entre l’exposition aux SPCs et le PPAG. L’exposition y était mesurée par la concentration des trihalométhanes totaux (TTHM) dans les réseaux de distribution d’eau durant le troisième trimestre de grossesse. Le rapport de cotes (RC) combiné associé à une augmentation de 10 μg/L était de 1,01 (IC 95 % : 1,00-1,02). Ce RC combiné suggère une association positive. Cependant, il est extrêmement proche de la valeur nulle 1.
Les preuves épidémiologiques appuyant l’implication des SPCs dans le développement du fœtus humain ont été jugées peu concluantes dues aux limites de l’évaluation de l’exposition (Graves et al., 2001, Tardiff et al., 2006 ; Nieuwenhuijsen et al., 2009 ; Grellier et al., 2010 ; Villanueva et al., 2015). Des études plus récentes ont ainsi été réalisées avec
une meilleure évaluation de l’exposition dans des réseaux de distribution d’eau et en tenant compte de l’exposition individuelle des participantes.
Une étude cas-témoins effectuée dans la région de la ville de Québec (Canada) a évalué l’association entre l’exposition maternelle aux THMs et AHAs durant les trois trimestres de grossesse et le risque de RCIU (PPAG < 10e percentile) (Levallois et al., 2012). L’exposition
aux SPCs était évaluée par une estimation des concentrations en THMs et en AHAs dans l’eau du robinet des résidences des participantes en tenant compte de la variabilité spatio-temporelle des SPCs dans les systèmes de distributions d’eau, et par les doses internes en THMs et AHAs en considérant les différentes voies d’exposition de chacun de ces groupes de SPCs (ingestion, inhalation et voie cutanée). Les résultats ont montré qu’aucune relation dose-réponse n’est clairement observée entre les concentrations en TTHM et AHA5 dans l’eau du robinet des résidences divisées en quartiles et le risque de PPAG. Cependant, un risque élevé de PPAG a été constaté durant le troisième trimestre de grossesse lorsque les concentrations en AHAs (TCAA, AHA5 et AHA9) étaient au-dessus de leur 4e quartile et
lorsque les concentrations en TTHM et en AHA5 dans l’eau potable étaient au-dessus de leurs normes au Québec (TTHM 80 µg/L et AHA5 60 µg/L), les rapports de Cotes (RC) ajustés étaient respectivement de 1,5 (IC 95 % : 1,1-1,9) pour les TTHM et 1,4 (IC 95 % : 1,1-1,9) pour les AHA5. Une relation dose-réponse monotone a aussi été constatée pour la dose ingérée des AHA5 lorsqu'elle était divisée en quartiles (Levallois et al., 2012).
Une étude de cohorte prospective a également trouvé une association positive entre l’exposition durant le troisième trimestre de grossesse à une concentration en TTHM dans l’eau potable supérieure à 80 µg/L et le risque de PPAG avec un RR de 2,0 (IC 95 % :1,1-3,6) (Hoffman et al., 2008).
Dans une étude plus récente (Cao et al., 2016), les concentrations sanguines en TTHM et en THMs spécifiques (chloroforme, BDCM, DBCM, TBM) ont été mesurées chez 1184 femmes enceintes. Les mères ayant des concentrations sanguines en BDCM et DBCM supérieures au 3e tertile (BDCM : 4,8 ng/L et DBCM : 2,6 ng/L) étaient plus à risque
d’accoucher d’un nourrisson de petite taille comparées aux mères dont les concentrations sanguines en ces SPCs étaient inférieures au 3e tertile. Pour des concentrations sanguines en
DBCM supérieures au 3e tertile, la réduction de la taille du fœtus à la naissance était de -0,20
cm (IC 95 % : -0,37 ; -0,04) avec une valeur-p du test de tendance de 0,02 et pour le BDCM, cette réduction était de -0,15 cm (IC 95 %: -0,29 ; -0,01) avec une valeur-p du test de tendance de 0,04. Le risque de PPAG était en général augmenté pour les mères exposées à des valeurs supérieures au 2e (44,2-74,4 ng/L) et 3e (74,4 ng/L) tertile des TTHM en
comparaison au 1er tertile (44,2 ng/L) avec des RC respectifs de 2,91 (IC 95 % : 1,32-6,42)
et 2,25 (IC 95 % : 1,01-5,03).
En conclusion, la revue de la littérature toxicologique et épidémiologique indique que la relation entre les SPCs et le RCIU n’est pas clairement établie. La susceptibilité génétique pourrait expliquer en partie la variabilité des résultats et donnerait des pistes sur les potentiels mécanismes de toxicité des SPCs chez les individus vulnérables (Villanueva et al., 2015).
3. SUSCEPTIBILITÉ GÉNÉTIQUE AU RCIU LORS D’EXPOSITION
MATERNELLE AUX SPCs
L’hypothèse d’une prédisposition génétique permettrait une meilleure compréhension du mécanisme biologique qui rendrait plausible un lien de causalité entre l’exposition maternelle aux SPCs et le risque de RCIU.
À ce jour, peu d'études épidémiologiques se sont intéressées au rôle des caractéristiques génétiques dans le retard de la croissance fœtal lors d’exposition maternelle aux SPCs (Danileviciute et al., 2012; Infante-Rivard, 2004; Kogevinas et al., 2016; Levallois et al., 2016). Les principaux gènes étudiés sont impliqués dans le métabolisme de biotransformation des xénobiotiques.
3.1. Processus de détoxification : biotransformation des xénobiotiques
Les substances exogènes, communément d’origine environnementale, sont désignées sous le terme de "xénobiotique". Les xénobiotiques à caractère lipophile traversent aisément la paroi intestinale, la peau et la barrière placentaire où ils peuvent avoir des effets toxiques pour la mère et le fœtus. La biotransformation des xénobiotiques s’inscrit dans le processus de détoxification éliminant ces substances exogènes dans les liquides biologiques (Dekant, 2009). Elle se déroule principalement dans les cellules hépatiques, mais également dans les cellules intestinales, cutanées et placentaires (Bozina et al., 2009). Les réactions de biotransformation se scindent en deux phases : la phase I ou phase de fonctionnalisation et la phase II ou phase de conjugaison. Les réactions de ces deux phases permettent d’obtenir des métabolites assez hydrophiles pouvant facilement être excrétés dans les liquides biologiques (Dekant, 2009). Les enzymes du cytochrome P450 (CYP450) sont responsables des réactions d’oxydation de la phase I (Ingelman-Sundberg, 2005) qui constituent une étape limitante de la biotransformation. Les glutathions S-transférases sont les enzymes majoritairement impliquées dans les réactions de la phase II de biotransformation des xénobiotiques. La variation génétique ou le polymorphisme génétique des enzymes de biotransformation pourrait affecter le processus de détoxification et exposer l’individu aux pathologies associées à la toxicité du xénobiotique. On distingue plusieurs types de marqueurs polymorphes : le polymorphisme nucléotidique SNP (single nucleotide polymorphism) dû à un changement d’une seule paire de bases dans la séquence nucléotidique, les Indels (insertions-délétions d’une séquence nucléotidique), les polymorphismes de longueur de fragment de restriction ou RFLP (restriction fragment length polymorphism), les minisatellites, les microsatellites et une forme particulière de polymorphisme structural nommée variabilité du nombre de copies (CNV :copy number variation).
3.2. Études de susceptibilité génétique au RCIU lors d’exposition maternelle aux SPCs
Infante Rivard (2004) a évalué l’influence du SNP CYP2E1*5 (rs3813867 allèle C ou G1259C) du gène du cytochrome CYP2E1 sur le risque de RCIU/ PPAG (< 10e percentile).
L’isoenzyme CYP2E1 de la phase I du métabolisme de biotransformation des xénobiotiques oxyde une large variété d’hydrocarbures halogénés, famille à laquelle appartiennent les SPCs (Bolt et al., 2003). L’étude d’Infante Rivard (2004) a observé une augmentation du risque de PPAG pour les nouveau-nés porteurs de l’allèle CYP2E1*5 et dont les mères étaient exposées durant leur grossesse à des niveaux de TTHM supérieurs au 90e percentile (soit 29,4 µg/L)
avec un RC ajusté de 13,2 (IC 95 % :1,19,-146,72).
L’étude de Danileviciute et al. (2012) a montré que les mères porteuses de la délétion du gène GSTM1 (del-GSTM1) avaient un risque plus élevé d’avoir un enfant de petit poids à la naissance (PPN) lorsqu’elles étaient exposées durant leur troisième trimestre de grossesse à des doses élevées de TTHM et de chloroforme avec des RC respectifs de 4,37 (IC 95 % : 1,36–14,08) et 5,06 (IC 95 % : 1,50–17,05). Le test d’interaction indiquait également un effet modifiant de la del-GSTM1 sur l’association entre l’exposition maternelle au chloroforme et le PPN. Cependant, aucune modification d’effet n’avait été observée pour l’issue du PPAG qui est l’indicateur le plus commun du RCIU. La délétion du gène GSTT1 (del-GSTT1) avait aussi été étudiée, mais elle n’a montré aucun effet modifiant de l'association pour les deux issues étudiées (PPAG et PPN).
L’étude de Levallois et al. (2016) a évalué pour l’issue PPAG, l’interaction entre les SNPs du gène CYP2E1 incluant l’allèle CYP2E1*5 étudié dans l’étude d’Infante Rivard (2004) ainsi que les délétions des gènes GSTM1 et GSTT1 étudiées par Danileviciute et al. (2012) avec une meilleure évaluation de l’exposition des participantes considérant les doses internes en THMs et AHAs. L’effet modifiant de l’allèle CYP2E1*5 (rs3813867 allèle C) observé dans l’étude d’Infante Rivard (2004) ainsi que celui observé avec la del-GSTM1 dans l’étude de Danileviciute et al. (2012) n’ont pas été retrouvés dans l’étude de Levallois et al. (2016). Cependant, d’autres SNPs du gène CYP2E1, rs117618383 et rs2515641 ont été
rapportés comme ayant un effet modifiant, mais ces interactions perdaient leur significativité statistique après correction pour l’utilisation de tests multiples (correction de Bonferroni).
Kogevinas et al. (2016) ont rapporté une modification d’effet de l’association entre l’exposition maternelle aux TTHM et le PPAG par le SNP rs743535 allèle T du gène CYP2E1 et la del-GSTT1 (CNV du gène GSTT1) avec des valeurs-p d’interaction significatives au seuil de 0,05. Pour les mères ayant le génotype de référence (absence du polymorphisme CNV), une augmentation du risque de PPAG a été constatée lorsque les TTHM augmentaient de 10 µg/L avec un RC de 1,4 (IC 95 % :0,9-2,1). Cependant, ces effets modifiants n’ont pas persisté après la correction pour l’utilisation de tests multiples (Bonferroni).
Un résumé détaillé des études de susceptibilité génétique précédemment présentées se trouve dans le tableau 3 ci-dessous.
Tableau 3 : Études de susceptibilité génétique au RCIU lors d’exposition maternelle aux trihalométhanes (THMs) et aux acides haloacétiques (AHAs)
Auteurs Devis d’étude Population d’étude Gènes étudiés Mesure de l’exposition aux SPCs
SPCs étudiés Modèles statistiques Résultats RC (IC 95 %) Infante-Rivard, 2004 Cas-témoins hospitaliers 493 cas PPAG<10e percentile 472 témoins appariés sur l’âge gestationnel, la race et le sexe
Montréal, Canada
CYP2E1 (G1259C)
MTHFR (C677T)
Chez la mère et l’enfant
Mesures règlementaires collectées par les municipalités et le Ministère de l’Environnement. Les prélèvements furent réalisés dans 189
systèmes de
distribution, mais la fréquence de collecte n’est pas indiquée.
Fenêtre d’exposition : Grossesse entière THMs Estimation de l’exposition par ingestion et
durant les douches.
Dichotomisation au 90e percentile
Régression logistique multiple, RC ajusté pour les variables : race, sexe, AG, IMC avant la grossesse, primiparité, parité, prééclampsie, antécédents de RCIU, tabagisme et gain de poids durant la grossesse.
Aucune association significative entre l’exposition maternelle aux THMs totaux ou spécifiques et le risque de RCIU.
(-) : Référence et (+): 1ou 2allèles
Allèle CYP2E1*5 chez les nouveau-nés :
CYP2E1*5 (+) et TTHM (>29,4 µg/L): RC= 13,2 (1,2-146,7)
CYP2E1*5 (-) et TTHM (>29,4 µg/L): RC= 0,8 (0,5-1,5)
Allèle CYP2E1*5 chez les mères
CYP2E1*5 (+) et TTHM (>29,4 µg/L): RC= 6,5 (0,6-71,5)
CYP2E1*5 (-) et TTHM (>29,4 µg/L): RC= 0,8 (0,5-1,4)
Pas d’effet de modification par le polymorphisme (C677T) du gène MTHFR.
Danileviciute et al., 2012
Étude cas-témoins nichée dans une cohorte 682 femmes enceintes Issue : le PPAG <10e percentile et PPN. Kaunas, Lituanie del-GSTM1 del-GSTT1 Chez la mère Doses internes : Ingestion, douches et bains Fenêtre d’exposition : Grossesse entière et les trois trimestres de grossesse
THMs
Dichotomisation
Régression logistique, RC ajusté pour les variables : niveau d’étude, tabagisme de la mère et du père, alcool, hypertension, âge gestationnel, IMC, prématurité.
Pour le troisième trimestre de grossesse : Aucune modification d’effet n’a été observée pour le PPAG. GSTT1 et TTHM : RC =1,22 (0,73-2,03) del-GSTT1 et TTHM : RC= 1,51 (0,43-5,29) Interaction : RC =1,19 (0,17-8,09) GSTM1 et TTHM : RC= 0,86 (0,43-1,74) del-GSTM1 et TTHM : RC= 1,81 (0,92-3,56) Interaction : RC= 2,19 (0,83-5,79)
Des résultats non significatifs ont aussi été trouvés pour les THMs spécifiques (CF, DBCM, BDCM).
Auteurs Devis d’étude Population d’étude Gènes étudiés Mesure de l’exposition aux SPCs
SPCs étudiés Modèle statistique Résultats RC (IC 95 %) Levallois et al., 2016 Cas-témoins de la paire mère-enfant 1549 mères et 1455 enfants
324 mères des cas PPAG et 1225 mère des témoins 293 enfants PPAG et 1162 témoins
Cas à terme <10e
percentile du poids à la naissance sur l’âge gestationnel.
Témoins nés la même semaine et dans la même région géographique que les cas.
Villes de Québec et Lévis, Canada SNP (G1259C) de CYP2E1 et 14 autres SNPs de CYP2E1 del-GSTM1 et del-GSTT1
Chez la mère et l’enfant
Estimation de la
concentration en SPCs dans l’eau de robinet des
participantes et Doses internes : Ingestion cutanée et inhalation par douches.
Fenêtre d’exposition : Les trois trimestres de grossesse, mais focus sur le troisième trimestre. THMs et AHAs Dichotomisation au 4e quartile Régression logistique multiple avec RC ajustée pour les variables : Tabagisme passif, IMC, âge de la mère, primiparité, tabagisme au 3e trimestre. Méthode semi-paramétrique du maximum de vraisemblance de (Chen et al., 2012)
Interactions entre les SNPs du gène CYP2E1 et les concentrations en SPCs aux résidences : rs117618383 allèle T du gène CYP2E1 chez les enfants. CYP2E1 CC + TTHM : RC= 1,0 (0,7-1,5) CYP2E1 CT-TT +TTHM : RC= 4,6 (1,2-17,6) p-interaction =0,03 CYP2E1 CC + AHA5 : RC= 1,4 (1,0-1,9) CYP2E1 CT-TT +AHA5 : RC= 5,3 (1,5-18,6) p-interaction =0,04
rs2515641 allèle T du gène CYP2E1 chez les enfants.
CYP2E1 CC + TTHM : RC= 1,1 (0,7-1,6)
CYP2E1 CT-TT +TTHM : RC= 0,3 (0,1-0,8) p-interaction =0,01
Interactions statistiquement non significatives après la correction de Bonferroni
(valeur-p= 0,005). Kogevinas et al., 2016 Cohorte européenne (HiWate) de la paire mère-enfant Analyse génétique : Étude cas-témoins nichée dans la cohorte 14005 paires mère-enfant Effectif de l’analyse génétique :
348 mères de cas PPAG (<10e percentile) et 395
mères des témoins. 349 enfants PPAG et 400 témoins.
Grèce, Espagne, France, Lituanie, Royaume-Uni, Valence (2002-2010) SNPs des CYP450: CYP2E1, CYP1A1, CYP1A2, CYP2A6, CYP2D6, CYP2A6, CYP3A7, CYP3A43 Glutathions S-transférases : GSTT1, GSTT2, GSTT2B
Chez la mère et l’enfant
Concentrations des THMs aux résidences estimées à partir des données
collectées
ad hoc. Estimation des doses totales de THMs absorbées selon les différentes voies
d’exposition (ingestion, douches et bains).
Fenêtre d’exposition : Grossesse entière et les trois trimestres de grossesse THMs Exposition traitée en continu avec pour unité 10 µg/L Régression logistique multiple, RC ajusté pour les variables : sexe, race, parité, tabagisme durant la grossesse
Effet du SNP rs743535 allèle T du gène
CYP2E1sur le PPAG par augmentation de 10 µg/L de TTHM :
CYP2E1 CC : RC= 1,1 (1,0-1,2)
CYP2E1 CT-TT :RC= 0,9 (0,6-1,1) p-interaction=0,028
Effet du CNV du gène GSTT1 sur le PPAG par augmentation de 10 µg/L de TTHM :
GSTT1 - /-: RC= 1,4 (0,9-2,1)
CNV de GSTT1-1 ou 2 allèles : RC= 1,0 (0,9-1,1)
p-interaction=0,037
Interactions statistiquement non significatives après la correction de Bonferroni (valeur-p= 0,0011). Aucun effet modifiant pour tous les autres polymorphismes des gènes étudiés.
Le rôle de la susceptibilité génétique dans l’association entre les SPCs et le RCIU a principalement été étudié pour les gènes des enzymes des phases I et II du métabolisme de biotransformation des xénobiotiques particulièrement le gène de l’isoenzyme du cytochrome CYP2E1 et des glutathions S-transférases GSTT1 et GSTM1. Notre étude d’interaction gène-environnement s’est limitée à certains gènes candidats du cytochrome P450 qui avaient été peu étudiés auparavant.
4. GÈNES DU CYTOCHROME P450 CANDIDATS POUR UNE ÉTUDE
D’INTERACTION GÈNE-ENVIRONNEMENT DANS LE RISQUE DE
RCIU LORS D’EXPOSITION PRÉNATALE AUX SPCs
Afin d’identifier tous les gènes de susceptibilité d’une maladie complexe, la procédure idéale serait d’étudier systématiquement toutes les variations du génome dans une étude à grande échelle nommée étude d’association pangénomique GWAS (genome-wide association study). Cependant, en raison des coûts prohibitifs et de la fréquence de variations dans la population, l’approche la plus communément employée est celle des gènes candidats (Montpetit & Chagnon, 2006). Cette approche a pour avantage de se limiter aux gènes dont la fonction est déjà connue ou sur lesquels une hypothèse voudrait être testée.
Les isoenzymes du CYP450 sont divisées en familles et sous-familles dont les membres respectifs ont des pourcentages d’homologie de 40 % et 55 % dans leur séquence protéique (Ingelman-Sundberg, 2001). La séquence du génome humain a révélé qu’il existe plus de 90 différents gènes humains du cytochrome P450 dont les CYP450 des familles 1-3 seraient responsables de 70 à 80 % de la phase I de biotransformation des médicaments (Ingelman-Sundberg, 2005) et d’un grand nombre d’autres xénobiotiques. Ceux des familles 4-58 métaboliseraient les molécules endogènes (Bozina et al., 2009).