HAL Id: hal-02801120
https://hal.inrae.fr/hal-02801120
Submitted on 5 Jun 2020
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Analyse de la variabilité génotypique et modélisation de
l’architecture et du fonctionnement photosynthétique et
stomatique d’un sous échantillon de la core-collection
française de pommiers (Malus domestica X Borkh)
Rémi Thomasset
To cite this version:
Rémi Thomasset. Analyse de la variabilité génotypique et modélisation de l’architecture et du fonc-tionnement photosynthétique et stomatique d’un sous échantillon de la core-collection française de pommiers (Malus domestica X Borkh). [Stage] France. Ecole d’Ingénieurs en Agriculture (ESITPA), FRA. 2016, 67 p. �hal-02801120�
1
Institut Polytechnique Lasalle Beauvais – Esitpa 3 rue du Tronquet – 76134 Mont-Saint-Aignan Cedex
Année académique 2015-2016
Rapport de projet ingénieur
Pour l’obtention du titre d’Ingénieurs en Agriculture
Analyse de la variabilité génotypique et modélisation de l’architecture et
du fonctionnement photosynthétique et stomatique d’un sous échantillon
de la core-collection française de pommiers (Malus domestica X Borkh)
Thomasset Rémi
Encadré par :
Benoît Pallas- chercheur – INRA UMR AGAP- Montpellier Jérôme Ngao – chercheur – INRA UMR PIAF- Clermont-Ferrand
Christophe Gangneux – enseignant chercheur- Institut Polytechnique Lasalle Beauvais Esitpa – Mont-Saint-Aignan
2
Remerciements
Je tiens en premier lieu à remercier Benoît Pallas et Jérôme Ngao, mes deux maitres de stage, pour m’avoir aidé et suivis tout le long de ce stage. Leurs connaissances en éco-physiologies et modélisations ont été une véritable encyclopédie de connaissances, leur aide lors du rapport a été très précieuse. Bien sûr, il faut remercier Christophe Gangneux, mon tuteur de l’Uni LaSalle pour son suivi et son soutien.
Par la suite il est important de signalé l’aide apporté par l’équipe de chercheurs, doctorants post-doctorants et techniciens de l’équipe AFEF et de l’UMR Piaf qui m’ont accueillis chaleureusement. Ils ont toujours été présents lorsque j’avais des doutes. Je tiens spécialement à remercier Evelyne Costes pour son aide en architecture des pommiers, Jean-Luc Régnard pour ses connaissances agronomiques, David Gomez-Candon pour les connaissances en arboriculture, Vincent Migault pour ses aides en statistiques et Sébastien Martinez pour son aide expérimentale. L’équipe de stagiaires d’AFEF m’ont permis de partager des connaissances, des avis, et ils ont toujours été d’un soutien moral très important pour la réalisation de mon projet ingénieur. Je tiens spécialement à remercier Olivier Simler, camarade d’expérimentation et d’un conseil toujours avisé.
Enfin je tiens à remercier ma famille et mes amis qui ont toujours crus en mon potentiel. Plus particulièrement je tiens à souligner le soutien de Marc Roze, Victoria Buchholz et Killian Cherry tout le long de ce stage.
3
Résumé
Mots-clés : Photosynthèse, conductance stomatique, pommier, Farquhar, Jarvis, architecture
Ce présent rapport a été réalisé au sein de l’UMR AGAP et PIAF de l’INRA. Il a été analysé et modélisé l’architecture et le fonctionnement photosynthétique et stomatique d’un sous échantillon d’une core-collection française de pommiers. En tout il était analysé 6 génotypes choisis au préalable grâce à leurs différences de vigueurs rencontrées lors de l’expérience Phénoarch en 2014. Les pommiers étaient plantés dans un verger à Mauguio (34). Afin de réaliser la modélisation architecturale, un relevé a été effectué grâce à la digitalisation manuelle. Les données montraient des différences significatives en terme architectural. Afin d’implémenter les modèles de fonctionnement foliaire des courbes de réponses de la photosynthèse et de la conductance stomatique à différents facteurs environnementaux ont été réalisés en 2015 et 2016. Bien qu’il n’y ait pas de différences significatives, des tendances ont été montrées. La modélisation des maquettes d’arbres et de la photosynthèse étaient satisfaisantes bien que la conductance stomatique n’était pas convenablement simulée, en raison de variabilité de fonctionnement stomatique entre feuilles. Par la suite il sera important de re-calibrer le modèle de conductance stomatique et de réaliser des simulations compilant l’architecture et le fonctionnement foliaire.
Abstract
Key words : Photosynthesis, stomatal conductance, apple tree, Farquhar, Jarvis, architecture
This report was redacted within the UMR AGAP and PIAF in the INRA institute. The architecture, photosynthesis and stomatal functioning were analyzed and modelled, within a sub-sample of a French core-collection. 6 genotypes were compared in this report. The orchard was situated in the Mauguio town (France). In the aim to model the architecture, experimental data were obtained by the digitalisation. For these data the genotypes were significant. In order to calibrate the models of photosynthesis and stomatal conductance, a couple of measurements with contrasted environmental conditions were performed between 2015 and 2016. These data did not shown significant difference, trends were highlighted. The models simulate well the architecture and the photosynthesis of the trees. On the other hand the stomatal conductance could not be simulated with precision, due to the inter-leaf variability. Afterwards a re-calibration of the stomatal conductance model will be essential as well as to combine an architecture-functioning model for future simulations at the tree scale.
4
Table des matières
Contexte de l’étude ... 5
I. Contexte professionnel ... 5
Introduction générale ... 7
I. Economie de la pomme dans le monde et en France ... 7
II. La recherche et améliorations variétales du pommier ... 7
III. L’architecture du pommier ... 9
IV. Photosynthèse et stomates ... 13
V. Modélisation du fonctionnement foliaire ... 15
Hypothèse de l’étude ... 17
I. Etat des lieux ... 17
II. Objectifs de l’étude ... 17
III. Problématiques de l’étude ... 17
Matériels et méthodes ... 19
I. Matériel végétal et conditions de culture ... 19
II. Modélisation architecturale ... 21
III. Modélisation du fonctionnement photosynthétique ... 30
IV. Détermination des limitations stomatiques et photochimiques de la photosynthèse en condition optimale ... 33
V. Modélisation de la conductance stomatique ... 33
VI. Simulations et validations du modèle combiné Farquhar-Jarvis ... 36
Résultats ... 38
I. Analyse de la variabilité architecturale ... 38
II. Fonctionnement photosynthétique et stomatique ... 44
III. Validation du modèle de Farquhar-Jarvis ... 52
Discussion ... 53
I. Mesures d’architecture ... 53
II. Sources et causes de variabilité de fonctionnement foliaire intra-génotype ... 53
III. Qualité des mesures de fonctionnement foliaire observées ... 57
IV. Qualité des estimations des paramètres de Farquhar ... 57
V. Qualité des estimations des paramètres de Jarvis ... 58
VI. La simulation de la photosynthèse ... 58
VII. La simulation de la conductance stomatique et de la transpiration ... 59
5 Conclusion ... 61
Contexte de l’étude
I. Contexte professionnel 1- L’institut: l’INRA
L’institut Nationale de Recherche Agronomique (INRA) est le premier institut de recherche agronomique français et le second mondial. Il est placé sous la double tutelle du ministère de la recherche et de l’agriculture. Il a été fondé en 1946 pour répondre à la problématique de la souveraineté alimentaire française. Maintenant ses missions se sont élargies : de la publication scientifique à l’expertise scientifique en passant par des innovations diverses. Ses champs d’études sont l’agriculture, l’alimentation et l’environnement. L’INRA est réparti sur le territoire avec 20 centres régionaux comptabilisant 8500 chercheurs, ingénieurs et techniciens.
2- Les unités mixtes de recherches (UMR) : AGAP et PIAF
Les UMR sont des unités mixtes de recherche crées grâce à des contrats d’associations entre des universités et des instituts de recherches. Mon stage s’inscrit au sein de deux UMR :
AGAP (Amélioration Génétique et Adaptation des Plantes méditerranéennes et tropicales), réunissant le Cirad, l’INRA de Montpellier et Sup Agro Montpellier. L’unité AGAP est répartie sur plusieurs sites, dont le campus Cirad de Lavalette à Montpellier (34). Cette UMR est composé de 12 équipes, avec des champs de recherches axées sur la biologie, l’architecture et la génétique dans un but d’amélioration des plantes. J’ai intégré l’équipe AFEF (Architecture et Fonctionnement des Espèces fruitières), forte d’une équipe de 14 personne qui s’intéressent à l’étude et à la modélisation de traits éco-physiologiques et déterminismes génétiques de caractères de développement dans un but d’amélioration végétale.
PIAF (Physique et Physiologie Intégratives de l’Arbre Fruitier et Forestier), réunissant l’INRA de Auvergne Rhône-Alpes et l’université Blaise Pascal de Clermont-Ferrand. Il y a deux sites, celui de l’INRA à Crouël (63) et l’autre situé sur le campus des Cezeaux (63). Mon stage s’est déroulé au sein de l’équipe MEA (Micro Environnement et Arbre) sur le site de Crouël. Cette s’équipe de 19 personnes s’applique à étudier les interactions entre l’arbre et son environnement biologique, microclimatique et minérale. Le but étant d’anticiper et de limiter la vulnérabilité des arbres : aux bioagresseurs, au gel et autres contraintes climatiques dans un contexte de changement climatique.
L’apprentissage théorique et la formation technique à l’utilisation des appareils de mesures se sont faits au sein de l’équipe MEA durant 5 semaines en Mars-Avril 2016. La partie expérimentale et l’analyse de données ont été faites au sein de l’équipe AFEF. Le tuteur MEA était M. Ngao et le tuteur AFEF, M. Pallas.
1.31 1.34 1.53 1.55 2.2 2.25 0 5 10 15 20 25 30 35 40 P ro du ct io n (m il li on s de to nn es )
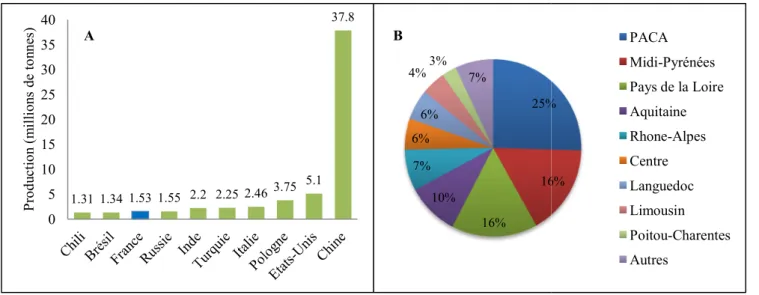
Figure 1. A- Production mondiale de pommes des 10 plus grands pays producteurs, exprimé en millions de tonnes produites en 2014. B- Répartition par région de la production française en pourcentage de la production nationale en 2014.
PACA=Provence Alpes Cote d’Azur. Source, Agreste 2014.
A 25% 16% 16% 10% 7% 6% 6% 4%3% 7% 2.25 2.46 3.75 5.1 37.8
Production mondiale de pommes des 10 plus grands pays producteurs, exprimé en millions de tonnes produites en 2014. Répartition par région de la production française en pourcentage de la production nationale en 2014.
Source, Agreste 2014. B 6 25% 16% PACA Midi-Pyrénées Pays de la Loire Aquitaine Rhone-Alpes Centre Languedoc Limousin Poitou-Charentes Autres
Production mondiale de pommes des 10 plus grands pays producteurs, exprimé en millions de tonnes produites en 2014. Répartition par région de la production française en pourcentage de la production nationale en 2014.
7
Introduction générale
I. Economie de la pomme dans le monde et en France
La pomme est la première production fruitière mondiale avec 64 millions de tonnes produites en 2014 (figure 1A, Agreste). A elle seule la Chine produit 60% de la production mondiale, la France, elle, est 8ème producteur et 6ème exportateur mondial, avec une baisse de production de 2005 à 2010 de 15% (figure 1A, Agreste). Les trois principales régions productrices sont la Provence-Alpes Côte d’Azur, le Midi Pyrénées et les Pays de la Loire (figure 1B, Agreste). En 2014-2015 la balance commerciale française représentait 408 millions d’euros (Agreste). Les vergers de pommiers (table + cidre) couvraient en 2015 une surface de 49 650 ha (75% de la surface fruitière), mais ces surfaces sont actuellement en diminution (-25% de 2005 à 2015), (Agreste). La consommation française de pommes fraiches est stable depuis 2010, avec en moyenne 8Kg/hab/an (Agreste).
II. La recherche et améliorations variétales du pommier
A ce jour la sélection du pommier a été essentiellement axée sur des traits de résistances aux bio-agresseurs, de rendements, de qualités organoleptiques et conservations optimales des fruits (Segura, 2006). Peu de recherches ont été menées pour sélectionner d’autres traits, alors que dans un contexte de changement climatique la recherche de nouveaux traits pour sélectionner de nouveaux pommiers plus performants et tolérants face aux facteurs environnementaux devient indispensable. Dans ce contexte les traits d architecture et de fonctionnement foliaire peuvent apparaitre comme des cibles de sélection pertinentes de par leur importance sur le fonctionnement intégré de la plante. En effet ces deux types de traits déterminent de nombreux processus essentiel à la production comme l’interception du rayonnement, l’assimilation nette de carbone, les flux transpiratoires et le microclimat.
La diversité phénotypique de ces traits étant importante chez le pommier (Gross, 2014) cela laisse entrevoir des possibilités d’améliorations pour la sélection.
L’équipe AFEF étudie depuis plus de 10 ans la variabilité génotypique et phénotypique du pommier pour des traits d’architecture et de fonctionnement, notamment foliaire. Actuellement l’équipe travaille sur une core-collection française de pommiers. Une core-collection est un sous échantillon de génotype représentant le maximum de diversité allélique avec un nombre d’individus restreint. Cette core-collection a été entièrement phénotypée en 2014 lors d’une campagne de mesures au sein d’une plateforme de phénotypage haut débit en conditions contrôlées sous-serre (Phénoarch). Les mesures ont mit en évidence des différences phénotypiques en termes de traits architecturaux. C’est pourquoi cette core-collection a été implantée au champ cette fois-ci pour étudier la diversité phénotypique des trais architecturaux et de fonctionnements foliaires en conditions environnementales non contrôlées. Ce rapport portera sur l’étude de ces traits architecturaux, et fonctionnels foliaires au champ.
8 Figure 2 Représentation schématique d’une bourse et pousses de bourses.
9
III. L’architecture du pommier 1- Notions d’architecture
L’architecture des plantes est définie selon trois critères, d’après Godin et al (1999) :
La géométrie des organes, décrit leur longueurs, leurs points d’insertions et terminaux, les arcures. Pour la feuille il s’agit de l’angle d’insertion du pétiole, la phyllotaxie (ordre et disposition des feuilles le long de la branche), la surface foliaire, sa longueur et sa largeur. La typologie des organes, comme les fruits, fleurs, feuilles et branches (elles-mêmes
séparées en plusieurs sous-groupes).
La topologie des organes représente l’enchainement des organes entre eux et leurs relations hiérarchiques (un fruit est dépendant de la branche sur laquelle il s’insère, cette branche est dépendante d’une branche plus ancienne…).
L’architecture s’intéresse, en premier lieu, aux phytomères (unité fonctionnelle de base de plantes composée d’un entrenœud et d’une feuille). L’enchainement de phytomères sans interruption de croissance est appelé unité de croissance. Un ensemble d’unités de croissance est un axe, et la totalité des axes forme l’arbre. (Godin et al, 1999).
Le pommier possède comme organes végétatifs, des unités de croissances courtes (longueur<5cm), moyennes (>5cm et <20cm) et longues (>20cm), (Godin et al, 1999, Massonnet et al, 2008). Cette différenciation est faite car des différences de phytomères ont été remarqués (longueur entre-nœud, taille de feuille…). (Massonnet, 2004). Le pommier possède pour organes reproductifs des bourses (figure 2), ce sont des unités de croissance ayant un renflement dû au stockage de réserve pour la fructification, et de tailles restreintes (<5cm). Les unités de croissance poussant à la suite d’une bourse sont appelées pousse de bourse (figure 2), elles-mêmes sont divisées en courte, moyenne et longue. La différence est faite entre pousse végétative et pousse de bourse car il y a des différences de phytomères (Massonnet, 2004).
Selon la description de Hallé et Oldeman (1970), le pommier a une croissance monopodiale pour ses unités de croissances végétatives (le point de départ des unités de croissance se situe aux bourgeons terminaux des axes), ou sympodiale (le départ de l’unité de croissance se situe aux bourgeons axillaires) pour les pousses de bourses. La croissance est acrotone c’est-à-dire la croissance est plus forte pour les rameaux du haut de la canopée et la croissance et la fructification se réalisent principalement vers l’extérieure du houppier.
10 Figure 3 A- Forme haute tige. B- Formes palissées. Source : BTSA AP Montreuil-sous-Bois
C- Forme solaxe centrifuge. Source : Agrireseau.net
11
2- Architecture, agronomie et amélioration végétale
Chez le pommier, traditionnellement deux types d’architectures dominaient en France : la haute-tige et le gobelet (figure 3A et 3B), (Laurens et al, 2000). La révolution verte de la deuxième moitié du XXème siècle a eu pour conséquence d’intensifier les pratiques agricoles. Ces formes sont devenues non-rentables (mise à fruits lente, densité d’arbres faible à l’hectare) et les arboriculteurs ont dû adapter la formation architecturale des arbres. La forme solaxe (figure 3C) est la conduite dominante de nos jours en France (adoptée sur 90-95% des superficies française, (Laurens et al, 2000)) car cette forme est plus conforme à l’architecture naturelle de l’arbre ce qui réduit les interventions humaines pour la taille. De plus avec cette architecture le délai entre la plantation et l’entrée en production est réduite et la pénétration de la lumière dans la canopée est favorisée ce qui améliore la maturation et la coloration des fruits. (Laurens et al, 2000).
D’un point de vue de l’amélioration végétale, l’architecture à un impact sur l’interception lumineuse, faisant partie de la composante de la création de biomasse (Monteith et Moss, 1977). Mais d’autres facteurs sont influencés et sont important à prendre en compte: qualité et quantité des fruits, facilité de travail pour l’agriculteur, limitation de la pression des bio-agresseurs (Costes et al, 2006).
3- Modélisation de l’architecture
La modélisation de l’architecture permet en premier lieu de simplifier l’architecture des arbres mais aussi de l’étudier plus en profondeur. C’est notamment le cas lorsqu’il est souhaité étudier des fonctionnements physiologique ou éco-physiologique au sein de la canopée d’un arbre. Ainsi il peut être étudié le fonctionnement foliaire au sein de la canopée intégrée et non pas seulement sur des feuilles distribuées au sein du houppier. Mais cette modélisation permet aussi de déterminer des grandeurs d’arbres, des croissances pluriannuelles, des surfaces foliaires et des performances d’interceptions lumineuses entres autres. La surface foliaire et l’interception lumineuse sont calculées par le logiciel Vegestar4 (Adam et al, 2007).
Figure 4 Représentation schématique d’une coupe de feuille. Source
Figure 5 – A- Représentation schématique
Calvin. Source : MS pharmacie C- Absorbance de la chlorophylle a et b à différente longueurs d’ondes solaire. Source Wikipedia
A
C
Représentation schématique d’une coupe de feuille. Source : Ms.Pharmacie
Représentation schématique simplifié de la photosynthèse. B- Représentation schématique du cycle de Absorbance de la chlorophylle a et b à différente longueurs d’ondes solaire. Source
B
12
: Ms.Pharmacie
Représentation schématique du cycle de Absorbance de la chlorophylle a et b à différente longueurs d’ondes solaire. Source :
13
IV. Photosynthèse et stomates 1- Notions
Généralement la photosynthèse s’effectue dans les feuilles, dans des organites spécialisés appelés chloroplaste, eux-mêmes situés dans le mésophile palissadique et lacuneux ainsi que parfois dans les stomates (orifice de petite taille située sur l’épiderme des feuilles servant à l’échange plante-atmosphère) (figure 4).Au sein du parenchyme lacuneux il y a des espaces intercellulaires servant à l’échange de gaz, solutés et eau, de plus il y a un réseau important de nervures secondaires (figure 4). Cet espace peut être plus ou moins résistant au passage des gaz et solutés, c’est la résistance mésophyllienne. La cuticule est la couche externe de la feuille composée de molécules hydrophobes, comme la cire ou la cutine (figure 4). Elle protège la feuille et limite les perditions en eau. (Raven et al 2007). Les nervures sont composées du xylème (vaisseau conducteur de sève brute) qui alimente la feuille en eau et sels minéraux et du phloème (vaisseau conducteur de sève élaborée) qui exporte les composés de la photosynthèse, c’est le système d’irrigation foliaire (figure 4). Enfin ce qui n’apparait pas sur le schéma sont les mitochondries, responsable de la respiration foliaire, servant au rechargement de l’ATP (Lawlor, 1995). Cette respiration est aussi appelé « respiration à l’obscurité » et est symbolisé Rd.
La photosynthèse est le processus qui en utilisant l’eau, le CO2 et l’énergie lumineuse,
synthétise des sucres (figure 5A). Globalement il est différencié deux phases :
Une photochimique, qui réceptionne l’énergie lumineuse, qui excitera des molécules d’eau, libérant des électrons et du dioxygène. Ces électrons servent au rechargement de la NADPH et de l’ADP, elles-même servant au rechargement de la Rubisco (figure 5A). La vitesse maximale de transport d’électrons qui rechargent la NADP- et l’ADP est appelé Jmax. Seules les longueurs d’ondes du rayonnement solaire bleus (de 400 à 500 nm) et rouge (de 600 à 700 nm) sont réceptionnées (figure 5C). Ces longueurs d’ondes sont les Radiations Photosynthétiquement Active (PAR).
Une biochimique, qui est le cycle de Calvin (figure 5B). Ce cycle commence par la fixation du CO2 atmosphérique par la Rubisco sur la RuBp, avec au final, formation de
3-phosphoglycérate. Cette fixation du CO2 et création de 3-phosphoglycérate est réalisé
grâce à la fonction carboxylase de la Rubisco, la réaction chimique est la carboxylation. La vitesse maximale de carboxylation de la Rubisco est appelé Vcmax. La seconde étape est constituée de réductions successives qui requièrent des NADPH et ATP, à la fin de cette étape sont formés des trioses-phosphates. Pour 3 molécules de CO2 fixées, 6
trioses-phosphates sont formés, 1 sera exporté pour former des oses plus complexe, et les 5 autres serviront au rechargement de 3 Rubp (Rubisco non rechargée). Le taux d’utilisation de ces trioses phosphates pour le rechargement de la RuBp est appelé TPU.
14 C on du ct an ce s to m at iq ue Température C on du ct an ce s to m at iq ue PAR C on du ct an ce s to m at iq ue VPD
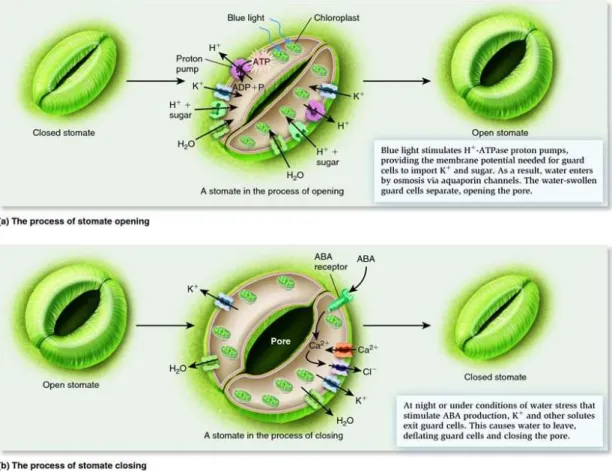
Figure 6 Schéma du mécanisme d’ouverture (A) et de fermeture (B) des somates (Van Cottem, 2006). Illustration du site internet :stomatawordpress.com
Figure 7 Courbes de réponses théoriques de la conductance stomatique à certains facteurs environnementaux : A- température, B- PAR (radiation active photosynthétiquement) C- VPD (déficit de pression de vapeur saturante). Les valeurs de conductance stomatique et des facteurs environnementaux sont purement fictives.
15
Le mécanisme d’ouverture des stomates est le suivant: le PAR excite les antennes des chloroplastes, s’en suit l’activation de l’ATPase pour importer des ions (principalement K+) et sucres (principalement du malate). Cela crée une différence de potentiel osmotique provoquant l’entrée d’eau dans les vacuoles des cellules de gardes. Ce « gonflement » des cellules de gardes permet l’ouverture des stomates. (fihgure 6) (Lawlor, 1995).
Le mécanisme de fermetures des stomates est le suivant : Des signaux sont envoyés par l’arrivée en concentration importante de l’acide abscissique (ABA) et d’ions calcium, les autres ions et sucres sortent des cellules par différence de potentiel osmotique, l’eau sort après. Ceci entraine une pression autour des cellules de gardes, provoquant la fermeture des stomates. (figure 6)
Pour s’ouvrir les stomates ont donc besoin de lumière et d’eau, en priorité, la plante doit donc être en condition lumineuse et hydrique satisfaisante. Un autre signale fort d’ouverture est la diminution de la pression partielle du CO2 interne à la feuille (Ci), afin d’alimenter la
photosynthèse, les stomates s’ouvrent donc. Les stomates se ferment lorsque l’acide abscissique arrive à ses récepteurs, lorsque les conditions environnementales ne sont pas satisfaisante ou par rétro-action. L’ABA est produite principalement par les racines ressentant un stress hydrique.
Les stomates répondent également aux conditions environnementales, ainsi pour la température, les températures basses ou hautes vont fermer les stomates. Couramment, la réponse des stomates est une hyperbole en forme de cloche évasée avec un optimum thermique (figure 7A). Les stomates ont une réponse rapide à la quantité de lumière avant d’atteindre un plateau tendant vers l’infini (figure 7B). La réponse des stomates au VPD (déficit de pression de vapeur saturante, fonction de la température et de l’humidité relative de l’air), forme d’abord un plateau, puis suit une décroissance linéaire pour des VPD plus élevé (figure 7C). De plus les stomates se ferment lorsque le Ci est important car le substrat est suffisant pour la photosynthèse, avec l’avantage de sauvegarder l’eau. Enfin des fermetures stomatiques peuvent s’effectuer lors de rétro-actions par les sucres issus de la photosynthèse (beaucoup de composés en attente d’export-> arrêt momentané des échanges gazeux), mais aussi lorsque la feuille est en déficit hydrique (sauvegarde de l’eau).
V. Modélisation du fonctionnement foliaire 1- Photosynthèse
Farquhar et al (1980) ont produits un modèle mécanistique de la photosynthèse prenant en compte Vcmax, Jmax, TPU et Rd et il a été largement réutilisé pour modéliser la photosynthèse (Wullscheleger, 1993). Ceci en raison de sa robustesse, de sa facilité d’implémentation et de ses multiples possibilités de simulations (Yin et Struik, 2009).
Vcmax dépend principalement de la quantité de Rubisco et de l’activité de sa fonction carboxylase (donc de la concentration en CO2 interne (Ci)). Jmax dépend principalement de la
16
quantité de PAR reçu par la feuille. Jmax et Vcmax sont en général en étroite relation (il ne peut pas y avoir un grand Vcmax sans un grand Jmax qui recharge la RuBp), (Wullscheleger, 1993). Enfin Rd dépend de la demande de la plante en molécule d’intérêt, il dépend donc de la taille de la machinerie photosynthétique et de la situation de stress de la plante notamment (Harley et al, 1992).
En résumé sa force est d’être basée sur des équations mécanistiques commune à toute les plantes de fonctionnement photosynthétique en C3. Ce modèle a été adapté de la feuille à la canopée d’une forêt (Yin et Struik, 2009).
2- Conductance stomatique
La modélisation de la conductance stomatique est un peu plus problématique car comme il a été vu elle dépend de beaucoup de facteurs interne et externes, et qui ne sont pas toujours bien cernés (Damour et al, 2010). Plusieurs types de modèles sont utilisés :
Des modèles empiriques, comme celui utilisé dans ce rapport, proposé par Jarvis (1976). Il modélise la conductance somatique en fonction de variables environnementales : le PAR, la température, le VPD (dépression de vapeur saturante, fonction de la température et de l’humidité relative de l’air), le CO2 atmosphérique l’état hydrique de la feuille. Ce modèle a fait ses preuves (Damour et al, 2010) et peut être utilisé dans une gamme diverse de situations mais nécessite des mesures de réponses de la conductance stomatique aux facteurs environnementaux pour être calibré.
Il existe aussi des modèles tentant de se diriger vers une méthode plus mécanistique, plus simple d’utilisation et plus robuste. Tardieu et al (1996) propose d’utiliser la concentration en ABA pour estimer la conductance stomatique. D’autres modèles optent pour une approche hydraulique, en calculant les transports d’eau vers la feuille (Sperry et al 1998). Enfin les derniers sont hydromécanique, ils prennent en compte l’ABA et le transport d’eau (Dewar, 2002).
Néanmoins il n’est pas encore très bien compris quelle est la relation entre Gs, contenu en eau foliaire et l’ABA. C’est pourquoi dans ce rapport sera utilisé le modèle de Jarvis (1976) ayant déjà fait ses preuves.
N’a été présenté ici que les modèles au niveau foliaire, d’autre existe pour des échelles plus macroscopiques mais ne seront pas étudié ici, car la modélisation réalisée au sein de ce rapport est au niveau foliaire.
La modélisation du fonctionnement foliaire, notamment avec le modèle Farquhar-Jarvis permet de simuler le fonctionnement photosynthétique et stomatique dans des conditions environnementales contrastées (de lumière, CO2, température et VPD) et ainsi obtenir rapidement
17
Hypothèse de l’étude
I. Etat des lieux
Un jeu de données expérimental de mesures de photosynthèse avait déjà été obtenus en 2015 afin d’implémenter le modèle de Farquhar et al (1980), il permet d’estimer Vcmax, Jmax, TPU et Rd. Il avait été aussi mesuré la photosynthèse et la conductance stomatique en condition environnementale optimale. De plus un suivi architectural de la typologie et topologie a été réalisé durant l’automne 2015. Il avait été mesuré 6 génotypes de pommiers.
II. Objectifs de l’étude
Dans un premier temps il était demandé d’analyser la variabilité génotypique du jeu de données sur la photosynthèse et de la conductance stomatique en condition optimale, ainsi que les estimations du modèle de Farquhar.
En second lieu, il s’agissait de compléter le jeu de données expérimental, c’est-à-dire renseigner la géométrie des unités de croissance, afin d’avoir une architecture complète des arbres (pour obtenir des maquettes d’arbres modélisés) ; ainsi que d’obtenir des mesures de conductances stomatique en environnement contrasté de température et VPD. Il devait être analysé la diversité génotypique de l’architecture et de la conductance stomatique en situations contrastées.
Enfin ces jeux de données obtenus sur les deux années devaient servir à renseigner des paramètres permettant la modélisation : du fonctionnement photosynthétique grâce au modèle de Farquhar, du fonctionnement stomatique grâce au modèle de Jarvis et de l’architecture des pommiers grâce au modèle Vegestar4.
III. Problématiques de l’étude L’approche proposée répondra à deux questions :
1. Quelle est la variabilité des traits architecturaux et de fonctionnement foliaire au sein du sous-échantillon de génotypes de la core-collection étudiée ?
2. Les simulations du modèle de Farquhar-Jarvis rendent-elles compte de la photosynthèse et de la conductance observée au sein du sous échantillon de génotype de la
18 80 85 90 95 100 105 24/6 29/6 4/7 9/7 14/7 19/7 24/7 29/7 % R F U Date (jour/mois) 0 50 100 150 200 250 300 0 5 10 15 20 25 30 35 m ar avr m ai ju in juil ao u se p oc t no v de c ja nv fev mar avr mai juin juil aou sep oct nov dec ja nv fev mar avr mai juin juil P lu vi om ét ri e (m m ) T em pé ra tu re ( ºc ) Mois
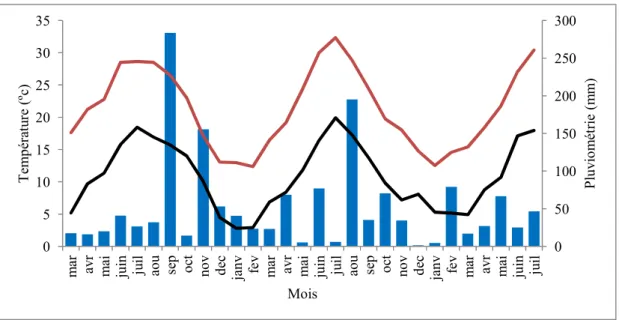
Figure 8- Evolution des températures journalière minimales (ligne noire) et maximale (ligne rouge) (ºC) et de la pluviométrie (colonnes bleus (mm)) de Mars 2014 à Juillet 2016. Les températures sont des moyennes mensuelles et les pluviométries sont des sommes mensuelles. Données issues de la station météorologique INRA de Mauguio.
Figure 9- Evolution du contenu relatif de l’eau du sol du 24 juin au 29 juillet 2016, exprimé en pourcentage de la RFU. Les valeurs sont des moyennes de 4 arbres des 12 arbres qui seront étudiés dans ce rapport.RFU= réserve en eau du sol facilement utilisable par les plantes. Elles sont issues des tensiomètres qu’utilise l’équipe AFEF sur la parcelle. Données obtenues grâce à Deladande (com pers).
19
Matériels et méthodes
I. Matériel végétal et conditions de culture
Le verger se situe sur la commune de Mauguio (34), aux coordonnées GPS suivantes : 43º36’N 3º58’E. La parcelle fait partie de l’Unité expérimentale (UE) Diascope de l’INRA de Montpellier, elle mesure 187 mètres de long sur 50 mètres de large, soit 0.935 hectare.
Le climat est de type méditerranéen, et possède une amplitude thermique plus faible qu’à l’intérieur des terres en raison de la proximité de la mer (6km). La météo observée depuis 2014 est caractérisée par un hiver doux (9.3°C de moyenne journalière) et sec (45 mm/ mois d’hiver). L’été est chaud (23.6°C de moyenne journalière) et avec des précipitations éparses (figure 8). Il y a peu de risque de dégâts dû au gel mais le mois de Juillet peut être chaud (entre 30 et 35 degrés), pouvant entrainer des stress thermiques (Ashraf et Harris, 2013 ; Yamori et al, 2014). La faible humidité et les fortes températures rencontrées durant la période feuillée (avril-octobre) entraine un déficit de pression de vapeur saturante pouvant être élevé (VPD) de 1.9 kPa en moyenne, allant parfois jusqu’à 3.3 kPa (juillet 2015). Ces valeurs peuvent limiter la photosynthèse du pommier (Massonnet et al, 2007). Enfin la parcelle est ventée, toute l’année durant, avec des vents moyens de 10 km/h et des rafales journalières à 30-40 km/h. (données station météorologique de l’INRA de Mauguio).
Le sol a été analysé par l’UMR Lisah (Laboratoire d’étude des Intéractions entre Sols Agrosystème-Hydrosystème) sur un profil de 80 cm, ce qui correspond, pour des arbres de 2 ans, à leur exploration racinaire (Garcia, 2004). Le sol est de type limono-argileux et caillouteux (23% d’éléments supérieurs à 2mm), avec 1.2% de matière organique, un C/N de 11 et une réserve utile est de 65mm. Le sol possède une bonne structure pour le pommier et pour le porte-greffe (Gautier, 2001) avec un bon turnover de la matière organique mais avec une faible rétention d’eau (Arvalis, 2014).
Aucune taille n’a été effectuée, les interlignes ont été enherbés et les rangs ont été désherbés chimiquement. La conduite phytosanitaire est chimique, en suivant les alertes de Sudarbo, pour éviter tout dommage des bio-agresseurs. L’irrigation était optimale afin de prévenir toute carence ou stress. Des sondes capacitives (Sentek ®) étaient installés au sein de la parcelle sur quelques arbres étudiés, les arbres durant l’étude en 2016 ne subissaient pas de stress hydrique car il y avait de bonne conditions hydrique (contenu en eau du sol de 96% de la RFU (réserve en eau du sol facilement utilisable par les plantes) en moyenne sur la période, figure 9). Les doses et fréquences d’irrigation étaient les suivantes : 2*40 L/semaine/arbre du 1er jusqu’au 30 juillet puis 3*40 L/arbre/semaine jusqu’en septembre. .Cet itinéraire a été conseillé par l’entreprise ISAGRI. L’alignement des rangs de plantation est Nord-Sud avec un angle de 10ºOuest. Cet alignement a été privilégié pour limiter l’impact du vent qui souffle souvent dans l’axe Nord/Sud. Les arbres ont étés plantés avec l’espacement suivant : 1.8 m intra-lignes et 5 m interlignes, soit une densité de 1113 arbres/hectare. Cette densité est faible au vu des recommandations de l’obtenteur (Cepiland) qui conseille des densités de plantation de 1600 à 4000 arbres/ha. Elle a
20 Nom commun du génotype Code du génotype Vigueur Longueur totale des rameaux (cm) Surface foliaire totale (m2) Masse sèche (g) Rouge d’oriule 342 Non vigoureux 93 0.22 80 France deliquet 8717 Non vigoureux 96 0.18 78
jacques
St-chamond 9234 Non vigoureux 103 0.19 98 Cassou 337 Vigoureux 143 0.31 154 Président
roulin 6917 Vigoureux 145 0.29 131 Beau soleil 8232 Vigoureux 160 0.26 154
Tableau 1- Données de vigueurs physiques (longueur totale des rameaux (cm), surface foliaire totale (m2) et masse
sèche (g)) des 6 génotypes étudiés au sein de ce rapport, classés entre vigoureux et non vigoureux. Données issues de l’expérience Phénoarch, 2014.
21
été choisie afin de ne pas contraindre la croissance des arbres, dans le but de mieux étudier leurs architectures. Sur cette parcelle, il a été planté en Mars 2014 242 génotypes, avec 4 répétitions (1 répétition= 1 arbre). Ces génotypes sont issus de la core-collection française, de l’INRA d’Angers, qui ont été phénotypés durant le projet de plateforme de phénotypage haut débit (Phénoarch) en 2014.Cette expérience a permis de déterminer des classes de vigueurs entre génotypes (tableau 1). L’étude au sein de ce rapport s’applique sur 6 de ces 242 génotypes avec 2 répétitions par génotype. Ils sont différenciés entre vigoureux et non vigoureux (tableau 1), et considérés comme représentatifs de la variabilité observée au sein de la core-collection.
II. Modélisation architecturale
1- Les modèles de représentation de l’architecture
Le logiciel Vegestar4 (Adam et al, 2007), développé au sein de l’UMR PIAF, modélise l’architecture des unités de croissance avec une reconstruction des feuilles. Ce logiciel permet de calculer une surface foliaire totale et un paramètre d’efficience d’interception lumineuse (STAR). Il s’agit du Silhouette to Total leaf Area Ratio ((STAR) Oker-Blom et Smolander, 1988)), cette variable représente la surface éclairée en fonction de la surface foliaire totale projetée dans 46 directions (Massonnet, 2004) dans l’espace en prenant en compte le rayonnement direct et diffus (Den Dulk, 1989). La rediffusion du rayonnement est négligé car il impacte peu le bilan radiatif (Massonnet, 2004). La formule du STAR est :
= ∝ × ( é é )
α est le coefficient de pondération pour les différentes directions des rayonnements. SF éclairée est la surface foliaire éclairée à une certaine élévation solaire. SFT est la surface foliaire totale projetée. Le STAR est donc une somme du rapport surface foliaire éclairée sur la surface foliaire totale projetée à différentes position du soleil.
Afin de reconstruire les maquettes d’arbres le logiciel Vegemaker (Adam et al, 2014) a été utilisé. Cet outil permet de reconstruire en 3 dimensions le feuillage d’un arbre à partir des données spatiales des unités de croissance et des relations allométriques.
Des analyses de la variance ont permis d’analyser les différences entre individus (α=0.05). Pour chaque génotype il y avait 2 répétitions (2 arbres). Le STAR et la surface foliaire totale de l’arbre ont été analysées.
22 Figure 10- Représentation schématique de la digitalisation manuelle. L’équerre sert de 0 représentant les 3
dimensions de mesure. L’émetteur émet un champ magnétique autour de lui. Le pointeur permet à l’expérimentateur de mesurer les coordonnées x,y,z des unités de croissances. L’unité de contrôle reçoit ce message qui est transmis au logiciel qui à un logiciel de traitement et de représentation des données. Massonnet (2004)
23
2- Acquisition de l’architecture des unités de croissances
Afin de représenter les unités de croissance de l’année 2015 qui serviront à la reconstruction des maquettes, une digitalisation manuelle a été effectuée. Cette technique utilise un digitaliseur électromagnétique (Long Ranger Polhemus Inc., Colchester, VT, USA) (figure 10). Il s’agit d’un pointeur contenant une bobine qui déforme le champ magnétique crée par la sphère d’émission électromagnétique (figure 10). L’unité de contrôle reçoit et compile ce message et enregistre les coordonnées géométriques (Raab et al ,1979, Sinoquet et al, 1997). Le zéro est assuré par une équerre placée au Nord et parallèle au sol. . Le protocole suivi est celui édité par Polhemus (2003). Enfin les données ont été enregistrées grâce au logiciel développé au sein de l’Unité Mixte de Recherche en Physiologie Intégrative de l’Arbre Fruitier et Forestier (UMR PIAF) de Clermont-Ferrand.(Donès et al, 2006).
Un relevé des coordonnées x,y,z des bases/sommets des unités de croissances 2014-2015 a été réalisé en Mars 2016. Dans le cas où il y avait des branches courbées plusieurs points intermédiaires entre la base et le sommet de l’unité de croissance ont étés relevé. Dans le cas où il y avait une reprise d’élongation au court de l’année 2015, un couple base sommet a été relevé pour cette élongation.
La typologie a été relevée, en divisant entre unités de croissance végétative, pousses de bourses et bourse, le tout en suivant la topologie de l’arbre.
Ces relevés ont permis, entre autres, d’obtenir des données de longueurs et nombres totales d’unités de croissance par arbre. Des analyses de la variance, après avoir log-transformés les valeurs, ont permis d’analyser les différences entre génotype (α=0.05). En cas de différences significatives un test post-hoc de Tukey a été réalisé. Il y avait 4 répétitions par génotype (4 arbres).
24 Génotype Pente relation l = a × L Pente relation SF = a × L Unité de croissance courte <5cm (equ2) Unité de croissance longue >5cm (equ 2) Unité de croissance courte <5cm (equ 3) Unité de croissance longue >5cm (equ 3) 337 0.59 0.59 0.32 0.34 6917 0.58 0.56 0.44 0.39 8232 0.51 0.57 0.41 0.33 8717 0.49 0.61 0.49 0.42 342 0.65 0.72 0.31 0.38 9234 0.61 0.62 0.37 0.31 P-value génotype <0.0001 <0.0001 <0.0001 <0.0001 Moyenne BIC 672 2573 1846 7264 Moyenne r2 0.96 0.97 0.94 0.94
Tableau 2- Relations allométriques par génotype à l’échelle foliaire. Les unités de croissance inférieures et supérieures à 5cm ont des coefficients d’allométries distinctes. Les deux équations sont linéaires avec une ordonnée à l’origine forcée à 0. l= largeur maximale de la feuille ; L=longueur de la nervure principale ; SF= surface foliaire unitaire ; a= coefficient déterminé. Deux modèles pour chaque équation ont été testés :
1- Le coefficient a est commun à tous les génotypes 2- Le coefficient a est personnel pour chaque génotype Les modèles ayant le plus faible BIC est retenu.
25
3- Acquisition de l’architecture foliaire
Pour établir l’architecture foliaire il faut mettre en place une allométrie foliaire, car la digitalisation permet de renseigner l’architecture raméale mais il manque les feuilles. Il s’agit de relations linéaires, au nombre de 4 (tableau 2 et 3). Il y a deux relations à l’échelle de la feuille : largeur feuille= f(longueur feuille) et surface foliaire unitaire= f(longueur feuille). Ces relations ont une ordonnée à l’origine forcée à 0 pour ne pas modéliser des surfaces foliaires et largeurs négatives, donc seules les pentes sont déterminées. Les deux autres relations sont elles, à l’échelle de l’unité de croissance. Il est définit : nombre de feuilles unité de croissance= f(longueur unité de croissance) et la surface foliaire de l’unité de croissance= f(longueur de l’unité de croissance). Afin de construire ces allométries foliaires il a été échantillonné 5 unités de croissance supérieures à 5cm et 3 unités de croissance inférieures à 5 cm sur chaque arbre, soit 10 et 6 unités de croissance par génotype. Ont été différenciés les unités de croissances longues et courtes car il a été prouvé que leurs allométries foliaires différaient (Massonnet, 2004). Pour chaque unité de croissance sa longueur a été relevée ainsi que le nombre de feuilles. Ensuite, chaque feuille de l’unité de croissance a été photographiée et analysée par le logiciel d’analyse d’architecture foliaire Piaf-Plani (Adam et al, 2013). Le logiciel calcule la longueur suivant nervures principales, largeurs maximales et surface foliaire de chaque feuille.
Des modèles linéaires ont été réalisés (tableau 2 et 3) afin de choisir le meilleur ajustement. Le critères d’information bayésien (BIC) a été utilisé comme indicateur de la qualité de l’ajustement, son calcul est le suivant : BIC = 2lnL + ln(N) k . L est la vraisemblance du modèle maximisé, N, la taille de l’échantillon et k le nombre de paramètres. Il sert ici au choix du modèle, plus le modèle est de meilleur qualité plus le BIC est faible. Le coefficient de détermination R2 a aussi été choisis et détermine dans quelle mesure la droite de régression décrit la distribution des points, ses valeurs sont comprises entre 0 et 1 et plus la valeur est haute, meilleure est le modèle, sa formule est la suivante : R2 = SCE estimé par la régression SCE totale SCE sont la somme des carrés des écarts Des analyses de variance des modèles linéaires choisis ont permis de déterminer les différences entre génotype (α=0.05). En cas d’absence de différences significative sur un des coefficients, il était considéré égal pour tous les génotypes (tableau 3).
Différents coefficients ont été extraits afin d’en analyser plus en détail les différences entre génotypes Ils ont été choisis car ils présentaient des différences significatives entre génotype, seulement les unités de croissance longues ont été analysé car elles représentent en moyenne 88% de la longueur totale des ramures, les unités de croissance courte ont donc été considérées comme négligeable, les coefficients sont les suivants :
Le coefficient b de l’équation 4 : NBF = a × L + b pour les unités de croissance longues. Le NBF est le nombre de feuilles, L la longueur de l’unité de croissance, a et b sont les coefficients de régression linéaire de la relation. Ce coefficient représente le nombre de
26 Génotype Coefficient régression NBF = a × L + b Coefficient régression SFU = a × L + b Unité de croissance courte <5cm (equ4) Unité de croissance longue >5cm (equ 4) Unité de croissance courte <5cm (equ 5) Unité de croissance longue >5cm (equ 5) a b a b a b a b 337 0.81 5.9 0.28 10.96 19 85.4 14.7 5.6 6917 0.81 5.9 0.28 8.7 19 42.2 9.8 5.6 8232 0.81 5.9 0.28 8.3 19 70.3 12.5 5.6 8717 0.81 5.9 0.28 7.1 19 10.3 6.6 5.6 342 0.81 5.9 0.28 11.6 19 95.8 12.6 5.6 9234 0.81 5.9 0.28 7.5 19 60.5 10.7 5.6 P-value >0.05 >0.05 >0.05 0.001 >0.05 <0.0001 <0.0001 >0.05 Moyenne BIC 200 361 447 833 Moyenne r2 0.14 0.7 0.57 0.84
Tableau 3-Relations allométriques par génotype à l’échelle de l’unité de croissance. Les unités de croissances inférieures et supérieures à 5cm ont des coefficients d’allométries distinctes. Les deux équations sont linéaires; L=longueur de l’unité de croissance ; SFU= surface foliaire totale unité de croissance ; a= coefficient pente ; b=ordonnée à l’origine. Trois types de modèles linéaires par équation ont été testés :
1-Les coefficients a et b sont personnels pour chaque génotype
2- Le coefficient a est personnel à chaque génotype et le b est commun pour tous les génotypes 3- Les coefficients a et b sont communs à tous les génotypes.
27
feuilles que possèdent les unités de croissances longues avant 5cm d’élongation, ce qui correspond aux feuilles préformées. Ce paramètre est le NbFp.
Le coefficient a de l’équation 5 SFU = a × L + b pour les unités de croissance longues. SFU est la surface foliaire de totale de l’unité de croissance, L est la longueur de l’unité de croissance, a et b sont les coefficients de régression linéaire de la relation. Ce coefficient représente l’augmentation de la surface foliaire en fonction de l’augmentation de la longueur des unités de croissance. Ce coefficient est le « pente surface foliaire/longueur rameau » en cm2/cm.
Le coefficient a de l’équation 2 l = a × L pour les unités de croissance longues. l est la largeur de la feuille et L la longueur de la feuille dans l’axe de la nervure principale. Ce coefficient représente le rapport largeur maximale sur la longueur de la nervure centrale. Ce coefficient est le « rapport largeur/longueur feuille ».
28
Nº Equation Unité
6 Anet = min(Ac, Aj, Ap) − Rd µmol/m2/s
7 Ac = Vcmax × Ci Ci + Kc (1 +Ko)O µmol/m 2/s 8 Aj = J × Ci 4 (Ci +OΓ) µmol/m 2/s 9 Ap =3 × TPU 1 −CiΓ µmol/m 2/s 10 J = α × PAR
(1 + ∝ × PAR Jmax⁄ Valeur absolue
Paramètres Définition Valeur (unite)
O Pression partielle de l’oxygène interne à la feuille 21 (Pa) Γ Facteur spécifique de la rubisco 3.74 (Valeur absolue) Kc Constante de Michaelis-Menten pour la carboxylation 27.24 (Valeur absolue) Ko Constante de Michaelis-Menten pour l’oxygénation 16.58 (Valeur absolue)
Variables Définition Unité
Anet Photosynthèse nette µmol/m2/s
Ac Photosynthèse nette Rubisco limitante µmol/m2/s
Aj Photosynhtèse nette limitée par le transfert d’électrons µmol/m2/s
Ap Photosynhtèse nette limitée par le taux d’utilisation des tri-phosphates µmol/m2/s
Vcmax Vitesse maximale de carboxylation µmol/m2/s
Jmax Vitesse maximale de transferts d’électrons µmol/m2/s
J Taux potentiel de transport d’électrons µmol/m2/s
α Efficience de conversion de la lumière mol électron/ mol photon
Rd Respiration à la lumière µmol/m2/s
PAR Radiation photosynthétiquement active µmol/m2/s
Ci Pression partielle du CO2 interne à la feuille Variable (Pa)
Tableau 5-Paramètres fixes et variables du modèle de Farquhar et al 1980, avec définitions et unités respectives.
Variables estimées du modèle avec définitions et unités respectives.
29 -10 0 10 20 30 40 50 0 10 20 30 40 50 60 70 80 90 100 A ne t ( µ m ol /m 2/ s) Ci (Pa) Vcmax Jmax Rd
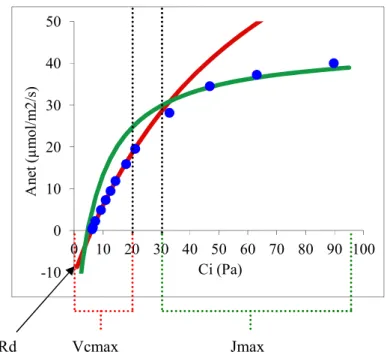
Figure 11-Illustration graphique de l’ajustement et estimation des paramètres de Farquhar (Vcmax, Jmax, Rd, µmol/m2/s). Ajustement fait sur des courbes de réponses de la photosynthèse nette (Anet, µmol/m2/s) au CO
2 interne
30
III. Modélisation du fonctionnement photosynthétique 1- Le modèle de Farquhar et al 1980
Une liste des équations et abréviations est disponible (tableau 4 et 5) .
Le modèle utilisé est celui proposé par Farquhar et al (1980), modèle mécanistique de la photosynthèse nette (Anet) en fonction de la pression partielle en CO2 interne de la feuille (Ci).
Cette photosynthèse peut être limité par :
1. La quantité, l’activité et la cinétique de la Rubisco lorsque le Ci est considéré comme limitant, typiquement à des valeurs inférieures à 20 Pa (Sharkey, 2007 ;(tableau 4,Ac, équation 7)).
2. Le taux de transferts d’électrons qui rechargent la Rubisco lorsque le Ci n’est plus limitant mais que la lumière devient facteur limitant, typiquement à des valeurs supérieures à 30 Pa (Sharkey, 2007 ; (tableau 4, Aj, équation 8).
3. Le taux d’utilisation des tri-phosphates, lorsque le Ci et la lumière ne sont plus limitant, mais que l’exportation des sucres est limitante, typiquement cela arrive à des valeurs de Ci à 80 Pa et se remarque par une baisse de la photosynthèse nette (Wullschleger, 1993 ;(tableau 4, Ap, équation 9).
Les paramètres d’entrés du modèles sont : O, Γ, Ci, Kc, Ko, elles sont considérées comme des constantes (tableau 5). Les courbes de réponses de la photosynthèse nette au Ci (pression partielle de CO2 interne à la feuille en Pa) permettent d’estimer les variables suivantes : Vcmax, Rd, Ac, Aj et Ap. Les courbes de réponses de la photosynthèse nette au PAR (radiation photosynthétiquement active en µmol/m2/s ) permet d’estimer le α pour calculer le J (équation 10) qui servira pour estimer Aj.
Les valeurs de Γ, Kc ET Ko sont celles utilisée par Schultz (2003), pour la vigne. Le taux d’utilisation des tri-phosphates n’a pas été pris en compte du manque de mesures de photosynthèse nette tri-phosphates-limitante, il n’était donc pas possible de les estimer.
Après estimation des paramètres (Vcmax, Jmax et Rd) des analyses de la variance (α=0.05) ont été réalisées pour différencier les génotypes. Il y avait 3 répétitions (3 feuilles) par génotype.
2- Les courbes de réponses de la photosynthèse nette au Ci et au PAR
L’appareil utilisé pour ces courbes de réponse était un LICOR 6400, une machine d’analyse d’échanges gazeux foliaires par infrarouge. Cet appareil est composé d’une chambre hermétique où l’on enferme la feuille mesurée. À l’intérieur, il peut être imposé des consignes environnementales : température foliaire, humidité, VPD, PAR et CO2. Pour implémenter le modèle de Farquhar, des courbes de réponses de la photosynthèse nette au Ci et au PAR ont étés réalisées en Juin-Août 2015 afin d’estimer Vcmax, Jmax, α et Rd. Les mesures ont été effectuées sur 3 feuilles matures par génotype réparties sur deux répétitions. Une calibration était effectuée au début de chaque jour de mesure.
31
Les courbes de réponses au Ci démarraient à 400 ppm de CO2 atmosphérique puis suivaient
l’ordre suivant : 400-300-250-200-150-100-75-50-400-600-800-1000-1300-1500 ppm. Le départ de la courbe s’effectue à CO2 ambiant avant d’entamer une descente vers le minimum de 50 ppm.
Cela permet ne pas saturer la chambre sous-stomatique en CO2 et ainsi d’erroner la réponse
foliaire (Cornic, 2007). La température foliaire était de 25°C ±1°C, le VPD ≤ 1.5 kPa et le PAR ajusté à 1700 µmol/m2/s (conditions environnementales non limitante). Ce sont les conditions utilisées chez Le Roux (1999) et Massonnet (2007) ; respectivement pour noyers et pommiers
Les courbes de réponses au PAR démarraient à PAR 1700 µmol/m2/s afin de s’assurer de l’ouverture de toutes les stomates. Par la suite les valeurs suivantes ont été imposées : 2000-1500-1000-750-500-250-100-50-25-0 µmol/m2/s. La température foliaire était de 25°C ±1°C, le VPD ≤ 1.5 kPa et CO2 atmosphérique de 400 ppm.
3- Détermination des paramètres de Farquhar : Vcmax-Jmax et Rd
L’ajustement se fait via les courbes de réponses de la photosynthèse nette (Anet) par rapport à la pression partielle de CO2 interne de la feuille (Ci), (Harley & al, 1992), (figure 11).
Des régressions non linéaires feuille par feuille ont été utilisées pour estimer les paramètres (Vcmax, Jmax et Rd ; (Wullschleger, 1993)). Les points considérés comme co-limités à la fois par la quantité de Rubisco et sa régénération (Ac ou Aj) n’ont pas été pris en compte pour l’ajustement. Typiquement, il s’agit des points compris entre 20 et 30 Pa de Ci, conformément à ce que recommande Sharkey (2007). Les points mesurés dans la gamme de Ci inférieur à 20 Pa ont servis à l’estimation de Vcmax et Rd. Les points supérieurs à 30 Pa ont servis à l’estimation de Jmax. Rd représente l’ordonné à l’origine de la courbe d’ajustement du Vcmax.
L’ajustement a été réalisé grâce à la fonction nls du logiciel R et la qualité des ajustements a été évaluée en utilisant la racine de l’erreur quadratique moyenne (RMSE) qui représente l’erreur moyenne d’un ajustement par rapport à la distribution des points, son calcul est le suivant : R = ∑ ( − ) , où n est la taille de l’échantillon, ym la valeur mesuré et yp la valeur prédit par le modèle. Plus la RMSE est faible plus la qualité du modèle est élevée.
32 Figure 12- A-B-C Réponses tout génotype confondus de la Gs/Gsmax à la température (ºC, A), au PAR (µmol/m2/s, B) et au VPD (kPa, C).
Equations: (A, equ 12) - y = −0.001x + 0.044 x + 0.522 (B, equ 13) -
y =
( ( . . )) (C1 equ 14) - = 1 ;
(C2, equ 15) - = −0.27 × ( − 1.72) + 1
A
B
33
IV. Détermination des limitations stomatiques et photochimiques de la photosynthèse en condition optimale
Afin d’expliquer les causes des différences de photosynthèse nette rencontrées en condition environnementales dites optimale (Ca= 400 ppm ± 10 ppm, Tª= 25ªC ± 0.2ªC, PAR=1700 µmol/m2/s, VPD ≤ 1.5 kPa.) entre génotypes une méthode d’estimation de l’importance de la part
stomatique et photochimique dans ces différences a été utilisée. Cette méthode a été proposée par Prioul et al, 1984 ; puis réutilisée par Wilson & al, 2000 ; Grassi & Magnani, 2005). Elle permet de quantifier quelle est la proportion de la variation de Anet entre génotype, qui peut soit être impacté au fonctionnement stomatique (appelé limitation stomatique) ou soit au fonctionnement photochimique (appelé limitation photochimique). Ces limitation sont exprimées en pourcentage, elles sont appelées limitations relatives. Afin de quantifier en µmol/m2/s, ce que représentait ces pourcentages, les limitations relatives ont étés multipliées par la différence de photosynthèse nette entre génotype. Ici, le PAR est saturant donc Jmax=constant, ce pourquoi, est utilisé Vcmax pour estimer la limitation photochimique.
V. Modélisation de la conductance stomatique 1- Le modèle de Jarvis
Ce modèle est proposé par Jarvis (1976), il émet l’hypothèse que la plante réagit de manière indépendante aux variables environnementales, l’équation générale du modèle est la suivante :
Gs = Gsmax × ⨍(PAR) × ⨍(T°) × ⨍(VPD) × ⨍(Cs) × ⨍(Ψf)
Une conductance stomatique maximale (Gsmax, mol/m2/s) est mesurée en conditions environnementales optimales (PAR= 1700 µmol/m2/s ; T°= 25°C ; VPD≤1.5 kPa ; Cs= 40Pa). Cette Gsmax est commune au génotype. L’équation est multiplicative où chaque fonction ⨍(x) ont des valeurs comprises entre 0 et 1. Chaque fonction va donc limiter le Gsmax, si une fonction est proche de 1, le facteur environnemental est peu limitant, si une fonction est proche de 0, le facteur environnemental est très limitant. Les paramètres environnementaux limitant sont : Le PAR, la température foliaire, le VPD foliaire, le CO2 à la surface de la feuille (Cs) et le déficit hydrique de la feuille (Ψf). Dans ce rapport, Cs est considéré constant à l’échelle journalière et Ψf est considéré comme non-limitant car le verger est irrigué, ces facteurs ne sont donc pas pris en compte.
34
Génotype Coefficients courbe PAR Coefficients courbe Température Coefficients courbe VPD
a b a b c γ a 337 -24 562 -0.0052 0.22 -1.44 1.1 -0.2 6917 -130 292 - 0.0018 0.08 0.03 1.7 -0.21 8232 -90 413 - 0.0039 0.18 -1.12 1.7 -0.3 8717 -3 298 - 0.0023 0.11 -0.31 2 -0.35 342 216 216 0.0001 - 0.03 1.54 1.6 -0.19 9234 45 308 - 0.0008 0.04 0.46 1.9 -0.36
Tableau 6-Coefficients par génotype des courbes de réponses de la Gs/Gsmax aux facteurs environnementaux (PAR, µmol/m2/s ; température, ºC et VPD, kPa)
35
2- Les courbes de réponses de la conductance stomatique au PAR, TºC et VPD foliaire
Afin d’estimer les limitations de chaque fonction des courbes de réponses de la conductance stomatique ont été réalisées. Pour analyser la réponse de la conductance stomatique au PAR, il a été utilisé la courbe de réponse de la photosynthèse nette au PAR de 2015, car le Licor 6400 mesure simultanément la photosynthèse nette et la conductance stomatique. Les autres mesures ont été réalisées en juillet 2016, le même appareil a été utilisé. Le protocole d’échantillonnage était le même que pour les courbes Anet/Ci et Anet/PAR, à l’exception des courbes à la température, les génotypes 337, 342, 8232 et 9234 n’ont été mesurés que sur 2 feuilles sur la même répétition.
Les courbes de réponse à la température foliaire suivait l’ordre suivant : 25ºC puis baisse par palier 1.5 ± 0.5 degrés jusqu’au minimum puis remontée jusqu’au maximum avec les même paliers. Seuls les points de remontés ont été pris en compte. La gamme de température explorée allait de 18ºC à 35ºC tout génotype confondus. Le VPD était ≤ 1.5 kPa, le CO2 était de 400 ppm et le PAR était à 1700 µmol/m2/s.
Les courbes de réponse au VPD ont été réalisées dans l’ordre suivant : 1.5-1.25-1-0.8-1-1.25-1.5-1.75-2-2.5-3-3.5 kPa. Ici, seules les mesures faites dans la remontée (de 1 à 3.5 kPa ) ont été prises en compte. Le CO2 était de 400 ppm, le PAR était à 1700 µmol/m2/s, la température foliaire à 25 degrés ± 1. Les points supérieurs à 3 kPa de VPD ont été obtenus en augmentant la température foliaire à 28ºC.
3- Détermination des paramètres de Jarvis.
Afin d’estimer les paramètres de Jarvis, des courbes d’ajustements ont été mises en place (figure 12A-B-C). Ce sont des courbes de réponses de la Gs/Gsmax en fonction des paramètres environnementaux. Les ajustements se sont fait par génotype. Les courbes de réponses sont :
Pour la température, une polynomiale : = + + (figure 12A, équation 12) Pour le PAR, une sigmoïde y =
( ( )) (figure 12B, équation 14)
Pour le VPD, une courbe linéaire en deux parties avec un plateau (figure 12C). Pour cette courbe elle forme un plateau (où Gs/Gsmax=1) jusqu’à atteindre la valeur de VPD du point de rupture elle a pour équation Gs/Gsmax = 1 (équation 13) aux valeurs de VPD> point de rupture, (lorsque la conductance commence à chuter) alors l’équation est : y = ax + b . (équation 15).Ce type d’ajustement est aussi utilisé chez Massonnet, 2007.
36
Des qualités d’ajustements globaux sur tous les génotypes pour chaque courbe de réponse de la Gs/Gsmax ont été calculées. L’indicateur choisi est la RMSE et le coefficient de corrélation de pearson (figure 12A-B-C).
Les paramètres des courbes ont étés ajustés par génotype (tableau 6), un test du rapport de vraisemblance a été effectuée sur ces courbes, par génotype (α=0.05). De plus, les coefficients de ces courbes ont été recalculés par génotype afin d’obtenir des paramètres plus facilement compréhensible par le lecteur. On a par courbe :
PAR : Gs/Gsmax 50%= quantité de PAR requis pour atteindre 50% de la Gs et Dérivée fonction*100= il s’agit de la dérivée de la fonction sigmoïde précédente multiplié par 100 au point où Gs= 50% du Gsmax, le calcul de la de Dérivée fonction *100 est la suivante : Dérivée fonction ∗ 100 = ( ) × 100 . Ce paramètre permet de mesurer la sensibilité de la Gs au PAR.
Température : optimum thermique= température pour laquelle Gs=Gsmax ; et Sensibilité thermique= dérivée de la relation polynomiale de degré 2 Gs/Gsmax à la température au point de température optimum + 1ºC, sa formule est : Sensibilité thermique = 2 × (optimum thermique + 1°C) + b. Elle est réalisée à optimum thermique + 1 degré car à l’optimum thermique il n’y a pas de pente, donc pour estimer une sensibilité de la Gs à la température la dérivée a été calculée à ce point-ci.
VPD : Point de rupture= point de la relation entre Gs/Gsmax et VPD où la Gs commence à diminuer ; et la pente= pente diminution relation Gs/Gsmax et VPD aux valeurs de VPD supérieures au point de rupture. Cette pente est le paramètre a de l’équation ax + b .Le point de rupture permet d’estimer la zone de confort de Gs par rapport au VPD et la pente, la sensibilité de Gs au VPD.
VI. Simulations et validations du modèle combiné Farquhar-Jarvis Un script R combinant les formules, variables et paramètres de Farquhar et Jarvis précédemment vu a été utilisé. Afin de valider ce modèle, des mesures ont été faites sur des feuilles indépendantes de celles utilisées pour les courbes de réponses. Les feuilles étaient matures et saines, 3 feuilles ont été mesurées par répétition, soit 6 par génotype. Les mesures se déroulaient en condition environnementale de température, VPD, PAR et CO2. La stabilisation de
la photosynthèse et de la conductance stomatique étaient vérifiées avant chaque mesure. Cette conductance et photosynthèse représentent les variables observées. Pour vérifier la bonne simulation du modèle, les conditions environnementales ont été entrées et le modèle simulait en retour des photosynthèses nettes et des conductances stomatiques.
La qualité de la simulation de la photosynthèse nette, conductance stomatique et transpiration ont été estimées avec comme indicateur, la RMSE et R2.
37 0 5 10 15 20 25 30 35 40 L on gu eu r cu m ul ée d es u ni té s de cr oi ss an ce ( m ) 337 6917 8232 8717 342 9234 0 20 40 60 80 100 120 140 160 180 200 N om br e d' un ité s de c ro is sa nc e 337 6917 8232 8717 342 9234 Génotype NbFp
Pente surface foliaire/ longueur rameau (cm2/cm) Rapport largeur/longueur feuille 337 11 14.7 0.59 6917 9 9.8 0.56 8232 8 12.5 0.57 8717 7 6.6 0.61 342 12 12.6 0.72 9234 7 10.7 0.62
Figure 13- A- Moyennes par génotype des longueurs cumulées des unités de croissances 2014-2015. B- Moyennes du nombre d’unités de croissances par génotype ayant poussées en 2014-2015
A-B- Les moyennes et les écarts-types (barres d’erreurs) sont obtenues à partir de 4 répétitions par génotype Une analyse de la variance après avoir log-transformé les valeurs a été effectuée. Un test post-hoc de Tukey a été effectué. Les génotypes ayant la même lettre ne sont pas significativement différent.
abc ab c c bc b ab cd bc bc
Tableau 7-Valeurs des paramètres issus des relations allométriques estimées en 2016.
Le NbFp (équation 4) représente le nombre de feuille que possèdent les unités de croissance avant l’élongation (considéré ici à <5cm).
La pente surface foliaire/longueur rameau (équation 5) représente l’augmentation de la surface foliaire en fonction de l’augmentation de la longueur des unités de croissances.
Le rapport largeur/longueur feuille (équation 2) représente ici à l’échelle foliaire le rapport de l’endroit où la largeur maximale sur la longueur de la nervure principale de la feuille.
Les valeurs des paramètres sont issues de modèles linéaires (cf matériels et méthodes)
p-value=0.0008 p-value= <0.0001
a a