This manuscript bas been reproduced ftom the microfilm master. UMI films the text directly ftom the original or copy submitted. Thus, some thesis and dissertation copies are in typewriter face, while others may be ftom any type of computer printer.
The quality ofthis reproduction is dependent upon the quality of the copy submitted. Broken or indistinct print, colored or poor quality illustrations and photographs, print bleedthrough, substandard margins, and improper alignment can adversely affect reproduction.
In the unlikely event that the author did net send UMI a complete manuscript and there are missing pages, these will be noted. Also, if unauthorized copyright material had to be removed, a note wilI indicate the deletion.
Oversize materials (e.g., maps, drawings, charts) are reproduced by sectioning the original, beginning at the upper left-hand corner and continuing ftom left to right in equal sections with small overlaps. Each original is also photographed in one exposure and is included in reduced form at the back of the book.
Photographs included in the original manuscript have been reproduced xerographically in this copy. Higher quality 6" x 9" black and white photographie prints are available for any photograpbs or illustrations appearing in this copy for an additional charge. Contact UMI directly to order.
UMI
A Bell & Howell Information Company
300 North Zeeb Road. Ann Arbor MI 48106-1346 USA 3I3n61-4100 8001s21-0600
Expression et caractérisation du canal potassique
voltage-dépendant lymphocytaire Kvl.3 chez les cellules HEK 293.
par Julie Martel
Département de Biochimie
Thèse présentée à la Faculté de Médecine de l'Université de Sherbrooke en vue de l'obtention du grade de
PHILOSOPHIAE DOCTOR (Ph.D. en Biochimie)
l+I
of Canada Acquisitions andBibliographie Services Acquisitions et services bibliographiques
395 Wellington Street Ottawa ON K1A ON4
Canada
395, rue Wellington Ottawa ON K1 A ON4 canac1a
The author bas granted a
non-exclusive licence allowing the
National Library of Canada to
reproduce, loan, distribute or sell
copies of this thesis
in
microform,
paper or electronic formats.
The author retains ownership of the
copyright
in
this thesis. Neither the
thesis nor substantial extracts from it
may be printed or otherwise
reproduced without the author' s
penmss1on.
Your fiJe Votrll rèMrenœ Our file Nol1IJ référenCll
L'auteur a accordé une licence non
exclusive permettant
àla
Bibliothèque nationale du Canada de
reproduire, prêter, distnbuer ou
vendre des copies de cette thèse sous
la forme de microfiche/film, de
reproduction sur papier ou sur format
électronique.
L'auteur conserve la propriété du
droit d'auteur qui protège cette thèse.
Ni la thèse ni des extraits substantiels
de celle-ci ne doivent être imprimés
ou autrement reproduits sans son
autorisation.
0-612-26390-8
A Pascal qui est là tous les jours ... A maman qui est là souvent ... A papa qui est là tout le temps ...
~
~
TABLE DES MA TIER.ES . . . . i
LISTE DES TABLEAUX ... V LISTE DES FIGURES . . . . vi
LISTE DES ABREVIATIONS ... ix
RESUME ... xi
1. IN'I'RODUCTION . . . 1
1. 1 Les constituants de la cellule . . . 1
1.2 La membrane plasmique . . . 1
1.3 Pores ou transporteurs? . . . 2
1.4 Perméabilité sélective . . . 3
1.5 Les canaux K+ . . . . 3
1.5.1 La diversité des canaux K+ . . . 3
1.5.1.1 Les canaux K+ voltage-dépendant . . . 4
1.5 .1.1.1 Les canaux K + voltage-dépendant à rectification 1.5.1.1.2 1.5.1.2 1.5.1.3 1.5.1.4 1.5.2 1.6 1.6.1 1.6.2 1.6.3 1.6.4 1.6.4. l 1.6.4.2 1.6.4.3 1.7 1.7.1 1.7.1.1 1.7.1.2 1.8 1.9 1.10 1.11 1.11.1 1.11.2 retardée . . . 4
Les canaux K + voltage-dépendant de type A . . . 5
Les canaux K + activés par le calcium . . . 5
Les canaux K + à rectification entrante . . . 6
Les canaux K+ transitoires . . . 6
Les canaux K + voltage-dépendant de la famille Shaker . . . 7
La structure des canaux K+ voltage-dépendant . . . 10
La région P . . . 10
L.e segment S4 . . . 11
Organisation tétramérique . . . 13
Des protéines membranaires dépourvues de peptide signal . . . 14
Les composantes associées . . . 14
La sous-unité KvB . . . . 15
La protéine PSD-95 . . . 20
La modulation de l'activité des canaux K+ . . . 22
Les divers mécanismes de régulation des canaux K + . . . 22
La régulation des canaux K + via l' AMPc et le calcium chez le lymphocyte . . . 22
La régulation via la phosphory\ation par la PKC, la PKA et les PTK . . . 23
La sélectivité ionique . . . 26
Modélisation de la structure à l'échelle atomique des canaux K+ voltage-dépendant . . . 27
L'inactivation des canaux . . . 31
La pharmacologie des canaux K + voltage-dépendant . . . 34
L.e TEA . . . 34
1.11.4 1.12 1.13 1.14 1.15 La dendrotoxine . . . 37
Le canal K+ voltage-dépendant lymphocytaire Kvl.3 . . . 37
L'expression de canaux K + dans des systèmes hétérologues . . . 39
Les maladies associées à un canal K + défectif . . . 41
But du travail . . . 44
2. MATERIEL ET METHODES ... 46
2 .1 Matériel . . . 46
2.2 Méthodes . . . 47
2.2.1 Culture cellulaire . . . 4 7 2.2.2 Comptage des cellules et détermination de la viabilité 2.2.3 2.2.4 2.2.5 2.2.6 2.2.6.1 2.2.6.2 2.2.6.3 2.2.6.4 2.2.6.5 2.2.6.6 2.2.6.7 2.2.7 2.2.7.1 2.2.7.2 2.2.7.3 2.2.8 2.2.9 2.2.9.1 2.2.9.1.1 2.2.9.1.2 2.2.9.1.3 2.2.9.2 2.2.9.2.1 2.2.9.2.2 cellulaire . . . 48
Amplification par PCR et ligation . . . 48
Isolement des plasmides et vecteurs . . . 51
Transfection des cellules HEK 293 . . . 52
Techniques utilisées pour la mise en évidence des différents messagers d'intérêt . . . 53
Isolement des sondes . . . 54
Radiomarquage des sondes . . . 54
Isolement del' ARN total des cellules HEK 293 et Jurkat E.6.1 . . . . 55
Préparation d'ARN messager des cellules Jurkat pour les études de RT-PCR . . . 55
Transfert de l' ARN sur membrane de nylon . . . 56
Préhybridation et hybridation de la membrane . . . 57
Lavage des membranes . . . 58
Mise en évidence des mutants de délétions du canal Kvl.3 chez les cellules HEK 293 transfectées . . . 58
Analyse Western des canaux transfectés chez les cellules HEK 293 . . 59
Mise en évidence de l'expression des canaux K + par la technique d'immunolocalisation . . . 61
Analyse de l'expression des canaux K • par cytofluorimétrie de flux . 62 Essai d'amplification d'une sous-unité KvB par la transcriptase inverse . . . 62
Technique de Southern blot . . . 64
Southern blot des produits de PCR . . . 64
Transfert de I' ADNc sur membrane de nylon . . . 64
Préhybridation et hybridation de la membrane . . . 65
Lavage de la membrane . . . 65
Etudes de Southern blot génomique des cellules Jurkat . . . 66
Isolement de L' ADN génomique des cellules Jurkat, de sang périphérique et de cerveau de rat . . . 66
2.2.9.2.4 2.2.10 2.2.10.1 2.2.10.2 2.2.10.3 2.2.10.4 2.2.10.5 Lavage de la membrane . . . . . . . 68 Etudes électrophysiologiques . . . . . . . 68 Méthodes du patch-clamp . . . . . . . 68 Nonnes et conventions . . . . . . . 71
Composition des milieux intracellulaires et extracellulaires . . . 72
Fabrication des micropipettes . . . . . . . . . . . 72
Montage pour la technique de patch-clamp . . . . . . . 73
3. RESULTATS . . . . . . . 74
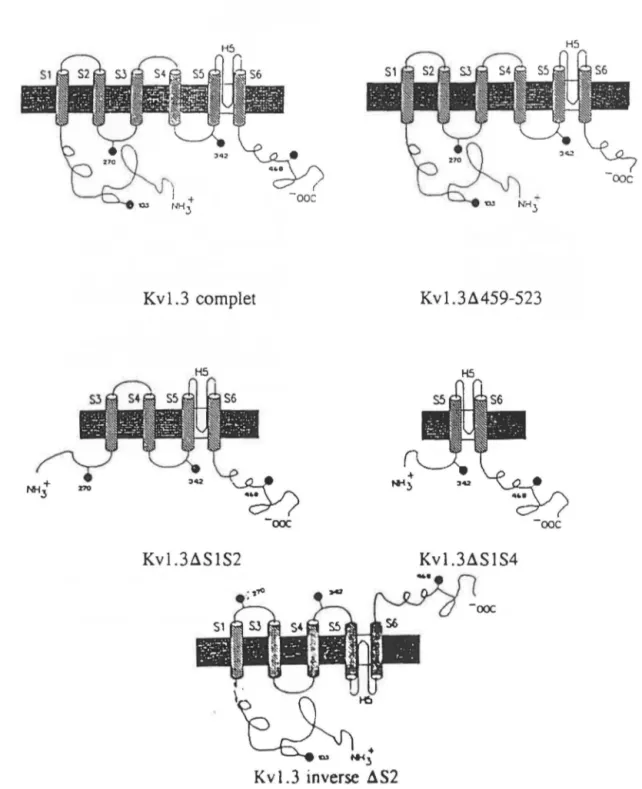
3.1 Expression des divers mutants de délétion du canal Kvl.3 . . . 74
3 .1.1 Amplification par PCR des divers mutants de délétion du canal K v 1. 3 7 4 3.1.2 Clonage des divers ADNc correspondant aux mutants de délétion du canal 3.1.3 3.1.4 3.1.5 3.1.6 3.2 Kvl.3 . . . . . . . . . . . 77
Transfection chez les cellules HEK 293 . . . . . 77
Analyse Northem des divers canaux K+ tronqués . . . 80
Analyse Western des divers canaux K+ tronqués . . . 80
Analyse par immunofluorescence indirecte des divers canaux K+ tronqués . . . . . . . 84
Caractérisation des canaux Kvl.3 complet et .L\459-523 exprimés chez les cellules HEK 293 . . . . . . . 84
3.2.1 Caractérisation électrophysiologique . . . . . . . 84
3.2.2 Caractérisation pharmacologique . . . . . . . 95
3.3 Etude de la régulation des canaux Kvl.3 complet et .L\459-523 par la PKC et la PKA par la technique du patch-clamp en configuration cellule entière . . . . . . . . . . . 95
3.4 Caractérisation et régulation des canaux unitaires Kvl.3 complets ... 101
3.4. l Caractérisation du canal unitaire Kvl.3 en configuration cellule attachée . . . . . . . . . . . . . 101
3.4.2 Régulation du canal Kvl.3 unitaire par la PKC et la PKA en configuration de patch excisé . . . . . . . . . 108
3.5 Caractérisation électrophysiologique des canaux AS1S2, AS1S4 et inverse (AS2) ... 114
3.6 Etude du rôle de la sous-unité KvB ... 122
3.6.1 Coexpression des sous-unités KvBl.1, KvBl.2 et KvB2 et du canal Kvl.3 chez les cellules HEK 293 ... 122
3.6.2 Etudes électrophysiologiques des cellules HEK 293 cotransfectées avec une sous-unité KvB et le canal Kvl.3 ... 126
3.6.3 Etude de l'implication de la sous-unité KvBl.2 dans la régulation du canal Kvl.3 ... 126
3.6.4 Tentative de mise en évidence d'une sous-unité KvB chez le lymphocyte Jurkat ... 128
4. DISCUSSION . . . . 135
4.1 Expression des divers mutants de délétions du canal Kvl.3 ... 135
4.2 Caractérisation électrophysiologique des canaux Kvl.3 complets et tronqués 4.3 4.4 4.4.1 4.4.2 exprimés chez les cellules HEK 293 ... 139
Etude de la régulation des canaux Kvl.3 complet et 4.459-523 par la PKC et la PKA par la technique du patch-clamp en configuration de cellule entière . . . . . . . . 141
Implication d'une sous-unité KvB ... 146
Implication des sous-unités KvBl. l, KvBl.2 et KvB2 dans l'inactivation et la régulation du canal Kvl.3 chez les cellules HEK 293 ... 147
Tentative de mise en évidence d'une sous-unité Kvs chez le lymphocyte Jurkat ... 149
5. CONCLUSION . . . . . . . . 153
REMERCIEMENTS . . . . 154
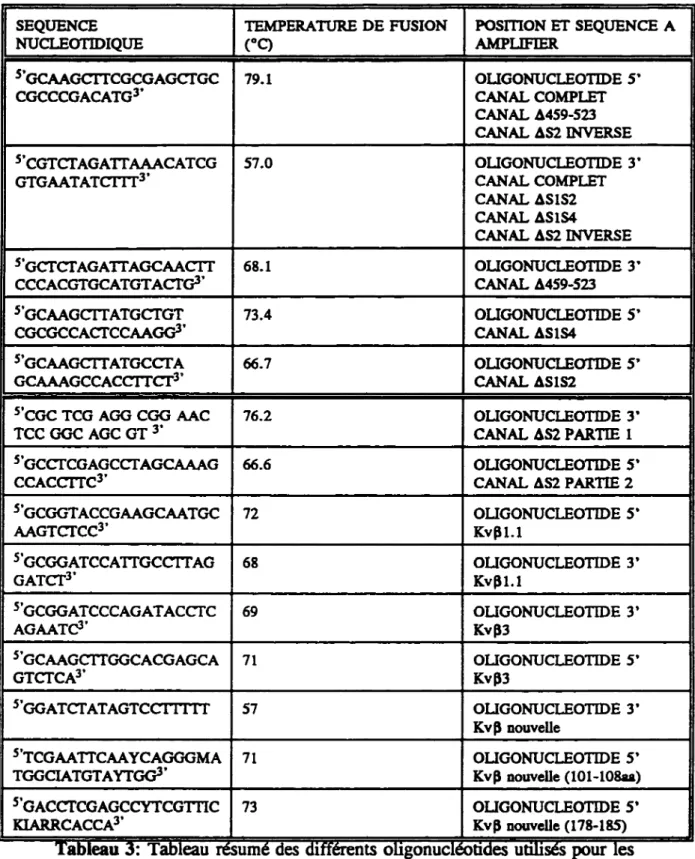
Tableau 1: Nomenclature des gènes de la famille des canaux K+ voltage-dépendant . . . . . . . 9 Tableau 2: Tableau résumé des canaux K+ possèdant, dans la région N-terminale, ·une ou plusieurs séquences riches en résidus proline . . . 25 Tableau 3: Tableau résumé des différents oligonucléotides utilisés pour les amplifications PCR et RT-PCR . . . 50
Figure 1: Représentation schématique de la structure des canaux K + voltage-dépendant de la famille Shaker . . . 12 Figure 2: Représentation schématique de la sous-unité KvB . . . 18 Figure 3: Région et séquence d'interactions de la sous-unité KvB avec le canal K +
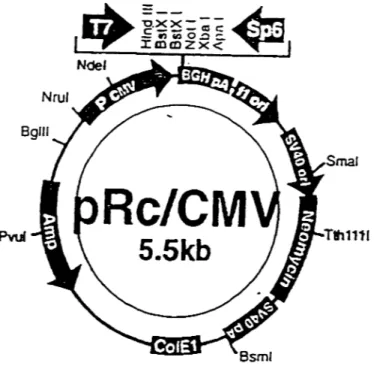
voltage-dépendant . . . 19 Figure 4: Représentation schématique de la protéine PSD-95 . . . 21 Figure S: Représentation schématique du canal Shaker obtenu par modélisation . 30 Figure 6: Schématisation simplifiée des états du canal Na+ . . . 32 Figure 7: Représentation schématique du pore des canaux K+ voltage-dépendant 36 Figure 8: Représentation schématique de la structure du canal K + voltage-dépendant Kvl.3 . . . 40 Figure 9: Représentation schématique des différentes configurations pour les études en patch-clamp . . . 70 Figure 10: Représentation schématique des différents canaux Kvl.3 complet et tronqués exprimés chez les cellules HEK 293 . . . 75 Figure 11: Amplification par PCR des divers mutants de délétion du canal Kvl.3 76 Figure 12: Représentation du vecteur d'expression eucaryote pRC/CMV . . . 78 Figure 13: Représentation des digestions enzymatiques Hindill et XBAI obtenues des vecteurs isolés des bactéries XL 1 . . . . . . . . . . . . . . . . . . . 79 Figure 14: Photographie de cellules transfectées avec le vecteur encodant le gène
de la B-galactosidase . . . 81 Figure 15: Résultat d'analyse de type Northem des divers canaux Kvl .3 chez les cellules HEK 293 . . . 82 Figure 16: Résultat d'une analyse de type Western . . . 83 Figure 17: Résultats d'analyse par immunofluorescence indirecte . . . 85
A459-523 . . . 91 Figure 19: Courbe d'activation du canal Kvl.3 complet et A459-523 . . . 92 Figure 20: Courbe d'inactivation du canal Kvl.3 complet et A459-523 . . . 94 Figure 21: Courbes des temps d'activation en fonction du potentiel du canal Kvl.3 complet et A459-523 . . . 96 Figure 22: Courbes des temps d'inactivation en fonction du potentiel du canal Kvl.3 complet et A459-523 . . . 97 Figure 23: Pourcentage de diminution de l'amplitude du courant du canal Kvl.3 complet et A459-523 suite à l'ajout du TEA, 4-AP, charybdotoxine et Ni2+ . . . • . . . • . . • . . . • . . . . 98
Figure 24: Inhibition de l'amplitude du courant suite aux effets de la PKC et de la
PKA ... 100
Figure 25: Tracés et histogrammes de l'amplitude du courant unitaire du canal
Kvl .3 ... 102 Figure 26: Courbe de la relation Po en fonction du potentiel membranaire du canal
Kvl.3 complet ... 105 Figure 27: Courbe de relation courant-voltage du canal unitaire Kvl.3 complet . 106 Figure 28: Courbe de relation NPo courant-voltage du canal unitaire Kvl.3
complet . . . l 07 Figure 29: Nombres d'ouvertures du canal Kvl.3 complet en fonction du temps . 109 Figure 30: Nombres de fermetures du canal Kvl.3 complet en fonction du temps 110 Figure 31: Courbe de relation courant-voltage du canal unitaire Kvl.3 complet en conditions asymétriques . . . 111 Figure 32: Courbe de relation Po en fonction du potentiel du canal Kvl.3 en conditions
asymétriques ... 112 Figure 33: Courbe de relation Po courant-voltage obtenue des expériences en canal unitaire en conditions asymétriques ... 113
excisé . . . . 115 Figure 35: Sommation des Po suite aux effets médiés par la PKA ... 118 Figure 36: Courbe de relation courant-voltage des canaux endogènes et âSlS2, AS1S4 et âS2 . . . 120 Figure 37: Courbe de relation courant-voltage du mutant âS 1S4 suite à des hyperpolarisations ... 121 Figure 38: Représentation du vecteur d'expression eucaryotique pREP7 ... 124 Figure 39: Analyse de type Northern sur les cellules HEK 293 cotransfectées avec le canal Kvl.3, la sous-unité KvBl.2 et la sous-unité KvB2 ... 125 Figure 40: Décours du courant K+ suite à une dépolarisation à 40 rnV chez les cellules HEK 293 transfectées avec le canal Kvl.3 complet avec (cr
+
B) et sans (cr)la sous-unité KvB 1.2, en configuration cellule entière . . . 127 Figure 41: Histogramme de l'inhibition de l'amplitude du courant suite à l'ajout de TPA et de 8Br-cAMP chez les cellules cotransfectées avec le canal Kvl.3 complet et la sous-unité KvB 1.2 ou la sous-unité KvB2 ... 129 Figure 42: Analyse de type Northern pour une sous-unité KvS dans l'ARN de cellules Jurkat, de sang périphérique et de cerveau de rat ... 132 Figure 43: Analyse de type Southern sur les produits obtenus de l'amplification par
RT-PCR à partir de l 'ARN de cellules Jurkat. de sang périphérique et de cerveau de rat ... 133 Figure 44: Analyse de type Southern sur I' ADN génomique de cellules Jurkat, de sang périphérique et de cerveau de rat ... 134
ADNc 4-AP
ARN
ARNm
ATP
BSA DAG DEPC DMSO DNase dNTPDTI
EDTA FACS HEP ES IP3 MOPS NP40 PAGE PBS PCRAcide déoxyribonucléique complémentaire 4-aminopyridine
Acide ribonucléique
Acide ribonucléique messager Adénosine triphosphate Albumine bovine sérique 1,2-sn-diacylglycérol Diéthylpyrocarbonate Dimethylsulfoxyde Déoxynucléase Déoxynucléotide triphosphate D,L-Dithiothréitol
Acide éthylène diamine tétraacétique «Fluorescence Activating Cells Sorter>>
acide (N-(2-h ydroxyeth y l )pipérazine-N' -(2-éthanesulfoniq ue)) my0-inositol-l ,4,5 triphosphate
Acide (3-(N-morpholino )propane-sulfonique Nonidet P-40
«Polyacrylamide Gel Electrophoresis» Tampon phosphate salin
PKA Protéine kinase A
PKC Protéine kinase C
PLC Phospholipase C
PMA {TPA) Phorbol 12-myristate 13-acétate poly A+ Queue de polyadénylation
PTK Protéine tyrosine kinase
RNase Ribonucléase
RT Transcriptase inverse
SDS Sodium dodecyl sulfate
ssc
Saline-sodium-citrateSTE Sodium-tris-EDTA
TAE Tris-acétate-EDT A
TBE Tampon tris/borate/EDT A
TE Tampon Tris/EDT A
TEA Tétraéthylammonium
RESUME
Les canaux K+ font partie d'une famille de protéines impliquées dans le passage se1ectif des ions K + chez toutes les cellules eucaryotes. Dans le cas du lymphocyte, l'activité de ces canaux est intimement associée au processus d'activation en réponse ·aux agents mitogéniques. Chez le lymphocyte T humain périphérique, seul le type na été mis en évidence et il en est de même de la lignée lymphocytaire T Jurkat. Ce type de canal montre une sensibilité aux bloqueurs, tétraéthylammonium (TEA), 4-aminopyridine (4-AP) et la charybdotoxine. La structure du canal est composée de sous-unités a et B (4:4). Un
profil d'hydropathie montre que la sous-unité a Kvl.3 possède 6 régions transmembranaires (S 1 à S6) et les régions N- et C-terminales sont localisées du côté intracellulaire. Le pore H5 est situé entre les segments S5 et S6. Le segment S4 est responsable de la sensibilité au voltage, tandis que les segments S5 et S6 contribuent à la formation du pore. Le canal Kvl.3 est régulé par phosphorylation impliquant la PKA, la PKC et les PTK. Les sites probables de phosphorylation sont dans la région C-terminale (un site PKA), dans les régions cytosoliques (3 sites PKC) et en N-terminal (un site PTK).
Des mutants du canal Kvl.3 (complet, â459-523, âS1S2, âSlS4 et âS2) ont été générés par la technique d'amplification PCR et les produits obtenus ont été clonés dans un vecteur d'expression eucaryote et transfectés chez la lignée de cellules HEK 293 afin d'étudier la relation structure-activité. Les études électrophysiologiques ont montré que seul le canal Kvl.3 complet et â459-523 reconstituent des canaux K+ et conservent sensiblement les mêmes propriétés que le canal natif du lymphocyte Jurkat. Des études d'immunolocalisation indirecte ont montré la présence de ces deux canaux à la surface membranaire des cellules HEK 293. Par contre, les mutants âS1S2, âS1S4 et âS2 ne montrent pas d'expression à la surface membranaire et par le fait même, aucun courant autre que celui dû au canal endogène ne peut être mesuré.
Les effets de la PKA et par la PKC ont été étudiés sur les canaux Kvl.3 complet et â459-523. Nos résultats ont montré que ces deux canaux sont affectés par la PKC puisque l'ajout de TPA (16 nM) diminue l'amplitude du courant d'environ 30%. Par contre, seul l'activité du canal Kvl.3 complet est inhibé à 30% par le 8Br-cAMP (1 mM). Ces résultats suggèrent que le canal Kvl.3 transfecté montre une sensibilité partielle aux effets de ces deux protéines kinases qui inhibent complètement l'activité du canal Kvl.3 chez le lymphocyte Jurkat.
La sous-unité KvB accélère la cinétique d'inactivation des canaux K+. Puisque le canal Kvl.3 transfecté s'inactivait très lentement, des études d'inactivation ont été entreprises en présence des sous-unités KvBl.2 et KvB2. Nos résultats montrent que la sous-unité KvSl.2 accélère l'inactivation du canal Kvl.3. Cependant, des études de régulation par la PKC et par la PKA ont montré que ces sous-unités KvB ne sont pas impliquées dans la régulation du canal Kvl.3. Des études de RT-PCR et d'analyse de type
Southern sur l'ADN génomique de cellules Jurkat n'ont pas permis de mettre en évidence une sous-unité KvB propre aux lymphocytes Jurkat.
1.INTRODUCTION
1.1 Les constituants de la cellule
Les protéines, les lipides, les polysaccharides, les sels et l'eau font partie de toute cellule vivante. Ces constituants, de concert avec les gènes, les enzymes et les substrats servent à maintenir l'homéostasie cellulaire et sont essentiels aux activités chimiques, électriques, mécaniques et osmotiques cellulaires. L'homéostasie signifie que certains paramètres comme le volume cellulaire, le pH et la concentration des ions intracellulaires sont maintenus relativement constants.
1.2 La membrane plasmique
La membrane plasmique délimite le contour des cellules en définissant une barrière entre le milieu intracellulaire et extracellulaire. Elle est constituée d'une bicouche lipidique dans laquelle sont ancrées des protéines et des glycolipides. De part et d'autre de cette barrière, il existe dans toute cellule une inégalité de répartition des ions. Par exemple, la concentration intracellulaire des ions K + est 15 fois plus élevée que celle extracellulaire. La situation est inverse dans le cas des ions Na+. Ce gradient ionique est maintenu grâce aux pompes Na+ IK + A TPases. De plus, la membrane plasmique possède une propriété importante qui est celle de présenter une perméabilité sélective vis-à-vis différents ions, dont les principaux sont le K+, le Na+, le Ca2+ et le
cr.
Le gradient de concentration etla perméabilité de la membrane sont responsables de la différence de potentiel électrique membranaire.
l. 3 Pores ou transporteurs?
Quelles sont les structures biologiques responsables de la sélectivité ionique et, par le fait même, du transfert de charges à travers la matrice lipidique? Jadis, il existait deux écoles de pensée: l'une proposait que le transport de charges se faisait par l'intermédiaire de transporteurs, et l'autre optait plutôt pour le principe de canaux ou pores.
Le concept de transporteur est généralement bien admis pour expliquer différents types d'échanges. En fait, les transporteurs sont conçus comme étant des protéines insérées dans la membrane et capables d'exposer alternativement des sites d'affinité sélective vers les milieux intracellulaires et extracellulaires.
Le terme «pore>> au sens large est employé pour désigner les structures membranaires qui modulent le passage de l'eau, des ions et des petites molécules (Danielly et Davson, 1935). Depuis les années 1970, certaines de ces structures ont été isolées au moyen de techniques biochimiques et leur propriétés étudiées au moyen de techniques biophysiques.
Les canaux ioniques sont maintenant connus comme étant des macromolécules transmembranaires de nature protéique. Bien que la signification du terme soit discutable,
certains auteurs sont d'avis que les canaux possèdent des propriétés semblables aux enzymes à cause de leur spécificité de reconnaissance des ions, qu'ils catalysent le passage des ions et qu'ils soient modulés par des facteurs physiques, biologiques et chimiques comme le pH, la concentration, la température et les hormones (Catterall et Epstein, 1992)
1.4 Perméabilité sélective
L'hypothèse de la perméabilité sélective au K+ remonte aux années 150. A ce
moment, on commençait à élaborer la base de la théorie ionique du potentiel de repos et du potentiel d'action des cellules excitables (Hodgkin, 1951). La perméabilité potassique était étudiée de façon indirecte par le biais des changements dans le potentiel d'action. Par la suite, l'axone géante du calmar a été l'une des préparations utilisée pour l'étude des mécanismes de transport quantitatif du Na+ et du K + à travers la membrane et leurs implications dans l'excitabilité des fibres nerveuses.
1.5 Les canaux K+
1.5.1 La diversité des canaux K+
Les études concernant les différentes composantes des courants globaux ont permis de distinguer, outre les composantes sodiques et calciques, plusieurs types de courants potassiques. Initialement, des ligands de haute affinité pour les canaux K+ n'étaient pas
disponible contrairement aux canaux Na+ et Ca2 + et ceci a retardé la caractérisation biochimique des canaux K +. Leur purification et la détermination de leur séquence peptidique sont demeurées ainsi inconnues pendant plusieurs années. Cependant, l'utilisation des techniques de biologie moléculaire a permis de déduire la structure primaire de plusieurs familles de canaux K + (Pongs, 1992).
Les canaux potassiques sont des protéines membranaires ubiquitaires présentes chez des cellules excitables et non excitables. Ils jouent des rôles cruciaux dans plusieurs processus cellulaires comme la relâche de neurotransmetteur, la sécrétion hormonale, l'activation cellulaire et la régulation du volume cellulaire.
Les différents types de canaux transportant les ions potassiques sont les canaux voltage-dépendant à rectification retardée et ceux de type A, les canaux à rectification entrante, les canaux transitoire sortant et les canaux activés par le calcium.
1.5. 1.1 Les canaux K + voltage-dépendant
1.5 .1. 1. 1 Les canaux K + voltage-dépendant à rectification retardée
Les canaux K+ voltage-dépendant à rectification retardée «delayed outward rectifier» sont souvent ceux responsables du courant K + chez plusieurs cellules. Ces canaux sont impliqués dans la repolarisation suite à un potentiel d'action. Ils s'activent et s'inactivent
lentement et sont présents chez la plupart des cellules excitables mais également chez des cellules non-excitables comme le lymphocyte T où leur action est essentielle à la réponse immune (DeCoursey et coll., 1984; Matteson et Deutsch, 1984).
Il existe plusieurs familles de canaux voltage-dépendant à rectification retardée, possédant des cinétiques et pharmacologies différentes.
1.5. 1.1.2 Les canaux K + voltage-dépendant de type A
Le canal K+ de type A s'active relativement rapidement et de façon transitoire suite
à une dépolarisation membranaire. Ce type de canal a été observé initialement sur une préparation de neurones de mollusques (Connor et Stevens, 1971), et se retrouve présent avec d'autres types de canaux K+ chez une même cellule. Ce canal est très sensible au 4-AP et au TEA interne. Contrairement aux canaux K + à rectification retardée, les membres de la famille des canaux de type A possèdent sensiblement les mêmes caractéristiques électrophysiologiques et pharmacologiques entre eux.
1.5.1.2 Les canaux K+ activés par le calcium
Les canaux K+ calcium dépendant, (GKca), sont activés par des concentrations cytoplasmiques de calcium de l'ordre du µM. Même si dans certains cas ce type de canal est également sensible au voltage, on croit qu'il s'agisse plutôt de la liaison du calcium au
canal qui est dépendante du voltage et qui permet son ouverture. La reconstitution de ce type de canal dans des bicouches lipidiques montre sans équivoque que la liaison du calcium est directe. Les GKea sont présents chez plusieurs types de cellules mais principalement chez les cellules excitables et sécrétrices. Leur rôle serait celui de contrôler l'entrée de calcium dans la cellule et la repolarisation suite à une dépolarisation membranaire ou à une hyperpolarisation.
De fait, on peut distinguer trois types de canaux K + activés par le calcium. Le premier, le canal SK, est un canal K+ de faible conductance unitaire qui est bloqué par l'apamine. Le deuxième,le Maxi-Kea ou BK, est un canal K+ de haute conductance unitaire qui est bloqué par de faibles concentrations externes de TEA ou de charybdotoxine. Le troisième, des canaux de conductances intermédiaires, insensibles à l'iberiotoxine et à l 'apamine, qui dépendent peu du voltage.
1.5.1.3 Les canaux K+ à rectification entrante
Le canal à rectification entrante est retrouvé chez plusieurs types cellulaires comme les cellules cardiaques et musculaires. Impliqué dans la durée des longs plateaux de potentiel d'action, il est également important pour l'activité •pacemaker' du coeur. Sa conductance augmente avec l'hyperpolarisation permettant ainsi l'entrée de K +.
1.5.1.4 Les canaux K+ transitoires
Les caractéristiques d'activation et d'inactivation de ce type de canal sont très différentes des autres types de canaux K+. Ayant une activité de base très faible, le courant K + transitoire est activé suite à des dépolarisations membranaires à des niveaux près du potentiel de repos. Son inactivation est typiquement représentée par une courbe d'allure exponentielle. Ces canaux auraient un rôle à jouer dans le maintien du potentiel de repos de la membrane (Rudy, 1988).
1.5 .2 Les canaux K + voltage-dépendant de la famille Shaker
Un mutant de Drosophila melanogaster présentant des tremblements des membres postérieurs et exhibant des anormalités électrophysiologiques ainsi que dans le relâchement de neurotransmetteurs, a permis de cibler le gène défectif qui a été appelé Shaker (Sh). Suite au clonage, la séquence d'acides aminés déduite a prédit une protéine membranaire semblable à celle de la structure des canaux Ca2 + et Na+. Cette prédiction s'est avérée véridique suite à l'injection de l' ARNm correspondant chez les ovocytes de Xenopus, qui a permis de mettre en évidence l'expression d'un canal K+ (Timpe et coll., 1988).
L'isolement du gène encodant un canal potassique voltage-dépendant chez la drosophile (Kvl, Kamb et coll., 1987; Pongs et coll., 1988) a ouvert la voie au clonage de plusieurs autres canaux K + dont Shab (Kv2), Shaw (Kv3) et Shal (Kv4), qui sont
fonctionnellement distincts du canal Shaker (Butler et coll., 1989; Wei et coll., 1990; Covarrubias et coll., 1991) (Tableau 1). Des gènes homologues au canal Shaker ont été décrits dans plusieurs organismes dont Aplysia (Pfaffinger et coll., 1991), C. elegans (Wei et coll., 1991), la limace (Johansen et coll., 1990) et le schistosome. On connait maintenant 17 gènes de vertébrés encodant des canaux K+ voltage-dépendant. La plupart de ces gènes se distribuent en 4 sous-classes bien définies, lesquelles sont structuralement et évolutivement reliées au gène de la drosophile.
Le gène du canal Shaker chez la drosophile contient plusieurs exons (au moins 23) repartis sur plus de 120kb et est épissé de façon alternative pour générer 5 transcripts actifs et distincts (Pongs et coll., 1988; Tseng-Crank et coll., 1990). Par contre, tous les homologues du canal Shaker, de Kvl. l à Kvl.8, sont encodés par un seul exon. Seul le canal K v l. 7 possède un intron entre la région codante liant la boucle S l à S2. La
signification évolutive dans la différence de structure, de la mouche aux vertébrés, ainsi que le mécanisme par lequel cette famille de gènes a évolué demeurent obscurs. Quoique tous les canaux Kv soient exprimés dans le cerveau, leur distribution dans d'autres tissus est restreinte. Les mécanismes moléculaires régissant cette expression tissu-spécifique sont inconnus. Il se pourrait qu'un mécanisme similaire à celui des canaux Na+, c'est-à-dire la présence de séquences •silencers' et •enhancers' contrôle leur expression (Maue et coll., 1990).
~
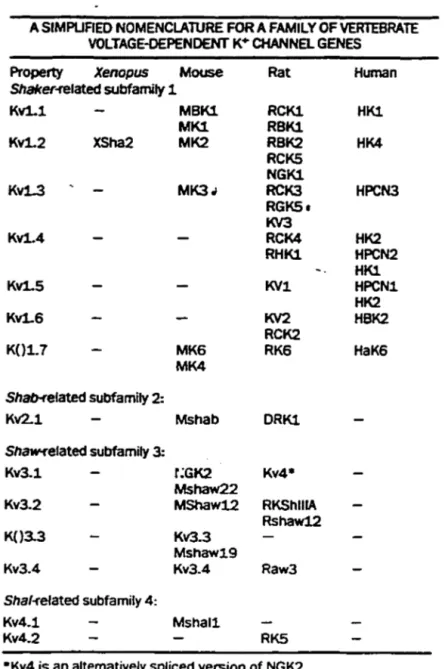
A SIMPUFIEO NOMENCLAlURE FOR A FAMILY OF VERTEBRATE VOLTAGE-DEPENDENT K• CHANNEL GENES
Property Xenopus Mouse Rat Human
Shalcer-related subfamily 1 Kvl.1 MBKl RCKl HKl MK1 RBKl Kvl.2 XSha2 MK2 RBK2 HK4 RCKS NGKl Kvl..3 MK3.; RCK3 HPCN3 RGK51 KV3 Kvl.4 RCK4 HK2 RHKl HPCN2 HKl Kvl.5 KVl HPCNl HK2 Kvl.6 KV2 HBK2 RCK2 K(}l.7 MK6 RK6 HaK6 MK4 ShatHelated subfamily 2: Kv2.1 Mshab DRKl Shaw-t"elated subfamily 3: Kv3.1 r;GK2 Kv4• Mshaw22 Kv3.2 MShaw12 RKShlllA Rshaw12 K()3.3 Kv3.3 Mshaw19 Kv3.4 Kv3.4 Raw3 Shal-refated subfamily 4: Kv4.1 Mshal1 Kv4.2 RKS
•Kv4 is an altematively spliced version of NGK2.
Tableau 1: Nomenclature des gènes de la famille des canaux K+ voltage-dépendant
1.6 La structure des canaux K+ voltage-dépendant
Une topologie des canaux K+ a été proposée suite à des études d'hydropathie et d'analyses de structure-fonction (Jan et Jan, 1992; Pongs, 1992, Durell et Guy, 1992). Il va de soi que l'organisation des canaux dans la membrane a été facilitée par les nombreux travaux de Numa sur le canal sodique (Noda et coll., 1986). Les canaux potassiques voltage-dépendant possèdent 6 régions transmembranaires, Sl à S6, et les portions N et C-terminales sont localisées du côté cytoplasmique. La région H5 ou P, située entre les segments SS et S6, est considérée comme étant impliquée dans la formation du pore. Pour sa part, la région S4 joue le rôle de senseur de variation de voltage (Papazian et coll., 1991). La boucle reliant SI à S2 est N-glycosylée telle que mise en évidence par des essais de traduction in vitro, et ces observations suggèrent que la boucle Sl-S2 est extracellulaire (Chua et coll., 1992; Shen et coll., 1993) (Figure 1). En alignant les séquences d'acides aminés correspondant à tous les homologues de la famille Shaker, on remarque une très grande homologie dans la région S4 à S6 (70%) ainsi que pour une portion substantielle en partie N-terminale de la région transmembranaire S 1. Pour le reste de la protéine, la divergence entre les canaux est évidente.
1.6. l La région P
La région du pore, Pou H5, est composée de 22 résidus d'acides aminés et est la plus conservée à travers les espèces. En fait, cette région peut-être identifiée dans tous les
...
canaux potassiques connus: Kv, ceux activés par le calcium (Atkinson et coll., 1991), ceux à rectification entrant (Anderson et coll., 1992), le canal GIRK couplé aux protéines G (Kubo et coll., 1993), le éther-à-gogo de la drosophile (Warmke et coll., 1991 et 1993) et le canal isolé chez E.coli {Milkman, 1994). Le motif G-Y/F-G est commun à chacun. Puisque cette séquence est absente chez d'autres canaux cationiques (Na+ et Ca2+), cette observation suggère que la région P joue un rôle prédominant dans la détermination de la sélectivité de ces canaux.
1.6.2 Le segment S4
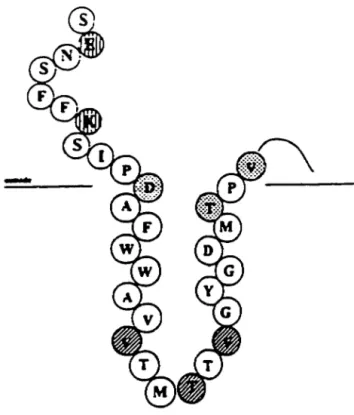
Les canaux voltage-dépendant sont activés suite à un changement du potentiel membranaire. Le segment S4 est impliqué dans la sensibilité au voltage. Composé d'un domaine «leucine zipper», la mutagénèse de ces résidus altére les propriétés d'ouverture (gating) du canal (Papazian et coll., 1991). Cette heptade de résidus leucine répété 5 fois pourrait être importante dans plusieurs interactions protéine-protéine (McCormack et coll., 1989). La distribution des résidus chargés positivement se fait à chaque 3 résidus d'acides aminés, un patron caractéristique que l'on retrouve également dans les cas des canaux Na+ et Ca2+ voltage-dépendant. La sensibilité au voltage peut également impliquer des résidus situés ailleurs qu'en S4. Un résidu arginine présente en S2, conservé chez tous les canaux Kv, pourrait influencer la dépendance de ces canaux au voltage, de même que le motif FFDR de la région N-terminale, l'acide glutamique en S2 et SS et finalement, un acide aspartique en S3 (McCormack et coll., 1991) .
- i 1 1 . St S2 S3 ,..-, ,
\
, F \
i
.) SSV
H5coo
9F'igure l:Représentation schématique de la structure des canaux K+ voltage-dépendant de la famille Shaker. Les 6 régions transmembranaires sont identifiées par Sl à S6, la région H5 jouant le rôle de pore ionique. La région N- et C-terminales sont intracellulaires (Jan et Jan, 1989).
1.6.3 Organisation tétramérique
L'association d'homomultimères de 4 unités Sl-S6 est nécessaire pour produire un canal fonctionnel (Shen et coll., 1993; Pfaffinger et DeRubeis, 1995; Durrell et Guy, 1992). La coexpression de 2 canaux distincts résulte en un courant ionique de comportement hybride indiquant que l 'hétéromultimérisation peut contribuer à la diversité (lsacoff et coll., 1990; McCormack et coll., 1990; Chenet coll., 1996). Ce principe n'est pas accepté par tous les investigateurs et certains prétendent que les monomères identiques ne peuvent s'assembler qu'entre eux (Critz et coll., 1993; Covarrubias et coll., 1991). Cependant, des données récentres suggèrent que l 'hétéromultimérisation a lieu si les 2 canaux sont exprimés chez des cellules qui sont dépourvues de ceux-ci (communication au congrès 4th Annual Neuropharmacology Conference, Official Satellite Symposium on Potassium Channel, Washington OC., 14-16 novembre 1996).
Une région de 115 résidus d'acides aminés de la portion N-terminale a été rapportée comme étant un déterminant important dans la formation du tétramère. Une délétion de cette portion abolit l'expression du canal potassique (Shen et coll., 1993; Li et coll., 1992). Cependant, une délétion correspondant à ce segment chez le canal Kvl.3 murin ou encore chez le canal Kv2. l de rat n'affecte pas la fonction du canal, suggérant que d'autes résidus sont responsables pour l'assemblage en multimère (Aiyar et coll., 1993). Des travaux plus récents démontrent clairement qu'une région appelée Tl «tetramerisation domain l» (Figure 3), située en N-terminale, ainsi que le domaine transmembranaire S 1 sont
directement impliqués dans l'assemblage des canaux K+ (Pfaffinger et DeRubeis, 1995).
1.6.4 Des protéines membranaires dépourvues de peptide signal
La quasi totalité des protéines exprimées au niveau de la membrane plasmique possèdent initialement un peptide signal qui permet leur ancrage à la membrane du réticulum endoplasmique et de l'appareil de Golgi et leur ciblage. Fait étonnant, les canaux ioniques sont dépourvus d'une telle structure et la question demeure toujours sans réponse concernant leur mécanisme de ciblage fonctionnel à la membrane plasmique. Cependant, un certain nombre de résultats récents ont permis d'avancer quelques hypothèses.
1.6.4. l Les composantes associées
L'expression de canaux K+ dans des systèmes hétérologues montre des différences de propriétés électrophysiologiques, de régulation et de maturation post-transcriptionelle. Plusieurs travaux sur des canaux reconstitués ont montré que les caractéristiques électrophysiologiques restent globalement identiques, quoique que les temps d'inactivation et d'activation peuvent souvent varier d'un facteur 10. En fait, des travaux du groupe de Lester (communication au congrès 4th Annual Neuropharmacology Conference, Official Satellite Symposium on Potassium Channel, Washington DC., 14-16 novembre 1996) montrent que le temps d'activation du canal GIRK change suivant le système d'expression, 2s chez l'ovocyte, 0.8s chez les cellules CHO et 0.5s chez les cellules natives de l'oreillette.
Plusieurs groupes ont également montré que la régulation d'un canal exprimé dans un autre type cellulaire peut s'avérer restreinte et même nulle (Zong et coll., 1995). Ces résultats suggèrent qu'il existe peut-être une implication de composantes cellulaires pour la fonction du canal, lesquelles seraient absentes chez le système hétérologue d'expression ou que l'environnement lipidique du canal transfecté soit différent et par le fait même. le canal se retrouve dans une conformation altérée.
1.6.4.2 La sous-unité Kvs
La purification récente du récepteur ex-dendrotoxine à partir du cerveau de rat et de boeuf a montré que ces deux canaux s'associent in vivo avec une protéine soluble appelée
KvB (Rettig et coll., 1994). Il a été montré que ces récepteurs ex-dendrotoxine correspondent à des membres de la famille Kvl Shaker (Parcej et Dolly, 1989). Cette protéine de 4lkDa (367 acides aminés) ne possède pas de segments transmembranaires d'après le profil d'hydropathie ni de sites de N-glycosylation par essai de traduction in vitro
(Scott et coll., 1990). Par l'analyse de sa séquence, on a observé plusieurs sites putatifs de phosphorylation par la PKC et la PKA. Sa structure prédite serait hélicoïdale (Figure 2).
A priori, on croyait que les canaux K+ fonctionnels consistaient en une homo- ou hétéromultimérisation de sous-unités ex. Par la suite, la copurification de sous-unités ex et
KvB a suggéré qu'il existe des protéines associées pouvant avoir un rôle à jouer dans la diversité des canaux K +. Les expériences de contransfection ont permis d'obtenir des
informations sur un rôle possible de cette sous-unité.
Trois sous-unités KvB ont été clonées, KvBl, KvB2 et KvB3 (Rettig et coll., 1994; Morales et coll., 1995; Heinemann et coll., 1995). L'alignement des séquences nucléotidiques révèlent qu'elles sont identiques à 85% dans les 329 résidus d'acides aminés dans la région C-terminale et très divergeantes en N-terminal. De plus, le gène de la sous-unité Kv.81 peut générer des variants d'épissage alternatif, KvBI. l, KvBI.2 et KvBl.3 actifs (Leicher et coll., 1996).
Les expériences de cotransfection du canal K v 1.1 et de la sous-unité K v B 1. 1, un variant d'épissage alternatif de Kv.Bl, chez Xenopus leavis ont montré que l'inactivation lente de ce «delayed rectifier» se comportait en inactivation rapide de type A. Par ailleurs, des travaux de Shi et collaborateurs (1996) ont clairement montré que l'efficacité d'expression du canal est favorisée par la coexpression d'une protéine de type KvB. Le fait qu'il soit possible d'exprimer un canal K + dans un système héterologue en absence de cette sous-unité suggère qu'elle n'est pas essentielle à l'expression du canal mais plutôt à sa stabilité membranaire. Malgré que l'expression membranaire du canal soit augmentée dans la majorité des cas, comme il a été montré par des expériences d'immunolocalisation, le courant global n'est pas affecté (communication personnelle de Dr. Trimmer). Le «knockout» du gène de la sous unité K v .B 1. 1 n'a pas de conséquences létales chez la souris. Ainsi, les sous-unités KvB joueraient le rôle de chaperones pour les canaux en se liant à la portion N-terminale du canal appelée Tl via sa portion N-terminale (Figure 3) (lsom et
coll., 1994; Sewing et coll., 1996) mais, contrairement aux chaperones conventionnelles. elles restent associées au canal où elle pourrait jouer, dans certains cas, un rôle additionnel. celui de moduler l'inactivation du canal (Rettig et coll., 1994).
La sous-unité KvB2 est ubiquitaire, très conservée et abondante. Par contre. les études de cotransfection avec le canal K v 1.1 ont clairement montré qu'elle n'a pas d'effet sur l'inactivation des canaux K+ connus mais augmente le taux d'expression des canaux à la surface membranaire. Ceci suggère qu'à défaut d'avoir un rôle d'inactivation sur un canal non identifié, le rôle majeur des sous-unités KvB serait de chaperone. Des études d'inactivation du canal Kvl.5 ont montré qu'il suffit d'avoir les résidus de la sous-unité KvB qui interagissent avec la portion N-terminale pour qu'il y ait inactivation (communication du Dr.Pongs au 4th Annual Neuropharmacology Conference, Official Satellite Symposium on Potassium Channel, Washington OC., 14-16 novembre 1996). La stoechiométrie proposée serait 4 sous-unités KvB pour 4 unités a (un cariai fonctionnel) (Parcej et coll., 1992)
COI INSIOE
Figure
2:Représentation schématique de la sous-unité Kvp. Sa structure prédite est hélicale et l'on croit qu'elle se loge près de la portion N-terrninale du canal (Isom et coll., 1994).,.
A
B
SS
-
. :-..
-in PDPLRNBYPP DRNRPSPDGI LYYYQSGGRL RRPVNVSLDV
T18 PADBl:llFYQL GDBAMBRPRB DBGPIDBBlt m
KvJU Kvl.l 118- KFYELGEEAMEKFREDE -134 Kvl.2 11'- RFYELGEEAMEMFREDE -130 Kvl.3 135- RFYQLGEEAMEKFREDE -151 Kvl.4 259- KFYQLGEEALLKFREDE -215 Kvl.S 192- RFYOLGDEAMERFREDE -208 Kvl.6 122- RFYQLGDEALAAFREDE -138 c:oasened .sequeace -FY-LG-EA---FREDE
••• •
••••
Figure 3:A) Région et séquence d'interaction de la sous-unité Kvp avec le canal K+ voltage-dépendant. Cette interaction se ferait sur le site TIB plus précisement (tetramerisation domain 1). B) Séquences conservées d'interaction de la sous-unité Kvp présentent chez les différents membres de la famille Shaker (Sewing et coll., 1996).
(
1.6.4.3 La protéine PSD-95
Des travaux de Kim et collaborateurs (1995) ont montré que des protéines de la famille des guanylates kinases se lient à la portion C-terminale des canaux K + de type Shaker. Cette famille inclut la protéine PSD-95 (SAP-70). Cette protéine est composée de 3 domaines PDZ (PDZl, PDZ2 et PDZ3), un domaine SH3 et un domaine guanylate kinase qui, jusqu'à maintenant, ne s'est pas averé fonctionnel (Figure 4). Le domaine de reconnaissance de la protéine PSD-95 par les canaux se fait à la séquence T/SDV dans la portion C-terminale. Des études de cotransfection ont montré que la protéine PSD-95 entraîne la formation des microaggrégats de canaux à la surface membranaire. Ici également, l'expression membranaire des canaux est favorisée par la coexpression mais le courant global n'est pas affecté. La stoechiométrie proposée est celle d'une protéine PSD-95/sous-unité KvB (4:4). L'avenue future d'un rôle physiologique de la PSD-95 est sûrement le recrutement de protéines adaptatrices riches en résidus proline par la liaison au domaine SH3 présent sur la protéine PSD-95.
Ces nouvelles informations sur les rôles des protéines KvB et PSD-95, laissent supposer que la protéine KvB aurait un rôle plutôt de chaperonne tandis que la protéine PSD-95 servirait au recrutement de protéines à la membrane (communication personnelle du Dr. Jim Trimmer).
POZ1 POZ2 • f51
''°
24 PSD-95POZ3
ltt 113 GK
Figure 4:Représentation schématique de la protéine PSD-95. Elle est composée d'un domaine SH3, 3 domaines PDZ (PDZ1,PDZ2 et PDZ3) et 1 domaine guanylate kinase (Kim et coll., 1995).
1. 7 La modulation de l'activité des canaux K+
1.7.1 Les divers méc;mismes de régulation des
canaux
K+La modulation de l'activité des canaux K+ peut être affectée par plusieurs mécanismes. Par exemple, un canal ligand-dépendant va s'activer suite à l'interaction avec son ligand. L'activité ionique peut également être influencée par des facteurs comme le pH, la liaison du
ea
2+ au canal et le blocage du canalpar
d'autres ions ou par une portion du canal lui-même. Le mécanisme de la modulation des canaux le plus étudié et le plus répandu est la phosphorylation. La phosphorylation sur des résidus sérine, thréonine et tyrosine est un mécanisme ubiquitaire pour la régulation de l'activité des canaux et pour les processus cellulaires dans lesquels les canaux sont impliqués. Il existe à présent des résultats qui montrent que les canaux sont des substrats pour les kinases et les phosphoprotéines phosphatases, et que la phosphorylation des canaux peut influencer leurs propriétés électriques dans les neurones et dans d'autres types cellulaires (Levitan, 1994; Lewis et Cahalan, 1995).1. 7 .1.1 La régulation des canaux K + via l' AMPc et le calcium chez le lymphocyte
Il y a maintenant une abondance de travaux qui montrent que les canaux voltage-dépendant sont régulés par phosphorylation voltage-dépendante de l' AMPc (Levitan, 1994; Payet et Dupuis, 1992). Chez le lymphocyte B murin, l'addition d' AMPc du côté intracellulaire
diminue la conductance du canal K+ (Choquet et coll., 1987). Par contre, ce même type d'expériences chez le lymphocyte T n'induit pas de changements (Lee et Deutsch, 1990) ou de façon contradictoire, module l'amplitude du courant (Payet et Dupuis, 1992). On attribue ce patron d'effets différentiels par l'absence de messagers ou de composantes cellulaires entre les deux systèmes (Levitan, 1994).
Comme mécanisme de régulation chez le lymphocyte T humain, le canal de type n
est inhibé à une concentration de Ca2+ intracellulaire optimale suite à une élévation de Ca2+ (Bregestovski et coll., 1986).
1.7.1.2 La régulation via la phosphorylation par la PKC, la PKA et les PTK
Les canaux de la famille Shaker possèdent un site potentiel de phosphorylation par une protéine tyrosine kinase (PTK) dans la région N-terminale (RPSFDAILY) (Holmes et coll., 1995). Sa conservation à travers les espèces suggère un rôle important de celle-ci, quoique la délétion de la portion N-terminale n'a pas eu d'effet apparent sur la fonctionnalité du canal (Aiyar et coll., 1993).
Tous les membres de la famille du canal Shaker possèdent un ou plusieurs sites consensus de phosphorylation par la PKC (Ser/Thr-X-Arg/Lys) compris entre les segments S4 et SS et dans la boucle S2-S3 (Kennelly et Krebs, 1991; Payet et Dupuis, 1992). Comme le site de phosphorylation par une PTK, le ou les sites PKC sont fonctionnels et la
phosphorylation affecte l'activité du canal. L'effet des esters de phorbol comme le PMA, un activateur de la PKC (Nishizuka, 1992), résulte en une diminution de l'amplitude du courant du canal Kvl.3 chez le lymphocyte Jurkat suggérant une pbosphorylation. Cet effet est renversé par des inhibiteurs de la PKC (Attali et coll., 1992; Aiyar et coll., 1993; Payet et Dupuis, 1992). ln vitro, le canal Kvl.3 de rat est phospborylé à un ou plusieurs sites (Cai et Douglass, 1993). Par contre, des travaux récents de Bowlby et collaborateurs (1995) qui ont exprimé le canal Kvl.3 dans un système hétérologue suggèrent que la modulation du canal serait plutôt dû à un blocage
par
le second messager DAG indépendament de l'activation de la PKC. De cette façon, l'effet de la PKC ne serait pas direct (Bowlby et Levitan, 1995). Comme plusieurs travaux laissent croire que l'action de la PKC n'est pasdirect ou tout simplement indépendant, ceci suggèrent l'implication d'autres protéines ou facteurs dans la régulation (Aiyar et coll., 1993; Bowlby et coll., 1995). Par exemple, le canal Kvl.3, comme plusieurs autres canaux K+, possède en N-terminal une région riche en résidus proline, 43RYEPLPPSLp52, qui pourrait jouer un rôle dans le recrutement de protéines adaptatrices possédant des domaines SH3 (Tableau 2) (Holmes et coll., 1996).
Par ailleurs, le canal Kvl.3 possède également un site putatif de phosphorylation par la PKA. Ce site est un substrat potentiel comme il a été démontré in vitro et in vivo (Cai et Douglass, 1993; Payet et Dupuis, 1992).
1 accession number)
Il
11 Potassium Channds 1
@iaker-related subfamilr 1
jKvl.2 (human, L02752)
ll
16FGHPQDTYDP, 436PKIPSSP IKvl.3 (rat, Xl6001) ll35RYEPLPP ALPIKvl.3 (human, MSSSIS)
ll
43RYEPLPPSLP !Kvl.5 (rat, M27158)ll
65RPLPPMAIKvl.5 (human, M55513)
ll
65RPLPPLPDPGVRPLPPLPEELPRRP !Kvl.6 (human, XI7622} ll149KPLPSQPlshab-related subfamill 1
1
1Kv2. l (rat, XI6476)
ll
13PPEPMEIV, 562PSPV APLP, 576PTPLLP, 596PLPTSPKFRP1Kv2.2 (rat, M77482) ll21PPEPVEII, 619FLTPVP 1
lshaw-related subfamily 1
1Kv3.l (rat, M68880)
ll
461PRPPQLGSP 11Kv3.2 (rat, M34052) ll56FLPPPLSPPPRPPPLSPVP, 498PP APLASSP, 5S0pPLSPPERLP 1
1Kv3.3 (rat, M84.210-I}
l
33P APTPQPPESSPPPLLPP, 565PRPPQPGSPNYCKPDPPPPPPPHP, 597ppppITPP, 61SPPGPITTHP, 638PPLPAPGEPCP .1Kv3.4 (human, M64676} ll551PQWPREFPNGP 1
Gha/-related subfamilr 1
1Kv4.l (mouse, M64226} rQPLPPAP, 006PJPPANTPDESQPSSP
1 1Kv4.2 (rat, S64320) j21PAVSPMPAPP
1Kv4.3 (rat, lA8619)
ll
21PVANCPMPLAP 1lsma11
K(Ca) channel subfamily 1jhSKl (human, U69883)
ll6
9p ARPSPGSPRGQP. 5211RPPPPPLPPRPGPGP1 1 NMDA Receetor/Channels 1
jNMDA2C (mouse, QO 1098)
ll
942PGPPGQPSPSG\\'RPP. 962PLARRAPQPP ARPQP 1 jmmA2D (rat, L31612)l
: 926PLSPPTTQPPQKPPPPGFPSPP APP 900ppp AKPPPPPQPLPRPPPGPAP,Tableau
l:Tableau résumé des canaux K + possèdant, dans la région N-terminale, une ou plusieurs séquences riches en résidus proline (Holmes et coll., 1996).1.8 La sélectivité ionique
Les canaux ioniques sont des macromolécules qui exercent une sélectivité vis-à-vis les ions. Le concept initial que le diamètre de l'ion était un facteur critique à la sélectivité a été abandonné car les ions sont en fait hydratés en solution et deviennent probablement partiellement deshydratés lors de leur passage à travers le pore ionique. Ainsi, des élements structuraux qui affectent le degré d'hydratation de l'ion pourraient être des facteurs déterminants dans la sélectivité.
Les résidus d'acides aminés chargés qui forment le pore pourraient jouer ce rôle en produisant des interactions électrostatiques avec les ions qui traversent le canal. La déshydratation compensée par des interactions avec les résidus chargés du canal pourrait être un mécanisme de sélection ionique (Eisenman et Hom, 1983).
Les interactions 1l ont également été proposées comme un mécanisme de sélectivité
ionique. En fait, tout résidu d'acide aminé possédant un noyau aromatique comme la tyrosine, le tryptophane et la phénylalanine, pourrait engager une interaction 1l avec l'ion
en transit. L'évidence pour ce mécanisme a été obtenue par mutation des résidus PDAFWW A VVTMTTVGYGDMTPV chez le canal RCKl ce qui a résulté en une baisse de sélectivité (Tytgat, 1994; Kumpf et Dougherty, 1993).
voltage-dépendant, on remarque que la séquence correspondant au pore varie entre le canal sodique, calcique et potassique. Afin d'identifier les résidus d'acides aminés impliqués dans la formation du filtre sélectif, on a procédé à l'alignement des séquences. Celui-ci a montré que des résidus d'acide glutamique conservés dans le canal calcique sont remplacés par des résidus lysine et alanine dans le canal sodique. Si on mute ces résidus alanine et lysine en résidus d'acide glutamique, le canal sodique transforme sa sélectivité pour une préférence calcique. Ces résultats suggèrent que ces résidus sont impliqués étroitement dans la sélectivité (lmoto, 1993).
Chez le canal potassique, il existe une séquence GYG très conservée à l'intérieur du pore. Cette séquence se retrouve même chez les plantes. La délétion de YG chez le canal RCKI affecte la sélectivité envers le potassium, suggérant une fois de plus que ces résidus consituent la signature du canal. Il est donc possible d'altérer la sélectivité ionique par de faibles changements dans la séquence du canal.
Ainsi, la dimension du pore et les interactions entre les ions et le canal sont deux paramètres importants pour la sélectivité. Il est probable que les données définitives pour comprendre la sélectivité ne le seront qu'à partir de la solution de la structure tertiaire des canaux.
Des analyses récentes de microscopie électronique de canaux K+ purifiés ont été la première confirmation directe que les canaux s'assemblent en une structure tétramérique (Li et coll., 1994). De plus, les diverses expériences de mutagénêse dirigée ont clari~é en
partie le rôle de chacune des régions tra.nsmembranaires. A défaut d'une structure crystalline, Dureil et Guy (1992) ont proposé un modèle pour les canaux K+ voltage-dépendant. Quoique que le modèle soit consistant avec les données expérimentales, plusieurs aspects restent encore inconnus. Cependant, le modèle moléculaire est le seul outil du genre disponible pour 1 'instant et demeure un bon guide pour les études de structure-fonction. Récemment, les mêmes auteurs ont proposé un modèle plus détaillé sur la structure du pore des canaux K+ voltage-dépendant (Dureil et Guy, 1996)
Le modèle de Dureil et Guy (1992) est illustré à la figure 5. On remarque en a la disposition des régions transmembranaires dans la bicouche lipidique et en b, la façon avec laquelle elles s'assemblent entre elles. Les représentations cet d, montrent le canal dans son
état fermé (c) et ouvert (d). Fait à noter, lors de l'activation du canal, le modèle prédit une expulsion des régions transmembranaires S4 vers l'extérieur du canal (d). Finalement, en e et
r,
le modèle représente le canal fermé (e) et ouvert (f), vu du côté extracellulaire.Dureil et Guy ont utilisé une approche hiérarchique pour développer le modèle structural. D'abord, le clonage des canaux apporte la séquence d'acides aminés. Par la suite, les graphiques d 'hydropathie déterminent les régions plus hydrophobes. A partir de ceci, Dureil et Guy ont proposé une topologie transmembranaire de la protéine et postulé
~ quels segments sont impliquées dans les processus tel le gating, l'inactivation, la sélectivité
ionique et la liaison des diverses drogues. Par la suite, ils ont proposé une orientation et une représentation générale des segments transmembranaires. Finalement, les auteurs ont fait appel aux logiciels de graphisme et de modélisation chimique par ordinateur pour spécifier
la position de chaque atome. Au fur et à mesure que de nouvelles données expérimentales ont été connues, le modèle a pu être raffiné et devenir de plus en plus précis.
c
Figure S:Représentation schématique du canal Shaker obtenu par modélisation. En
a), on retrouve les 6 segments transmembranaires et la région P (H5) qui se regroupent entre elles (b). En c) nous avons une vue transversale du canal dans la bicouche lipidique nous montrant le canal fermé (c) et ouvert (d). Une vue aérienne est représentée pour le canal fermé (e) et ouvert (f) (Durell et Guy, 1992).
1.10 L'inactivation des canaux
Les canaux existent dans plusieurs conformations ou états. Comme illustré à la figure 6, un canal, suite à un stimulus approprié, s'ouvre ou se ferme de façon aléatoire. Par contre, il arrive qu'un canal se referme avant la fin du saut de potentiel. Le canal se trouve alors dans un état dit inactivé. Cet état diffère de l'état fermé: les canaux inactivés ne se réouvrent pas si on prolonge le saut de potentiel dépolarisant.
Les canaux voltage-dépendant existent dans au moins 3 conformations différentes, un état fermé (F), un état ouvert conducteur (0) et un état non conducteur, inactivé (l). La transition F à 0 correspond à l'activation du canal tandis que la transition 0 à I correspond à son inactivation. Deux options s'offrent pour réouvrir le canal lorsque celui-ci est dans un état inactivé. La première est celle de revenir au potentiel de repos et d'attendre pendant quelques temps, et la deuxième est celle d'induire une hyperpolarisation de la membrane et revenir au potentiel de repos.
Jusqu'à maintenant, pour les canaux K+ voltage-dépendant, on croit qu'au moins 3 régions du canal sont impliquées dans l'inactivation: la région N-terminale, la région P et la région transmembranaire S6. L'inactivation rapide (type N) se produit en quelques millisecondes et implique la région N-terminale qui viendrait bloquer le pore suivant le modèle •ball and Chain• (Hoshi et coll., 1990). Ce type d'inactivation est bloqué par le TEA ajouté de façon externe ou interne (MacKinnon et Yellen,
1990).
Il existe également,..
•=•Na+
•••
••
fermeF
;;:::::::::==0
:;::::::=:=:I
•
•••
•••
•
•
2 ouvert••
••••
··:
3 inactivè gradient èlectrochimioueFlgure
6:Schématisation simplifiée des états du canal Na+. Le canal existe dans au moins 3 conformations: fermé (F), ouvert (0) et inactivé (1). La conformation du canal dans ces différents états est représentée (Hammond et Tritsch, 1990).le mode d'inactivation de type C caractérisée par une inactivation lente (plusieurs secondes) dont le mécanisme serait un changement global de la structure de la protéine. Ce type d'inactivation n'est pas affectée par le TEA ajouté intracellulaire. Il est donc possibl~ de
discerner entre une inactivation de type C et de type N par l'ajout de TEA du côté
intracellulaire. L'inactivation de type P implique le pore ionique (lverson et Rudy, 1990). Il existe également l'inactivation de type A qui implique aussi la portion N-terminale, mais qui produit une inactivation lente.
On croit que les résidus d'acides aminés MAA V AGLYGLGEDRQHRKKQ de la portion N-terminale des canaux K+ ont un très grand rôle à jouer puisque leur délétion enlève l'inactivation rapide tandis que leur ajout rétablit cette inactivation (7.agotta et coll., 1990). Les résidus en caractères gras seraient impliqués dans la formation d'une structure globulaire (balle) qui interagirait avec la portion S4-S5 (lsacoff et coll., 1991). Des mutations dans les segments S4 et SS aux résidus LQILGRTLKASMREL altèrent les cinétiques d'inactivation, suggérant qu'il s'agit peut-être de la région réceptrice de la partie globulaire (lsacoff et coll., 1991). Par exemple, le remplacement du résidu glutamate (MREL) par un résidu d'acide aspartique diminue drastiquement l'inactivation (lsacoff et coll., 1991). Les résidus cibles sont surtout le dimère EL qui lorsque muté diminue la cinétique d'inactivation, et A qui lorsque mutée, augmente la cinétique d'inactivation. L'inactivation serait une conséquence de l'obstruction du pore par la balle (mécanisme 'ball and chain').
Des mutants de délétions du canal Kvl.2 dans la région C- ou N-terminale retarde l'inactivation lente de type C, tandis qu'une délétion des régions N- et C-tenninale entraîne des composantes d'inactivation identiques au canal natif (VanDongen et coll., 1990). Ces résultats suggèrent que d'autres résidus ailleurs dans le canal seraient responsables de l'inactivation.
Il a été rapporté que l'oxydation de résidus cystéines avait comme conséquence d'inactiver les canaux Kvl.4 et le Kv3.4 (Ruppersberg et coll., 1991). Par ailleurs, des travaux de Boland et collaborateurs (1994) ont montré que ces résidus cystéines chez les canaux de la famille Shaker ne sont pas essentiels à l'activité de ces canaux.
1.11 La pharmacologie des canaux K+ voltage-dépendant
La sensibilité à différents agents pharmacologiques représente une caractéristique propre à chaque canal ionique. Il existe une multitude de drogues bloquant les canaux K+, plus au moins spécifiques à ceux-ci, et ce à différentes concentrations. Les drogues les plus étudiées sont le TEA, la charybdotoxine, la 4-aminopyridine et la dendrotoxine.
1.11.1 Le TEA
Le TEA se fixe sur le canal K+ du côté interne et externe. Des études comparatives de divers types de canaux K+ versus leur sensibilité au TEA ont suggéré que la région du
pore était un canditat plausible pour le site de liaison du TEA (Pongs, 1992) (Figure 7). Le TEA ajouté de manière externe se fixe dans une stoechiométrie 1 : 1. Le résidu tyrosine de la séquence GYGDXYPXX (en position 19 de la figure 7) a une très grande influence sur cette sensibilité. La mutation de ce résidu par un résidu lysine ou arginine rend le canal insensible au TEA (Kavanaugh et coll., 1991).
Un autre site de fixation du TEA a été découvert à l'intérieur du pore et la stoechiométrie est également 1: 1. Ce site, TMTIVGYG, peut difficilement être muté sans altérer la sensibilité au TEA (Yellen et coll., 1991). De plus, la fixation du TEA interne est dépendante du voltage, devenant moins sensible à des potentiels plus positifs (Yellen et coll., 1991).
1. 11. 2 La charybdotoxine
La charybdotoxine est une toxine du scorpion Heiurus quinquestriatus. Cette drogue est un bloqueur spécifique des canaux K+ activés par le Ca2+. Elle inhibe également les
canaux K+ voltage-dépendant de la famille Shaker. Son action se fait via sa fixation au niveau du pore, du côté externe en bloquant l'entrée du canal. Une chimère entre la boucle S5-S6 d'un canal sensible à la charybdotoxine et le reste d'un canal insensible à la charybdotoxine rend celui-ci sensible à la toxine (Stocker et coll., 1991). La charybdotoxine est chargée positivement et semble se lier aux groupements chargés négativement à la surface externe du canal. Le résidu d'acide glutamique en position 422 aurait un très grand
t
Figure 7: Représentation schématique du porc des canaux K + voltage dépendant. Les résidus pointillés sont importants pour la sensibilité au TEA externe, les résidus hachurés obliques sont impliqués dans la sensibilité au TEA interne et les résidus hachurés perpendiculairement sont impliqués dans la sensibilité à la charybdotoxine (Pongs, 1992).
rôle à jouer dans cette sensibilité en stabilisant la liaison de la charybdotoxine via une influence électrostatique.
1. 11. 3 La 4-aminopyridine
Le bloqueur classique 4-aminopyridine inhibe les canaux K + avec des affinités faibles (Kd, 0.2 à 9 mM). Des études récentes ont montré que le site de liaison est formé de l'association entre la portion N-terminale de SS et la partie C-terminale de S6 (Kirsch et coll., 1992).
1.11.4 La dendrotoxine
La dendrotoxine est un peptide du venin du serpent mamba. Comme la charybdotoxine, la dendrotoxine obstrue le pore et est constituée de résidus chargés positivement. Quoique les sites de fixation de la dendrotoxine soient différents de la charybdotoxine, quelques sites se chevauchent. Plusieurs des mutations qui affectent la sensibilité à la charybdotoxine affectent aussi la sensibilité à la dendrotoxine (Stocker et coll., 1991).
1.12 Le canal K+voltage-dépendant lymphocytaire Kvl.3