HAL Id: tel-03140341
https://tel.archives-ouvertes.fr/tel-03140341
Submitted on 12 Feb 2021HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires
Caractérisation du découplage des fonctions des cellules
natural killer au cours des infections par les virus de la
dengue, du zika et du chikungunya
Christopher Maucourant
To cite this version:
Christopher Maucourant. Caractérisation du découplage des fonctions des cellules natural killer au cours des infections par les virus de la dengue, du zika et du chikungunya. Immunologie. Sorbonne Université, 2019. Français. �NNT : 2019SORUS274�. �tel-03140341�
THESE DE DOCTORAT SORBONNE UNIVERSITE
Spécialité Immunologie
Ecole doctorale Physiologie, Physiopathologie et Thérapeutique (ED 394)
Présentée par
Mr Christopher MAUCOURANT
Pour obtenir le grade de
DOCTEUR DE SORBONNE UNIVERSITE
« CARACTERISATION DU DECOUPLAGE DES FONCTIONS DES CELLULES NATURAL KILLER AU COURS DES INFECTIONS PAR LES VIRUS DE LA
DENGUE, DU ZIKA ET DU CHIKUNGUNYA »
Soutenue le 15 Novembre 2019
Devant le jury composé de :
Dr. Vincent VIEILLARD, Directeur de thèse Dr. Pierre ROQUES, Rapporteur
Dr. Eric LEROY, Rapporteur Dr. Anne CAIGNARD, Examinatrice Dr. Vincent MARECHAL, Président du Jury
Table des matières
REMERCIEMENTS ... 4 ABREVIATIONS ... 5 RESUME EN FRANÇAIS ... 8 ENGLISH SUMMARY ... 9 INTRODUCTION ... 9 PREAMBULE. ... 10A) DENGUE, ZIKA ET CHIKUNGUNYA : UNITE ET DIVERSITE DE TROIS ARBOVIRUS ... 11
1) DECOUVERTES ET HISTORIQUE DES GRANDES EPIDEMIES. ... 14
1.1) Découverte, émergence et historique du virus Zika (ZIKV) ... 15
1.2) Découverte, émergence et historique du virus de la Dengue (DENV) ... 19
1.3) Découverte, émergence et historique du virus du Chikungunya (CHIKV) ... 22
2) SYMPTOMOLOGIE, THERAPEUTIQUE ET STRATEGIES VACCINALES ET DIAGNOSTIC: ... 27
2.1) Symptomologie associée au virus Zika ... 27
2.2) Symptomologie associée à l’infection par le virus de la dengue ... 27
2.3) Symptomologie associée à l’infection par le virus du Chikungunya ... 28
2.4) Stratégies thérapeutiques, prévention et diagnostic : ... 30
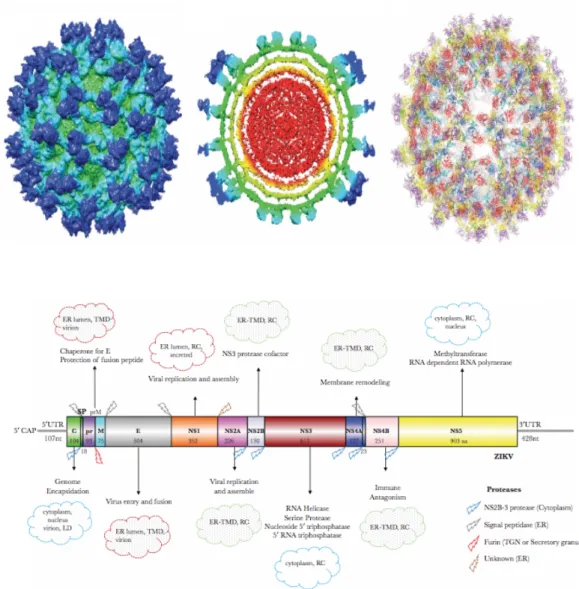
3) STRUCTURE ET TROPISME CELLULAIRE ET REPLICATION ... 38
3.1) Structure Générale des flavivirus : DENV et ZIKV ... 38
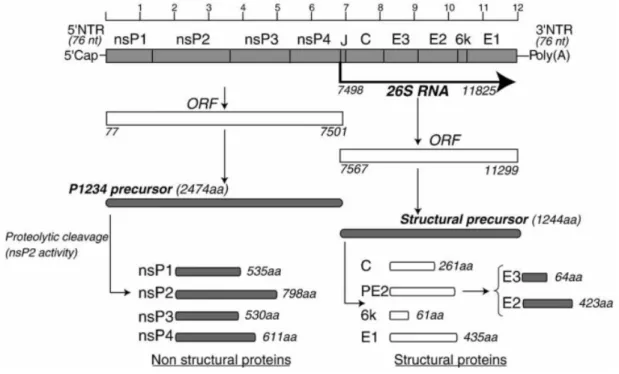
3.2) Structure générale du CHIKV : ... 39
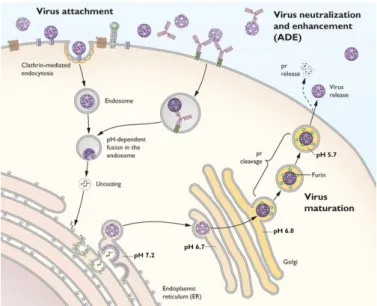
3.3) Réplication Virale ... 41
3.4) Tropisme cellulaire : ... 44
3.5) Récepteurs cellulaires ... 46
4) PHYSIOPATHOLOGIE ET REPONSE IMMUNITAIRE ... 48
4.1) Physiopathologie de la réponse à DENV ... 48
4.2 ) Physiopathalogie associée à l’infection par ZIKV ... 55
4.3) Physiopathologie de l’infection par CHIKV : ... 60
4.4) Réponse immunitaire innée anti-DENV, ZIKV et CHIKV : ... 62
4.5 ) La réponse immunitaire adaptative : ... 70
B) LES CELLULES NATURAL KILLER ... 82
1) PHENOTYPE ET MORPHOLOGIE DES CELLULES NK ... 83
2) DEVELOPPEMENT DES CELLULES NK ... 84
3) LES RECEPTEURS DES CELLULES NK ... 88
3.1) Les récepteurs de la super famille des immunoglobulines ... 88
3.2) Les récepteurs de la superfamille des lectines de type C ... 97
3.3) Les co-récepteurs des cellules NK : ... 101
3.4) Les récepteurs aux cytokines/chimiokines: ... 103
4.1) Les fonctions cytotoxiques des cellules NK ... 110
4.2) Les fonctions Immuno-régulatrices des cellules NK : ... 113
4.3) Interactions avec l’immunité adaptative. ... 115
4.4) La réponse NK au cours des infections virales et plus particulièrement au cours des arboviroses. ... 117
OBJECTIFS ... 120
RESULTATS ... 124
PROJET 1 :ETUDE DE LA REPONSE NK OBSERVEE AU SEIN DES CELLULES NATURAL KILLER AU COURS DES INFECTIONS PAR LE VIRUS DE LA DENGUE, DU CHIKUNGUNYA ET DU ZIKA ... ERREUR !SIGNET NON DEFINI. 1.A : Etude des interactions cellules NK/cellules infectées par le sérotype 2 du virus de la Dengue.. ... 124
1.B) Etude des interactions cellules NK/cellules infectées par le virus du Chikungunya.. ... 163
1.C) Etude de la réponse NK dirigée contre ZIKV ex vivo chez des patients et étude du cross-talk NK/mDCs infectées par ZIKV in vitro. ... 184
PROJET 2 :EXPLORATION DU PHOSPHOPROTEOME DES CELLULES NK AU COURS DES INFECTIONS PAR LES VIRUS DE LA DENGUE (DENV-2) ET DU CHIKUNGUNYA : ... 218
DISCUSSION & PERSPECTIVES ... 230
A) LA REPONSE NK DIRIGEE CONTRE LE SEROTYPE 2 DU VIRUS DE LA DENGUE : ... 230
B) LA REPONSE NK DIRIGEE CONTRE LE VIRUS DU CHIKUNGUNYA. ... 234
C) LA REPONSE NK CONTRE LE VIRUS ZIKA. ... 238
CONCLUSION ... 241 BIBLIOGRAPHIE. ... 242 ANNEXE 1 : ... 282 ANNEXE 2 : ... 297 ANNEXE 3 :………327
Remerciements
Merci à toi Vincent de m’avoir accueilli au sein de ton laboratoire, de m’avoir formé et soutenu à chaque instant. Merci à Nadine Tarantino, notre technicienne nationale, sans qui je serais sérieusement dans la * (Censuré). Tu as sauvé ma thèse, merci pour ton soutien, pour t’être formée au trieur…juste pour moi. Merci à Véronique Anne, Mélie, Catherine, Gabriel, Cecilia et Baptiste pour les cafés, les conseils, les rigolades et les q-PCR. Je n’oublierai jamais tous les moments passés ensemble.
Merci à vous, Anne Caignard, Eric Leroy, Pierre Roques et Vincent Maréchal d’avoir accepté d’être membre de mon jury, pour vos conseils ainsi que pour l’aide et le temps que vous avez consacré à ce travail. Merci beaucoup.
Merci à Niklas Björkström pour la confiance que tu éprouves à mon égard et pour m’ouvrir les portes d’une aventure extra-ordinaire de 4 ans en Suède.
Merci à Martine Staudenman sans qui jamais cette aventure n’aurait pu être possible. Merci infiniment d’avoir pris cette décision qui me permet d’être là aujourd’hui…il y a déjà 8 ans de cela.
Je remercie également tous ceux qui m’ont soutenu à chaque instant, sans relâche. Il y a toi Jeanne, qui m’accompagne depuis déjà quelques années. Sans toi je n’aurai probablement jamais fini. Merci pour tout et notement d’avoir pris le temps de m’aider à corriger. Merci à toi Yan à qui je dédicace mon futur 1’40’’90 en footing. Tu m’as appris pleins de trucs, notamment que c’est pas parce qu’on est pas prêts qu’on ne peut pas souffrir de Sayanite aigüe. Enfin il y a vous, l’Elephant Team ! Heureusement qu’il y avait le rapport de Barnabé pour me rappeler qu’en fait, je ne m’en tirai pas si mal que ça ! Anne, je suis une quiche en ping et en bad, mais merci quand même pour toutes ces parties. Ça fait du bien avant des échéances importantes. Quant à toi Nico, merci de m’avoir destressé ! Ton stress est
contagieux, mais bizarrement, il rappelle à quel point ça sert à rien de se mettre la pression. Merci à tous !
Abréviations
ADN Acide Désoxyribonucléique
ADCC Antibody-dependent cell cytotoxicity ADE Antibody Dependant Enhancement AICL Activation-Induced-C type-Lectin ALAT Alanine Transaminases
AP-1 Activator Protein 1 ARN Acide Ribonucléique ASAT Aspartate Transaminases
CBM : Card11 (carma1), Blc-10, Malt-1 CD Cluster de Différenciation
CDC Center for disease control CHIKV Virus Chikungunya
CIRMF Centre International de Recherches Médicales de Franceville CMH Complexe Majeur d’Histocompatibilité
CRP Protéine C Réactive
CPA Cellules Présentatrices d’Antigène DAG Diacylycérol
DC Dendritic Cell
DC-SIGN Dendritic Cell-Specific Intercellular adhesion molecule-3- Grabbing Nonintegrin
DENV Virus de la Dengue
DNAM DNAX Accessory Molecule EBV Virus d’Epstein-Barr
EBOV Ebola Virus ECP Effet Cytopathogène
EDx : Domaine x de la protéine d’enveloppe ELISA Enzyme-Linked Immunosorbent Assay FasL Ligand Fas
Fc Fraction Cristallisable
GM-CSF Granulocytes Macrophages-Colony Stimulating Factor GP Glycoprotéine
HCMV Human CytoMegalo Virus
HLA Human Leukocyte Antigen IFN Interféron Ig Immunoglobuline IgG Immunoglobuline G IgM Immunoglobuline M IL Interleukine
ILT Immunoglobulin Like Transcript ISG Interferon Stimulating Genes
ITAM Immunoreceptor Tyrosine based Activation Motif ITIM Immunoreceptor Tyrosine based Inhibition Motif ITSM immunoreceptor tyrosine-based switch motif INRS Institut National de la recherche et de sécurité InVs Institut de veille sanitaire
IP3 Triphosphoinositol
KIR Killer cell Immunoglobulin-like Receptor KO Knock Out
LB Lymphocyte B
LIR Leukocyte Ig-Like Receptor LPS Lipopolysaccharide
LT Lymphocyte T
LTc Lymphocyte T Cytotoxique
MCP-1 Monocyte Chemoattractant Protein-1 MIC MHC class I chain-related protein A MIP Macrophage Inflammatory Protein Mo-DC Monocytes derived dendritic cells MTOC Centre organisateur des microtubules
NASBA Nucleic Acid Sequence Based Amplification NCR Natural Cytotoxicity Receptors
NFκB Nuclear Factor-kappa B NK cellules Natural Killer
OMS Organisation Mondiale de la Santé PAMPs Pathogen-Associated Microbia Pattern PBMC Peripheral Blood Mononuclear Cells PBS Phosphate Buffered Saline
PFU Particle Forming Unit
PIP2 Phosphatidylinositol-4,5-bisphosphate PIP3 Phosphatidylinositol-3,4,5-Triphosphate PKC-q Protéine Kinase C q
PLC-g Phospho-Lipase C g
RANTES Regulated on Activation Normal T Expressed and Secreted RT-PCR Reverse Transcription-Polymerase Chain Reaction
SCID Severe Combined Immunodeficient Disease
SAP signalling lymphocyte activation molecular [SLAM] associated protein SHP x Src-homology 2 domain (SH2)-containing x
SIDA Syndrome d’Immuno-Déficience Acquise SYK Spleen Tyrosine Kinase
ZAP-70 Zeta-chain-associated protein kinase 70 SZC syndrome congénital de Zika
TCR T-Cell Receptor TGF Tumor Growth Factor TNF Tumor Necrosis Factor
TRAIL Tumor necrosis factor-Related Apoptosis-Inducing ligand ULBP UL16 Binding Protein
VHB Virus de l’Hépatite B VHC Virus de l’Hépatite C
VIH Virus de l’Immunodéficence Humaine VLP Virus-Like Particles
WHO World Health Organization ZIKV Virus du Zika
Résumé en Français
L’histoire récente a été marquée par l’apparition de nouvelles épidémies de Dengue (DENV), de Chikungunya (CHIKV) et de Zika (ZIKV). Si ces maladies sont principalement asymptomatiques, elles peuvent entraîner toute une palette de complications graves, allant des arthralgies chroniques handicapantes à des formes hémorragiques pouvant conduire au décès du patient (majoritairement DENV) en passant par des microcéphalies (majoritairement ZIKV) et des syndromes de Guillain-Barré (majoritairement CHIKV et ZIKV). Ces récentes épidémies ont classé ces maladies dans la catégorie « à déclaration obligatoire » et en font une priorité sanitaire pour l’Organisation Mondiale de la Santé (OMS). A ce jour, aucun traitement spécifique n’est disponible contre ces maladies, rendant ainsi la compréhension de l’immunité dirigée contre ces virus une priorité. Bien que peu de choses soient connues dans l’immunité dirigée contre ces virus, certaines études ont permis de montrer l’implication de l’immunité innée dans la clairance virale du DENV et du CHIKV, tandis que ZIKV n’avait, jusqu’à l’apparition de symptômes majeurs, que peu mobilisé la communauté scientifique. Parmi les composants de l’immunité innée, les cellules Natural Killer (NK) sont connues pour s’activer sans immunisation préalable et tuer les cellules infectées tout en produisant des cytokines capables d’activer d’autres médiateurs de l’immunité, donnant à ces cellules un rôle central dans la mise en place de l’immunité adaptative. Les premiers travaux menés par notre laboratoire avaient montré que la réponse NK était découplée en réponse à l’infection par DENV ou CHIKV. Ainsi les cellules NK sont uniquement cytotoxiques vis-à-vis de CHIKV et uniquement sécrétrices de cytokines contre DENV. Afin de mieux comprendre ce « découplage fonctionnel » nous avons mis au point des modèles d’études in vitro de co-culture entre des cibles infectées et des cellules NK autologues. Ces modèles nous ont permis d’identifier les couples ligands-récepteurs mis en jeu au cours de ces infections et de caractériser les voies de signalisation impliquées dans ce découplage fonctionnel.
De plus, dans le cadre du programme ZIKALLIANCE, nous avons étudié la réponse des cellules NK chez les patients infectés par ZIKV et montré des similitudes avec celle dirigée contre DENV. A l’aide d’un modèle d’étude in vitro nous avons également identifié les couples ligands/récepteurs qui sont impliqués dans ces réponses.
L’ensemble de ces données nous a permis d’apporter de nouveaux éléments clefs dans la réponse NK aux arbovirus et de caractériser les mécanismes cellulaires et/ou moléculaires qui sont impliqués dans la mise en place du découplage fonctionnel observé au cours de ces réponses.
English Summary
Recent history has been marked by major outbreaks of Dengue (DENV), Chikungunya (CHIKV) and Zika (ZIKV). While these diseases are mainly asymptomatic, they can lead serious complications, from chronic disabling arthralgia to hemorrhagic forms that can lead to the death (mainly DENV), as well as microcephaly (mainly ZIKV) and Guillain-Barré syndrome (mainly CHIKV and ZIKV). These recent epidemics have classified these diseases as "notifiable diseases" and as Public Health Emergency of International Concern by the World
Health Organization (WHO). To date, no specific treatments are available for these diseases,
making understanding immunity to these viruses a priority. While, little is known for these viruses, it was shown the involvement of the innate immunity in the viral clearance of DENV and CHIKV. For ZIKV, before the recent outbreaks this virus was considered as not a priority. Among the innate immunity cells, Natural Killer (NK) cells are known to be activated without prior immunization. Generally, in response to an infection, NK cells are cytotoxic and produce an array of cytokines that play a decisive role in the development of the adaptive immunity. Several studies carried out by our laboratory had shown “functional decoupling” of NK cells in response to DENV and CHIKV infections : NK cells were only cytotoxic against CHIKV and only producer of cytokines in DENV infections. In order to understand this unusual mechanism, we have carried out in vitro co-culture models between infected-targets and autologous NK cells to identify the ligand/receptor pairs involved in these infections and to characterize the signaling pathways involved in the “functional decoupling”.
In addition, as part of the ZIKALLIANCE program, we have analyzed the response of NK cells in patients infected by ZIKV and observed a response similar to that observed in DENV-infected patients. We therefore used an in vitro model to determine the receptor / ligand pairs used in ZIKV.
Altogether, our data bring new elements to the NK cell response against arboviruses, and characterize the unusual cellular and or molecular mechanisms involved in the “functional decoupling”.
Préambule.
Ces dernières années, l’incidence des arboviroses a fortement progressé. En plus de la « réémergence » de la dengue dont on estime à 50 millions de cas par an, et celle du chikungunya pour lesquels de nombreux cas sont survenus ces dernières années (Inde 2006, Nouvelle Calédonie 2013, Polynésie française 2014, Italie 2014, France 2014…), l’épidémie de Zika survenue en 2015 notamment au Brésil a remis ces virus au cœur de l’actualité et correspondent à une préoccupation sanitaire majeure (Institut pasteur).
Si l’infection par le virus du Chikungunya est généralement bénigne avec un taux de mortalité finalement assez faible, elle est généralement associée à des complications réellement invalidantes telles que des arthralgies aiguës et chroniques. (Gerardin P et al., 2008 ; Simon
F et al., 2011) A l’inverse, l’infection par le virus de la dengue entraîne en moyenne 500 000
cas de forme hémorragique conduisant dans 2.5 % des cas au décès. (WHO) Concernant le virus ZIKA, ce sont près de 1 500 000 cas qui ont été déclarés au Brésil en 2015. Bien que la plupart des cas soient asymptomatiques, un certain nombre de complications graves sont observées avec notamment des syndromes de Guillain-Barré entrainant une paralysie ascendante progressive pouvant toucher les muscles respiratoires ainsi que des transmissions de la mère à l’enfant pouvant engendrer de graves anomalies du développement cérébral chez celui-ci. (Institut pasteur).
La présence, de plus en plus importante, dans nos pays des moustiques vecteurs Aedes
albopictus rend la situation d’autant plus préoccupante que de nombreux cas se sont avérés en
France et en Italie, faisant que ces maladies ont été ajoutées à la liste des maladies virales à déclaration obligatoire (Institut pasteur). L’absence de traitements spécifiques pour ces trois virus et de vaccin pour ZIKA et Chikungunya donne un véritable enjeu à la compréhension des mécanismes de la réponse immunitaire dirigée contre ces pathogènes.
A ce jour la réponse immunitaire dirigée contre ces virus est assez faiblement caractérisée. Cependant, au regard de l’évolution de la virémie qui décroit fortement quelques jours après infection et de certaines complications comme la forme hémorragique de la dengue, l’immunité innée semble jouer un grand rôle dans la clairance de ces maladies et/ou dans leur symptomologie. La compréhension de ces mécanismes immunitaires innés semble donc être une étape importante pour la mise au point de médicaments et vaccins contre ces maladies. Parmi les cellules de l’immunité innée, les cellules « natural killer » (NK) semblent être une clé de voûte entre clairance virale et activation de l’immunité adaptative.
Avant d’entamer ces travaux, Caroline Petitdemange et al., (2011, 2016) avaient montré que les cellules NK issues de patients infectés par la dengue étaient, de façons surprenante,
productrices de cytokines mais pas cytotoxiques alors qu’au contraire les cellules NK provenant de patients infectés par le Chikungunya étaient cytotoxiques et peu productrices de cytokines. En plus de la caractérisation des réponse NK associées à l’infection par ZIKA, c’est la compréhension de ce découplage fonctionnel inattendu qui va être au cœur de cette étude. La compréhension des mécanismes cellules/cellules et des voies de signalisation impliquées dans ces réponses pourrait également être un élément important dans le but d’élaborer de nouvelles stratégies thérapeutiques. C’est donc dans l’élaboration de modèles d’études de ce découplage fonctionnel que nous nous sommes concentrés au cours de ces travaux afin de pouvoir déterminer les mécanismes cellulaires impliqués dans la régulation des cellules NK au cours de ces infections aigues, depuis la caractérisation des couples ligands récepteurs jusqu’aux voies de signalisation sous-jacentes à l’engagement de ces récepteurs.
A) Dengue, Zika et Chikungunya : Unité et diversité de trois
arbovirus
Les arbovirus sont des pathogènes viraux transmis par des arthropodes comme par exemple les moustiques, les poux, les puces et les punaises (Coosemans M et al., 1998). Ces pathogènes constituent une priorité sanitaire croissante selon la World Health Organizaton (WHO). L’urbanisation, la pauvreté, la globalisation et les changements climatiques sont reconnus comme des facteurs de propagation de ces arboviroses à travers le monde.
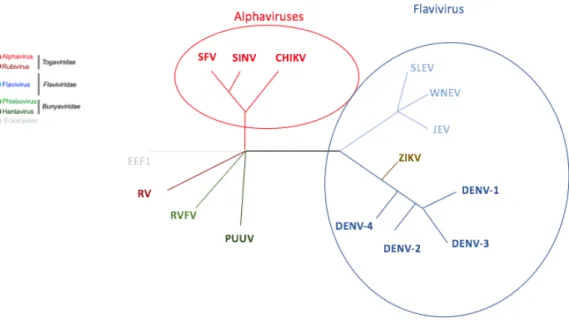
On dénombre plus de 500 arbovirus connus dont seulement une centaine sont pathogènes pour l’homme. Bien que près de 400 arbovirus ne soient pas pathogènes chez l’homme, ils forment dans leur ensemble un réservoir viral important pouvant conduire à la formation de nouveaux pathogènes dans le futur. S’ils sont génétiquement divers, ce sont pour la plupart des virus à ARN répartis principalement dans les régions tropicales mais pas que, comme l’on peut le voir dans la figure 1.
Figure 1 : Répartition mondiale des flavivirus et des alphavirus (Maucourant et al, 2019 ; Annexe 1).
Bagaza virus (BAGV), Bamaga virus (BGV), Banzi virus (BANV), Bouboui virus (BOUV), Dengue virus (DENV), Israel Turkey meningoencephalomyelitis (ITV), Japanese encephalitis virus (JEV), Jugra virus (JUGV), Kokobera virus (KOKV), Lamni virus (LAMV), Murray Valley encephalitis virus (MVEV), Nouanamé virus (NOUV), Rabensburg virus (RABV), Saint Louis encephalitis virus (SLEV), Spondweni virus (SPOV), Tembusu virus (TMUV), T’Ho virus (THOV), Usutu virus (USUV), Wesselsbron virus (WESSV), West Nile virus (WNV), yellow fever virus (YFV) and Zika virus (ZIKV). Alphaviruses : Barmah forest virus (BFV), Chikungunya virus (CHIKV), Mayaro virus (MAYV), O’nyong-nyong virus (ONNV), Ross River virus (RRV), Semliki forest virus (SFV) and Sindbis virus (SINV).
A ce jour, les arbovirus les plus préoccupants au niveau sanitaire font partie de la famille des
Flaviviridae et des Togoviridae. Parmi les Flaviviridae on retrouve le genre des flavivirus qui
comprend les virus de la dengue (DENV) et du Zika (ZIKV) mais également le virus de la fièvre jaune (YFV) et le West Nile virus (WN) tandis que dans le groupe des Togoviridae on retrouve le genre des alphavirus qui comprend le virus du Chikungunya (CHIKV) et le Sindbis Virus (SINV) (Figure n°2).
Figure 2 : Représentation phylogénétiques représentant la filiation entre les principaux arbovirus : Adapté de M. Dessau et N. Komar
Bunyaviridae : RVFV : Rift Valley Fever Virus ; PUUV : Puumala Virus ; RV : Rotavirus Alphavirus : CHIKV : Chikungunya Virus ; SFV : Semliki Forest Virus ; SINV: Sindbis Virus
Flavivirus : SLEV : Saint-Louis Encepphalitis Virus ; WNEV: West Nile Virus ; JEV: Japonese Encephalitis Virus DENV-X : Sérotype X du Virus de la Dengue ; ZIKV : Zika Virus.
De façon préoccupante, l’importance et la fréquence des épidémies liées à ces arbovirus ne cesse de croître et gagne du territoire sur des régions qui étaient jusque-là préservées. De manière globale, ce sont des millions de personnes qui sont infectées tous les ans par ces virus disséminés par la piqure des moustiques Aedes albopictus et Aedes aegypti qui sont également retrouvés de plus en plus fréquemment dans les régions du nord. Ces moustiques, originaires de l’Afrique de l’Ouest et ayant à l’origine comme cibles des animaux sylvestres, ont évolué à la suite de la destruction de leur environnement pour devenir anthropophiles dans les environnements urbains (Maucourant et al., 2019, Annexe 1).
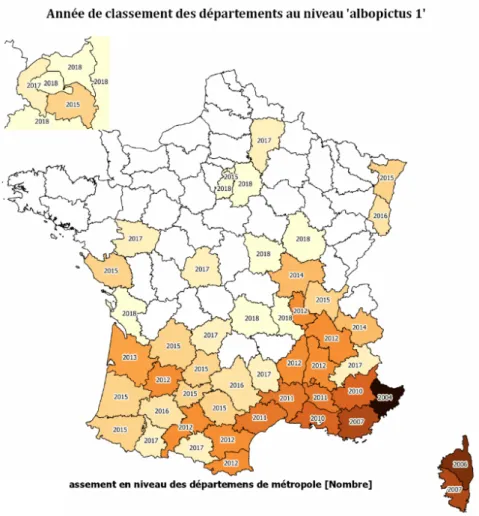
La présence d’Aedes albopictus de plus en plus fréquente dans les pays du nord entraîne un
nette augmentation du nombre de cas d’infection annuel et une nette progression de la population à risque comme le montre la figure 3 publiée par le ministère de la santé montrant, par département, l’année d’implantation d’Aedes albopictus en France.
Figure n°3 : Année de classement des département français au niveau « Albopictus 1 » d’après le ministère de la santé
1) Découvertes et historique des grandes épidémies.
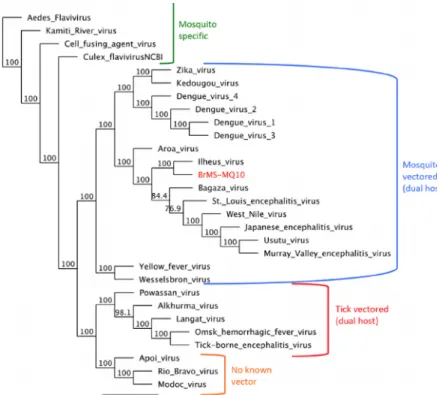
S’ils partagent une histoire commune, chacun des trois virus a été responsable de nombreuses épidémies, souvent disctintes mais parfois commune, avec des foyers où dengue, zika et chikungunya sévissaient simultanément, rendant le diagnostic parfois compliqué et faisant que pendant longtemps ces différentes maladies infectieuses ont pu être confondues. Malgré leur symptômologie parfois très proche et le fait qu’ils soient apparentés, le virus du chikungunya est structurellement et phylogénétiquement différent des virus de la dengue et du zika, très proches entre eux : Comme représenté dans la figure 4, DENV et ZIKV sont deux arbovirus appartenant à la famille des flaviviridae. L’arbre phylogénétique représentant les différentes souches du virus du CHIKV est quant à lui représenté en partie 1.3.
Figure 4 : Représentation phylogénétique représentant la filiation entre les principaux flavivirus :
Arbre de maximum de vraisemblance obtenu à partir de séquences de codage complètes à l'aide d'un modèle de substitution GTR. (Komar et al., 2004). Arbre donné avec des valeurs bootstrap qui représentent le pourcentage de 1000 réplicats dans lequel les membres d'un clade donné se retrouve dans la même topographie.
1.1) Découverte, émergence et historique du virus Zika
Le virus Zika a été isolé pour la première fois en 1947 en Ouganda à partir d’un singe sentinelle Macaque Rhésus. Ces sentinelles ont été importées d’asie afin de permettre une surveillance des risques épidémiques. En avril 1947, 6 singes sentinels présentent des symptômes grippaux avec de fortes fièvres. Parmi ces singes, le Rhésus 766 est envoyé au laboratoire d’Entebbe pour analyses. Son sérum est alors injecté en intrapéritonéal et en intracérébral chez la souris. Comme pour une grande partie des arboviroses, seules les souris injectées en intracérébral déclenchent des symptômes fiévreux 10 jours post-inoculation. Un autre singe (Rhésus 771) est inoculé avec le sérum de Rhésus 766 sans qu’aucun symptôme ne soit observé. 35 jours après inoculation, il est montré que le sérum du Rhésus 771 est neutralisant pour le sérum du Rhésus 766, suggérant ainsi la présence d’anticorps neutralisants produits chez ce singe. Le virus isolé des souris après inoculation par le sérum de Rhésus 766 est appelé Zika (ZIKV), portant ainsi le nom de la forêt où étaient placés ces singes. C’est en 1948, dans le cadre d’une étude portants sur les moustiques vecteurs de la fièvre jaune, que des moustiques de l’espèce des Aedes
C’est en 1954 que le premier cas de transmission à l’homme est décrit : une fille de 10 ans souffrant de fièvre et de maux de tête est conduite à l’hôpital : l’inoculation par voie intracérébral de son sérum dans le cerveau de 6 souris entraîne leur décès alors que celle en intra-péritonéale n’entraîne aucun symptôme. Parallèlement, il est montré que l’inoculation du sérum provenant des souris malades chez d’autres souris en présence du sérum de Rhésus 766 n’entraine aucun effet, suggérant qu’il s’agit ainsi du même virus (Haddow AJ et al., 1947). Afin de mieux caractériser le tableau clinique de cette maladie, une infection humaine expérimentale est réalisée en 1956 chez un européen vacciné contre la fièvre jaune. Il est alors inoculé en intra-épidermique et déclenche la maladie 72 heures post-innoculation : il se plaint alors de fièvre, nausées et de vertiges avant que les symptômes ne disparaissent au bout de 7
jours. En parallèle, au 5ème jour post infection, le volontaire est placé au contact d’une centaine
de moustiques qui le piquent. Cependant, l’exposition de souriceaux à ces moustiques n’engendre pas de symptôme chez ces animaux. (Haddow AJ et al., 1964).
Cependant, historiquement, l’identification des différentes souches virales ainsi que l’étude de la différenciation des différents sérogroupes a longtemps reposé sur des tests sérologiques. Or Zika présente une forte cross réactivité avec d’autres souches virales appartenant au
sérogroupe des Spondweni virus, dont zika fait partie, et ceux principalement avec le virus Chuku. Cette cross réactivité conduit donc à une mauvaise identification du virus Spondweni Chuku comme étant une souche du virus Zika (Draper CC et al., 1965). Ainsi les résultats des études sur l’infection expérimentale d’un volontaire humain, ainsi que ceux de l’étude sur la compétence d’Aedes aegypti à transmettre le virus sont discutées, dans la mesure où les deux souches virales ont pu être confondues (WHO).
En 1958 deux autres souches de ZIKV sont isolées à partir d’Aedes africanus en Ouganda dans la forêt de Lunyo, puis 3 autres en 1962 et 1963 (Simpson D et al., 1964). En 1973 et 1975 les deuxièmes et troisièmes cas d’infection humaine sont reportés. Durant les vingt années qui suivent, de nombreuses souches différentes sont isolées à partir d’Aedes Africanus en Afrique centrale de l’est et de l’ouest (Burkina Faso, Cameroun, Côte d’Ivoire, Egypte, Ethiopie, Gabon, Kenya, Mozambique, Nigeria, Ouganda, République Centre-Africaine, Sénégal, Sierra Leone, Somalie et Tanzanie) et d’Aedes aegypti en Malaisie. Ainsi, entre 1968 et 2002, 606 souches virales ont été isolées dont 10 chez l’Homme. Ces virus sont alors identifiés également en Malaisie, Indonésie, Pakistan, Thaïlande, Vietnam, Philippines et Cambodge. On distingue donc deux lignées de ZIKV : la lignée africaine divisée en deux sous-lignées et la lignée asiatique qui ont évolué séparément. En Afrique le virus est maintenu grâce à un cycle dit
des zones forestières équatoriales. Cependant les primates non-humains ne sont pas les seuls réservoirs de ces virus : en effet il semblerait que les buffles, les éléphants, les chèvres, les gnous et les zèbres puissent en être porteur. (Haddow AJ et al., 1947). Entre 1947 et 2006 seuls 14 cas d’infection humaine sont rapportés. Ces cas sont rapportés uniquement en Afrique et en Asie. C’est en 2007 que la première épidémie de ZIKV est décrite. Paradoxalement, malgré le très large spectre de distribution du moustique vecteur en Asie et en Afrique, cette première épidémie a lieu sur l’île de Yap située dans les Etats Fédérés de Micronésie. Au cours de cette épidémie, sur 7500 habitants de l’île, seuls 49 cas d’infection sont symptomatiques sans que ne soient observées de complications graves et près de 73% de la population de plus de trois ans a été infectée sans qu’aucun symptôme ne soit observé comme en témoigne la présence d’ARN viral chez ces individus (Lanciotti RS et al., 2007 ; Duffy MR et al., 2009 ;
Maucourant C et al, In Press ; Annexe 2).
En 2013 une deuxième épidémie de ZIKV survient. Elle émerge en Polynésie Française alors en proie avec une épidémie de DENV. L’épidémie touche très rapidement les 5 archipels que compte la Polynésie. Le 29 octobre 2013, le ZIKV est identifié comme responsable de syndromes associant fièvre modérée, éruption cutanée et de conjonctivites non purulente chez des patients négatifs en PCR pour DENV. Sur 270 000 habitants, ce sont près de 28 000 personnes qui ont été infectées par ZIKV, soit 11 % de la population bien que ce chiffre soit probablement sous-estimé du fait que la majorité des infections soient asymptomatiques. Contrairement à l’épidémie survenue sur l’île de Yap en 2007, cette épidémie est marquée par la présence d’atteintes neurologiques importantes (73 cas de syndrome de Guillain Barré dont le premier survient en décembre). (Maucourant et al, In Press ; Annexe 2).
Fin 2013, le virus émerge en Nouvelle-Calédonie, territoire Français situé dans le pacifique sud suite à l’importation de cas provenant de la Polynésie Française. En janvier 2014, le premier cas autochtone est décrit. Ce sont ensuite 1400 nouveaux cas qui seront décrits avec une dispersion du virus vers le Pacifique sud. C’est ainsi que les îles Cook, l’île de Pâques (Chili), Vanuatu ainsi que les îles Salomon et Fidji sont atteintes.
En 2014, des cas importés sont répertoriés au Japon en France, en Allemagne, en Norvège et en Australie. (Trappe D et al., 2014) Ces cas importés proviennent majoritairement du Pacifique sauf pour le cas du patient Australien qui revenait d’Indonésie, témoignant ainsi de la capacité du virus à survivre et à se répliquer dans des régions du monde où ZIKV n’est pas présent de façon endémique. Ainsi toutes les zones géographiques où les moustiques vecteurs sont présents représentent un territoire à risque pour une nouvelle épidémie.
Début 2015, au Brésil, des cas de patients présentant des symptômes ressemblants à ceux causés par DENV sont décrits dans l’état de Grande do Norte au nord-est. Ces patients testés par PCR sont pourtant négatifs pour DENV et CHIKV. ZIKV sera identifié en mars 2015 chez huit de ces patients par PCR. En juillet 2015 les autorités Brésiliennes annoncent la probabilité d’un lien entre les syndromes de Guillain Barré décrits et l’infection par ZIKV ainsi qu’avec les microcéphalies et les malformations néonatales en constante augmentation en octobre 2015. Ces microcéphalies sont principalement marquées par la petite taille de la tête des bébés atteints. (Zanluca C et al., 2015). Ainsi, fin 2015, la Polynésie répertorie 17 cas de malformation du système nerveux central chez des fœtus et nourrissons (microcéphalie, problème de développement du cerveau et du cervelet) contre 1 cas les années précédentes qui seront aussi associés à ce virus. Enfin une analyse phylogénétique fait remonter l’apparition du ZIKV au Brésil aux années 1920 et fait apparaître l’existence de 3 lignées évoluant de façons distinctes : deux lignées africaines et une lignée asiatique d’où provient les 2 principales souches : la souche cambodgienne et la souche malaisienne dérivant d’un même ancêtre commun. Ces souches asiatiques sont ainsi responsables des principales épidémies qui ont eu lieu récemment dans le pacifique et au Brésil, ainsi que des cas Européen sporadiques.
La transmission par le moustique semble ne pas être la seule voie de transmission possible : des cas de transmission homo- et hétérosexuel sont clairement décrits : le génome du virus étant détectable dans le sperme jusqu’à 6 mois post-symptômes. En revanche les cas de transmission de la femme vers l’homme sont beaucoup moins clairs et de nouvelles données sont attendues pour préciser leur incidence.
Enfin un troisième type de transmission est décrit : il s’agit d’une transmission verticale : de la mère à l’enfant, avec un risque majeur au cours des premiers mois de vie fœtale.
La figure 5 représente l’émergence de ce virus dont le nombre de cas annuel ne cesse de croître ces dernières années (WHO):
Figure 5 : Nombre annuel cumulé de pays ayant reporté des cas d’infection au cours de ces dernières années en fonctions des zones géographique dessinée par le WHO : AFRO = Africa ; PAHO = Pan American ; WPRO = West Pacifique ; SEARO = South East.
1.2) Découverte, émergence et historique du virus de la Dengue (DENV)
Contrairement au ZIKV qui porte son nom du lieu où il a été isolé, le virus de la dengue (DENV) porterait son nom en raison des symptômes qu’il provoque. En effet, en Swahili l’expression « ki denga pepo » signifie crampe démoniaque : faisant ainsi allusion aux douleurs et crampes déclenchées par cette maladie. Le terme de dengue entre dans le langage courant Anglais et Français au cours du XIXème siècle. (McSherry J et al., 1993). Les origines géographiques du DENV ne sont pas connues même si des études phylogénétiques montreraient une origine Africaine (Durand JP et al., 2003). Si l’on ne peut pas affirmer avec certitude qu’il s’agissait bien d’une épidémie de DENV, la première trace de maladie dont la symptomologie est comparable à ce que l’on connaît des 4 sérotypes du virus apparaît en 992 dans l’encyclopédie médicale chinoise (Gubler DJ et al., 2006.)
Il faudra ensuite attendre le XVIIème siècle pour trouver trace d’une épidémie pouvant s’y rapprocher. Parmi ces épidémies on peut noter par exemple qu’en 1648 le père Du Tertre décrit en Guadeloupe une épidémie entrainant « faiblesse » et « coup de barre » pouvant notamment être responsable de l’échec de la colonisation du Panama par l’écosse en 1699. La première épidémie de DENV décrite a eu lieu sur le continent Américain de la fin du XVIIIème siècle jusqu’au début du XXème. D’origine Africaine elle aurait été importée avec le commerce du sucre, du Rhum et des esclaves. Une deuxième épidémie est apparue lors de la colonisation du Queensland dans les années 1860 qui serait liée à l’urbanisation provoquée par l’installation de colons d’origine Australienne. Cette épidémie a duré jusqu’en 1916. (Halstead SB et al., 1992) En Europe, les premiers cas d’infection par DENV sont décrits en 1784 à Cadix et Séville (Espagne). La France voit ses premiers cas apparaître au Havre en 1829 tandis que d’autres cas apparaissent en 1890 à Naples (Italie). En 1928, à Athènes, près d’un million de cas sont décrits à l’origine du décès d’un millier de personnes. En 1916, l’équipe de Bancroft et al., en Australie, démontre qu’Aedes aegypti est un vecteur de DENV suite à la première transmission expérimentale du virus. Les deux prémiers sérotypes DENV1 et DENV 2 sont respectivement isolés en 1940 puis en 1946 en Guyane, à partir du sérum provenant de souris infectées par voie intracérébrale. (Chastel C et al., 1992). L’Asie du sud-est est également touchée durant cette période avec 440 000 cas en Chine en 1980 puis 200 000 cas en Thaïlande en 1987. C’est à partir de cette époque qu’elle commence à s’étendre à l’Océan Indien et au Pacifique du sud avec notamment 32 800 cas cumulés en 2001 entre Tahiti et la Polynésie française avant de s’installer aux Antilles Française avec des pics épidémiques en 2003 puis en 2006-2008 et enfin en 2010. Depuis 2010, DENV sévit sur un mode épidémique aux Antilles avec près de 86 000 cas en Martinique et Guadeloupe cette année-là. (InVS)
Selon l’OMS, Aedes albopictus s’est implanté en Amérique du nord et en Europe incluant de
nombreux départements Français (Figure 1). Sa période d’activité s’étend du 1er mai au 30
Novembre mais il peut être ponctuellement retrouvé plus tard grâce à sa capacité à résister à des températures inférieures à 10 °C. C’est à Nice en 2010 que les deux premiers cas autochtones français ont été décrits. En 2012, une épidémie survenue sur l’archipel de Madère (Portugal) avec plus de 2000 cas déclarés a entrainé l’apparition de cas importés en France. En 2013 des cas ont été rapportés en Floride et en Chine. De nos jours, le virus est extrêmement actif au Honduras, au Costa-Rica, au Mexique ainsi qu’à Singapour et au Laos où des flambées sont régulièrement signalées. De même des épidémies de DENV-3 sont signalées dans les îles Cook, en Malaisie ainsi que sur les Îles Fidji et de Vanuatu. (Institut pasteur)
près de 26000 cas de formes hémorragiques sont diagnostiquées sur le continent Américain avec par exemple 6000 cas au Vénézuela. Ce serait ainsi, selon l’OMS, près de 500 000 cas de formes hémorragiques qui seraient déclarés entrainant la mort de près de 2,5% des patients. Ces complications seraient liées à l’existence d’anticorps facilitants : l’infection par un serotype donné entraîne la formation d’une réponse mémoire vis à vis de ce sérotype qui est alors délétère en cas de ré-infection par un autre sérotype : enfin les anticorps ainsi produits ont une affinité suffisamment forte pour se fixer aux virions mais pas suffisante pour les neutraliser : permettant ainsi l’entrée des virions via les fragments Fc des cellules possédant des récepteurs aux fragments FC.
Le virus est maintenu grâce à la présence de deux cycles du vecteur : un cycle sylvatique et un cycle urbain :
- Le cycle sylvatique a lieu principalement dans les fôrets des régions tropicales d’Asie et d’Afrique : il permet notamment le maintien de formes ancestrales de DENV ainsi que le maintien d’un réservoir pouvant potentiellement devenir dans le futur pathogène pour l’homme. A ce jour seul l’homme et le singe sont connus pour être hôtes de ce virus : ce cycle est donc maintenu par la contamination de primate non humain par la piqure de moustique vecteur :
Aedes aegypti principalement mais également d’autres moustiques restreints à ces fôrets comme Aedes niveus en Asie et Aedes furcifer, Aedes luteocephalus et Aedes Taylori en Afrique.
- Le cycle urbain, correspondant notamment au principal réservoir de dengue humaine. L’être humain est à la fois le réservoir naturel du virus mais également son disséminateur. Ce cycle évolue de façon totalement indépendante au cycle Sylvatique. Le principal vecteur est Aedes
aegypti présent dans les régions tropicales et subtropicales et recolonisant petit à petit des
régions desquelles il avait été chassé comme la méditerranée. L’autre vecteur, dit vecteur secondaire, est Aedes albopictus d’origine asiatique. S’il est moins efficace à transmettre la maladie, il en est le principal vecteur dans les régions du nord puisque Aedes aegypti est totalement absent de ces régions. D’autres moustiques vecteurs peuvent être localement impliqués comme Aedes polynesiensis dans les îles du pacifique sud. Ces moustiques ont évolué suite aux différentes aires d’urbanisations qui ont entrainé des déforestations importantes : ils sont ainsi devenus anthropophiles permettant ainsi l’indépendance de ce cycle urbain. (Durand
JP et al., 2003)
La figure 6 représente l’émergence de ce virus dont le nombre de cas annuel ne cesse de croître ces dernières années (WHO) :
Figure 6 : Nombre annuel cummulé des cas d’infection au cours de ces dernières années en fonctions des zones géographiques dessinées par le WHO : AFRO = Africa ; AMRO = PAHO = Pan American ; WPRO = West Pacifique ; SEARO = South East.
1.3) Découverte, émergence et historique du virus du Chikungunya (CHIKV)
Le virus du Chikungunya (CHIKV) est à l’origine d’une maladie aiguë généralement accompagnée d'éruptions cutanées, d'arthralgies graves et souvent chroniques. CHIKV est probablement présent en Afrique depuis des centaines d’années et s’est exporté en Asie et en Amérique au cours des 18e et 19e siècles (Halstead SB et al., 2015 ; Carey DE et al., 1971). La première épidémie de CHIKV de l’aire moderne remonte à juillet 1952, le long des plateaux côtiers de Mawia, Makonde et Rondo situés aujourd'hui en Tanzanie (Haddow AJ et al., 1952). La faible incidence du paludisme dans cette région peut avoir facilité la reconnaissance des symptômes de l’infection par CHIKV, qui ont été décrits comme un "début très aigu de douleurs articulaires invalidantes souvent accompagnées d'une fièvre sévère, et éventuellement d'une éruption cutanée visible" (Ross RW et al., 1956).
Dans les villages touchés par cette épidémie, ce sont 40 à 50% des habitants qui ont été touchés par le virus. Le sol de ces plateaux est très perméable, ce qui oblige les riverains à stocker l'eau dans leurs villages. Il en a résulté une importante propagation d'Aedes aegypti (Haddow AJ et
al., 1952). Afin de déterminer le mode de transmission, des moustiques ont été mis en contact
moustiques sont mis en contact avec des souris : il en a résulté la mort des souris infectées (Ross
RW et al., 1956).
Ce virus transmis par les moustiques est alors appelé Chikungunya en référence à ses symptômes. En effet Chikungunya signifie « qui marche recourbé sur soi-même » en Makondé. Peu après cette première épidémie, des infections humaines ont été détectées en Ouganda transmises par le moustique arboricole Aedes Africanus (Weinbren MP et al., 1958). C'était la première preuve de l’existence d'un cycle sylvatique et d’un cycle zoonotique de ce virus. Par la suite, le virus a été découvert dans de nombreuses parties de l'Afrique subsaharienne, avec une transmission principalement par les moustiques arboricoles (Coffey LL et al., 2014). Plus tard, en 1964, des anticorps dirigés contre CHIKV ont été détectés chez des primates non-humains capturés au Zimbabwe actuel, et des singes vervets se sont révélés être des hôtes compétents pour la transmission par les moustiques infectés (Paterson HE et McIntosh BM
et al., 1964). Depuis, plusieurs études ont corroboré le rôle des primates non-humains en tant
qu'hôtes permettant l’amplification du virus au sein de moustiques vecteurs zoonotiques comme
Aedes Africanus et Aedes Furcifer. Finalement, des études phylogénétiques ont classé les
souches de CHIKV de tous ces sites de l’Afrique dans un clade appelé ECSA : lignée enzootique d'Afrique de l'Est, du Sud et d'Afrique centrale (Figure 7) (Powers AM et al., 2000
; Volk SM et al., 2010).
La fin du XXe siècle a vu une recrudescence accrue du CHIKV dans de nombreuses régions d'Afrique subsaharienne, ainsi que des flambées occasionnelles et sporadiques de fièvres associées au CHIKV en Afrique et en Asie. Des études longitudinales sur les souches de CHIKV dans l'est du Sénégal ont révélé un schéma d’amplification détecté par l’infection médiée par de vecteurs arboricoles survenus en 1975, 1979, 1983 et 1992 (Diallo D et al., 1999,
2012). Les isolats de CHIKV provenant de ces études et de quelques autres études dans la région
ont finalement été séquencés et se sont révélés appartenir à un deuxième clade appelé lignée Ouest Africaine (Figure 7) (Volk SM et al., 2010 ; Powers AM et al., 2000).
On ne sait toujours pas si ce modèle d’amplification décrit au Sénégal correspond à des extinctions et réintroductions locales du virus, ou s’il s’agit d’une circulation stable accompagnée d'une amplification périodique au sein de primates non-humains. Bien que la séroprévalence des primates non-humains Sénégalais ainsi que les isolats de virus indiquent une probable implication de ces primates dans le maintien du CHIKV au Sénégal, certains éléments suggèrent que d'autres vertébrés, comme des oiseaux, pourraient également servir d'hôtes réservoirs (Diallo D et al., 2013). Ainsi l'évaluation des hôtes potentiels des moustiques arboricoles comme les primates non-humains indigènes ou ceux introduits par l’Homme (comme les singes verts d'Afrique dans plusieurs îles des Caraïbes), est particulièrement
importante pour évaluer le risque de développement de cycles enzootiques dans certaines régions.
La première épidémie observée de CHIKV en dehors du continent Africain a eue lieu à Bangkok en Thaïlande en 1958. Le vecteur incriminé était Aedes aegypti. (Hammon WM et
al., 1960). Par la suite, d’autres foyers ont été découverts au Cambodge et en Inde entre 1961
et 1963 ; souvent associés à des épisodes d’infection par DENV. Des anticorps dirigés contre CHIKV ont également été détectés dans des sérums prélevés en inde dès 1954, (Pavri, 1964) suggérant une apparition en Asie plus précoce. Ceci est également confirmé par la séroprévalence élevée ainsi que le faible taux de maladie déclarée chez les personnes âgées de plus de 50 ans dans les années 1960 (Hermon YE et al., 1967). Des premières traces de CHIKV ont pu exister en Asie dès 1779 à Batavia (Aujourd’hui Jakarta) où « une fièvre articulaire » a été décrite. Cette hypothèse est également appuyée par le fait que c’est aussi vers cette époque que des cas de dengue sont décrits dans cette ville et que l’on sait qu’Aedes aegypti, vecteur du Chikungunya, est également vecteur de la dengue (Carey DE et al., 1971).
Le séquençage des souches isolées durant les épidémies asiatiques de 1958 à 1973 a montré que les différentes souches constituaient un groupe monophylétique placé à la base de la lignée d'Afrique orientale, centrale et du Sud, maintenant appelé lignage asiatique (figure 7). Des estimations indiquent que la souche asiatique a divergé de la lignée d’Afrique orientale, centrale et du sud entre 1879 et 1956, ce qui est incompatible avec la présence de la même lignée en Indonésie en 1779 (Volk SM et al., 2010).
Figure 7 : Arbre phylogénétique montrant les liens de parenté entre les différentes souches et lignages du virus du chikungunya construit avec la méthode du maximum de vraisemblance (Ronquist et Huelsenbeck et al., 2003). Les bootstraps ont été générés en utilisant 1000 réplicats et montrés seulement sur les branches principales pour plus de clarté. ECSA, lignée enzootique d'Afrique de l'Est, du Sud et d'Afrique centrale.
A partir des années 2000, d'importantes épidémies ont été répertoriées en Asie du Sud-Est (AbuBakar S et al., 2007) ainsi que dans plusieurs îles d'Océanie (Lanciotti RS, Valadere
AM et al 2014 ; Nhan TX et al., 2014 ; Kawashima KD et al, 2014 ; Ledermann JP et al., 2014 ; Roth A et al., 2014). Il est cependant à noter que l'histoire du Chikungunya a pris un
tournant en 2004 lorsqu'une nouvelle souche épidémique a émergé de la lignée d’Afrique de l’Est, du Sud et d’Afrique centrale. Détectée pour la première fois en circulation sur les côtes du Kenya (Chrétien JP et al., 2007 ; Kariuki Njenga M et al., 2008), cette nouvelle souche s'est disséminée en 2005 dans les îles de l'océan Indien, où d'importants foyers se sont déclarés. Le cas le plus étudié est certainement celui de l'île de La Réunion en 2006 où environ 300 000 cas ont été déclarés touchant ainsi près d’un tiers de la population de l’île (Schilte C et al., 2013
; Gerardin P et al., 2008) à l’origine de 273 décès (Josseran L et al., 2008). Au cours de cette
évidence une mutation ponctuelle d’un acide aminé à la position 226 de la glycoprotéine de l’enveloppe E1 entrainant la substitution d’une Alanine en Valine (Fig. 4) (Schuffenecker I et
al., 2006). Il est intéressant de noter que ce résidu fut précédemment impliqué dans la capacité
du virus de la forêt de Semliki (SFV) à infecter le moustique Aedes albopictus. Ces données et l’absence d’Aedes aegypti dans l’ile de la Réunion, a permis d’émettre l’hypothèse que la mutation dans la protéine d’enveloppe E1 est associée à une meilleure transmission du virus par le moustique Aedes albopictus qui, bien qu’il fût connu comme sensible à l’infection par le virus du Chikungunya, n’avait jamais été impliqué dans des infections majeures. Des études expérimentales ont confirmé cette hypothèse ainsi que l'évolution convergente de cette substitution dans plusieurs régions d'Asie et d'Afrique (Volk SM et al., 2010 ; de Lamballerie
X et al., 2008). Après s'être propagée du Kenya à l'Asie du Sud, puis à l'Asie du Sud-Est, à
l’origine d’épidémies majeures impliquant des millions de personnes, la nouvelle lignée de l'océan Indien a continué à diverger et à se propager en Asie. Bien que de nombreuses souches issues de cette nouvelle lignée mutante circulent dans les régions où les populations d'Aedes
albopictus sont importantes, d'autres souches ont conservé la région E1 non mutée dans les
régions Asiatiques où sont principalement présents des moustiques vecteurs du genre Aedes aegypti.
Le séquençage d'autres souches asiatiques a révélé que plusieurs d'entre-elles ont subie d'autres mutations adaptatives à Aedes albopictus n’ayant aucun impact sur la transmission médiée par
Aedes aegypti (Tsetsarkin K et al., 2011 ; Tsetsarkin K et al., 2014). Au plus fort des
épidémies de CHIKV impliquant des souches de la lignée de l’océan indien, des milliers de voyageurs infectés ont importé le virus dans presque toutes les régions du monde. Celles-ci ont par exemple entraîné le déclenchement de petits foyers épidémiques dans le nord de l'Italie (Rezza G et al., 2007) et le sud de la France (Grandadam M et al., 2011), en lien avec la présence d’Aedes albopictus sur ces territoires. Ces foyers européens ont mis en évidence le risque pour les régions tempérées de voir se développer ces arboviroses notamment en raison de la capacité qu’a Aedes albopictus à survivre à des périodes hivernales. De même, de nombreux voyageurs infectés ont importé le CHIKV sur le continent Américain (Lanciotti RS
et al., 2007), mais aucune transmission locale n'a été détectée avant 2013, où une première
transmission a été détectée à Saint Martin (Leparc Goffart et al., 2014 ; Lanciotti RS et
Valadere AM et al., 2014), puis dans d’autres iles des Caraïbes. Dès lors, cette souche asiatique
s’est répandue dans tous les pays d'Amérique Centrale et dans la plus grande partie de l'Amérique du Sud, mais également à 11 cas autochtones en Floride au cours de l'été 2014.
2) Symptomologie, thérapeutique et stratégies vaccinales et diagnostic :
2.1) Symptomologie associée au virus Zika
L’infection par le ZIKV a, dans ses formes non sévères, des symptômes assez proches de ceux observés au cours des infections par les autres arboviroses, dont le DENV et le CHIKV, compliquant ainsi le diagnostic de cette infection. Dans 70 % des cas, la maladie est asymptomatique tandis que dans la majorité des cas symptomatiques non sévères on retrouve majoritairement des symptômes de types grippaux, avec de la fièvre, des nausées et des douleurs articulaires et musculaires. La maladie se caractérise parfois par l’apparition d’un rash (des éruptions cutanées) à type d’exanthème maculo-papuleux possiblement prurigineux. La fièvre est inconstante très souvent inférieure à 38,5°C et est régulièrement accompagnée d’une hyperhémie conjonctivale ainsi que d’arthralgies et de myalgies. La maladie est dans la plupart des cas de courte durée, avec des symptômes n’excédant pas 3 jours. Le pronostic est favorable dans la majorité des cas mais des complications neurologiques à type de syndrome de Guillain-barré ont été décrites au Brésil et en Polynésie française entrainant une paralysie ascendante progressive des muscles respiratoires ainsi que des transmissions de la mère à l’enfant pouvant engendrer de graves anomalies du développement cérébral de l’enfant. Cependant, même dans les formes les plus graves, aucun décès n’a été observé à ce jour. (Institut pasteur)
2.2) Symptomologie associée à l’infection par le virus de la dengue
L’infection par DENV se manifeste par un large spectre de manifestations cliniques allant de la forme asymptomatique à des complications graves pouvant entraîner le décès. Historiquement on a longtemps classé les symptômes provoqués par DENV selon 4 stades : dengue classique, dengue sévère, dengue hémorragique (DHF) et dengue avec syndrome de choc septique (DSS). Cependant, en 2009, l’organisation mondiale pour la santé (OMS) à appelé à regrouper les formes hémorragiques et les formes avec syndromes de choc dans la catégorie dengues sévères. Il y a donc à ce jour deux stades de maladie :
Tout d’abord, la dengue dîte classique qui est la forme la plus bégnine et la plus fréquente. Elle se caractérise par une forte fièvre (>38,5°C), des céphalées, des myalgies, des douleurs lombaires et une conjonctivite. Chez l’enfant, notamment en cas de déshydratation, elle peut causer des convulsions et des troubles neurologiques. Souvent, un rash est observé 3 à 5 jours après le déclenchement de la fièvre. Ce rash est surtout marqué au niveau de la tête et du cou avec notamment la présence d’un rash maculo-papuleux, ainsi que sur les membres supérieurs et inférieurs. Pendant cette phase de fortes douleurs musculaires et articulaires peuvent être perçues. Si la plupart du temps les symptômes disparaissent au bout de 7 jours, une asthénie et des douleurs peuvent persister dans certains cas plus de temps. Au niveau de la numération
sanguine, on peut observer une thrombocytopénie (30 000 < X < 100 000 mm3) ainsi qu’une élévation modérée de la CRP (<30 mg/L).
Dans 3 à 5 % des cas, des complications peuvent être observées : ce sont les formes sévères de dengue recouvrant à la fois les formes hémorragiques et de syndrome de choc (OMS) :
- Les formes hémorragiques correspondent à un tableau clinique associant les 3 critères suivants : manifestations hémorragiques (signe du tourniquet positif, hémorragies de la peau et
des muqueuses, hémorragies viscérales), une thrombocytopénie importante (< 30 000 mm3) et
une fuite plasmatique pouvant avoir 3 causes : un taux d’hématocrite augmenté d’au moins 20% par rapport à la valeur normale, des épanchements séreux, une hypoprotidémie (< 50 g/L) ou une albuminémie (<25 g/L). Cette fuite plasmatique est notamment caractérisée par le développement d’ascite et d’effusion pleurale.
- Les formes de syndrome de choc qui correspondent à un tableau clinique de dengue hémorragique avec au moins l’un des deux critères suivants : un pouls rapide et filant, une tension artérielle différentielle pincée (<20 mmHg), une hypotension ou une pression artérielle systolique faible (< 90 mmHg).
Il est cependant important de noter que les formes sévères sont le plus souvent observées lors d’une ré-infection par un autre sérotype de DENV. Cette observation s’expliquerait par le phénomène de facilitation médiée par les anticorps (ADE) : une première infection entraîne la production d’anticorps dirigés contre un sérotype en particulier. Ces anticorps assurent une protection contre ce sérotype en cas de réinfection mais lors d’une seconde infection par un autre sérotype, dite infection hétérologue, ces anticorps se fixent aux virions sans les neutraliser, permettant, via la fixation des complexes immuns aux récepteurs aux fragments FC, de faciliter l’entrée du virus au sein des monocytes facilitant sa multiplication et déclenchant une réaction inflammatoire intense, notamment médiée par les Lymphocytes T, avec augmentation de la perméabilité vasculaire provoquant de cette manière un risque accru d’hémorragie. Ainsi, non seulement une infection par un sérotype donné ne protège pas contre les trois autres, mais une réinfection par un autre sérotype est parfois associée à une forme sévère de la maladie.
2.3) Symptomologie associée à l’infection par le virus du Chikungunya
Comme pour DENV et ZIKV il existe des formes classiques (i) allant de l’absence de symptôme a des symptômes bénins, et des formes graves (ii) pouvant conduire au décès des personnes touchées :
(i) La forme classique
l’actuelle Tanzanie (Haddow AJ et al., 1952). Ces symptômes ont été décrits comme un " début très aigu de douleurs articulaires invalidantes souvent accompagné d'une fièvre sévère, et éventuellement d'une éruption cutanée visible " (Ross RW et al., 1956).
En effet, le principal symptôme lié à cette maladie est la présence d’importantes douleurs articulaires donnant ainsi son nom à ce virus. Après une période d’incubation s’étendant de 2 à 10 jours, des douleurs, souvent invalidantes, se font ressentir au niveau des poignets, des doigts, des chevilles, des pieds mais aussi des genoux et de façon plus ponctuelle au niveau des hanches et des épaules. En plus de ces douleurs articulaires, on retrouve fréquemment des maux de tête, des douleurs musculaires associées à d’importantes fièvres souvent supérieures à 38 °C. On retrouve également des éruptions cutanées au niveau du tronc et des membres mais surtout au niveau du thorax qui peut être associé à un œdème facial (Deller JJ et al., 1967 ; Simon F et
al., 2007), une inflammation ganglionnaire ainsi qu’une inflammation de la conjonctive et des
saignements des gencives et du nez. Des hémorragies minimes peuvent également être observées (purpura et gingivorragie) mais concernent principalement les enfants (Brighton SW
et al., 1983).
Les atteintes articulaires peuvent entraîner d’importes incapacités fonctionnelles et sont d’autant plus importantes que le patient est âgé, déshydraté ou présente une autre pathologie chronique. Des études ont montré que le taux d’arthralgies chroniques était de l’ordre de 60% chez les patients de 15 à 18 mois post-infection (Sissoko D et al.,2009). Les analyses sanguines pratiquées chez les patients en phases aigüe ne montrent pas de variabilité importante des marqueurs inflammatoires sanguins, malgré la forte fièvre : on n’observe donc pas de variation des ALAT et ASAT, de la CRP, du fibrinogène et du complément. Cependant une lymphocytose et une thrombopénie marquent la phase aigüe. La rémission des formes classiques de l’infection par CHIKV est assez rapide. La fièvre ainsi que les manifestations cutanées disparaissent quelques jours après leur apparition mais les atteintes articulaires peuvent persister pendant plusieurs semaines. Cependant, dans certains cas, les douleurs articulaires peuvent persister de manière chronique pendant des années. Ainsi 10 % des sujet infectés souffriraient de douleurs articulaires 3 à 5 ans post-infection (Institut Pasteur 2019).
(ii) Les formes graves
Jusqu’à l’apparition et l’expansion de la lignée de l’océan indien porteuse de la mutation A226V dans la protéine d’enveloppe en 2004, la maladie n’était pas une priorité pour les autorités sanitaires puisque peu dépidémies et de formes graves avaient été observées.
Cependant l’épidémie de 2005-2006, survenue sur l’île de la Réunion, entre autres, a révélé que la forme mutante du CHIKV est associée à des complications cliniques importantes, comme l’apparition de formes neurologiques graves avec par exemple des méningo-encéphalites et des atteintes des nerfs périphériques pouvant entraîner des syndromes de Guillain-Barré qui ont notamment été observés chez des patients présentant un système immunitaire affaibli, comme des bébés infectés in utero ou des personnes âgées ou présentant de multiples comorbidités (pathologies cardiovasculaires, diabète). On retrouve également des cas d’hépatites graves ainsi que des péricadites, des myocardites, des surinfections bactériennes, des pneumonies et des chocs septiques (Schuffenecker I et al., 2006).
La table 1 présente un résumé des principaux symptômes observés au cours des infections par les virus de la dengue, du chikungunya et du zika :
Symptômes Dengue Chikungunya Zika
Fièvre ++++ +++ +++ Myalgie/Arthralgies +++ ++++ ++ Oedèmes - - ++ Rash Maculopapulaire ++ ++ +++ Douleurs rétro-orbitales ++ + ++ Conjontivites - + +++ Lymphadénopathies ++ ++ + Hépatomégalies - +++ - Leuco/thrombo-pénies +++ +++ - Hémorragies + - -
Table 1 : Table comparative de la symptomologie associées à une infection par les virus de la dengue, Chikungunya et Zika. Adapté d’Halstead et al., et du département de la santé de l’état de Yap (Ioos S et al., 2014).
2.4) Stratégies thérapeutiques, prévention et diagnostic :
Il n’existe pas de traitements spécifiques contre ces virus et la seule façon efficace de s’en protéger est de se tenir éloigné du moustique vecteur. Ainsi la méthode la plus efficace dans les pays où ces moustiques sévissent est l’utilisation de moustiquaires et de répulsifs. De façon préventive, la méthode historique consiste en l’éradication des moustiques par les autorités
l’isolement des patients virémiques au contact avec le vecteur. Afin de réduire le nombre de gîtes larvaires, des opérations de suppression des eaux stagnantes sont réalisées à proximité des habitations. On trouve également l’utilisation de larvicides chimiques organophosphorés ou contenant des pyréthrinöides, mais également l’utilisation de larvicides biologiques comme
Bacillus thuringiensis israelensis. Cependant malgré toutes ces précautions, le contrôle du
moustique vecteur est peu efficace, rendant ainsi l’obtention de traitements et de vaccins efficaces une priorité dans la lutte contre ces maladies. Cette faible efficacité semble liée à une importante méconnaissance du cycle écologique des moustiques vecteurs rendant ainsi toutes ces stratégies obsolètes (Delatte H et al., 2008). De plus, le moustique étant en constante adaptation à son nouveau milieu de vie urbain, il est difficile de bien caractériser son cycle de vie.
2.4.1) Stratégies thérapeutiques dirigée contre ZIKV
Pour lutter contre l’infection par ZIKV, il n’existe ni vaccin ni aucun traitement spécifique. La stratégie thérapeutique se limite donc au traitement des symptômes et à la surveillance. Afin de réduire la symptomologie, la prise d’antalgiques peut être prescrite avec une forte contre-indication pour l’utilisation des anti-inflammatoires non stéroïdiens et d’Aspirine en raison de la ressemblance des symptômes avec ceux que provoquent DENV et de l’effet anticoagulant de ces médicaments qui pourraient entrainer des hémorragies en cas d’infection par DENV. Il existe classiquement deux méthodes de diagnostic : la détection par q-RT-PCR du génome viral dans le sang et les urines du patient dans un premier temps ainsi que la recherche sérologique dans un deuxième temps réalisée pour confirmer la présence d’anticorps spécifique du virus. Ces tests sont réalisés uniquement par les centres nationaux de référence des arboviroses (CNR).
La seule façon de se protéger contre le virus consiste donc à se tenir éloigné des moustiques vecteur Aedes aegypti et Aedes albopictus bien que ce dernier soit de plus en plus décrit comme faiblement compétant pour la transmission du virus. En plus des méthodes d’éliminations du moustique vecteur, des précautions très particulières doivent être prises avec les femmes enceintes vivants dans les zones où le virus est endémique. En effet, de nombreux cas de transmissions verticales ont été décrits notamment au Brésil à partir de 2015. Plus particulièrement il a été montré que cette transmission était particulièrement à risque au cours des deux premiers trimestres de grossesse, période au cours de laquelle les risques de malformation fœtal sont les plus importants (INPES). Ainsi les femmes enceintes vivant dans ces régions doivent porter une attention particulière à l’utilisation de répulsif et suivre les recommandations d’usage sur l’utilisation de ces produits par les femmes enceintes (INPES).
Les femmes enceintes qui désirent se rendre dans une zone où le virus est présent de manière endémique doivent évaluer les risques avant leur déplacement, notamment avec leur médecin traitant, bien que ce type de déplacement soit fortement déconseillé (INPES).
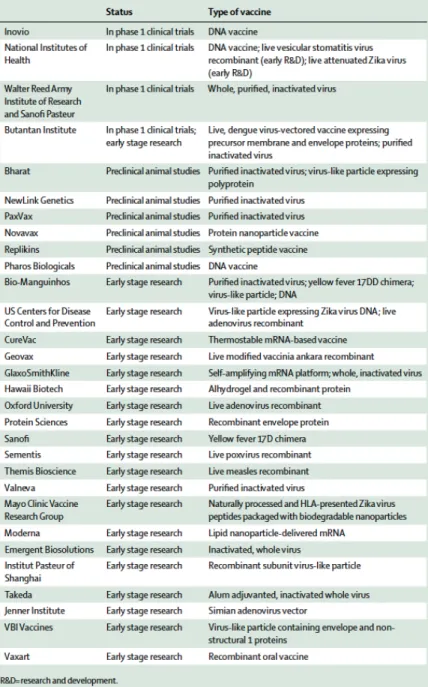
A ce jour, il n’existe pas de vaccin contre ZIKV, bien que de nombreux candidats vaccins soient actuellement testés. La table 2 représente le statut ainsi que le type de ces principaux vaccins. On distingue ainsi tous les types de vaccins : vaccins à ADN, VLP ou vaccins vivants atténués ou inactivés. Parmi ces vaccins, trois sont en phase I d’éssais cliniques.
2.4.2) Stratégies thérapeutiques dirigée contre le virus de la dengue
Il n’existe également aucun traitement spécifique contre DENV. La stratégie thérapeutique se limite donc au traitement des symptômes et à la surveillance. Ainsi, les formes bénignes seront traitées par une bonne hydratation, du repos et une lutte contre la fièvre et les douleurs uniquement par la prescription d’antalgiques et d’antipyrétiques. Comme précédemment indiqué, l’utilisation d’AINS comme l’ibuprofène et l’aspirine est fortement contre-indiquée de part leur effet d’antiagrégeant plaquettaire.
Une surveillance stricte de la survenue des signes de gravité doit être facilitée dans la population via la remise d’un document d’information transmis aux familles en cas d’infection. Ces formes graves peuvent nécessiter une hospitalisation afin de maintenir les fonctions vitales à l’organisme. La précocité de la prise en charge va être un élément clé dans la diminution de la létalité liée à cette maladie.
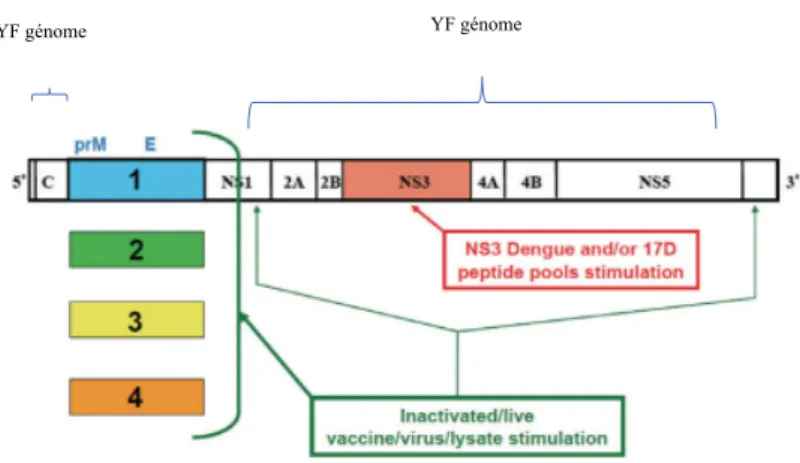
Contrairement au ZIKV et au CHIKV, un vaccin, appelé Dengvaxia, dirigé contre les 4 sérotypes de DENV, a été développé par Sanofi-Pasteur et commercialisé au Mexique en 2015 puis en 2016 aux Philippines, au Brésil, au Salvador, au Costa Rica, au Paraguay, au Guatemala, au Pérou, en Indonésie, en Thaïlande et à Singapour. La principale difficulté pour ce vaccin tétravalent était d’obtenir une solution immunogène pour les 4 sérotypes du virus tout en évitant le phénomène des anticorps facilitant observés en cas d’une infection secondaire par un autre sérotype que celui de la primo-infection. Il s’agit d’un vaccin vivant atténué contenant un mélange de 4 virus chimères recombinants de la fièvre jaune exprimant les protéines prM et E des 4 sérotypes du virus de la dengue (Figure 8) (Sanofi-Pasteur).