DOYENS HONORAIRES :
1962 - 1969 : Professeur_Abdelmalek FARAJ 1969 - 1974 : Professeur Abdellatif BERBICH 1974 - 1981 : Professeur Bachir LAZRAK 1981 - 1989 : Professeur Taieb CHKILI
1989 - 1997 : Professeur Mohamed Tahar ALAOUI 1997 - 2003 : Professeur Abdelmajid BELMAHI 2003 - 2013 : Professeur Najia HAJJAJ - HASSOUNI
ADMINISTRATION :
Doyen
Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines Professeur Brahim LEKEHAL Vice Doyen charge de la Recherche et de la Coopération
Professeur Toufiq DAKKA Vice-Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Younes RAHALI Secrétaire Général : Mr. Mohamed KARRA
UNIVERSITE MOHAMMED V
FACULTE DE MEDECINE ET DE PHARMACIE RABAT
1 - ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS DE L'ENSEIGNEMENT SUPERIEUR : Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne - Clinique Royale Pr. MAAZOUZI Ahmed Wajdi Anesthésie –Réanimation
Pr. SETTAF Abdellatif Pathologie Chirurgicale Janvier, Février et Décembre 1987
Pr. LACHKAR Hassan Médecine Interne
Décembre 1988
Pr. DAFIRI Rachida Radiologie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne -Doyen de la FMPR
Pr. OUAZZANI Taibi Mohamed Réda Neurologie Janvier et Novembre 1990
Pr. KHARBACH Aicha Gynécologie Obstétrique Pr. TAZI Saoud Anas Anesthésie Réanimation Février Avril Juillet et Décembre 1991
Pr. AZZOUZI Abderrahim Anesthésie Réanimation- Doyen de FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZAD Rachid Gynécologie Obstétrique Méd. Chef Maternité des Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie- Dir. du Centre National PV Rabat
Pr. TAOUFIK Jamal Chimie thérapeutique Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale Doyen de FMPT Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie Pr. CHRAIBI Chafiq Gynécologie Obstétrique Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques Doyen de la FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale - Directeur du CHIS
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie - Orthopédie
Pr. RHRAB Brahim Gynécologie -Obstétrique
Pr. ŞENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie Inspecteur du SSM
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BERRADA Mohamed Saleh Traumatologie - Orthopédie Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale Pr. AMRAOUI Mohamed Chirurgie Générale Pr. BAIDADA Abdelaziz Gynécologie Obstétrique Pr. BARGACH Samir Gynécologie Obstétrique Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale Décembre 1996
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie Directeur HMI Mohammed V Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique Novembre 1998
Pr. BENOMAR ALI Neurologie Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
Janvier 2000
Pr. ABID Ahmed* Pneumo-phtisiologie
Pr. AIT OUAMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Directeur Hộp. My Youssef
Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumophtisiologie Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. TACHINANTE Rajae Anesthésie-Réanimation Pr. TAZI MEZALEK Zoubida Médecine Interne Novembre 2000
Pr. AIDI Saadia Neurologie
Pr, AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie Réanimation
Pr. EL HASSANI Amine Pédiatrie - Directeur Hôp.Cheikh Zaid
Pr. EL KHADER Khalid Urologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Décembre 2001
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale Pr. EL HIJRI Ahmed Anesthésie-Réanimation Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie Pédiatrique Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie - Directeur Hôp. d'Enfants Rabat
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique V-D chargé Aff Acad. Est.
Pr. MEDARHRI Jalil Chirurgie Générale Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie Pr. BERNOUSSI Zakiya Anatomie Pathologique Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL Fellous Sidi Zouhair Chirurgie Pédiatrique Pr. EL HAQURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RAISS Mohamed Chirurgie Générale
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre * Ophtalmologie Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. BAHIRI Rachid Rhumatologie Directeur Hôp. Al Ayachi Salé
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire Pr. LYAGOUBI Mohammed Parasitologie
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
Pr. ZERAIDI Najia Gynécologie Obstétrique
AVRIL 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio - Vasculaire. Directeur Hôpital Ibn Sina Mé
Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr, KISRA Mounir Chirurgie - Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo - Phtisiologie
Pr. TELLAL Saida* Biochimie
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr, ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi * Chirurgie cardio vasculaire Pr. AMHAJJI Larbi * Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed * Anesthésie réanimation Pr. BALOUCH Lhousaine * Biochimie-chimie Pr. BENZIANE Hamid * Pharmacie clinique Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHERKAOUI Naoual * Pharmacie galénique Pr. EHIRCHIOU Abdelkader * Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire Pr. EL ABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid * Radiothérapie
Pr. ICHOU Mohamed * Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LOUZI Lhoussain * Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed * Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRANI Saad * Virologie
Pr. OUZZIF Ez zohra Biochimie chimie
Pr. RABHI Monsef* Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine * Microbiologie
Pr. SIFAT Hassan * Radiothérapie
Pr. TABERKANET Mustafa * Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale Pr. TANANE Mansour * Traumatologie-orthopédie Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Mars 2009
Pr. ABOUZAHIR Ali * Médecine interne
Pr. AGADR Aomar * Pédiatrie
Pr. AIT ALI Abdelmounaim * Chirurgie Générale Pr. AIT BENHADDOU El Hachmia Neurologie
Pr. AKHADDAR Ali * Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. ARKHA Yassir Neuro-chirurgie Directeur Hôp.des Spécialités
Pr. BELYAMANI Lahcen Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae * Biochimie-chimie
Pr. BOUI Mohammed * Dermatologie
Pr. BOUNAIM Ahmed * Chirurgie Générale
Pr. BOUSSOUGA Mostapha * Traumatologie-orthopédie
Pr. CHTATA Hassan Toufik * Chirurgie Vasculaire Périphérique Pr. DOGHMI Kamal * Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie Pr. ENNIBI Khalid * Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. LAMSAOURI Jamal * Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-Phtisiologie
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine Interne Directeur ERSSM
Pr. BELAGUID Abdelaziz Physiologie
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine Aéronautique
Pr. DAMI Abdellah* Biochimie-Chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie Pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie Plastique et Réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro-Entérologie
Pr. LAMALMI Najat Anatomie Pathologique
Pr. MOSADIK Ahlam Anesthésie Réanimation Pr. MOUJAHID Mountasșir* Chirurgie Générale
Pr. NAZIH Mouna* Hématologie
Pr. ZOUAIDIA Fouad Anatomie Pathologique Décembre 2010
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie pédiatrique Pr. ABOUELALAA Khalil * Anesthésie Réanimation Pr. BENCHEBBA Driss * Traumatologie-orthopédie Pr. DRIŞSI Mohamed * Anesthésie Réanimation Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek * Médecine Interne Pr. EL OUAZZANI Hanane * Pneumophtisiologie Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie Pathologique
Pr. RAISSOUNI Maha* Cardiologie
* Enseignants Militaires Février 2013
Pr. AHID Samir Pharmacologie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie
Pr. AMOR Mourad Anesthésie Réanimation
Pr. AWAB Almahdi Anesthésie Réanimation
Pr. BELAYACHI Jihane Réanimation Médicale Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie
Pr. BENNANA Ahmed* Informatique Pharmaceutique Pr. BENSGHIR Mustapha * Anesthésie Réanimation Pr. BENYAHIA Mohammed * Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique et Bromatologie Pr. BOUABID Ahmed Salim* Traumatologie orthopédie
Pr BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali * Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. DINI Nouzha * Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI NIZARE Neuro-chirurgie
Pr. EL GUERROUJ Hasnae Médecine Nucléaire Pr. EL HARTI Jaouad Chimie Thérapeutique
Pr. EL JAOUDI Rachid * Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologique
Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation Pr. EN-NOUALI Hassane * Radiologie
Pr. ERRGUIG Laila Physiologie
Pr. FIKRI Meryem Radiologie
Pr. GHFIR Imade Médecine Nucléaire
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques
Pr. KADIRI Mohamed * Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-chirurgie
Pr. MRABTI Hind Oncologie Médicale
Pr. NEJJARI Rachid Pharmacognosie
Pr. OUBEJJA Houda Chirugie Pédiatrique
Pr. OUKABLI Mohamed Anatomie Pathologique
Pr. RAHALI Younes Pharmacie Galénique Vice-Doyen à la Pharmacie
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim * Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique
Pr. ROUIBAA Fedoua * Gastro-Entérologie
Pr SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire Pr. SEDDIK Hassan * Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali * Traumatologie Orthopédie
* Enseignants Militaires AVRIL 2013
Pr. EL KHATIB MOHAMED KARIM* Stomatologie et Chirurgie Maxillo-faciale
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique Pr. BENCHAKROUN Mohammed Traumatologie-Orthopédie Pr. BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie- Embryologie-Cytogénétique
Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie
Pr. JANANE Abdellah Urologie
Pr. JEAIDI Anass * Hématologie Biologique
Pr. KOUACH Jaouad* Génycologie-Obstétrique Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie
Pr. OULAHYANE Rachid* Chirurgie Pédiatrique Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SEKKACH Youssef* Médecine Interne
DECEMBRE 2014
Pr. ABILKACEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale Pr. BEKKALI Hicham * Anesthésie-Réanimation Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale Pr. BOUABDELLAH Mounya Biochimie-Chimie
Pr. BOUCHRIK Mourad* Parasitologie
Pr. DERRAJI Soufiane* Pharmacie Clinique
Pr. DOBLALI Taoufik Microbiologie
Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique
Pr. JAHIDI Mohamed* O.R.L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI NEZHA Anesthésie-Réanimation
Pr. RAMI Mohamed Chirurgie Pédiatrique
Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg. AOUT 2015
Pr. MEZIANE Meryem Dermatologie
Pr. TAHIRI Latifa Rhumatologie
PROFESSEURS AGREGES:
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale
Pr. EL ASRI Fouad* Ophtalmologie
Pr. ERRAMI Noureddine* O.R.L
Pr. NITASSI Sophia O.R.L
JUIN 2017
Pr. ABI Rachid* Microbiologie
Pr. ASFALOU Ilyasse* Cardiologie
Pr. BOUAYTI El Arbi* Médecine préventive, santé publique et Hyg.
Pr. BOUTAYEB Saber Oncologie Médicale
Pr. EL GHISSASSI Ibrahim Oncologie Médicale
Pr. HAFIDI Jawad Anatomie
Pr. OURAINI Saloua* O.R.L
Pr. RAZINE Rachid Médecine préventive, santé publique et Hyg.
Pr. ZRARA Abdelhamid* Immunologie
NOVEMBRE 2018
Pr. AMELLAL Mina Anatomie
Pr. SOULY Karim Microbiologie
Pr. TAHRI Rjae Histologie-Embryologie-Cytogénétique *Enseignants Militaires
2 - ENSEIGNANTS-CHERCHEURS SCIENTIFIQUES PROFESSEURS/Prs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naima Histologie-Embryologie
Pr. ANSAR M'hammed Chimie Organique et Pharmacie Chimique Pr .BARKIYOU Malika Histologie-Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. CHAHED OUAZZANI Lalla Chadia Biochimie chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie moléculaire/Biotechnologie Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 04/02/2020 Khaled Abdellah
Chef du Service des Ressources Humaines FMPR
A la mémoire de ma mère
A ceux qui me sont les plus chers
A ceux qui ont toujours cru en moi
A ceux qui m’ont toujours encouragé
A mon très cher père
Ce modeste travail est le fruit de tout sacrifice déployé pour notre
éducation.
Vous avez toujours souhaité le meilleur pour nous.
Vous avez fournis beaucoup d’efforts aussi bien physiques et moraux à
notre égard.
Vous n’avez jamais cessé de nous encourager et de prier pour nous.
C’est grâce à vos percepts que nous avions appris à compter sur
nous-mêmes.
Vous méritez sans conteste qu’on vous décerne les prix « Père
Exemplaire ».
Pére : je t’aime et j’implore le tout puissant pour qu’il t’accorde une bonne
santé et une vie heureuse.
A mes frères Aiman et Sami
Aucun mot ne pourrait exprimer ma gratitude, mon amour et mon
respect.
Je remercie le bon dieu de vous avoir dans ma vie. Puisse le bon dieu nous
procure santé et longue vie.
A notre Maître et Président de jury
Monsieur le Professeur Jamal TAOUFIK
Professeur de Chimie Thérapeutique
Nous sommes très sensibles à l’honneur que vous nous faites en acceptant
de présider notre jury de thèse.
Nous vous exprimons notre grande admiration pour vos hautes qualités
morales, humaines et professionnelles.
Nous vous prions de trouver, dans ce modeste travail, l’expression de notre
sincère reconnaissance et notre respectueuse admiration.
A notre Maître et rapporteur de thèse
Monsieur le Professeur Youssef RAMLI
Professeur de Chimie Organique et Pharmacochimie
Vous m’aviez fait l’honneur de me confier ce travail, qui n’aurait pu se
faire sans vos précieuses directives et vos judicieux conseils.
Je tiens à vous exprimer ici toute ma gratitude pour votre grande
disponibilité et votre immense gentillesse.
Veuillez accepter, l’assurance de ma profonde estime et ma vive
reconnaissance.
A notre Maître et juge de thèse
Monsieur le Professeur Jaouad HARTI
Professeur de Chimie Thérapeutique
Nous sommes sensibles à l’honneur que vous nous faites en acceptant de
participer au jury de notre thèse et très touchés par la gentillesse avec
laquelle vous nous avez toujours accueillis.
Puisse ce travail être pour nous, l’occasion de vous exprimer notre profond
respect et notre gratitude la plus sincère.
A notre Maître et juge de thèse
Monsieur le Professeur M’hammed ANSAR
Professeur de Chimie organique
Nous avons le privilège et l’honneur de vous avoir parmi les membres de
notre jury.
Veuillez accepter nos remerciements et notre admiration pour vos qualités
d’enseignant et votre compétence.
A toute l’équipe de chimie thérapeutique, pharmacie clinique et pratique
pharmaceutique
Mr le professeur Jamal LMSAORI
Mr le professeur Ahmed Banana
Mr professeur Ahmed ZAHIDI
Mme la professeure fatima LZRK
Mr le professeur Sefrioui
Mme Latifa LMsaori
A Zaoui Younes, El Jemli Meryem, MORTADA Salma, Akchar jihan,
Zineb Khalil, Zineb Lachab, Zakhour Rajae, Boukharsa Younes, Akrade
Rachida, MISIOUI Mouhcine, Fetach Saad…
A tous les chercheurs des Laboratoires : de Chimie Thérapeutique,
Pharmacologie et Toxicologie et Biotechnologie de la Faculté de
Médecine et de Pharmacie de Rabat, qui m’ont aidé, encouragé et soutenu
A tous (toutes) mes ami(e)s pour leur sincère amitié et confiance et à qui
je dois ma reconnaissance et mon attachement, ainsi qu’à toute personne
ayant participé de près ou de loin à l’aboutissement de cette thèse.
Liste des abbreviation
ADME Absorption, distribution, métabolisme, excrétion
AMM Autorisation de mise sur le marché
CVHD Criblage virtuel à haut débit
CAS Chemical abstracts service
DNS Acide dinitrosalicylique
FID Fédération Internationale du Diabète
g Gramme
h Heure
IR Infrarouge
HAS Haute Autorité de Santé
IC50 Concentration inhibitrice médiane
Kg Kilogramme
MERS-CoV Middle East respiratory syndrome coronavirus
l Litre
mg Milligramme
ml Millilitre
µmoles Micromoles
mn Minute
OMS Organisation Mondiale de la Santé
RMN Résonance nucléaire magnétique
PDB Protein Data Bank
RSA Relation structure activité
SM Spectrométrie de masse
SOSA Selective Optimization of Side Activities
SCONPs Classification structurale des produits naturels
t/mn Tours/Minute
WHO World Health Organization
% Pourcentage
Liste des figures
Figure 1: Les différentes étapes de développement d’un médicament ... 6 Figure 2: a) Taxus baccata b) structure du taxol ... 9 Figure 3: Synthèse d’inhibiteur de l’acétylcholine par assemblage de fragments ... 11 Figure 4: Nouveaux antiviraux dérivés de l’aristeromycine ... 12 Figure 5: Principe de la chimie combinatoire ... 14 Figure 6: Création de chimiothèque ... 15 Figure 7: Imatinib ... 16 Figure 8: Amarrage moléculaire... 22 Figure 9: Structure d’α-glucosidase... 26 Figure 10: Structure de l’ α-amylase ... 26 Figure 11: Structure générale des acétamides ... 27 Figure 12: Interface du logiciel Discovery Studio 4.5 Client ... 28 Figure 13: Interface du logiciel AutoDock vina. ... 29 Figure14: Interface du logiciel Pymol. ... 30 Figure 15: Hydrolyse du pNPG (4-Nitrophényl α-D-glucopyranoside) par α –glucosidase ... 35 Figure 16: Docking moléculaire du produit 1a avec l’α-glucosidase... 40 Figure 17: Docking moléculaire du produit 7a avec l’α-glucosidase... 40 Figure 18: Docking moléculaire du produit 5b avec l’α-glucosidase... 42 Figure19: Docking moléculaire du produit 9b avec l’α-glucosidase... 42 Figure 20: Docking moléculaire du produit 1a avec l’α-amylase. ... 44 Figure 21: Docking moléculaire du produit 7a avec l’α-amylase. ... 44 Figure 22: Docking moléculaire du produit 5b avec l’α-amylase. ... 45
Figure 23: Docking moléculaire du produit 9b avec l’α-amylase. ... 46 Figure 24: Schéma de synthèse des chloro-acétamides. ... 46 Figure 25: Schéma synthèse des Azido-acétamides ... 49 Figure 26: spectre RMN1H de la molécule 3a ... 52
Figure 27: Spectre RMN13C molécule 3a ... 53
Figure 28: Spectre de masse molécule 3a ... 54 Figure 29: Spectre RMN1H de la molécule 3b ... 54
Figure 30: Spectre RMN13C molécule 3b ... 55
Figure 31: Spectre de masse molécule 3b ... 56 Figure 32: Structure ORTEP du composé 3b ... 56 Figure 33: Effet inhibiteur des dérivés du chloro-acétamide sur l’α-Glucosidas (NA : non
actif) ... 60
Figure 34: Effet inhibiteur des dérivés de l’azido-acétamide sur l’α-Glucosidase (NA : non
actif) ... 61
Figure 35: Effet inhibiteur des dérivés du chloro-acétamide sur l’α-amylase (NA : non
actif). ... 63
Figure 36: Effet inhibiteur des dérivés de l’azido-acétamide sur l’α-amylase (NA : non
Liste des tableaux
Tableau I: Les Energies libres de liaisons ligand-enzyme et les résidus impliqués
d’α-glucosidase. ... 39
Tableau II: Les énergies libres de liaisons ligand-enzyme et les résidus impliqués
d’α-glucosidase ... 41
Tableau III: Energie libre de liaisons ligand-enzyme et les résidus impliqués d’α-amylase. . 43 Tableau IV: Les énergies libres de liaisons ligand-enzyme et les résidus impliqués
d’α-amylase. ... 45
Tableau V: Résultat de synthèse des dérivés du chloro-acétamide 1a-9a ... 47 Tableau VI: Résultat de synthèse des dérivés du chloro-acétamide 1b-9b ... 50 Tableau VII: Données expérimentales du composé 3b. ... 57 Tableau VIII: Les valeurs IC50 de l’α-Glucosidase des dérivés d’acétamide testés 1a-9a. .... 59
Tableau IX: Les valeurs IC50 des dérivés d’azido-acétamides pour l’inhibition de l’
α-Glucosidase. ... 59
Tableau X: Les valeurs IC50 des dérivés d’acétamides pour l’inhibition de l’ α-amylase. ... 62
Tableau XI: Les valeurs d’IC50 d’inhibition de l’ α-amylase par les dérivés
Production scientifique
Article 1:
Synthesis, Experimental and Theoretical
Characterization of 2-azido-N-(4-methoxyphenyl)
acetamide
Article soumis
Article 2:
Synthesis, in silico and in vitro anti hyperglycemia
activity evaluation of new chloro acetamid and azido-
acetamid
Introduction générale ...1 Partie 1 : Conception des molécules bioactives ...4
I. Histoire naturelle du médicament ...5 II. L’espace chimique des produits naturels ...8 III. Synthèse intégrale ... 10 a. Assemblage des fragments ... 10 b. Constructions à partir des structures existantes ... 11 c. Les Chemins aléatoires (Random walks) ... 13 IV. La chimie combinatoire ... 14 V. Conception rationnelle de médicaments ... 16 a. Drug design ... 17 i) Approche basée sur le ligand ( ligand-based drug design) ... 18 ii) Approche base sur la structure (structure-based drug design) ... 18 (1) L’identification du site actif ... 19 (2) Les liaisons des fragments du ligand ... 20 (3) Approximation de l’énergie libre de liaison ... 21 b. Amarrage moléculaire ... 21
Partie 2: Approche innovante pour le développement de nouveaux dérivés d’acétamide. ... 23
1. Introduction ... 24 2. Matériels et méthodes ... 28 a) Amarrage moléculaire ( Molecular Docking) ... 28 i) Préparation des ligands et des cibles biologique ... 28 ii) Docking par AutoDock vina ... 29 iii) Visualisation par Pymol ... 30
b) Synthèse et cristallisation ... 30 i) Synthèse des dérivés du 2-chloro-N-(aryl)acétamide ... 31 (1) Mode opératoire général... 31 ii) Synthèse des dérivés du 2-azido-N-(aryl) acétamide ... 31 c) Activité anti -hyperglycémiante ... 31 i) Test enzymatique d’inhibition d’α-amylase... 32 (1) Réactifs ... 32 (2) Principe... 32 ii) Test enzymatique d’inhibition d’α-glucosidase ... 34 (1) Réactifs ... 35 (2) Principe... 35 (3) Mode opératoire ... 37 3. Résultats et discussion ... 38 a) Amarrage moléculaire ... 38 b) Chimie ... 46 c) Etudes in vitro de l’activité anti-hyperglycémiante ... 58 i) α-Glucosidase ... 58 ii) α-amylase ... 61 4. Conclusion ... 65
Conclusion général ... 66 Résumés ... 68 Annexes: Article soumis au journal of molecular structure ... 72 Références ... 92 Références bibliographiques ... 100
1
2
Le médicament semble aussi vieux que l’humanité. L’homme depuis le temps a cherché des moyens de se protéger de la souffrance et de la mort. La majorité des produits utilisés à cette fin ont été découverts dans le règne végétal. Depuis l’Antiquité jusqu’au XVIe siècle, les plantes, fraîches ou sèches, étaient utilisées sous diverses formes : poudres, baumes ou huiles essentielles, permettant parfois de présenter le produit actif sous une forme plus concentrée.
L’isolement de principes actifs définis chimiquement a permis de définir le médicament tel qu’on le connait aujourd’hui. Un précurseur en la matière fut le médecin suisse Paracelse. Au début du XVIe siècle, cet alchimiste prôna l’extraction de «l’âme des végétaux », la "quintessence"[1].
Cependant, il fallut attendre le XIXe siècle pour que la morphine soit isolée de l’opium [2], la strychnine de la Noix vomique ou bien la quinine de l’écorce de Quinquina [3]. Ce siècle a vu la chimie faire un bond en avant. Notamment dans le domaine des colorants. Paul Ehrlich observe que les colorants ont des affinités plus ou moins fortes en fonction des tissus biologiques et émet le postulat de l’existence de "chimiorécepteurs". Il étudie alors la structure chimique des médicaments du point de vue de leur mode d’action et de leur affinité pour les cellules qu’ils visent. Convaincu que les chimiorécepteurs des micro-organismes parasites et des cellules cancéreuses sont différents de ceux des tissus hôtes, il s’emploie à trouver des substances chimiques qui ont des affinités particulières pour les organismes pathogènes. Ainsi, il s’intéresse à Trepanema pallidum, bactérie responsable de la syphilis[4], et identifie la 606éme molécule de la série de molécules à base d’Arsenic dont il dispose comme étant active contre cette bactérie. Après des centaines d’expériences prouvant l’efficacité de la molécule contre la syphilis, il présenta le Salvarsan comme remède à cette maladie. La chimiothérapie est née. Paul Ehrlich recevra pour ses nombreux travaux le Prix Nobel de Médecine en 1908 [5].
Depuis, la pharmacologie est devenue une discipline à part entière. La littérature scientifique entre 1877 et 1939 est remplie des nombreuses découvertes de substances antibiotiques. L’une des plus importantes d’entre elles est sûrement la pénicilline, découverte par Alexander Fleming et isolée une dizaine d’années plus tard par Chain et Florey[6]. Sa très grande efficacité et son absence de toxicité sur l’homme révolutionnent le traitement des
3
infections bactériennes[7]. De nombreuses autres molécules thérapeutiques ont depuis été découvertes, comme l’Ivermectine [8] préconisé dans le traitement de plusieurs formes de filariose ou la cyclosporine A, un immuno-suppresseur qui a révolutionné la prévention du rejet d’organe lors d’une transplantation. La cyclosporine a été découverte en 1972, lors d’un programme de criblage de susbstances naturelles pour la découverte de nouveaux antibiotiques [9].
Aujourd’hui, de nombreuses avancées technologiques et scientifiques, dans les domaines de la chimie, de la génétique, de la biochimie, de la biologie ou de l’informatique, ont transformé la recherche de nouveaux médicaments dans l’industrie pharmaceutique.
Mon travail de thèse étant inscrit en grande partie dans une logique thérapeutique, j’ai choisi de donner dans une première partie des éléments de réflexion concernant la découverte de molécules bioactives candidates-médicaments. A savoir l’espace chimique des produits naturels comme source d’inspiration, les modes de synthèse intégrale, la chimie combinatoire et les approches rationnelles de la conception des médicaments.
Ces éléments permettront de justifier l’approche choisie pour avoir des inhibiteurs dérivés d’acétamide de haute affinité pour l’α-glucosidase et pour l’α-amylase.
4
Partie 1 :
Conception des molécules bioactives
5
I. Histoire naturelle du médicament
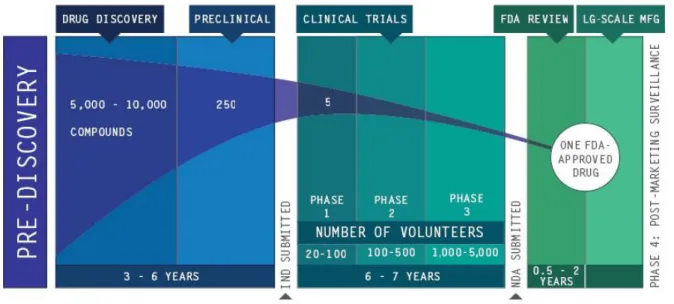
La découverte d’un médicament comporte quelques étapes avant d’aborder les essais cliniques chez l’homme (Figure 1).
La première, créative, consistant en la mise en évidence de propriétés biologiques intéressantes chez un principe actif, préparé par synthèse ou d’origine naturelle et constituant un chef de file (tête de série). Cette étape peut faire appel au criblage à haut débit, à l’aide de robots automatisés de composés issus de collections de substances chimiques (chimiothèques) ou obtenus par chimie combinatoire (synthèses automatisées à haut débit). Notons que la connaissance de propriétés thérapeutiques de matières premières d’origine végétale, fongique ou minérale, déjà connues par la médecine traditionnelle, a souvent orienté les recherches vers la séparation de principes actifs rentrant dans leur composition, suivie de la détermination de leur structure. Ces recherches ont conduit par la suite à leurs préparations à une grande échelle ainsi que de divers analogues structuraux en vue d’améliorer leurs propriétés biologiques.
D’autre part, lors de l’identification d’une cible biologique associée à une pathologie déterminée, la mise au point d’un test de criblage approprié peut également conduire à la sélection d’un chef de file. Ce dernier devrait présenter une bonne activité et posséder une structure telle qu’elle puisse permettre d’aborder la seconde étape, celle de son optimisation en vue d’améliorer ses propriétés biologiques. Celle-ci fait appel aux méthodes qualitatives et quantitatives d’études de relations structure-activité (RSA), conduisant à la sélection d’un principe actif susceptible de constituer un candidat médicament. Ce n’est qu’ensuite que seront poursuivis les essais toxicologiques et pharmacocinétiques ADME (absorption, distribution, métabolisme, excrétion) à l’aide de cultures cellulaires appropriées avant de les envisager chez différentes espèces animales et par la suite chez l’homme.
6
Figure 1: Les différentes étapes de développement d’un médicament
La mise au point de nouveaux médicaments peut également faire appel à l’optimisation des activités secondaires de principes actifs déjà connus. Cette approche SOSA (Selective Optimization of Side Activities) constitue une nouvelle voie de recherche. Elle prend en considération le fait qu’un médicament puisse agir sur différents récepteurs ou cibles biologiques. L’optimisation va consister à améliorer l’activité secondaire du principe actif pour une cible différente de celle pour laquelle elle a été initialement destinée. Elle va ainsi permettre de développer sélectivement l’effet secondaire pour conduire à un nouveau médicament.
La troisième étape est celle caractérisant le dossier pharmaceutique. Elle comporte des études analytiques du principe actif (préparation, identification, pureté, stabilité, dosage...) et de recherche galénique en vue de la mise en forme du principe actif en fonction de l’usage qui lui est réservé. Notons que, parallèlement aux procédés chimiques pour les études de métabolisme, la vectorisation d’un principe actif peut influencer les paramètres pharmacocinétiques et améliorer la sélectivité et l’activité.
7
La dernière étape concerne les études chez l’Homme, poursuivies selon les phases suivantes :
– phase I (6-12 mois): détermination de la dose maximale tolérée de principe actif chez des volontaires sains. Le choix de la dose initiale s’appuie sur les données connues à partir d’expérimentations animales ou de médicaments appartenant à la même famille thérapeutique (20 à 100 volontaires sains)
– phase II (12-24 mois): mise en évidence et preuve du ou des activités du principe actif. Elles sont complétées par la détermination des paramètres pharmacocinétiques en vue de déterminer la vitesse d’absorption du principe actif, d’établir son taux de fixation aux protéines plasmatiques, sa distribution dans divers tissus, son métabolisme éventuel, son élimination et sa demi-vie, permettant d’établir le mode d’emploi. De telles études sont initialement réalisées sur des animaux avant d’être transposées à l’Homme. Toutefois, la tendance actuelle s’oriente vers l’usage de cultures cellulaires humaines appropriées au cours d’une étape préliminaire (100 à 1000 patients)
– phase III : phase des essais cliniques permettant de valider la sécurité et l’efficacité du produit. Elle comporte des études comparatives. Elle conduit à la demande d’autorisation de mise sur le marché (AMM). Cette étape est indispensable en raison de la variabilité de la réponse donnée par un sujet, pour un médicament déterminé, en particulier selon son génome.
– phase IV : débutant après la mise sur le marché du médicament. Elle se caractérise par des études à grande échelle en vue de confirmer les propriétés thérapeutiques du médicament, son innocuité et de détecter d’éventuels effets secondaires. Ces études peuvent entraîner dans certains cas le retrait du médicament.
8
II. L’espace chimique des produits naturels
Historiquement, les produits naturels et leurs dérivés ont été une source majeure d'agents thérapeutiques. Presque 50 % des nouvelles entités chimiques présentées dans les années 1980 et les années 1990 ont été tirées directement ou indirectement des structures de produits naturels [10] Il y a maintenant un regain d'intérêt de la biosynthèse des squelettes de produits naturels et de l’amélioration des méthodes synthétiques qui peuvent plus aisément produire des structures complexes issues des produits naturels. [11, 12].
De nombreuses molécules extraites de la nature, plantes et autres organismes vivants, de la terre ont démontré leur grande utilité pour combattre de nombreuses maladies. En les étudiant, les chercheurs ont pu élucider les mécanismes cellulaires complexes sous-jacents à leur activité thérapeutique. C’est ainsi qu’ils ont découvert de nouvelles ≪ cibles thérapeutiques≫, à savoir des entités de notre organisme (protéines, ADN, etc.) sur lesquelles peuvent agir des médicaments. Poussant encore plus loin leur recherche, ils ont ainsi pu concevoir de nouvelles molécules, ressemblant aux produits naturels, mais avec des propriétés thérapeutiques encore meilleures. Cette démarche a permis de réaliser de grandes avancées, si bien que 61 % des nouvelles molécules chimiques introduites comme médicaments au cours de la période 1981-2002 sont inspirées de produits naturels (78 % des antibactériens) 74 % des anticancéreux), ce chiffre atteignant 80 % en 2003 [13].
Ainsi en 1962 le botaniste américain, Arthur Barclay, découvrit les propriétés inattendues des extraits d’écorce de l’if. L’extrait actif fut purifié par le chimiste Monroe Wall et son mode d’action, original, élucidé en 1979. Et a conduit à l’isolation du Taxol, un agent empêchant la formation du fuseau mitotique [14].(Figure 2)
9
a) b)
Figure2: a) Taxus baccata b) structure du taxol
Des méthodes synthétiques plus récentes s'efforcent, grâce à la synthèse basée sur la diversité, de permettre, à partir d’un bloc chimique simple au départ; la génération d'une grande collection d'entités diverses et complexes. Pour faciliter l’exploration d'un espace chimique de composés basés sur les produits naturels, Waldmann et ses collaborateurs ont fourni une classification structurale des produits naturels (SCONPs) basée sur les squelettes sous-jacents présents dans ces produits naturels [15].
Cette organisation hiérarchique basée sur le squelette structural des composés naturels peut fournir des conseils sur la sélection de motifs moléculaires spécifiques utilisés dans le développement de bibliothèques chimiques basées sur les composés naturels.
10
III. Synthèse intégrale:
a. Assemblage des fragments
La découverte de nouveaux médicaments basée sur les fragments repose sur le concept de base que la complémentarité moléculaire est plus facilement et efficacement explorée avec les petits fragments moléculaires de taille allant jusqu'à 12 atomes, puisque le nombre de tels fragments, ~107, est beaucoup plus petit que le grand nombre de molécules semblables au médicament qui est supérieur à 1060.
Des exemples récents d’application de cette technique ont été détaillés par Congreve et al., [16]. La synthèse guidée par un modèle peut être considérée comme une extension de l’assemblage par fragments : par exemple, la biosynthèse peut être utilisée comme modèle d’assemblage de fragments moléculaires afin de conduire à la formation des liaisons covalentes entre fragments et former une molécule active[17].
Un excellent exemple de succès de cette approche est la synthèse de l’inhibiteur de l’acétylcholine estérase avec une affinité femto môlaire à partir des motifs de la Tacrine et du Phenanthridinium[18]. (Figure 3)
11
Figure 3: Synthèse d’inhibiteur de l’acétylcholine par assemblage de fragments
b. Constructions à partir des structures existantes
La base la plus fructueuse pour la découverte d’un nouveau médicament est de se baser sur un médicament déjà connu [19]. Clairement, il existe beaucoup d’exemples de médicaments qui sont des variations d’anciens médicaments : par exemple les β-bloquants, les antidépresseurs tricycliques, le 1,4-dihydropyridine bloquant des canaux de calcium, etc..[20] Parfois des médicaments sont produits en réponse à la concurrence ou pour des besoins économiques. Cette approche produit fréquemment des molécules très similaires mais avec des propriétés pharmacocinétiques et pharmacodynamiques différentes. De plus, puisque ces
12
molécules sont déjà connues dans l’occupation d’un espace pharmacologique validé, elles peuvent être employées comme « têtes de série » pour de nouvelles indications thérapeutiques.
Récemment, cette approche a permis le développement d’anti rétroviraux actives sur le coronavirus (MERS-CoV) [21], par synthèse de nouvelles molécules analogues de la 6-Fluorinated-aristeromycine inhibant à la fois l’ARN polymérase et l’adenosyl-L- homocystéine (SAH) hydrolase. (Figure 4)
N N N N NH2 OH OH H H H H O H N N N N NH2 H2 C OH OH H H H H O H X y N N N N NH2 OH OH H H H H y X O P HN O O O O (-)aristeromycin X=F, Y=H X=H, Y=F X=Y=F
Figure 4: Nouveaux antiviraux dérivés de l’aristeromycine
L’approche basée sur l’optimisation sélective des effets secondaires (SOSA) permet de cribler une bibliothèque de médicaments existants (avec des valeurs de toxicité et biodisponibilité connue chez l’homme) sur de nouvelles cibles. L’optimisation structurale subséquente permet de convertir l’effet secondaire pour un médicament existant en une activité principale d’une nouvelle entité thérapeutique [22].
En se basant sur cette approche, Très récemment, l’équipe de recherche de chimie thérapeutique de la Faculté de Médecine et de Pharmacie de Rabat à mise au point des méthodes de synthèse des dérivés du phenytoine et a isolé un nombre considérable de molécules analogues à la fois plus actives et moins toxiques [23], [24].
13
c. Les Chemins aléatoires (Random walks)
Cette méthode permet d’explorer la diversité moléculaire en utilisant la génération aléatoire des structures moléculaires à partir d’un sous-ensemble constitué de molécules ayant un intérêt thérapeutique précis. Étant donné les dimensions de l’espace chimique des petites molécules, la probabilité de recherche fructueuse par les chemins purement aléatoires est faible, ce qui explique l'échec des premières mises en œuvre de la chimie combinatoire qui n’incluaient pas les considérations sur « la qualité » des médicaments [25].
De plus en plus, l'attention est portée sur les bibliothèques focalisées, basées soit sur des échafaudages moléculaires productifs (médicaments existant et structures privilégiées), soit sur l’imitation de la chimie combinatoire de la nature par des méthodes basées sur la diversité [26].
14
IV. La chimie combinatoire
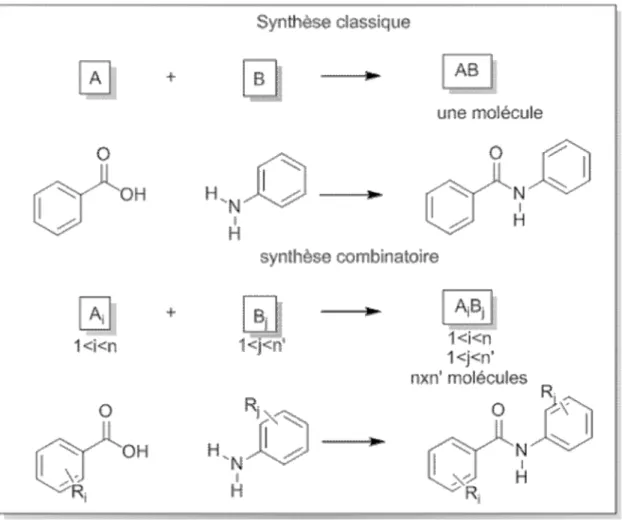
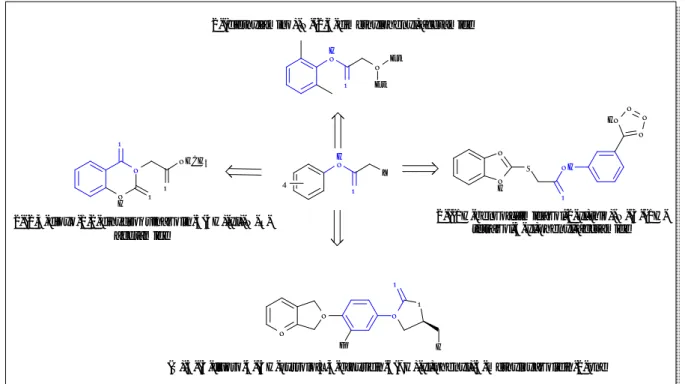
Le principe fondamental de la chimie combinatoire n'est pas tant éloigné du travail du chimiste organicien classique. Plutôt que de se limiter à la mise en présence de deux molécules A et B pour obtenir le composés AB (figure 5), l'idée est de sélectionner n molécules A1 à An partageant la même fonction réactive et de les mettre en réaction avec n’
molécules de type B. Ainsi, n x n’ composés sont obtenus et constituent une banque ou une chimio-thèque de composés. Ces molécules sont testées telles quelles, sans purification ni analyse poussée, qui sont les étapes les plus longues et les plus coûteuses du travail du chimiste. Le principe est donc de n'isoler et de ne caractériser complètement un produit que lorsqu'il a déjà manifesté une activité intéressante.
15
La chimie combinatoire (réelle ou virtuelle) est apparue naturellement comme une option viable au problème de la diversité moléculaire. Aujourd’hui, c’est un moyen pratique pour prédire et synthétiser un grand nombre de molécules en chimie pharmaceutique et agrochimique [27], [29]. Comme moteur de diversité, cet outil est devenu indispensable et a joué un rôle important dans le progrès de la synthèse automatique et parallèle survenu ces dernières années. Cette méthode repose sur l’idée d’obtenir le plus grand nombre de produits possible d’une réaction particulière et ceci sous certaines conditions [30], [31]. Comme le mot l’indique, ces possibilités dites «combinatoires» ne sont pas infinies mais très nombreuses, d’où le problème du traitement (réel ou virtuel) de ces molécules (Figure 6). Aux données combinatoires s’ajoutent de nouvelles molécules, issues des synthèses, des extractions et d’autres procédés chimiques, dans les bases de données chimiques à caractère académique ou industriel. Ainsi, chaque année, le CAS voit sa base de molécules chimiques augmenter de millions de nouveaux composants. Les structures, les propriétés physicochimiques et biologiques de ces molécules sont ensuite codées et enregistrées, générant plus d’informations. L’organisation, l’analyse, la recherche et la gestion de cette grande quantité d’informations ouvrent de nouvelles possibilités aux techniques novatrices de chimie informatique, parmi lesquelles on compte le CEHD ou CVHD, la fouille de données (data-mining), etc.
16
V. Conception rationnelle de médicaments :
Les méthodes traditionnelles de découverte de médicaments s’appuient beaucoup sur la base ≪ essai-erreur ≫ effectués via les tests de substances chimiques sur des cellules de cultures ou sur les animaux. En regroupant les effets apparents des traitements, la conception rationnelle de médicaments se fonde essentiellement sur deux évidences. La première est que les modulations d’une cible spécifique peuvent présenter un potentiel thérapeutique. Cette hypothèse découle de nombreuses études montrant l’association entre les mutations de cibles biologiques et certains états pathologiques. La deuxième évidence est que toute cible thérapeutique doit présenter des propriétés dites ≪ druggable ≫. Cette propriété décrit la capacité d’une cible à se lier à de petites molécules ayant le pouvoir de moduler son activité.
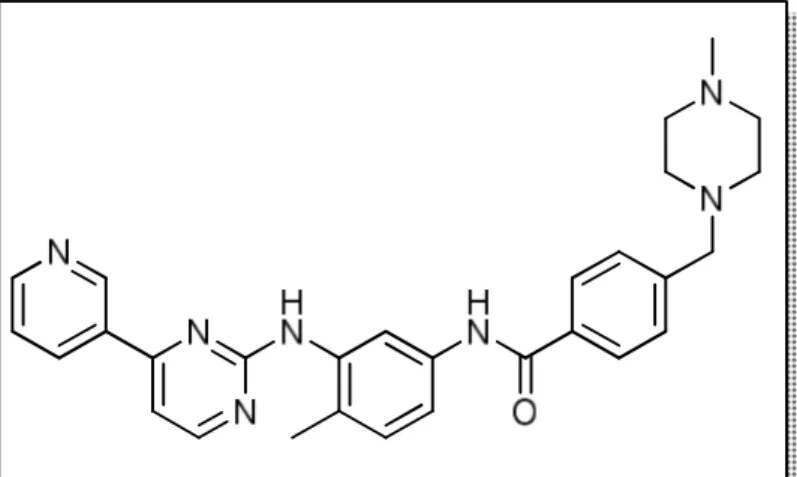
Un exemple d’anticancéreux célèbre et issu des méthodes de conception rationnelle de médicament est la molécule de l’imatinib (plus connue sous le nom commercial du GlivecR). Cet inhibiteur de Tyrosine Kinase est spécifique de la protéine Bcr-Abl caractéristique de la Leucémie Myéloïde Chronique (LMC) et de la Leucémie Myéloïde Aigue (LMA) (Figure 7).
17
a. Drug design:
Le domaine du Drug design ou conception de médicaments peut être exploré par la modélisation moléculaire et la conception de nouvelles molécules à l’aide des outils informatiques.
Il est aussi appelé Drug Design rationnel et peut être défini par un ensemble de processus inventifs capables de trouver de nouveaux médicaments basés sur les connaissances de cibles biologiques. Le médicament ou la molécule thérapeutique est généralement une petite molécule activant ou inhibant la fonction d’une biomolécule telle que les protéines et entrainant un bénéfice thérapeutique pour le patient. Fondamentalement, la conception de médicament inclut la conception de petites molécules de formes et charges complémentaires à la cible moléculaire avec laquelle elles interagiront. La conception de médicaments repose fréquemment sur les techniques de modélisation sur ordinateur dites aussi ≪ in silico≫[32]. Ce type de modélisation est connu sous le nom de conception de médicaments assistée par ordinateur.
Les techniques de modélisation tentent de prédire l’affinité entre le ligand et sa cible et, à ce jour, les résultats sont globalement satisfaisants. Cependant, il existe d’autres propriétés qui doivent être optimisées pour que le ligand devienne sûr et efficace autant que puisse l’être un médicament. Ces caractéristiques moléculaires qui sont l’absence d’effets secondaires, la biodisponibilité, la demi vie métabolique, la toxicité etc, sont par ailleurs assez difficiles à optimiser avec les techniques de conception de médicaments rationnelles.
Une cible médicamenteuse est une clé moléculaire qui se trouve dans un métabolisme particulier et évolue dans un cheminement de signalisation spécifique à une pathologie ou une infection, ou à la survie de pathogènes microbiens. Il existe des approches qui tentent d’inhiber le fonctionnement du cheminement de la maladie par l’intervention d’une molécule clé qui arrêterait le fonctionnement en question. Des médicaments se liant à la région active et inhibant cette partie clé de la molécule peuvent être alors conçus. Une autre approche vise à améliorer le cheminement normal par la promotion de molécules spécifiques, qui affectent ce cheminement en question, dans un état pathologique. En plus de tout cela, les médicaments conçus doivent répondre à la propriété de sélectivité. Cette sélectivité est un terme relatif qui
18
correspond au rapport de l’affinité du médicament pour la cible visée, dans un objectif thérapeutique, sur son affinité pour d’autres cibles. En d’autres termes, si le médicament ne répond pas à la caractéristique de la sélectivité, cela provoquerait de lourds effets secondaires.
Plus communément, les médicaments sont des petites molécules organiques produites à partir de synthèses chimiques ou à partir de processus biologiques (les médicamentes ou nanoparticules basées sur les polymères de gènes via l’ARN messager ou « gène silencing ».
Deux types d’approches de drug design sont connus. La première fait référence au ligand et se nomme « ligand-based drug design » et la deuxième se réfère à la cible moléculaire et se nomme « structure-based drug design ».
i) Approche basée sur le ligand ( ligand-based drug design)
Cette démarche repose sur les connaissances acquises concernant d’autres molécules interagissant avec la cible d’intérêt biologique. Ces composés peuvent être utilisés afin d’en dériver un pharmacophore qui définit le minimum de caractéristiques que doit posséder la molécule afin d’interagir avec le système biologique d’intérêt [33]. Ici, le manipulateur détermine une relation de structure-activité quantitative (QSAR) dans laquelle une corrélation entre les propriétés des molécules calculées et leur activité biologique, expérimentalement déterminée, est établie. A leur tour, ces relations QSAR peuvent être utilisées pour la prédiction de nouveaux analogues.
ii) Approche base sur la structure (structure-based drug design)
L’approche repose sur les connaissances de la structure tridimensionnelle de la cible biologique. Ces connaissances sont obtenues par des méthodes expérimentales telles que la cristallographie par rayons X et la spectroscopie par Résonnance Magnétique Nucléaire (RMN). Ceci est possible si la structure de la cible est connue. Par contre, pour toutes les structures non déterminées expérimentalement il est possible d’obtenir un modèle, construit avec la modélisation par homologie, basé sur la structure expérimentale d’une protéine proche (même classe voire même famille). En utilisant la structure de la cible biologique, la conception de molécules ayant une grande affinité sélective à la cible se fait à l’aide d’outils graphiques et interactifs, de procédures de calculs automatises et en comptant aussi sur
19
l’intuition d’un chimiste médicinal. Avec le développement des méthodes expérimentales (Cristallographie aux Rayons X, spectroscopie RMN), la quantité d’informations des structures 3D des cibles biomoléculaires connait elle aussi un grand essor. En même temps, les informations relatives aux propriétés électroniques et à la dynamique structurale des ligands sont en continuelle expansion. Tous ces développements se répercutent positivement sur l’évolution des approches « structure-based » de la conception des médicaments. D’où la division de ce type d’approche en deux :
a. première catégorie s’intéresse à « trouver » un ligand pour une cible ou un récepteur donne dans une base de données servant aux recherches. Cette méthode consiste à cribler un grand nombre de ligands pour extraire ceux qui s’adaptent à la poche de liaison du récepteur. L’avantage de cette méthode consiste en l’économie d’efforts de synthèse dans la recherche de nouveaux « composés de tête » (lead compounds).
b. La deuxième catégorie s’intéresse, quant à elle, à la « construction» du ligand, généralement désignée comme « receptor-based» de la conception des médicaments. Les ligands sont édifies sans tenir compte des contraintes structurales dues à la poche de liaison, en assemblant de petites parties de molécules de manière graduelle. Les différentes parties en question peuvent être des fragments moléculaires ou des atomes. L’avantage de cette méthode, qui connait de plus en plus d’engouement [34], réside dans la construction de molécules originales qui ne se trouvent pas dans les bases de données.
Généralement, la méthodologie utilisée dans la démarche «structure-base » consiste en trois étapes essentielles :
(1) L’identification du site actif
Cette première étape consiste à analyser la protéine en trouvant les coordonnées du site actif ou site de liaison et les résidus essentiels à la formation des liaisons ligand-récepteur. Pour cela, il est nécessaire d’avoir la structure 3D de la protéine avec un ligand pre-docke (pre-arrime), dans le format de fichier PDB par exemple, et de disposer aussi des propriétés atomiques de l’ensemble. Ligand et récepteur doivent être classés et leurs propriétés atomiques doivent être définies généralement comme suit :
20
Les atomes hydrophobes : tous les carbones sont dans des chaines carbonées ou dans des groupements aromatiques.
Les liaisons hydrogène donneur : cela concerne les atomes d’hydrogène liés à des atomes d’oxygène et d’azote.
Les liaisons hydrogène accepteur : cela concerne les liaisons des atomes d’oxygène et d’azote (hybrides sp ou sp2) avec des paires d’électrons libres.
L’espace interne de la région de liaison est étudié avec des atomes sonde virtuels selon les quatre types de liaisons, de manière à étendre les connaissances sur l’ensemble des recoins de cette région. Cela nous donne l’information nécessaire pour faire correspondre les groupements d’interactions du ligand avec les bons points d’ancrage dans la poche de liaison du récepteur.
(2) Les liaisons des fragments du ligand
Le terme « fragment » est utilisé pour désigner les « blocs» d’atomes entrant dans la construction d’une structure organique. Le premier fragment sera introduit dans les différentes régions du site d’activation déjà défini auquel l’expérimentateur combinera d’autres fragments moléculaires un par un. Pour cela, il faudra prendre en compte des paramètres tels qu’une énergie de liaison minime extraite de la surface d’énergie potentielle entre les fragments introduits et la poche de liaison. D’où la nécessite de faire des calculs de fonctions de score pour chaque changement de conformation des fragments dérivant des multiples combinaisons. Au vu de l’étendue des combinaisons possibles, il est préférable de prendre comme base de construction la conformation du premier fragment qui forme des interactions significatives. Cette première conformation, assurant une bonne affinité d’interaction, décidera de la manière d’évolution du ligand au cours d’un processus optimisant l’énergie du complexe protéine/ligand. Cette stratégie réduit efficacement la lourdeur des calculs de construction de fragments en diminuant, certes, le nombre de combinaisons possible mais en fiabilisant les ligands construits [34], [35].
21
(3) Approximation de l’énergie libre de liaison
L’hypothèse de base sous-jacente de la conception de médicament ≪ structure-based ≫ est qu’un bon ligand doit se lier a sa cible avec une bonne affinité. Pour cela, le paramètre le plus important dans l’obtention potentielle des nouveaux ligands réside dans la prédiction des affinités de liaisons entre un ligand et sa cible et son utilisation comme critère de sélection. Cette prédiction passe par la fonction empirique développée par Bohm :
Sachant que:
ΔGbind = ΔGmouvement + ΔGinteraction + ΔGdesolvation + ΔGconfiguration
L’idée de base est que toute énergie libre de liaison peut se décomposer en éléments indépendants et connus pour être importants dans le processus de liaison. Chaque partie de l’équation représente une sorte d’énergie libre d’altération durant le processus de liaison entre le ligand et son récepteur. L’établissement et l’étalonnage de sous-modelés de ces équations représentent de vrais challenges pour les chercheurs. Ces sous-modèles dépendent des considérations accordées aux systèmes étudiés et sont continuellement améliorés [36].
Par rapport aux fonctions de score habituellement utilisées dans les algorithmes de docking, ces méthodes précises sont plus couteuses en temps de calcul et ne sont pas encore utilisées couramment en criblage virtuel.
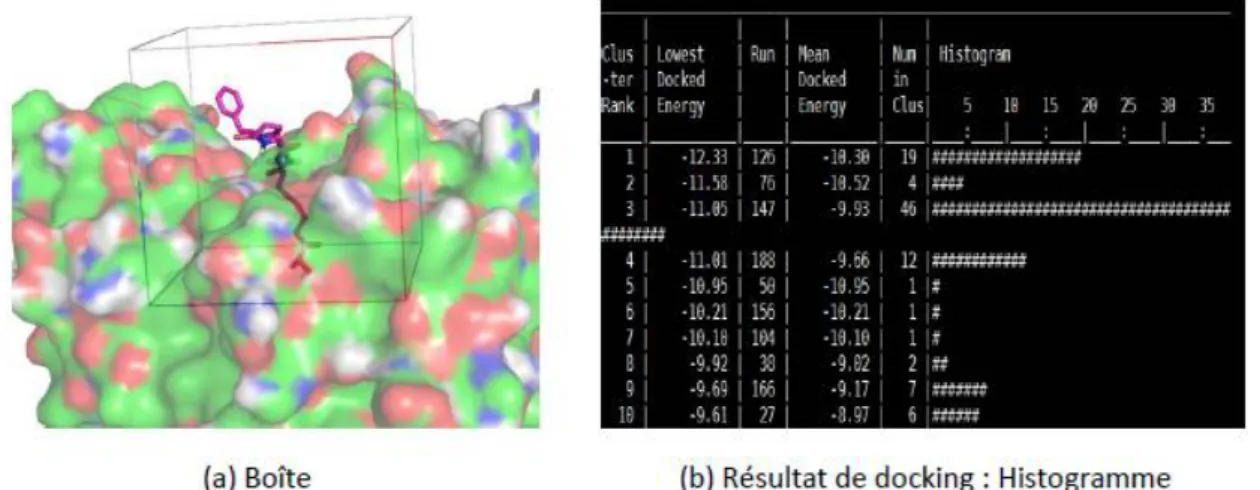
b. Amarrage moléculaire
Le Docking moléculaire in silico vise à prédire la structure d'un complexe moléculaire à partir des molécules isolées, Il est utilisé pour faire des criblages très rapides et peu coûteux afin d’identifier une molécule pouvant avoir une forte activité sur une protéine cible ou au contraire d’identifier la cible d’une molécule ayant des activités biologiques intéressantes D’autre part, lorsque la structure tridimensionnelle d’une protéine cible est définie, le docking permet de mettre en évidence les régions et les résidus à explorer pour optimiser l’affinité