HAL Id: tel-02927435
https://tel.archives-ouvertes.fr/tel-02927435
Submitted on 1 Sep 2020HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
racinaire chez Arabidopsis thaliana
Yannick Guerringue
To cite this version:
Yannick Guerringue. Caractérisation du canal mécanosensible RMA et recherche de sa contribution à la mécanotransduction racinaire chez Arabidopsis thaliana. Biologie végétale. Université Paris-Saclay, 2020. Français. �NNT : 2020UPASS105�. �tel-02927435�
Caractérisation du canal mécanosensible RMA et
recherche de sa contribution à la mécanotransduction
racinaire chez
Arabidopsis thaliana
Thèse de doctorat de l'université Paris-Saclay
École doctorale n°567
Sciences du végétal : du gène à l'écosystème (SDV)
Spécialité de doctorat: Biologie Unité de recherche : Université Paris-Saclay, CEA, CNRS, Institute for Integrative Biology of the Cell (I2BC), 91198, Gif-sur-Yvette, France. Référent : Faculté des sciences
Thèse présentée et soutenue à Gif-sur-Yvette, le 03 juillet 2020, par
Yannick GUERRINGUE
Composition du Jury
Samantha VERNHETTES
Directrice de Recherche, INRAE, Université Paris-Saclay Présidente Olivier HAMANT
Directeur de Recherche, INRAE, ENS Lyon Rapporteur & Examinateur Anne-Aliénor VERY
Chargée de Recherche, HDR, CNRS, Université de Montpellier
Rapporteur & Examinatrice Bertrand COSTE
Chargé de Recherche, CNRS, Université Aix-Marseille Examinateur Christian MAZARS
Directeur de Recherche, CNRS, Université Toulouse III
Examinateur
Jean-Marie FRACHISSE
Chargé de Recherche, CNRS, Université Paris-Saclay Directeur de thèse
Th
ès
e
de
d
oc
to
ra
t
N N T : 2 02 0U PA SS 10 5
Je remercie Jean-Marie qui m'a chaleureusement accueilli en Master pour un stage et m'a fait découvrir avec passion le domaine (certes passionnant) des canaux mécanosensibles. Il m'a formé avec patience à la technique subtile du patch clamp et m'a permis de construire ce travail de thèse. Il a su être à l'écoute et être de bon conseil tout en laissant exprimer mes envies et mes aspirations.
Mes remerciements vont également à l'ENS Lyon qui m'a accordé sa confiance en m'allouant cette bourse de thèse.
Merci à Sébastien qui m'a accueilli dans l'équipe et a su partager sa culture scientifique éclectique.
Merci à Joni qui a pris le temps de me former à la fabrication des puces et la mise en place des expériences de microfluidique et qui a toujours montré un grand enthousiasme. Merci aussi à Vassanti qui a pris la suite de Joni. Nos discussions autour des pousses-seringues étaient aussi bien scientifiques que philosophiques (même si je ne te remercie pas pour La Horde du Contrevent).
Merci à la plateforme Imagerie Gif, notamment Laetitia, Romain et Sandrine qui m'ont appris la théorie comme l'utilisation pratique des microscopes et étaient toujours présents pour répondre aux questions.
Merci à Jean-Marc qui a trouvé la pédagogie pour me faire comprendre les enjeux de physique derrière mes expériences et a apporté un regard différent sur mon travail.
Je remercie tous les laboratoires qui nous ont envoyé des échantillons et qui sont cités dans la partie Matériel & Méthodes.
du patch clamp, aussi bien les conseils que les frustrations. Merci à Sylvain, à Sophie, à Michele et à Christelle pour leur expertise en biologie moléculaire, même si je n'ai pas toujours suivi leurs conseils. Merci à Julie pour sa folie et son aide constante même après avoir quitté le labo. Merci à Céleste pour sa bonne humeur et ses conseils de lecture torturés. Merci pour tous les bons moments : les soirées karaoké avec Marjorie, Julie, Amanda, Alvaro, Christof, Xia, l'organisation du repas de Noël avec Julie et Céleste, les discussions au coin du radiateur avec Elsa.
Merci à Violette, stagiaire avec qui j'ai dû me mettre à la biologie moléculaire. J'espère aussi pouvoir accueillir Isaty en stage cet été pour lui donner envie de travailler sur les canaux mécanosensibles comme mes prédécesseurs l'ont fait avec moi.
Je remercie les collègues et les étudiants à l'université Paris Diderot qui m'ont permis de me consacrer à mon envie d'enseigner et de transmettre, moments de respirations dans mon travail de thèse.
Merci à Rémi Peyronnet, Gwyneth Ingram et Jean-René Martin qui ont accepté de faire partie de mon comité de thèse pour partager leur expérience et leurs conseils.
Merci aux membres de mon jury de thèse Olivier Hamant, Anne-Aliénor Véry, Bertrand Coste, Christian Mazars et Samantha Vernhettes.
Table des matières
INTRODUCTION ... 15
I - De la sensibilité des plantes aux forces mécaniques ... 15
1 - La perception humaine de la sensibilité des plantes ... 15
2 - La répartition des contraintes mécaniques dans la plante ... 19
3 - Le développement des plantes est conditionné par les contraintes mécaniques ... 21
4 - Signalisation cellulaire lors d'une mécanostimulation ... 24
Expression génétique ... 24
Signal calcique : le déclencheur ? ... 25
Evénements précoces déclenchés par le calcium ... 28
Cas particulier d'un stress osmotique ... 30
Propagation du signal et réponse systémique ... 32
Accommodation aux stimulations mécaniques répétées ... 33
II - La transduction des signaux mécaniques chez les plantes ... 34
1 - Contraintes et déformations lors d'une stimulation mécanique ... 34
2 - Structures spécialisées dans la mécanoperception ... 36
3 - Mécanosenseurs moléculaires ... 37
Microtubules corticaux ... 37
Dans la paroi ... 39
Dans la membrane plasmique ... 41
Mécanotransduction à la périphérie cellulaire ... 45
III - Les canaux mécanosensibles : des transducteurs moléculaires de forces ... 46
1 - Caractérisation électrophysiologique des canaux mécanosensibles chez les plantes ... 46
Les canaux putatifs : MCA et Piezo ... 50
2 - Fonctionnement des canaux mécanosensibles... 51
3 - Rôle physiologique des canaux mécanosensibles ... 70
Régulation de la pression osmotique ... 70
Développement et contraintes mécaniques ... 72
Autres pistes à explorer ... 73
4 - Objectifs de la thèse : Rôle de RMA dans la mécanotransduction calcique ... 76
RESULTATS ... 79
Chapitre 1 : Caractérisation biophysique du canal mécanosensible RMA ... 79
Propriétés dynamiques des canaux RMA soumis à la pression ... 79
Sélectivité de RMA ... 81
Sensibilité de RMA à la tension membranaire ... 82
Activation de RMA au cours du temps ... 85
Caractérisation de l'inactivation de RMA ... 87
Construction d'un modèle d'activation de RMA ... 89
Chapitre 2 : Intégration de RMA dans la mécanotransduction cellulaire ... 92
Régulation de l'activité de RMA par le calcium ... 92
Régulation de l'activité de RMA par les microtubules ... 93
Recherche de l'identité moléculaire de RMA ... 95
Chapitre 3 : Recherche de l'activité RMA in planta : Contribution aux signaux calciques ... 99
1 - Contribution de RMA à la formation des signaux calciques générés par un choc osmotique ... 100
Caractérisation des signaux calciques chez le sauvage ... 100
Effet d'un inhibiteur sur les signaux calciques ... 101
Mesure des signaux calciques déclenchés par une pression ... 106
DISCUSSION ... 109
I - Modèle d'activation de RMA dans les cellules végétales ... 109
Estimation de la tension membranaire dans un patch excisé ... 109
Causes de la perte d'activité de RMA ... 111
Effet du cytosquelette sur l'activité des canaux mécanosensibles ... 113
II - Identité moléculaire de RMA ... 114
Variabilité de l'activité RMA entre patchs ... 114
Etude des mutants piezo et osca ... 116
III - Activation de RMA dans la plante ... 117
Activation des canaux RMA dans la cellule végétale ... 117
Développement d'une nouvelle technique pour analyser l'ouverture des canaux mécanosensibles in planta ... 119
Les canaux mécanosensibles en tant que soupape de sécurité ... 121
Les canaux mécanosensibles en tant que senseurs de tension ... 122
CONCLUSION ... 125
MATERIEL & METHODES ... 129
I - Electrophysiologie ... 129
Matériel biologique ... 129
Génotypes ... 129
Culture des cals ... 130
Analyse des données ... 135
II - Microfluidique ... 135
Matériel biologique ... 136
Fabrication des puces... 137
Fabrication des pièces de PDMS ... 137
Fabrication de la puce microfluidique ... 138
Fabrication de la puce à valve ... 140
Calibration de la puce à valve ... 140
Mise en culture des plantules ... 141
Acquisition des données ... 142
Analyse des données ... 144
ANNEXE ... 147
Figure 1 – Représentation de la scala naturae à la Renaissance. ... 16
Figure 2 – Plantes exécutant un mouvement rapide en réponse à une stimulation tactile. ... 17
Figure 3 – Quelques dessins de Darwin qui décrivent des mouvements de plantes. ... 18
Figure 4 – Morphogénèse et contraintes mécaniques. ... 23
Figure 5 – Signaux calciques déclenchés par des stimulations mécaniques. ... 27
Figure 6 – Signalisation déclenchée par une stimulation mécanique. ... 29
Figure 7 – Contraintes mécaniques et déformations associées. ... 35
Figure 8 – Réorientation des microtubules selon les contraintes mécaniques. ... 38
Figure 9 – Défauts de mécanotransduction dans les mutants feronia. ... 40
Figure 10 – Modèle d'activation des canaux mécanosensibles par leur interaction avec les lipides membranaires. ... 44
Figure 11 – Mécanosenseurs à la périphérie cellulaire. ... 46
Figure 12 – Enregistrements de l'activité des différents MSL ... 48
Figure 13 – Enregistrements de l'activité des canaux cationiques ... 49
Figure 14 – Fonctions des canaux mécanosensibles chez les plantes. ... 71
Figure 15 – Dynamique du courant RMA induit par un pulse de pression. ... 80
Figure 16 – Le canal RMA est perméable au sodium. ... 82
Figure 17 – Le canal RMA est activé par la tension membranaire. ... 83
Figure 18 – La pression d'apparition du premier pic est un paramètre intrinsèque au canal qui permet d'estimer la tension dans le patch. ... 84
Figure 19 – L'activité de RMA diminue au fur et à mesure des stimulations. ... 86
Figure 20 – La perte d'activité de RMA est indépendante de la durée du pulse de pression. ... 87
Figure 21 – Analyse de l'inactivation de RMA. ... 88
Figure 24 – L'ajout d'oryzaline dans la pipette augmente la sensibilité de RMA à la pression. ... 94
Figure 25 – Le courant RMA n'est pas perturbé dans les mutants piezo. ... 96
Figure 26 – Le courant RMA n'est pas perturbé dans différents mutants osca. ... 97
Figure 27 – Caractérisation des signaux calciques déclenchés par des chocs osmotiques dans la racine. ... 101
Figure 28 – Effet du gadolinium sur les signaux calciques déclenchés par des chocs osmotiques. ... 102
Figure 29 – Caractérisation des signaux calciques déclenchés par des chocs osmotiques dans les racines des mutants dek1-2 et dek1-3. ... 104
Figure 30 – Montage et calibration de la puce à valve. ... 106
Figure 31 – Caractérisation des signaux calciques déclenchés par une pression. ... 107
Figure 32 – Schématisation des étapes nécessaires à l'obtention de la configuration outside-out. ... 133
Figure 33 – Illustration des fits utilisés pour analyser l'activité de RMA. ... 134
Figure 34 – Protocole de fabrication d'une chambre microfluidique. ... 138
Figure 35 – Protocole de fabrication d'une chambre microfluidique avec valve. ... 139
Figure 36 – Mise en place d'une expérience de microfluidique. ... 141
L’étude a été réalisée sur l’organisme modèle Arabidopsis thaliana, qu’on note Arabidopsis dans le texte.
La langue contemporaine des sciences étant l’anglais, plusieurs termes difficiles à traduire ont été employés en anglais ou francisés. C’est le cas des termes techniques utilisés en électrophysiologie comme patch clamp, seal (scellement de la membrane à la pipette), patch (morceau de membrane à la pointe de la pipette), pulse (stimulation de pression en créneau) et des configurations (cell-attached, whole-cell, outside-out, inside-out). De plus le verbe anglais fit a été francisé en fitter, signifiant faire un ajustement sur une courbe.
Les figures notées avec un S se trouvent dans la partie Annexe à la fin du document.
ADN ADN-T ATP BAPTA CAM CML CRISPR DEK DMSO FER FRET GFP HBED HEK HEPES HSPC acide désoxyribonucléique ADN de transfert adénosine triphosphate acide 1,2-bis(o-aminophénoxy)éthane-N,N,N′,N′-tétraacetique calmoduline calmodulin-like
clustered regularly interspaced short palindromic repeats
defective kernel diméthylsulfoxyde FERONIA
Förster resonance energy transfer green fluorescent protein
acide hydroxybenzyl éthylènediamine diacétique
human embryonic kidney cell
acide 4-(2-hydroxyéthyl)-1-pipérazine éthane sulfonique
high-speed pressure clamp
JA KO LB MAC MCA MES MS MSL PCR PDMS PTFE RMA RBOH ROS SDS TCH TPC UV acide jasmonique knock-out milieu Luria-Bertani méristème apical caulinaire mid1-complementing activity
acide 2-(N-morpholino) éthanosulfonique milieu Murashige-Skoog
MscS-like channel
polymerase chain reaction polydiméthylsiloxane polytétrafluoroéthylène rapid mechanically activated
NADPH oxidase/respiratory burst oxidase homolog
reactive oxygen species dodécylsulfate de sodium touch genes
two-pore channel ultra-violet
Introduction
I - De la sensibilité des plantes aux forces mécaniques
1 - La perception humaine de la sensibilité des plantes
« Nous disons donc, pour commencer toute cette étude, que l'être animé se distingue de l'être inanimé, parce qu'il vit. Mais vivre ayant plusieurs sens, pour affirmer d'un être qu'il vit, il nous suffit qu'il y ait en lui une seule des choses suivantes : l'intelligence, la sensibilité, le mouvement et le repos dans l'espace, et aussi ce mouvement qui se rapporte à la nutrition, à l'accroissement et au dépérissement. Ce qui fait que de toutes les plantes on peut dire qu'elles vivent, c'est qu'elles paraissent avoir en elles-mêmes une force et un principe d'où elles tirent leur accroissement et leur dépérissement en sens contraires. […] Ainsi donc c'est par ce principe que la vie appartient aux êtres qui vivent. Mais l'animal n'est constitué primitivement que par la sensibilité. Aussi les êtres qui ne sont pas doués de mouvement et qui ne changent pas de place, s'ils ont cependant la sensibilité, n'en sont pas moins appelés des animaux ; et nous ne disons pas simplement qu'ils vivent. Le premier sens qui appartient à tous les animaux, c'est le toucher; et de même que la nutrition peut s'isoler du toucher et de toute sensibilité, de même le toucher peut s'isoler de tous les autres sens. Nous appelons faculté de nutrition cette partie de l'âme qui est commune aux plantes elles-mêmes; mais tous les animaux sans exception paraissent avoir le sens du toucher. » (Aristote, De l'âme)
Dans son traité De l'âme, Aristote cherche à définir la vie et à tirer de grands principes sur le monde vivant et son organisation. Il y distingue trois types d'âmes : l'âme végétale, l'âme animale et l'âme humaine. L'âme végétale représente le développement des êtres vivants, et la nutrition qui procure des ressources, « ce mouvement qui se rapporte à la nutrition, à l'accroissement et au dépérissement ». L'âme animale donne en plus la faculté de percevoir son environnement, « la sensibilité, le mouvement et le repos dans l'espace ». Enfin l'âme humaine se distingue par son intelligence. Si Aristote admet que les plantes sont habitées d'un principe vital, celui-ci est considéré comme basique et il n'admet pas que les plantes ont conscience de leur environnement. Les plantes sont considérées comme des organismes passifs et primaires, qui ne font que croître. Cette conception de la vie est à l'origine d'une classification naturelle, sous forme d' « échelle des êtres », exposée par Aristote dans son Histoire des animaux, et reprise et formalisée au Moyen-Age sous le terme de scala naturae (Figure 1), dans laquelle les plantes sont tout en bas, ne se distinguant des pierres que par leur principe de vie.
16
Quelles sont les raisons pour lesquelles Aristote considère les plantes comme inférieures aux animaux ? Dès l'Antiquité la notion de sensibilité est réservée aux animaux car elle semble liée à la notion de mouvement. D'ailleurs le mot âme (anima en latin), a la même étymologie qu'animer et animal. On peut penser au premier abord que les plantes sont immobiles alors que les animaux sont mobiles. Et pourtant les plantes sont constamment en mouvement : le vent dans les feuilles d'un arbre, une abeille qui se pose sur une fleur, un akène de pissenlit transporté par le vent. Certes, tous ces mouvements sont passifs et ils ne signifient pas que les plantes sont capables de générer leurs propres mouvements. Les plantes ont un mode de vie fixé alors que les animaux peuvent se déplacer. Pour autant certains animaux comme les éponges ou les coraux ont également une vie fixée de la même manière que les végétaux. Alors qu'est-ce qui distingue fondamentalement une plante d'une éponge? Aristote estime que « les êtres qui ne sont pas doués de mouvement et qui ne changent pas de place, s'ils ont cependant la sensibilité, n'en sont pas moins appelés des animaux ». Ce serait donc bien la sensibilité qui distingue les plantes des animaux. Dans ce contexte, s'intéresser à la sensibilité des plantes a une portée aussi bien scientifique que philosophique et métaphysique. C'est remettre les plantes à leur juste place dans la classification naturelle, et en miroir s'interroger sur la place de l'homme dans cette classification. Se poser la question provocante : « Les plantes ont-elles une âme, une conscience, une intelligence ? », si on se débarrasse de tout anthropocentrisme, permet aussi de
Figure 1 – Représentation de la scala naturae à la Renaissance.
17
s'intéresser à d'autres modes de fonctionnement du vivant, plus éloignés de celui de l'être humain, d'autres paradigmes, d'autres adaptations aux mêmes contraintes avec les mêmes outils moléculaires et cellulaires.
Parmi les sens des animaux, Aristote considère le toucher comme le sens le plus fondamental. En effet, tous les organismes vivants, unicellulaires ou pluricellulaires, sont soumis à des contraintes mécaniques qui mettent en danger leur intégrité physique. On comprend alors que la capacité à sentir ces forces donne un avantage significatif pour la survie de l'individu. C'est pourquoi certains proposent que la mécanoperception soit une fonction originelle des premières cellules (Teng et al., 2015).
L'empreinte d'Aristote est encore présente dans notre société contemporaine et les plantes sont encore perçues comme étant passives face à l'environnement. Révéler aujourd'hui que les plantes ont le sens du toucher semble encore susciter pour le grand public et dans les magazines de vulgarisation scientifique autant de surprise que d'émerveillement. Pourtant certaines plantes sont connues pour réagir très rapidement à un contact physique, comme Dionaea muscipula ou Mimosa pudica qui se referment quand on les touche (Braam, 2005) (Figure 2). Ces mouvements générés par la plante
Figure 2 – Plantes exécutant un mouvement rapide en réponse à une stimulation tactile.
Photographies présentant le piège de Dionaea muscipula se refermant au contact d'un insecte (gauche) et les feuilles de Mimosa pudica se repliant à la suite d'un contact (adapté de Braam, 2005). Les flèches blanches indiquent les poils sensibles du piège.
18
elle-même en quelques secondes sont loin de l'idée qu'on se fait d'une plante. Et pourtant toutes les plantes sont capables de produire des mouvements actifs, mais, à l’exception de quelques exemples remarquables, ces mouvements sont lents et ne sont pas observables à l'échelle de temps de l'œil humain.
Bien avant la vidéo, Charles Darwin a décrit les mouvements généraux des plantes pour mieux comprendre leur sensibilité à leur environnement (Darwin and Darwin, 1880), car il semble que la notion de sensibilité soit toujours liée à celle de mobilité (Figure 3). Non seulement il décrit des mouvements actifs des plantes qui sont la résultante de mouvements circulaires (circumnutations) et de la croissance, mais il montre que ces mouvements peuvent être modifiés ou dirigés par les conditions du milieu. Par exemple les circumnutations des feuilles suivent le soleil (héliotropisme) et Figure 3 – Quelques dessins de Darwin qui décrivent des mouvements de plantes.
Darwin rend compte dans The power of movement in plants différents mouvements de plantes spontanés ou induits (Darwin and Darwin, 1880). (A) Mouvements de circumnutation de cotylédons de Brassica oleracea pendant 10h45min. (B) Tige de Desmodium gyrans avec les feuilles dressées le jour (gauche) et endormies la nuit (droite). (C) Coléoptiles de Phalaris canariensis après une exposition à une source de lumière située à droite (phototropisme). (D) Radicules de Vicia faba tournée à 90° (géotropisme). (E) Radicule de Vicia faba sur laquelle on a collé un bout de carton sur le côté gauche (flèche).
A
B
C
E
19
la croissance des cotylédons se fait en direction de la lumière (phototropisme). Pour ce qui nous intéresse, Darwin montre que la croissance des racines est modulée par des forces mécaniques. La direction de croissance est déterminée par la force de gravité (géotropisme). De plus, un contact avec l'extrémité racinaire provoque la croissance de la racine à l'opposé de ce contact. Ainsi, Darwin est un des premiers à montrer que les plantes sont capables de percevoir des caractéristiques physiques de leur environnement et que leur morphologie, leur croissance et leurs mouvements sont directement façonnés par ces caractéristiques.
2 - La répartition des contraintes mécaniques dans la plante
Avant de détailler quels sont les effets des contraintes mécaniques sur le développement des plantes, il nous faut d'abord décrire les forces en jeu dans une plante au repos. Nous décrirons d’abord la répartition des contraintes mécaniques à l’échelle cellulaire puis élargirons à toute la plante. Les
Cadre 1 – Transport d'ions à travers la membrane plasmique
On mesure une différence de potentiel électrique de part et d'autre de la membrane plasmique, dite potentiel de repos, qui est de l'ordre de -150mV à -180mV dans les cellules végétales. Chez les plantes, le potentiel de repos est le résultat de la diffusion des ions K+ hors de la cellule ainsi
que de l'activité de la pompe H+-ATPase, qui exclue des protons dans l'apoplasme, beaucoup plus
acide que le cytosol, en échange de l'hydrolyse d'ATP. Des transports actifs secondaires comme des symports K+/H+ permettent de maintenir le déséquilibre en K+ et donc le potentiel de
membrane.
Le transport des ions à travers la membrane se fait dans le sens du gradient électrochimique de l'ion en question. Ce gradient correspond à la différence de potentiel électrochimique µ entre les deux compartiments, qui dépend à la fois de la concentration en ion dans chaque compartiment et du potentiel de repos, se calcule par l'équation de Nernst.
gradient électrochimique : ∆µ = µ − µ = 𝑅𝑇 ln([[ ]] + 𝑧𝐹(𝐸 − 𝐸 ) µi : potentiel électrochimique de l'ion dans le compartiment i
R : constante des gaz parfaits T : température
[ion]i : concentration en ion dans le compartiment i
z : charge de l'ion F : constante de Faraday
ΔE = (Eint - Eext) : potentiel de repos
L'équilibre thermodynamique est atteint lorsque le gradient électrochimique est nul. Les ions vont vers le compartiment au potentiel électrochimique le plus faible. Le gradient électrochimique génère donc une force motrice qui permet le transport d'ions de part et d'autre de la membrane sans dépense d'énergie. Les canaux, principaux objets de cette étude, sont des protéines transmembranaires qui aménagent un pore dans la membrane qui permet aux ions de traverser dans le sens de leur gradient électrochimique (transport passif).
20
cellules végétales sont délimitées par une membrane plasmique, structurée en une bicouche lipidique, qui empêche la diffusion de toute molécule non hydrophobe, dans laquelle s'insèrent des protéines, qui assurent un transport sélectif d'ions ou de molécules polaires à travers la membrane (Singer and Nicolson, 1972; Larsson et al., 1990). La membrane est donc une barrière sélective qui permet la régulation de la composition chimique du cytoplasme et de l'apoplasme, et notamment, en concentrant des solutés dans la cellule (Cadre 1), fait augmenter la pression osmotique (Cadre 2) (Beauzamy et al., 2014). La pression de turgescence à l'intérieur des cellules végétales est en effet très élevée, de l'ordre de 1 à 10 bars (Geitmann, 2006). Les cellules végétales sont contenues dans une matrice extracellulaire (la paroi) composée principalement de polymères d'oses formant des fibres comme la cellulose et un gel hydraté comme les pectines (Höfte and Voxeur, 2017). La pression de turgescence est à l'origine de forces de tension élevées dans le plan de la paroi. La cellule est contrainte dans ce cadre rigide (les protoplastes, cellules sans paroi, ont une forme ronde) et la membrane
Cadre 2 – Transport d'eau dans la plante et pression osmotique
A l'image des ions, la répartition de l'eau dans chaque compartiment est régie par leur potentiel hydrique Ψ (en MPa):
𝛹 = 𝑃 + 𝜋 + 𝜏 + 𝜌 P : pression hydrostatique = pression de turgescence π : pression osmotique
𝜋 = −𝑅𝑇𝐶 R : constante des gaz parfaits
T : température
C : osmolarité du compartiment
L'osmolarité correspond à la somme des concentrations de tous les solutés.
τ (potentiel matriciel correspondant aux forces de tension superficiel) et ρ (potentiel gravitationnel) peuvent être négligés à l'échelle de la cellule mais ont un effet significatif dans le cas de la circulation des sèves, d'autant plus que la plante est grande.
De même que pour les ions, l'équilibre thermodynamique est atteint lorsque la différence de potentiel hydrique entre les deux compartiments ∆Ψ est nulle. L'eau va donc vers le compartiment au potentiel hydrique le plus faible, correspondant au premier ordre au compartiment le plus concentré.
Le potentiel hydrique du sol est proche de 0 alors que celui de l'air est très négatif. L'eau du sol a donc tendance à s'évaporer dans l'air. Les potentiels hydriques dans la plante sont à l'intermédiaire entre ceux du sol et de l'air, décroissants des racines aux feuilles. Cette différence de potentiel des racines aux feuilles est un moteur pour le prélèvement de l'eau dans le sol et la circulation de la sève brute.
21
plasmique est comprimée contre la paroi. Le couple pression de turgescence/paroi agit comme un hydrosquelette qui permet aux plantes herbacées de s'élever sans support. De plus la force de tension exercée par la cellule sur la paroi est un moteur de la croissance cellulaire (Zonia and Munnik, 2007; Mirabet et al., 2011).
Qu'en est-il de la répartition de cette tension de la paroi dans l'organisme ? Les cellules sont connectées entre elles par la paroi et sont donc mécaniquement interdépendantes. Une différence de croissance entre couches cellulaires voisines, alors que la paroi entre les deux couches a une longueur constante, engendre une contrainte mécanique : la couche cellulaire qui a une croissance plus élevée tire sur sa voisine, et est donc sous pression alors que l'autre est sous tension (Boudaoud, 2010). Par exemple, il a été montré par des incisions que l'épiderme est sous tension et contraint la croissance des tissus sous-jacents qui sont sous pression. De plus, le potentiel hydrique est variable dans la plante, ce qui permet notamment la circulation des sèves. Ainsi les chambres sous-stomatiques, lieux de l'évaporation de l'eau, sont sous forte tension alors que les cellules de charge du phloème où se concentrent les solutés sont sous forte pression osmotique. De plus, la pression est modulée par le propre poids de l'organisme, qui peut être négligeable dans le cas d'une plante herbacée mais pas d'un arbre.
On le voit, même sans l'intervention de forces extérieures, les organismes végétaux sont soumis à de fortes contraintes dont la répartition n'est pas homogène et qui, avec la participation de forces extérieures, participent à leur morphogénèse.
3 - Le développement des plantes est conditionné par les contraintes mécaniques
La croissance de certaines plantes est principalement fondée sur le toucher. C'est le cas des plantes grimpantes, qui utilisent un support pour soutenir leur croissance en hauteur (Braam, 2005; Darwin, 1906). Ces plantes développent des vrilles qui s'enroulent autour du support lors d'un contact physique pour s’y accrocher, jouant un rôle de soutien. Ces vrilles auraient même une sensibilité plus grande
22
qu'un doigt humain (Braam, 2005). De même, toutes les plantes sont soumises à des contraintes mécaniques externes lors de leur développement. La gravité limite leur croissance en hauteur, la résistance du sol freine leur croissance en profondeur, et le vent perturbe cet équilibre entre parties aériennes et souterraines qui permet leur ancrage. La sécheresse et la pluie changent la disponibilité en eau ce qui a pour conséquence des variations de pression osmotique. D'autres paramètres physiques comme la température ont aussi des effets mécaniques sur les plantes, comme la rigidification des membranes ou la variation de disponibilité en eau. Enfin, le contact avec des animaux pouvant être herbivores ou parasites est interprété par la plante comme un signal d'alerte. Ainsi les plantes évoluent dans un environnement aux caractéristiques mécaniques fluctuantes et hétérogènes qui menacent leur intégrité physique.
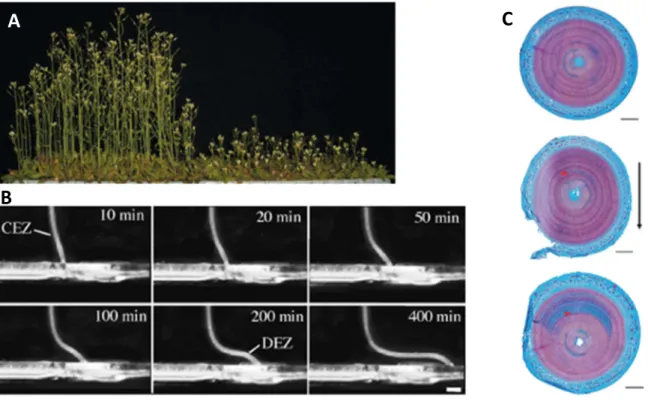
La morphologie générale des plantes est modifiée lorsqu'elles sont touchées (Figure 4) : on parle de thigmomorphogénèse (du grec thigmos signifiant toucher) (Jaffe, 1973).On observe que des plantes stimulées mécaniquement de manière régulière ont une croissance réduite en hauteur et augmentée en largeur (Chehab et al., 2009). Les arbres soumis à un fort régime de vent présentent un appareil racinaire plus développé, au détriment des organes aériens, ce qui augmente l'ancrage dans le sol et diminue la surface de prise au vent (Coutand, 2010). De plus, on observe une augmentation de la production de bois dans les tiges soumises à une courbure (Roignant et al., 2018). Les stimulations mécaniques engendrées par le vent ont un impact sur l'ensemble de l'architecture de l'arbre pour mieux résister à de fortes contraintes mécaniques. La nécessité des stimulations mécaniques pour renforcer la structure des plantes est en cela comparable au développement de l'os chez les Vertébrés qui est lui aussi activé par des signaux mécaniques (Moulia et al., 2006). D'autres altérations globales ont été observées lors de stimulations mécaniques répétées sur la quantité de chlorophylle et de phytohormones, sur le temps de floraison, ou encore sur la résistance au stress (Biddington, 1986). De plus, la taille des plantes dépend aussi de la place qu'elles ont. Par exemple si on laisse grandir des plantules d'Arabidopsis dans une boîte de Pétri, elles produisent des feuilles et une hampe florale plus
23
petites que si on les cultive en pot, leur taille s'adaptant à l'espace qu'elles ont dans la boîte.
De même, le développement du système racinaire est modulé par ses interactions mécaniques avec le sol. Les racines grandissent dans un environnement aux propriétés mécaniques hétérogènes. Une racine qui rencontre un obstacle infranchissable (représenté par une lamelle de verre dans les expériences en laboratoire) a une réponse gravitropique diminuée en faveur du thigmotropisme et change sa direction de croissance de 90° (Darwin and Darwin, 1880; Massa and Gilroy, 2003)). De plus les racines secondaires se forment dans les courbures de la racine principale, là où la tension est supposée plus forte (Richter et al., 2009).
Les contraintes mécaniques ont aussi une importance cruciale lors du développement à l'échelle
Figure 4 – Morphogénèse et contraintes mécaniques.
(A) Plants d'Arabidopsis non traités (gauche) ou touchés deux fois par jour (droite) (d'après Braam, 2005). (B) Suivi temporel d'une racine d'Arabidopsis rencontrant un obstacle infranchissable (CEZ : central elongation zone ; DEZ : distal elongation zone) (d'après Massa & Gilroy, 2003). (C) Coupes tranversales de tiges de peuplier contrôle (haut), soumises à des flexions répétées (milieu, thigmotropisme) ou à une rotation de 35° (bas, gravitropisme). La coloration permet de distinguer les parois lignifiées en bleu et ainsi la production de bois de tension. La flèche noire montre la direction de flexion. Les flèches rouges désignent le cambium en début de traitement (d'après Roignant et al., 2018).
C
A
24
cellulaire (Mirabet et al., 2011). D'une part, les forces mécaniques sont nécessaires à la division et à la croissance cellulaires. Par exemple la pression osmotique dans la cellule engendre des forces de tension sur la paroi qui sont à l'origine de sa croissance. D'autre part, le champ de force semble être un régulateur du développement à part entière, agissant directement sur le taux de division, l'orientation du plan de division, la croissance et même la différenciation cellulaire. Une stimulation mécanique provoque l’arrêt de l'élongation cellulaire au bout de quelques minutes (Coutand et al., 2000). La paroi, qui régule l'élongation cellulaire, est aussitôt remodelée (Tenhaken, 2015). Elle devient plus rigide par des réticulations entre différents composants ainsi que l'ajout de callose (Telewski, 2006). Le modèle le plus étudié est le méristème apical caulinaire (MAC) chez Arabidopsis. Il a été montré que le plan de division des cellules de l'épiderme du MAC est parallèle à la direction de tension maximale (Louveaux et al., 2016). Pour déstabiliser les contraintes mécaniques, une cellule de l'épiderme du MAC a été détruite par ablation au laser, ce qui a pour effet de créer un cercle de tension autour de la blessure. On observe alors que le plan de division des cellules autour est parallèle à ce cercle, ce qui a pour conséquence la fermeture de la blessure.
Ainsi les contraintes mécaniques, quelle que soit leur origine, ont un effet sur les événements fondamentaux du développement que sont la division cellulaire, l'élongation cellulaire et la formation de la paroi. Si parfois ce contrôle est direct, comme c'est le cas de la pression osmotique sur l'élongation cellulaire, c'est la plupart du temps par la perception des contraintes mécaniques par la cellule et le déclenchement de voies de signalisation que cette régulation peut avoir lieu.
4 - Signalisation cellulaire lors d'une mécanostimulation
Expression génétique
Pour comprendre comment la morphogénèse est modifiée par les contraintes mécaniques, les changements d'expression génétique lors d'une stimulation ont été quantifiés. Les premiers gènes découverts chez Arabidopsis dont l'expression est induite par le toucher (touch-induced) ont été
25
appelés TOUCH (TCH) (Braam and Davis, 1990). Parmi les cinq gènes TCH, trois (CaM2, CML24 et CML12) sont apparentés aux calmodulines, protéines qui lient le calcium et sont impliquées dans le décodage des signaux calciques (Dodd et al., 2010). On trouve aussi une xyloglycane endotransglucosylase/hydrolase (XTH), famille d'enzymes impliquées dans la formation et le remodelage de la paroi (Rose et al., 2002). Une étude plus complète sur tout le génome (Lee et al., 2005) a retrouvé ces deux types de gènes (protéines liant le calcium et enzymes de la paroi) comme étant les plus représentés. Elle a aussi mis en évidence des gènes de résistance aux pathogènes et des gènes de signalisation codant pour des kinases et des facteurs de transcription.
Ainsi, même si des gènes exprimés codent pour des effecteurs directs impliqués par exemple dans le remodelage de la paroi ou les défenses immunitaires, beaucoup sont des gènes qui sont engagés dans la signalisation cellulaire, suggérant que les contraintes mécaniques agissent directement sur le fonctionnement des protéines. De plus, on observe des réponses cellulaires comme l'arrêt de l'élongation quelques minutes après la stimulation mécanique alors que le contrôle de l'expression des gènes est plus lent. Ainsi on distinguerait une réponse rapide qui activerait des cibles déjà présentes dans la zone localisée où se concentrent les contraintes ; et une réponse à plus long terme, impliquant l'induction de l'expression génétique et la signalisation longue distance, qui aurait un effet global sur toute la plante.
Signal calcique : le déclencheur ?
Parmi les gènes de voies de signalisation activés, il semble que ceux associés au calcium aient une importance prépondérante. La signalisation calcique est fondée sur l'exclusion de l'ion calcium du cytosol où sa concentration est très faible (de l'ordre de 100 nM), alors qu'elle est plus élevée dans l'apoplasme et les organites comme la vacuole et le réticulum endoplasmique (Trewavas and Knight, 1994). Des augmentations de concentration en calcium dans le cytosol, qu'on nomme signaux calciques, sont déclenchées en réponse à de nombreux stress, biotiques ou abiotiques. La visualisation
26
de ces signaux calciques a été rendue possible par la découverte chez une espèce de méduse (Aequorea victoria, même espèce que pour la GFP) de l'æquorine, une protéine bioluminescente en présence de calcium (Pérez Koldenkova and Nagai, 2013). C'est ainsi que dès 1991 on a pu mesurer avec l'æquorine des signaux calciques dans des plantules d'Arabidopsis soumises à une stimulation mécanique (Knight et al., 1991). Puis l'étude biochimique de la calmoduline et de son interaction avec une de ses protéines cibles a permis de concevoir d'autres types de biosenseurs. Ces derniers contiennent la calmoduline ainsi que le domaine M13 d'interaction de sa protéine cible, fusionnés à une GFP (Pérez Koldenkova and Nagai, 2013). L'interaction de la calmoduline avec le calcium provoque un changement de conformation qui change les propriétés de fluorescence du fluorophore (GCaMP, GECO) ou l'efficacité du FRET (Cameleon). Ces biosenseurs peuvent être exprimés dans les plantes par transformation et on peut ainsi suivre les variations de la concentration en calcium cytosolique.
L’entrée de calcium dans le cytosol est un signal pour la cellule ; de nombreuses protéines ont une activité qui dépend de l'interaction avec le calcium. C'est par exemple le cas du canal vacuolaire Two-pore channel 1 (TPC1). Ce canal est voltage-dépendant une fois activé par le calcium via deux domaines EF hand (Guo et al., 2016). TPC1 laisse passer le calcium et est proposé comme un amplificateur du signal calcique en libérant du calcium de la réserve vacuolaire (Gilroy et al., 2016). Certaines protéines sont quant à elles spécialisées dans le décodage du signal calcique (Dodd et al., 2010). Leur activation par le calcium déclenche leur interaction avec leurs cibles et/ou la phosphorylation de leurs cibles qui peuvent être par exemple des canaux ioniques, des facteurs de transcription, le cytosquelette ou des kinases à la base de cascades de phosphorylation. Chez les plantes on trouve trois grandes familles de protéines liant le calcium : les calmodulines (CAM) et calmodulin-like (CML), les calcium-dependent protein kinases (CDPK) et les calcineurin B-like proteins (CBL).
Le développement des techniques de microscopie et de ces nouveaux biosenseurs a permis une étude plus précise de la mécanoperception dans la racine (Figure 5) (Monshausen et al., 2009).
27
Toucher une cellule de l'épiderme avec une micropipette suffit à déclencher l'entrée de calcium dans le cytosol au niveau du contact, témoignant de la précision spatiale de la détection de la stimulation mécanique et de sa rapidité. Le signal calcique se propage ensuite dans toute la cellule. Quand la racine est courbée manuellement, on observe un signal calcique dans la zone de courbure, avec une intensité plus forte dans la partie concave. Ceci suggère que les signaux calciques sont déclenchés sous tension et non sous pression. De même, lorsqu'une racine rencontre un obstacle, on n'observe pas de signal calcique à la pointe racinaire, au contact avec l'obstacle, mais dans la zone de courbure générée lors de la croissance contre l'obstacle, dans la partie sous tension. De même, dans le méristème apical caulinaire, un contact physique avec une pipette de verre déclenche des signaux calciques à l'endroit du contact, qui se propagent dans tout le méristème (Li et al., 2019).
Figure 5 – Signaux calciques déclenchés par des stimulations mécaniques.
Suivi temporel de racines d'Arabidopsis exprimant la sonde calcique Cameleon (gauche) et quantification associée (droite). L'échelle de couleur est construite de telle sorte que le vert correspond à une faible concentration en Ca2+ et rouge une forte concentration. Les racines ont subi un contact avec une pipette de
28
Les plantes ne sont pas seulement soumises à des stimulations mécaniques externes mais leur croissance produit des contraintes internes. Est-ce que les signaux calciques peuvent être générés par ces contraintes ? On observe des pics calciques spontanés se limitant à une cellule ou se propageant sur quelques cellules dans le méristème apical caulinaire (Li et al., 2019). Mais ces signaux n'ont pas été corrélés à des forces mécaniques. On peut faire l'hypothèse que dans la diversité des pics spontanés, certains sont déclenchés par des stimulations mécaniques.
Quel est le mécanisme à l'origine de l'entrée de calcium dans le cytosol ? On a pu mesurer des conductances au calcium dans toutes les membranes cellulaires : membrane plasmique, tonoplaste et membranes des mitochondries, des chloroplastes et du réticulum endoplasmique (Demidchik et al., 2018). Les canaux perméables au calcium identifiés à ce jour chez les plantes ne présentent pas de sélectivité au calcium et sont plus généralement perméables aux cations indifféremment de leur charge. Des inhibiteurs des canaux mécanosensibles comme le lanthane ou le gadolinium suppriment les signaux calciques suscités par une stimulation mécanique (Monshausen et al., 2009), suggérant que les canaux responsables sont situés à la membrane plasmique. Le rouge de ruthénium, un inhibiteur supposé de la sortie du calcium des organites, fait disparaître les signaux calciques (Legue et al., 1997; Trewavas and Knight, 1994), montrant également une origine intracellulaire du calcium. Connaître les mécanosenseurs à l'origine de l'ouverture des canaux calciques permettra de mieux définir l'origine du calcium. Le modèle actuel de calcium-induced calcium release consiste en une entrée de calcium par la membrane plasmique, amplifiée par l'ouverture de canaux calciques présents dans les membranes internes comme TPC1, qui est lui-même activé par le calcium (Gilroy et al., 2016).
Evénements précoces déclenchés par le calcium
Concomitamment au signal calcique, on observe une alcalinisation de l'apoplasme conjuguée à une acidification du cytoplasme cortical (Monshausen et al., 2009; Zhou et al., 2017). L'entrée de calcium dans le cytosol est nécessaire et suffisante au déclenchement de cette réponse, le calcium pouvant par
29
exemple inhiber la pompe H+-ATPase qui assure le maintien de l'acidité de l'apoplasme. Les
conséquences de ce changement de pH sur l'activité des protéines spécifiques, toutes étant potentiellement sensibles au pH, ou sur des voies de signalisation sensibles au pH, sont encore très mal connues. Mais ce changement immédiat de pH pourrait être à l'origine de l'arrêt rapide de l'élongation cellulaire qui nécessite un pH bas.
En parallèle, une production de molécules de stress oxydant (ROS) peut être mesurée (Monshausen et al., 2009). De même que pour le pH, le signal calcique est nécessaire et suffisant à la production de ROS. Il a été montré que les protéines RBOH dans la membrane plasmique responsables de la production de ROS sont activées par le calcium (Gilroy et al., 2014). Or les ROS sont des régulateurs des processus cellulaires du développement (Mhamdi and Breusegem, 2018). Par exemple, par leur fort potentiel oxydant, ils peuvent réagir avec des composants de la paroi et induire la réticulation entre des composants phénoliques, ce qui a pour effet d'augmenter la rigidité de la paroi et de ralentir l'élongation cellulaire.
Figure 6 – Signalisation déclenchée par une stimulation mécanique.
30
Enfin, un stress mécanique induit la production de monoxyde d'azote NO (Garcês et al., 2001). Cette petite molécule est aussi un messager cellulaire impliqué dans de nombreux processus développementaux et pourrait interagir avec les voies de signalisation du calcium et des ROS (Verma et al., 2020). Ainsi, une stimulation mécanique déclenche un signal calcique qui induit de nombreuses autres voies de signalisation qui sont interconnectées et interdépendantes (Figure 6).
Cas particulier d'un stress osmotique
Les plantes subissent des changements de potentiel hydrique dans leur environnement qui peuvent être dus aux variations de la quantité d'eau (sécheresse, inondation) ou à une concentration élevée en osmolytes dans le sol (stress salin). Ces variations entraînent des flux d'eau entre l'intérieur et l'extérieur des cellules et ont une influence sur la pression osmotique, ce qui a donc un effet mécanique. De même que pour une stimulation mécanique, un choc osmotique réalisé avec du chlorure de sodium NaCl ou un sucre non métabolisable (mannitol, sorbitol) déclenche un signal calcique (Knight et al., 1997). Cette signalisation calcique est aussi connectée à celle des ROS, du pH et du NO (Kader and Lindberg, 2010; Seifikalhor et al., 2019). Elle provoque l'activation de cascades de phosphorylations différentes selon le type de stimulation, stress osmotique ou stress salin (Boudsocq and Laurière, 2005).
Les voies de signalisation liées au calcium ne sont donc pas vraiment spécifiques d'un stress mécanique et sont déclenchées par de nombreux autres stress abiotiques ou biotiques. Or chaque type de stimulation ne cause pas les mêmes réponses cellulaires. C'est dans ce contexte que le concept de signature calcique a été proposé : chaque stimulus produit des signaux calciques différents dans le temps et l'espace, et spécifiques de celui-ci (McAinsh and Pittman, 2009). Par exemple, dans des feuilles d'Arabidopsis, la forme des signaux calciques dépend du type de stimulation et de la couche cellulaire (Martí et al., 2013). Une stimulation mécanique déclenche un signal calcique en forme de pic qui est semblable dans toutes les couches cellulaires alors que la forme du signal pour un stress salin
31
est différente selon la couche cellulaire. En quoi la forme du signal calcique est-elle importante pour son interprétation ? L'induction artificielle d'oscillations calciques par stimulations électriques montre que la forme du signal a une influence sur l'induction de l'expression génétique (Whalley and Knight, 2013). Ces différents signaux sont ensuite interprétés par une machinerie cellulaire qui peut être différente selon le type cellulaire ou le stade de développement, les protéines senseurs de calcium jouant un rôle déterminant (Boudsocq and Laurière, 2005; Dodd et al., 2010). Ainsi des stimulus différents déclenchent certes un signal calcique mais la forme du signal calcique est spécifique au stimulus. Les différentes signatures calciques n’activant pas les mêmes voies de signalisation, la réponse cellulaire est spécifique du stimulus déclencheur.
Lors d'un stress salin, il est en réalité difficile de faire la distinction entre l'effet purement mécanique et l'effet chimique sur la réponse cellulaire, surtout qu'on connaît assez peu le mode de perception de l'osmolarité chez les plantes. Or on observe des différences de signatures calciques entre un stress salin et un stress mécanique (Martí et al., 2013). La perception du sodium comme élément toxique peut en effet aussi déclencher un signal calcique. La signature calcique générée par un choc osmotique avec du NaCl est biphasique et plus intense que celle générée avec du sorbitol, qui est monophasique, suggérant que la deuxième augmentation de calcium dans le signal est due à la perception du sodium (Schmöckel et al., 2015). Il semble donc que la signature calcique déclenchée par un stress salin soit le produit de stress osmotique et de la perception du sodium. L'effet osmotique pur produirait une signature calcique similaire à l'effet d'une stimulation mécanique. Et pourtant un choc osmotique et un contact physique ne déclenchent pas les mêmes réponses cellulaires. En comparaison à un contact physique localisé, anisotrope et bref, le choc osmotique s'applique à toutes les cellules d'une façon isotrope et sur une plus longue durée. Ceci expliquerait que la signature calcique ait la même forme mais une intensité plus grande pour le choc osmotique.
32
Propagation du signal et réponse systémique
La réponse de la plante à un stress mécanique se décompose en une réponse cellulaire localisée rapide et une réponse systémique à plus long terme. En effet le signal calcique se propage dans toute la plante par le système vasculaire (Xiong et al., 2014). Cette vague de calcium s'accompagne de la propagation de potentiels d'action et de ROS si bien qu'on s'interroge sur la relation de causalité entre ces différents signaux et l'interdépendance de leur propagation (Gilroy et al., 2016). L'inhibition d'une des trois voies de signalisation semble affecter les deux autres, suggérant une interdépendance, même si le calcium semble être le déclencheur. Les auteurs proposent que les trois voies se propagent par des compartiments différents : les ROS par l'apoplasme, le calcium par le cytoplasme, les potentiels d'action par la membrane plasmique, ces deux derniers nécessitant la présence de plasmodesmes. De plus, on peut mesurer une onde de pression qui se propage du site de stimulation par le système vasculaire (Farmer et al., 2014). Une étude récente suggère que l'onde de pression se propage de façon autonome par le couplage entre la déformation locale des tissus et la pression hydraulique dans le système vasculaire (Louf et al., 2017). Cette onde de pression pourrait déclencher des signaux calciques via l'activation de mécanosenseurs.
De plus, la réponse systémique passe par la synthèse de phytohormones connues pour répondre à un stress mécanique. L'éthylène a été la première à être détectée après une stimulation mécanique (Chehab et al., 2009). Mais si les effets de l'éthylène ressemblent à ceux de la thigmomorphogénèse, des mutants de perception de l'éthylène ne sont pas affectés dans cette dernière (Johnson et al., 1998). Il reste donc à distinguer la part des effets thigmotropes qui est due à l'éthylène. Le jasmonate (JA) est une autre phytohormone dont la synthèse est déclenchée par une stimulation mécanique (Chehab et al., 2012). Le JA est nécessaire et suffisant pour le mise en place de la réponse thigmomorphogénétique typique d'une plante soumise à un stress mécanique. L'étude montre aussi que l'augmentation de JA lors d'une stimulation mécanique permet de mieux résister à un pathogène ou à un herbivore. Le mécanisme qui permet à une stimulation mécanique de déclencher la synthèse de JA n'est pas bien
33
caractérisé. On sait que l'expression de gènes codant pour des enzymes dans la voie de biosynthèse du JA est activée par une stimulation mécanique (Chehab et al., 2009). Cependant la synthèse de JA se déclenche au bout d'une trentaine de secondes (Glauser et al., 2009). Ainsi une stimulation mécanique déclencherait la synthèse de JA en deux phases : une phase rapide qui pourrait être dépendante du calcium et une phase plus lente impliquant l'expression des gènes impliqués dans la voie de biosynthèse du JA. De même la voie des gibbérélines a été montrée comme étant affectée par une stimulation mécanique et impliquée dans la thigmomorphogénèse (Lange and Lange, 2015). Enfin, l'acide abscissique est bien connu pour intervenir dans les cas de stress osmotique, provoquant notamment la fermeture des stomates (Yoshida et al., 2014).
Ainsi la réponse systémique se traduit par la propagation des signaux calciques ainsi que par la production d'hormones.
Accommodation aux stimulations mécaniques répétées
Dans la nature, les plantes sont soumises à des stimulations mécaniques répétées, comme par exemple le vent qui provoque des oscillations de la tige et des feuilles. Après plusieurs stimulations répétées, les réponses cellulaires ont une intensité plus faible, phénomène appelé accommodation (Leblanc-Fournier et al., 2014). Dès la deuxième stimulation, l'inhibition de l'élongation, la surexpression des gènes TCH et l'intensité des signaux calciques sont plus faibles. Trois mécanismes peuvent être à l'origine de cette accommodation. Il peut tout d'abord être envisagé que les mécanosenseurs qui déclenchent la réponse calcique sont moins sensibles aux forces mécaniques après une première activation. La deuxième hypothèse consiste en une boucle de régulation négative qui affecterait la signalisation cellulaire évoquée ci-dessus. On a vu que des gènes impliqués dans la signalisation calcique étaient surexprimés et pourraient permettre l'établissement de cette boucle. Enfin des modifications épigénétiques pourrait donner une mémoire à plus long terme des stimulations.
34
Les forces mécaniques peuvent donc déclencher de nombreuses signalisations cellulaires interdépendantes dont le calcium semble être la source. Si ces réponses cellulaires sont plutôt bien caractérisées, il reste à comprendre comment elles sont initiées. La transduction des forces mécaniques en signaux interprétables par la cellule s’effectue par l’activation de mécanosenseurs, des protéines sensibles aux forces mécaniques dont la déformation cause l'activation de ces voies de signalisation.
II - La transduction des signaux mécaniques chez les plantes
1 - Contraintes et déformations lors d'une stimulation mécanique
Se concentrent sur les cellules végétales des contraintes mécaniques liées à la croissance et à la pression de turgescence des cellules adjacentes, ainsi qu'à des phénomènes externes comme le vent. Ces contraintes mécaniques (stress) appliquées sur l'organe sont distribuées dans toute la plante et mesurées en unité de force par surface : N.m-2 soit en Pascal (Pa) (Figure 7A). Elles induisent des
déformations (strain) des organes (Moulia et al., 2015; Fruleux et al., 2019). Par exemple le vent, en appliquant une pression sur la tige (stress), peut induire une courbure de la celle-ci (strain). La façon dont les contraintes mécaniques induisent des déformations dépend des propriétés rhéologiques des matériaux. La paroi végétale est considérée comme un matériau visco-élastique. Pour des contraintes faibles, la déformation est proportionnelle à la contrainte : on parle d'élasticité. Pour des contraintes plus élevées, la déformation est plus faible et irréversible : on parle de plasticité. La croissance de la paroi est le résultat de sa plasticité. La cellule exerce une pression de turgescence isotrope sur la paroi, ce qui conduit à une croissance isotrope de la paroi (Hamant and Traas, 2010; Mirabet et al., 2011; Beauzamy et al., 2014). Mais si les fibres de cellulose sont organisées dans une direction préférentielle, elles opposent une plus grande résistance à la contrainte, réduisant la croissance dans cette direction et ayant pour conséquence une croissance anisotrope (Figure 7B). Ainsi la croissance anisotrope n'est pas due à une contrainte anisotrope mais aux propriétés rhéologiques de la paroi.
35
La répartition des contraintes mécaniques dans l'organisme dépend donc des propriétés rhéologiques de ces tissus et de leur déformation. Toutes les cellules ne sont pas soumises aux mêmes
Figure 7 – Contraintes mécaniques et déformations associées.
(A) (gauche) Représentation d'un matériau soumis à des contraintes mécaniques (en rouge) qui subit une déformation (en bleu) en conséquence. On peut exprimer les contraintes (stress) comme le rapport des forces (F) sur la surface (A) et la déformation (strain) comme le rapport de la différence de taille (∆L) sur la taille initiale (L). (droite) Relation entre les contraintes et la déformation et domaines d'élasticité et de plasticité. (B) Elongation cellulaire en fonction de l'orientation des fibres de cellulose (en noir). Les flèches rouges correspondent à la contrainte (pression de turgescence) et les flèches bleues à la déformation. (C) Déformation de deux structures spécialisées dans la mécanoréception : le poil sensible de la dionée gobe-mouche (gauche) et le trichome d'Arabidopsis (droite). En gris sont représentées les cellules mécanoreceptrices. Les flèches noires correspondent à la contrainte appliquée. En rouge sont indiquées les zones de contrainte maximale.
36
contraintes mécaniques lors d'une stimulation mécanique. Par exemple, quand une tige est pliée par le vent, la déformation dépend de la morphologie et de la composition de la tige. La base de la tige subit une déformation plus importante et la contrainte y est plus forte. On peut s'attendre à ce que des zones qui concentrent les contraintes mécaniques soient des structures mécano-réceptrices, ou contiennent plus de mécanorécepteurs cellulaires.
2 - Structures spécialisées dans la mécanoperception
Les plantes très sensibles au toucher présentent des organes spécialisés dans la perception des stimulus mécaniques. C'est le cas des poils sensibles de la Dionée gobe-mouche. Cette plante carnivore a des feuilles en forme de piège qui se referment sur leur proie (Figure 2). Les proies sont détectées quand elles touchent une des trois structures allongées et rigides que sont les poils sensibles. La flexion du poil déclenche un potentiel d'action qui est à l'origine de la fermeture du piège ; des plantes à qui on a enlevé les poils ou des mutants qui n'ont pas de poils ne se referment pas au contact d'une proie (Scherzer et al., 2019). Il ne s’agit pas d’une perte de perception car il est toujours possible de déclencher la fermeture du piège avec une stimulation mécanique sur le piège. Cette dernière doit néanmoins être de l'ordre de 100 mN.mm-2 alors que la force nécessaire à appliquer sur le poil pour la
fermeture du piège est de l'ordre de 100µN. Il a été montré que les cellules mécanosensorielles qui génèrent le potentiel d'action sont à la base du poil (Benolken and Jacobson, 1970). Par un effet de levier, la contrainte maximale à la base du poil lors d'une stimulation est de l'ordre de 100 mN.mm-2,
ce qui est comparable à la force nécessaire pour fermer un piège sans poils (Figure 7C). Ainsi, ce n'est pas par une augmentation de sensibilité des cellules sensorielles mais par une amplification des forces mécaniques par une structure en forme de levier que le piège de la dionée est très sensible. On observe la même chose pour les trichomes sur les feuilles d'Arabidopsis (Zhou et al., 2017). Ces structures unicellulaires, elles aussi allongées, en forme de parapluie, tapissent l'épiderme des feuilles et sont connues pour participer à des fonctions variées dans la protection de la feuille contre des stress hydriques, lumineux ou biotiques. Lors d'une stimulation mécanique, on observe une déformation à la
37
base du trichome ainsi qu'un signal calcique et l'alcalinisation de la paroi dans les cellules épidermiques voisines. La paroi du trichome n'a pas une épaisseur homogène, elle est plus épaisse au sommet qu'à la base. Par une modélisation informatique, les auteurs ont montré que cette différence d'épaisseur de la paroi du trichome permet une concentration des contraintes mécaniques à la base du trichome alors qu'une épaisseur homogène concentrerait les contraintes au sommet (Figure 7C). Ainsi la structure du trichome permet la propagation des stimulations mécaniques aux cellules voisines qui y répondent.
Ces deux exemples montrent que des adaptations au toucher consistent en des structures dont la déformation concentre et amplifie les contraintes mécaniques sur quelques cellules capables d'y répondre. Mais on ne connaît pas chez les plantes de cellules spécialisées dans la perception des signaux mécaniques dont la sensibilité serait exacerbée. Il semble que toutes les cellules perçoivent et dépendent des contraintes mécaniques. On peut donc se demander quels sont les molécules présentes dans la plupart des cellules qui permettent la sensibilité aux contraintes mécaniques.
3 - Mécanosenseurs moléculaires
Les mécanosenseurs sont des macromolécules dont la déformation causée par une contrainte mécanique constitue une information interprétable par la cellule et permet le déclenchement d'une réponse cellulaire telle qu'on l'a décrite précédemment.
Microtubules corticaux
L'une des structures cellulaires dynamiques qui est particulièrement sensible aux contraintes mécaniques est le réseau de microtubules corticaux (Hamant et al., 2019). Les microtubules forment des tiges de 25 nm de diamètre très rigides (faible longueur de persistance) se pliant difficilement (Gittes et al., 1993). Ces propriétés semblent être à l'origine de leur position corticale ainsi que de leur orientation dans le sens de la longueur de la cellule, les zones de courbures étant plus déstabilisantes.
38
Des tests in vitro montrent que les microtubules s'alignent intrinsèquement dans le sens de la tension et perpendiculairement à une compression, leur dépolymérisation étant ralentie par la tension mécanique (Figure 8A-B) (Inoue et al., 2016; Hamant et al., 2019). Ces propriétés ont été observée in vivo dans de nombreux organes (principalement dans l'épiderme), notamment dans le méristème apical caulinaire (Hamant et al., 2008), où l'alignement des microtubules corticaux est parallèle à la tension maximale prédite (Figure 8C-D). Si on change la répartition des contraintes mécaniques par l'ablation d'une cellule ou par compression du méristème, les microtubules se réorientent dans le sens de la nouvelle tension maximale. Il semble que cette réorientation est indépendante de facteurs biochimiques comme des phytohormones ou des signaux calciques, et que les microtubules répondent intrinsèquement à des changements de contrainte mécanique.
Les microtubules sont impliqués dans la régulation de la forme des cellules (ce qui a été appelé tensegrity) et de leur division, et dans la détection de différents paramètres mécaniques comme la
Figure 8 – Réorientation des microtubules selon les contraintes mécaniques.
(A) Système permettant d'appliquer des contraintes aux microtubules. Une couche de PDMS est recouverte de kinésine pour interagir avec les microtubules. (B) Observation des microtubules lorsque la couche de PDMS est soumise à des forces d'élongation ou de compression. (C) Observation des microtubules (en vert) dans le méristème apical caulinaire et modèle associé (orientation des microtubules en rouge). (D) Répartition prédite des contraintes dans le méristème (en rouge) et orientation observée des microtubules (en vert) dans le sens de la tension maximale. (adapté de Hamant et al., 2019)
A B
39
tension de la paroi, la température, la pression osmotique ou la gravité (Nick, 2013). Les étapes entre la réorganisation des microtubules et le déclenchement de réponses cellulaires adéquates sont encore mal connues. Les microtubules pourraient également interagir avec d'autres mécanosenseurs et agir, si on considère leur forme, comme des leviers qui amplifient les contraintes mécaniques. Il a été montré que les CESA (cellulose-synthase) interagissent avec les microtubules corticaux qui sont utilisés comme des guides, des rails pour la synthèse de la cellulose (Hamant and Traas, 2010). Les microfibrilles de cellulose sont synthétisées dans la même direction que les microtubules, eux-mêmes étant alignés dans le sens de la tension mécanique maximale, ce qui provoque un renforcement de la paroi contre les contraintes mécaniques, et oriente la croissance cellulaire. Les microtubules, en s'orientant selon la direction de la contrainte maximale, contiennent donc une information directionnelle qui peut influencer la direction de croissance ou de division des cellules. On voit aussi par cet exemple que les microtubules corticaux ont un effet sur la paroi, elle-même étant un lieu potentiel de mécanoperception cellulaire.
Dans la paroi
La paroi est en effet fortement sollicitée par des contraintes mécaniques à la fois internes et externes. On peut donc imaginer que les déformations subies par les composants de la paroi lors d'une stimulation mécanique pourraient être détectées et activer des voies de signalisation mécanique. Par exemple, une tension mécanique pourrait libérer des oligosaccharides issus de la fragmentation des polysaccharides pariétaux, des molécules de signalisation piégées dans la paroi ou découvrir certains sites des molécules cachés, qui seraient reconnus par des récepteurs. En effet, des protéines membranaires ou pariétales sont impliquées dans le contrôle de l'intégrité de la paroi (Voxeur and Höfte, 2016) et pourraient être recrutées lors d'un choc mécanique. Ces protéines contrôlent l'homéostasie mécanique de la paroi et régulent en conséquence la croissance cellulaire ainsi que la composition de la paroi.
40
Pour l'instant, seulement l'une d'elles est connue pour être impliquée dans la perception de signaux mécaniques externes : il s'agit de FERONIA (FER) (Li et al., 2016; Voxeur and Höfte, 2016). D'abord repérée dans la libération des cellules reproductrices du tube pollinique, FER est une protéine transmembranaire aux rôles très variés dans le développement et le contrôle de l'intégrité de la paroi. Pour ce qui nous intéresse, les mutants fer présentent des altérations dans la mécanoperception racinaire, se manifestant par une obliquité (skewing) racinaire exacerbée, une pénétration difficile dans une couche d'agar plus dense et un croissance passive lors de la rencontre d'un obstacle infranchissable (Figure 9A) (Shih et al., 2014). FER semble être un senseur des contraintes mécaniques dans la paroi. C'est ce que propose une autre étude plus récente qui étudie le rôle de FER dans la résistance au stress salin (Feng et al., 2018). Des ions monovalents comme Na+ perturbe les
interactions entre les pectines et le calcium ce qui diminue la rigidité de la paroi. On observe en conséquence un gonflement des cellules au niveau de la zone d'élongation de racines soumises à un stress salin, témoignant d'une fragilité de la paroi qui résiste moins à la pression de turgescence
(Figure 9C). La paroi est ensuite renforcée et retrouve sa rigidité originelle chez les plantes sauvages,
Figure 9 – Défauts de mécanotransduction dans les mutants feronia.
(A) Les racines du mutant fer ne présentent pas l'angle typique en contact avec un obstacle (adapté de Shih et al., 2014). (B) Signaux calciques obtenus par une flexion de la racine (gauche) ou un contact avec une pipette de verre (droite). (C) Zone d'élongation de racines 8 h après transfert dans un milieu contenant 140mM NaCl. On observe une perte d'anisotropie chez le sauvage et un éclatement des cellules chez le mutant fer (adapté de Feng et al., 2018).
C
fer