HAL Id: jpa-00236745
https://hal.archives-ouvertes.fr/jpa-00236745
Submitted on 1 Jan 1963
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of
sci-entific research documents, whether they are
pub-lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destinée au dépôt et à la diffusion de documents
scientifiques de niveau recherche, publiés ou non,
émanant des établissements d’enseignement et de
recherche français ou étrangers, des laboratoires
publics ou privés.
Sur les diagrammes d’alliages du gallium I ou II avec
l’étain, le zinc ou l’indium
S. Delcroix, A. Defrain, Israêl Epelboin
To cite this version:
S. Delcroix, A. Defrain, Israêl Epelboin. Sur les diagrammes d’alliages du gallium I ou II avec l’étain,
le zinc ou l’indium. J. Phys. Radium, 1963, 24 (1), pp.17-20. �10.1051/jphysrad:0196300240101700�.
�jpa-00236745�
SUR LES DIAGRAMMES D’ALLIAGES DU GALLIUM I OU II AVEC
L’ÉTAIN,
LE ZINC OU L’INDIUMPar Mlle S.
DELCROIX,
A. DEFRAIN et I.EPELBOIN,
C. N. R. S. Laboratoire de Physique
(Sorbonne)
et Laboratoire de ChimiePhysique (E.
S. P. C.)Résumé. 2014
Comparaison à la pression
atmosphérique
des diagrammes d’alliages binaires du gallium I ou du gallium II avec l’étain, le zinc ou l’indium. La forme stable GaI donne deseutec-tiques avec les trois métaux. Les diagrammes de l’étain avec le gallium I ou le gallium II présentent la même allure ; par contre le zinc ou l’indium donnent des composés
intermétallique
savec legallium II.
Abstract. 2014 The
authors
compare, at atmospheric pressure, the diagrams of the binaryalloys
of the gallium I or II with tin, zinc or indium. The stable form GaI gives eutectics with the three metals and the diagrams of tin with GaI or II are similar ; on the other hand, zinc and indiumgive intermetallic compounds with gallium II.
Nous avons montré
[1], [2]
que l’onpeut obtenir,
àpartir
dugallium liquide
maintenu ensurfusion,
une
phase
solide métastable dontle point
defu-sion est
- 16,3
OC. Par sespropriétés
thermody-namiques,
cettephase
s’identifie à la forme Ga II existant auxpressions supérieures
à 12 050kg/CM2
[3].
Legallium
1,
stable à lapression
atmosphé-rique,
fond à29,78 °C
en diminuant de volume(comportement
anormal à lafusion).
Par contre laforme Ga II est
plus
dense que leliquide.
Legal-lium II se
transforme
engallium
1 par une réac-tion brutaleexothermique
et il ne semble pasexis-ter de liens
apparents
entre les deux structures.La structure de Ga II est caractérisée par un
grou-pement
des atomes en chaînes enzig-zag,
la dis-tance entre deux atomes voisins dans une chainevaut
2,68 A
etl’angle
Ga-Ga-Ga est de 72°30[4].
Dans legallium
1 les atomes sontgroupés
parpaires,
laplus
courte distance Ga-Ga valant2,44
A
[5].
Dans ce
qui
suit nous comparons lesdiagrammes
d’alliages
binaires dugallium
sous ses deux formes avecrespectivement
l’étain,
le zinc et l’indium.Ces trois métaux ne
gênent
pas la surfusion dugal-lium et forment avec Ga I des
eutectiques qui
sont àl’origine
de certainsphénomènes
de «préfùsion
» des monocristaux degallium
[6].
Les données de la littérature concernant les dia-grammes
d’alliages
Ga I-Sn et Ga I-Zn ne sont pasconcordantes.
D’après
[7]
l’eutectique gallium
I-étain se forme à 20 aG et contient 8
%
enpoids
d’étain ;
l’eutectique gallium
1-zincapparaît
à 25 °C pour une teneur de 5%
enpoids
de zinc.(Il
faut remarquer que lepoint
de fusion dugallium
utilisé était de29,9
°C).
Kroll[8]
trouve quel’eu-tectique
avec l’étain seproduit
à 15 °C et contient 12%
enpoids
d’étain tandis quel’eutectique
avecle zinc est à 21 °C pour 9
%
enpoids
de zinc.Tou-tefois cette dernière étude est très sommaire.
D’après
un mémoireplus
récent[9]
l’eutectique
gallium
I-zinc se forme à25,4
°C pour3,5
%
enpoids
de zinc. Lediagramme
gallium
I-indium estmieux connu.
D’après
[10]
l’eutectique
se forme à 16 °C pour24 ±
0,5
%
enpoids
d’indium. Ces résultats sont en accord avec ceux deDeny
[11]
etSwirbeley
[12].
A notre connaissance on n’a pas encore étudié lesalliages
dugallium
II.Dans nos études nous avons utilisé du
gallium
de très hautepureté
que nous devons àl’obligeance
de M. P. de laBreteque,
de la SociétéFrançaise
pour l’In-dustrie de l’Aluminium. Lesanalyses
spectrogra-phiques
ont été effectuées au C. E. A.grâce
à M. Hure., Pour faciliter la surfusion nous chauffons
préala-blement
chaque
échantillon,
d’une dizaine de grammesd’alliage,
dans de l’eau bouillante contenant des tracesd’acide
chlorhydrique
afin d’éliminer la couched’oxyde.
Leliquide
est ensuite refroidijusqu’à
ce quela surfusion cesse de
façon
à faireapparaître
laphase
,solide ;
lespoints correspondant
aux solidus etliquidus
sont déterminés sur les courbes d’échauffement paranalyse
thermique
ou par mesure de la résistanceélec-trique.
Les résultats obtenus sont vérifiés parl’analyse
thermique
différentielle degouttes
d’alliage
débarras-sées des
particules
d’oxyde (le
diamètre de cesgouttes
variant de 300 à 800
um).
Diagrammes
d’équilibre
gallium-étain.
- Nousavons établi que
l’eutectique
gallium
7-étain
seforme à
20,4 :i:: 0,1
°C pour uneconcentration
enétain de
12,8 %,
enpoids
(*).
Les résultatsobtenus
permettent
la construction dudiagramme
repré-senté sur lafigure 1 :
la branche ABcorrespond
à
l’équilibre gallium
I-liquide
et la branche BC àl’équilibre étain-liquide ;
lapartie
BD estl’extra-polation
de BC dans le domaine de la surfusion.Les
points
expérimentaux
sur la branche BD ont(*)
On sait que la solubilité de l’étain dans legallium
est de 0,028 % en poids d’étain à la température eutec.tique
[13]. ,18
été déterminés par des mesures de résistance
élec-trique :
pour ce faire nous avons étudié la varia-tion de la résistance de diversalliages
en fonction de latempérature.
A cet effet la masseliquide
contenue dans un tube en U est refroidie
jusqu’à
cessation de la surfusion. Par
chauffage
on observeFIG.1. -
Diagrammes d’équilibre Ga I- et Ga II-Sn pour les faibles concentrations en étain.
la dissolution
progressive
de l’étain etlorsque
celle-ci se termine on remarque unbrusque
chan-gement
depente
sur la courbe de variation de la résistance en fonction de latempératures.
Latempé-rature
correspondant
à cechangement
depente,
pour unecomposition
donnée, permet
âe
cons-truire la
partie
BD duliquidus.
Sur les courbesd’analyse
thermique,
on constatel’apparition
d’unpalier
à -23,3 Jb
0,3
°Cqui correspond
à la for-mation d’uneutectique
entre Ga II et l’étaincontenant
5,3
% en poids
d’étain(point figuré
parD sur la
figure
1).
Lesbranches
ED et DBconsti-tuent le
liquidus
dudiagramme d’équilibre
gal-lium II-étain.D’après
la loi de Raoult et connaissant lespro-priétés
thermodynamiques
[2]
de laphase
instablenous pouvons
calculer l’abaissement dupoint
defusion
de
Ga IIcorrespondant
à lacomposition
eutectique
de5,3 %
enpoids
d’étain : on trouveATf
=6,8
OC ;
cequi
est en accord avec la valeurdéterminée
expérimentalement
.Diagramme
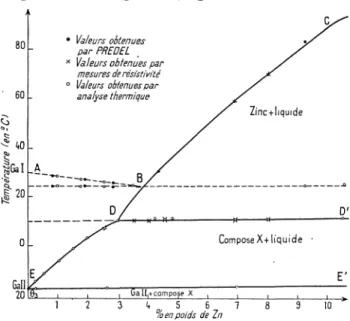
d’équilibre
gallium-zinc.
- Pourl’alliage
gallium
I-zinc nos résultats sont assezvoisins de ceux de Heumann :
l’eutectique
seforme à
25,2 =F 0,1
°C et sacomposition
est3,6
%
enpoids
de zinc(point
B,
figure
2).
FiG. 2. -
Diagrammes Ga I- et Ga II-Zn pour les faibles
concentrations en zinc. L’horizontale DD’
correspond
à la température 0,.A la
précision
denos-mesures,
nous n’avons pasconstaté la formation d’un
eutectique
entre legallium
II et lezinc. L’analyse
thermique
desalliages
contenantplus
de 3%
enpoids
de zincrévèle un
palier
à latempérature
02
=10 -!
0,2 °C,
L’existence de cepalier
est confirmée par desmesures de résistance
électrique.
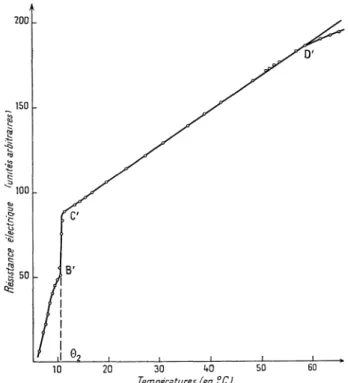
Commeexemple,
nous donnons une courbe(fig. 3)
qui
représente
la variation de la résistanceélectrique
en fonction dela
température
d’un
alliage
à 7%
enpoids
de zinc. Nousremarquons
unpalier
B’C’ à latempérature
02
et unchangement
depente
en D’qui correspond
à la
température
àlaquelle
la dissolution du zinc dans leliquide
se termine. Laprésence
dupalier
à latempérature
62 pourrait s’interpréter
par laformation d’un
composé
X àpoint
de fusionin-congruent ;
cependant l’impossibilité
de maintenir en surfusion au-dessous de latempérature
0 2
desalliages
de teneur enpoids
de zincsupérieure
à 10%
ne nouspermet
pas depréciser
cepoint
de vue avec nos méthodesd’investigation.
Diagrammes
d’équilibre
gallium-indium.
- Sur lafigure
4 nous avonsreproduit
lediagramme
d’é-quilibre
entre legallium
I etl’indium,
établi avecFIG. 3. -
Variations de la résistance électrique avec la
température d’un alliage de gallium II et de zinc (7 % en
poids de zinc).
Pour étudier les
alliages
Ga II-Indium nousavons fait des mesures
d’analyse thermique
enopérant
de la mêmefaçon
que pour lesalliages
d’étain et de zinc., Les résultats obtenus sont
grou-pés
sur lediagramme présenté
sur lafigure
4. Nousconstatons en
premier
lieu que legallium
II etl’indium forment un
eutectique qui
fond à-
28,3 + 0,2
°C pour unecomposition
enpoids
d’indiumvoisine
de 10%. (point figuratif
F).
La brancheBF
est leliquidus prolongé
dans le domaine de la surfusion etcorrespond
àl’équi-libre
indium-liquide.
D’ailleurs dans leurarticle
Deny,
Hamiltôn et Lewis[11]
avaient mentionnéque le
liquidus présentait
uneligne d’équilibre
métastable BB’.
Il se forme aussi un autre
eutectique
entre legallium
II et uncomposé
Y àpoint
de fusionincongruent :
ceteutectique
contenant5,6
%
enpoids
d’indium fond à -23,2-
±
0,2
°C(point
représentatif D).
Leliquidus
DCcorrespond
àl’équilibre
entre leliquide
et lecomposé
Y. Enrefroidissant les
alliages
dont la teneur enpoids
d’indium estsupérieure
à 14%
on observe sur les courbes de refroidissement unpremier
palier
à- 10, 1 -4- 0,2
°Cqui
indique l’apparition
ducom-posé
Y(droite CC’),
et un secondpalier,
à-
23,2 ± 0,2 °C,
qui
montre la formation de/
FIG. 4. -
Diagrammes d’équilibre Ga I- et Ga II-In.
l’eutectique
Ga77-composé
Y(droite
DD").
Par refroidissement desalliages
de teneur enpoids
d’indium inférieure à 20
%
nous pouvons obtenirl’un ou l’autre de ces deux
eutectiques.
Il existe aussi des cas où la solidification s’effectue à -re-20
monte et se fixe à celle de l’autre
palier eutectique,
c’est-à-dire à -
23,2
OC. Dans ce dernier casl’équi-libre : Ga
II-Indium-liquide
se transformesponta-nément en un nouvel état
d’équilibre :
Ga77-Com-posé
Y-liquide.
Commeexemple
nous donnonsdeux
analyses thermiques
différentes d’unalliage
à1,82
%
enpoids
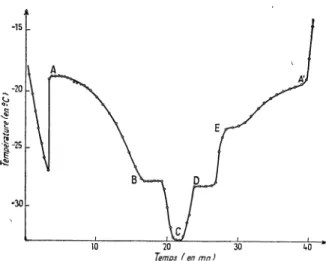
d’indium. Unepremière
analyse
(fig.
5)
décèlel’apparition
de cristaux de Ga IIFIG. 5.
£Analyse
thermique d’un alliagede gallium II et d’indium
(1,82
% enpoids d’indium).
(point;A)
puis
de cristauxd’eutectique
Ga II-indium(palier
B).
L’alliage
est ensuiteréchauffé ;
lepalier
Dcorrespond
à la fusion del’eutectique
Ga II-Inpuis
soudain latempérature
remonte etse fixe à -
23,2
°C(point E) :
ilapparait
sponta-némentl’eutectique
GaII-composé
Y. EnA’,
nousfranchissons le
liquidus
GaII-liquide.
La courbe de lafigure
6 concernel’analyse thermique
du mêmealliage
sansl’apparition
del’eutectique qui
se forme à -23,2
°C..D’autres cas seprésentent
où l’on obtient directementl’eutectique
à -23,2
°C.Nous n’avons pu maintenir en surfusion
au-des-sous de -10 °C des
alliages
de teneur enpoids
d’indium
supérieure
à 70%. Cependant,
pour déterminer la constitution ducomposé
Y àpoint
FIG. 6. - Autre allure d’une
analyse
thermique
du même alliage degallium
II et d’indium(1,82
% enpoids
d’indium).
de fusion
incongruent
nous avons étudié une séried’échantillons jusqu’à
l’obtention d’unalliage
dontl’analyse
thermique
ne révèleplus
l’existence dupalier
à -23,2
oC,
ce que l’on observe pour unalliage
dont la teneur enpoids
d’indium est voi-sine de 52%
(composition
trèsproche
de celle deGa3 In2).
En conclusion ces résultats montrent que les
deux formes
allotropiques
dugallium
secom-portent
différemment dans la formation desal-liages
binaires. Si lesdiagrammes
Ga I-Sn,
Ga
II-Sn,
Ga I-Zn et Ga I-In sont essentielle-ment dutype
eutectique,
par contre ilapparait
descomposés
àpoint
de fusionincongruent
entreGa II et l’indium et
probablement
entre Ga II etle zinc. La
grande
instabilité desalliages
formés avec Ga II ne nouspermettait
pas d’en fairel’étude aux rayons X.
Cependant
la méthode récente[14]
depréparation
degouttes exemptes
d’oxyde
permet
d’élaborer desalliages
beaucoup
plus
stables et laisseespérer
une étudecristallogra-phique plus
aisée.Manuscrit reçu le 27
juillet
1962.BIBLIOGRAPHIE
[1] DEFRAIN
(A.)
et EPELBOIN(I.),
J.Physique Rad., 1960,
21, 7 6.
[2] DEFRAIN
(A.),
Thèse, Paris, Éditions Métaux etCor-rosion, 1960.
[3] BRIDGMAN (P. W.), Phys. Rev., 1935, 48, 893.
[4] CURIEN
(H.),
RIMSKY(A.)
et DEFRAIN(A.),
Bull. Soc. Franc. Min. Crist., 1961, 84, 260.[5] LAVES
(F.),
Z. Krist, 1933, 84, 256.[6] EPELBOIN
(I.)
et ERNY(M.),
J.Physique
Rad., 1960, 21, 82.[7] PUSCHIN
(M.
A.), STEPANOVIC(S.)
et STAJIC(V.),
Z.Anorg. Chemie, 1932, 209, 329-334.
[8] KROLL
(W.),
Metallw., 1932, 11, 435-437.[9] HEUMANN
(T.)
et PREDEL(B.),
Z. Metall., 1958, 49, 90-95.[10] FRENCH
(S.
J.), SAUNDERS(D. J.)
et INGLE(G. W.),
J. Phys. Chem.,1938, 42, 265-274.
[11] DENY
(J.
P.), HAMILTON(J.
H.), LEWIS(J. R.),
T. A. I. M. E., 1952,194, 39-42.[12] SWIRBELEY (W.
J.)
et SELIS(S. M.),
J. Phys. Chem., 1954, 58, 33-35.[13] AUDIT
(P.),
EPELBOIN(I.)
et ERNY(M.),
Rev. Metal., 1962, 59, n° 3, 233.[14] BOSIO