UNIVERSITÉ MOHAMMED V-RABAT
FACULTE DE MÉDECINE ET DE PHARMACIE – RABAT
ANNEE : 2016 THÈSE N° : 98
LES ThérapieS cibléeS ET LEUR
PLACE en onco-hématologie
THÈSE
Présentée et soutenue publiquement le:………..….…2016
PAR
Mr MOHAMED EL AACHAB
Né le 13 février 1991 à Casablanca
Pour l'Obtention du Doctorat en pharmacie
MOTS CLES :
thérapies ciblées, anticorps monoclonaux, inhibiteurs de tyrosine kinase, hémopathies malignes.MEMBRES DE JURY
Mr. A. MASRAR
PRÉSIDENT
Professeur d’Hématologie biologique
Mme. M. NAZIH
RAPPORTEUR
Professeur d’Hématologie biologique
Mme. S. BENKIRANE
Professeur d’Hématologie biologique
Mme. M. El MARJANY
Professeur de Radiothérapie-oncologie
انتملع ام لاإ انل ملع لا كناحبس
ميكحلا ميلعلا تنأ كنإ
ةيلآا ةرقبلا ةروس
:
UNIVERSITE MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 – 2013 : Professeur Najia HAJJAJ - HASSOUNI
ADMINISTRATION :
Doyen : Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines
Professeur Mohammed AHALLAT
Vice Doyen chargé de la Recherche et de la Coopération
Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général : Mr. El Hassane AHALLAT
1- ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS :
Mai et Octobre 1981
Pr. MAAZOUZI Ahmed Wajih Chirurgie Cardio-Vasculaire Pr. TAOBANE Hamid* Chirurgie Thoracique
Mai et Novembre 1982
Pr. BENOSMAN Abdellatif Chirurgie Thoracique
Novembre 1983
Pr. HAJJAJ Najia ép. HASSOUNI Rhumatologie
Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif pathologie Chirurgicale
Pr. BENJELLOUN Halima Cardiologie
Pr. BENSAID Younes Pathologie Chirurgicale Pr. EL ALAOUI Faris Moulay El Mostafa Neurologie
Janvier, Février et Décembre 1987
Pr. AJANA Ali Radiologie
Pr. CHAHED OUAZZANI Houria Gastro-Entérologie Pr. EL YAACOUBI Moradh Traumatologie Orthopédie Pr. ESSAID EL FEYDI Abdellah Gastro-Entérologie
Pr. LACHKAR Hassan Médecine Interne Pr. YAHYAOUI Mohamed Neurologie
Décembre 1988
Pr. BENHAMAMOUCH Mohamed Najib Chirurgie Pédiatrique Pr. DAFIRI Rachida Radiologie
Pr. HERMAS Mohamed Traumatologie Orthopédie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR Pr. BOUKILI MAKHOUKHI Abdelali* Cardiologie
Pr. CHAD Bouziane Pathologie Chirurgicale Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. CHKOFF Rachid Pathologie Chirurgicale Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique Pr. MANSOURI Fatima Anatomie-Pathologique Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AL HAMANY Zaîtounia Anatomie-Pathologique
Pr. AZZOUZI Abderrahim Anesthésie Réanimation –Doyen de la FMPO Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale Pr. BENSOUDA Yahia Pharmacie galénique Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie Obstétrique Pr. CHABRAOUI Layachi Biochimie et Chimie
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie – Dir. du Centre National PV Pr. TAOUFIK Jamal Chimie thérapeutique
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale Pr. BENSOUDA Adil Anesthésie Réanimation Pr. BOUJIDA Mohamed Najib Radiologie
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie Pr. CHRAIBI Chafiq Gynécologie Obstétrique Pr. DAOUDI Rajae Ophtalmologie
Pr. DEHAYNI Mohamed* Gynécologie Obstétrique Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie Pr. GHAFIR Driss* Médecine Interne Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie Pr. BEN RAIS Nozha Biophysique Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques Pr. EL AMRANI Sabah Gynécologie Obstétrique
Pr. EL AOUAD Rajae Immunologie
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale- Directeur CHIS Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique Pr. HADRI Larbi* Médecine Interne Pr. HASSAM Badredine Dermatologie Pr. IFRINE Lahssan Chirurgie Générale Pr. JELTHI Ahmed Anatomie Pathologique Pr. MAHFOUD Mustapha Traumatologie – Orthopédie Pr. MOUDENE Ahmed* Traumatologie- Orthopédie Pr. RHRAB Brahim Gynécologie –Obstétrique Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie
Pr. ABDELHAK M’barek Chirurgie Pédiatrique Pr. BELAIDI Halima Neurologie
Pr. BRAHMI Rida Slimane Gynécologie Obstétrique Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie
Pr. CHAMI Ilham Radiologie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie Pr. EL ABBADI Najia Neurochirurgie Pr. HANINE Ahmed* Radiologie
Pr. JALIL Abdelouahed Chirurgie Générale Pr. LAKHDAR Amina Gynécologie Obstétrique Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale Pr. AMRAOUI Mohamed Chirurgie Générale Pr. BAIDADA Abdelaziz Gynécologie Obstétrique Pr. BARGACH Samir Gynécologie Obstétrique Pr. CHAARI Jilali* Médecine Interne
Pr. DIMOU M’barek* Anesthésie Réanimation Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie Pr. HDA Abdelhamid* Cardiologie - Dir. HMIMV Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie Pr. MOHAMMADI Mohamed Médecine Interne
Pr. OUADGHIRI Mohamed Traumatologie-Orthopédie Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie Pr. CHAOUIR Souad* Radiologie Pr. ERREIMI Naima Pédiatrie Pr. FELLAT Nadia Cardiologie
Pr. HAIMEUR Charki* Anesthésie Réanimation Pr. KADDOURI Noureddine Chirurgie Pédiatrique Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. OUAHABI Hamid* Neurologie Pr. TAOUFIQ Jallal Psychiatrie
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. AFIFI RAJAA Gastro-Entérologie
Pr. BENOMAR ALI Neurologie – Doyen Abulcassis Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale Pr. EZZAITOUNI Fatima Néphrologie
Pr. LAZRAK Khalid * Traumatologie Orthopédie Pr. BENKIRANE Majid* Hématologie
Pr. KHATOURI ALI* Cardiologie
Pr. LABRAIMI Ahmed* Anatomie Pathologique
Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. ISMAILI Hassane* Traumatologie Orthopédie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation inspecteur SS Pr. TACHINANTE Rajae Anesthésie-Réanimation
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AIT OURHROUI Mohamed Dermatologie Pr. AJANA Fatima Zohra Gastro-Entérologie Pr. BENAMR Said Chirurgie Générale Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation Pr. EL HASSANI Amine Pédiatrie
Pr. EL KHADER Khalid Urologie Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques Pr. HSSAIDA Rachid* Anesthésie-Réanimation
Pr. LAHLOU Abdou Traumatologie Orthopédie Pr. MAFTAH Mohamed* Neurochirurgie
Pr. MAHASSINI Najat Anatomie Pathologique Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. NASSIH Mohamed* Stomatologie Et Chirurgie Maxillo-Faciale Pr. ROUIMI Abdelhadi* Neurologie
Décembre 2000
Pr. ZOHAIR ABDELAH* ORL
Décembre 2001
Pr. ABABOU Adil Anesthésie-Réanimation Pr. BALKHI Hicham* Anesthésie-Réanimation Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie Pr. BENELBARHDADI Imane Gastro-Entérologie Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie Pr. BEZZA Ahmed* Rhumatologie Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. GAZZAZ Miloudi* Neuro-Chirurgie Pr. HRORA Abdelmalek Chirurgie Générale Pr. KABBAJ Saad Anesthésie-Réanimation Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale Pr. MIKDAME Mohammed* Hématologie Clinique Pr. MOHSINE Raouf Chirurgie Générale Pr. NOUINI Yassine Urologie
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie Pr. BERNOUSSI Zakiya Anatomie Pathologique Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique Pr. EL HAOURI Mohamed * Dermatologie
Pr. EL MANSARI Omar* Chirurgie Générale Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie Pr. KRIOUILE Yamina Pédiatrie
Pr. LAGHMARI Mina Ophtalmologie
Pr. MABROUK Hfid* Traumatologie Orthopédie Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique Pr. MOUSTAGHFIR Abdelhamid* Cardiologie
Pr. NAITLHO Abdelhamid* Médecine Interne
Pr. RACHID Khalid * Traumatologie Orthopédie Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie Pr. BENKIRANE Ahmed* Gastro-Entérologie Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie Pr. CHERRADI Nadia Anatomie Pathologique Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie Pr. HACHI Hafid Chirurgie Générale Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHABOUZE Samira Gynécologie Obstétrique Pr. KHARMAZ Mohamed Traumatologie Orthopédie Pr. LEZREK Mohammed* Urologie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique Pr. TIJAMI Fouad Chirurgie Générale Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALAOUI Ahmed Essaid Microbiologie Pr. ALLALI Fadoua Rhumatologie Pr. AMAZOUZI Abdellah Ophtalmologie Pr. AZIZ Noureddine* Radiologie Pr. BAHIRI Rachid Rhumatologie Pr. BARKAT Amina Pédiatrie
Pr. BENHALIMA Hanane Stomatologie et Chirurgie Maxillo Faciale Pr. BENYASS Aatif Cardiologie
Pr. BERNOUSSI Abdelghani Ophtalmologie Pr. CHARIF CHEFCHAOUNI Mohamed Ophtalmologie Pr. DOUDOUH Abderrahim* Biophysique Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire Pr. LYAGOUBI Mohammed Parasitologie
Pr. NIAMANE Radouane* Rhumatologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique Pr. ZERAIDI Najia Gynécologie Obstétrique
Décembre 2005
Pr. CHANI Mohamed Anesthésie Réanimation
Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie Pr. BENCHEIKH Razika O.R.L Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique Pr. DOGHMI Nawal Cardiologie
Pr. ESSAMRI Wafaa Gastro-entérologie Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation Pr. GHADOUANE Mohammed* Urologie
Pr. HARMOUCHE Hicham Médecine Interne Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie Pr. OUANASS Abderrazzak Psychiatrie Pr. SAFI Soumaya* Endocrinologie Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale Pr. ACHACHI Leila Pneumo phtisiologie Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire Pr. AMHAJJI Larbi* Traumatologie orthopédie
Pr. AMMAR Haddou* ORL
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed* Anesthésie réanimation directeur ERSSM Pr. BALOUCH Lhousaine* Biochimie-chimie
Pr. BENZIANE Hamid* Pharmacie clinique Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHARKAOUI Naoual* Pharmacie galénique Pr. EHIRCHIOU Abdelkader* Chirurgie générale Pr. ELABSI Mohamed Chirurgie générale Pr. EL MOUSSAOUI Rachid Anesthésie réanimation Pr. EL OMARI Fatima Psychiatrie
Pr. GANA Rachid Neuro chirurgie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale Pr. ISMAILI Nadia Dermatologie Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie réanimation Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation médicale Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo phtisiologie Pr. MASRAR Azlarab Hématologie biologique Pr. MOUTAJ Redouane * Parasitologie
Pr. MRABET Mustapha* Médecine préventive santé publique et hygiène
Pr. MRANI Saad* Virologie
Pr. RABHI Monsef* Médecine interne Pr. RADOUANE Bouchaib* Radiologie Pr. SEFFAR Myriame Microbiologie Pr. SEKHSOKH Yessine* Microbiologie Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2007
Pr. DOUHAL ABDERRAHMAN Ophtalmologie
Décembre 2008
Pr ZOUBIR Mohamed* Anesthésie Réanimation Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Pr. ABOUZAHIR Ali* Médecine interne Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMAHZOUNE Brahim* Chirurgie Cardio-vasculaire Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie
Pr. AZENDOUR Hicham* Anesthésie Réanimation Pr. BELYAMANI Lahcen* Anesthésie Réanimation Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie Pr. BOUI Mohammed* Dermatologie Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie orthopédique Pr. CHAKOUR Mohammed * Hématologie biologique
Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie Pr. L’KASSIMI Hachemi* Microbiologie
Pr. LAMSAOURI Jamal* Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique Pr. MSSROURI Rahal Chirurgie Générale Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie Pr. ZOUHAIR Said* Microbiologie
PROFESSEURS AGREGES :
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation Pr. AMEZIANE Taoufiq* Médecine interne Pr. BELAGUID Abdelaziz Physiologie
Pr. BOUAITY Brahim* ORL
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique Pr. DAMI Abdellah* Biochimie chimie Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie plastique et réparatrice Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro entérologie Pr. LAMALMI Najat Anatomie pathologique Pr. LEZREK Mounir Ophtalmologie
Pr. MALIH Mohamed* Pédiatrie
Pr. MOSADIK Ahlam Anesthésie Réanimation Pr. MOUJAHID Mountassir* Chirurgie générale Pr. NAZIH Mouna* Hématologie
Pr. ZOUAIDIA Fouad Anatomie pathologique
Mai 2012
Pr. ABOUELALAA Khalil* Anesthésie Réanimation Pr. BELAIZI Mohamed* Psychiatrie
Pr. BENCHEBBA Driss* Traumatologie Orthopédique Pr. DRISSI Mohamed* Anesthésie Réanimation Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek* Médecine Interne Pr. EL OUAZZANI Hanane* Pneumophtisiologie Pr. ER-RAJI Mounir Chirurgie Pédiatrique Pr. JAHID Ahmed Anatomie pathologique Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
Février 2013
Pr. AHID Samir Pharmacologie – Chimie Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie Pr. AMOUR Mourad Anesthésie Réanimation Pr. AWAB Almahdi Anesthésie Réanimation Pr. BELAYACHI Jihane Réanimation Médicale Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation Pr. BENCHEKROUN Laila Biochimie-Chimie Pr. BENKIRANE Souad Hématologie biologique Pr. BENNANA Ahmed* Informatique Pharmaceutique Pr. BENSEFFAJ Nadia Immunologie
Pr. BENSGHIR Mustapha* Anesthésie Réanimation Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie Pr. EL GUERROUJ Hasnae Médecine Nucléaire Pr. EL HARTI Jaouad Chimie Thérapeutique Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation Pr. EN-NOUALI Hassane* Radiologie
Pr. ERRGUIG Laila Physiologie Pr. FIKRI Meryim Radiologie Pr. GHANIMI Zineb Pédiatrie
Pr. GHFIR Imade Médecine Nucléaire Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie Pr. LATIB Rachida Radiologie Pr. MAAMAR Mouna Fatima Zahra Médecine Interne Pr. MEDDAH Bouchra Pharmacologie Pr. MELHAOUI Adyl Neuro-chirurgie Pr. MRABTI Hind Oncologie Médicale Pr. NEJJARI Rachid Pharmacognosie Pr. OUBEJJA Houda Chirurgie Pédiatrique Pr. OUKABLI Mohamed* Anatomie Pathologique Pr. RAHALI Younes Pharmacie Galénique Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie Pr. REDA Karim* Ophtalmologie Pr. REGRAGUI Wafa Neurologie Pr. RKAIN Hanan Physiologie Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique Pr. ROUIBAA Fedoua* Gastro-Entérologie Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale Pr. GHOUNDALE Omar* Urologie
Pr. ZYANI Mohammad* Médecine Interne
2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES
PROFESSEURS / PRs. HABILITESPr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. BOURJOUANE Mohamed Microbiologie
Pr. BARKYOU Malika Histologie-Embryologie Pr. CHAHED OUAZZANI Lalla Chadia Biochimie – chimie Pr. DAKKA Taoufiq Physiologie
Pr. DRAOUI Mustapha Chimie Analytique Pr. EL GUESSABI Lahcen Pharmacognosie Pr. ETTAIB Abdelkader Zootechnie Pr. FAOUZI Moulay El Abbes Pharmacologie Pr. HAMZAOUI Laila Biophysique Pr. HMAMOUCHI Mohamed Chimie Organique Pr. IBRAHIMI Azeddine Biologie moléculaire Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie Pr. ZAHIDI Ahmed Pharmacologie Pr. ZELLOU Amina Chimie Organique
Mise à jour le 09/01/2015 par le Service des Ressources Humaines
Dédicaces
A mes très chers parents
Abdelkader et Rkia
Aucune expression, ni aucune dédicace ne pourrait exprimer mes
meilleures reconnaissances.
Vous avez guidé mes premiers pas, et vous étiez toujours une source
intarissable d'amour et de sacrifice.
J'espère réaliser en ce jour un de vos rêves, et être digne, toute ma
vie personnelle et professionnelle, de votre éducation et de votre
confiance.
Puisse Dieu vous protéger, vous accorder santé et longue vie.
A mes très Chers Frères et mes soeurs Yassine, Youssef, Hassna
et Meriem
En témoignage des profonds liens fraternels qui nous unissent. Ces
quelques lignes ne sauront exprimer toute l’affection et l’amour que je
vous porte. Puisse dieu vous procurer santé, bonheur, et prospérité
que vous méritiez.
A tous mes oncles et mes cousins
Que ce travail puisse vous exprimer mon profond attachement, mon
amour et mon respect.
Je vous souhaite une vie pleine de bonheur et de réussite.
A mes très chers amis
Karim, Ayoub, Yassine, Fayçal, Mohammed, Hassane,
ABELILAH, Mohammed, Hicham, Amine, Khalid, Nidhal, Ahmed,
Mamoun, Ikhlas , Youssra, ,Sanaa, Fadwa…
A tous ceux dont l’oubli du nom n’est pas celui du cœur.
Je ne peux trouver les mots justes et sincères pour vous
exprimer mon affection et mes pensées, vous êtes pour moi des
confrères sur qui je peux compter.
En témoignage de l’amitié qui nous unie et des souvenirs de
tous les moments que nous avons passé ensemble, je vous dédie ce
travail et je vous souhaite une vie pleine de santé et de bonheur.
A tous mes amis et camarades de promotion
A Allah
Tout puissant
Qui m’a inspiré
Qui m’a guidé dans le bon chemin
Je vous dois ce que je suis devenue
Louanges et remerciements
Pour votre clémence et miséricorde.
A
NOTRE MAITRE ET PRESIDENT DE THESE
MONSIEUR LE PROFESSEUR AZLARAB MASRAR
CHEF DE SERVICE HEMATOLOGIE BIOLOGIQUE CHU
Vous nous avez accordé un immense honneur
et un grand privilège en acceptant la présidence de notre jury de
thèse.
Nous vous remercions aussi pour la gentillesse
et la spontanéité avec lesquelles vous avez bien voulu diriger ce
travail.
Nous vous prions, cher Maître, d'accepter dans ce travail le
témoignage de notre haute considération,
A
NOTRE MAITRE ET DIRECTRICE DE THESE
MADAME LE PROFESSEUR MOUNA NAZIH
PROFESSEUR D'HEMATOLOGIE BIOLOGIQUE
Merci pour m’avoir accueilli dans votre service et pour
m’avoir accepté ce sujet de thèse, pour la confiance que vous
m’avez accordée du début à la fin du travail et pour votre
disponibilité.
Vous n’avez jamais lésiné ni sur votre temps ni sur votre
savoir tout le long de ce travail.
Merci pour votre soutien, votre patience, vos
encouragements et votre optimisme infaillible, merci d’avoir
trouvé les mots qu’il faut aux moments qu’il faut.
Je n’oublie pas enfin votre aide précieuse dans la relecture et
la correction de ma thèse.
Je vous prie de trouver ici, chère Professeur, le témoignage de
ma profonde reconnaissance et de mon immense respect.
A
NOTRE MAITRE ET JUGE DE THESE
MONSIEUR LE PROFESSEUR MOHAMMED EL MARJANY
PROFESSEUR DE RDIOTHERAPIE-ONCOLOGIE
Nous vous remercions vivement pour l’honneur que vous nous
faites en acceptant de juger ce travail.
Nous sommes très sensibles à votre gentillesse, votre accueil
très aimable, votre volonté d’enseigner et à votre profonde
humanité.
Que ce travail soit pour nous l’occasion de vous exprimer notre
admiration ainsi que notre gratitude.
Veuillez croire, cher maître, en nos sentiments les plus
respectueux.
A
NOTRE MAITRE ET JUGE DE THESE
MADAME LE PROFESSEUR
SOUAD BENKIRANE
PROFESSEUR D’HEMATOLOGIE BIOLOGIQUE
Nous vous remercions vivement de l’honneur que vous nous
faites en acceptant de juger ce travail.
Votre compétence, votre dynamisme, ainsi que vos qualités
humaines et professionnelles exemplaires ont toujours suscité
notre admiration.
Qu’il soit permis, chère maître, de vous exprimer notre sincère
reconnaissance, notre profond respect et notre plus grande estime
LISTE DES TABLEAUX
Tableau 1 : Inhibiteurs de Métalloprotéases en clinique et sur le marché.
Tableau 2 : Critères clinico-biologiques d’accélération selon le registre international des
greffes de moelle osseuse (IBMTR).
Tableau 3 : La réponse au traitement
Tableau 4 : Bortezomib en traitement de rechute
Liste des figures
Figure 1 : Les mécanismes fondamentaux de l’oncogenèse et leur ciblage potentiel par une thérapie
ciblée (Hanahan, 2011).
Figure 2 : Structure du Glivec® (Imatinib mésylate)
Figure 3 : Schéma historique des enregistrements des traitements ciblés.
Figure 4 : Principales voies de signalisation intracellulaire
Figure 5 : Récepteurs à activité tyrosine kinase
Figure 6 : Activation des RTKs
Figure 7. : Structure schématique d’une immunoglobuline G
Figure 8 : Les différentes générations d’anticorps thérapeutiques
Figure 9 : Production des anticorps monoclonaux d’après Kôhler et Milstein.
Figure 10. : Méthodes permettant d’obtenir des anticorps humains et humanisés
Figure 11. : Stratégies utilisées pour améliorer les propriétés pharmacologiques des anticorps.
Figure 12 : Structure de base d’un anticorps.
Figure 13 : Mécanismes d'action des anticorps monoclonaux dans l'immunothérapie anti¬tumorale :
la CDC.
Figure 14 : Mécanismes d'action des anticorps monoclonaux dans l’immunothérapie anti-tumorale:
mécanismes indirects: ADCC.
Figure 15 : Mécanisme de cytotoxicité induit par les anticorps anti-CD20
Figure 16 : Les AcMo sont éliminés par catabolisme non spécifique et en partie protégés par le
récepteur Fc néonatal ou FcRn.
Figure 17 : L’élimination des AcMo après fixation sur leur antigène-cible
Figure 18 : Formules développées des trois classes chimiques des ITKs
Figure 20 : Voie de signalisation JAK-STAT dans les myélofibroses
Figure 21 : Voie de signalisation de c-KIT et PDGFRA
Figure 22 : Rôle des voies de signalisation en aval de VEGFR
Figure 23 : Voie de signalisation d'EGFR
Figure 24 : Schéma du récepteur RET avec représentation des principales mutations et sites de
phosphorylation
Figure 25 : Représentation 3D des conformations inactive versus active des proteines kinases d’après
http://www.cellbiol.net/ste/rpimages.php
Figure 26 : Modèle pharmacophorique des inhibiteurs de type I
Figure 27 : Modèle pharmacophorique des inhibiteurs de type I1/2
Figure 28 : Modèle pharmacophorique des inhibiteurs de type II
Figure 29 : Principaux mécanismes de résistance à l’imatinib : trois partenaires importants.
Figure 30 : Exemples d’inhibiteurs des EGFRs
Figure 31 : Structure d’OSI-906, inhibiteur du RTK IGF-1R
Figure 32 : Structure de XL-880, inhibiteur du RTK c-Met
Figure 33 : Exemples d’inhibiteurs de PI3K
Figure 34 : Exemples d’inhibiteurs d’Akt en phase clinique
Figure 35 : Structure de l’inhibiteur de mTor Temsirolimus (Torisel®)
Figure 36 : Structure du Tipifarnib, inhibiteur de l’activation de Ras
Figure 37 : Principaux inhibiteurs de MEK en phase clinique
Figure 38 : Régulation du cycle cellulaire par les cycline-dependent kinases (CDKs)
Figure 39 : Exemples d’inhibiteurs de CDKs
Figure 40 : Exemples d’inhibiteurs d’Aurora en phase clinique
Figure 41 : Exemples de molécules inhibitrices du VEGFR
Figure 43 : Marimastat
Figure 44 : Batimastat
Figure 45 : AG3340
Figure 46 : CGS 25966
Figure 47 : Chromosome Philadelphie. La translocation réciproque t(9;22)
Liste des abréviations
AcMo : Anticorps Monoclonaux
ADCC : cytotoxicité cellulaire dépendante d’anticorps
ADN : Acide Désoxyribo-Nucléique
AGP : Alpha 1 Glycoprotéine ALK : anaplastic lymphoma kinase
AMM : autorisation de mise sur le marché
ATP : Adénosine triphosphate
ATRA : acide tout trans rétinoique
Bcr-Abl : Bcr, Breakpoint cluster region, Abl, Abelson
CBNPC : Cancer bronchique non à petites cellules
CDK : Cyclin-dependent kinase
CD : cluster de différentiation
CDC : cytotoxicité dépendante du complément
CDK : Cyclin-dependent kinase
CDR : région déterminante de complémentarité, complementary determining region
CHO : Chinese Hamster Ovary
CHOP : cyclophosphamide, doxorubicine, vincristine, prednisolone
CSH : cellule souche hématopoïétique
CSF : Coloning Stimulating Factor
EGFR : Epidermal growth factor receptor
ELISA : Enzyme-linked Immunosorbent Assay
Epo : Erythropoïétine
ERK : Extracellular signal-regulated kinase
Fab : fragment du site de liaison de l’antigène, fragment antigen-binding
Fc : Fragment cristallisable
FDA : Food and Drug Administration
FLT3 : FMS like tyrosine kinase
GISTs : tumours gastro-intestinales
HAMA : anticorps humain anti-anticorps murin, human anti-mouse antibody
HAHA : Human Anti-Human Antibodie
HER : Human epidermal receptor
HGF : Hepatocyte growth factor
hOCT1 : human organic cation transporteur 1
IGFR : Insulin-like growth factor receptor
IL : Interleukine
IR : Infra rouge ou Insulin Receptor
ITK : inhibiteur de tyrosine kinase
JAK : Janus kinase
JNK : Jun N-terminal Kinase
cKIT : récepteur au SCF
LAL : Leucémie aigue lymphoblastique
LAM : Leucémie aigue myéloblastique
LAP : Leucémie aiguë promyélocytaire
LB : Lymphocyte B
LLC : leucémie lymphoïde chronique
LMC : Leucémie myéloïde chronique
LNH : Lymphome Non Hodgkinien
LMNH : Lymphomes malins non hodgkiniens
LT : Lymphocyte T
MAPK : Mitogen-activated protein kinase
MEK : Mitogen-activated extracellular signal-regulated protein kinase
MMP : Métalloprotéinase matricielle
mTor : Mammalian target of rapamycin
PDGFR : Platelet-derived growth factor receptor
PI3K : Phosphoinositide 3 kinase
PIP3 : Phosphatidylinositol (3,4,5)-trisphosphate
PK/PD : Pharmacokinetic/Pharmacodynamic
PTEN : Phosphatase and TENsin homolog
PV : polyglobulie de Vaquez
RET : Rearranged during tranfection
RTK : Récepteur tyrosine kinase
SCF : Stem cell factor
SH : Src Homology
Src : Sarcoma
STAT : Signal transducers and activator of transcription
TNF : Tumor Necrosis Factor
VEGF : vascular endothelial growth factor
VEGFR : Vascular endothelial growth factor receptor
VH : Chaîne lourde
VL : Chaîne Légère
TC : Thérapie ciblée
Sommaire
I- Introduction : ... 1 PREMIERE PARTIE : GENERALITES CONCERNANT LA THERAPIE CIBLEE I- Définition ... 3 II- Historique ... 4 III- Rappel physiologique ... 5 1. Les récepteurs à activité tyrosine kinase : ... 8 2. Voie RAF/MEK/ERK ... 9 3. Voie PI3K/AKT/mTOR ... 10 IV- Classification des thérapies ciblées ... 11 IV-A Les différentes classes de la thérapie ciblée et leur mode d’action : ... 11 1-Les anticorps monoclonaux : ... 11 1.1 Structure protéique des anticorps : ... 11 1.2 Pharmacologie des anticorps monoclonaux : ... 13 1.2.1 Mécanismes d’action des anticorps ... 13 1.2.2 Propriétés pharmacocinétiques des anticorps monoclonaux : ... 17 1.3 Cibles des Ac monoclonaux ... 20
1.3.1 Cibles potentielles des anticorps monoclonaux dans les hémopathies
malignes ... 21 a. CD20 ... 21 b. CD22 ... 21 c. CD23 ... 22 d. CD40 ... 22 e. CD80 ... 22 f. CD52 ... 23 g. CD33 ... 23 1.4 Les différentes générations d’anticorps thérapeutiques : ... 24 1.4.1 Les anticorps murins : ... 24 1.4.2 Les anticorps recombinants chimériques et humanisés : ... 26 1.4.3 Les anticorps recombinants entièrement humains : ... 28
1.4.4 Les anticorps optimisés : ... 32 1.5 Toxicité ... 37 1.6 Mécanisme de résistance ... 38 2- Les inhibiteurs de tyrosine kinase (TKI) ... 39 2.1 Définition ... 39 2.2 Structure chimique des ITKs : ... 39 2.3 Les différents types de cibles : ... 41 2.3.1 Exemples de kinases impliquées dans des hémopathies ... 41 2.3.2 Quelques exemples de RTKs dérégulés dans les cancers ... 46 2.4 Pharmacologies des ITKs ... 55 2.4.1 Mécanisme d’action ... 55 2.4.2 Pharmacocinétique des ITKs ... 60 2.5 Toxicité des inhibiteurs de tyrosine kinase : ... 62 2.6 Principaux Mécanismes de résistances aux inhibiteurs de tyrosine kinase : ... 63 IV-B Classification selon le niveau d’action ... 65 1-TC ciblant la cellule tumorale au nivau membranaire ... 65 1.1 Famille HER (voir EGFR P:44) ... 65 1.2 Kit et PDGF-R (Exemple imatinib) (voir Kit et PDGF-R P:40) ... 66 1.3 ALK (voir ALK P:46) ... 67 1.4 VEGFR (voir VEGFR P:42) ... 67 1.5 IGF1-R ... 68 1.6 HGF et son récepteur MET ... 69 2. TC visant les voies de signalisation sous membranaires : ... 70 2.1 voie PI 3K / AKT /mTOR ... 70 2.2 Voie RAF/MEK/ERK ... 72 2.2.1 Les inhibiteurs de Ras ... 72 2.2.2 Les inhibiteurs de MEK ... 73 2.2.3 Les inhibiteurs de ERK ... 74 2.2.4 Les inhibiteurs de Raf ... 74 2.3 Inhibiteurs protéasomes ... 74 3. TC agissant au niveau nucléaires : ... 76
3.1 Les cyclines ... 76 3.2 kinases Aurora ... 77 4-TC agissant sur l’environnement tumoral : ... 78 4.1 Les antiangiogéniques ... 78 4.2 Les inhibiteurs des métalloprotéases ... 80 DEUXIEME PARTIES : PLACE DE LA THERAPIE CIBLEE EN HEMATOLOGIE I- La leucémie myéloïde chronique (LMC) : modèle d’oncogénése ... 83 A. Rappel sur la leucémie myéloïde chronique ... 83 B. Imatinib ciblant la translocation (9 , 22) ... 87 C-résultats des essais cliniques ... 89 II- Les lymphomes malins non hodgkiniens (LMNH) ... 90 A-rappel sur les lymphomes malins non hodgkiniens ... 90 B-TC Rituximab et autre ... 95 C-Résultats des études cliniques (R – CHOP : nouveau standard) [284] ... 96 III- Le myélome multiple ... 98 A-Rappel sur la pathologie ... 98 B-TC Ciblant le protéasome : Bortezomib ... 101 C- Résultats ... 102 IV- La polyglobulie primitive (ou maladie de Vaquez) ... 105 A-Rappel ... 105 B- TC Ciblant JAK2 : ... 109 PERSPECTIVES D’AVENIR ... 110 CONCLUSION ... 117 Bibliographie ... 121
1
I- Introduction :
La notion de thérapie ciblée est un concept qui a pris son essor au début des années 1990. En effet malgré une diminution importante du risque de rechute, les résultats des traitements classiques, chimiothérapie et hormonothérapie, ne sont pas entièrement satisfaisants. Il était donc nécessaire de développer de nouvelles stratégies thérapeutiques et d’identifier de nouvelles cibles potentielles. Les progrès de la recherche fondamentale ont permis d’établir que la cellule tumorale interagissait avec son environnement. La recherche académique et industrielle a développé des molécules dirigées contre ces cibles thérapeutiques. Les thérapeutiques ciblées, par un mécanisme non directement cytotoxique, visent à contrôler la maladie sur une longue période. Selon leur nature et leur mode d’action, ces molécules vont s’intégrer dans une stratégie thérapeutique globale où elles feront partie de schémas utilisant conjointement la chimiothérapie et/ou l’hormonothérapie et/ou la radiothérapie. De ce fait, le nombre de schémas thérapeutiques possibles devient élevé et le profil biologique de chaque tumeur oriente la décision thérapeutique vers un traitement de plus en plus personnalisé. Le nombre de gènes et de fonctions cellulaires qui jalonnent la transformation d’une cellule normale en cellule tumorale fait que le nombre de cibles thérapeutiques potentielles est extrêmement important. Cependant, il faut trouver des cibles suffisamment spécifiques de la cellule cancéreuse pour la rendre repérable sans ambigüité et suffisamment importantes dans le processus tumoral pour que leur blocage ait une activité thérapeutique. A ce titre, l’hormonothérapie a représenté la première thérapie ciblée même si celle-ci ne s’adressait pas encore à une cible unique mais à un ensemble d’organes cibles sensibles à une hormone donnée car pourvus des récepteurs correspondants.
Les anomalies des voies de signalisation cellulaire sont largement impliquées dans la cancérogenèse. Les progrès technologiques en biologie moléculaire ont permis d’identifier certains de ces dysfonctionnements, caractérisant les tissus cancéreux et de proposer des approches thérapeutiques ciblées agissant spécifiquement au niveau de ces anomalies moléculaires. Les approches thérapeutiques développées visent soit à bloquer la signalisation au niveau extracellulaire à l’aide d’anticorps monoclonaux dirigés contre le facteur de croissance ou contre la partie extracellulaire du récepteur membranaire, soit à bloquer la
2
signalisation intracellulaire à l’aide d’inhibiteurs de phosphorylation, agissant sur la partie intracellulaire du récepteur ou au niveau de protéines intracellulaires intermédiaires impliquées dans la cascade de signalisation.
Les progrès récents dans la compréhension des mécanismes et l'identification des signatures immunophénotypiques spécifiques aux hémopathies malignes moléculaires, ont conduit à la découverte de nombreuses nouvelles stratégies thérapeutiques, dont certains remplissent tous les critères énumérés ci-dessus pour la thérapie ciblée.
L’objectif de notre travail est de distinguer les différentes classes de la thérapie ciblée, détailler ses principaux mécanismes et de déterminer leur place dans les hémopathies malignes.
3
PREMIERE PARTIE : GENERALITES CONCERNANT LA
THERAPIE CIBLEE
I- Définition
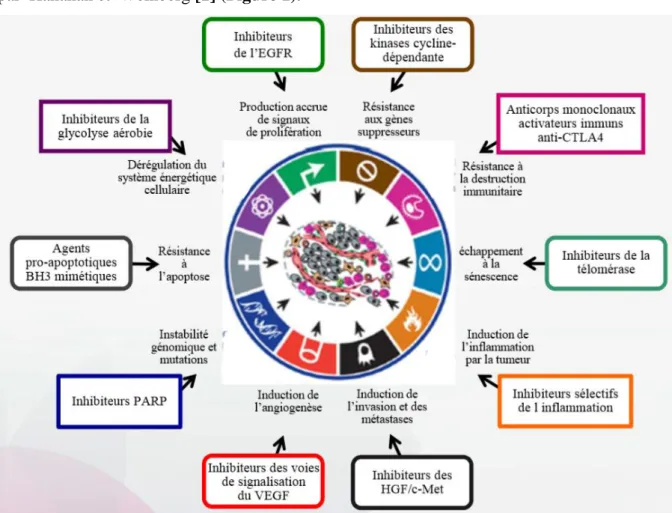
Toute thérapie anticancéreuse est en pratique une thérapie ciblée sur quelque chose. La radiothérapie cible l’acide désoxyribonucléique (ADN), l’adriamycine la topo-isomérase II, le tamoxifène les récepteurs hormonaux tandis que le bistouri du chirurgien cible la tumeur. Les thérapies moléculaires ciblées représentent une nouvelle classe d’agents anticancéreux caractérisés non pas uniquement par une notion de ciblage mais surtout par le fait que leur développement ait été spécifiquement défini par une activité sur un processus impliqué dans l’oncogenèse, ciblant alors les mécanismes fondamentaux décrits par Hanahan et Weinberg [1] (Figure 1).
Figure 1 : Les mécanismes fondamentaux de l’oncogenèse et leur ciblage potentiel par une thérapie
4
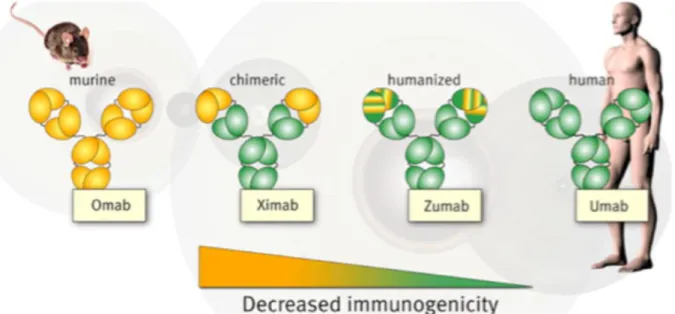
Le terme de «thérapie ciblée» est utilisé pour désigner certaines des nouvelles molécules, disponibles entre autres dans l’arsenal thérapeutique oncologique, qui interfèrent de façon relativement ciblée avec la biologie cellulaire. Ces molécules, développées grâce à notre connaissance toujours plus fine de la signalétique cellulaire des tumeurs, se sont ajoutées et intégrées aux chimiothérapies conventionnelles. Parmi elles, on trouve des substances qui agissent à l’extérieur de la cellule cancéreuse (des anticorps monoclonaux reconnaissables à leur suffixe «–mab») et d’autres qui agissent au sein même de la cellule (les petites molécules en «–inib») Leur mécanisme d’action, de même que leur mode d’administration simplifié et leur profil d’effets secondaires en fait des thérapies rapidement adoptées.
II- Historique
A la fin des années 80, les progrès en biologie moléculaire et en génétique ont permis d’obtenir de nouvelles données sur les mécanismes de l’oncogenèse. Ces progrès ont montré que la prolifération des cellules cancéreuses, l’apoptose, l’angiogenèse, l’invasion et la formation des métastases sont des processus régulés par un réseau complexe de signaux cellulaires impliquant un grand nombre de protéines. La recherche a pu mettre en évidence que de nombreux oncogènes codent pour des protéines kinases. Au début des années 90 commence alors l’ère de la thérapie ciblée avec l’explosion du nombre de cibles thérapeutiques découvertes. En 2001, les études de Brian Druker aboutissent à la mise sur le marché du Glivec® (imatinib mésylate) pour le traitement de la leucémie myéloïde chronique (Figure 2).
Figure 2 : Structure du Glivec® (Imatinib mésylate)
C’est le premier médicament dirigé contre une protéine kinase spécifique des cellules tumorales. Il marque le début de la thérapie ciblée dans les traitements antinéoplasiques. En
5
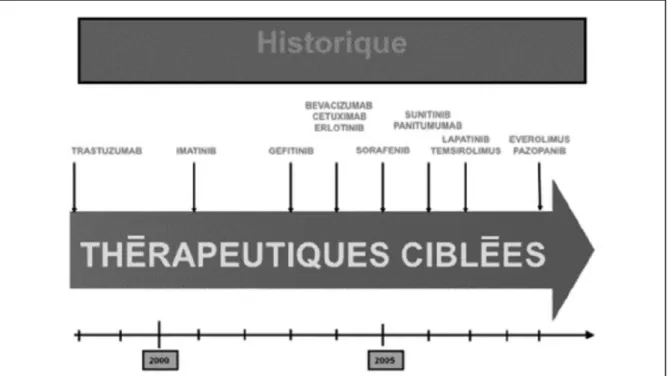
2004, la FDA approuve le premier anticorps monoclonal Avastin® (bevacizumab) utilisé en thérapie ciblée pour le traitement du cancer du côlon. D’autres médicaments de type anticorps monoclonaux ou petites molécules inhibitrices de protéines kinases, sont utilisés actuellement en clinique avec succès. Pour éclaircir ce réseau complexe d’interactions cellulaires, la suite de ce chapitre décrit les principales cibles thérapeutiques anticancéreuses actuellement en cours d’investigation ou validées par le développement d’un médicament. (Figure 3).
Figure 3 ; Schéma historique des enregistrements des traitements ciblés.
III- Rappel physiologique
Le développement des thérapies moléculaires ciblées s’est en pratique initialement focalisé, il y a quelques années maintenant, sur les mécanismes de l’oncogenèse impliquant les systèmes récepteurs membranaires/ligands tels que le récepteur C-KIT ou la famille HER (human epidermal growth factor receptor). Anticorps monoclonaux et inhibiteurs de tyrosine kinase dominaient alors les agents thérapeutiques en investigation. De multiples cibles potentielles ont en parallèle été mises en évidence, permettant aux thérapies moléculaires ciblées d’entrer dans les voies intra cellulaires (mammalian target of rapamycin [mTOR], régulation épigénétique, protéasome, etc.)[2] ou d’agir sur les
6
interactions entre cellules cancéreuses et tissu péritumoral, notamment au travers de la régulation de l’angiogenèse ou de l’immunité antitumorale.
La signalisation cellulaire ou transduction du signal désigne l'intégration d'un message d'origine extracellulaire par une cellule. Le message passe à travers la membrane plasmique, arrive dans le cytoplasme, puis passe dans le noyau pour générer la transcription de protéines. Les cellules émettent des médiateurs ou ligands (hormones, facteurs de croissance, cytokines, peptides…) qui sont détectés par d'autres cellules au niveau de récepteurs extra ou intracellulaires spécifiques, ce qui induit une réponse de la cellule réceptrice. La fixation du ligand sur son récepteur induit un changement de conformation de celui-ci, ce qui active une cascade de réactions biochimiques conduites par les enzymes à l’intérieur de la cellule (par exemple une série de phosphorylations pour les protéines kinases).
Les voies de signalisation régulent finement des processus cellulaires clés tels que la prolifération, la différenciation, la mobilité, la réponse au stress, l’apoptose, le métabolisme et l’inflammation. La Figure 4 représente les principales voies de signalisation impliquées dans la régulation de ces processus.
7
Figure 4 : Principales voies de signalisation intracellulaire
Dans les cellules cancéreuses, certaines voies de signalisation sont altérées par la mutation ou la surexpression d’un oncogène, conduisant à leur dérégulation. En général, plusieurs voies de signalisation sont impliquées dans la carcinogenèse. [3,4] Selon les protéines altérées, le phénotype de la cellule cancéreuse sera différent. Parmi les cibles les plus attractives de la thérapie ciblée anticancéreuse participant à la signalisation intracellulaire, on distingue : les récepteurs tyrosine kinases (RTKs), la voie MAP kinase Raf/MEK/ERK et la voie PI3K/Akt/mTor.
8
1. Les récepteurs à activité tyrosine kinase :
Les récepteurs à activité tyrosine kinase (RTKs) font partie de la famille des récepteurs à activité enzymatique qui associe une fonction de liaison et une fonction enzymatique effectrice. A l'heure actuelle, il existe environ 58 récepteurs à activité tyrosine kinase. Selon leur organisation structurale, ces récepteurs se regroupent en plusieurs familles. Vingt familles de RTKs ont été décrites (figure 5) [5]. Ces récepteurs ont une structure et des mécanismes d'activation assez similaires.
Figure 5 : Récepteurs à activité tyrosine kinase [5]
Ce sont tous des récepteurs transmembranaires monomériques exception faite pour le récepteur de l'insuline. On retrouve du côté extracellulaire, le domaine d'affinité pour le ligand. Lorsque le ligand se fixe sur son récepteur, celui-ci s'autodimérise. Du côté intracellulaire, ceci provoque l'autophosphorylation croisée du récepteur (ou transphosphorylation). Sous forme homodimérique, le RTK se phosphoryle de part et d'autre sur ses deux sous-unités, par modifications conformationnelles successives et ce, exclusivement sur ses résidus tyrosine issus de domaines qui en sont riches (figure 6). Pour chaque résidu tyrosine phosphorylé, il y a une molécule d'ATP consommée. Cette phosphorylation permet d'une part d'accroître l'activité
9
enzymatique du récepteur sur son site catalytique (qui n'a pas de relation directe avec la transduction du signal) et d'autre part, de libérer des sites à haute affinité pour des protéines de signalisation : des enzymes ou bien des protéines adaptatrices. Le signal de transduction prolifère par l'interaction du site d'affinité du récepteur et des protéines de signalisation : des enzymes ou bien des protéines adaptatrices. Le signal de transduction prolifère par l'interaction du site d'affinité du récepteur et des protéines qui s'y associent.
Le récepteur prototype de chaque famille est indiqué au dessus du récepteur et les membres de la même famille sont listés en dessous. Les RTKs impliqués dans les cancers apparaissent en italique.
Figure 6 : Activation des RTKs [5]
Les récepteurs à activité tyrosine kinase sont fréquemment surexprimés ou dérégulés dans les cancers. Les mécanismes correspondent en général à des mutations ponctuelles, des délétions au niveau du gène codant pour le récepteur, à une amplification génique ou à des réarrangements chromosomiques. Ces altérations sont le plus souvent activatrices et aboutissent à une activité kinase augmentée ou constitutive [5].
2. Voie RAF/MEK/ERK
La voie MAPKinase est une voie essentielle de régulation de croissance cellulaire, de transformation et d’apoptose. Un des principaux composants est la kinase Raf dont le rôle est
10
de transformer le signal provenant de Ras dans une cascade de kinases cytoplasmiques par phosphorylation et activation [6]. Une fois activée, Ras va concourir au recrutement des kinases RAF (A-RAF, B-RAF et RAF-1) vers la membrane cellulaire. À leur tour activées, les kinases RAF vont entraîner une cascade de phosphorylation impliquant les protéines MEK (MEK1 et MEK2) puis ERK (ERK1 et ERK2) qui portent une activité tyrosine-kinase et une activité sérine/ thréonine-kinase. L’activation de la voie RAF/MEK/ERK par la liaison aux récepteurs liés à HIF (VEGFR, EGFR et PDGFR) concourt à la stimulation de la prolifération cellulaire mais également à la diminution de l’apoptose en interagissant avec des protéines de la famille Bcl-2 ou ASK-1 [6].
3. Voie PI3K/AKT/mTOR
La protéine mTOR est une sérine/thréonine-kinase dont l’activation peut se faire dans plusieurs situations :
par activation de la voie PI3K/AKT en réponse :
- à l’activation des récepteurs membranaires à activité tyrosine-kinase (EGFR, HER2, IGF-1R) [6] ;
- à l’activation de Ras indépendamment de toute stimulation liée à des récepteurs prouvant des intercommunications entre les 2 voies (Ras/RAF/MEK/ERK et PI3K/AKT/ mTOR) [6] ; - à des mutations des gènes PI3KCA et PI3KR1 [6].par perte du PTEN qui un suppresseur de tumeur et qui régule négativement la voie PI3K/AKT [6].
AKT est une kinase stimulant mTOR. En plus de ces activités de régulation de mTOR, AKT a un rôle anti-apoptotique majeur. Elle est impliquée dans de nombreux cancers [6] et il a été montré, dans le cancer du sein, que son niveau d’activité peut être associé à une résistance au traitement hormonal et à un mauvais pronostic [6].
mTOR est particulièrement impliquée dans la coordination des facteurs de croissance et de nutrition mais également dans l’angiogenèse, les modulations métaboliques et l’apoptose
[6]. Sa découverte en 1995 [6] a fait suite aux travaux d’équipes qui cherchaient à élucider les
mécanismes d’action de la rapamycine comme immunosupresseur [6]. Le nom en a gardé la trace : mTOR pour mammalian Target of Rapamycin.
11
IV- Classification des thérapies ciblées
IV-A Les différentes classes de la thérapie ciblée et leur mode d’action : 1-Les anticorps monoclonaux :
1.1 Structure protéique des anticorps :
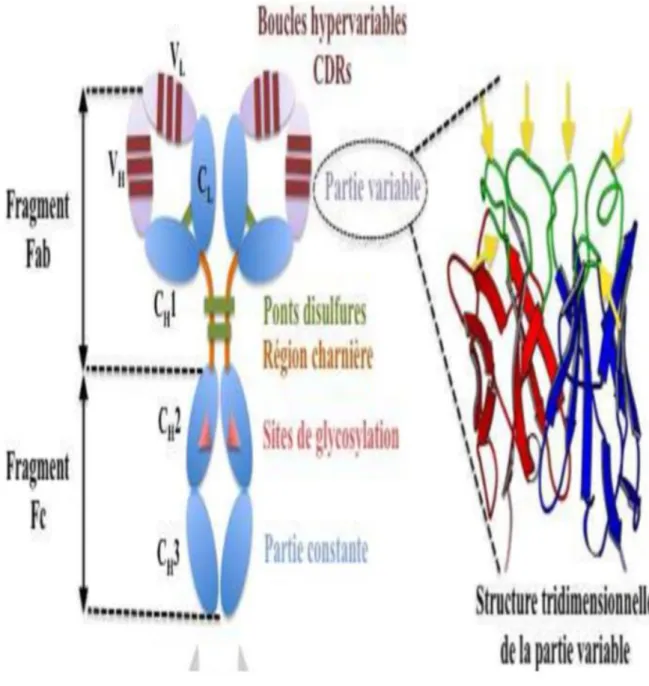
Les anticorps sont des glycoprotéines appartenant à la superfamille des immunoglobulines (Ig). Toutes les protéines de cette famille, contiennent au moins un motif structural dénommé « domaine immunoglobuline ». Ce domaine, de 70 à 130 acides aminés (a.a), possède une structure secondaire caractéristique, formée par deux feuillets béta antiparallèles superposés à la manière d’un sandwich (Figure 1, structure tridimensionnelle). Cette structure est stabilisée par des interactions entre des a.a hydrophobes ainsi que par des ponts disulfures formés par des résidus cystéines très conservés [7], Il existe différents types de domaines Ig : des domaines constants (IgC) et des domaines variables (IgV). Les anticorps sont formés par un ensemble de domaines IgC et IgV, eux-mêmes localisés au sein de quatre chaînes polypeptidiques : 2 chaînes lourdes (notées H pour Heavy) et 2 chaînes légères (notées L pour light) identiques entres elles, et reliées par des ponts disulfures. Chaque chaîne lourde comprend 3 ou 4 domaines constants (notés CHI,CH2,CH3 et CH4) et un domaine variable VH, pour une masse totale d’environ 50 kDa ; chaque chaîne légère comprend 1 domaine constant CL et 1 domaine variable VL
aboutissant à une masse de 25 kDa. Ainsi, un anticorps entier monomérique, composé de ses 4 chaînes, présente une masse d’environ 150 kDa. Cette organisation protéique particulière est à l’origine de la structure de base (monomérique) des anticorps en forme de « Y » (Figure 4) [8],
12
Figure 7 ; Structure schématique d’une immunoglobuline G. La structure tridimensionnelle de la partie
variable provient du site suivant : http://xray.bmc.uu.se/lars/Practicals/Immun/antibody.html ; les six CDRs représentés en vert sont localisés par des flèches jaunes ; rouge = VL ; bleu = VH La partie inférieure du schéma présente les fragments obtenus à la suite de digestions enzymatiques à la pepsine ou à la papaïne.
13
1.2 Pharmacologie des anticorps monoclonaux : 1.2.1 Mécanismes d’action des anticorps
Pour qu’un anticorps monoclonal soit efficace, il faut que certaines conditions soient réunies :
•
Ainsi, l’antigène doit être présent sur la totalité des cellules tumorales avec une densité antigénique élevée.•
Il est aussi nécessaire qu’il joue un rôle important dans la survie et les fonctions des cellules tumorales.•
et qu’il y ait absence de libération de cet anticorps dans le milieu extracellulaire.•
Enfin, il ne faut pas ou que peu de modulation antigénique (disparition de l’expression de l’antigène par la cellule tumorale après exposition à l’anticorps monoclonal spécifique).Les pathologies malignes, notamment hématologiques, sont pour toutes ces raisons des cibles de choix à l’utilisation thérapeutique des anticorps monoclonaux.
L’anticorps monoclonal ainsi défini possède trois domaines fonctionnels : deux sites spécifiques de fixation antigénique dits Fab (antigen binding) et un site effecteur appelé fragment Fc (cristallisable) (figure 12).
14
Globalement, les anticorps monoclonaux peuvent fonctionner selon trois principaux modes d’action :
• en bloquant l’action de molécules ou de récepteurs spécifiques,
• en ciblant des cellules spécifiques
• ou en fonctionnant comme des molécules de signalisation.
1.2.1.1 Blocage : [10]
Les anticorps monoclonaux sont utilisés pour bloquer de façon spécifique, la fonction de facteurs de croissance, cytokines ou autres médiateurs solubles. Ce blocage se fait par liaison directe au facteur lui-même ou à son récepteur. Exemple : les anticorps monoclonaux peuvent empêcher l’interaction et l’activation des cellules immunes par blocage de la liaison ligand récepteur, mécanisme qui permet d’expliquer l’activité thérapeutique de certains anticorps monoclonaux dans les maladies auto-immunes et inflammatoires. La liaison d’un anticorps peut aussi suffire pour neutraliser certaines toxines et certains virus.
1.2.1.2 Ciblage : [9,10]
En oncologie, les anticorps monoclonaux sont utilisés pour cibler les cellules tumorales. Deux mécanismes existent :
a. La cytotoxicité dépendante du complément ou CDC :
La partie constante Fc des anticorps peut aussi activer les protéines du complément C1q, il en résulte la formation d’un complexe lytique responsable de la lyse cellulaire. La régulation de ce phénomène est liée aux protéines inhibitrices du complément en particulier CD35 ou CR1 (complement receptor type 1), CD55 ou DAF (decay accelerating factor).
15
Figure 13 : Mécanismes d'action des anticorps monoclonaux dans l'immunothérapie antitumorale : la
CDC. [10]
b. La cytotoxicité cellulaire dépendante des anticorps ou ADCC :
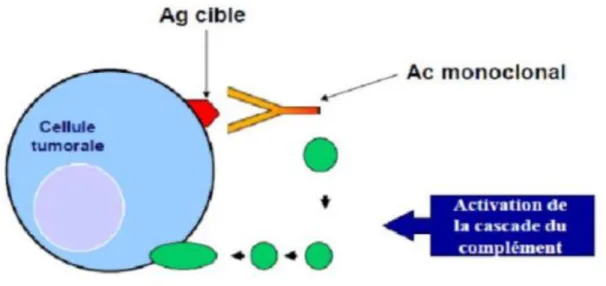
Cette cytotoxicité s’effectue par différentes cellules (monocytes, macrophages, cellules NK) capables de fixer la partie Fc de l’anticorps monoclonal. La fixation du Fc sur son récepteur induit l’activation des cellules effectrices qui sécrètent dans la cellule cible diverses molécules cytotoxiques : perforines, granzymes, provoquant sa lyse
Figure 14 : Mécanismes d'action des anticorps monoclonaux dans l’immunothérapie antitumorale :
16
Ainsi, l’anticorps représente le lien entre la cellule tumorale et le système immun en activant les cellules NK, les macrophages et monocytes. Il peut aussi induire directement l’apoptose
[11]. (Figure 15). On peut également l’utiliser en association avec d’autres molécules (toxines,
chimiothérapie) ; on parle alors d’anticorps monoclonaux conjugués ou combinés. L’intérêt est double :
• cibler directement l’effet recherché sur les cellules tumorales (limitation des effets secondaires)
• et majorer la toxicité à ce niveau.
Figure 15 : Mécanisme de cytotoxicité induit par les anticorps anti-CD20 [11]
1.2.1.3 Signalisation : [11]
La réponse effectrice cytotoxique ne peut pas, à elle seule, expliquer les résultats obtenus avec les anticorps monoclonaux en cancérologie, et implique l’existence d’autres mécanisme. La liaison de récepteurs membranaires par les anticorps monoclonaux de signalisation génère des signaux transmembranaires permettant de contrôler la croissance et l’apoptose des cellules tumorales. Alternativement, certains anticorps en se liant au récepteur, miment
17
efficacement le ligand naturel et inhibent les fonctions de transmission de signal associées. L’utilisation d’anticorps de signalisation peut également induire la dérégulation de l’expression ciblée, mécanisme associé à la modification de signalisation intracellulaire.
1.2.2 Propriétés pharmacocinétiques des anticorps monoclonaux :
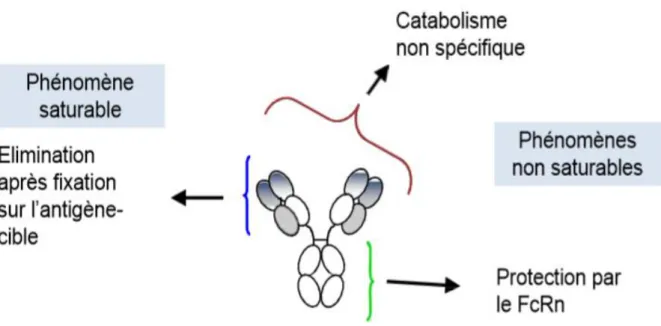
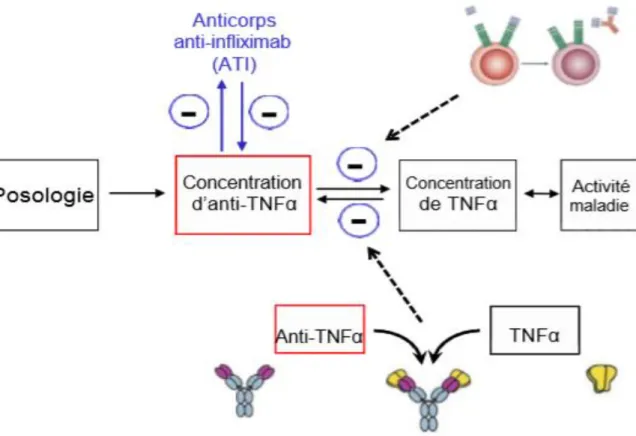
Après administration sous-cutanée, intra-musculaire ou intraveineuse, l’absorption des AcMo est très lente, avec un temps de pic autour d’une semaine. Les mécanismes d’élimination des AcMo sont très différents des médicaments « classiques ». D’une part, ils subissent un catabolisme non spécifique, les IgG étant dégradées comme les autres protéines circulantes par les cellules endothéliales vasculaires, ce phénomène n’étant pas saturable. D’autre part, les AcMo sont éliminés après fixation sur leur cible, par internalisation lorsque la cible est un récepteur membranaire ou par formation de complexes immuns lorsque la cible est circulante.
[12] La quantité de cible étant, par définition, limitée, ce mode d’élimination des AcMo est
saturable. Le troisième mécanisme intervenant dans l’élimination des AcMo est leur protection contre la dégradation grâce à un récepteur particulier, le récepteur Fc néonatal ou FcRn.[12] Cette protection explique leur longue demi-vie d’environ 3 semaines (figure 16). Lorsque les protéines circulantes sont captées de façon passive par les cellules endothéliales vasculaires, les
18
Figure 16 : Les AcMo sont éliminés par catabolisme non spécifique et en partie protégés par le
récepteur Fc néonatal ou FcRn. Ces deux phénoèmes ne sont pas saturables. Ils sont également éliminés après fixation sur l’antigène-cible. Ce dernier étant, par définition, en quantité limitée, ce mode d’élimination des AcMo est saturable.
endosomes s’acidifient progressivement et les protéines sont dégradées dans des lysosomes. Le FcRn, présent dans les vésicules d’endocytose, fixe les anticorps au niveau de leur portion Fc et les détourne de cette voie de dégradation pour les rediriger vers la membrane apicale de la cellule. Aux concentrations thérapeutiques des AcMo, ce phénomène n’est pas saturable. En terme de modélisation pharmacocinétique, l’élimination des AcMo est donc habituellement non linéaire et doit être décrite à la fois par des phénomènes non saturables et par des phénomènes saturables. Le FcRn, qui est présent dans de nombreux tissus, est également responsable de la transcytose des anticorps et donc de leur distribution tissulaire. Les anticorps ne sont donc pas confinés dans la circulation systémique. Le FcRn est responsable notamment du passage trans- placentaire des anticorps maternels (anticorps naturels ou AcMo) en fin de grossesse, de l’expulsion des anticorps du système nerveux central (ce qui explique le faible passage des AcMo injectés par voie intra-veineuse). [12]
![Figure 5 : Récepteurs à activité tyrosine kinase [5]](https://thumb-eu.123doks.com/thumbv2/123doknet/14393393.701524/46.892.113.777.343.726/figure-récepteurs-activité-tyrosine-kinase.webp)
![Figure 12 : Structure de base d’un anticorps. [9]](https://thumb-eu.123doks.com/thumbv2/123doknet/14393393.701524/51.892.109.784.672.984/figure-structure-base-anticorps.webp)
![Figure 15 : Mécanisme de cytotoxicité induit par les anticorps anti-CD20 [11]](https://thumb-eu.123doks.com/thumbv2/123doknet/14393393.701524/54.892.92.811.364.782/figure-mécanisme-cytotoxicité-induit-anticorps-anti-cd.webp)