ROYAUME DU MAROC
UNIVERSITE MOHAMED V
FACULTE DE MEDECINE ET DE PHARMACIE RABAT
Mémoire de Fin de Spécialité
-Pharmacie Industrielle-
Réalisé par : Dr. Zineb ALIAT
Encadré par : Pr. Mustapha BOUATIA
Pour l’obtention du Diplôme de Spécialité
Année 2020
Screening phytochimique et évaluation de l’activité
antioxydante et antilithiasique de Juncus acutus
2
Je tiens à exprimer toute ma reconnaissance à mon
encadrant de mémoire Pr Mustapha BOUATIA. Je
le remercie de m’avoir encadrée, orientée, aidée et
conseillée.
J’adresse mes sincères remerciements à tous les
professeurs, intervenants et toutes les personnes du
laboratoire de chimie analytique pour avoir mis à
ma disposition l’aide et le matériel nécessaires pour
la réalisation de ce travail.
A tous ces intervenants, je présente mes
remerciements, mon respect et ma gratitude
3
Table des matières
RESUME: ... 7
INTRODUCTION : ... 8
MATERIEL ET METHODES : ... 9
Matériel végétal : ... 9
Préparation des extraits : ... 9
Caractérisation phytochimique : ... 10
Détermination des polyphénols totaux : ... 10
Dosage des flavonoïdes totaux : ... 11
Activité antioxydante: ... 11 Activité antilithiasique :... 12 Analyses statistiques : ... 13 RESULTATS ET DISCUSSION : ... 13 Rendements d’extraction : ... 13 Caractérisation physicochimique : ... 13 Polyphénols totaux:... 14 Flavonoïdes totaux : ... 15 Ativité antioxydante: ... 16 Activité antilithiasique :... 19 Conclusion: ... 22 Références: ... 23
4
LISTE DES TABLEAUX
Tableau 1 : Screening de quelques groupes phytochimiques de 4 extraits de Juncus acutus
Tableau 2 : Teneur totale en polyphénols exprimée en milligrammes équivalent d'acide gallique par gramme de poudre de Juncus acutus
Tableau 3 : Teneur totale en flavonoïdes exprimée en milligrammes équivalents de Quercétine par gramme de poudre de Juncus acutus
5
LISTE DES FIGURES
Figure 1 : Pourcentage d’inhibition des radicaux libres des différents extraits de Juncus acutus en utilisant le test DPPH.
Figure 2 : Les valeurs de capacité de piégeage des radicaux DPPH (IC50) des différents extraits de Juncus acutus
Figure 3 : Pouvoir réducteur des extraits de Juncus acutus
Figure 4 : Test au phosphomolybdate de Juncus acutus
Figure 5 : Taux de dissolution des calculs de cystine dans l'extrait de Juncus acutus et la solution témoin
Figure 6 : Taux de dissolution des calculs d'acide urique dans l'extrait de Juncus acutus et la solution témoin
Figure 7 : Taux de dissolution des calculs de carbapatite dans l'extrait de Juncus acutus et la solution témoin
6
LISTE DES ABREVIATIONS
AA : Acide Ascorbique
ABTS : Sel d'ammonium d'acide 2,2'-azinobis-3-éthylbenzothiazoline-6-sulfonique AE : Acétate d’ethyle
BHA : Butylhydroxyanisole BHT : Butylhydroxytoluène DPPH : Diphényl-picrylhydrazyl
FRAP : Ferric Ion Reducing Antioxidant Parameter
FTIR : Spectrophotométrie Infrarouge à Transformée de Fourier MET : Méthanol
ORAC : Oxygen Radical Absorbance Capacity
TRAP : Total Radical Trapping Antioxidant Parameter UV-V : Ultraviolet-Visible
7
RESUME:
L'objectif de ce travail était de réaliser un screening phytochimique des graines de Juncus
acutus et d'évaluer son activité antioxydante et son activité antilithiasique. Le screening
phytochimique a démontré la présence de catéchine, de tanins et d'alcaloïdes dans les différents extraits étudiés. L'activité antioxydante des extraits méthanoliques et d'acétate d'éthyle par ultrasons et macération a été évaluée par la méthode du DPPH, du FRAP et du phosphomolybdate. L'extrait d'acétate d'éthyle par ultrasons, l'extrait méthanolique par macération et ultrasons ont respectivement montré une IC50 avec DPPH de 1,449 mg / ml, 1,535 mg / ml et 4,771 mg / ml et un pouvoir réducteur a été observé à des concentrations de 419,561 mg BHA / 100 g, 207,143 mgBHA / 100g et 142,20mgBHA / 100g par la méthode de FRAP et à des concentrations de 839,470mg AAE/100g, 283,260mgAAE / 100g et 141,018mgAAE / 100g par le test au phosphomolybdate. La détermination des polyphénols totaux de l'extrait d'acétate d'éthyle par ultrasons, de l'extrait méthanolique par macération et par ultrasons a présenté respectivement des teneurs de 2,428 mg GAE/g, 1,960 mg GAE/g et 1,172 mg GAE/g, de même, le dosage des flavonoïdes a montré respectivement des concentrations de 14,469 mg EQ/g, 6,466 mg EQ/g et 3,143 mg EQ/g. L'activité antilithiasique a été évaluée sur des calculs de Carbapatite, de Cystine et des calculs d'acide urique. La perte de masse d'acide urique, de carbapatite et de cystine était respectivement de 42%, 7% et 16%. 143 mg EQ / g.
Mots clés: Juncus acutus - Activité antioxydante - Activité antilithiasique – flavonoïdes -
8
INTRODUCTION :
Les plantes médicinales sont le principal remède pour la fabrication de remèdes pharmaceutiques. En effet, les substances naturelles provenant des plantes ont de multiples intérêts mis à profit dans le système de soins traditionnel et dans différentes industries. Parmi ces composés, on retrouve dans une large mesure les métabolites secondaires qui sont particulièrement illustrés en thérapeutique [Hebi et Eddouks, 2016]. Dans notre étude, nous nous concentrerons sur les activités antioxydante et antilithiasique de Juncus acutus.
Les antioxydants les plus populaires sont l'acide ascorbique (vitamine C),-carotène (Provitamine A), tocophérol (Vitamine E) et les composés phénoliques. En effet, la plupart des antioxydants synthétiques ou naturels ont des groupes hydroxyphénoliques dans leurs structures et les propriétés antioxydantes sont attribuées en partie à la capacité de ces composés naturels à piéger les radicaux libres tels que les radicaux hydroxyles et les superoxydes [Rice-Evanset al.,1995; Bartosz, 2003; Popovici et al., 2010].
Plusieurs méthodes sont utilisées pour évaluer, in vitro et in vivo, l'activité antioxydante en piégeant différents radicaux, tels que les peroxydes par la méthode ORAC (Oxygen Radical Absorbance Capacity ou capacité d'absorption des radicaux libres), par le TRAP (Total Radical Trapping Antioxidant Parameter) [Ricardo da Silva et al., 1991]; par la méthode au FRAP (Ferric Ion Reducing Antioxidant Parameter) [Benzie et souche, 1996]; ou par les radicaux ABTS (sel d'ammonium d'acide 2,2'-azinobis-3-éthylbenzothiazoline-6-sulfonique) [Re et al., 1999], ainsi que la méthode utilisant le radical libre DPPH (Diphényl-picrylhydrazyl) [Popovici et al., 2010; Sharma Om et Bhat, 2009].
Dans notre étude, trois méthodes seront utilisées pour évaluer cette activité: FRAP, DPPH et test au phosphomolybdate.
9 Au Maroc tel que rapporté par Bouatia et al. (2015), le type de calculs prépondérant était l'oxalate de calcium monohydraté (56,4%), suivi par l'acide urique (18,1%), de la carbapatite (7,9%) et de la cystine (0,6%).
Dans cette étude, nous avons choisi d'étudier l'effet des extraits de Juncus acutus sur la les calculs rénaux de la carbapatite, l'acide urique et la cystine.
Cette étude s'est fixée comme principaux objectifs :
• Réalisation d'un screening phytochimique pour rechercher certains groupes phytochimiques. • Détermination des polyphénols totaux et des flavonoïdes totaux contenus dans les graines de
Juncus acutus.
• Etude de l'activité antioxydante des extraits méthanoliques et de l'acétate d'éthyle de Juncus
acutus.
• Etude de l'activité antilithiasique des extraits méthanoliques et de l'acétate d'éthyle de Juncus
acutus.
MATERIEL
ET METHODES :
Matériel végétal :
L'échantillon prélevé provient de la région sud du Maroc. Au laboratoire, nous avons broyé les graines de Juncus acutus avec un broyeur jusqu'à obtention d'une poudre fine.
Préparation des extraits :
Nous avons utilisé deux types d’extraction : la macération sous agitation pendant 24 heures et l'extraction aux ultrasons pendant 60 minutes.
Extraction par macération:
40 g de poudre des graines de Juncus acutus sont extraits dans 100 ml d'acétate d'éthyle par macération sous agitation pendant 24 heures à température ambiante. Après filtration et séchage
10 de la même poudre, une deuxième extraction dans 100 ml de méthanol a été réalisée dans les mêmes conditions précédemment décrites.
Extraction par ultrasons:
40 g de poudre des graines de Juncus acutus sont extraits dans 100 ml d'acétate d'éthyle sous ultrasons pendant 60 minutes à 39 ° C. Après filtration et séchage de la même poudre, une deuxième extraction dans 100 ml de méthanol a été réalisée dans les mêmes conditions précédemment décrites.
Les 4 filtrats sont concentrés dans une étuve à 40 ° C afin de se débarrasser du solvant et de récupérer les extraits. Les 4 extraits ainsi récupérés, sont conservés dans des flacons stériles au réfrigérateur.
Caractérisation phytochimique :
Nous avons effectué, séparément, des réactions qualitatives sur nos différents extraits de Juncus
acutus pour le screening de certains groupes phytochimiques en utilisant les méthodes de
Harborne (1998),Trease et Evans (1989) ainsi rapporté par Buvaneswari et al. (2011) et Touré (2015).
Détermination des polyphénols totaux :
La teneur totale en composés phénoliques a été déterminée en utilisant la méthode de Folin Ciocalteu [Hashemi et al., 2016]. 1,25 ml du réactif Folin (dix fois dilué) a été ajouté à 250 µl d'extrait ou d'étalon (préparé dans le méthanol) avec des concentrations allant de 0,3 à 3 mg/ml. Après 4 min, 1 ml d'une solution de carbonate de sodium (7,5 g/100 ml) est ajouté au mélange précédent. L'ensemble est incubé dans l'obscurité à température ambiante pendant 30 min. L'absorbance a été mesurée à 765 nm. La concentration des polyphénols totaux est exprimée en milligrammes équivalent d'acide gallique par gramme d'extrait (mg GAE / g d'extrait).
11
Dosage des flavonoïdes totaux :
La méthode du trichlorure acétique [Tohma et al., 2016] est utilisé pour estimer les flavonoïdes totaux dans les extraits. 1,5 ml de la solution d'AlCl3 (2%) est ajouté à 1,5 ml de l'échantillon
ou de standard. Après 1 heure de réaction en absence de lumière, la densité optique est déterminée à 415 nm. La concentration en flavonoïdes a été exprimée en milligramme équivalent de quercétine par gramme d'extrait (mg EQ / g d'extrait).
Activité antioxydante:
Capacité de piégeage des radicaux libres: DPPH
Le DPPH, un radical libre de couleur violette, est réduit en composé jaune en présence de composés anti-radicaux libres [Hossain et al., 2015]. Dans les tubes à essai, 500 µl de chaque extrait ou standard de concentrations différentes (2,5; 5 ; 10 et 15 µg / ml) et 2 ml de solution de méthanol DPPH (50 µM) ont été introduits, après mélange au vortex, les tubes sont incubés dans l’obscurité à température ambiante pendant 30 minutes. La mesure a été effectuée à l'aide d'un spectrophotomètre UV-V à une longueur d'onde de 517 nm.
Des valeurs IC50 ont été calculées pour déterminer l'inhibition de 50% des radicaux DPPH. Le BHT a été utilisé comme standard.
Dosage du pouvoir antioxydant réducteur ferrique: FRAP
Le pouvoir réducteur de nos extraits a été déterminé en utilisant la méthode de Florentine Marie-Chantal [Foe et al., 2016]. Le volume de 250 μl de chaque extrait ou de standard de concentration (0,01 à 0,1 mg / ml) a été ajouté au mélange de 1,25 ml de tampon phosphate (0,2 M ; pH 6,6) et 1,25 ml de ferricyanure de potassium (1%). Après incubation pendant 20 minutes dans un bain-marie à 50 ° C, 1.25 ml d'acide trichlorure acétique (10%) a été ajouté au mélange puis centrifugé à 3000 tr / min pendant 10 minutes. Le surnageant (1,25 ml) a été ajouté à un mélange de 1,25 ml d'eau distillée et 250 μl de chlorure ferrique (0,1%). L'absorbance a été
12 mesurée au spectrophotomètre à 700 nm. Une absorbance accrue du mélange réactionnel suggère un pouvoir réducteur élevé. Les résultats ont été exprimés en milligrammes équivalent de butylhydroxyanisole (BHAE) pour 100 grammes d'extrait (mg de BHA / 100g d'extrait).
Phosphomolybdate
Le test est basé sur la réduction du Mo (VI) en Mo (V) par l'échantillon et la formation subséquente d'un complexe phosphate de Mo (V) vert à pH acide. Le volume de 0,3 ml de la solution d'extrait est ajouté à 3 ml du réactif (acide sulfurique 0.6 M, phosphate de sodium 28mM et molybdate d'ammonium 4 mM). Le tube est fermé et incubé dans un bain-marie à 95°C pendant 90 minutes. Après refroidissement à température ambiante, l'absorbance de la solution est mesurée à 695 nm contre un blanc avec un spectrophotomètre UV-Visible. L’acide ascorbique a été utilisé comme standard. Les résultats ont été exprimés en milligramme équivalent d'acide ascorbique pour 100 grammes d'extrait (mg AAE / 100g d'extrait).
Activité antilithiasique :
Douze calculs rénaux de carbapatite; cystine et acide urique pur du sud du Maroc ont été sélectionnés après analyse par spectrophotométrie infrarouge à transformée de Fourier (FTIR). Leur masse était de 330 ± 12 mg. Un extrait de plante a été préparé par infusion de 3g de plante sèche dans 100 ml de solution physiologique bouillante pendant 30 minutes. La solution de NaCl de 9 g/l était utilisée comme milieu témoin pour apprécier les modifications de masse des calculs. Après filtration, l'extrait a été partagé (60 ml) dans des flacons en verre Erlenmeyer. Les calculs ont été placés dans un sac poreux de fibres tressées et suspendus dans l'extrait. [Hannache et al., 2012]
La perte de masse des calculs rénaux a été évaluée en pesant le calcul après séchage à 40 ° C pendant 18 heures. Chaque test a été effectué 3 fois.
L'évaluation de l'activité de l'extrait a été déterminée en calculant le taux de dissolution des calculs après séjour dans le milieu expérimental en comparant le poids résiduel des calculs à
13 leur poids initial avant incubation avec notre extrait. Le pourcentage de dissolution a été déterminé par la formule:
a% = (Winitial - Wfinal) × 100 / Winitial
Avec: a% est le taux de dissolution du calcul et Winitial et Wfinal sont les poids de calcul avant et après incubation avec l’extrait de la plante.
Analyses statistiques :
Les résultats sont exprimés en moyenne écart-type (SD) et toutes les analyses ont été effectuées en triple. Les résultats ont été comparés par ANOVA unidirectionnelle avec le post-test de bonferoni. Une différence est significative si p0,05.
RESULTATS ET DISCUSSION :
Rendements d’extraction :
Le rendement était de 0,517% pour l’extraction par macération réalisée au premier stade avec de l'acétate d'éthyle sur la poudre de Juncus acutus, la deuxième extraction effectuée au méthanol a donné un rendement plus élevé qui est de 1,62%.
Pour l’extraction sous ultrasons, les rendements étaient de 2,9% pour l'extrait à l'acétate d'éthyle et de 1,16% pour l'extrait au méthanol.
L'extraction par le méthanol de la poudre de graines de Juncus acutus par ultrasons a montré un rendement plus élevé que celui obtenu par macération, et des rendements presque identiques pour l'extraction avec de l'acétate d'éthyle pour les deux méthodes.
Caractérisation physicochimique :
14
Tableau 1: Screening de quelques groupes phytochimiques de 4 extraits de Juncus acutus
Constituants
Macération Sous échographie
Extrait d'acétate d'éthyle Extrait de méthanol Extrait d'acétate d'éthyle Extrait de méthanol Stérols et polyterpènes + + - - Polyphénols - - - - Flavonoïdes - - - - Tanins catéchiques + + + + Tanins gaulois - - - - Alcaloïdes + + + + Saponosides - - - -
(+) indique la présence; (-) indique l'absence
Le screening phytochimique des graines de Juncus acutus a montré la présence des tanins catéchiques et d'alcaloïdes dans tous les extraits. Les stérols et les polyterpènes n'étaient présents que dans les extraits de macération. Une étude des extraits aqueux de Juncus subulatus
Forsak a révélé la présence d'alcaloïdes, de glycosides, de saponisides, de flavonoïdes et de
terpénoïdes [Fawzy et al., 2013].
Polyphénols totaux:
La spectrophotométrie UV / Visible a permis de quantifier le niveau des polyphénols présents dans les 3 extraits de Juncus acutus.
La courbe d'étalonnage établie à partir de différentes concentrations d'acide gallique a permis d'estimer la teneur phénolique de chacun des 3 extraits. La concentration des composés phénoliques a ensuite été calculée à partir de la courbe d'étalonnage et exprimée en mgGAE/g. La teneur totale en polyphénols dans les différents extraits de Juncus acutus est présentée dans le tableau 2.
15
Tableau 2: Teneur totale en polyphénols exprimée en milligrammes équivalent d'acide
gallique par gramme de poudre de Juncus acutus
Extrait de Juncus acutus Teneur totale en polyphénols (mg GAE/g) Extraction par macération
- Extrait de méthanol 1,960
Extraction par ultrasons - Extrait d'acétate d'éthyle - Extrait de méthanol
2,428 1,172
L'extrait d'acétate d'éthyle par ultrasons montre la teneur la plus élevée en composés phénoliques 2,428 mg GAE / g.
Flavonoïdes totaux :
La courbe d'étalonnage est tracée en utilisant différentes concentrations de Quercétine. La concentration de flavonoïdes dans les extraits de Juncus acutus est déterminée en se reportant à la courbe d'étalonnage.
La teneur en flavonoïdes est exprimée en milligrammes équivalent de Quercétine par gramme d’extrait (mg QE / g d'extrait).
La teneur en flavonoïdes totaux dans les différents extraits de Juncus acutus est donnée dans le tableau 3.
16
Tableau 3: Teneur totale en flavonoïdes exprimée en milligrammes équivalents de
Quercétine par gramme de poudre de Juncus acutus
Extrait de Juncus acutus Teneur totale en flavonoïdes (mgQE/g) Extraction par macération
- Extrait de méthanol 6,466
Extraction par ultrasons - Extrait d'acétate d'éthyle - Extrait de méthanol
14,694 3,143
L'extrait d'acétate d'éthyle par ultrasons présente la teneur en flavonoïdes la plus élevée avec une concentration de 14,694 mg QE / g.
Les teneurs totales en polyphénols et en flavonoïdes totaux de nos extraits étaient plus élevées que celles trouvées dans d'autres études sur Juncus acutus [Erdem et al., 2015] et Juncus effusus [Li et al., 2013].
Activité antioxydante : DPPH :
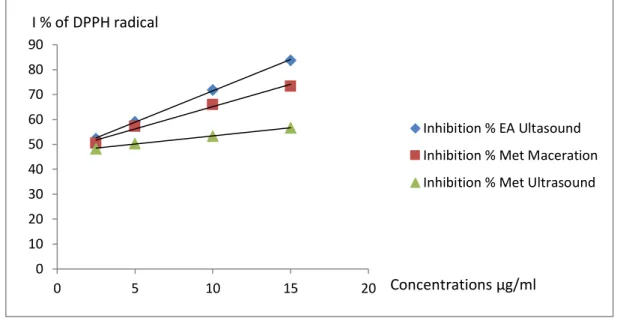
Les différentes concentrations de l'extrait d'acétate d'éthyle par ultrasons (2,5; 5; 10 et 15 μg/ml) ont montré des activités antioxydantes dose-dépendantes avec 52,30%; 59,14%; 71,83%; et 83,82% d'inhibition. Quant à l'extrait méthanolique, il a montré des taux de 50,46%; 57,35% ; 66,02% et 75,35% d'inhibition pour l'extraction par macération, et des taux de 48,30%; 50,45%; 53,36% et 56,65% pour l'extraction par ultrasons (figure 1).
17
Figure 1: Pourcentage d’inhibition des radicaux libres des différents extraits de Juncus acutus en utilisant le test DPPH.
La capacité antioxydante des différents extraits a été déterminée à partir de l'IC50, la concentration nécessaire pour réduire 50% du radical DPPH. Plus la valeur de IC50 est faible, plus l'activité de l'extrait testé est grande [Hebi et Eddouks, 2016].
Les valeurs IC50 pour les extraits de Juncus acutus sont présentées dans la figure 2.
Figure 2: Les valeurs de capacité de piégeage des radicaux DPPH (IC50) des différents extraits de Juncus acutus
0 10 20 30 40 50 60 70 80 90 0 5 10 15 20 Inhibition % EA Ultasound Inhibition % Met Maceration Inhibition % Met Ultrasound
I % of DPPH radical Concentrations µg/ml 0 1 2 3 4 5 6
EA Ultasound Met Maceration Met Ultrasound
IC50 (mg/ml)
Extract
1,459 1,535
18 L'activité antioxydante la plus importante a été notée pour l’extrait d'acétate d'éthyle par ultrasons de Juncus acutus avec une IC50 de 1,459 mg / ml.
FRAP (Reducing power assay) :
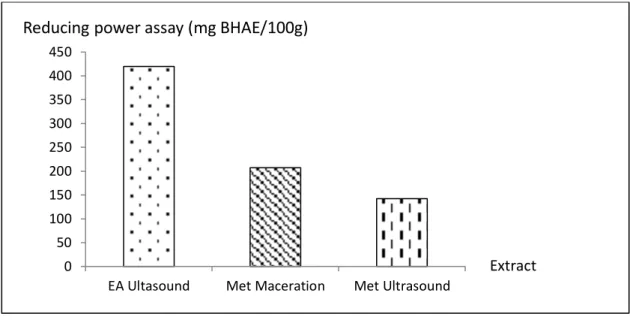
Le pouvoir réducteur ferrique peut servir d'indicateur significatif du potentiel antioxydant. Les capacités de réduction des extraits de Juncus acutus ont été déterminées par référence à la courbe d'étalonnage de l'anti-oxydant de référence BHA. Le pouvoir réducteur le plus important a été noté pour l’extrait d'acétate d'éthyle par ultrasons avec une concentration de 419,561 mg BHAE / 100 g. (Figure 3)
Figure 3: Pouvoir réducteur des extraits de Juncus acutus
Test au phosphomolybdate
Le test est basé sur la réduction de Mo (VI) en Mo (V) par l'échantillon et la formation subséquente d'un complexe phosphate de Mo (V) vert à pH acide. Les capacités de réduction des extraits de Juncus acutus ont été déterminées par référence à la courbe d'étalonnage de la vitamine C. Le pouvoir réducteur le plus important a été noté pour l’extrait d'acétate d'éthyle par ultrasons avec un taux de 839,470 mg AAE / 100 g (figure 4).
0 50 100 150 200 250 300 350 400 450
EA Ultasound Met Maceration Met Ultrasound
Reducing power assay (mg BHAE/100g)
19
Figure 4: Test au phosphomolybdate de Juncus acutus
Nos résultats ont montré une activité antioxydante plus importante que ceux trouvés dans d'autres études réalisées sur Juncus Bufonius [El Gawad et al., 2015] et Juncus acutus [Erdem
et al., 2015].Il est également noté que la teneur en polyphénols totaux et en flavonoïdes totaux
et l'activité antioxydante la plus importante ont été observées dans l'extrait d'acétate d'éthyle par ultrasons.
Activité antilithiasique :
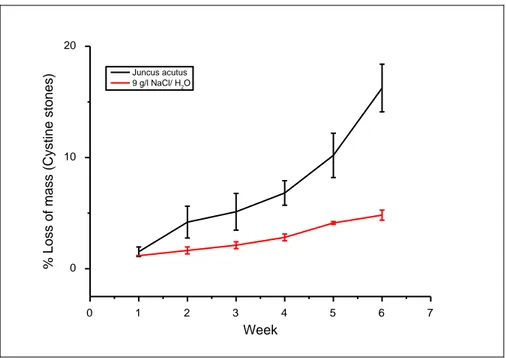
La perte de masse des calculs de cystine était de 60 mg ± 5 mg pour Juncus acutus et 20 mg ± 2 mg pour la solution témoin (16% contre 4% pour la solution témoin (figure 5)).
0 100 200 300 400 500 600 700 800 900
AE Ultrasons Met Macération Met Ultrasons
Phosphomolybdate test (mg AAE / 100g )
20 0 1 2 3 4 5 6 7 0 10 20 % Loss o f m ass ( Cystine ston es) Week Juncus acutus 9 g/l NaCl/ H2O
Figure 5: Taux de dissolution des calculs de cystine dans l'extrait de Juncus acutus et la solution témoin
Cette perte de masse était de 158 mg ± 35 mg pour Juncus acutus et de 61 mg ± 3 mg pour la solution témoin (42% contre 20% pour la solution témoin (figure 6)) pour les calculs d'acide urique. 0 1 2 3 4 5 6 7 -5 0 5 10 15 20 25 30 35 40 45 50 % Loss o f m ass ( Uric acid ston es) Week Juncus acutus 9g/l NaCl/H2O
Figure 6: Taux de dissolution des calculs d'acide urique dans l'extrait de Juncus acutus et la solution témoin
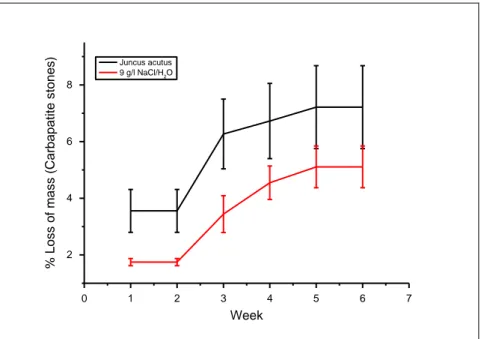
21 Et c'était 25 mg ± 4 mg pour Juncus acutus et 19 mg ± 2 mg pour la solution témoin (7% vs 5% pour la solution témoin (figure 7)) pour les calculs de carbapatite.
0 1 2 3 4 5 6 7 2 4 6 8 % Loss o f m ass ( Carb ap atite sto ne s) Week Juncus acutus 9 g/l NaCl/H2O
Figure 7: Taux de dissolution des calculs de carbapatite dans l'extrait de Juncus acutus et la solution témoin
La masse des trois calculs rénaux lors de l'incubation avec l'extrait de Juncus acutus et la solution témoin au cours des trois premières semaines a peu varié, le taux de dissolution est resté faible (p> 0,05) et a commencé à augmenter entre la quatrième et la sixième semaine (p=0,01).
Nos résultats n'ont pas montré de différence significative entre l'extrait et la solution témoin en ce qui concerne la perte de masse des calculs de cystine, carbapatite et acide urique sur la période expérimentale choisie. Cependant, la pente de la courbe de dissolution obtenue pour les calculs de cystine et d'acide urique a fortement augmenté au cours des dernières semaines par rapport aux courbes observées avec les calculs de carbapatite. Ce qui suggère que cette plante est probablement plus efficace pour dissoudre les calculs de cystine et d'acide urique, mais nécessite probablement plus de temps pour la dissolution des calculs.
22
Conclusion:
Ces travaux nous ont tout d'abord permis de réaliser un screening phytochimique, afin de rechercher certains groupes phytochimiques tels que les stérols et les polyterpènes, les polyphénols, les flavonoïdes, la catéchine et les tanins galliques, les alcaloïdes et les saponosides; dans des extraits de Juncus acutus.
Cela nous a également permis de quantifier les flavonoïdes totaux et les polyphénols totaux. L'application de la méthode Folain-Ciocalteu et de la méthode au trichlorure d'aluminium a montré que la teneur totale en polyphénols est comprise entre 1,172 et 2,428 mg EAG / g; et que la teneur totale en flavonoïdes est comprise entre 3,143 et 14,469 mgEQ / g.
Concernant l'activité antioxydante, nous avons réalisé 3 tests: le test DPPH, le FRAP et le test au phosphomolybdate. La teneur en polyphénols totaux la plus élevée ainsi que la teneur en flavonoïdes totaux et l'activité antioxydante la plus importante ont été observées dans l'extrait d'acétate d'éthyle par ultrasons. L'étude de l'activité antioxydante des extraits méthanoliques et de l'acétate d'éthyle de Juncus acutus, a montré qu'ils possèdent une activité antioxydante non négligeable.
L'étude de l'activité antilithiasique démontre que Juncus acutus est probablement plus efficace pour dissoudre les calculs de cystine et d'acide urique, mais nécessite probablement plus de temps pour la dissolution des calculs.
23
Références:
- Bartosz G. Génération d'espèces réactives de l'oxygène dans les systèmes biologiques. Commentaires sur la toxicologie 2003, 9, 5-21.
- Benzie IF, souche J. La capacité de réduction ferrique du plasma (FRAP) comme mesure du pouvoir antioxydant: le test FRAP. Analytical Biochemistry 1996, 239, 70-76.
- BOUATIA, M., BENRAMDANE, L., IDRISSI, M. Oulad Bouyahya, et al. Une étude
épidémiologique sur la composition des calculs urinaires au Maroc en fonction de l'âge et du sexe. African Journal of Urology, 2015, vol. 21, no 3, p. 194-197
- Buvaneswari K; Ramamoorthy D; Velanganni J, World J. Agric. Sci., 2011, 7 (6), 659-666.
- EL-GAWAD, AM Abd, MASHALY, Ibrahim A., et AL-NAFIE, Rasool I. Activité antioxydante et potentiel allélopathique de cinq plantes sauvages sur la germination et la croissance Bidens pilosa L. Int. J. Curr. Res, 2015, vol. 7, p. 21019-21024.
- ERDEM, F., CETINKAYA, N., NISBET, C., et al. Estimation de la digestibilité de la matière
organique, de l'énergie métabolisable, des composés phénoliques et de l'activité antioxydante des tiges et des graines de la plante Juncus acutus dans la nutrition des ruminants. Journal sud-africain des sciences animales, 2015, vol. 45, no 5, p. 502-509.
- FAWZY, Mustafa Ahmed, HIFNEY, Awatief Fahmey, AISS, Ahmed Abdel-Salam, et al. Constituants phytochimiques et effets allélopathiques de certaines plantes médicinales extraites sur la diversité des algues du sol. Journal of Agricultural Science and Technology. A, 2013, vol. 3, no 12A, p. 1000. - FOE, Florentine Marie-Chantal Ndoye, TCHINANG, Tatiana Flore Kemegni, NYEGUE, Ascencion
Maximilienne, et al.Composition chimique, propriétés antioxydantes et anti-inflammatoires in vitro des huiles essentielles de quatre plantes alimentaires et médicinales du Cameroun. BMC médecine complémentaire et alternative, 2016, vol. 16, no 1, p. 117.
- HANNACHE, B., BAZIN, D., BOUTEFNOUCHET, A., et al. Effet des extraits de plantes
médicinales sur la dissolution des calculs rénaux de cystine in vitro: étude à l'échelle mésoscopique. Progrès en urologie, 2012, vol. 22, no 10, p. 577-582.
- Harborne JB. Méthodes phytochimiques: guide des techniques modernes d'analyse des plantes, 3e édition, Chapman et Hall., Londres, 1998.
- HASHEMI, Seyed Mohammad Bagher, BREWER, Mary Susan, SAFARI, Javad, et al. Activité antioxydante, mécanismes de réaction et cinétique de l'extrait de Matricaria recutita dans l'oxydation d'huile mélangée commerciale. Journal international des propriétés alimentaires, 2016, vol. 19, no 2, p. 257-271.
- HEBI, M. et EDDOUKS, M. Évaluation de l'activité antioxydante de Stevia rebaudiana. Phytothérapie, 2016, vol. 14, no 1, p. 17-22.
24 - HOSSAIN, M. Amzad et SHAH, Muhammad Dawood. Une étude sur la teneur totale en phénols et
l'activité antioxydante des huiles essentielles et des différents extraits de solvants de plantes endémiques Merremia borneensis. Journal arabe de chimie, 2015, vol. 8, no 1, p. 66-71.
- LI, Sha, LI, Shu-Ke, GAN, Ren-You, et al. Capacités antioxydantes et contenu phénolique total des infusions de 223 plantes médicinales. Cultures et produits industriels, 2013, vol. 51, p. 289-298. - POPOVICI, Cristina, SAYKOVA, Ilonka et TYLKOWSKI, Bartosz. Évaluation de l'activité
antioxydante des composés phénoliques par la réactivité avec le radical libre DPPH. 2010. - Re R., Pellegrini N., Proteggente A., Pannala A., Yang M., Rice-Evans C. Activité antioxydante
appliquant un essai de décoloration amélioré des cations radicalaires ABTS. Free Radical Biology andMedicine 1999, 26, 1231-1237.
- Ricardo da Silva JM, Darmon N., Fernandez Y., Mitjavila S. Capacité de piégeur de radicaux libres d'oxygène dans des modèles aqueux de différentes procyanidines de pépins de raisin. Journal of Agricultural and Food Chemistry 1991, 39, 549-1552.
- Rice-Evans CA, Miller NJ, Bolwell PG, Bramley PM, Pridham JB Les activités antioxydantes relatives des flavonoïdes polyphénoliques d'origine végétale. Free Radical Research 1995, 22, 375-383.
- Sharma Om P., Bhat TK, DPPH antioxydant assay revisited. Chimie alimentaire 2009, 113 (4), 1202. - TOHMA, Hatice, KÖKSAL, Ekrem, KILIÇ, Ömer, et al. Analyse RP-HPLC / MS / MS des composés
phénoliques, des activités antioxydantes et antimicrobiennes des espèces de Salvia L. Antioxydants, 2016, vol. 5, no 4, p. 38.
- Touré HA Criblage phytochimique et activité antioxydante des extraits aqueux-éthanoliques d'Opuntia ficus indica, Journal of Chemical and Pharmaceutical Research, 2015, 7 (7): 409-415.
- Trease GE; Evans WC. Trease and Evans 'Pharmacognosy, 13th Edition, Balliere Tindall, Londres, 1989; 176-180.