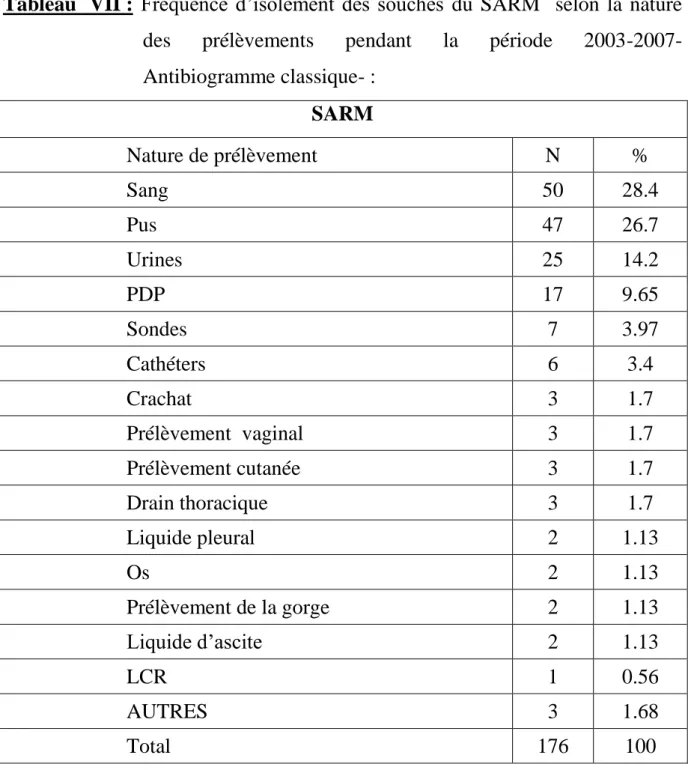
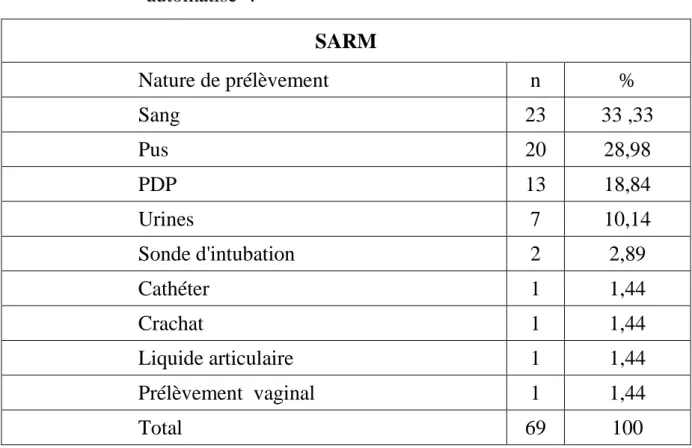
1
Introduction
Les infections nosocomiales (IN) ont toujours occupées une place importante dans les différents services hospitaliers en raison des taux élevés de mortalité, de morbidité et des coûts d’hospitalisations dont elles sont responsables. Elles sont favorisées par la présence des bactéries multi-résistantes parmi lesquelles Staphylococcus aureus résistante à la méticilline (SARM) est un des deux principales espèces responsables d’IN.
La présence de SARM chez les patients hospitalisés ne constitue plus un phénomène isolé, mais récurrent dans de nombreux établissements de soins, et la proportion d’isolats de SARM au sein de l’espèce de S.aureus, est variable à la fois d’un pays à l’autre, et même entre différents hôpitaux d’un même pays.
La fréquence croissante de sa résistance à la méticilline (+ d’autres marqueurs de résistance) pose des problèmes thérapeutiques actuels, et donc la surveillance locale de la résistance aux antibiotiques est nécessaire dans les hôpitaux pour détecter des variations dans la sensibilité des germes, et d’évaluer de ce fait la politique de prescription des anti-infectieux.
Pour cela, le but de cette étude est de déterminer la fréquence et la répartition des Staphylococcus aureus isolés de différents prélèvements biologiques et pathologiques provenant de divers services du Centre Hospitalier Ibn Sina de Rabat, ainsi que la fréquence de la résistance de ce germe aux différents antibiotiques .
2
PREMIERE PARTIE
Aspects bactériologiques des
staphylocoques, sensibilité aux
antibiotiques, aspects cliniques et
3
A. Aspects bactériologiques des Staphylocoques et sensibilité aux
antibiotiques :
1. Caractéristiques des staphylocoques (1.2.3.4.5.6) : 1.1. Classification:
Les premiers staphylocoques ont été décrits en 1880 par Pasteur dans un pus de furoncle et également dans l’os.
Le groupe des staphylocoques est crée en 1883 par Ogston pour décrire des grains groupés en amas comme une grappe de raisin (du grec Staphylê, grappe de raisin, et kokkos, grain).
En 1884, Rosenbach fait la différence entre les staphylocoques dorés et les staphylocoques blancs en raison de leur couleur.
Les staphylocoques appartiennent au genre Staphylococcus, ce dernier avec les trois genres Stomatococcus, Planococcus et Micrococcus, font partie de la famille des micrococcaceae.
Les staphylocoques sont classés en fonction de :
Leurs caractères phénotypiques qui sont leur aspects culturaux, la structure de leur paroi, leurs caractères métaboliques, leur sensibilités à divers antibiotiques.
Leurs caractères génotypiques comme le polymorphisme de restriction, leur ribotypage.
La nouvelle taxonomie considère que la production de la coagulase libre, active sur le plasma oxalaté de lapin comme critère de classification. En effet, on
4
distingue ceux qui sont coagulase positifs : les S .aureus et S .intermedius, mais également ces deux espèces sont caractérisées par la production d’un pigment jaune doré, et par la présence d’une protéine A de paroi chez prés de 90% de ces souches. Cependant, il existe des souches de S.aureus atypiques qui n’expriment pas la coagulase (5).
Tous ces caractères sont absents chez l’autre groupe de staphylocoques à coagulase négative qui sont facilement identifiés. Ce deuxième groupe comprend :
S .épidermidis, S .saprophyticus, S .cohnii, S.xylosus, S.haemolyticus, S.hominis, S .warneri.S.capitis, S.simulans, S.hyicus, S.sciuri, et S.lentus.
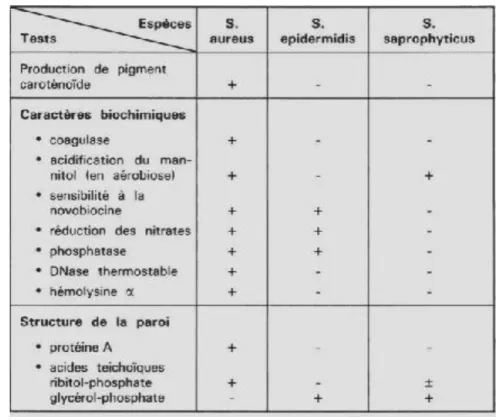
L’espèce de S.aureus est distinguée des autres espèces staphylococciques par ses caractères biochimiques et la structure de paroi.
1.2. Habitat :
Les staphylocoques sont des germes très résistants et ubiquitaires retrouvés au niveau de l’eau, de la terre, de l’air et de la surface des matériaux variés. Certaines espèces de Staphylocoques sont retrouvées chez l’homme, d’autres uniquement chez les animaux ou dans les aliments. Ce sont les principaux germes commensaux de la peau et des muqueuses, en particulier les espèces S .aureus et S.épidermidis.
Les prélèvements répétés révèlent trois catégories de sujets : ce qui ne sont jamais porteurs (20%), les porteurs transitoires (60%) et les porteurs persistants (30%).sur les mains, portage transitoire et persistant coexistent.
Le portage nasal naturel est évalué de 103 à 104 unités formant colonies (ufc) /cm2 (7).
5
Le portage au niveau des fosses nasales antérieures joue un rôle déterminant. Chez le patient, il est responsable de la colonisation des zones humides (aisselles), du pharynx et de la peau environnante, et de la dispersion sur les mains, à l’origine des infections croisées hospitalières et de l’auto-infection des plaies chirurgicales. Le portage nasal du personnel médical et paramédical est responsable de l’acquisition de S .aureus par le patient non colonisé .Tous trois sont des porteurs habituels de souches de S .aureus sensibles à la méticilline(8). Par contre, le portage de souches de S.aureus résistantes à la méticilline ne touche qu’un pourcentage très faible du personnel, situé autour de 0.4%, pouvant atteindre 8%(9).Les raisons de cette discordance sont inconnues.
Les 12% de porteurs périnéaux seraient les plus disperseurs et constituent donc un danger potentiel s’ils sont dans une unité à risques (salle d’opération par exemple).
Ce portage et cette dispersion des staphylocoques sont un facteur contributif à l’infection endémique à staphylocoques et aux poussées épidémiques dans certaines unités d’hospitalisation : service de brûlés, de chirurgie et de soins intensifs.
1.3. Transmission :
La transmission interhumaine s’opère généralement par contact direct (manuportage).Elle peut aussi être indirecte par les vêtements, la literie ou les aliments.
Les Staphylocoques apparaissent parfois sous la forme de graves épidémies surtout hospitalières.
6 1.4. Caractères bactériologiques :
1.4.1. Morphologie microscopique :
-Aspect au microscope après coloration de GRAM:
Ce sont des cocci à gram positif, sphériques, de 0 .5-1.5µm de diamètre, groupés en amas .L’aspect en amas est classique mais on peut voir beaucoup plus rarement des diplocoques ou de chaînettes. Immobiles, dépourvus de spores et habituellement ne possèdent pas de capsules. Il existe quelque rares souches muqueuses et entourées d’une pseudocapsule.
Voici la photographie ci-dessous :
(10)
1.4.2. Groupement :
Les staphylocoques se divisent en plusieurs plans, réalisant ainsi l’aspect caractéristique en grappe de raisin .Cependant ils peuvent également être isolés, par paires ou en très courte chaîne.
1.4.3. Aspect des colonies:
Les S.aureus forment en aérobiose des colonies lisses, arrondies, bombées, pigmentées (typiquement jaune d’or), qui tournent autour de 4mm de diamètre en 24 heures et opaques. Voici leur aspect sur gélose au sang (10) :
7 1.4.4. Culture :
Conditions de culture :
S .aureus est une bactérie aérobie facultative préférentielle, se développe bien sur les milieux minimum (milieux de pH bases), c’est une bactérie mésophile (37°C de croissance optimal), neutrophile (pH 7 optimal) et halophile (se développe à des fortes concentrations de NaCl).Elle est aussi relativement résistante aux inhibiteurs bactériens comme le cristal violet et le tellurite de potassium. S .aureus possède aussi de nombreuses résistances aux antibiotiques qui varient selon les souches.
Le milieu de culture peut être de type gélosé, bouillon, pomme de terre, ensemencement en piqûre d’un culot de gélatine et enfin dans les milieux synthétiques.
Parfois, la culture est plus difficile .C’est le cas de certains staphylocoques responsables d’endocardites et de suppurations chroniques (ostéomyélites) poussant en microcolonies, lentement (48 heures) et difficilement, obligeant à des milieux supplémentés en thiamine, hémine, ménadione.
Sur milieu gélosé, les colonies sont arrondies, bombées luisantes, jaunes dorés, opaques. Le métabolisme des glucides est particulièrement intéressant, la plupart
8
des sucres sont fermentés mais celui du mannitol fournit une réponse importante, en effet, ce polyalcool est fermenté seulement par les staphylocoques pathogènes (caractère de pathogènicicité).
Milieu d’isolement utilisé:
-Milieux non sélectifs :
Gélose nutritive, Gélose Trypticase Soja (milieu gélosé au sang), Gélose BCP (BromoCrésol Pourpre, on peut y ajouter du lactose), Gélose CLED (Bleu de BromoThymol).
-Milieu sélectif :
Gélose Chapman (NaCl 7.5%, mannitol, rouge de phénol) Gélose Baird Parker (identification facultative de S .aureus)
1.5. Caractères biochimiques :
S.aureus possède les caractéristiques du genre Staphylococcus soit :
-possède une catalase à la différence des streptocoques qui n’en possèdent pas.
-Absence d’une oxydase.
-Fermente le glucose sans gaz (entre autre galactose, lactose, glycérol et mannitol).
Mais S.aureus possède bien d’autres caractéristiques biochimiques propres à l’espèce, notamment :
Présence d’une coagulase libre ou staphylocoagulase (enzyme extracellulaires).
Récepteur au fibrinogène (RF).
Protéine de paroi chez prés de 90% de souches. Phosphatase.
9
Thermonucléase ou DNase thermostable.
Dégrade le mannitol sur la gélose de Chapman.
Enfin on recherche aussi l’utilisation de nombreux oses, osides et alcools pour l’identification de S.aureus en utilisant notamment des microgaleries type API staph®ou macrogaleries équivalentes.
1.6. Vitalité :
Les S .aureus sont détruits par une température entre 60°C et 80°C en 10 minutes, ils résistent 2h à 55°C, ils sont très sensibles aux antibiotiques en culture, résistent mieux en milieux albumineux.
La conservation des souches était obtenue par les anciens auteurs en culot de gélatine (1 an ou 2) ou mieux en macération de viande gélatinée en ampoules, scellées (17 ans) .Aujourd’hui, l’emploi de la dessiccation sous congélation ou lyophilisation fournit un bon moyen de conservation.
1.7. Structures antigéniques de S.aureus -bactériologie :
1.7.1. Deux antigènes fondamentaux caractéristiques de l’espèce Staphylococcus aureus ont été isolés :
-Un Polysaccharide A représentant le mucopeptide pariétal et des acides ribitol teichoiques : ceux-ci existent sous deux formes antigéniques distinctes, dépendant de lien alpha ou bêta du ribitol et de N-acétyl-glucosamine : les souches contiennent ces deux formes en proportion variable.
-Une Protéine A brute, dont la purification permet d’isoler une protéine A purifiée et une protéine B, la protéine A purifiée réagit non spécifiquement avec les immunoglobulines G en se fixant sur leur fraction Fc, elle précipite donc
10
avec tous les sérums humains normaux, elle sensibilise les hématies tannées de mouton à l’agglutination.
1.7.2. Il existe des antigènes dits « de surface », ou agglutinogènes de type :
En effet au moyen d’immun –sérums de lapin, il est possible de caractériser 13 serotypes différents de S.aureus, c’est dans les trois premiers (I, II, et III de Cowan) que l’on rencontre la majorité des souches pathogènes humaines.
1.7.3. Lysotypie :
De très nombreux bactériophages staphylococciques ont été isolés, la lysotypie présente un grand intérêt épidémiologique en permettant d’identifier toutes les souches responsables d’une épidémie qui présentent un « aspect lytique » spécifique.
1.8. Facteurs de virulence et pathogénicité :
Les différents éléments structuraux de la paroi de S .aureus ainsi que la production d’exoenzymes et d’exotoxines sont capables de déterminer chez l’hôte des effets pathogènes marqués par :
La remarquable et rapide dissémination des métastases
Le caractère destructif, profond et suppuré des foyers métastatiques ou de la porte d’entrée, limitant in vivo l’activité d’antibiotiques très actifs in vitro, La persistance parfois prolongée du staphylocoque, surtout en présence d’un matériel étranger, expliquant un taux de rechute voisin de 5% lorsque la guérison a été obtenue.
11 1.8.1. Les protéines de surface :
Le S .aureus possède un grand nombre de protéines exposées à la surface de la bactérie et qui ont la capacité de se fixer sur des molécules de l’hôte .Ce sont des adhésines dont un certain nombre appartiennent à la famille des MSCRAMM (Microbial Surface Component Recognizing Adhesive Matrix Molecule) qui reconnaissent les molécules de la matrice extracellulaire (collagène, elastine, proteoglycanes, fibronectines), les principales sont les suivantes :
-la protéine A, de poids moléculaire 42.000, cette haloprotéine est présente chez la plupart des souches de S.aureus, elle est liée au peptidoglycane et elle est capable de fixer le fragment Fc des immunoglobulines, elle se lie aussi au facteur de Von Willebrand, et elle joue le rôle d’une adhésine au début de l’infection intra-vasculaire.
-la protéine de liaison au collagène de type I, II, IV, qui joue un rôle dans les infections ostéoarticulaires.
-la protéine de liaison à la fibronectine, qui permet l’adhérence aux caillots plasmatiques et aux biomatériaux (cathéters, prothèses) ayant un contact prolongé avec le sang.
Elle favorise l’initialisation des infections sur corps étrangers.
Elle serait impliquée dans les phénomènes d’internalisation du staphylocoque dans les cellules endothéliales et favoriserait la localisation au niveau de l’endocarde.
-la protéine de liaison au fibrinogène ou clumping factor
(clfA.clfB), qui provoque l’agrégation des bactéries en présence de plasma.
Elle est un facteur de virulence dans les infections sur les plaies et sur corps étrangers.
12
Elle peut être synthétisée par d’autres espèces que S .aureus, telles que
S .épidermidis.
Il semblerait que le clfB soit facteur impliqué dans la colonisation nasale.
1.8.2. Résistance à la phagocytose :
Le glycolix, produit par S .aureus et constitué d’exopolysaccharides capsulaires, fabrique un biofilm qui permet une résistance au niveau du site infecté ou colonisé en engluant les bactéries. S .aureus peut induir l’apoptose des cellules épithéliales et des phagocytes, un à deux jours après avoir phagocyté des bactéries de l’espèce S.aureus, les cellules épithéliales contiennent des « Small colony variants »qui sont des colonies naines de staphylocoques. Ces dernières vont survivre et être responsables d’infection persistantes avec destruction tissulaires, comme dans l’endocardite aiguë (11,12).
1.8.3. Les Toxines :
1° Les hémolysines : (staphylotoxines)
Ces staphylotoxines sont de natures protéiques, thermostables, ces exotoxines ont des effets hémolytiques, nécrotiques, létales et variables selon les substances dites alpha, bêta, gamma, delta qui les constituent.les types alpha et bêta ont un rôle important en pathologie humaine.
2°La leucocidine de Panton et Valentine(LPV) est la plus importante des leucocidines, formée de deux constituants protéiques, elle est active sur les polynucléaires de l’homme et du lapin. Ces toxines se fixant sur leur cible et provoquent la formation de canaux membranaires laissant passer des cations divalents.
13
La LPV leucotoxique et dermonécrotique mais non hémolytique, elle est un facteur de virulence important dans des infections graves et dans les infections cutanées et dans des pneumopathies nécrosantes.
3°Toxines à tropisme cutané :
Ces toxines entraînent chez les sujets porteurs de staphylocoques qui l’élaborent des lésions cutanées bulleuses.
4°Les entéroxines :
Ces entéroxines sont responsables d’intoxication alimentaires et d’entérocolites, et ce sont des exotoxines protéiques dont ils existent les types (A, B, C, D).Elles ont une activité superantigénique qui stimule les lymphocytes T et induit la production massive de cytokines.
1.8.4. Les enzymes :
-la coagulase : il s’agit d’une substance protéique faiblement antigénique, thermostable. Il en existe deux types :
Un coagulase libérée dans le milieu de culture et une seconde qui reste liée au corps bactérien (clumping factor).
-la fibrinolyse ou staphylokinase : c’est une substance antigénique thermolabile. -l’hyaluronidase : c’est un facteur de diffusion qui joue un rôle dans la destruction du tissu conjonctif du fait de l’hydrolyse de l’acide hyaluronique, principal constituant de ce tissu.
-les Désoxyribonucléases (DNase)
-la lipase et estérases, capables de métaboliser les graisses cutanées.
-Bêtalactaminases et pénicillinases : sont des enzymes élaborées par certains staphylocoques grâce à des plasmides spécifiques pour inactiver les
14
antibiotiques correspondants, mécanisme essentiel de la résistance à cet antibiotique.
Comme on le voit, le staphylocoque doré possède une richesse enzymatique, qui non seulement le met à l’abri de la phagocytose, mais lui permet aussi d’agresser profondément l’organisme et d’y diffuser tout en détruisant certains antibiotiques sensées être actifs sur lui par son élaboration de bêtalactamase.
2. Phénotype de résistance aux antibiotiques de S .aureus (13):
2.1. Bêtalactamines :
La cible des bêtalactamines est un ensemble d’enzymes de la membrane cytoplasmique nécessaires à la formation du peptidoglycane de la paroi.Les bêtalactamines se fixent d’une manière irréversible à l’une ou à l’autre de ces protéines appelées, pour cette raison, « protéine liant la pénicilline » (PLP).Le substrat normal de ces PLP est l’acétyl-D-alanyl-D-alanine. La pénicilline et les autres bêtalactamines agissent comme des analogues de substrats empêchant la synthèse de la paroi cellulaire (14) .Ainsi, en présence d’une bêtalactamine, les bactéries sensibles ont de ce fait une paroi fragilisée et sont incapables de résister aux chocs osmotiques.
S .aureus est naturellement sensible à toutes les bêtalactamines, excepté à
l’aztréonam par manque d’affinité pour les PLP.
Deux principaux mécanismes sont impliqués dans la résistance acquise de S .aureus aux bêtalactamines
2.1.1. Production d’un bêtalactamase :
La pénicillinase est apparue dès l’utilisation de la pénicilline G et actuellement produite par 70% à 80% des souches communautaires de S .aureus et par 80% à
15
90% des souches hospitalières.La synthèse de cette enzyme est inductible et les inducteurs les plus puissants sont la méticilline et le céfotaxime(13).
Le support génétique est un plasmide (ou un transposon) et il est codé par le gène blaZ .L’expression du blaZ est régulée par deux gènes, blaR1-blaI situés en amont et transcrits en direction opposée à blaZ (pour revue 15).
On décrit quatre types de pénicillinase appelées A, B,C,et D qui hydrolysent la pénicilline G ,les carboxypénicillines (ticarcilline),les aminopénicillines (ampicilline,amoxicilline),les ureidopénicillines(mezlocilline,pipéracilline). Au contraire elles épargnent les pénicillines M, les céphalosporines, les monobactames et les carbapénèmes.
Les inhibiteurs de bêtalactamase tel l’acide clavulanique, le sulbactam et le tazobactam restituent aux premiers cités leur action, permettant l’utilisation d’association telle amoxicilline-acide clavulanique sur des souches présentant donc le phénotype : Péni-R, Méti-S.
2.1.2. Modification des PLP (résistance à la méticilline) :
La résistance à la méticilline par modification de la cible, appelée aussi résistance intrinsèque, est due à la production d’une nouvelle PLP appelée PLP2a ou PLP’présentant peu d’affinité pour la méticilline et toutes les autres bêtalactamines et leur dérivés(16).La PLP2a est codée par le gène mecA dont l’expression dépend au moins de deux systèmes régulateurs agissant au niveau transcriptionnel (17): le système de gènes mecI et mecR1 situés en amont du gène mecA et le système bla1et blaR1 situés en amont du gène blaZ de la pénicillinase.La protéine MecR1 ,produit du gène mecR1 ,agirait comme transducteur de signal :MecR1 détecte la présence de bêtalactamine grâce à son domaine extracellulaire.Une fois l’antibiotique lié,il y a activation du domaine
16
intracellulaire.Celui –ci subirait une activation par protéolyse limitée lui conférant une activité protéasique .Cette dernière conduit à la dégradation du MecI(répresseur de la transcription codé par mecI) qui est fixé au niveau de l’opérateur d’où libération de ce dernier et expression du mecA(18) .
Le système mecI-mecR1 exerce une répression transcriptionnelle sur mecA plus importante que celle exercée par le système blaI-blaR1.Il semble que la majorité des SARM aient un système mecI-mecR1 non fonctionnel soit par délétion de ces gènes soit par mutation ponctuelle.Le système blaI-blaR1 prend alors le contrôle du gène mecA et la transcription de ce gène devient inductible (19). - Niveaux de résistance à la méticilline des staphylocoques (20) :
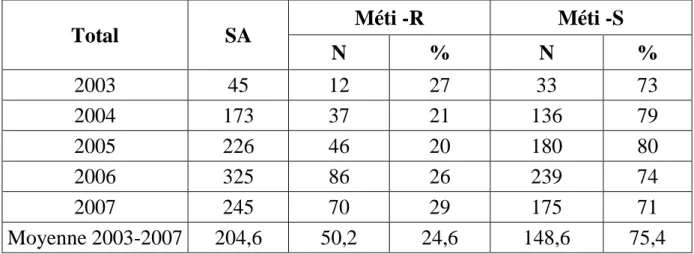
Tomasz a individualisé quatre classes de résistance à la méticilline des staphylocoques, tant pour les SA que pour les SCN, par l’étude des populations en présence de concentrations croissantes de méticilline.
Les SARM et les SCNRM très hétérogènes appartiennent à la classe 1 ; ils présentent une CMI de méticilline <2mg/L pour la population prédominante, et >100mg/L pour une population très minoritaire (10-8 bactéries).
Les SARM et les SCNRM de classes 2 et 3 sont hétérogènes avec une CMI de la population dominante <2mg/L et >100mg/L pour la population minoritaire (10-6 à 10-4 bactéries).
La classe 4 regroupe les SARM et les SCNRM de résistance homogène (CMI>100mg/L).La classe 1 correspondrait au premier stade d’acquisition du gène mec A pour une souche de staphylocoque originellement sensible à la méticilline et aux autres familles d’antibiotiques antistaphylococciques.
17
2.1.3. Autres types de résistance (21) :
Les souches de S.aureus présentant une résistance limitée ou de bas niveau à la méticilline n’ont pas gène mecA .Ce sont en fait les souches appelées BORSA (pour Borderline Résistant S.aureus ) qui présentent une résistance à la méticilline à couse d’une production accrue de bêtalactamase,et les souches appelées MODSA (pour Modified Penicillin Binding Protein) dont la résistance est due soit à une production de PLP4 soit à la synthèse d’une PLP2 modifiée, dans les deux cas on a une diminution de l’affinité pour les bêtalactamases.
2.2-Aminosides :
Leur cible est le sous –unité 30 S des ribosomes bactériens ce qui entraine une altération de la synthèse des protéines .Ils sont bactéricides, concentration dépendants et ont un effet post-antibiotique.
Les staphylocoques sont normalement sensibles aux aminosides. Deux mécanismes sont impliqués dans la résistance aux aminosides :
L’altération de la cible ribosomale, qui touche essentiellement la streptomycine.
L’imperméabilité, le transport actif de l’aminoside ne se fait plus, ce qui entraîne une résistance de bas niveau, croisée pour tous les aminosides.
La modification enzymatique des aminosides .Ces enzymes sont regroupée en trois classes :
o Les phosphotransférases (APH) qui catalysent la phosphorylation d’un groupement hydroxylé.
o Les nucleotidyltransférase (ANT) qui catalysent l’adrénylation d’un groupement hydroxylé.
18
Des études plus précises ont démontrés que la résistance à la kanamycine-tobramycine-gentamycine était portée chez les S .aureus par un transposons .Ce transposon Tn4001 est souvent retrouvé dans les plasmides de résistance Psk1 mais peut également s’insérer directement dans le chromosome bactérien. Il code pour une enzyme bifonctionnelle qui inactive la kanamycine, la tobramycine, la gentamycine mais aussi l’amikacine et la nétilmicine.Les principaux phénotypes détectés chez les staphylocoques peut être expliqués par la présence de trois enzymes :
Ainsi, l’APH (3’) III confère une résistance de haut niveau à la kanamycine et à la néomycine (phénotype KN).
L’ANT (4’) (4’’) I conduit à une résistance de haut niveau à la kanamycine et à tobramycine (phénotype KT).
L’APH (2)-AAC (6’) conduit à une résistance de haut niveau à la kanamycine, à la tobramycine et à la gentamycine (phénotype KTG).
Un quatrième enzyme confère la résistance à streptomycine et donc le phénotype S, il s’agit de l’ANT (6) ou APH (3’’) ou ANT (9).
2.3. Macrolides-lincosamines-streptogramines (MLS) :
Ces trois familles d’antibiotiques ont des structures chimiques différentes mais on les regroupées car leur mécanisme d’action et leur spectre antibactérien sont commun : elles inhibent la synthèse des protéines en se fixant sur la sous-unité 50S du ribosome bactérien.
Les macrolides et les lincosamides ne sont pas bactéricides contre les staphylocoques mais les streptogramines le sont du fait de la synergie de leurs deux composants, un composantA (ou streptogramineA) et ou un composé B (ou streptogramines B) qui sont bactériostatiques lorsqu’ils sont utilisés isolement.
19
2.3.1. Les trois grands mécanismes de résistance aux MLS :
-la modification de cible ou résistance de phénotype MLSB :
Elle est de loin la plus fréquente .Elle est liée à la synthèse d’un enzyme codée par les familles de gènes erm portés par un plasmide ou un transposon. Cette enzyme est une méthylase qui peu être constitutive ou inductible. La méthylation provoque un changement de conformation de l’ARN et une diminution d’affinité des MLS pour leur cible. Il y a résistance croisée entre tous les macrolides, les lincosamides et le facteur B des streptogramines mais le composé A des streptogramines ainsi que l’association A+B (qui est la pristinamycine) restent actifs.
-l’inactivation enzymatique :
La production d’une nucléotidytransférase modifie les lincosamides et confére un haut niveau de résistance à la lincomycine et un bas niveau de résistance à la clindamycine .Il s’agit de la résistance de phénotype L, codée par le gène LnvA. L’acquisition d’une acétyltransférases peut être codée par cinq gènes vat (qui sont vat A/B/C/D/E) et confère une résistance à la streptogramine A.
L’acquisition d’une hydrolase codée par le gène vgb (A/B) confère une résistance à la streptogramine B.
-l’efflux actif ATP dépendant :
Le gène msrA donne un phénotype de résistance aux macrolides à 14 et 15 atomes de carbone et composé B des streptogramines.
Les gènes vga (A/B/variantAv) donnent une résistance isolée aux streptogramines A.
La résistance au facteur A entraîne une résistance à l’association SA+SB (avec des CMI (concentration minimale inhibitrice) de la pristinamycine de 1 à
20
8µg /ml au lieu de 0.12 à 0.5mg/l) .Cette résistance à S.aureus peut être mal détectée en testant que la pristinamycine.Ce phénotype concerne moins de 5% des souches de SARM .Il est donc recommandé de tester séparément la sensibilité à la streptogramine A afin de détecter ce phénotype.
2.3.2. SARM de phénotype LSA :
Il s’agit d’un phénotype encore mal connu et peu décrit dans la littérature qui peut toucher toutes les espèces de staphylocoques et leur confère une résistance à la lincomycine voir à la clindamycine et une résistance à la streptogramineA et à la pristinamycine.
La résistance à la streptogramine A est conférée par deux catégories de gènes -vat ABCDE qui code pour des acétyltransférases inactivant la molécule.
-vga AB et lnv A qui codent pour des protéines liant l’ATP, à l’origine d’un phénomène d’efflux.
-on a décrit récemment un variant de vgaA (vga Av) par un transposon appelé, Tn5406 et localisé sur des plasmides ou des chromosomes de staphylocoques .Il serait à l’origine du mécanisme de résistance LSA.
Cette résistance se voit dans seulement 7% des souches de S.aureus résistantes à la streptogramines A, qui ne font elles –mêmes partie que de 0.2% à 2% des S .aureus totaux (111,112).
Le niveau de résistance à la pristinamycine des souches LSA est difficile à déterminer .Il est aisément détectable par antibiogramme si on utilise systématiquement un disque chargé de streptogramine A.
21 2.4. Quinolones :
Elles interférent avec l’état topologique de l’ADN bactérien en se fixant sur une enzyme, l’ADN –gyrase ou topoisomérase II.
S .aureus est naturellement résistant aux Quinolones de première génération
mais sensible aux fluoroquinolones.
La résistance acquise est liée à des mutations chromosomiques qui entraînent une modification de la cible affectant L’ADN –gyrase (mutation dans les gènes gyrA et par C) ou une diminution de la perméabilité liée à une modification des porines.
2.5. Cyclines :
Elles inhibent la synthèse protéique en se liant à la sous-unité 30S du ribosome et sont bactériostatiques.
S .aureus est naturellement sensible aux tétracyclines.
Il y a deux principaux mécanismes de résistance qui sont :
o L’efflux de la tétracycline liée au gène plasmidique tet qui code pour une protéine membranaire TET .Dans ce cas, la résistance est isolée à la tétracycline. o La modification d’affinité pour la cible ribosomale liée à un gène transposable codant la synthèse d’une protéine recouvrant le ribosome .Dans ce cas, la résistance est croisée à la tétracycline et à la minocycline.
2.6. Sulfamides et triméthoprime :
Ils inhibent la synthèse microbienne de l’acide folique et sont bactériostatiques. La résistance aux sulfamides est de nature chromosomique chez S .aureus .Celle au triméthoprime est plasmidique ou chromosomique et touche la dihydrofolate
22
réductase .Elle est presque toujours associée à la résistance aux sulfamides, générant ainsi une résistance à l’association des deux (cotrimoxazole).
Les SARM sont fréquemment résistants aux sulfamides.
2.7. Fosfomycine :
Elle agit par inhibition de la synthèse des précurseurs du peptidoglycane et est bactéricide .On décrit deux mécanismes de résistance qui sont une mutation au niveau du système de transport (codé par les gènes glpT et uhp) et une inactivation enzymatique (codée par le gène fos B).
2.8. Rifampicine :
Elle fait partie de la famille des rifamycines qui sont bactéricides et qui bloquent l’initiation de la transcription de l’ADN bactérien en se fixant sur la sous-unité B de l’ARN polymérase.
Le mécanisme de résistance est la sélection de mutants, par des mutations ponctuelles dans le gène rpo B codant pour l’ARN polymérase ADN dépendant.
2.9. Acide fusidique :
Il inhibe la synthèse protéique et est bactériostatique.
Il se lie au facteur d’élongation EF-G et bloque la fixation des aminoacylARNt sur le ribosome .La résistance peut être liée à une sélection de mutants du facteur d’élongation de faible affinité pour l’antibiotique ou à une modification de la perméabilité ou séquestration de l’antibiotique.
23 2.10. Phénicolés :
Ils inhibent la synthèse protéique en se fixant sur la sous –unité 50S des ribosomes .La résistance s’explique par l’acquisition de petits plasmides codant pour la synthèse d’un chloramphénicol acétyltransférase.
2.11.Glycopeptides :
Ils agissent par inhibition de la synthèse de la paroi bactérienne en bloquant la formation du peptidoglycane, ils sont lentement bactéricides et temps-dépendants.Ces antibiotiques sont normalement actifs sur S.aureus et sont considérés comme le traitement de choix des infections à SARM, mais on commence à détecter des souches de S .aureus de sensibilité diminuée aux deux glycopeptides, après avoir isolé des souches d’entérocoques, de S .haemolyticus et de S .épidermidis de sensibilité diminuée aux glycopeptides.
Le mécanisme de résistance est mal connu et entraînerait un épaississement de la paroi.
Les différents acronymes utilisés afin de désigner les souches de S .aureus de sensibilité diminuée aux glycopeptides sont :
VISA (Vancomycine intermediate S .aureus) :
Il désigne les souches avec sensibilité intermédiaire pour la vancomycine .Ces souches VISA sont en général résistant ou de sensibilité intermédiaire à la teicoplanine.
GISA (Glycopeptide intermediate S .aureus) :
Il désigne les souches de sensibilité intermédiaire à la vancomycine ou à la teicoplanine.
VRSA (Glycopeptide résistant S .aureus) :
24
Le niveau de CMI de ces souches utilisé pour déterminer le niveau de résistance est variable selon les pays.
GRSA (Glycopeptide résistant S .aureus) :
Il désigne les souches résistantes à la teicoplanine ou à la vancomycine.
Le CDC d’Atlanta a débuté une politique surveillance des infections nosocomiales à GISA (souches de S .aureus de sensibilité intermédiaire aux glycopeptides) et a désigné une population à risque : patients hémodialysés, sous dialyse péritonéale ou prédisposés à des infections à SARM et traités par vancomycine au long cours.
En France, la proportion de S.aureus intermédiaires aux glycopeptides parmi les SARM varie de moins de 1% à 25% selon les hôpitaux, les régions et les méthodes de détection. L’apparition des souches de SARM de sensibilité diminuée aux glycopeptides intervient dans un contexte d’épidémies intra-hospitalières de SARM et où la consommation des glycopeptides est élevée (22).
25
3. Profil de résistance aux antibiotiques de S.aureus dans certains pays :
-Maroc :
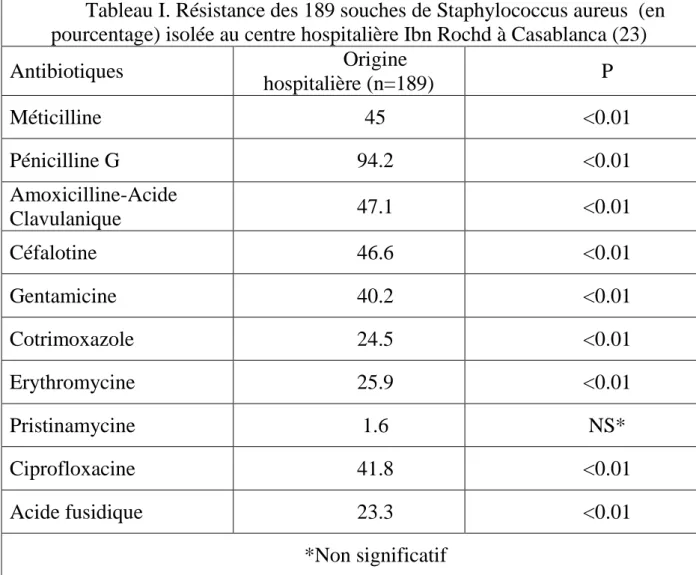
Tableau I. Résistance des 189 souches de Staphylococcus aureus (en pourcentage) isolée au centre hospitalière Ibn Rochd à Casablanca (23)
Antibiotiques Origine hospitalière (n=189) P Méticilline 45 <0.01 Pénicilline G 94.2 <0.01 Amoxicilline-Acide Clavulanique 47.1 <0.01 Céfalotine 46.6 <0.01 Gentamicine 40.2 <0.01 Cotrimoxazole 24.5 <0.01 Erythromycine 25.9 <0.01 Pristinamycine 1.6 NS* Ciprofloxacine 41.8 <0.01 Acide fusidique 23.3 <0.01 *Non significatif
26
-Bénin :(24)
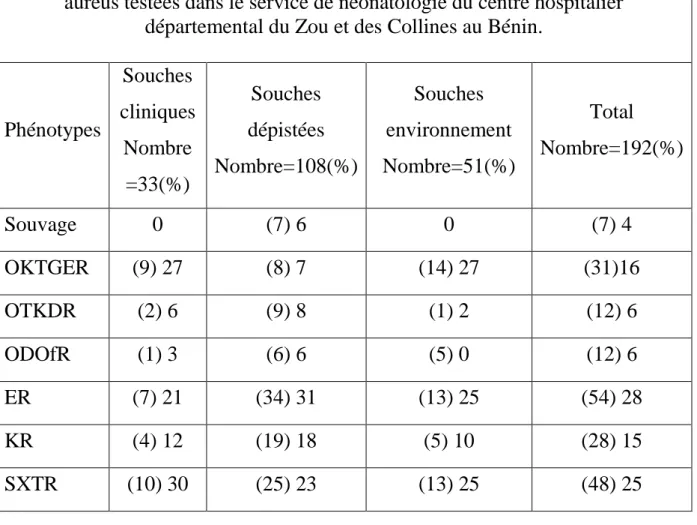
Tableau II : Résultats de l’antibiotypie des 192 souches de Staphylococcus aureus testées dans le service de néonatologie du centre hospitalier
départemental du Zou et des Collines au Bénin.
Phénotypes Souches cliniques Nombre =33(%) Souches dépistées Nombre=108(%) Souches environnement Nombre=51(%) Total Nombre=192(%) Souvage 0 (7) 6 0 (7) 4 OKTGER (9) 27 (8) 7 (14) 27 (31)16 OTKDR (2) 6 (9) 8 (1) 2 (12) 6 ODOfR (1) 3 (6) 6 (5) 0 (12) 6 ER (7) 21 (34) 31 (13) 25 (54) 28 KR (4) 12 (19) 18 (5) 10 (28) 15 SXTR (10) 30 (25) 23 (13) 25 (48) 25
O : oxacilline ; K : kanamycine ; T : tobramycine ; G : gentamycine ; E : érythromycine ; R : résistant ; OKTGER : résistant à l’oxacilline,
kanamycine, gentamycine , érythromycine ;ODOfR :résistant à l’oxacilline,la doxycycline,et Ofloxacine ;SXTR :résistant au trithoprime-sulfaméthazoline ;ER :résistant à l’ érythromycine, KR :résistant à la kanamycine.
L’analyse globale de la résistance des SARM aux antibiotiques confirme la multirésistance de ces germes qui sont connus par leur aptitude à résister à
27
plusieurs autres groupes d’antibiotiques : vis-à-vis des cyclines, des macrolides, des lincosamides, des fluoroquinolones, de l’acide fusidique et des aminosides avec une plus fréquente sensibilité à la gentamicine et apparition des souches GISA (25).Cette résistance en milieu hospitalière est donc extrêmement variable d’un pays à un autre(26.27.28) et d’un hôpital à un autre et d’un service à un autre .Ces variations peuvent être expliquées par l’existence ou non de souches épidémiques ,le moment de l’étude, la présence de patients à risques, le transfert de patients entre différents services, la pratique d’une politique de contrôle des infections ,et la fiabilité des méthodes de laboratoire utilisées pour la détection des SARM (26).
3.1. Prévention des résistances dans les unités de soins intensifs (USI) (29) :
L’initiation d’un traitement antibiotique empirique dans les USI est très fréquente (prévalence moyenne : 40 à 60%) car le risque de sepsis et de choc septique est très élevé et il n’existe aucune méthode clinique et biologique pour prédire ce type de complications. De ce fait, la prévalence des traitements antibiotiques non nécessaires en USI est très élevée et augmente le risque de sélection des souches bactériennes résistantes dans ces services .Dans sa présentation(30), Stephan Harbarth de l’université de Genève, a redéfini les règles principales pour améliorer la prise en charge des patients suspectés de sepsis :
Entre autres, ne prescrire des antibiotiques qu’en cas de sepsis avéré par des tests microbiologiques et restreindre le spectre antibiotique à la bactérie en cause, donner le traitement à une dose et une durée optimales.
28
En cas de patients sévèrement atteints, ne pas retarder l’antibiothérapie intraveineuse mais envoyer immédiatement les prélèvements au laboratoire pour adapter l’antibiotique et la durée du traitement au vu des résultats.
Limiter l’antibiothérapie préventive et ne pas la prolonger plus de 48 heures après l’intervention.
Néanmoins, même si ces règles diminuent le risque pour les patients de développer un sepsis, la détection et le traitement du sepsis précoce nécessitent d’être améliorés de façon urgente, notamment par le développement de nouvelles méthodes diagnostiques.
Par ailleurs, la question des stratégies préconisées pour limiter la survenue des résistances aux antibiotiques dans les USI a été abordée. Certains auteurs proposent la stratégie de cycling, un concept d’hétérogénéité antibiotique permettant théoriquement de limiter la pression de sélection sur certains antibiotiques et consistant à changer périodiquement d’antibiotique au sein d’un service (31, 32,33).
Pour George Drusano de l’ordway research institut à New York, la meilleure façon de limiter l’émergence de résistances aux antibiotiques dans une unité de soins, c’est de faire « le bon choix, au bon moment et à la bonne dose » (34).Le bon moment, c’est la « première fois », sachant qu’un traitement inadéquat mène à une augmentation de la mortalité, de la durée de séjour dans l’unité de soins et de la durée de ventilation mécanique. Le « bon choix »consiste à adapter le traitement empirique au profil de sensibilité de l’unité de soins concernée. Mais le plus important est peut être la dose à la quelle l’antibiotique doit être administré .En effet, c’est sur la dose utilisée qu’il est possible de contrôler le taux d’amplification de la population résistante à un médicament. De plus, que
29
le mécanisme de résistance passe par une mutation chromosomique ou par l’induction de pompes d’efflux, il provoque une augmentation de la concentration minimale inhibitrice(CMI).C’est pourquoi, une possibilité de supprimer la résistance serait d’employer des modèles pharmacodynamiques précliniques d’exposition médicamenteuse pour déterminer les doses cliniques qui ont la plus grande probabilité d’atteindre ce but. Le Dr Drusano propose aussi d’appliquer des modèles mathématiques tels que la simulation de Monte-Carlo pour sélectionner parmi les doses de médicament candidates celles qui ont le plus de chances de supprimer la résistance en clinique (35).En enfin pour lui, la durée de traitement est aussi importante ,un effet maximal du médicament ayant été démontré dans une étude de validation de ses modèles après cinq à sept jours d’un traitement à forte dose ,le régime à dose plus faible permettant l’amplification des populations mutantes .
4. Marqueurs épidémiologiques :
Ils permettent de distinguer au sein d’une espèce bactérienne les souches d’origine distincte ou clones bactériens. Le typage épidémiologique permet de confirmer la transmission endémique ou épidémique d’un pathogène au sein d’une population humaine, de trouver l’origine de la contamination et le mode de transmission, de suivre l’évolution du réservoir du pathogène au sein de la population et de mesurer l’efficacité des stratégies de maîtrise des infections épidémiques et de prévention des infections endémiques .Il existe un grand nombre de méthodes de typage.
30 4.1. Marqueurs phénotypiques :
Ils sont relativement faciles à mettre en œuvre mais ils s’appuient sur des caractères variables.
Le biotype étudie les caractères morphologiques, biochimiques et métaboliques variables au sein d’une même espèce.
L’antibiotype étudie les résistances acquises, son avantage est qu’il est réalisé quotidiennement au laboratoire sur la plupart des souches isolées l’émergence d’un nouveau phénotype de résistance est souvent un signal d’alerte pour soupçonner une dissémination clonale épidémique (36, 37).
Le serotype identifie des déterminants antigéniques variables au sein d’une même espèce.
Le lysotype étudie la sensibilité à des bactériophages. l’électrophorèse des protéines et immunoblotting. L’analyse des isoenzymes.
4.2. Marqueurs génotypiques :
Ils sont basés sur la caractérisation d’ADN total, chromosomique ou extra-chromosomique et sont de plus en plus utilisés au laboratoire. Les principales méthodes, car elles sont très nombreuses, sont :
-le profil plasmidique.
-le profil de restriction génomique.
-l’analyse RFLP (Restriction Fragment Lengh Polymorphism) par Souther –blot de l’ADN chromosomique.
31 5. Le diagnostic bactériologique :
S .aureus peut être à l’origine d’infections sévères mettant en jeu le pronostic
vital, c’est pourquoi le biologiste doit l’identifier avec des tests sensibles, spécifiques et rapides.
Un diagnostic fiable et rapide du SARM contribue à l’efficacité de la prise en charge des patients et à la mise en place de mesures d’hygiène hospitalière adaptées. Le diagnostic classique par culture microbiologique offre une excellente sensibilité, mais dans des délais de réponse variant de 48 à 72 heures. Les délais des tests d’amplification moléculaire ne sont, quant à eux, que de quelques heures.
-Prélèvement : On peut travailler avec différents prélèvements pathologiques (pus, plis cutanés, oreille, urine, gorge, hémoculture, nasal, drain, crachat, œil…) en utilisant des écouvillons stériles.
Les staphylocoques sont présents à l’état commensal sur la peau et les muqueuses. La rigueur dans le prélèvement est fondamentale pour faciliter le diagnostic .Le recueil doit :
Pour les lésions cutanéo-muqueuses : se faire au site précis de lésion, à l’aide d’une aiguille montée sur une seringue et en procédant à une aspiration douce.
Pour les prélèvements de sang, l’urine, de LCR ou d’une collection fermée : doit être réalisé après une désinfection locale de la peau avec un antiseptique efficace (chlorhexicidine iodée ou non) pour éviter la contamination.
32
Les hémocultures doivent être multipliées (au moins 3) pour permettre l’isolement du germe à plusieurs reprises, contribuant ainsi à affirmer son caractère pathogène.
-l’isolement :
L’examen direct du prélèvement peut donner une orientation diagnostique importante mais le diagnostic définitif du genre et de l’espèce ne sera obtenu qu’après la culture et l’identification des souches.
L’isolement par culture peut se faire sur milieu non sélectif de type gélose au sang ou sur milieu sélectif gélosé de type Chapman.
Le milieu est ensemencé puis mis à l’étuve à 37°C pendant 24 heures en aérobiose la plupart du temps ou en anaérobiose surtout pour des prélèvements tels que du pus ou de l’os.
-Identification de S.aureus : (voir au dessus)
Aspect macroscopique des colonies (diagnostic de présomption)
Aspect au microscope après coloration de Gram (diagnostic de présomption)
Diagnostic de genre et d’espèce :
La présence d’une catalase est un caractère quasi-constant chez ces bactéries et sa mise en évidence permet de distinguer parmi les cocci à gram positif les staphylocoques des streptocoques.
La production ou non de pigment, les tests biochimiques simples permettent de différencier facilement les différentes espèces impliquée en clinique (Tab 3 voir ci-dessous).Ces tests apportent une identification définitive, établissant le diagnostic de certitude. Comme le test de la coagulase, qui met en évidence
33
l’aptitude des bactéries à coaguler le plasma permet l’identification de la majorité des souches de S.aureus.
Il est recommandé d’utiliser deux tests d’identification de S.aureus : la détection de la coagulase et un test d’agglutination et s’il y a discordance entre les deux, il faudra réaliser une identification biochimique.
Tableau III : Identification de SA par caractères biochimiques
Utilisation d’une galerie d’identification biochimique :
Il y a des galeries non automatisées (ex : API Staph (bioMérieux)). Ces systèmes utilisent des tests d’acidification ou d’assimilation des sucres et des tests enzymatiques.
34
Galerie d’identification non automatisée de type API (10)
Autres qui sont automatisées (ex : Vitek 2 ID-GPC (bioMérieux)).Ces systèmes sont basés sur des tests enzymatiques, des tests d’acidification ou d’utilisation des sucres, des tests de résistance aux substances inhibitrices. Leur identification se fait après 2 à 24 heures d’incubation.
-Diagnostic sérologique :
Le taux sérique normal des antistaphylosines a étant de 0.5 à 2 Unités par millilitre, un taux supérieur à 2U est donc significatif. Ce dosage est rarement demandé.
-Typages des souches :
Les serotypes et lysotypes des espèces isolées n’ont pas d’intérêt en pratique clinique courante. Leur intérêt est épidémiologique.Pour S .aureus, les sérotypes les plus fréquents sont les I, II, III, et 18.Ce dernier, multirésistant aux antibiotiques, est le sérotype le plus fréquent en milieu hospitalier.
35
6. Détermination de la sensibilité aux antibiotiques (ou antibiogramme):
Plusieurs méthodes sont recommandées par le National Committee for Clinical Laboratory Standards pour le dépistage de la résistance à la méticilline de
S.aureus :
Méthode de diffusion en gélose de Mueller-Hinton :
Elle se fait à l’aide de disques chargés d’antibiotiques .Elle repose sur le principe suivant : une source d’antibiotique déposée sur une gélose diffuse et produit des concentrations progressivement décroissantes .c’est à dire un gradient de concentration inversement proportionnel à la distance du point de diffusion .Des disques de papier filtre de 6 mm de diamètre imprégnés d’une quantité déterminée d’antibiotiques, sont déposés sur une gélose préalablement ensemencée à partir d’un inoculum bactérien ajusté à 107
ufc /ml .Après une incubation à 37°C pendant 18 heures ,on mesure le diamètre de la zone d’inhibition ,dépourvue de croissance bactérienne.
L’interprétation des diamètres d’inhibition, basée sur les normes du Comité Française de l’Antibiogramme permet de classer la souche en trois catégories possibles sensible, intermédiaire ou résistance et de donner une approche de la CMI grâce à une droite de régression.
36
SARM sur gélose de MH (10)
Méthode de détection en milieu liquide ou Vitek :
L’automate Vitek réalise l’antibiogramme des principales bactéries rencontrées en clinique à partir d’un inoculum bactérien standardisé. Les cartes d’antibiogramme sont constituées de cupules contenant diverses concentrations d’antibiotiques testés permettant de calculer une approche de la CMI après lecture de croissance microbienne en turbidimétrie.
Détection de la résistance à la méticilline :
Différentes méthodes de détection de la résistance à la méticilline ont été évaluées.
Test à l’oxacilline :
Cette méthode a été réalisée, en utilisant des disques d’oxacilline à 1µg, à 5µg, avec des variables :
-l’inoculum
-la concentration en NaCl dans le milieu M-H (2% à 4%) ou sans NaCl
-la température d’incubation (30°c ou 37°c) -la durée d’incubation (18 à 72 heures)
37
À partir d’un inoculum lourd de 108
UFC /mL, après 18 heures d’incubation à 37°c et pour un diamètre critique de 20mm, l’utilisation du disque d’oxacilline à 5µg présentait une sensibilité de 84.6% pour les SARM de classe 1,de 100% pour les SARM des autres classes ,et une spécificité de 100%.Dans les mêmes conditions et pour un diamètre critique de 13 mm, l’utilisation du disque d’oxacilline à 1µg présentait une sensibilité de 88.5% pour les SARM de classe 1,de 100% pour les SARM des autres classes, une spécificité de 97.1% seulement, avec l’inoculum de 106
UFC /ml la spécifié était inacceptable(20).
Disque de céfoxitine (Méfoxin®) (20) :
La détection de la résistance intrinsèque à la méticilline des souches de S.aureus repose sur l’étude de la sensibilité à la céfoxitine dans les conditions usuelles de l’antibiogramme par diffusion (gélose de Mueller-Hinton sans complément, inoculum aux environs de 5x106UFC/ml ,incubation de 18-24 heures à 37°C :dans ces conditions toute souche « sensible » à la céfoxitine(diamètre ≥27mm) doit être classée « méti-S »,alors que toute souche présentant un diamètre inférieur à 27mm(souche non sensible) doit être considérée comme « méti-R ».
Le disque de céfoxitine a permis de détecter 100% des souches de SARM et 94% des souches des staphylocoques à coagulase négative (SCNRM).
La méticillinorésistance est définie par un diamètre d’inhibition de la céfoxitine <27mm à la fois pour les SARM et les SCNRM.
Disque de latamoxef (Moxalactam®) :
À partir d’une culture de 18 heures sur milieu gélosé non sélectif, une suspension en solution saline (0.9 % NaCl) équivalente au standard Mc Farland 0.5 (108UFC /ml) est diluée au 1 /100 en eau distillée. L’ensemencement est fait
38
par inondation sur gélose de M-H.Aprés séchage les disques de céfoxitine et de latamoxef sont appliqués sur la gélose, au même temps que les disques représentatifs des diverses familles d’antibiotiques antistaphylococciques .Après 18 heures d’incubation à l’étuve à 37°C en aérobiose, la lecture des diamètres est réalisée.
Dans les conditions de l’antibiogramme standard en milieu de M-H ensemencé avec un inoculum de 106UFC /ml est incubé 18 heures à 37 °C, la sensibilité et la spécificité de la méthode du disque de latamoxef étaient de 100%, quelque soit la classe de SARM.
La méticillinorésistance est définie par un diamètre d’inhibition de latamoxef <24mm.
Disque de pénicilline (ainsi que l’aspect de sa bordure d’inhibition) permettant, comme actuellement, la recherche d’une pénicillinase.
Test immunologique : le test Slidex MRSA détection ® (bioMérieux)
C’est un test d’agglutination sur lame, les particules de latex sensibilisées par un anticorps monoclonal dirigé contre les protéines liant les pénicillines (PLP2a) vont réagir spécifiquement avec les S.aureus méticilline-R et une agglutination visible à l’œil nu est observée.
Ce test identifie les SARM à partir d’un isolement sur milieu gélosé .Et cela dans des conditions strictes à respecter : inoculum abondant, chauffage 3min à 95°C en bain-marie à sec, et lecture de la réaction après 5 min de rotation sur agitateur de Kline. Dans ces conditions, le test SlidexMRSA détection ® à une sensibilité de 98% et une spécificité de 100% (20).
La détermination de la concentration minimale inhibitrice (CMI) en utilisant la méthode d’E-test.
39
Les souches de S .aureus étaient considérées comme résistantes à la méticilline si la CMI à l’oxacilline est supérieur à 2mg / L.
La détection en utilisant une technique d’amplification moléculaire (38,39): Les méthodes de dépistage moléculaire commencent à faire leur apparition depuis quelques années .Pour qu’elles soient efficaces, il est important qu’elles apportent une réduction importante du temps d’analyse (dépistage rapide < 3 heures) et qu’elles permettent la détection directe de SARM dans un échantillon contenant une flore microbienne polymorphe avec, entre autres, des SASM et des SARM coagulase négative.
Ex : PCR IDI- MRSA (BD Diagnostic GeneOhm) : -Extraction de l’écouvillon
-Extraction de l’ADN
-Emorces et sondes d’hybridation -PCR en temps réel
Cette technique doit être réservée aux situations où il s’agit de savoir si oui ou non des mesures d’isolement sont nécessaires.
B. Aspects cliniques, Particularités cliniques des IN, Principes de
traitement :
1. Mécanisme de l’infection à S.aureus :
L’événement initial est la rupture de la première ligne de défense contre l’infection : la barrière cutanéo-muqueuse.Toute lésion, même minime, excoriation, plaie traumatique, brûlure ,injection parentérale, incision chirurgicale …,permet la colonisation tissulaire par la flore commensale du
40
patient lui-même ou d’un autre patient par le manuportage .Au niveau de la lésion tissulaire, au contact de la prolifération bactérienne, se produit une intense réaction inflammatoire, évoluant vers la formation d’une zone centrale de nécrose avec tendance à l’abcédation.
Sous l’influence de facteurs dus à la virulence de la bactérie et à l’hôte, l’extension se fait vers les vaisseaux de voisinage, créant une thrombophlébite localisée à l’origine de la dissémination bactérienne par voie sanguine (septicémie) avec formation d’abcès métastatiques siégeant dans n’importe quel tissu de l’organisme, a coté des substances élaborées par la bactérie : les toxines.
2. Aspects cliniques des infections à S.aureus :
2 .1.Infections non toxémiques ou suppuratives :
2.1.1. Infections cutanéo-muqueuses et sous-cutanées :
On peut diviser les infections cutanées en infections pyogènes localisées et en atteintes généralisées liées à des syndromes toxiniques et qui seront traitées dans un autre chapitre.
Les infections cutanées localisées sont les plus fréquentes des infections à staphylocoques. On peut énumérer :
La folliculite, lésion inflammatoire suppurée et douloureuse centrée sur un follicule pileux, est la plus typique. Elle peut prendre une allure extensive en profondeur (furoncle, anthrax, cellulite) ou en superficie (sycosis de la barbe). Les panaris superficiels ou sous-cutanés sont des infections typiquement staphylococciques.
L’hydrosadénite suppurée est l’infection des glandes sudoripares, le plus souvent localisée au creux axillaire.
41
L’impétigo de l’enfant, situé sur les jambes ou la face, réalise des lésions maculovésiculeuses, croûteuses et vernissées, différentes de celles de l’impétigo streptococcique.
Impétigo (10)
L’abcès mammaire à S.aureus complique 1 % à 3% des allaitements maternels. Il survient vers la 2éme-3éme semaine du post-partum.
La staphylococcie maligne de la face est une urgence diagnostique et thérapeutique. Elle se caractérise par une infection de l’aile du nez ou de la lèvre supérieure, avec placard inflammatoire où se dessine un trajet veineux bleuté s’étendant vers l’angle interne de l’œil .Elle évolue vers la thrombophlébite du sinus caverneux.
Les infections localisées aux muqueuses peuvent atteindre les yeux (conjonctivites), la sphère génitale (salpingites, abcès pelviens), les voies aériennes supérieures (sinusites, otites, parotidites, mastoïdites, amygdalites).
S.aureus n’est pas, à l’opposé des lésions cutanées, le germe responsable le plus
fréquent.
2.1.2. Pyomyosites aigues suppurées :
Elles réalisent parfois de volumineux abcès d’un ou plusieurs groupes musculaires .Elles sont fréquentes en pays tropical.
42 2.1.3. Septicémies :
Devant une septicémie communautaire ou nosocomiale à S.aureus, s’impose la recherche :
De la porte d’entrée : cutanée, cathéter intravasculaire …L’absence de porte d’entrée impose la recherche d’une endocardite.
De localisations septiques métastatiques ostéoarticulaires, pulmonaires, cutanées, valvulaires, neuroméningées.Les arthropathies dégénératives ou inflammatoires et le retard diagnostique favorisent la greffe bactérienne.
Le terrain pathologique sous-jacent (diabète, insuffisance rénale) est le facteur prédisposant prépondérant.
Leur évolution est sévère avec un état de choc dans 10 à 20% des cas et une mortalité avoisinant 11 à 43 %(40).
2.1.4. Endocardites :
La proportion des endocardites infectieuses dues à S.aureus semble globalement augmenter, jusqu’à plus de 30% dans des séries récentes. S.aureus apparaît ainsi être la première cause d’endocardite (41, 42,43). La plupart des endocardites à S .aureus surviennent sur une valve native .Ce type d’endocardites à S.aureus sur valve native, chez les patients non toxicomanes par voie intraveineuse, sont localisées dans 90% des cas au cœur gauche. S.aureus est l’agent de 80% des endocardites tricuspidiennes, qui sont l’apanage des toxicomanes par voie intraveineuse, et accessoirement des thrombophlébites sur cathéter intraveineux ou intracardiaque(44).S.aureus est la cause de 20% des endocardites sur prothèse, et d’environ la moitié des endocardites infectieuses associées à des activités de soins(41,45).
43
S.aureus est associé à une évolution plus rapide que les autres bactéries, et à
une plus grande fréquence des portes d’entrée cutanées ou iatrogènes, des complications emboliques, et des signes échographiques de complication paravalvulaire (41,46).
Les complications neurologiques (un tiers des patients) sont dues à un embole cérébral septique le plus souvent, à une méningite ou à un abcès. Elles entraînent une augmentation de la mortalité (47).Les embolies pulmonaires sont habituelles dans les endocardites tricuspidiennes, révélatrices dans la moitié des cas.
La mortalité des endocardites à S.aureus varie de 30 % à 62%, généralement plus élevée que pour les autres bactéries (41,46).
2.1.5. Pneumonies :
S .aureus est à l’origine de moins de 10% des pneumopathies communautaires.
La pneumonie à S .aureus peut survenir dans un contexte d’épidémie de grippe (20% à 30% de ces pneumonies), chez des patients atteints de mucoviscidiose, infectés par le VIH et particulièrement ceux atteints de pneumocystose, intubés et ventilés ou en pédiatrie.
Les pneumopathies d’origine hématogène se voient chez des patients toxicomanes intraveineux, en cours de dialyse ou porteur d’un matériel étranger. La radiographie pulmonaire peut montrer des foyers de condensation alvéolaires, voir des bulles et des abcès chez les enfants. La mortalité est élevée et atteint 40% des patients.
S.aureus est le second germe à l’origine de pneumopathies nosocomiales (40%
en augmentation) qui sont classées selon leur délai de survenue par rapport au jour d’hospitalisation.
44
Des souches de SASM sont généralement responsables des pneumopathies précoces (avant le 5ejour) et les SARM des pneumopathies précoces avec antécédent d’antibiothérapie ou des pneumopathies tardives (48).
Chez le patient hospitalisé en postopératoire ou intubé ou trachéotomisé,
S .aureus est responsable de 12 à 15% des pneumonies nosocomiales.
Sur les sondes d’intubation, S .aureus adhère et persiste comme sur les cathéters intravasculaires (49).Ainsi, de lourds inoculum peuvent être inhalés. Les modifications de la flore bucco-pharyngée avec colonisation par S.aureus sont une autre source d’inhalation. Une antibiothérapie préalable est un facteur de risque.
2.1.6. Manifestations neurologiques :
Elles peuvent être en rapport avec :
Une embolie cérébrale ou un anévrysme infectieux (susceptible de se rompre) au cours de l’endocardite du cœur gauche (50).
Une méningite à S .aureus n’est retrouvée que dans 1% à 3% des méningites acquises en ville (51). Dans le contexte nosocomial, elles surviennent principalement en postopératoire et chez les patients ayant un corps étranger encéphalique. Une méningite complique près de 14% des septicémies (52) et impose la recherche d’un autre foyer métastatique ou d’une endocardite (53). S .aureus est responsable de 18% à 28 % des ventriculites sur shunt de dérivation ventriculaire et de 10% à 20 % des méningites et ventriculites postopératoires, secondaire dans 65% des cas à une infection de la plaie opératoire (54).L’inoculation peut être directe lors d’une ponction lombaire .
Une infection paraméningée : L’abcès épidural (ou épidurite ) est du dans 60% des cas à S.aureus.Il crée une paraplégie douloureuse rapidement
45
progressive par compression. Il est la conséquence, par ordre de fréquence, d’une infection cutanée avec bactériémie (21%), d’une ostéomyélite vertébrale (13%) ou d’une infection par contiguïté des parties molles (après chirurgie vertébrale (10% ); escarres, cathéter épidural …).Aucune porte d’entrée n’est retrouvée dans 40% des cas. Une pathologie dégénérative du rachis est un facteur favorisant. La myélographie affirme le diagnostic(55).
L’empyème sous dural complique les infections de l’oreille moyenne ou des sinus, les ostéomyélites vertébrales ou un acte chirurgical. Il est hautement compressif aussi bien au niveau du SNC (hypertension intracrânienne) qu’au niveau spinal (paraplégie).La tomodensitométrie est la méthode diagnostique de choix. S.aureus est responsable de 15 à 25% des empyèmes (56).
L’abcès du cerveau est rare .Il complique une septicémie, une infection sinusienne ou otitique ou un acte chirurgical.
2.1.7. Infections ostéo-articulaires :
Les facteurs de risque de l’infection ostéo-articulaire à S .aureus sont liés à son mécanisme physiopathologique (57). S.aureus est responsable de 30 à 45% des ostéomyélites.
Sur matériel de prothèse, S.aureus est responsable de 59% des infections précoces (dans le mois postopératoire), de 15% des infections secondaires (le plus souvent dans les 2ans) qui suivent l’implantation. Ces infections sont la conséquence d’une contamination massive peropératoire ou lors d’un traumatisme(infection précoce)ou du site d’implantation du matériel d’ostéosynthèse,ou du tissu adjacent(infection par contiguïté) ou modeste (infection secondaire ).Elles doivent être différenciées des infections tardives,
46
localisation métastatique d’une septicémie à point de départ quelconque dont S .aureus est responsable dans 23% des cas(58).
L’ostéomyélite aigu hématogène est l’apanage de l’enfant et prédomine sur les os longs. Elle se révèle souvent à l’occasion d’un traumatisme mineur .Le point de départ est en règle une infection cutanée .Chez l’adulte, une articulation ou un os remanié par un processus inflammatoire dégénératif en est le facteur favorisant le plus fréquent, réalisant une ostéo-arthrite .20% des septicémies à
S.aureus se compliquent d’une localisation osseuse (47).
Toutes ces infections peuvent évoluer vers l’ostéomyélite chronique avec fistule. Les arthrites aigues peuvent résulter d’une inoculation directe lors d’une infiltration locale, d’une plaie traumatique ou d’un acte chirurgical (ménisectomie).Les arthrites hématogènes surviennent au cours d’une septicémie.70% des arthrites sont iatrogènes et plus de 80% d’entre elles sont dues à S.aureus (59).
Les spondylodiscites atteignent plus volontiers le rachis lombaire (70%) que le rachis dorsal (de D5 à D12).Elles sont, dans 40 à 45 % des cas, dues à
S.aureus.Le mécanisme est essentiellement hématogène .L’inoculation directe,
iatrogène, est rare (exploration invasive du rachis, chirurgie).
La tomodensitométrie peut être utile si le pincement discal et les images d’ostéolyse des plateaux vertébraux ne sont pas caractéristiques à la radiographie.
Dans toutes les infections ostéoartiulaires, la responsabilité de S.aureus doit être affirmée par sa mise en évidence au niveau du foyer ostéoarticulaire par ponction ou ponction-biopsie au trocart en cas de négativité des hémocultures. Le rendement des prélèvements est de 70 à 80%.Les prélèvements des orifices