HAL Id: hal-02819724
https://hal.inrae.fr/hal-02819724
Submitted on 6 Jun 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Identification du (des) gène(s) impliqué(s) dans le
phénotype peu de fructose d’une population
interspécifique de pêchers (Prunus persica)
Mathilde Hoerter
To cite this version:
Mathilde Hoerter. Identification du (des) gène(s) impliqué(s) dans le phénotype peu de fructose d’une population interspécifique de pêchers (Prunus persica). Sciences du Vivant [q-bio]. 2009. �hal-02819724�
« Les analyses et les conclusions de ce travail d’étudiant n’engagent que la responsabilité de son auteur et non celle d’AGROCAMPUS OUEST » AGROCAMPUS OUEST 65 rue de Saint-Brieuc CS 84215 35042 Rennes Cedex Tel : 02 23 48 55 00 UNIVERSITE DE RENNES 1 2, rue du Thabor CS 46510 35065 Rennes Cedex Tel : 0 2 23 23 35 35 INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE Unité de Génétique et Amélioration
des Fruits et Légumes BP 94 - 84143 Montfavet cedex
Tel : 04 32 72 28 40
Mémoire de Fin d’Etudes
Master 2ème année : Sciences, Technologies, Santé
Spécialité : Biologie Végétale Intégrative - Gène, Plante, Agrosystème Parcours Professionnel : Systèmes de Productions Végétales Raisonnés Option : Sélection VégétaleIdentification du (des) gène(s) impliqué(s) dans
le phénotype peu de fructose d’une population
interspécifique de pêchers (Prunus persica)
Par : Melle Mathilde HOERTER
Soutenu le 16 septembre 2009
Devant le jury :
Maria MANZANARES-DAULEUX (Responsable d’option) Anne LAPERCHE
Antoine GRAVOT Sophie ROLLAND
Maitre de stage :
REMERCIEMENTS
Tout d’abord, je tiens à remercier Bénédicte Quilot-Turion, ma maître de stage pour m’avoir accueilli et encadré durant ces six derniers mois. Merci Bénédicte de ta disponibilité, de ton aide constante et bienveillante, mais surtout merci de m’avoir fait confiance.
Un grand merci à Sophie pour son aide précieuse dans toute la partie BM de cette étude. Merci pour le temps que tu m’as consacré, pour ta disponibilité permanente, et ton soutien tout le long de ce stage, jusque dans les derniers moments.
Merci à Alexandre, qui m’a le premier montré les méandres du LBM. A Stéphane et Patrick pour leurs conseils avisés dans les périodes de doutes
.
Merci à Rebecca, pour son aide précieuse en enzymologie et à Nicolas pour son coup de main lors des analyses de séquence.
Merci à Véronique de m’avoir aidé lors des broyages et de m’avoir fait prendre l’air de temps en temps.
Merci à André, Mara, Charlotte, Virginie, Brigitte, Valérie, Maurice et tous ceux grâce à qui la pause de midi se transformait en moments de détente réparateurs. Merci à tous de votre accueil chaleureux.
Et enfin, je tiens à remercier toutes les personnes dont j’oublie le nom qui ont participé de près ou de loin à l’avancement de ce projet.
SOMMAIRE
LISTE DES ANNEXESLISTE DES ILLUSTRATIONS LISTE DES ABREVIATIONS
I. INTRODUCTION 1
-II. SYNTHESE BIBLIOGRAPHIQUE 2
-II.1.LA QUALITE DE LA PECHE -2
-II.1.1.LES SUCRES DE LA PECHE -2
-II.1.2.LE FRUCTOSE ET METABOLISME DU FRUCTOSE -3
-II.1.3.LE CONTROLE GENETIQUE DE LA QUALITE -4
-II.2.PROBLEMATIQUE -5
-II.3.DEMARCHE -6
-III. MATERIEL ET METHODES 7
-III.1.MATERIEL VEGETAL -7
-III.2.METHODES -7
-III.2.1.CARTOGRAPHIE ET ANALYSE QTL -7
-III.2.2.RECHERCHE DE GENES CANDIDATS DANS LES BASES DE DONNEES -8
-III.2.3.CARACTERISATION DES GENES CANDIDATS -9
-III.2.4.ANALYSE PHYSIOLOGIQUE DE L’EXPRESSION DES GENES CANDIDATS -10
-IV. RESULTATS ET DISCUSSION 12
-IV.1.CARTOGRAPHIE DU CARACTERE « SANS FRUCTOSE » -12
-IV.2.CHOIX DES GENES CANDIDATS -13
-IV.2.1.GENES CANDIDATS POSITIONNELS -13
-IV.2.2.GENES CANDIDATS FONCTIONNELS -13
-IV.3.LA SORBITOL DESHYDROGENASE -15
-IV.3.1.CARTOGRAPHIE DES GENES CANDIDATS -15
-IV.3.2.EXPRESSION DE GENE -16
-IV.3.3.ACTIVITE ENZYMATIQUE -17
-IV.4.LA FRUCTOKINASE -17
-IV.4.1.CARTOGRAPHIE DES GENES CANDIDATS -17
-IV.4.2.IDENTIFICATION DES DIFFERENTS ALLELES -18
-IV.5.LA PHOSPHOGLUCOSE ISOMERASE -20
-IV.5.1.CARTOGRAPHIE DU GENE CANDIDAT PGI -20
-IV.5.2.IDENTIFICATION DES DIFFERENTS ALLELES -20
-IV.6.LES AUTRES CANDIDATS -22
-IV.6.1.LA PHOSPHOFRUCTOKINASE -22
-IV.6.2.LA FRUCTOSE-6-PHOSPHATE-2-KINASE/FRUCTOSE-2.6-BISPHOSPHATASE -22
-V. CONCLUSIONS ET PERSPECTIVES 23
-VI. REFERENCES BIBLIOGRAPHIQUES 25
-LISTE DES ANNEXES
Annexe I : Clonage d’un produit PCR dans un plasmide pGEM-T easy ... - 28 - Annexe II : Extraction d’ARN de fruits frais ... - 30 - Annexe III : Description des amorces... - 32 -
LISTE DES ILLUSTRATIONS
Figure 1: Métabolisme du fructose dans le fruit de la pêche. ...3
Figure 2 : Position approximative de 28 gènes majeurs cartographiés sur la carte de référence des Prunus...4
Figure 3 : Distribution des individus selon leur teneur en fructose et glucose ...5
Figure 4 : Cinétique du rapport fructose/glucose chez les individus C203, C227, C216 et C207...5
Figure 5 : Etude de la dispersion des teneurs en différents sucres dans les deux classes phénotypiques ...5
Figure 6 : Les fruits de Summergrand , P. davidiana et d’un individu de la BC2 ...7
Figure 7 : Schéma d'obtention de la population d'étude ...7
Figure 8 : Rapport fructose sur glucose pour les 4 individus BC2 choisis pour l’étude...7
Figure 9 : Distribution des teneurs en fructose à maturité dans la BC2 ...12
Figure 10 : Distribution du rapport fructose/glucose dans la BC2 ...12
Figure 11: Détection de QTL sur le groupe de liaison 1...12
Figure 12 : Localisation du locus (FRU) contrôlant le caractère « avec » ou « sans » fructose ...13
Figure 13 : Localisation des séquences homologues des EST Prunus sur le génome d'A. thaliana ...13
Figure 14 : Expression relative du gène SDH-a...16
Figure 15 : Activité relative de la SDH ...17
Figure 16 : Polymorphisme de longueur mis en évidence pour la FRK-b...17
Figure 17 : Cartographie du candidat FRK-b (FRK) sur le groupe de liaison 1 de la BC2 ...18
Figure 18 : Alignement des séquences de FRK-b sur la zone 900-1293 ...19
Figure 19 : Alignement de la FRK-b avec les fructokinases homologues d'autres espèces végétales...19
Figure 20 : Alignement des séquences protéiques des différents allèles de la FRK-b ..19
Figure 21 : Alignement des séquences protéiques des différents allèles de la PGI-b...20
Figure 22 : Alignement de la PGI de référence avec les PGI homologues d'autres espèces végétales. ...20
Figure 23 : Localisation du candidat PFK-b (PFk) sur le groupe de liaison 3 de l'abricotier Goldrich ...22
Tableau 1: Fréquences génotypiques théoriques attendues dans la population BC2...7
Tableau 2: EST localisés au niveau du marqueur AG116 ...8
Tableau 3 : Composition du Mix PCR de base...9
Tableau 4 : Composition du Mix de RT-PCR (Transcription inverse)...10
Tableau 5 : Composition du Mix de qPCR...10
Tableau 6 : Composition du Mix de dosage enzymatique...11
Tableau 7 : Séquences d'A. thaliana homologues aux EST Prunus au niveau du marqueur AG116 ...13
Tableau 8: Séquences de M. truncatula homologues aux EST Prunus au niveau du marqueur AG116 ...14
Tableau 9 : Synthèse de la recherche de candidats dans les bases de données...14
Tableau 10 : Synthèse des résultats de recherche de polymorphisme de longueur ...15
ABREVIATIONS
ADN : Acide désoxyribonucléique ARN : Acide ribonucléique
BC2 : Back-cross
Bp (base pairs): paires de bases cM : CentiMorgan
EST (Expressed sequence tag) : Etiquette de séquence exprimée FRK: Fructokinase
Fru : Fructose
GDR : Genome Databank for Rosaceae Glu : Glucose
MF : Masse fraiche Pase : Phosphatase
PCR (Polymerase Chain Reaction) : Réaction de polymérisation en chaines PFK: Phosphofructokinase
PGI: Phosphoglucose-isomérase
qRT-PCR (quantitative Reverse Transcriptase PCR ) : PCR quantitative en temps réel après RT
QTL (Quantitative trait locus) : Locus impliqué dans un caractère quantitatif RT (Reverse transciption) : Transcription inverse
SDH: Sorbitol déshydrogénase
SIM (Simple Interval Mapping) : Cartographie simple d’intervalles SOX : Sorbitol oxydase
- 1 -
I.
Introduction
Avec 15 508 hectares de vergers et une production ayant atteint en 2007 près de 365 000 tonnes (données FAO), la pêche est la troisième production fruitière française après la pomme et le raisin. La plupart des vergers de pêchers se trouvent dans le Sud-Est du pays.
La qualité gustative des pêches est un enjeu majeur pour les différents acteurs de la filière fruits (producteurs, coopératives de collecte, commerçants…). En effet, le consommateur est de plus en plus exigeant sur la qualité des produits qu’il consomme, une qualité sous laquelle le consommateur regroupe tout un ensemble de critères variés, depuis la couleur du fruit, sa taille, son goût, la texture de sa chair, jusqu’à des exigences en terme de durée de conservation.
Mais ce concept de qualité est complexe et les préférences varient suivant les consommateurs. L’un préfèrera un fruit légèrement acidulé alors qu’un autre préfèrera un fruit doux. Cette difficulté à définir la qualité se retrouve dans les programmes d’amélioration qui peinent à prendre en compte l’ensemble des facteurs de qualité voulus par le consommateur du fait de la complexité de leur contrôle génétique et de l’influence de l’environnement.
Pour comprendre ce qui détermine la composition des pêches et donc leur qualité, les chercheurs de l'INRA étudient la croissance des fruits et l'accumulation des sucres et des acides, en croisant des approches d’écophysiologie et de génétique.
L’élaboration de la qualité des fruits résulte de l’interaction de nombreux processus au sein de l’arbre. De plus, elle dépend des pratiques culturales, du climat et du génome. Afin de mieux analyser cette triple influence et de comprendre l’élaboration de la qualité, des expérimentations sont couplées à une approche de modélisation. Cette dernière permet de relier les connaissances sur la croissance des différents organes, d’appréhender les circulations dans l’arbre, de comprendre les relations de compétition au sein de l’arbre. Cette approche intègre aussi les connaissances sur les processus d’élaboration de la qualité afin de raisonner, plutôt que par critères séparés, en « profil de qualité » tenant compte de l’antagonisme ou au contraire de la concordance entre les différents processus à l’œuvre dans l’arbre. La modélisation doit également permettre d’étudier l'effet sur la qualité des techniques de culture : éclaircissage des fruits, irrigation, taille.... Enfin, l’intégration d’une dimension génétique dans les modèles permettra de comparer des cultivars et d’analyser les interactions génotype x environnement. Ainsi, les modèles pourront être utilisés pour la sélection variétale en faveur de la qualité.
Ce stage s’inscrit dans une démarche visant à identifier les bases génétiques et moléculaires de la qualité des fruits du pêcher.
- 2 -
II.
Synthèse bibliographique
Le pêcher (Prunus persica (L.) Batsch) est une espèce d'arbre fruitier de la famille des
Rosaceae, cultivée pour son fruit comestible, la pêche. La pêche fait partie des fruits dits
climactériques.
II.1. La qualité de la pêche
La plus importante qualité d’un fruit est sa saveur, et dans la majorité des fruits les préférences en matière de saveur sont dominées par la douceur (Kanayama, 1998). Cette douceur est le fait des sucres contenus dans le fruit.
En effet, ce sont les concentrations en sucres et en acides qui déterminent pour une part importante la qualité de la pêche. Ces concentrations dépendent de trois processus, tous liés à la croissance du fruit : les apports en éléments carbonés (essentiellement sucres) par la sève, leur transformation par le métabolisme en différents sucres et acides, et la dilution de ces composés dans l’eau du fruit.
La taille (calibre) des pêches est un critère essentiel de leur qualité : les plus gros fruits sont les plus sucrés et les plus riches en acide malique, molécule favorable au plan gustatif. (Quilot et al., 2004)
La pêche est reliée au rameau par son pédoncule. Elle reçoit par ce canal la sève élaborée de la plante. Les produits de cette sève sont utilisés par le fruit pour synthétiser les substances dont il est constitué (arômes, sucres, acides, parois cellulaires …). Cette alimentation carbonée du fruit dépend de l'offre de l'arbre et aussi du flux d'eau, agent transporteur. De plus, elle varie beaucoup dans l’arbre. Ceci explique la variation de qualité observée entre les fruits d’un même arbre et d’un même verger.
C’est aussi par le pédoncule que la pêche reçoit la sève brute, qui lui fournit de l'eau et des éléments minéraux. Les besoins en eau du fruit sont importants : une grande partie de l'eau (50 à 80 %) qu’il reçoit par la sève est transpirée au travers de son épiderme. Le flux d'eau entrant dépend de ce que l’arbre est capable de fournir (état hydrique de l'arbre) et de la demande du fruit. En cas de déficit hydrique, ce flux est ralenti.
II.1.1. Les sucres de la pêche
Saccharose, fructose, glucose, sorbitol et inositol sont les principaux sucres que l’on trouve dans la pêche. Des traces de maltose, galactose et xylose ont aussi été reportées dans le fruit (Wrolstad and Shallenberger, 1981). Environ 50% du poids sec du fruit est constitué de sucres. L’inositol est celui présent en plus faibles quantités : il représente en moyenne seulement 1,1% du contenu total en sucres, alors que le saccharose représente lui plus de 74% des sucres de la pêche (Moriguchi et al., 1990). Celui-ci s'accumule dans le fruit surtout durant le dernier mois, d’autant plus fortement que la croissance du fruit est importante.
Le contenu en sucres des pêches est connu pour être influencé par la position du fruit dans l’arbre (Dann and Jerie, 1988 ; Marini, 1985). La teneur en sucres globaux peut en effet varier de 2 à 12 % selon :
- la position du fruit dans l'arbre : les fruits les plus sucrés se trouvent dans les parties de l’arbre les plus favorables à leur croissance (zones bien éclairées, présentant une surface foliaire suffisamment importante).
- la charge de l’arbre en fruits (Culpepper et Caldwell, 1930 ; Marini, 1985) - la taille ( i.e. l’élagage) de l’arbre (Coe, 1933)
- le climat (Culpepper et Caldwell, 1930 ; Haller and Hardling, 1939 ; Sweeney et
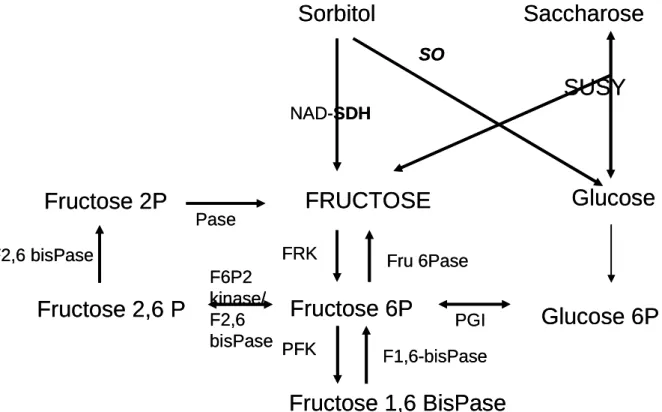
FRUCTOSE
Sorbitol
Saccharose
Glucose
NAD-SDHSUSY
SOFructose 6P
FRK Fru 6PaseFructose 1,6 BisPase
PFK F1,6-bisPaseGlucose 6P
PGIFructose 2,6 P
Fructose 2P
F2,6 bisPase Pase F6P2 kinase/ F2,6 bisPaseFRUCTOSE
Sorbitol
Saccharose
Glucose
NAD-SDHSUSY
SOFructose 6P
FRK Fru 6PaseFructose 1,6 BisPase
PFK F1,6-bisPaseGlucose 6P
PGIFructose 2,6 P
Fructose 2P
F2,6 bisPase Pase F6P2 kinase/ F2,6 bisPase- 3 -
Chez le pêcher comme chez beaucoup d’autres espèces Rosaceae, le sorbitol est le produit photosynthétique majeur et la principale forme de carbone circulante, devant le saccharose (Biesleski, 1982). Selon Moing et al., (1997), la concentration en sorbitol dans le phloème du pêcher est ainsi environ 4 fois supérieure à la concentration en saccharose.
De façon générale, la quantité de sucres contenue dans un fruit varie selon l’année et le climat mais la composition relative en sucres ne varie pas. Les contenus en sucres sont propres à chaque cultivar et peuvent varier d’un cultivar à l’autre (Moriguchi et al., 1990 ; Brooks et al., 1993). Une étude sur la maturité des fruits a révélé qu’il n’existait pas de changement significatif des teneurs en glucose, fructose et sucres totaux durant la maturation du fruit sur l’arbre (Brooks et al., 1993). Par contre, l’acidité et le pourcentage en sorbitol diminuent pendant que le rapport sucre/acide et le pourcentage de saccharose augmentent avec l’avancement de la maturation (Brooks et al., 1993).
La douceur apportée par les trois sucres principaux que sont saccharose, glucose et fructose est différente (Kanayama, 1998). Le fructose a été rapporté comme étant presque 2 fois plus doux que le saccharose (Doty, 1976), alors que le pouvoir sucrant du glucose est plus faible que celui du saccharose (Panghorn, 1963 ; Yamaguchi et al., 1970). Robertson et Meredith (1988) ont établi que les fruits de « haute qualité » contenaient un fort pourcentage de fructose et de plus faibles pourcentages en glucose et sorbitol que les fruits dits de « faible qualité ». Ainsi, les pêches les plus généralement consommées issues de variétés commerciales sont très riches en fructose. Leur teneur en fructose est en général équivalente à celle en glucose (G/F≈1). La modification de la composition en sucres pourrait être utilisée de manière à améliorer la qualité des fruits (Kanayama, 1998).
II.1.2.Le fructose et métabolisme du fructose
Parmi les trois sucres dits « majeurs » que sont le saccharose, le glucose et le fructose, le fructose présente le plus fort pouvoir sucrant (Kanayama et al., 2005). Sa concentration est le facteur qui affecte le plus le goût du fruit. (Schaffer et al., 1999)
Moriguchi (1990) a relevé des différences significatives dans la composition en sucres de pêches issues de cultivars différents. La teneur en fructose est plus faible chez les cultivars de type sauvage que chez les cultivars commerciaux de consommation courante. Certaines pêches de type sauvage ne contiennent que très peu de fructose (0-1 mg.g-1 MF), alors que les pêches commerciales contiennent 10 fois plus de fructose avec un taux moyen de 10 mg.g-1 MF. Les teneurs en glucose et sorbitol sont malgré tout équivalentes pour les deux types de pêches et à tous les stades physiologiques. Par contre, la teneur en saccharose des pêches commerciales est en générale très supérieure à celle des pêches sauvages. Ces observations ont été renouvelées plus tard par l’équipe de Kanayama (2005) qui a elle aussi relevé ce déficit en fructose chez des cultivars de type sauvage.
Au niveau métabolique, le fructose (Figure 1) est synthétisé à partir du sorbitol par la NAD-SDH puis phosphorylé en fructose-6-phosphate par une fructokinase (Yamada et al., 2001). Chez la pêche, comme chez la pomme et la poire, le sorbitol est par ailleurs converti en glucose par la sorbitol oxydase (SOX).
Etant au centre d’un métabolisme carboné très complexe, un déséquilibre dans l’expression des différentes enzymes intervenant de près ou de loin dans les voies de biosynthèse du fructose serait susceptible de provoquer un déficit en fructose (Kanayama et
al., 2005).
Toujours selon Kanayama (2005), les enzymes, Fructokinase, Fructose-6-Phosphatase et NAD-SDH peuvent ainsi être responsables de variations dans la teneur en fructose puisque le fructose constitue soit le substrat soit le produit de chacune de ces enzymes. La Phosphoglucose-isomérase qui catalyse l’interconversion entre Fructose-6-Phosphate et Glucose-6-Phosphate peut également affecter le ratio fructose/glucose.
Figure 2 : Position approximative de 28 gènes majeurs cartographiés chez différentes populations d’abricotiers (bleu), de pêchers (orange), d’amandiers ou de pêcher x amandier (jaune) et de cerisiers (vert) sur la carte de
référence des Prunus.
Les abréviations correspondent aux gènes suivants : Y, couleur de la chair de la pêche ; B, couleur des pétales des croisements amandier x pêcher ; sharka, résistance au virus ; B, couleur de la fleur d’amandier x pêcher ; M, résistance
aux nématodes ; D, dureté de la coque de l’amande ; DI, fleur double ; Cs, couleur de la chair autour du noyau ; Ag, couleur des anthères ; Pcp, polycarpel ; Fc, couleur de la fleur ; Lb, date de floraison ; F, adhérence de la chair au noyau ; D, abscence d’acidité des fruits ; Sk, amerture de l’amande ; G, pubescence de la peau du fruit ; NI, forme des feuilles, Dw,
nanisme des plantes ; Ps, stérilité mâle ; Sc, couleur de la peau du fruit ; Gr, couleur des feuilles ; S*, forme du fruit ; S, autoincompatibilité ; Ma, résistance aux nématodes ; E, forme de la glande de la feuille ; Sf, résistance au mildiou.
- 4 -
Dans son étude Kanayama (2005) a mis en évidence le fait que les cultivars de type commerciaux, riches en fructose, présentent une activité de l’enzyme SDH nettement supérieure à celle mesurée chez les cultivars sauvages. La SDH serait donc une enzyme clé du métabolisme du fructose chez la pêche.
II.1.3. Le contrôle génétique de la qualité
L’étude du contrôle génétique de la qualité a fait l’objet de nombreuses études. Dans certains fruits, particulièrement chez la tomate, des QTLs (Quantitative Trait Loci) de qualité contrôlant le contenu en composés solubles ont été détectés (Osborn et al., 1987 ; Paterson et al., 1988 ; Tanksley and Hewitt, 1988 ; Garvey and Hewitt, 1992). Chez la pêche, Dirlewanger (1999) a procédé à l’identification de QTL de caractères de qualité à partir de la population de cartographie Ferjalou Jalousia x Fantasia.
De nombreux QTLs de caractères de qualité ont ainsi été cartographiés notamment le poids des fruits, leur acidité et leurs teneurs en sucres (saccharose, glucose, fructose, sorbitol). La détection de nombreux QTLs à effets assez faibles et leur instabilité inter-annuelle souligne la complexité des processus d’élaboration de la qualité et l’influence de l’environnement (Dirlewanger et al., 1999).
La carte de référence du genre Prunus (TxE) a été réalisée à partir d’une descendance F2 issue du croisement d’un amandier (cv Texas) et d’un pêcher (cv Earlygold). La carte actuelle est composée de 562 marqueurs couvrant 519 centiMorgan (cM). La densité moyenne est de 0.92 cM par marqueur.
Une carte générale, dérivée de cette carte de référence, présente la position de 28 gènes majeurs affectant les caractères agronomiques de différentes espèces diploïdes (x=8) du genre Prunus (amandier, pêcher, abricotier, cerisier, et espèces sauvages) (Dirlewanger et
0 10 20 30 40 0 1 0 2 0 3 0 4 0
Teneurs en hexose à maturité
glucose (mg/g MF) fr u c to s e ( m g /g M F ) BC2 DAV SG ZE
Figure 3 : Distribution des individus selon leur teneur en fructose et glucose
100 150 200 250 0 1 0 2 0 3 0 4 0 jours julliens ra p p o rt f ru c to s e /g lu c o s e t e n e u rs e n h e x o s e s ( m g /g M F ) C203 100 150 200 250 0 1 0 2 0 3 0 4 0 jours julliens ra p p o rt f ru c to s e /g lu c o s e t e n e u rs e n h e x o s e s ( m g /g M F ) C227 100 150 200 250 0 1 0 2 0 3 0 4 0 jours julliens ra p p o rt f ru c to s e /g lu c o s e t e n e u rs e n h e x o s e s ( m g /g M F ) C207 100 150 200 250 0 1 0 2 0 3 0 4 0 jours julliens ra p p o rt f ru c to s e /g lu c o s e t e n e u rs e n h e x o s e s ( m g /g M F ) C216 glu f ru 100 150 200 250 0 .0 0 .5 1 .0 1 .5 100 150 200 250 0 .0 0 .5 1 .0 1 .5 100 150 200 250 0 .0 0 .5 1 .0 1 .5 100 150 200 250 0 .0 0 .5 1 .0 1 .5
Figure 4 : Cinétique du rapport fructose/glucose chez les individus C203, C227, C216 et C207
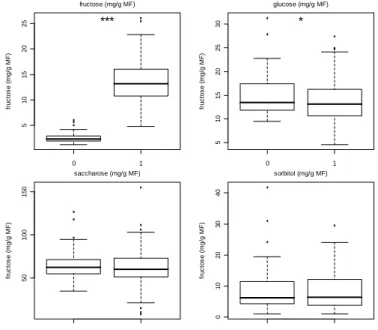
0 1 5 1 0 1 5 2 0 2 5 fr u c to s e ( m g /g M F ) fructose (mg/g MF) *** 0 1 5 1 0 1 5 2 0 2 5 3 0 fr u c to s e ( m g /g M F ) glucose (mg/g MF) * 0 1 5 0 1 0 0 1 5 0 fr u c to s e ( m g /g M F ) saccharose (mg/g MF) 0 1 0 1 0 2 0 3 0 4 0 fr u c to s e ( m g /g M F ) sorbitol (mg/g MF)
Figure 5 : Etude de la dispersion des teneurs en différents sucres dans les deux classes phénotypiques (0 « sans » et 1 « avec » fructose)
- 5 -
II.2.Problématique
Au sein d’une population interspécifique de pêcher (appelée BC2), issue de croisements de parents à caractères très contrastés : 1 génotype appartenant à l’espèce sauvage Prunus
davidiana et 2 variétés commerciales de pêcher (Prunus persica) ont été distingués deux
types de phénotypes bien distincts. L’un présente des teneurs en glucose et fructose équivalentes (cas typique des pêches commerciales), et l’autre un fort déficit en fructose par rapport au glucose (rapport fructose/glucose < 0.5) (Figure 3). Les individus déficitaires en fructose présentent en moyenne 4 à 10 fois moins de fructose que les individus présentant des teneurs normales en fructose. Ce rapport très contrasté entre génotypes reste constant tout au long du développement du fruit (Figure 4).
Comme indiqué précédemment et comme le montre la figure 5, le taux des autres sucres (glucose, saccharose et sorbitol) est relativement constant dans la population BC2 si l’on compare les individus déficitaires en fructose aux autres. Seule une légère diminution du taux de glucose semble accompagner le déficit en fructose.
Sur les 180 individus composant la population d’étude, 39 individus, soit près d’1/4 de la population, présentent ce déficit en fructose. Compte-tenu du schéma d’obtention de la population BC2, la fréquence des individus avec peu de fructose laisse penser que ce caractère serait contrôlé par un gène majeur et que ce serait le parent sauvage non récurrent
P. davidiana qui transmettrait l’allèle responsable du déficit. P. davidiana ne semble pas
présenter de déficit en fructose mais les teneurs en glucose et fructose sont tellement faibles par rapport aux individus de la population BC2 et aux cultivars commerciaux (Summergrand et Zephir), qu’il convient d’envisager une responsabilité de P. davidiana dans ce phénotype.
De précédents travaux réalisés sur le sujet ont d’ores et déjà permis d’identifier un locus majeur contrôlant le rapport fructose/glucose sur le groupe de liaison 1 (Quilot, 2004).
Les données disponibles sur le pêcher sont actuellement en plein essor avec le développement de bases de données spécialisées Prunus, comme le Genome Databank for Rosaceae (GDR), ou encore la base de données ESTree, regroupant les connaissances sur les génomes des espèces d’arboriculture fruitière. Tout cela, associé au développement à plus grande échelle des bases de données et techniques de biologie moléculaire, permet d’envisager et de lancer des recherches de plus en plus poussées sur le contrôle génétique de caractères d’intérêt chez le pêcher.
Ce projet a pour ambition d’identifier le ou les gène(s) responsable(s) du phénotype « peu de fructose » observé dans une population assimilable à une pseudo-back-cross 2 et de déterminer sa (leur) fonction.
Un locus majeur contrôlant le rapport fructose/glucose ayant été détecté sur le groupe de liaison 1, l’objectif est d’identifier le gène à ce locus et son déterminisme génétique.
Il pourrait tout simplement s’agir d’un gène codant une des enzymes directement impliquées dans la synthèse, la dégradation, ou le stockage du fructose ou bien plus largement de gènes de régulation qui interviendraient sur l’ensemble du métabolisme des sucres et modifieraient ainsi l’équilibre final glucose-fructose dans le fruit.
- 6 -
II.3.Démarche
Pour répondre à cette problématique, l’approche « gène candidat » a été choisie. Cette démarche consiste à proposer des séquences nucléotidiques connues, appelées « gènes candidats », dont la fonction ou position pourrait correspondre au gène majeur ou au QTL auquel on s’intéresse. L’hypothèse sous-jacente est qu’il existe un polymorphisme dans le gène candidat qui peut être responsable de la variation phénotypique observée.
Cette approche comprend trois étapes chronologiques. Tout d’abord, des gènes candidats sont proposés sur la base d’études physiologiques ou moléculaires (gènes candidats fonctionnels ou structurels) ou sur la base de données de liaisons génétiques (tous les gènes liés à un locus sont des gènes candidats positionnels). Puis on recherche un polymorphisme moléculaire afin de localiser les gènes candidats sur une carte génétique (tout gène candidat non lié au locus d’intérêt est rejeté). Ces deux stratégies sont parallèles et complémentaires. Enfin la validation du rôle du gène candidat repose sur des approches différentes qui peuvent nécessiter l’utilisation de méthodes variées allant de l’enzymologie à l’expression de gènes.
Les voies métaboliques liées au caractère d’intérêt étant partiellement connues chez la pêche, mais de façon plus complète chez de nombreuses autres espèces de rosacées, les gènes candidats peuvent être choisis parmi les gènes impliqués dans ces voies, gènes codant des enzymes ou gènes de régulation. Le nombre de gènes séquencés chez la pêche limite cette étape. Néanmoins, le nombre de gènes ou d’EST séquencés croît rapidement chez un grand nombre d’espèces. Par ailleurs, l’analyse du transcriptome par des approches à haut débit (puces à ADN), en étudiant simultanément un grand nombre d’ARNm différentiellement exprimés (Wang et al., 1999, chap 9), est une source de gènes candidats fonctionnels, comme cela a déjà été démontré chez la fraise (Aharoni et al., 2000).
Figure 6 : Les fruits de Summergrand , P. davidiana et d’un individu de la BC2 (Source : Quilot, données personnelles)
Prunus davidiana (P1908) X Summergrand
SD40 X Summergrand
SD
BC1 X Zéphir
BC2
Figure 7 : Schéma d'obtention de la population d'étude
Tableau 1: Fréquences génotypiques théoriques attendues dans la population BC2
C203 0 1 0 2 0 3 0 2001 2002 2005 2007 fr uc tos e (m g/ g M F ) C227 C216 0 10 20 30 0 1 0 2 0 3 0 C207 0 10 20 30 glucose (mg/g MF)
Figure 8 : Rapport fructose sur glucose pour les 4 individus BC2 choisis pour l’étude
Ze2 S2 Ze2 S1 Ze2D1 Ze2 Ze1 S2 Ze1 S1 Ze1 D1 Ze1 Zéphir S2 S1 D1
BC2
BC1 Ze2 S2 Ze2 S1 Ze2D1 Ze2 Ze1 S2 Ze1 S1 Ze1 D1 Ze1 Zéphir S2 S1 D1BC2
BC1⅛
¼
⅛
⅛
¼
⅛
¼
½
¼
½
½
⅛
¼
⅛
⅛
¼
⅛
¼
½
¼
½
½
- 7 -
III.
Matériel et Méthodes
III.1. Matériel végétal
Population d’étude
Le matériel végétal utilisé dans cette étude est issu des programmes de sélection menés en Avignon, pour l’amélioration de la résistance à plusieurs parasites du pêcher : la cloque, la sharka, l’oïdium et le puceron vert. Ce matériel est issu de croisements de parents à caractères contrastés : le parent sauvage, clone P1908 de l’espèce Prunus davidiana source de résistance, qui présente une très faible valeur agronomique, et l’autre parent, une variété commerciale de nectarine à chair jaune, Summergrand® (Prunus persica). (Figure 6)
A partir du croisement entre le clone P1908 et la variété Summergrand®, une première génération F1, appelée SD, a été obtenue. Parmi cette descendance, cinq hybrides (dont l’hybride SD40) présentant un bon niveau de résistance à l’oïdium (Spaerotheca pannosa var ; persicae) ont été sélectionnés. Un rétrocroisement a ensuite été effectué entre SD40 et la variété Summergrand® pour donner une famille BC1. A partir de cette population BC1, un mélange de pollen a été réalisé à partir des individus ayant un niveau de résistance très élevés à l’oïdium et ceux au contraire, extrêmement sensibles à l’oïdium. Ce mélange de pollen a servi à féconder la variété commerciale Zéphir®, nectarine à chair blanche. (Figure 7)
C’est cette population BC2, parmi laquelle nous avons pu distinguer deux sous familles en fonction du contenu en fructose des fruits, qui a fait l’objet de notre étude. Si on considère que les allèles proviennent soit de Prunus persica, soit de Prunus davidiana, cette population est semblable à une population BC2, et sera considérée comme telle par la suite, par souci de concision. En fait, cette population diffère d’une vraie BC2 par le fait que les parents persica utilisés pour produire les populations BC1 et BC2 ne sont pas identiques, bien que proches en comparaison à P. davidiana. De plus, malgré le niveau élevé de consanguinité chez les cultivars de pêchers, ces derniers sont tout de même souvent partiellement hétérozygotes (Aranzana et al., 2003). Les fréquences génotypiques théoriques, attendues dans la population BC2, sont détaillées dans le tableau 1.
Individus d’intérêt choisis pour cette étude
Pour répondre à notre question, 4 génotypes de la BC2 ont été choisit pour leurs teneurs contrastées en fructose, deux présentant des teneurs en glucose et fructose équivalentes (C203 et C227) et deux autres présentant un déficit en fructose par rapport au glucose (C216 et C207). (Figure 8)
Ces 4 génotypes sont considérés comme représentatifs des variations observées dans la population.
III.2. Méthodes
III.2.1. Cartographie et analyse QTL
Le logiciel MapMaker v3.0 (Lander et al., 1987) a été utilisé pour réaliser la carte génétique avec une fraction recombinante maximum de 0.3 et un LOD score minimum de 3.
La détection de QTL a été réalisée en utilisant la technique de cartographie d’intervalles (Interval mapping) avec le logiciel de détection QTL Cartographer software (Basten et al., 2001).
La détection de QTL est basée sur la recherche systématique de déséquilibres de liaison entre des locus marqueurs et les locus contrôlant les caractères quantitatifs ou QTLs
Tableau 2: EST localisés au niveau du marqueur AG116
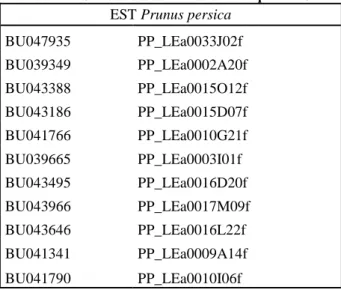
EST Prunus persica BU047935 PP_LEa0033J02f BU039349 PP_LEa0002A20f BU043388 PP_LEa0015O12f BU043186 PP_LEa0015D07f BU041766 PP_LEa0010G21f BU039665 PP_LEa0003I01f BU043495 PP_LEa0016D20f BU043966 PP_LEa0017M09f BU043646 PP_LEa0016L22f BU041341 PP_LEa0009A14f BU041790 PP_LEa0010I06f
- 8 -
(Quantitative Trait Loci). Il s’agit de mettre en évidence des corrélations statistiques entre un locus marqueur et un caractère quantitatif. Si la corrélation entre le caractère quantitatif et le locus testé est significative, alors il existe un déséquilibre de liaison entre le locus marqueur et le QTL.
La représentation des résultats de cartographie sous la forme d’une carte génétique a été réalisée grâce au logiciel MapManager.
Les données phénotypiques à disposition regroupent des mesures réalisées sur 3 ans de quantification des teneurs des différents sucres chez chacun des individus de la population BC2.
III.2.2. Recherche de gènes candidats dans les bases de données
Identification de gènes candidats de fonctionL’identification des gènes candidats a tout d’abord été menée par la recherche dans les voies métaboliques du fructose, d’enzymes pouvant par leur activité synthétiser ou dégrader le fructose et donc pouvant par une inactivation ou sur-activation provoquer des variations du contenu en fructose.
Une fois ces enzymes identifiées, toutes les séquences nucléotidiques se rapportant à ces candidats ont été recherchées : dans un premier temps de façon directe (séquences annotées) par interrogation des bases de données généralistes (NCBI) ou spécialisées Prunus (GDR, EStree) à l’aide de mots clés, puis dans un second temps par recherche de similarité entre séquences d’une même enzyme chez deux espèces différentes. Les séquences connues chez la pomme (Malus pumila) ou la poire (Pyrus communis) ont été comparées à l’aide du logiciel Blast à l’ensemble de la base de données Prunus. De ces interrogations des bases de données sont sorties des séquences isolées (singlet) ou groupées (contigs) pouvant correspondre directement ou par homologies avec les séquences d’autres espèces à la séquence du gène codant l’enzyme candidate chez le pêcher.
Identification de gènes candidats de position - Recherche de candidats par microsynténie avec Arabidopsis thaliana et Medicago truncatula
Le choix de gènes candidats peut reposer sur leur localisation génétique. On parle alors de gènes candidats positionnels car tous les gènes situés à proximité du locus à caractériser deviennent des candidats.
Le concept de synténie se base sur le principe de conservation de l’ordre des gènes ou des marqueurs entre les cartes ou séquences de génomes de plantes différentes.
Sur le groupe de liaison 1, au niveau du locus d’intérêt se trouvent 11 EST cartographiées sur la carte de référence Prunus TxE. Leur liste est donnée dans le tableau 2.
Les EST cartographiées au niveau du locus d’intérêt sont comparées à la base de données
Arabidopsis (arabidopsis.org) et Medicago (medicago.org), de façon a trouver les
homologues de ces EST pêcher, chez Arabidopsis thaliana et Medicago truncatula. Une fois identifiées, chaque série d’EST est localisée sur le génome soit d’Arabidopsis, soit de
Medicago. La localisation des EST homologues sur le génome d’Arabidopsis est réalisée à
l’aide de l’outil interactif « Chromosome Map Tool » disponible sur le site internet regroupant toutes les données concernant Arabidopsis (arabidopsis.org). Dans le cas où ces EST colocalisant chez les Prunus, colocaliseraient aussi chez Arabidopsis et/ou Medicago, nous serions en mesure de conclure à une bonne conservation de la structure du génome aux environs de ce locus. Cela nous permettrait par la suite de chercher chez Arabidopsis et/ou
Medicago si dans cette zone se trouvent des gènes identifiés chez ces espèces modèles ayant
un rapport avec le métabolisme des sucres et plus particulièrement du fructose. Les gènes liés au métabolisme des sucres ou plus précisément du fructose dans les génomes d’Arabidopsis ou Medicago au niveau d’une zone qui serait définie par les EST homologues
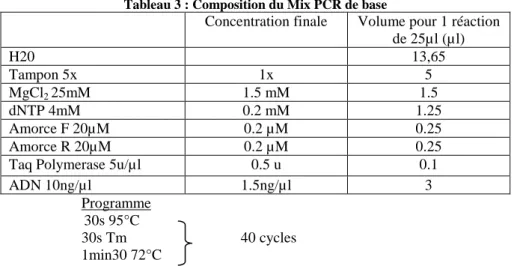
Tableau 3 : Composition du Mix PCR de base
Concentration finale Volume pour 1 réaction de 25µl (µl) H20 13,65 Tampon 5x 1x 5 MgCl2 25mM 1.5 mM 1.5 dNTP 4mM 0.2 mM 1.25 Amorce F 20µM 0.2 µM 0.25 Amorce R 20µM 0.2 µM 0.25
Taq Polymerase 5u/µl 0.5 u 0.1
ADN 10ng/µl 1.5ng/µl 3
Programme 30s 95°C
30s Tm 40 cycles 1min30 72°C
- 9 -
de notre locus d’intérêt chez le pêcher, constitueraient alors des candidats sérieux à identifier chez le pêcher.
III.2.3. Caractérisation des gènes candidats
L’étude des gènes candidats passe par la détection de polymorphisme (de longueur ou de séquence) et leur cartographie. Cette étape permet de rejeter tous les gènes candidats qui ne coségrègeraient pas avec le locus d’intérêt.
III.2.3.1. Design d’amorces
Le design des amorces a été réalisé à l’aide du logiciel Primer3. Les paramètres de définition des amorces ont été les suivants : taille de l’amorce entre 18 et 23 bases, une température d’hybridation (Tm) entre 55 et 62°C et un pourcentage en G+C supérieur à 50%. Plus l’amorce sera longue, et plus le pourcentage en G+C sera élevé, plus l’hybridation des amorces avec la séquence à amplifier sera spécifique. Pour la recherche d’un polymorphisme de longueur ou de séquence, on recherche un produit d’amplification long (en fonction des séquences disponibles) alors que pour des mesures d’expression de gènes par qPCR, on recherche des amorces définissant un produit de 120-180pb.
III.2.3.2. Polymorphisme de longueur de séquence
Un polymorphisme de longueur de séquence, pouvant être dû à l’insertion ou la délétion d’un fragment du gène, est révélé par électrophorèse sur gel d’agarose des produits d’amplification synthétisés à partir d’amorces spécifiques des extrémités 5’ et 3’ des gènes candidats.
La composition de base des mix PCR est détaillée dans letableau 3. Une variation de la concentration en agarose des gels d’électrophorèse permet de faire varier le degré de séparation des bandes. Pour séparer de petites bandes très proches il conviendra généralement d’augmenter la concentration en agarose (supérieure à 2%), alors que la séparation de bandes longues nécessitera une concentration plus faible (inférieure à 2%).
III.2.3.3. Polymorphisme de séquence nucléotidique
Pour les gènes ne présentant pas de polymorphisme de longueur, et afin d’isoler les deux allèles de chaque gène, un clonage en vecteur pGEM-T® a été réalisé. Le protocole de clonage utilisé est détaillé dans l’annexe I.
Le séquençage des gènes candidats a été réalisé par les prestataires MWG et GATC. Les séquences ainsi obtenues ont été analysées avec le logiciel Genalys et comparées à l’aide de celui-ci ou des logiciels d’alignements de séquence comme BLAST, ClustalW et Multalin.
Les analyses de séquence ont permis de mettre en évidence des polymorphismes de type insertions, délétions, substitutions.
III.2.3.4. Analyses protéomiques
Les traductions des séquences nucléotidiques ont été réalisées à l’aide du serveur BCM, les comparaisons à l’aide des logiciels ClustalW et Multalign.
Les détections de domaines ont été réalisées à l’aide du serveur Blast du NCBI, liée à la base de données des domaines conservés (« Conserved domains »). Les prédictions de structure secondaire des protéines ont été réalisées à l’aide du serveur GOR4.
Tableau 4 : Composition du Mix de RT-PCR (Transcription inverse)
Concentration finale Volume pour 1 réaction de 50µl (µl) H20 13,75 OligoDT 10µM 0.5 µM 2,5 dNTPs 4mM 1.2 mM 15 ARN 2µg 5 RT buffer AMV 5X 1x 10
RNAsin Promega 40u/µl 50u 1,25 AMV RT 10U/µl Promega 25 u 2,5
Programme 1h30 à 42°C 15min à 70°C 15min 4°C
Tableau 5 : Composition du Mix de qPCR
Concentration finale Volume pour 1 réaction de 20µl (µl) H20 9,8 Tampon 5x 0.5x 2 MgCl2 25mM 3mM 2,5 dNTP 4mM 0.2mM 1 Amorce F 20µM 0.25µM 0,25 Amorce R 20µM 0.25µM 0,25 SYBR Green Lonza 1/15 000 0,2 Taq Polymerase 5u/µl 0.5u/µl 2
ADNc 2 Programme (environ 2h) 2 min à 95°C 20 s à 95°C 20 s à Tm 40 cycles 35 s à 72°C 1 min à 95°C 30 s à Tm cycle de dissociation 30 s à 95°C
- 10 -
III.2.4.Analyse physiologique de l’expression des gènes candidats
III.2.4.1. Mesure de l’expression des gènesExtraction d’ARN
Les extractions d’ARN nécessaires à la quantification des expressions des gènes candidats ont été réalisées suivant la méthode de Chang et al. (1993), optimisée par l’utilisation du kit Nucleon Phytopure Plant DNA extraction (Amersham Biosciences). Le protocole d’extraction ainsi que les tampons et solutions utilisés sont détaillés en annexe II.
Synthèse des ADN complémentaires
Les ADN complémentaires (ADNc) sont obtenus par transcription inverse (ou reverse transcription) après purification et traitement à la DNase des ARN, suivant le protocole fournit par le fournisseur (DNase RQ1, Promega). La composition du mix PCR ainsi que le programme utilisé pour la reverse transcription sont détaillés dans le tableau 4.
PCR quantitative en temps réel
La mesure de l’expression des gènes par PCR quantitative en temps réel ou quantitative real time PCR (qRT-PCR) nécessite l’utilisation de gènes dits de ménages, c'est-à-dire exprimés de la même façon dans des génotypes différents et des conditions différentes, servants à la normalisation des résultats.
Les gènes de ménage utilisés dans de précédentes études d’expression de gènes chez la pêche ont été référencés et testés dans notre cas d’étude. Le choix des meilleurs gènes de ménages est réalisé via l’utilisation du logiciel GenNorm qui établit les gènes les plus stables. Les gènes de ménages retenus dans cette étude pour leur stabilité sont : le facteur d’élongation 1-alpha (Elongation Factor-1-alpha) DW355834 et le facteur d’initiation elF-4-gamma (Initiation factor elF-4-elF-4-gamma) FC861984.
La PCR quantitative est réalisée suivant un procédé simple. Dans le mix réactionnel est incorporé un intercalant d’ADN, le SYBR Green. A la fin de chaque cycle d’amplification, la fluorescence de ce fluorophore est mesurée. La fluorescence est proportionnelle à la quantité d’amplicons présents dans le milieu.
La composition du mix de qPCR et le programme utilisé sont détaillés dans le tableau 5. Les essais sont réalisés avec le Mx3000P™ Real-Time PCR System de Stratagène (Californie, USA).
Le calcul des expressions relatives à partir des données de qPCR a été réalisé grâce à la méthode dite du « ∆∆Ct » dont l’équation est la suivante :
Ct Ct Ct controle candidat Contrôle Candidat Normalisé −∆ −∆∆ ∆ − = = 2 2 2
Le Ct est le cycle à partir duquel le signal est supérieur au bruit de fond de fluorescence, donc le début de la phase exponentielle d’accumulation des amplicons. Le bruit de fond, correspond à la fluorescence de base du SYBR Green.
Le ∆Ct est calculé par division des valeurs de Ct de chaque individu par la valeur de Ct d’un individu choisit comme référence. L’individu de référence choisit dans cette étude est le C207. Le facteur « Contrôle » désigne le gène de normalisation.
Le rapport Candidat/contrôle permet de déterminer les différences d’expression relatives du gène d’intérêt (candidat) par rapport à cet individu de référence.
Tableau 6 : Composition du Mix de dosage enzymatique Concentration initiale Volume pour 2ml Extrait 0,8 Tris HCl pH9,5 1M 0,2 NAD+ 0,01M 0,2 Sorbitol 1M 0,8 H2O Qsp 2ml
- 11 -
III.2.4.2.Mesure de l’activité enzymatique Extraction de l’enzyme
Les fruits matures (mésocarpe) sont broyés dans de l’azote liquide et conservés à -80°C. Les extractions sont menées suivant le protocole établit par LoBianco et Rieger (1998). La SDH est extraite par broyage d’1g de tissu (mésocarpe) dans 4ml de tampon Tris-HCl (0.2M pH9 à 25°C), contenant 20mM de 2-mercaptoéthanol et 8%(v/v) de glycérol. Du tampon Tween 20 (0.1%, v/v) et du polyvinylpolypyrrolidone (1%, w/v) sont ajoutés à l’extraction durant le broyage. Après centrifugation à 3000g pendant 15 minutes, le surnageant est purifié en colonne Sephadex G-25.
Dosage de l’activité enzymatique
L’activité enzymatique de la SDH est estimée en mesurant le changement continu de l’absorbance à 340 nm et 25°C sur un spectrophotomètre multicuves Shimatzu® dans des cuves en quartz. Le logiciel de suite du spectrophotomètre est lancé en mode cinétique, de façon à suivre l’évolution de l’absorbance sur 5 minutes, après ajout de l’extrait enzymatique. On suit la transformation du NAD+ en NADH. La composition du mix de dosage est présentée dans le tableau 6.
fructose (mg/g MF) n o m b re d 'in d iv id u s 0 5 10 15 20 25 0 5 1 0 1 5 2 0 2 5 3 0
Figure 9 : Distribution des teneurs en fructose à maturité dans la BC2 fructose/glucose n o m b re d 'in d iv id u s 0.0 0.2 0.4 0.6 0.8 1.0 1.2 0 2 0 4 0 6 0
Figure 10 : Distribution du rapport fructose/glucose dans la BC2
Figure 11: Détection de QTL par cartographie simple d'intervalles (Simple Interval Mapping) avec QTLCartographer sur le groupe de liaison 1
- 12 -
IV.
Résultats et discussion
IV.1. Cartographie du caractère « sans fructose »
Distribution de la teneur en fructose
La composition en sucres des fruits des individus de la BC2 a été analysée à maturité par HPLC sur plusieurs années (2001, 2002, 2005, 2006). La teneur en fructose au sein de la population BC2 varie de 0 à 27 mg/g MF (Figure 9).La distribution de ce caractère se caractérise par 2 pics bien distincts correspondants aux deux sous-populations d’individus : l’une regroupant les individus présentant des teneurs « normales » en fructose, à peu près autant de fructose que de glucose, et l’autre (moins d’un quart de la population) regroupant les individus avec un fort déficit en fructose par rapport au glucose.
Le rapport fructose/glucose varie de 0,08 à 1,21 (moyenne sur les 4 années) (Figure 10) Il existe toutefois une variabilité assez importante des teneurs en fructose au sein de ces deux sous-populations. Certains individus ont des teneurs en fructose supérieures aux teneurs en glucose. Les teneurs des différents sucres varient d’une année sur l’autre mais la distribution des teneurs en fructose reste dichotomique et le caractère peu de fructose est stable d’une année sur l’autre. De même, ce rapport est maintenu tout au long de la croissance du fruit.
La fréquence des individus avec peu de fructose (moins d’1/4) laisse penser que ce caractère serait contrôlé par un gène majeur et que ce serait le parent sauvage non récurrent
P. davidiana qui transmettrait l’allèle responsable du déficit. Cependant, il est aussi possible
que le déficit en fructose provienne d’un allèle de Summergrand, celui intégré au moment du premier back-cross. Celui-ci s’exprimerait dans la population BC2 et non pas chez Summergrand du fait de sa combinaison avec des allèles de Zéphir.
Détection de QTL
La détection de QTL a été réalisée par cartographie d’intervalles simple aussi appelée Simple interval mapping (QTL Cartographer). Elle a mis en évidence la présence d’un QTL majeur contrôlant la teneur en fructose sur le groupe de liaison 1 entre les marqueurs PC78 et PC102. (Figure 11) Ce QTL explique 54% de la variation phénotypique observée avec un intervalle de confiance allant de 42 à 45.1cM. Ce QTL colocalise avec un autre QTL expliquant 91% de la variation du rapport fructose/glucose observée (intervalle de confiance 44,4-44,8cM). Ce profil appuie donc la thèse d’un gène majeur contrôlant le caractère « sans fructose » et confirme les résultats obtenus par Quilot (2004).
Ce locus peut être le siège soit d’un gène codant une enzyme qui influe directement sur la teneur en fructose des fruits soit d’un gène de régulation ayant une influence sur le métabolisme du fructose en général.
Cartographie d’un marqueur phénotypique
La possibilité de classer notre population en deux sous-populations séparant les individus avec ou sans fructose a permis de cartographier le caractère « sans fructose » comme un marqueur phénotypique. Les individus de la BC2 ont été codés de façon dichotomique : 0 pour les individus déficitaires en fructose et 1 pour les autres. Cette cartographie a permis de localiser un locus sur le groupe de liaison 1 entre les marqueurs PC78 et PC102, à environ 1 cM du marqueur PC102 (Figure 12). La cartographie comme marqueur phénotypique confirme le résultat de l’analyse QTL en précisant la position du gène.
UDP96-018 0.0 AG109 1.5 CFF5 7.2 AG102 12.0 CFF14 24.8 CFF7 29.7 CFF2 31.3 CFF19 35.3 PC78 40.1 FRU 43.8 PC102 46.0 CPPCT027 49.6 PC30 54.1 AG29 62.2 CFM7 62.9 UDP96-005 65.2 PC35 73.0 CFM12 77.1 CFF18 80.5 EPDCU3489 88.7 CPPCT026 89.4 AG44 90.9 FG79 94.7 CFF9 105.1 CPPCT042 106.7 CFM6 108.2 AC18 116.3 BPPCT028 129.3
Figure 12 : Localisation du locus (FRU) contrôlant le caractère « avec » ou « sans » fructose » , sur le groupe de liaison 1 de la BC2
Tableau 7 : Séquences d'A. thaliana homologues aux EST Prunus au niveau du marqueur AG116
EST Prunus persica EST A. thaliana BU047935 PP_LEa0033J02f AT3G16565 BU039349 PP_LEa0002A20f AT5G49020 BU043388 PP_LEa0015O12f AT5G49020 BU043186 PP_LEa0015D07f AT5G49030 BU041766 PP_LEa0010G21f AT5G15950 BU039665 PP_LEa0003I01f AT5G11710 BU043495 PP_LEa0016D20f
BU043966 PP_LEa0017M09f AT1G02090 BU043646 PP_LEa0016L22f AT3G07040 BU041341 PP_LEa0009A14f AT3G06880 BU041790 PP_LEa0010I06f AT4G15900
Figure 13 : Localisation des séquences homologues des EST prunus sur le génome d'A. thaliana
- 13 -
IV.2.Choix des gènes candidats
IV.2.1. Gènes candidats positionnels
Un candidat codant pour une fructokinase (FRK) a été identifié sur le groupe de liaison 1. Cet EST de pêcher (AJ873070), cartographié dans le cadre d’un projet européen de cartographie Prunus appelé Isafruit, a été identifié sur le premier groupe de liaison dans un intervalle de 1.4cM avant le marqueur AG29. Etant non seulement localisé aux abords de notre QTL-Gène majeur, mais en plus faisant partie de la famille polygénique des fructokinases liée au métabolisme du fructose, cet EST constitue un candidat très intéressant à étudier.
Recherche de microsynténie chez Arabidopsis thaliana et Medicago truncatula
Dans la zone du QTL-Gène majeur contrôlant le rapport fructose/glucose se trouve cartographiées 11 EST ancrées au marqueur AG116.
Pour chacune des ces 11 EST Prunus, nous avons recherché les séquences homologues chez Arabidopsis et Medicago. Les blast sur Arabidopsis ont permis de mettre en évidence 9 EST homologues de Prunus dont le détail est présenté dans le tableau 7. Les EST colocalisant chez les Prunus ne colocalisent pas chez Arabidopsis (Figure 13). En effet, bien que plusieurs EST soient cartographiés sur le chromosome 5, leur éclatement sur toute la longueur du chromosome ne permet pas de conclure à une conservation de la structure du génome à ce niveau entre les espèces.
De la même manière chez Medicago, 9 EST homologues des EST Prunus ancrées au marqueur AG116 ont été relevées (Tableau 8). Cependant, peu de ces EST se trouvent être cartographiées sur le génome de Medicago truncatula, ce qui ne permet pas de visualiser et de conclure à une quelconque conservation de la structure des génomes entre les Prunus et
Medicago.
Ainsi, la piste des gènes candidats positionnels par recherche de microsynténie entre les
Prunus et les espèces modèles qui leurs sont les plus proches, ne semble pas pouvoir
permettre de déterminer le gène responsable des variations des teneurs en fructose.
IV.2.2.Gènes candidats fonctionnels
L’étude des voies métaboliques du fructose a conduit dans un premier temps notre attention sur 3 enzymes essentielles: la Sorbitol Dehydrogenase NAD dépendante (SDH), la fructokinase (FRK), la Fructose-6-Phosphatase (F-6Pase). Ces enzymes ont une action directe potentielle sur la teneur en fructose. Pour ces 3 enzymes, plusieurs séquences ont été identifiées.
Pour la Sorbitol déshydrogénase, une séquence de pêcher (AB025969, notée SDH-a) avait déjà été identifiée par Yamada et al. (2001). Cette même séquence a été cartographiée dans le cadre du projet Isafruit sur le groupe de liaison 2. Cette information conduirait à éliminer ce candidat. Cependant, la coexistence de plusieurs copies de gènes codant cette enzyme est possible. Par exemple chez la pomme, la SDH est codée par une famille polygénique comptant 9 gènes, dont 5 exprimés dans le fruit (Nosarzewski et al, 2007). De plus, une étude préalable d’expression de la SDH, réalisée grâce à la puce à ADN µPEACH 1.0 développée à Padoue (Italie), a révélé un différentiel d’expression entre un génotype sans fructose et un génotype avec fructose. Ainsi, les résultats d’expression obtenus avec la puce ont mis en évidence une sur-activation de la SDH chez les génotypes ‘sans fructose’. Ce différentiel d’expression indique que la SDH est impliquée dans les variations de teneurs en fructose. La recherche dans les bases de données a permis de mettre en évidence 5
Tableau 8: Séquences de M. truncatula homologues aux EST Prunus au niveau du marqueur AG116
EST Prunus persica EST M. truncatula Localisation chez
M. truncatula BU047935 PP_LEa0033J02f BT051946 Non cartographié BU039349 PP_LEa0002A20f AC174367 Non cartographié BU043388 PP_LEa0015O12f AC174367 Non cartographié BU043186 PP_LEa0015D07f AC202516 Non cartographié BU041766 PP_LEa0010G21f EF408870 Non cartographié BU039665 PP_LEa0003I01f AC225504| Non cartographié BU043495 PP_LEa0016D20f
BU043966 PP_LEa0017M09f BT052249 Non cartographié BU043646 PP_LEa0016L22f AC135103 Chromosome 3 BU041341 PP_LEa0009A14f
BU041790 PP_LEa0010I06f AC135317 Chromosome 1
Tableau 9 : Synthèse de la recherche de candidats dans les bases de données
Enzyme Appellation simplifiée Cartographie éventuelle AB025969,1 SDH-a Lg2 BU041831 PP_LEa0010K07f SDH-b BU047295 PP_LEa0029H02f SDH-c DW341984 PP_LEc0007G12f SDH-d
BU043570 PP_LEa0016H18f SDH-e
DW351968 PU1_plate43_K15 SDH-f AJ873190 FRK-a AJ873070 FRK-b Lg1 PP_LEa_1_Contig_531 Contig 1068 cluster_1478_contig_1 FRK-c Lg4 AJ833355 Pp-S4_EST1305 FRK-d
BU048165 PP_LEa0034I04f FRK-e
BU046081 PP_LEa0025C01f FRK-f Cluster_1962_contig_1 PP_LEa0006K11f PGI-a Lg5 cluster_1621_contig_1 F80_AJ876212 PGI-b cluster_662_contig_1 cluster_5466_contig_1 PFK-a cluster_860_contig_1 cluster_766_contig_3 PFK-b PP_LEa0001K06f PFK-c Lg2 cluster_1158_contig_1 PFK-d F6P 2-kinase/
F-2,6-bisPase cluster_4000_contig_1 F2K/FbisPase Fructose-bisP aldolase cluster_43_contig_1 PU2_plate42_P15 FbisPald Lg2 PFK Références SDH FRK PGI
- 14 -
nouvelles séquences, identifiées par homologie comme correspondant à des séquences de SDH, notées SDH-b à f.
Pour la Fructokinase, la recherche dans les bases de données a permis d’isoler 5 séquences distinctes les unes des autres, et 1 contig, notés FRK-a à f. Chez la tomate, 4 FRK différentes ont d’ores et déjà été identifiées (Pego et al., 2000 ; German et al., 2004). Les différentes isoformes de fructokinase ne sont pas des formes redondantes de la même enzyme (Gonzali et al., 2001), chaque fructokinase ayant un rôle différent dans le développement de la plante (German et al., 2004). La comparaison avec la base de données GDR a permis de déterminer que parmi ces séquences, le candidat FRK-c (PP_LEa0014B12f compris dans le Cluster_1478_contig_1) est cartographié sur la carte de référence des Prunus TxE sur le groupe de liaison 4. Ce contig ne fera donc pas partie des analyses ultérieures. Le candidat AJ873070, noté FRK-b, a été cartographié, comme dit précédemment, dans le cadre du projet Isafruit sur le groupe de liaison 1.
Pour ce qui est de la Fructose-6-phosphatase, enzyme désignée comme candidate par Suzuki (2001) et Kanayama (2005), il n’a été trouvé que peu de traces de son existence chez les rosacées et plus largement dans le règne végétal. Cette enzyme n’a visiblement pas encore été isolée. Seules quelques données sur le champignon Lentinus edodes (Kulkarni, 1990) font référence à cette enzyme dont le rôle serait de catalyser la transformation du fructose-6-phosphate en fructose. Une purification de cette enzyme ainsi qu’une recherche de cartographie comparée entre ce champignon et la pêche ou plus largement les rosacées serait à réaliser pour pouvoir par la suite identifier des candidats.
Dans un second temps nous avons élargit nos recherches aux enzymes n’ayant pas d’action directe sur le fructose mais pouvant par leur action orienter le métabolisme vers un déséquilibre des teneurs en fructose : la Phosphoglucose-isomérase (PGI) responsable de l’isomérisation du fructose-6-phosphate en glucose-6-phosphate, la Phosphofructokinase (PFK) responsable de la phosphorylation du fructose-6-phosphate en fructose-1,6-bisphosphate, la Fructose-6-phosphate-2-kinase/Fructose-2.6-bisphosphatase enzyme bi-fonctionnelle responsable de l’interconversion du fructose-6-phosphate en bisphosphate et la Fructose bisphosphate aldolase contrôlant l’entrée du fructose-2,6-bisphosphate dans la voie des trioses phosphate.
Les recherches sur la Phosphoglucose-isomérase ont fait ressortir deux contigs et deux EST. Chacune des deux EST a pu être rattachée à l’un ou à l’autre des 2 contigs notés PGI-a et b. L’EST PP_LEa0006K11f ayant été cartographié sur le groupe de liaison 5 de la carte de référence des Prunus, le contig lui étant associé (Cluster_1962_contig_1) ne constitue donc plus un candidat positionnel valable. Le second contig (PGI-b) fera lui l’objet d’une tentative de cartographie sur notre population.
Pour ce qui est de la Phosphofructokinase, 3 contigs et 1 EST ont été extraits des bases de données, et notés PFK-a à d. L’EST PFK-c (PP_LEa0001K06f) ayant déjà été cartographié sur le groupe de liaison 2, il se trouve donc exclu de la liste des gènes candidats potentiellement responsables des variations phénotypiques observées.
Pour la Fructose-6-phosphate-2-kinase/Fructose-2.6-bisphosphatase, seul 1 cluster (Cluster_4000_contig_1) noté F2K/FbisPase est ressorti de l’exploration des bases de données, sans location connue.
Enfin, pour ce qui concerne la Fructose-bisphosphate aldolase, 1 seul contig (cluster_43_contig_1) a été extrait des bases de données, mais ce dernier a déjà été cartographié sur le groupe de liaison 2.
Le tableau 9 présente une synthèse des résultats ressortis de l’exploration des bases de données par enzyme candidate et des informations sur leur localisation éventuelle.
Tableau 10 : Synthèse des résultats de recherche de polymorphisme de longueur pour les différents candidats Enzyme Candidat C o u p le d 'a m o rc es Taille attendue à partir de la séquence codante (bp) Température (°C) Taille obtenue (bp) Polymorphisme a1 1322 53 2000 NON a2 544 53 1000 NON a3 551 53 700 NON b1 490 Ø Ø Ø b1' 453 Ø Ø Ø c1 572 60 1200 NON c1' 552 60 1200-900 NON d1 535 Ø Ø Ø d1' 522 60 >500 NON SDH-e e1 461 62 850 NON f1 670 Ø Ø Ø f1' 632 Ø Ø Ø FRK-a a1 410 53 <500 NON FRK-b b1 568 53 1500 OUI d1 616 Ø Ø Ø d1' Ø Ø Ø e1 311 Ø Ø Ø e1' 295 Ø Ø Ø FRK-f f1 474 55 <500 NON
PGI PGI-b b1 459 57 <1500 NON
PFK-a a1 1457 58 >2500 NON PFK-b b1 1481 62 3000 NON d1 720 62 1700 NON d1' 760 60 >1000 NON F6P 2-kinase/ F-2,6-bisPase F2K/ FbisPase F2K/ FbisPase-1 759 57 2500 NON PFK-d SDH FRK PFK SDH-a SDH-b SDH-c FRK-d FRK-e SDH-d SDH-f
Tableau 11: Rendement des extractions d'ARN
Génotype Rendement 1ère extraction (ng/g MF) Rendement 2ème extraction (ng/g MF D 424,078 SG 375,63 424,806 C203 182,32 384,512 C227 215,808 245,042 C216 218,724 387,554 C207 154,936 273,866