1
I
I
I
1
1
I
I
1
1
1
1
1
I
I
1
1
1
I
I
I
nts
Au terme de cette étude, on tient à remercie le Bori meæi le toui puissant qui
")us a domé le cowrage et la volonté d'aller jusqu'au bout et de ramener ce
présent travaïl à son u]time poïnt. \\\
r;::-:;;n::c;e~::n:;:;:-::;;ea«m.HammBLabraquimsaencadréa
soute:irui par ces conseilles et ces con:riaissarices dizram toute cette période.
Noustenonsàremercierlesnombresdejuryspou;beurshonorablesprésences
et pour leur conftibution df;ective dans l 'ertrichisseriem de ce mémoiïe et awsi
d'cn/otr accepté d'examïiiier ce modeste travail.
Nous e3cprimom aussi, rios remewcimiet'ïœ st no!l gratitiLdes au Mr.Mokræie
Braddï (Prof iesseur à l'Urtiversité de Béjdïa) pour son aide.
1
Nous remæcierons également tous les enseigrLanjÈ de dépanemem Gértie des
Procédés.
Enftn,nosvïfisremerciememtsàtouslesgensquiàpicontrïbuésdeprésoude
loïn à la réalisation de ce mémoire et surtoan nos f;amilles.
Merci à vous
I
I
I
I
1
1
I
I
I
I
I
1
1
I
I
I
I
I
1
1
I
I
I
1
1
I
1
1
I
1
1
I
I
I
I
I
1
1
I
I
I
I
Dédicace
•edédiecemémoï
AmeschersparentsmamèreFtmonpère
pouleupatienc:,nlceouu=eomue,nlteTsoutienetleu
Amesffères:Walid,Ishak
et
Naceraddine,safemmeetsabe||èpetiteMa|ak
Et à tous les membres de
A tous mes amis
Rachda
I
I
I
I
1
'
I
I
I
I
I
I
I
I
1
1
1
1
I
I
I
Sommaire
Liste des r]gures
Liste des tableaux
lntroduction généra]e ...,... 1
Chai)itre I : Générdités sur l'aliLminiiim
1. Définition d'aluminium ... 3
2. Elaboration de l'aluminium
2. 1. I.e minerai ...,...
2.2. Procédé de fabrication et revalorisation de l'aluminium
3. Propriétés de l'aluminium ... „ ... 6
4. les atouts de l'aluminium ... 7
4. 1 . Légèreté
4.2. Conductivité électrique et thermique ... 7
4.3. Tenue à la corTosion
4.4. Aptitude au traitement de surface
4.5. Diversité des alliages d'aluminium ... ~ ... 8 4.6. Recyclage
Chapitre 11 : Les alliages d'aluminium
1 . Introduction .... „ ... „ ... 9
2. Classification des alliages d'aluminium ... 9
2.1 . Les alliages de moulage 2.2. Les alliages de corroyage
I
I
1
1
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
1
1
3. L'influence des éléments d'alliage ... 14 4. Diagramme d'équilibre des alliages ... 15
5. Les alliages de la série 7000 ... 16
5.1. Les alliages 7000 avec cuivre 5.2. Les alliages 7000 sans cuivre. 5.3. Propriétés de la série 7000
5.4. Domaine d'application de la série 7000
16
16
18 18
Chupitre 111 : corroslon de l'aluminium
1. Introduction ... ~ ... 19
2. Définition de la corrosion ... 19
2.1. I.a corrosion d'aluminium ...
2.2. Les réactions électrochimiques de la corrosion d'àtuminium
3. Les fomes de la cori.osion ... 21
3 . 1 . Corrosion uniforme 3.2. Corrosion localisée.
3.2.1. Corrosion par pique
_.22
3.2.2. Corrosion inter-granulaire ...,....,...,.. 3.2.3. Corrosion par crevasse
3.2.4. Corrosion et dissolution sélective 3.2.5. Corrosion-ffottement
3.2.6. Corrosion sous contrainte 3.2.7. Fragilisation par hydrogène . 3.2.8. Conosion galvanique 22 23 23 24 24 25 25 25
4. Les fomes de corrosion d'aluminium ... 26
5. Protection contre la corrosion ... 27 5.1. Les inhibiteurs ...
I
I
I
I
I
I
I
I
1
1
1
I
1
1
I
I
1
1
I
I
I
5 . 1 . 1 . Définition5.1.2. Propriétés des inhibiteus
5.1.3. Domaine d'utilisation des inhibiteus ... „ 5 .1.4 Conditions d'utilisation des inhibiteurs 5.1.5. Classification des inhibiteuis
5.1.5.1 Par mécanisme réactionnel
5.1.5.2. Par réaction partielle
5.1.5 .3 . Par domaine d'application 5.1.6. Nature des inhibiteus
5,1.7. Mode d'action des inhibiteuis de corrosion 5.1.8. Méthodes d'étude des inhibiteurs de corrosion 5.1.9. Efficacité d'un inhibiteu de corrosion ... 5.1.10. Choix d'un inhibiteu
Chpitre IV : Modes et méthodes opérœtoires
1 . But de travail ..
2. Matériau d'étude
2. 1 . Echmtil]onnage
3. Milieu électrolytique
3.1. Le molybdate de sodium Na2Mo04
4. caractérisation du comportement en comosion
4.1 , Montage expérimentale
4.2. Techniques et conditions expérimentales
4.2. 1. Mesure de potentiel libre de la corrosion
4.2.2. Tracés des coubes intensité-potentiel
27 27 28 28 29 29 30 32 32 33 34 ... 34
1
1
I
I
I
I
I
I
1
1
I
I
1
1
I
I
I
1
1
1
I
4.2.3. Spectroscopie d'impédance électrochimiques « SIE »
5. technique de caractérisation de surface
5.1. Mcroscopie optique
7.2. Microscopie électronique à balayage et analyse EDS
Chapitre V : Résultats et analyses
1 . Caractérisation structurale du matériau ... 44
2. Caractérisation électrochimique.
2. 1 . Effet des chlorures
2. 2. Effet de l'inhibiteu Na2Mo04 . 2.3. Calcul du rendement de l'inhibiteu
3. Analyse physicochjmique de surface
3.10bservationsmacroscopiques...,...61
3. 2 0bservations métallographiques
4. Discussions
- Conclusion générale
- Perspectives et travaux futur ...
- Annexe
I
I
I
I
1
1
1
1
1
1
1
I
1
1
1
I
1
1
1
1
I
Liste des
Œqpme' 1Fîgiire 1-1 : Gisement des roches de bauxite ... 4
Figur¢ 1-2 : Composition de la bauxite en pourcentage ...
Figqre lt3 : Le procédé de
Figurel4 : Leprocédéd'électrolysede l'al-e. |
Chqpü'e 111
... 5
=:::::cc=o:,:n:::: .... :'''' ... ï ' ... :
Æ`ï-/-ïr
Figtire m-3 : Corrosion intergranulaire ...
Figum mi4 : Coztosion cavmeuse ...``
Figure m-5: Corrosion sélective ...
Figure m{
Figtire m-7: Coitosion sous contrainœ ... Figune ml8: Conosion galvanique
Fîgure m-9: Classification des inhibiteurs ...
Figune m-io: "agrammes d'Evans montrant le dép
23
25
cmt du potentiel de conosion dû
H;':=ï.S.e:n=:=m==oœË;n:_`ù„--t
Flgur€ IV-l : Echantillonnage
31
n...32
Chq,ioe lv 1,
...J...-...37
Figtir€ IV-2 : Montage expérimentale ...
Figure IV-3 : Courbes types potentiel/temps d'immersion, : Efll) ... 40
I
I
I
I
1
1
I
I
I
1
1
1
I
I
1
1
I
1
1
1
I
Figure IV-5 : I.e microscope métallographique
Fig]m IVL6 : Exemple d'un mjcroscope électmrique à balayage (MEB) doté d'une microsonde d'analyse EDS
Chqpitre V
Figure V-1 : Structue de l'dliage Al-Zn-Mg : Image hŒB + métàllographie ... 44
Figure V-2 : spectDe EDX de l'alliage d'aluminium étudié (Al-Zn-Mg) ... 45
Figure V-3 : Effet des chlorures sur l'évolution du potentiel de corrosion de l'alliage Al-Zn-Mg
Figure V4 : Coubes de polarisation logarithmiques traduisant l'effet des chloruies su le comportement électrochimique de l 'amage A1-Zn-Mg ...
Figure V-5 : La résistance de l'électrolyte (Re) et de la résistance de polarisation (Rp) à partir d'un diagramme de Nyquist .
Figure V-6 : Diagrammes de Nyquist obtenus après différents temps d'immersion de l'alliage Al-Zn-Mg dans la solution non chlorurée (Cl-F}M)
Figure V-7 : Diagrammes de Nyquist obtenus après différents temps d'immersion de
l'alliage Al-Zn-Mg dans la solution chlorurée (Cl-]=0.5M)
Figure V-8: Diagiammes de Nyquist traduisant l'effet des chlorures su le comportement électrœhimique de l'alliage Al-Zn-Mg après 72 heures d'immersion
Figure V-9 : Effet de l'inhibiteu su l'évolution du potentiel de conosion de l'alliage Al-Zn-Mg la solution chloruée ([Cl-] = 0.5ho
Fîgure V-10 : Coubes de polarisation logarithmiques traduisant l'effet de l'inhibiteu su
le comportement électrochimique de l'alliage Al-Zn-Mg em absence des chlorures ... 56
Figure V-11 : Coubes de polarisation logarithmiques traduisant 1'effet de 1'inhibiteu su le comportement électrochimique de l'alliage Al-Zn-Mg en présence des chlorures ([Cl-] =
I
1
1
I
1
1
I
I
I
1
1
1
1
I
1
1
1
1
1
I
I
Figure V-12 : Diagrammes de Nyquist traduisant l'effet de l'inhibiteu après 72 heues
d'immersion dans la solution en présence des chlorures ([C1-] = 0.5M) ... 57
Figure V-13 : Diagrammes de Nyquist obtenus après différents temps d'immersion dans la solution chlorurée en présence d' inhibiteu (250ppm)
Figure V-14 : Diagrammes de Nyquist obtenus après diffërents temps d'iinmersion dans la solution chloruée en présence d'inhibiteu (500ppm)
Figure V-15: Macrographies de l'alliage Al-Zn-Mg après 3 jours d'immersion dans les dïî£éie"kes soLrio"s .. (a) ef f iet des chlorures, @) ef fet de l'inhibiteur en abserice des
chlorures, (c) effiet de l'inhibitew en préserice des chloruTes. ... 61
Figur€ V-16 : Micrographies obtenues paD observation au microscope métallographique des échantillons après 72 h d'immersion dans les différenœs solutions
I
I
I
I
I
I
1
1
I
1
1
1
1
1
1
1
1
1
1
I
I
Liste des tableaux
Cho,pit,e 1
Tab]eau 1-1 : Différents propriétés de l'alumirium
Chai}üre 11 Tab]eau 11-1 : Familles d'alliages d'aluminium
Tableau 11-2: Séries d'alliage et les éléments d'addition
Tableau 11-3 : Composition des éléments de corroyage
Tableau 11-4 : Exemple d'application de la série 7000
Chapit'e 111
Tableau 111-1: Différentes formes de corrosion d'alliage de l'aluminium ... 26
Chapine IV
Tableau IV-l : Composition chimique de l'alliage Al-Zn-Mg
TabLeau IV-2 : Concentrations et caractéristiques des solutions électrolytiques utilisées .,.... 38
Chapitre V
Tableau V-l : Effet de des chlorures su l'évolution du potentiel de corrosion Œcorr) de
l ' alliage Al-Zn-Mg
Tableau V-2 : Effet de la concentration en inhibiteu su l'évolution de quelques paramètres
électrochimiques de l'alliage Al-Zn-Mg ... „ ... 49
Tableau V-3 : Variation de la résistance de la solution Œe) Çt la résistance de polarisation
(Rp) en fonction du temps d'immersion dans la solution sans et avec chlorures ... 52
Tableau V4 : Variation de la résistance de la solution (Re) et la résistance de polarisation
(Rp) en fonction du taux des chlorures pour un temps d'immersion de 72h ... 53
Tableau V-5 : Effet de l'inhibiteu su l'évolution du potentiel de corrosion de l'alliage
I
1
1
I
1
1
1
1
1
1
1
1
1
1
I
1
1
1
I
I
I
Tableau VÙ : Effet de la concentration en inhibiteu sur l'évolution de quelques paramètres
électrochimiques de l' àlliage Al-Zn-Mg
Tableau V-7 : Variation de la résistance de la solution Œe) et la résistance de polarisation (Rp) en fonction de la concentration en inhibiteu dans la solution chlorurée ([Cl-] = 0.5M)
1
I
1
1
1
1
1
I
I
I
1
1
1
I
1
1
1
1
I
I
I
I
I
I
1
1
1
I
I
1
1
I
1
1
I
1
1
I
I
1
1
I
Introduction générale INTRODUCTION GENERAI:ELes alliages d'alumiriun de la série 7XXX occupent une place très importante dms l'industrie aéromutique et automobile ainsi que dans le domaine de fabrication d'une gramde variété d'accessoires (électrique, motocycle, etc.). Ils possèdent une frible masse volumique qui constitue un atout pou la réduction de masse des pièces et équipements réalisés notamment pou les avions et l'automobile. En outre, ils présentent de hautes caractéristiques
mécariques ce qui pemet leu utilisation en tant que matériaux de structure. Ia résistance
mécanique de ces alliages est accrue par le phénomène de durcissement structural. La contre partie de ce traitement est l'établissement d'une microstructure très hétérogène. Ces alliages sont de ce firit très sensibles aux phénomènes de corrosion localisée lorsqu'ils sont en contact avec des milieux environnmts agressifs, en particulier les milieux chlorurés.
Afin de limiter la dégradation des alliages d'aluminium en service, plusieurs techniques de protection ont été utilisées, panni lesquelles nous citons : l'application des différents revêtements de surface, les traitements d'anodisation et de double anodisation, la protection anodique et cathodique ainsi que l'utilisation des inhibiteus de conosion.
L'utilisation des inhibiteus de corrosion est une technique assez populaire dans le domaine de conosion des alliages d'aluminium en raison de sa simplicité, son efficacité et son bas prix de revient. Les inhibiteurs peuvent être employés de deux manières différentes : ils peuvent être introduits dans le milieu envii'onnant agressif comme ils peuvent être inclus directement lors des différents traitements de surface ayant pou principale action de limiter les réactions de corrosion engendrées au voisinage des blessues.
En effet, il existe une variété de composés chiriques (minéraux ou organiques) utilisés comme inhibiteurs de corrosion des alliages d'aluminium. Les composés à base de chrome hexavalent sont, depuis toujours, 1es plus utilisés. Cependant, ces composés présentent l'inconvénient d'être toxique et cancérigènes poLm l'homme. De ce frit on ne cesse jusqu'à présent de chercher des composés qui peuvent être des solutions de substitution à ces
composés damgereux.
Dans cet ordre d'étude nous avons élaborée ce travail expérimental dont l'objectif principal est d'étudier, dans un premier temps, l'effet des chlorures su le comportement électrochimique d'un alliage d'aluminium de type 7075 puis de tester par la suite l'action inhibitrice d'un composé minérale qui est le molybdate de sodiun Na2Mo04, Ce composé présente l'atout d'êtne un composé non toxique.
I
I
1
1
I
1
1
I
I
1
1
1
I
I
I
I
1
1
I
1
1
Introduction généraleAinsi, ce mémoire s'articule aLitour de cinq chapitres :
+ Les deux premiers chapitres présentent une synthèse bfbliographique permettant de faire un état des comaissances concemant l'aluminium et ses alliages (élaboration, propriétés, famille
d'alliage, etc.).
+ Le chapiti€ 111 présente des comaissances sur le phénomène de corrosion, notamment celui de l'aluminium et de ses alliages, ainsi que les techniques de proœction, plus particulièremenç L'utilisation des inhibiteus de comosion.
i Le chapitre IV est consacré à la présentation des méthodes et conditions expérimentales mises
en œuvre au cours de cefte étude.
i Le chapitre V présente l'ensemble des résultats obtemus concemant la camctérisation
électmchimique et physicochimique de surfàce de l'alliage d'aluminium 7075 dms la solution chlomrée ou non, avec ou sans ajout de l'inhibiteur.
+ A la fin, les points forts de l'étude sont rappelés en conclusion générale de ce mémoire avec présentation de quelques travaux fiit`ms comme perspectives.
1
I
I
1
1
1
I
I
I
I
I
I
I
I
I
I
I
I
I
1
1
I
I
I
I
1
1
I
I
I
I
I
1
1
I
I
1
1
I
I
1
1
Chapifre 1l. DéfiDffion d'aluinhiu 1
mL:¥i]:stdmné]:::d:::^Î:Î;::.¥:Ape.d:Clæi
9énéralités sw l 'aluminiumification de Mendéliev, don. le
:nïd:seæ:qi:s:st]m3::aub¥àæft|q::6::,8aïœhuffi±d::;:eno:::Ci[:s=
qnasse volumique est 2.7 kg/dm3, son coefficient de dilatati
ïO:m:
ernrique linéaiiie est de l'ordre
m pu possède des propriétés
de 23.10{ °C-', son module de Yomg de 6600 bar. L'al
mécaniques tiès réduites st insuffisamœ poü son uffi+ dans m bon nombp
d'applicrio"mcmdes,ilestlégŒ,duŒlestilrisisteàla,œnosion.npristnœausime
trèsbonneconductivitéthenniqueetélectrique[1].=dfl=mfth:::]:ti:tpgud:m±°:5°;:iriLP±ÏS
mais fl pe`it êtœ obtenu presque pu par mffinage électro
impuictés ont diffërenœ effeœ su les propriétés électriques bt mécaniques. Les 'pr-orifté:
d'd`mirimpuvŒtêmméüor霌ajoumtdœélémmœid'dtitiomtelsqœleMg",
hh. Cu, etc.
®rincipalement Fe+Si),
(Al > 99.99%) [lJ. Ces
A la tmpéranire ambiante, l'al`minim fome dès viœ| une couche d'oxyde AA20b
:::,:ïïq:mmï:f,::emÉœîg±]e=û:=ïînŒï,
chlorhydrique,sulfiiriqueetnitrique.Parcontie,lesbasesattaquÉ
Cette piotection ped être améliorée par anodisation: il
ce film d'alumine n'a qu'me dms les solutions d'acide
nt violement le métàl.
t dtu daitement qui pemet
sï:t:,
d'obteri me couche épaisse d'JU20b mais poreuse, œ qui ¢st ensuiœ colmatée ri m
e¥:steî::eài:œc:::e;:aï=Ï:]::::=æeË].bïmff'"UÉçri°n
1 1`\\ 2. L'éhbomtîon de ]'a]uminium \`-.. bsmétaux,matièresprenrièresessentieüesàdenombre+industriesn'exisœntpas pursàI'étatmirelmaisgénéralementsouformed'oxydescon:,Ï:
minerais sont composés de nombreuses e*s. La production d
dans les nrinerais. Ces
métaJ à parir dü nrinerai
estlerisdtatd'mproœssuchimiqusthdusrielœmplŒeafin|delemettmmfomestde
le purificr.2.1. Le minemi '
L'aluminiumestleûoisièmeélémmtleplusabondmt
la masse) après l'oxygène et le silicium. L'aluminim est trè
sË]:ü:àûœ=stdœ(8iyoh:
quilecontiementetadoncéœlongœmpstrèsmœetprécieuxex+
cmûte terrestre (8 % de
Chqpitre 1
Généralités sur 1 'alumirtiu
_j*gS-;_ __,i_ '..1 tJIIII\_.=_`L--=-`ii m '.*ï '` , .- -= `*:j;-,-4- - --- Jü --- <_1`,,+ , `L ¥ !premiers
F:àii'+*`ï `,-- #Ï,±~r-J_€iJLh7•_-`__,`+,.`
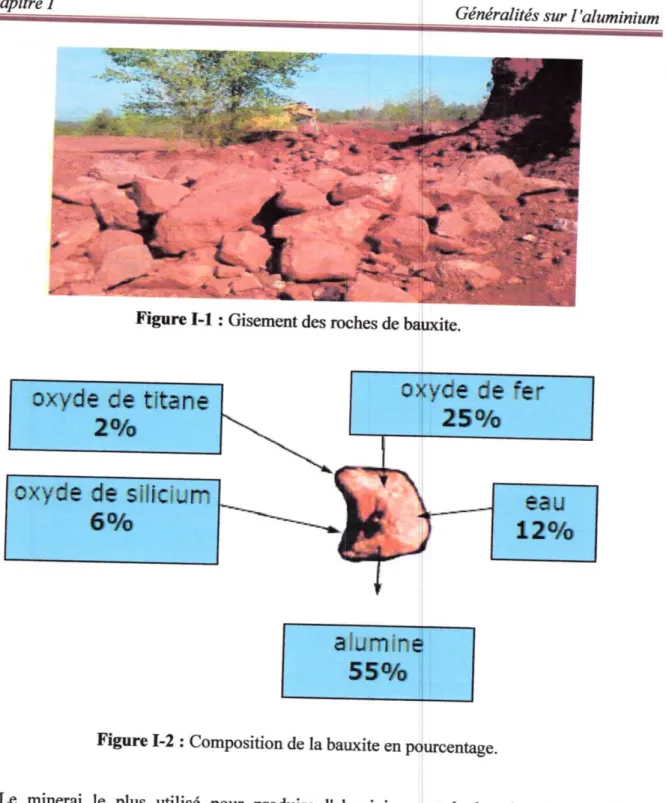
-ËiË-:-`+r,-,----+..`J9_Ù¥.,-#._ . i-.Ëï+`æË`.---v,-dFigure 1-1 : Œsemcmt des roches de baOxydedetjtane(0
•te.yde de fer250/o
20/aoxydedesilicium
ea12urcentage.stlabauxite060/Û
4aiumin
550/oFigure1-2:CompositiondelabauxiteenLemineraileplusutilisépouproduirel'aluminiumrisements fimt déoouverts dans le village des Bauxde-Proven d'où son nom en 1831 par03)dontl'électrolyseàl'étattpasuniquementquede•e(fomehydratéeA1203,nH20,quidonnesacouleu Piem Berthier). A partir de la bauxite, on produit l'dunrine (Al
fondu pemet d'obtenir l'aluminim La bauxite ne conti
"l'aluminium" : elle est constituée de 40 à 60 % en masse d'alnH20), de 10 à 20 % d'oxyde de fer m (fome hydraœe Fe203,
rouge au minerai et aussi de la siHce Si02 (en général moins de
%). La prerière étape de ladesautresconstitumtsdu production de l'aluminium consiste ainsi à sépatq l'alurie
minerai.
unrine.
1
1
I
I
I
I
I
1
1
:=Ïi¥ïi:,ËÏÏ5u=ïàs'ste]œprïvmœs
-bomerésïstancecoiTosion,v].sàvisdcsagcntsatmoph d'oxyde protectrice, l 'AI.UMnŒ,-conductibilitéthemiqueélevée:échangeurstiiermiques,
:-Ë:Ëudi::œiËidïe:œ=œid:stm-=:ïœ
-granderésistanceaufioid:sarésistmcemécaniqueaugn
-amagnétique:l'aluminiumetsesalliagesneprementpas - grande affinité avœ l'oxygène : désoxydant,
- pouvoir réflecteu élevé : éclairage,
D'autrespropriétés,physiques,mécaniques,etc.sontrésmées
Tablœu 1-1: mffërents propriétés de l'al
Z-13 M=29,974 R
(atomiquep,1428m
-
-ceimer-réticulaip= 0,4049m
- Structure:CFC (cubiqueàficecentré) - Massevoltmique= 2700Kg,m3 - Conductibilité électrique : • 62%decelJeducuivne • S'échauffe moinLs que lecui"
- Résistmceàla coimsion : Couche d'oxyde
mtuel(Æ203)
{) - Lœprriétés
i mécaniques d'aluminium
sont ffible, néamoins on
(t peut l'améliom paŒ' :
• Ehuissage
• Addition d'élémcmt
• Tritement
thermjque
: formation d'une couche
jusqu'à -250 oc, 'aimantation, le tableau suivant : - CFC:excellente ductibiËté - T(fiBion)
basse"oc
- FacileàmettreŒfome
- Moduleélasticité : 67000Mpa - Moduledetorsion :27000hoa
- Cœffcientde poisson : 0,34I
I
1
1
I
I
1
1
I
1
1
I
I
1
1
1
1
I
I
I
I
Chqpitre 1Généralités sur 1'aluminium
Les atouts de I'a]umÉrii]m
L'utilisationdel'alumiriumestenpleindevenirgrâceàsesnombreuxatouts,
1. Légèreté
L'alumjnium est léger et de plus présente des caractéristiques mécaniques très élevées. 11
esttrèsutilisédanslestransporœterrestresrapidesTGVetmaritimes,etdeplusenplusdans J'automobile.Bienque,entonnage,laproductiond'alumirimnereprésentequ'mpeupJus
de 2% de celles des aciers.
2. Conductivité élec.rique et thermique
L'aluminiumoflieuneexcellenteconductivitéélectriquepourmpoidsinférieuràceluidu
cuivre.C'estpourcelaqu'onleretrouvedeplusenpluspourleslignesàhautetension.
A l'instar du cuivre, l'àluririum, en plus d'une bome conductivité électrique procure également un fon pouvori caloporteur ce qui explique par exemple sa pi.ésence dans les dispositifs de refioiŒssements.
3. Tenue à la corrosion
L'aluminiumetlesalliagesontengénériLmebonnetenueàlaconosionamosphérique, en milieu marin. ubain, industriel. L'alumriium est utilisé de façon courante par les architœtes, aussi bien dams les édifices publics (Grmde Arche de la Défense, Pyramide du Louvre..)quepourleshabitationsindividuelles.Toutenofhtdenombreusespossibilitésde
fomesetdetraitemenœdelasurface,lesstmcturesdebâtimentenalmirimdemandentpeu
d'entretienetrésistentbiendansletemps.
Cetœbometenueàlacorrosionalliéeàsafribledensitéluiapermisudéveloppement
des applications de l'a]uminium. Elle a plusieurs conséquences importamtes pour les
utilisateurs:
- d'ue durée de vie des équipemenœ du matériel peut être très longue. 11 n'est pas rare en
effetdetrouverintacœdestoitures,desbardages,deséquiFNmenœdeporœdeplaisamce,des bateaux ..., vieux de plusieus décennies.
•d'mentretienfacilité,mêmesansprotectionadhoc(nipeintnimodisé)
-d'uneesthétiquepérenne.LesproduitsdecorrosiondeI'aluminiumsontblancsetpropicesà
l'enduction d'ue peinture.
I
I
1
1
1
1
I
1
1
1
I
1
1
I
1
1
1
I
I
I
I
Chapitie 1Généralités sur 1 'aluminium
4. Aptitude au tmîtements de surface
LestraitementidesurfacesuI'aluminiumontplusieuHobjectifspamjlesquels: -laprotectiondeœrtainsalliages,qmdleurésistmœàlacorrosion«natuelle»estjugée insuffisante, -Japérenni.édeJ'aspectenévi.tantJacoiTosi.onparpi.qûresouJenojrcïssement, -lamodificationdespropriétésdesLirfacecomeladuetésuperficïelle, -ladécorationdumétalparanodisationpuiscolmatagepigmentaire,
5. DiveiEité des amages d'aluminium
Lesprogrèspemamentidelamétallugiedel'alunriniumontaboutiàproposerunegamme étenduedenuances,bienadaptéeauxutilisationsenvisagées.
Tellement nombreux, Jes amages d'aluminium sont regïoupés confomément à une nomenclatue rigoureuse et complexe. Ainsi le métd pur non allié constitue la série 1000 et les autres séries dépendent de la natue de I'élément d'alliag¢ principst (2000 pou le Cu
3000pouleM,4000pouleSi,5000pouleMg,6000pouleMgetleSi,7000poule Zn).D'mefàmilleàuneautielespropriétéscamtéristiquessodttièsvariables. 6. Recyclage L'alumiriumestundesmétaudontlerccyclageestleplusa"iftamtsurleplam énergétiquequesurleplanéconomique.Larefiisionde1'alumiriumnereprésenteque5°/ode 1'énergienécessaireàl'élaborationdumétalàpartirduminerai. L'expériencedeplusieursdizainesd'améesderécupérationdes«vïeuxmétaux»montre
que les décheé d'alminim ont toujours une valeur mamhmde supérieue à celle des ferrailles.
I
I
I
I
I
I
I
I
1
1
1
1
1
I
1
1
I
I
I
I
I
I
I
I
I
I
I
1
1
1
1
1
1
1
1
1
I
1
1
1
1
I
]==n£t,ic_u:=A'.ie.'^îÏïï=a'-':
solubles et mobiles dans le métal, a effst durcissant; les princi
magnésiunL le silicim et le zinc O'm ou l.autre de ces deux dhiers éléments étant associe au
magnésium).A ces éléments d'addition principaLix s'ajoutent n ftibles teneurs des éléments
::::]:::ti:e]::emn:bïœïq"u:S:e:étü=L:m"Ï°n#:°=e'd=dgü=ï'(=:st
fomedescristamŒTaim)d'dumirim).LefŒ,træpeumlublî,estueimpurstédemêmeque
le silicium dans la plupart des alliages hors Al-Mg-Si.2. Classification des allîag€s d'a]uminium
l.a désignation des alliages d.aluminium sont réjes par un
National Stmdarts lnstitute (ANSD [3]. Les alliages d'alumini
Lti
udmc
tut américain, the American
sont classés selon un nombre composé de 4 chiffes. Le premier chiffie indique la série Pe l'alliage propre à l'élément d'addition majoritaiie, ils sont ajoutés en quantité variant de 1 à
àlliages de corroyage et plus. jusqu'a 20% de siLicium dans
que la nomenclatune adoptée pou la fimille lxH (durini
%(en teneu pondérale) pou les moulage. 11 est à noter
diffioe de celle des alliages
:=Ë,œ=
ÏDans les ffimilles 2 à 8, le 2ème
res de la composition chimique et a pour principal b`b de renseigner siir la pureté de l'altminium
chiffi€ de la nomenclatue est réservé aiK modifications success
de l'àlliage pemeœant d'améliorer oertaines piopriétés. Paff 2024 a été emeSstnée en 1954, l'alliage modifié 2124 breveté ainsi de suite, chaque modification restant dans les limitÉs permist
deriemcHffiœpcmeümtd'identifiemliageausehdehséri¢.
:,r:'
e, la composition de l'àlliage
70, l'alliage 2224 en 1978 et
par la nome. Enfin, lc§ deux
hmétdluaeùsdliagesd'duminiumhdustielsestdoncbasîesursixwsœmes:
• Aluminium¢uivre. • Alunrinium-manganèse. |: :=::Ï::î:œ°U-maæésim). ,
• Aluminium-magnésium-silicium. |=îrTdïn-=::ei°:p=aric=n:.tousài'medeshJtŒmmiiiesd'diiages.nsmnt
disponibles sous fomes de : i
I
1
1
I
I
1
1
I
1
1
I
1
1
I
I
1
1
1
1
I
I
Chapitre 11 Les alliages d'aluminium
+ Produits moulés.
+ Demi-produits corroyés : laminés, és ou matricés.
. .. I •,','''4 2.1. Lœ •,,. -,, , :5,.Ë:Î •, ,. ,_ , .[ Ï , déchets ï J-Ï ï+ ï..+
TH,Ê,,-.--`#E¥ Atlcun 10000 1000Cuivre
20000 2000Mmgmèse
30000 3000 Silî€ium 40000 4000 MagDésîum 50000 5000 Magnésium st sfliciqm 60000 6000Zinc (et cuivT€) 70000 7000
auiagœ de moulage
u de l' électrolyse. On distingue les alliages :
- de premières fiisions, élaborées à partir d'aluminium primaire, i
-de seconde fi)sion, (appelés aussi alliages d'affinage). Ils sont éaborés par refirions des
réc`]pérés. ns sont surtout utilisés pou la fàbrication des pièces automobiles du giotpedesapplicationsélectriques.està575°c.Ia&fonderiede
motopropulseu.
Ics principaux alliages de moulage sont :
• Aluminium non allié,f ;arille l0000 :
L'aluminium non àllié, moulé, est utilisé presque exclusivement-AILiageausilicieim,f;amille40000:
Du ftit de la facilité de mise en ouvre de ces àLliages, l'eutecti
moulage d'aluminium est ftite pou l'essentiel d'alliages au sili •um (famille 40000). 11 y a deuxdanslamécanique,dans
catégories d'alliage :
-Ceux qui ne contiement pas de cuivre. -Ceux qui contiennent de cuivre.
Ces alliages ont beaucoup d'application en pièces de
l'industrie électrique et aussi dans l'automobile. Ceux qui con •ennent du magnésium sont des alliages à durcissement structural.
I
I
I
I
1
1
1
1
I
1
1
1
1
I
1
1
1
1
I
I
I
Chapitre 11 Les alliages d'alumirium
Ils ont une excellente résistance à la corrosion atmosphérique.
- Alliage au criwe,f tmiLle 20000 :
Le 21000(A-U5GT) est le plus courant. C'est un alliage à durcissement structural.11 a une tenue à
la conosion méd£ocp et ne doit pas êtrc exposé sans protœtion aux intempéries ou à tout aim
milieu agressif.
• Altiages au magnésium,f iarritle 50000 :
Deux alliages sont courants : le 51000(A-G3T) et le 51300(A-G6) . Ils sont assez difficiles à
couler à cause du titre élevé en magnésium.
Ils ont me excellente résistance à la corrosion atmosphérique, en particulier en milieu marin, et
sont utilisés dans la fabrication de pièces d'accastillage.
- Atliage au zir.c,];arrille 70000 :
Un seul alliage à mentionner, le 71000(A-Z5G) qui est aussi difficile à couler. Sa résistance à la
corrosion est moyeme.
2.2. Les alliages de corroyage
D'ui point de vue métallugique, les fàmilles d'alliages d'aluminium de corroyage se divisent en deux groupes très distincts tant par la gamme de fabrication que par certaines propriétés. Ce
sont :
- Les allioges à duTcissement par écrouissage..
Stricto sensu, tous les métaux et alliages ducissent par écrouissage. Mais dans la métallugie de l'alumirim, cette désignation est réservée aux alliages des friilles qui ne sont pas susceptible de ducissement structural.
ns appartiement auD[ familles 1000, 3000,5000 et 8000. Leu gamme de fabrication est frite d'me suite de mises en fome à chaud et éventuellement ensuite à fioid, associée à des recuits intemédiaires ou finaux.
- LÆs oLlioges à durcissement structural..
Ils appartiement aux familles 2000 et 7000.Ce sont des alliages destinés aux applications mécariques. Leur emploi en milieu humide ou agressif est à éviter. Les caractéristiques
mécaniques maximales de ces alliages sont obtenues par un traitement comprenant trois étapes :
I
I
1
1
I
I
I
I
1
1
1
I
I
I
1
1
1
1
I
I
I
Chapitre 11 Les alliages d'aluminium
> Un chauffage à me tempémture élevée.
> Un refioidissement rapide appelé « la trempe ». > Un maintien.
2.3. Les a]]iag€s de comoyage et leurs i)roprÉétés
a. Aluminiu:ms non alliés de la série 1000 :
Les propriétés de ces nuances dépendent essentiellement : - des teneus en impuetés (fer et silicium en particulier).
- des additions mineures éventuelles.
- des niveaux de ducissement réalisés par écrouissage ou des riveaux d'adoucissement obtenus par restauration et recuit.
D'une façon générale les aluminiums non alliés présentent :
- une très bome aptitude à la défomation plastique.
- une résistance mécanique relativement frible.
- un excellent comportement vis-à-vis des agents chimiques et des diffërentes atmosphères. - une bonne aptitude au soudage, au brasage, à l'anodisation, de très bonnes propriétés
cryogériques.
b. Alliages aluminium-cuivre de la série 2000 :
Les alliages de la série 2000, à ducissement structural, foment une gamme importante d'alliages
se caractérismt pü :
- une résistance mécanique moyeme à l'état trempé mûri mais relativement élevée à l'état trempé revenu.
- unebonnetenue àchaud.
- une aptitude au soudage généralement mauvaise selon les procédés traditionnels. - une résistance à la corrosion relativement frible en atmosphère corrosive.
c. Alliaf!es aluminium-manfianè_s_e_de la série 3000 :
Les alriages de la série 3000, dont les applications industrielles sont importantes et variées, se caractérisent par :
- une résistamce mécanique fiLible mais qui peut être augmentée soit par écrouissage, soit par addition de magnésium (ces alliages n'étant pas susceptibles de durcissement stnictural
sont donc utilisés dans les états écrouis, restaurés ou recuit§).
- une bonne aptitude à la mise en fome, au soudage et au .
I
I
I
I
1
1
1
I
1
1
I
I
1
1
I
I
1
1
I
I
I
Chqpitre 11 Les alliages d'aluminium
- une excellente résistance à la corrosion.
d. Alliages aluminium-silicium de la série 4000 :
Les alliages de la série 4000 n'ont pas le poids industriel des alliages des séries 1000, 2000, 3000, 5000, 6000 et 7000. 11 appara^it cependamt nécessaire de mentionner cetK qui reçoivent des applications industrielles significatives.
e. Alliages aluminium-magnésium de la série 5000 :
I.es alliages aluminium-magnésium constituent une friille importante et variée d'alliages
industriels.
f Alliage aluminium-maq.ésium-silicium de la série 6000 :
Les deux éléments d'àlliage de la fàmille 6000 sont le magnésium et le silicium. Ces alliages
présentent :
- me bome aptitude à la transfomation à chaud par laminage, par filage et par forgeage. - une bonne résistance à la conosion. atmosphérique en particulier.
- ui bon niveau de camctéristiques mécaniques qui peut être amélioré soit par addition de
silicium, soit par l'addition de cuivre.
g. Alliage aluminium-zinc (et cuivre) de la série 7000 :
L'élément d'alliage de cette série est lezinc(Zn). Globalement, ils ont de très bomes
caractéristiques mécaniques ; ce sont les alliages d'aluminium à haute résistance.
Malheueusement ces très bonnes caractéristiques mécaniques sont obtenues au détriment de la résistance à la corrosion.il y a deux groupe d'alliage sans et avec cuivre.
Chapitre 11 Les alliages d'aluminium
Tat.leau H-2: Séries d'alliage et les éléments _11=Æ
-, -- - -- -+T='TTTr-++T----
ï_r---,,.,---
., .
-1000 AA non allié Al > 99% /
2000 Crivrc(Cu) 2-6
Æ-Cu Al-Cu-Mg
3000
MmgmèseQvh)
0,5 -1,5Al-M
4000
Silicim(Si)
0,8 -1,7 Al-Si5000
Magnésimadg)
0,5 - 5 Al-M86000
Magnésim+Siücim
Mg : 02 - 1,5 Æ-Si-MgŒ+Si)
Si : 02 - 1,57000
Zinc (et CuiŒ)
Zn .. S - 1 Al-Zn-Mg(Zh) Mg : 1 - 2
Al-Zn-Mgû
3. L'influence des éléments d'auiagea)I+ecuÈwe
e_
- Alliages à durcissement structural.
- Améliore les caractéristiques mécaniques. - Dinrinue la conductivité électrique. - Diminue la résistance à la corrosion. - Facilite l'usinage.
- Améliore la tenue au fluage. - Rend le soudage tiès difficile.
- Mise en fome possible su l'état recuit ou su trempe fiic
- Bonne aptitude aux traitements de surface. b) Le mangœnèse
- Alliages à duicissement par écrouissage. - Améliore les caractéristiques mécaniques. - Facilite l'emboutissage.
- Bonne tenue à la corrosion.
1
I
I
1
1
1
I
I
1
1
1
I
I
I
I
I
1
1
I
I
I
Chqpitre 11 Les alliages d'alumirium
c) IA "gnésium
- Alliages à durcissement par écrouissage.
- L'accroissement des caractéristiques mécaniques est fonction de la teneu en magnésium.
- Améliore la tenue à la corrosion. • Alliages soudables.
- Bonne aptitude aux traitements de surface.
d) Le siticium
- AJliages à ducissement structura], si présenœ de o,3 à 0,6 % de magnésium.
- Améliore la coulabilité de l'aluminium; elle est maximale à l3% de silicium (eutectique).
- Diminue l'usinabilité,1e silici`m étant `m élément du et abrasif.
- Diminue le coefficient de dilatation linéique.
- Possibiliü5 de soudage de certains alliages de mou]age ne contenant pas de cuivie.
- Boime tenue à la corrosion pou les alliages sans cuivre.
e) Le suicium + le magnésium
- Alliages à dLircissement structural.
- Améliorent les caractéristiques mécaniques.
- Améliorent l'aptitude au filage. - Très bonnetenue à la corrosion.
- Tris bonne aptitude aux traïtements de surface.
J) IJe Zjnc
- Améliore les caiactéristiques mécariques ; les 7000 ont les caractéristiques mécaniques les
plus élevées de tous les alliages d'aluminium.
- Alliages soudables, s'il n'y a pas d'addition de cuiwe. - Tenue à la corrosion médiocre.
4. Diagramme d'équiLibre des alliages d'a]uminium
En général, m alliage ne solidifie pas à températune constante : pou un refiDidissement assez lent, la solidification commence à une températue Tl et finit à une température 12 et il n'y a pas ui point de solidification mais un intervalle de solidification. Le diagramme de solidification est le domaine délimité par les températures Tl et T2 qui sont de la composition de l'alliage. h ligne
I
I
1
1
I
1
1
I
I
I
I
I
I
I
I
I
I
I
I
I
I
1
I
1
1
1
I
I
I
I
I
I
1
1
I
I
I
1
1
Chqpitre 11 Les alliages d'aluminim
S3. Propriétés de la série 7000
Cœdüæœontftésp&mmmtmisaupohtafindeprémtŒL
des propriétés suivantes : |
ts compromis performants
- Résîstance mécanique fonction de l'épaisseur des prod+œ en agissant s`n les élémenœ
:'éïîü:°:#Ccîïnïsîeotns:Œn::o.nenjouankuiesrimŒtsüerriques.
::#œe:
à fàible teneu en impuretés ts d'addition secondaire et en
Ténacité et compor(ement en fatigue en `itilisant des Œe, Si...), en ajustamt les teneuis de certains optimisant les traitements thermiques.
Ces alliages ont actuellement des applications importantes dahs l'industrie aéronautique et en
panicdiŒdanslesstmcnmesdesariommodemes(Airbu,B0tiï
5.4. DomaÈne d'applÈCQttion de la série 7000 |
g...) Tab]cauH4:Exempled'appücationdelasFe7000.[4]
ritè" de
-t utilisdeürs AppËcations mécaniques Consüuction aéronautique et spatialeL_
Canactéristiques mécaniques usinabiHté I.égèreb5, Caractéristiques mécaniques, mise Œ forme, Usinage,Aptitude am tritemcnts de
surfice, 7075 7049A 7020 7075 7175 7475 Pc,ge 18I
I
I
1
1
1
1
I
I
I
I
I
I
I
I
1
1
I
I
I
I
I
I
I
I
I
I
I
1
1
1
I
1
1
I
I
1
1
1
1
I
I
Chapime 111 Corrosion de 1 'aluminium
1. Introduction
h plupart des matériaux ont une interaction plus ou moins prononcée avec un grand nombre de milieux ambiants. Cette interaction altère souvcmt l'utilité du matériau en raison de
la détérioration de ses propriétés mécaniques (telles que la ductilité et la résistance) ou autres
ou encore de son apparence ; 11 arrive parfois, au grmd dépit de l'ingénieu concepteur, que la résistance à la dégradation d'un matériau ne soit pas prise en compte en vue d'une application donnée et que cela entraine des conséquences facheuses.
Les mécarismes détérioration ne sont pas les mêmes pou les trois types de matériau. Daim les métaux, il se produit me perte effective de matière soit par dissolution (corrosion), soit par fomation d'une pellicule ou d'autre croute non métallique (oxydation).Les matériau céramiques sont relativement résistants à la détérioration, qui se produit habituellement à température élevée ou dans un milieu ambiant extrême : Ce procédé est fiéquemment appelé corTosion. Quant au polymères, les mécanismes et conséquences de leu détérioration diffërent de ceu des métaux et des céramiques, et c'est pouquoi on parle plutôt de dégradation.
La corrosion désigne l'attaque destructrice et involontaire que subit un métal. De natuœ électrochimique, elle s'amorce généralement à la surface du métal. La conosion
métallique constitue un problème de taille : on estime que les pays industrialisés consacrent
environ 5% de leurs revenus à la prévention de la conosion et à l'entretien ou au remplacement de produit endommagés ou détruits par des réactions de corrosion. Les effsts
de la corrosion sont bien connus.
Dans le cas des matériaux métalliques, la corrosion est généralement d'origine électrœhimique. c'est-àdire qu'elle consiste en une réaction chimique marquée par un transfërt d'électrons entre deux espèces chimiques. Habituellement, les atomes métalliques perdent ou doment des électrons lors d'une réaction dite d'oxydation. [7]
2. Définition de [a conosion
La corrosion est généTalement définie comme une réaction interraciale irréversible d'ui matériau avec son environnement. Celui-ci subit en effet une perte de matière progressive aux points de contact avec le mjlieu environmnt accompagnée d'une dégmdation de ses propriétés physicochimique.
I
I
I
1
1
I
1
1
1
1
I
I
I
1
1
I
I
I
I
I
I
Chapitre 111 Corrosion de 1 'aluminium
La corrosion d'ui métal peut se développe essentiellement selon trois pi±sus
différents : corrosion chimique, électrochimique et bio¢orrosion.
2.1. La corrosion d'a]uminium
Les prem;ers essais de cozTosion connus sur l'alumirium ont commencé vers 1890, à partir du moment où ce métal fiit disponible en quantité suffisante pou envisager des
applications dans les bâtiments et dams les ustcnsiles de cuisine. C'est ainsi que les premieis essais de tenus à l'eau de pluie, au contact de plusieurs liquides àlimentaires : café, thé, fiirent entrepris dés le début de la décennie.
L'aluminiui ne se corrode pas d'une manière spécifique, mais sous diverses fomes suivant des facteus inhérents au métal (éléments d'alliages) et au milieu.
2.2. Les réactions é]ectrochimiqucs de la corrosion de l'aluminium
Les réactions fondamentales électrochimiques de la corrosion de l'aluminium en milieu aqueux ont fàit l'objet de plusieus études. De mnière simplifié, l'oxydation de
l'aluminium dans l'eau a lieu suivant la réaction : [4]
Al - Al+3 +
3e-L'aluminiun sous forme de métal, à la valence 0, passe en solution sous fome d'ion
trivalent Al+3 en perdant trois électrons.
Cette réaction est équilibrée par une réduction simultanée des ions présents pou capter les
élc€trons ainsi libérés. Dans les milieux aqueux habituels dont le pH est voisin de la
neutralité : eau douce, eau de mer humidité de l'atmosphère, des considérations themodynamique montrent que seulement deux réductions sont possibles :
•:. Réduction des protons H+ :
3H+ + 3e--:H2.
Les protons lr proviennent de la dissociation de l'eau :
H20 É 2H++OH-.
•} Réduction de l'oxygène dissous dans l'eau :
• Enmilieualcalinouneutre: 02 + 2H20 + 4e--40H-. • Enmilieuacide: 02+4H++4e- -2H20.
I
I
1
1
I
I
1
1
1
1
I
1
1
I
I
I
I
1
1
I
I
Chapitre lll Corrosion de l 'aluminium
A 20°C sous la pression ahophérique normale, la solubilité de l'oxygène dans l'eau est de
43,4mg/Kg. Elle diminue avec la température et n'est pas que de 30,8mg/Kg à 40°C et
13,8mgLÆ£gà80°C.
Globalement, la corrosion de l'aluminium dans un milieu aqueux est la somme des deux réactions électrochimiques d'oxydation et de réduction :
A1 + A13+
+3e-3 H+ + +3e-3 e- + : H2
Ou bien :
Ai+3H+ + A13++ 3 H2
Al + 3 H20 + A1(OH)3 + : H2
Cette réaction s'accompagne bien d'un changement d'état de l'aluminium qui, à la valence 0 sous fome de métal est passé à l'état d'alumine dans Lequel il est à la valence +3, et d'un échange d'électrons, l'aluminium ayant perdu trois(3) électrons récupérés paD. Ir.
La corrosion de l'aluminium se traduit par la fomation d'alumine A](OII) 3 qui est insoluble dans l'eau et précipite sous fome d'un gel blamc qu'on observe su les piques sous fome de flocons gélatineux blanc.
3. Les fomes de corrosion
11 est utile de qualifier la corrosion selon la manière dont elle se manifeste. Ia corrosion
métallique est parfois répartie des catégories suivamtes : [8] 3.1. Corrosion uiiifome
C'est l'æpect de corrosion le plus rencontié dans la pratique, mais c'est l'aspect aussi le moim dmgereux, car le métal est attaqué su toute la surface et avec la même vitesse de corrosion. les causes peuvent être chimiques, électrochimiques ou encore mécaniques.
La corrosion unifome peut être évitée par l'utilisation d'un Fevêtement ou par l'addition d'inhibiteu de conosion ou encore par l'application de la protection cathodique.
I
I
I
I
1
1
I
I
1
1
1
1
1
1
I
I
1
1
1
1
I
Chapitre 111 Corrosion de 1 'aluminium
FHBui. m-l: Corrosion unif+e.
32. Corrosion locatisée 1
C'estmeconosionqùsedémùeenmlieusÉiiqmmmtmqmme±
ou d'Lme structure métallique.
généité du matériau ou de
ËEflEiE
l'attaque se fàit en oertains En prafique la corrosion localisée provient d'l'environnement. C'est l'aspect de corrosion le plus dan
e-ndroitsdelasurfaoedum-étal.h'penedemûÊseest-fespehvementffible,maiscetypede corrosion est dangereux. |
kpmcidesœœsdeœtæptdeœnosionsont. 1,
;:=nd;:eé:;:qi=:;:Ë::mesd+#pæiadéfo-on
> Endommagement local de la couche passive.
1
Ics diffirents types de la corrosion localisée sont : , 3. 2. l. Corrosion pær piqure i
Dansœrtaincsconditionsd'cmviromcmemLlesmétau+etalliagesprotégésparunfilm
passif peuvent subir `ine anaque par piqûmtion, lorsqu'il se Produit une ruptue localisée du film. Ces piques se localisent en certains points de
ffiçon insidieuse et s'auto propagent : au fond méta[liques dissous entraine une augmentation phénomène de corrosion.
I
1
1
I
I
1
1
I
I
1
1
1
I
1
1
I
I
1
1
1
I
Chapitre 111 Corrosion de l 'aluminium
FigureHi-2:ComsionparpiLûre.
1
322. Corrosion interLgranu]aire ,
C'est me attaque sélective aux johœ de gmins p+ sùœ d'hétérogénéités localest
appauvrissement de l'un des constitiianœ ou au contrair, enrichissemen¢ par suite de y'adoBcréationdepilœlocdes
précipitation lors d'un traitemcmt thermique par exemple. n avec dissolution des zones anodiques.
Figure 111-3 : Corrosion inter-grbulaire.
1
3.23. Comosion par creusse ,
Appelée aussi corrosion cavemeuse, elle est due à |a différence d'accessibilité de l'oxygène entre deu zones d'une structi]pe métallique. n y'a àLon une attaque des parties
métàLliques les moins accessibles à l'oxygène.
I
1
1
I
1
1
I
I
I
1
1
I
1
1
1
1
I
1
1
1
I
Chapitre 111 CorTosion de l ' aluminium
Figqr€m4:ComsioncavemFuse.
3. 2. 4. Corr"ion et disso]qtion sé]edive |
Commesonnoml'indique,cemondedecorrosionJtraduitparladissolution sélectivederudesélémentsdel'amagesicelui¢iesthombgène,oudel'medesphasessi l'alliage est po[yphasé. |
Figur€m-5:Corrosionséiecdve. 3. 2. 5. Corrosion-frott€ment '
Figumi":Comston-ftttemrt.
I
I
1
1
I
I
1
1
I
I
1
1
I
I
1
1
1
1
I
1
1
Chqpïtre lll ,1 Corrosion de 1 'alumirtium
11 1
4. Fomes de €orrosion d'a]umhium |
4. Fomes de €orrosion d'a]umhium iIj5salliagesd'alurium,spécialeinentceuxdesséries|
000 et 7000 sont sens-ibles à la corrosion. De manière générale, pou 1'aluminium et ses al]ages, du frit de leu passivité et de leu affinité pou l'oxygène, la corrosion est souvent l ,isée aux points ftibles (défauts)
de la couche protectrice. Nous pouvons dénombrer de !1 principaux types de conosionpourœsamages. locali§ëe: '•.®lacorrosionparpiqûre,
«:. la corrosion inter-granulaire.
Néanmoins, il exjste d'amres fomes de corrosion rencontrée
Tablcau m-l : Différentes fomes de corrosion d'
•age de l'alunririm. [9]Formes de corrosion
L ,,l 1, LJ'`J`. ` . h
iJI,uHl ' 1, ' 1 1,Llil,Iil'
1000
Aum
Piques, générdisée.2000
Cuivre(Cu)
Piqtues, généralisée, souscontrainte,intergramilaii`e,feuilletante.
3000
hÆmg"èseOh)
Piqures, générilisée. 4000Silicim(Si)
Piqures, généraLisée. S000Magnésimadg)
Piq€, générdisée, souscontrainte®oulesfi}rtstaux enmagnésim)
6000
Silicim et magnési '(SietMg)
Piq-, générdisée.
7000
Zinc (avc€ ou sms cui |(ZhetCu) )
Piqures, généralisée, souscontrainte,intergrmulaire,feuilletante.
I
I
1
1
I
1
1
1
1
I
I
I
I
I
1
1
I
I
I
I
I
Chapitre 111 Corrosion de 1 'aluminium
5. Protection contn la coiTosion
La lutte contre la corrosion représente toutes les mesures qu'on peut prendre pou
protéger les matériaux métalliques contpe l'action destructive du milieu. La protection la plus immédiate est de choisir des métaux ou alliages résistant aux milieux agressifs. Et, dès la
phase de conception d'une installation, la protection contre la corrosion doit être considérée pou éviter de nombreux problèmes et garantir une certaine duée de vie. La solution adoptée doit être compatible avec les prescriptions concernmt la protection de l'enviromement et pemettre le recyclage ou l'élimination des diffërents composants à la fm de leu utilisation.
Plusieus techniques de protection existent que l'on peut classer comme ci après:
• prévention par une forme adaptée des pièces; • prévention par un choix judicieux des matériaux; • protection par revêtements ;
• protection par inhibiteurs; • protection électrochimique [10].
11 est à noter que des mesures préventives, prises au bon moment, permettent d'éviter de
nombreux problèmes de corrosion, et cela souvent sans fiais supplémentaires.
5.1. Les inhibiteurs 5.1. 1. Dérmition
Un inhibiteu par la National Association of Conosion Engineers aqACE) est la suivante : u` inhibiteu de conosion est une substance chimique qui ajoutée à frible concentration au milieu corrosif, ralentit ou stoppe le processus de corrosion d'm métal placé
au contact de ce milieu [ 1 1 ]
5.1. 2. Propriétés des inhibiteurs
Quamd on veut uti]iser ui inhibiteu, on essaye de trouver le meilleu. Cet inhjbiteu
doit présenter plusieus caractéristiques : [12]
> Abaisser la vitesse de corrosion d'm métal, sans en affecter les caractéristiques physico-chimique, en particulier la résistance mécanique ®ar exemple, risque de
ffagilisation par l'hydrogène en milieu acide)
> Etre stable en présence des autres constituants du milieu > Etre stable aux températues d'utilisation
I
I
I
I
1
1
I
I
1
1
I
I
I
1
1
I
I
I
I
I
I
Chapitre lll Corrosion de l 'aluminium
> Etre efficace à fàible concentration > Ne pas être toxique
> D'un point de vue économique, son prix est aussi très important (être peu onéreux)
5. 1. 3. Domæhe d'utilisation des inhÉbjteui¥
Les inhibiteurs ont plusieurs domaines traditiomels d'application :
• Le traitement des eaux (eaux sanitaires, eaux des procédés industriels, eaux de
chaudières...etc.)
• L'industrie du pétrole : forage, extraction, raffinage, stockage et transport. Dans cette industrie l'utilisation des inhibiteurs de corrosion est primordiale pou la sauvegarde
des installations
• Les peintures où les inhibiteurs de corrosion sont des additifs assurant la protection anticorrosion des métaux
• La protection temporaire des métaux, que ce soit pendamt le décapage acide, le nettoyage des installations ou le stockage à l'atmosphère (inhibiteus volatils, incorporation aux huiles et graisses de protection temporaire) ou pou le traitement des
huiles de coupe [13]
S. 1. 4. Conditions d'utilisation des inhibiteurs
Un inhibiteu peut êtne utilisé comme unique moyen de protection :
/ Soit comme protection ; 1'inhibiteu pemet alors l'utilisation des matériaux métallique (feneux non alliés, par exemple) dans les conditions satisfrisantes de
résistance à la corrosion, une surveillance de l'installation s'impose [14].
/ Soit comme protection temporaire pendant une période où la pièce ou l'installation est particulièrement sensible à la corrosion (stockage, décapage, netioyage). Dans ce cas, le contrôle du système est a priori plus simple, la prévision du comportement de l'inhibiteu dans le temps étant plus facile à fàire
Un inhibjteur peut être combiné à un autre moyen de protection supplémentaire d'un alliage à haut résistance à la corrosion, addition à un revêtement de surface tel que peinture,
graisse, huile, etc.
I
I
I
I
1
1
I
1
1
I
I
I
I
I
I
I
I
I
I
I
I
1
I
I
I
1
1
I
I
I
I
I
1
1
1
1
I
I
I
I
I
I
Chapitre 111 Corrosion de 1 'aluminium
b) Ires inhibüeiirs pœssivœnt
Ces inhibiteurs foment des films de paLssivation entre la surface corrodée et les
molécules d'inhibiteur. L'inhibition s'appelle aussi « inhibition d'interphase ». Ils sont
également incorporés dans les couches barrières et ainsi ces molécules inhibitrices conduisent
à des résœux homogèncs et denses présentant de fàit une fàible porosité et une bonne
stabilité [16].
c) Les inhibüeurs par i}récipitation
Certains inhibiteus provoquent la formation de films superficiels par précipitation de
sels minéraux ou de complexes orgmiques peu solubles. Ces films réduisent l'accessibilité de
l'oxygène à la surface, ils bloquent partiellement la dissolution anodique.
d) IAs inhibÈteurs pœr élin.Ènation de l'agent corrosiç
Ce type d'inhibiteus n'est applicable que dans les systèmes femés. 11 se pratique notament dms les circuits d'eau chaude des centrales themique. Une frible quantité de sulfite de sodium ou d'hydrazine ajoutée à l'eau, préalablement dégazée et dés ionisée,
supprime les dernières traces d'oxygène et élimine ainsi la corrosion. Par exemple, l'ajout
d'hydrazine [17].
N2H4+02 + N2+2H20
5. 1. 5. 2. Classement par réaction partielle a) Les inhibiteurs anodiques
ljes inhibiteus anodiques sont très nombreux. Ce sont des substances inorganiques corrme les orthophosphates, silicates, chromates, molybdate. . .Leu mode d'action consiste à élever la valeu du potentiel de corrosion du matériau afin de l'amener à une valeu pou laquelle il y a fomation d'un film passif protecteu su l'anode. Même si les inhibiteuis modiques sont très efficaces et souvent utilisés, ils ont généralement une propriété indésirable: si la teneu en inhibiteu est/ou devient progressivement abaissée, la surface métallique n'est plus entièrement couverte, et elle fonctiome comme mode, obtenant ainsi Lme combinaison dangereuse, une petite anode et une grande cathode, conduisant à la corrosion par piqûres. Dans ce cas, l'inhibiteu fàit plus de mal que de bien. C'est pou ça que
les inhibiteurs anodiques sont souvent désignés comme dangereux. [ 18].
I
I
I
I
I
I
1
1
I
I
1
1
I
I
I
I
I
I
I
1
1
b) Iies inh.ibæeurs cœthodÈqiies
L'action de ces inhibiteus se traduit par une diminvtion de la vitesse de la réaction
:teLïæïv--si
cathodique et donc par `m déplacement du potenti
nobles. Ce sont généralement des cations qui peuven.
ÜÏ
ion veis des valeus moins
la surfaoe cathodique, où ils
précipitent sous fomes de sels basiques ou mydroxydes,( fommt des films adhérents et
compacts. D'après leu mode d'action on observe qu'ils so tnès acides [14, 12]. On peut distinguer trois catégories d'inm
• les poisons cathodiques (ils rendent plus difficile • les précipités cathodiq.`ies Oe pH du milieu doit
utiles dans les environnements iteurs:
ction des ions H|,
usté afin de ne pas précipiter
ËaJ:
les sels sous la fome d'une suspension non protectnce)
• les désoxygénants ou les fixateurs d'oxygène (s\ilfites O¢a2S03) ou l'hydrazine (N2IL4) ce ne sont pas, à proprement parler,
c) Les inhibiœuTs nùxtis
Ces inhibiteLm diminuent la vitesse des deux
le potentiel de corrosion. [19]
Les diagmmme d'Evans de la figure 1 synthétise les divers
partielles, mais modifient peu
de ces types d'inhibiteus
:`s::
Figure m-io: Diag]ammes d.Evans montrant le déplacem du potentiel de corrosion dû à
la présence d'un inhibiteu de cono§ion [20]
I
1
1
I
I
1
1
I
I
I
I
I
I
1
1
I
I
I
I
I
I
Chqpitre 111 Corrosion de 1 'alumirïiwm
5. 1. 5 .3. Classen.enL i)u domaÈne d'appLicqtÈon
Dans la classification relative au domaine
inhibiteurs de corrosion utilisée en milieu aqueux,
o::a:ïŒcæo°uD
on peut distinguer les ue ou gazeux. Ceux utilisés en inilieux aqueux sont choisis en fonction de pH du milieu.
5.1. 6. Nqiure des inhibiœuæ: \| œ) Ir.hibüe.irs orgar.iq..es
œms]O=sL::=]:d::g:qb:Œ¥"::stïæuritii=ï]tad:::in:
Lïe:Ëpiïsc:a
principalement des atomes
#ei:=:::
élevée, même à ftible
moléculaiie de l'inhibiteu.
aux propriétés chimiques de la couche fomée sur
La plupari des ces inhibiœuis ont dans leu s
d'azote, de soufie ou d'oxygène
h principàle caractéristique de ces inhibiteurs est concentnation. L'effst inhibiteu augmente souvent avec
L'utilisation d' inhibiteus organiques est préfërée pou des rrisons d' écotoxicité.
΍-2 q7
NitTiœ dE dicyclohexylamine BemdiaŒc* {BTA) Fîgtir€ m-1l: quelques inhibiteus b) InhibiLeurs inorganiqiiesCes inhibiteurs minéraux sont utilisés en milieux al acides. Les molécules minérales se dissocient en sol`ition
&Î-m+
BenzDate t* sodiL.m
es de corrosion.
calins et presque jamais en milieux
lï,:':`.s
::]:;bîtiiTbî:ï:Cï=.]::::ym¥l'eie;i;:]Î::i:'
réglementé car ils créent des problèmes pou l'environnemen+
anions et cations ass`mt en
les phosphates sont les plus plupart des ces produits est
I
I
1
1
1
1
I
1
1
I
1
1
I
1
1
I
1
1
I
I
I
5. 1.7. Mode d'affion des Înhil)it€urs de corrosion
n n'existe pas de mode d'action unique des inhibiteus de comosion. Un même composé
Ï:ffld':L£:tio:)U::;r:mmœ:ï=;î:'stm:°onuvqi=eiiu:°:îtïe:::=:=ts=
lequel chaque inhibiteur agit dans les conditions dans certain nombne de considérations de base valàbles pou to
t la oorrosion étmt tm processus cssentiellemei
l.inhibiœu ne peiit se firire qu'au niveau d'ime des (transport d'espèces en solution, formation d'in des espèces à la surface des phases solides, transfert
t l'intervention de l'inhibite`n dans le pmœssus (oxygène, protons, produits de réaction) an sein de
lles il est placé, il existe un s inhibiteurs:
électiochimique, l'action de
des réactions élémentaires édiaires superficiels, adsoiption
charge électronique) ;
port des œpèoes électDactivcs
:eùï,nT=Ï
peu probable, lemécanisme d'action d'un inhibiteu est le plus soùvent à rechercher au voisinage immédiat de la surflce (au contact du métal ou dans
On peut concevoir l'action de l'inhibiteu comme :
Ïmneœntigtiàœiie.ci).
+ l'interposition d'me barriène cme le métal et le müieu corrosif, dans ce cas, qtri est
de essentielleinent celui des milieux acides, le rôle
surfæe sera primordial ;
+ le renforcement d'une barière préexistante, d'hydroxyde formée natimllement en milieii
pouna consister en une extension de l'oxyde à la
l'adsorption du œmposé à la
en général la couche d'oxyde ou
nsemïe:
ou alcalin. Ce renforcemcmt ou en la précipitation de sels aux endroits fiàibles de l'oxyde, ces sels étant des produits de conosion ;inhibitem et `me ou pluieuis étant égalcment spécifique des
'u:
+ la formation d'une barrière par interaction entre 1 espèces du milieu comsif, ce t)pe de mécanisme
milieux neutres ou alcalins.
Iæ mécanisme d'action d'un inhibiteu peut être considéré soi • m aspect mécanistique (intervention dans les process
deux aspects :
fondamentaux de la conosion) • m aspect morpholodque (intervention de la molécule d'inhibiteu dans la structue
nht::::eientciahqŒiemstanimed'arionlaseüffémcierfomŒtŒ
fonction des caractéristiques de pH du milieu [16].


![Figure m-io: Diag]ammes d.Evans montrant le déplacem du potentiel de corrosion dû à la présence d'un inhibiteu de cono§ion [20]](https://thumb-eu.123doks.com/thumbv2/123doknet/14530732.723503/48.892.107.829.333.1214/figure-evans-montrant-déplacem-potentiel-corrosion-présence-inhibiteu.webp)

![Figure 01 : diagramme de phase binaire (Al-Zn) I 1 1 1 I 1 4m3ü M82Al` 0 10 20 3() 40 St} 60 70 80 ç}O Iot}À]urninjum {wlçg)](https://thumb-eu.123doks.com/thumbv2/123doknet/14530732.723503/89.892.104.808.128.692/figure-diagramme-phase-binaire-al-iot-urninjum-wlçg.webp)
