HAL Id: hal-02988122
https://hal.archives-ouvertes.fr/hal-02988122
Submitted on 4 Nov 2020
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of
sci-entific research documents, whether they are
pub-lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destinée au dépôt et à la diffusion de documents
scientifiques de niveau recherche, publiés ou non,
émanant des établissements d’enseignement et de
recherche français ou étrangers, des laboratoires
publics ou privés.
RECHERCHES EXPÉRIMENTALES SUR
L’ÉVOLUTION LARVAIRE DE SKRJABING YL US
NASICOLA (NEMATODA :
METASTRONGYLOIDEA) CHEZ DEUX
MOLLUSQUES TERRESTRES
André Théron
To cite this version:
André Théron. RECHERCHES EXPÉRIMENTALES SUR L’ÉVOLUTION LARVAIRE DE
SKR-JABING YL US NASICOLA (NEMATODA : METASTRONGYLOIDEA) CHEZ DEUX
MOL-LUSQUES TERRESTRES. Vie et Milieu , Observatoire Océanologique - Laboratoire Arago, 1975,
pp.49 - 54. �hal-02988122�
Vie Milieu, 1975, Vol. XXV, fasc. 1, sér. C, pp. 49-54.
RECHERCHES EXPÉRIMENTALES
SUR L'ÉVOLUTION LARVAIRE
DE SKRJABING YL US NASICOLA
(NEMATODA : METASTRONGYLOIDEA)
CHEZ DEUX MOLLUSQUES TERRESTRES
par André THÉRON
Département de Biologie Animale, Centre Universitaire, F 66025 Perpignan
ABSTRACT
Skrjabingylus nasicola, a nematode parasite of the frontal sinus of Mustelids, has been found in Mustela nivalis from the South of France. The extra-mammalian larval stages of S. nasicola develop experi-mentally in two terrestrial snails : Helicella arenosa and Euparypha pisana.
According to the type of vector, the length of larval development is différent. This development is faster in H. arenosa than in E. pisana.
Third-stage larvae are not encysted in the intermediate host.
INTRODUCTION
Skrjabingylus nasicola (LEUCKART, 1842), est un Nématode
parasite des sinus frontaux des Mustelidae, connu de diverses localités d'Europe et d'Amérique du Nord. Nous l'avons découvert chez les Mustela nivalis de la plaine du Roussillon, qui sont à l'état adulte parasités à 100 %.
Les travaux expérimentaux de DUBNITSKY A.A., 1956, ont
50 A. THÉRON Nématode évoluent chez différentes espèces de Mollusques terrestres.
D'après HANSON I., 1967, des poïkylothermes et certains
micro-mammifères peuvent intervenir, en tant qu'hôtes paraténiques, dans ce cycle. L'évolution des larves du 3e stade se poursuit chez
le Carnivore où leur migration vers le microbiotope définitif entraîne des troubles pathologiques importants (LANKESTER M.W.
et ANDERSON R.C., 1971).
Nous avons recherché les modalités du développement larvaire de S. nasicola chez deux Gastéropodes terrestres : Helicella arenosa Ziegler, 1837 et Euparypha pisana (Millier, 1774) Germain, 1929.
RÉSULTATS
Les adultes (1) récoltés dans les sinus frontaux, permettent par dilacération de l'utérus des femelles gravides, d'obtenir des larves infestantes en abondance (les femelles sont vivipares). Les infestations sont réalisées en réunissant, dans un cristallisoir saturé de vapeur d'eau, les larves réparties sur un papier filtre et les Gastéropodes. Après 24 heures, ces derniers sont placés dans une enceinte climatique à + 20 °C et 100 % d'humidité relative.
Des dissections à intervalles réguliers permettent de suivre l'évolution du parasite chez le vecteur.
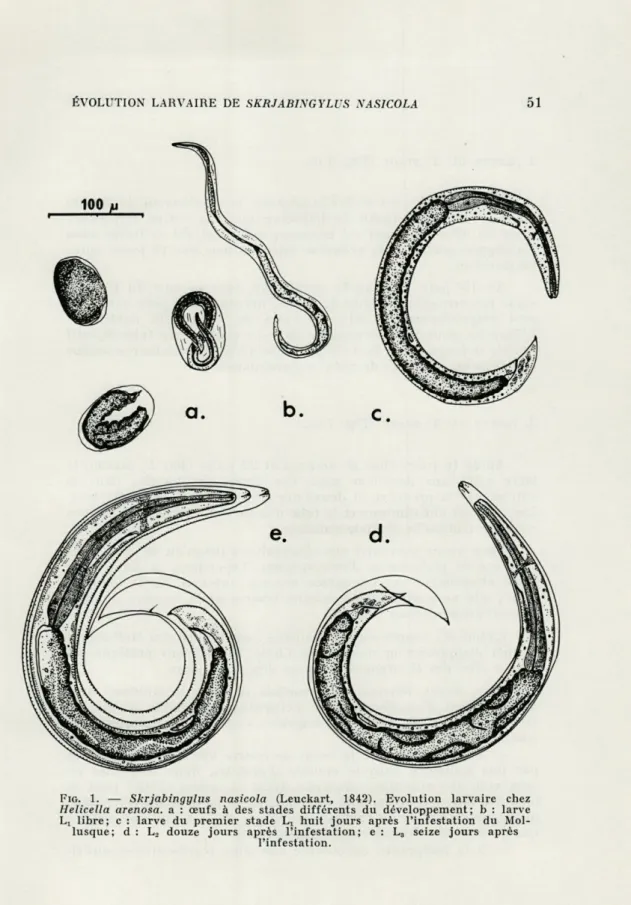
1. LARVE DU 1er STADE (Fig. 1 b et c).
Les larves Lt mesurent 330 u. de long et 19 [x de large; le
collier nerveux est à peine ébauché, la lumière du tube digestif est très étroite.
Ces larves pénètrent dans le pied des Mollusques. La première mue n'a lieu qu'après une période de croissance où apparaissent les ébauches des systèmes génital, nerveux et excréteur. Le tube digestif distendu est rempli de nombreuses granulations très réfrin-gentes. Après 8 jours, la larve mesure 515 |x de long.
(1) Mentionnons à ce propos que les Nématodes adultes sont porteurs dans l'ensemble de leurs tissus, d'un pigment rouge vif qui ne se trouve pas chez les larves. Une analyse spectrophotométrique en lumière visible de ce pigment en solution saline nous a montré un pic important à 413 mp. et deux pics d'absorption plus faible à 450 et 576 mp.. Le premier de ces pics ou bande de Soret est caractéristique des porphyrines et l'ensemble du spectre est analogue à celui d'une solution d'hémoglobine diluée. Le pigment rouge de S. nasicola est donc de nature hémoglobinique.
ÉVOLUTION LARVAIRE DE SKRJABINGYLUS NASICOLA 51
FIG. 1. — Skrjabingylus nasicola (Leuckart, 1842). Evolution larvaire chez
Helicella arenosa. a : œufs à des stades différents du développement; b : larve
Lt libre; c : larve du premier stade Lj huit jours après l'infestation du Mol-lusque; d : L2 douze jours après l'infestation; e : L3 seize jours après
52 A. THÉRON
2. LARVE DU 2e STADE (Fig. 1 d).
Lorsque l'hôte est Helicella arenosa, le décollement de la pre-mière mue débute à partir du douzième jour. Par contre, ce premier stade du développement est beaucoup plus lent s'il s'effectue chez Euparypha pisana et la première mue n'a lieu que 18 jours après l'infestation.
Au 13e jour, la larve L2 enveloppée dans la mue du premier
stade mesure 585 u. de long. L'anneau nerveux et le pore excréteur sont respectivement à 91p. et 114 u. de l'extrémité antérieure. L'ébauche génitale est longue de 28 p.. Le contenu du tube digestif semble se fragmenter. Dans la partie postérieure, on observe autour de l'anus un complexe de cellules glandulaires.
3. LARVE DU 3e STADE (Fig. 1 e).
Après 16 jours chez H. arenosa et 23 jours chez E. pisana, la larve subit une deuxième mue. Ces larves enveloppées dans la cuticule de la première et deuxième mue mesurent 660 u. de long. Les réserves ont diminué et le tube digestif semble se vider de son contenu. L'ébauche génitale s'allonge.
Nous avons poursuivi nos observations jusqu'au 48" jour sans observer de phénomène d'enkystement. Cependant, la larve s'en-roule étroitement sur elle-même souvent entourée de la dernière mue ; elle ne contient plus aucune réserve et la lumière du tube digestif est à nouveau vide.
L'étude de coupes sériées réalisées dans le pied des Mollusques permet d'apprécier la réaction de l'hôte. Nous avons pratiqué ces coupes chez des H. arenosa infestées depuis 21 jours.
Nous avons observé une réaction de type granulome, avec accumulation d'amoebocytes et d'éléments conjonctifs autour de chaque larve. A ce stade, ces capsules réactionnelles s'organisent comme suit :
— au centre, contre la larve, se trouve une zone caractérisée par une structure anhyste creusée d'alvéoles, dans lesquelles on peut voir une substance amorphe ayant la même afinité pour le bleu d'aniline que le contenu intestinal de la larve. Dans cette zone, qui semble résulter de l'activité trophique de la larve, ont pénétré quelques noyaux turgescents et dégénératifs;
essentiel-ÉVOLUTION LARVAIRE DE SKRJABINGYLUS NASICOLA 5.1
lement par une accumulation importante de noyaux amoebocytaires. Ces noyaux ne semblent pas montrer de caractères pathologiques; près de la zone centrale, ils s'orientent tangentiellement à celle-ci. Cet agglomérat d'amoebocytes, au fur et à mesure de sa crois-sance repousse à la périphérie les fibres conjonctives voisines. Ces fibres se tassent les unes contre les autres sans toutefois indivi-dualiser la capsule réactionnelle.
DISCUSSION
H. arenosa et E. pisana sont des hôtes expérimentaux nouveaux pour le développement larvaire de S. nasicola. Il est intéressant de souligner, que pour des conditions expérimentales en totalité iden-tiques, la vitesse du développement est différente chez ces deux vecteurs.
L'évolution chez H. arenosa est plus rapide que chez E. pisana, mais moins toutefois que chez Agriolimax reticulatus d'après les observations de DUBNITSKY comme en témoigne le tableau suivant :
Mollusque vecteur Première mue Deuxième mue
A. reticulatus 8 jours 15 jours
H, arenosa 12 jours 16 jours
E. pisana 18 jours 23 jours
Soulignons enfin, que contrairement à DUBNITSKY, nous n'avons
pas observé d'enkystement des larves chez l'hôte intermédiaire mais seulement des capsules réactionnelles non individualisées par une paroi kystique.
RÉSUMÉ
Skrjabingylus nasicola, Nématode parasite des sinus frontaux de Mustelidés, a été trouvé chez Mustela nivalis dans le Midi de la France.
54 A. THÉRON expérimentalement chez deux Mollusques terrestres : Helicella
arenosa et Euparypha pisana.
La durée du développement larvaire est différente suivant le vecteur. Celle-ci est plus rapide chez H. arenosa que chez E. pisana. Les larves du 3e stade ne sont pas enkystées chez l'hôte
inter-médiaire.
ZUSAMMENFASSUNG
Skrjabingylus nasicola, schmarotzender Nematode aus den
frontalen Stirnhôhlen der Musteliden, wurde in Sûd-Frankreich bei
Mustela nivalis entdeckt.
Die bei Sâugetieren nicht vorkommenden Larvalstadien entwik-keln sich experimentell in zwei terrestrischen Mollusken : Helicella
arenosa und Euparypha pisana. Die larvale Entwicklungsdauer
verlàuft schneller bei H. arenosa als bei E. pisana. Die Larven des dritten Stadiums verkapseln sich nicht im Zwischenwirt.
BIBLIOGRAPHIE
DUBNITSKY, A.A., 1956. A study of the life cycle of the Nematode
Skrja-bingylus nasicola, a parasite of the frontal sinus of furbearing
animais of the marten family (in Russian). Karakule. Zverov., 9 :
59-61.
HANSON, I., 1967. Transmission of the parasitic nematode Skrjabingylus
nasicola (Leuckart, 1842) to species of Mustela (Mammalia). Oikos,
18 : 247-252.
LANKESTER, M.W. & B.C. ANDERSON. The route of migration and patho-genesis of Skrjabingylus spp. (Nematoda : Metastrongyloidea) in Mustelids. Can. J. Zool, 49 : 1283-1293.