HAL Id: tel-03129086
https://tel.archives-ouvertes.fr/tel-03129086
Submitted on 2 Feb 2021HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Approche immunométabolique du traitement de
l’obésité par une activation de la voie PPARβ/δ ou un
apport en acide α-lipoïque dans une étude
translationnelle
Sebastien Le Garf
To cite this version:
Sebastien Le Garf. Approche immunométabolique du traitement de l’obésité par une activation de la voie PPARβ/δ ou un apport en acide α-lipoïque dans une étude translationnelle. Biologie moléculaire. Université Côte d’Azur, 2020. Français. �NNT : 2020COAZ6017�. �tel-03129086�
THÈSE DE DOCTORAT
Approche immunométabolique du traitement de
l’obésité par une activation de la voie PPARβ/δ ou
un apport en acide α-lipoïque dans une étude
translationnelle
Sébastien LE GARF
Centre Méditerranéen de Médecine Moléculaire (C3M)
Présentée en vue de l’obtention du gradede docteur en Sciences de la Vie et de la Santé (Recherche clinique et thérapeutique) d’Université Côte d’Azur
Devant le jury, composé de :
Pr Martine Duclos, PU-PH, INRA UMR1019 Dr Philippe Gual, DR2, INSERM U1065 Dr Laurence Mille-Hamard, MCU, UBIAE Dr Béatrice Morio, DR1, INSERM U1060
Approche immunométabolique du traitement de
l’obésité par une activation de la voie PPARβ/δ
ou un apport en acide α-lipoïque dans une étude
translationnelle
COMPOSITION DU JURY DE THÈSE
Président du jury
Dr. Philippe GUAL, Directeur de recherche INSERM U1065, Centre Méditerranéen de Médecine Moléculaire (C3M), Université Côte d’Azur (UCA).
Rapporteurs
Dr. Laurence MILLE-HAMARD, Maître de conférences, HDR, Unité de Biologie Intégrative des Adaptations à l’Exercice (UBIAE), Université d’Évry-Val-d’Essonne. Dr. Cédric MORO, Directeur de recherche INSERM U1048, Institut des Maladies Métaboliques et Cardiovasculaires (I2MC), Université Toulouse III.
Examinatrices
Pr. Martine DUCLOS, Professeure des Universités-Praticien Hospitalier, Institut National de Recherche pour l’alimentation et l’environnement (INRAE), Unité de Nutrition Humaine, Université Clermont Auvergne.
Dr. Béatrice MORIO, Directeur de recherche INSERM U1060, Laboratoire CarMeN – INRAE 1397, Université Lyon I.
Directrice de thèse
Dr. Anne-Sophie ROUSSEAU, Maître de conférences, HDR, INSERM U1065, Centre Méditerranéen de Médecine Moléculaire (C3M), Université Côte d’Azur (UCA).
RÉSUMÉ
La réponse immunitaire et la régulation métabolique sont étroitement imbriquées. Cette interface, appelée l’immunométabolisme, est un processus central pour l’homéostasie de l’organisme. Ce processus est altéré au cours de la pathogenèse de l’obésité. Cette maladie contribue à l’installation d’une inflammation chronique de bas-grade à l’origine de comorbidités et caractérisée par l’augmentation de cellules inflammatoires à l’instar de lymphocytes T (LT) pro-inflammatoires et une diminution en partie de LT anti-inflammatoires. Ces derniers sont majoritairement composés des LT régulateurs, Tregs, étant singuliers au regard de leur utilisation préférentielle du métabolisme d’oxydation des acides gras libres (AGL). L’activité physique et l’équilibre alimentaire sont des stratégies de premier recours dans la prise en charge de l’obésité. Ces interventions non-médicamenteuses (INM) sont la pierre angulaire dans la perte de poids durable. Elles imposent un changement de mode de vie devant être associé à une programmation personnalisée pour être efficace sur le long terme. L’objectif de nos recherches est de potentialiser les effets de ces INM, dans un modèle femelle où les données fondamentales manquent indéniablement, par un traitement avec un agoniste de PPARβ/δ ou avec l’acide alpha-lipoïque (ALA). Ces deux candidats sont des modulateurs du métabolisme oxydolipidique et du statut Redox. L’hypothèse émise est une amélioration du statut immunitaire par ces traitements complémentaires aux INM en favorisant l’orientation des LT vers un profil Tregs.
Première étude : en condition d’obésité chez la souris femelle, nous avons étudié les effets de l’agoniste GW0742 de PPARβ/δ associé aux INM de l’obésité et nous avons mis en évidence des effets spécifiques du traitement GW0742 traduisant une augmentation de la prévalence des Tregs dans les ganglions lymphatiques et de l’activité de l’AMPK ainsi qu’une réduction plus importante du tissu adipeux viscéral et de l’inflammation du muscle squelettique.
inflammatoire et observé une augmentation des capacités oxydatives des LT ex vivo et de l’oxydation des AGL des LT in vitro. En effet cette supplémentation, chez la souris femelle rendue obèse et la femme en situation d’obésité, réduit l’adiposité viscérale et s’accompagne d’une augmentation, seulement investiguée chez la souris, de la concentration en Tregs dans le TAV.
L’administration en ALA est une stratégie complémentaire des INM de l’obésité en régulant le métabolisme et potentiellement le statut Redox des Tregs. Après avoir montré le rôle significatif de la voie PPARβ/δ dans l’augmentation du métabolisme oxydolipidique des LT, notre équipe a approfondi par ces travaux de thèse, la piste thérapeutique de l’obésité sur la régulation du métabolisme des Tregs et ses répercussions bénéfiques sur le statut immunitaire en prévention de l’inflammation systémique. Il reste à démontrer le degré d’implication des voies de signalisations Nrf2 et PPARβ/δ pouvant être à l’origine de ces modifications du statut immunitaire observées.
Mots clés : Immunométabolisme, Interventions Non-Médicamenteuses (INM), Lymphocytes T régulateurs (Tregs), Obésité.
ABSTRACT
The immune response and metabolic regulation are closely linked. This interface, called immunometabolism, is a central mechanism of systemic homeostasis. It is altered during the pathogenesis of obesity. This disease contributes to the onset of chronic low-grade inflammation that causes comorbidities and is characterized by an increase in pro-inflammatory T lymphocytes (T cells) and a decrease in anti-inflammatory T cells. The latter are mainly composed of regulatory T cells, Tregs, that are unique in terms of their preferential use of free fatty acids (FFA) oxidation. Physical activity and healthy diet are first-line strategies in the management of obesity. These non-drug interventions (NDI) are the cornerstone in sustainable weight loss. They impose a lifestyle change that must be combined with personalized programming to be effective over the long term. The objective of our research is to potentiate the effects of these NDI, in a female model, where the fundamental data are undeniably lacking, by the use of a PPARβ/δ agonist and alpha-lipoic acid (ALA). These two candidates are modulators of fatty acid oxidation and redox status.
First study: under obesity conditions, in female mice, we have studied the effects of the agonist GW0742 of PPARβ/δ associated with NDI of obesity and we have shown specific effects of treatment GW0742 reflecting an increase in the prevalence of Tregs in the lymph nodes and AMPK activity as well as a greater reduction in visceral adipose mass and inflammation of skeletal muscle.
Second study: effects of the use of ALA, a powerful antioxidant with anti-inflammatory properties, and this molecule increases the level of expression and the transcriptional activity of PPARβ/δ. ALA is involved in the regulation of Redox status, by increasing the GSH/GSSG ratio and via the Nrf2 pathway, and in the oxidative metabolism of T cells. Using a translational approach, we demonstrated the effects of ALA administration associated with NDI on the inflammatory profile by observing an increase in the oxidative capacities of CD4+ T cells in vivo and the oxidation of FFA of CD4+ T cells in vitro. In fact, this supplementation, in obese female mice and obese women, reduces visceral adiposity and is accompanied by an increase, only investigated in mice, in the concentration of Tregs in visceral adipose tissue.
Administration of ALA is an effective complementary strategy for NDI in obesity by regulating the metabolism and potentially the Redox status of Tregs. After showing the significant role of the PPARβ/δ pathway in the increase of the oxidolipid metabolism of T cells, our team deepened by these thesis work, the therapeutic track of obesity on the regulation of Treg metabolism and its beneficial repercussions on the immune status in prevention of systemic inflammation. It remains to demonstrate the
REMERCIEMENTS
À mon jury de soutenance de thèse,Vous me faites l’honneur d’accepter d’évaluer mes travaux de thèse. Je remercie le Dr Philippe Gual de présider mon jury de thèse, les Drs Laurence Mille-Hamard et Cédric Moro d’en être les rapporteurs et le Pr Martine Duclos et le Dr Béatrice Morio d’en être les examinatrices. À ma directrice de thèse, Dr Anne-Sophie Rousseau,
Tous nos échanges scientifiques m’ont été inestimables et ont fait mûrir mon sens de réflexion. Tu as toujours su mettre en place les conditions idéales pour que je puisse m’épanouir scientifiquement. Cette thèse n’aurait jamais pu voir le jour sans ton dévouement et je te remercie pour la confiance que tu m’as accordée.
À l’ensemble des membres de l’équipe 9 du C3M,
Vous m’avez tous accepté avec mon caractère et j’ai bien conscience de sa complexité… Merci au Dr Jaap Neels et au Pr Guilia Chinetti d’avoir pris de leur précieux temps à m’aiguiller tout au long de mon doctorat y compris pendant la dernière ligne droite. Un immense merci à Joseph Murdaca, aux Drs Isabelle Mothe-Satney, Brigitte Sibille, Gwenaëlle Le Menn et Claudine Moratal. Isabelle et Brigitte, vous avez su être disponible et nous avons créé des liens d’amitiés qui me sont chers (copains comme cochons).
Aux professionnels de l’Institut Polyclinique de Cannes,
Madame Géraldine Journel, les Drs Philippe Fauqué et Émilie Perrin, monsieur Cyril Eininger, les diététiciennes (Audrey et Julie), les infirmières et les enseignants en APA (François et Laurie), vous êtes en grande partie responsable de la faisabilité et de la qualité de l’étude clinique. Je vous en remercie très sincèrement.
À mes collègues et amis thésards,
Au cours de ces 3 dernières années, les sentiments de déception, de frustration mais aussi d’assouvissement nous ont rapprochés. Qui d’autre aurait pu me comprendre et me rassurer tout en relativisant… merci à Johanna, Adélie, Alexia et Marion.
À mes mentors de tous horizons,
Joseph M, tu m’as enseigné une infime partie de ton immense savoir m’ayant permis de m’émanciper dans la recherche fondamentale.
Pr Rodolphe Anty et Dr Véronique Nègre, vous êtes à l’origine de mon attirance pour la recherche clinique et ma compréhension de cet écosystème.
Daniel R, depuis ma tendre enfance, tu es l’essence même de mon ouverture d’esprit. À ma tendre et chère famille,
Mes parents, Maman et Kounou, ce travail est le vôtre. Je suis le fruit de votre éducation et c’est en m’inculquant toutes vos valeurs que j’en suis là. Je suis tellement heureux et fier de vous avoir à mes côtés. À ma belle-famille, vous m’avez accueilli les bras ouverts depuis ces nombreuses années. Tous les moments partagés avec vous ont été une source intarissable de joie et ceci a été d’autant plus vrai pendant la période de confinement où j’ai été dans de parfaites conditions pour la rédaction de ce manuscrit.
À l’amour de ma vie, tu m’as supporté, réconforté et aimé en toutes circonstances pendant ces années de thèse.
TABLE DES MATIÈRES
1
GÉNÉRALITÉS SUR L’OBÉSITÉ ... 15
-1.1 Définition et histoire ... 15
-1.2 Épidémiologie ... 16
-1.3 Physiopathologie de l’obésité ... 17
-1.4 Inflammation chronique de basgrade... 20
-2
SYSTÈME IMMUNITAIRE ET OBÉSITÉ ... 22
-2.1 Le système immunitaire : inné et adaptatif ... 22
-2.1.1 Immunité innée ... 22
-2.1.2 Immunité adaptative ... 22
-2.2 Régulation de l’inflammation de bas-grade : rôle de l’immunité adaptative ... 25
2.2.1 Lymphocytes T CD8+ ... 25
2.2.2 Lymphocytes T CD4+ ... 26
2.3 Immunométabolisme : interface entre l’immunité et le métabolisme ... 33
2.3.1 Voies métaboliques énergétiques ... 35
2.3.2 Métabolisme des lymphocytes T ... 38
2.4 Lymphocyte T : implication du stress-oxydant et du statut Redox ... 44
3
RÉCEPTEURS NUCLÉAIRES : rôle de PPARβ/δ dans
l’obésité ... 49
3.1 PPARα et PPARγ ... 50
3.2 PPARβ/δ : généralités ... 52
3.3 PPARβ/δ et immunométabolisme ... 58
3.3.1 PPARβ/δ et métabolisme énergétique ... 58
3.3.2 PPARβ/δ et l’inflammation de bas-grade dans l’obésité ... 64
3.3.3 PPARβ/δ et immunométabolisme : lymphocytes T ... 66
3.3.4 Fonction prophylactique de la voie PPARβ/δ : essais cliniques ... 67
4
MESURES THÉRAPEUTIQUES : effets sur l’inflammation
associée à l’obésité ... 70
4.1 Mesures médicamenteuses et chirurgicales ... 70
4.2 Interventions non-médicamenteuses : mesures hygiéno-diététiques ... 71
4.2.2 Activité physique : généralités et implication dans l’inflammation ... 77
4.2.3 Compléments alimentaires et réduction de l’inflammation liée à l’obésité ... 87
5
ACIDE ALPHA-LIPOÏQUE ... 89
5.1 Acide α-lipoïque : généralités ... 89
5.2 Modes d’action de l’acide α-lipoïque... 94
5.2.1 Acide α-lipoïque et PPARs ... 94
5.2.2 Acide α-lipoïque et AMPK ... 96
5.2.3 Acide α-lipoïque et NRF2 ... 97
5.3 Acide α-lipoïque : effets sur les lymphocytes T ... 101
6
PROBLÉMATIQUE ... 104
7
OBJECTIFS ... 106
8
DÉROULEMENT SCIENTIFIQUE ... 108
8.1 Matériels et méthodes expérimentales ... 108
8.1.1 Modèle animal ... 108
8.1.2 Modèles cellulaires ... 112
8.1.3 Essai clinique interventionnel monocentrique ... 114
8.2 Essai clinique : questionnaires et résultats non-publiés ... 124
9
RÉSULTATS ... 127
9.1 Article 1 : ... 127 9.2 Article 2 : ... 14910
DISCUSSION ... 173
11
CONCLUSION ET PERSPECTIVES ... 181
12
ANNEXES... 183
13
BIBLIOGRAPHIE ... 197
LISTE DES PUBLICATIONS ET
PARTICIPATIONS AUX CONGRÈS
PUBLICATIONSComplementary immunometabolic effects of exercise and PPARβ/δ agonist in the context of diet-induced weight loss in obese female mice
Sébastien Le Garf, Joseph Murdaca, Isabelle Mothe-Satney, Brigitte Sibille,
Gwenaëlle Le Menn, Giulia Chinetti, Jaap G. Neels and Anne-Sophie Rousseau. Int. J. Mol. Sci., 20, 5182; doi:10.3390/ijms20205182 (2019)
Alpha Lipoic Acid supplementation increases the efficacy of exercise- and diet-induced obesity treatment and induces immunometabolic changes in
female mice and women
Sébastien Le Garf, Brigitte Sibille, Isabelle Mothe-Satney, Cyril Eininger, Philippe
Fauqué, Joseph Murdaca, Giulia Chinetti, Jaap G. Neels and Anne-Sophie Rousseau. (Soumis, FASEB, Juillet 2020)
PARTICIPATIONS AUX CONGRÈS ET ÉVÈNEMENTS SCIENTIFIQUES
Festival des Sciences : Fête de la Science Nice (Octobres 2018 et 2019)
Impacts de l'environnement sur notre santé : Ateliers autour des grandes pathologies influencées par notre mode de vie et par des facteurs environnementaux.
Journées Francophones de la Nutrition (JFN) Nice (Novembre 2018)
Communications « meilleurs posters et oral en 90 sec » : Conséquences immunométaboliques d’une activation de la voie PPARβ/δ dans le traitement de l’obésité chez la souris.
Nutrition Clinique et Métabolisme 33(1) : 80-81 ; doi : 10.1016/j.nupar.2019.01.373
Ma Thèse en 180 secondes (MT180) Nice (Mars 2019)
Communication orale : Effets immunométaboliques des stratégies non-médicamenteuses dans la prise en charge médicale de l’obésité.
Séminaire Jeunes Chercheurs (C3M) Nice (Juin 2019)
Communication orale : Targeting PPARβ/δ to potentiate non-drug strategies in obesity-care.
Cell symposia : Exercise Metabolism Sitges, Espagne (Mai 2019)
Communication poster : Exercise and PPARβ/δ agonist treatment improve immunometabolism and aerobic capacities in the contexte of diet-induced weight loss in obese female mice
LISTE DES FIGURES ET DES
TABLEAUX
Figure 1 : Les tissus adipeux viscéraux et sous-cutanés
Figure 2 : Expansion pathologique de l’adiposité en fonction de la prise de poids et conséquences physiopathologiques connexes
Figure 3 : Lien étroit entre l’immunité et l’inflammation chronique de bas-grade
Figure 4 : Activations, différenciations et fonctions immunitaires des sous-populations LT Figure 5 : Lymphocyte T régulateur différencié au niveau thymique ou périphérique Figure 6 : Signalisation cellulaire de Forkhead box Protein 3 (FoxP3)
Figure 7 : Les mécanismes d’action des lymphocytes T régulateurs Figure 8 : La communication bidirectionnelle de l’immunométabolisme Figure 9 : Chaînes de transports d’électrons et phosphorylation oxydative Figure 10 : mécanismes d’oxydation des acides gras libres par β-oxydation Figure 11 : Vue d’ensemble des principales voies métaboliques
Figure 12 : Le métabolisme régule les lymphocytes T dans leur cycle cellulaire jusqu’à leurs fonctions immunitaires
Figure 13 : Métabolisme des sous-populations des lymphocytes T
Figure 14 : Lien entre l’équilibre Redox, le stress-oxydant et l’homéostasie Figure 15 : Signalisation des LT et rôle du statut Redox
Figure 16 : Les liens potentiels entre la balance pro/antioxydant, le statut Redox et les voies métaboliques dans les Tregs qui contribueraient à l’inflammation connexe à l’obésité Figure 17 : Représentation de la structure en domaine de PPAR
Figure 18 : Modes d’action moléculaire de la régulation transcriptionnelle de PPARβ/δ Figure 19 : Effets croisés des PPARs sur les organes principaux impliqués dans le métabolisme énergétique
Figure 20 : Fonction métabolique de l’activation de PPARβ/δ dans le muscle squelettique Figure 21 : Rôle de PPARβ/δ sur les principaux organes directement touchés par l’obésité Figure 22 : Mode d’action potentiel contribuant à la réduction de ROS par l’activation de PPARβ/δ
Figure 24 : Illustration graphique du concept de Set-Point et ses répercussions sur la reprise de poids corporel dans le temps
Figure 25 : Répartition des fibres musculaires squelettiques selon leur métabolisme dominant
Figure 26 : Hypothèse du processus « Open-Window »
Figure 27 : Implication du couple Redox DHLA/LA dans la régénération des antioxydants Figure 28 : Les effets prophylactiques de l’ALA en passant par ceux démontrés chez l’animal in vivo ou in vitro jusqu’à ceux corroborés chez l’Homme
Figure 29 : Modulation de l’activité AMPK, activation doublée de PPARα/γ et diminution du stress oxydatif par l’acide alpha-lipoïque
Figure 30 : Structures et domaines du facteur de transcription Nrf2
Figure 31 : Mécanismes moléculaires potentiels des effets physiologiques adaptatifs à un stress en engageant la voie JNK et le facteur de transcription PPAR/δ
Figure 32 : Représentation schématique du protocole d’expérimentation animale
Figure 33 : Représentation schématique du protocole de la partie fondamentale de l’étude Figure 34 : Schématisation du protocole de sélection des LT CD4+ pour la polarisation in vitro des LT CD4+ en Tregs
Figure 35 : processus de recrutement des volontaires pour l’essai clinique
Figure 36 : Essai clinique interventionnel monocentrique à visée préventive des complications de l’obésité
Figure 37 : Analyse des répartitions macro-nutritionnelles dans l’essai clinique Figure 38 : Représentation d’une imagerie par monocoupe ombilicale
Figure 39 : Résultats au questionnaire de qualité de vie SF-36
Figure 40 : Résultats au questionnaire du profil de personnalité POMS Figure 41 : Représentation des potentiels modes d’action de l’ALA
Tableau 1 : Principales actions, localisations où le niveau d’expression est le plus important et gènes cibles des deux isoformes PPARα et γ
Tableau 2 : Principaux coactivateurs et corépresseurs des PPARs (Liste non exhaustive) Tableau 3 : Mécanismes des différentes interventions en chirurgie bariatrique
LISTE DES ABRÉVIATIONS
Acaa2 : Acetyl-Coa Acyltransferase 2 ACC : Acetyl-Coa Carboxylase
AGL : Acide Gras Libre
AGPI : Acide Gras Polyinsaturé AHR : Aryl Hydrocarbon Receptor ALA : Alpha-Lipoic Acid
ALD : Affection de Longue Durée
AMM : Autorisation de Mise sur le Marché AMPK : AMP-activated Protein Kinase AP : Activité Physique
APA : Activité Physique Adaptée APC : Antigen Presenting Cell
ARE : Antioxidant Response Element ATP : Adenosine Triphosphate
BCL6 : B-Cell Lymphoma 6 BCR : B Cell Receptor
CamKK : Ca2+/calmodulin-dependent protein
Kinase Kinase CD : Cluster de Différenciation CMH : Complexe Majeur d’Histocompatibilité CPT : Carnitine Palmitoyltransferase CRP : C-Reactive Protein
CTLA4 : Cytotoxic T-Lymphocyte Associated DET : Dépense Énergétique totale
DT2 : Diabète de Type 2
EAE : Experimental Autoimmune Encephalomyelitis
ETC : Electron Transport Chain FoxP3 : Forkhead box Protein 3 FSV : Fraction Stroma Vasculaire GATA3 : GATA binding protein 3 GLUT : Glucose Transporter GSH : Glutathione
Gpx : Glutathione peroxidase HbA1c : Hémoglobine glyquée A1c HFD : High Fat Diet
HO1 : Heme Oxygenase 1 IFNγ : Interferon gamma IKK : IκB Kinase
IL : Interleukine
IMC : Index de Masse Corporelle IRS : Insulin Receptor Substrate JNK : c-Jun N-terminal Kinases
Keap1 : Kelch-like ECH-associated protein 1 LB : Lymphocyte B
LPL : Lipoprotein Lipase LT : Lymphocyte T
M1 : Macrophage pro-inflammatoire M2 : Macrophage anti-inflammatoire MCP : Monocyte Chemoattractant Protein MET : Metabolic Equivalent of Task mTOR : mammalian Target Of Rapamycin NAFLD : Non-Alcoholic Fatty Liver Disease NF-κB : Nuclear Factor kappa B
NFAT : Nuclear Factor of Activated T-cells NKT : Natural Killer T cells
Nrf2 : Nuclear factor erythroid 2-related factor 2 NQO1 : NAD(P)H dehydrogenase Quinone 1 OXPHOS : Oxidative Phosphorylation PDK4 : Pyruvate Dehydrogenase Kinase 4 PGC1 : PPAR-γ Coactivator 1
PPAR : Peroxisome Proliferator Activated-receptor
PPRE : Peroxisome Proliferator Response Element
RN : Récepteur Nucléaire
RORγt : RAR-related Orphan Receptor γt ROS : Reactive Oxygen species
SIRT : Sirtuin 1 SO : Stress Oxydant
SOD : Superoxide Dismutase
T-bet : T-box-containing protein expressed in T cells
TA : Tissu Adipeux blanc TAV : Tissu Adipeux Viscéral TCA : Tricarboxylic Acid cycle TCR : T Cell Receptor
TGFβ : Transforming Growth Factor beta Th : Lymphocyte T helper (auxiliaire) TNFα : Tumor Necrosis Factor alpha Tregs : Lymphocytes T régulateurs
1 GÉNÉRALITÉS SUR L’OBÉSITÉ
1.1 DÉFINITION ET HISTOIRE
Réelle pathologie, l’obésité, est une accumulation excessive de la masse grasse dans tout l’organisme contribuant à des dépôts ectopiques de lipides. Ces dépôts dépendent de la modification cellulaire du tissu adipeux (cf. 1.3) aliénant à des morbi-mortalités.
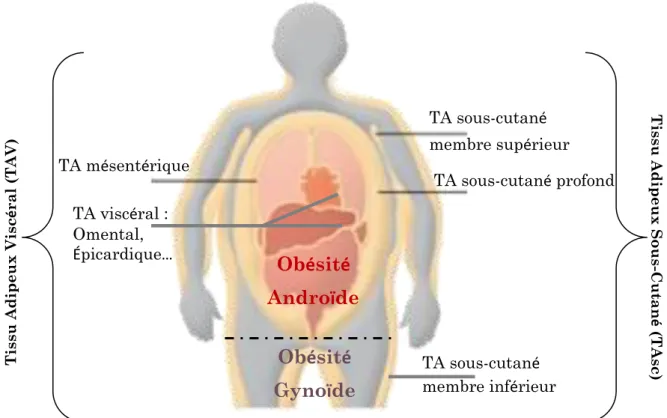
Un élément souvent utilisé pour le diagnostic de l’obésité est l’Indice de Masse Corporelle (IMC). Selon l’Organisation Mondiale de la Santé (OMS) une personne avec un IMC supérieur ou égal à 30kg/m2 est considérée comme obèse. Mais depuis les 10 dernières années cette valeur est de plus en plus combinée à d’autres facteurs anthropométriques tels que le tour de taille, le tour de hanche et/ ou le ratio de ces-derniers (Schneider et al. 2010; Winter et al. 2016). Ainsi, un tour de taille est défini à risque quand sa valeur est supérieure à 80cm chez la femme et à 94cm chez l’homme. Ces valeurs sont également à associer à l’origine ethnique et aux facteurs socio-culturels de la personne. A titre d’exemple, aux États-Unis les valeurs du tour de taille, dites à risques, diffèrent de celles européennes. Elles sont de 88cm chez la femme et 102cm chez l’homme (HAS 2011). La pertinence de l’enchevêtrement de ces mesures réside dans la forte corrélation entre le tour de taille et la proportion de masse adipeuse pathogène qui s’avère être moindre avec l’IMC lorsque plus de 30% des cas obèses selon cet indice présentent une adiposité normale (Leitner et al. 2017). En d’autres termes, il n’est pas faisable de discriminer la répartition de la masse graisseuse avec la simple utilisation de l’IMC. L’obésité, telle que définie pour la première fois par Jean Vague en 1947, se décompose en deux volets essentiels à considérer soit gynoïde ou androïde. Par ailleurs, l’obésité androïde peut aussi être définie comme périphérique ou viscérale (figure 1). Les individus atteints d’obésité androïde viscérale ont un risque de morbi-mortalité plus accru que ceux avec une obésité gynoïde (Després et Lemieux 2006; Després 2012).
Figure 1 : Le tissu adipeux (TA) viscéral est constitué des compartiments intra- et rétropéritonéaux, et le TA intrapéritonéal est lui-même constitué du TA omental et mésentérique. La délimitation entre les TA intra- et rétropéritonéaux est située le long de la surface ventrale du rein, et de la surface dorsale des intestins. Le TA rétropéritonéal est minoritaire et ne représente que 25% du dépôt viscéral total (Wajchenberg, 2000). Le TA viscéral se distingue des autres dépôts par sa connexion directe au foie, via la veine porte. Il existe deux couches distinctes de TA sous-cutané : le TA sous-cutané superficiel et le TA sous-cutané profond. 51% du TA sous-cutané de la femme se trouvent dans les couches profondes de TA cutané, alors que chez l’homme, ce sont 66% du TA sous-cutané total qui se trouvent dans cette couche.
1.2 ÉPIDÉMIOLOGIE
Au niveau mondial, l’obésité ne cesse d’augmenter et est considérée comme une véritable pandémie. À ce jour, 660 millions d’êtres humains adultes sont concernés. De plus, cette augmentation touche les adultes mais aussi les enfants et s’observe dans tous les groupes socio-économiques. En France, les études ESTEBAN 2014-2016 (Étude de Santé sur l’Environnement, la Biosurveillance, l’Activité physique et la Nutrition) et INCA 3 (Étude individuelle nationale des consommations alimentaires 2017) sur la corpulence montrent chez les adultes une prévalence de l’obésité en croissance. Cette donnée est fondée exclusivement sur le paramètre IMC ≧ 30kg/m2 avec un pourcentage estimée à 17% d’obésité chez l’adulte de 18 à 74 ans.
Ti ss u Ad ip eux Sou s-C utan é ( TAs c) TA mésentérique TA viscéral : Omental, Épicardique… TA sous-cutané membre supérieur TA sous-cutané profond TA sous-cutané membre inférieur Tis su Ad ip eu x Vis cé ral ( TAV )
Obésité
Androïde
Obésité
Gynoïde
Cette croissance de l’obésité a conduit à une augmentation aux recours à la chirurgie bariatrique ayant été plus rapide que celle de la prévalence de l’obésité dans l’ensemble de la population française selon le rapport de la Haute Autorité de Santé (HAS 2017). En 2016, le nombre de chirurgie est évalué à 58 130 (54 241 en 2014, 50 084 en 2013, 44 992 en 2012).
L’obésité androïde, viscérale particulièrement, peut s’accompagner de comorbidités à l’instar des maladies cardio-vasculaires (Cercato et Fonseca 2019), de nombreux cancers (National Cancer Institute, Obesity and Cancer 2017), du diabète de type 2 (DT2) dont 75% sont obèses (Basdevant et Ciangura 2010) et des stéatoses hépatiques non-alcooliques (NAFLD) concernant près de 90% des personnes obèses (Younossi et al. 2019). En raison des comorbidités connexes à l’obésité, cette maladie aurait provoqué 3,4 millions de décès au cours de l’année 2010 (Murray et al. 2012) et sa prévalence a triplé entre 1975 et 2016. Il est donc primordial de s’intéresser aux causes contribuant à l’aggravation de cette pathologie. Notamment, l’inflammation chronique de bas-grade (cf. 1.4) est un des principaux mécanismes dans la physiopathologie des comorbidités liées à l’obésité (Ellulu et al. 2017). Elle est, de façon corollaire, un réel enjeu de santé publique et représenterait un coût économique mondial de 2000 milliards de dollars par an soit environ 3% du PIB mondial (McKinsey Global Institute 2012). Une perte de poids même modeste est bénéfique pour prévenir ces comorbidités. La réduction de 10% du poids corporel en prévention permet de réduire les risques de maladies cardio-vasculaires sur 10 ans en améliorant les paramètres métaboliques et vasculaires (Brown et al. 2016), le risque DT2 de 58% (Lindstrom et al. 2003) et d’induire une régression significative de la fibrose hépatique chez les patients NAFLD (Vilar-Gomez et al. 2015).
1.3 PHYSIOPATHOLOGIE DE L’OBÉSITÉ
L'obésité résulte plutôt de l'interaction de ces facteurs et ces combinaisons peuvent varier dans le temps et entre les individus (Hopkins et Blundell 2016; Longo et al. 2019). Différentes phases impliquées dans l’aggravation de cette maladie se manifestent au cours de son évolution. Dans une première phase, l’organisme stocke l’excès d’énergie de façon adaptative. Cette phase est dite dynamique ou de constitution. Il s’ensuit une phase statique, dite de maintien, où la balance énergétique est maintenue. Cette dernière correspond aux pondérostats ou adipostats. Enfin le sujet en situation d’obésité entreprend des régimes conduisant à des pertes de poids, ipso facto des fluctuations pondérales (cf.4.2.1), c’est la phase d’oscillation. Cette dernière est associée aux principaux risques de morbi-mortalités (Zou et al. 2019), ceux-ci étant moins sévères en l’absence de cette phase d’oscillation. Par ailleurs, il a été montré une nette corrélation entre le risque de devenir obèse à l’âge adulte et la mise en œuvre de régimes restrictifs à l’adolescence (Pietiläinen et al. 2012).
Le tissu adipeux (TA), organe de stockage, est constitué normalement de 70% d’adipocytes caractérisés par une gouttelette lipidique uniloculaire (triglycérides). Ces cellules parenchymateuses composent le TA ainsi que les préadipocytes et la fraction stroma-vasculaire (FSV) constituée des cellules sanguines, endothéliales, fibroblastes et des cellules immunitaires comme les macrophages et les lymphocytes. Le TA, véritable glande endocrine, sécrète différentes hormones appelées adipokines. Il est capable d’intégrer différents signaux hormonaux venant de plusieurs organes tels que le foie, le cerveau, l’intestin, le cœur et les muscles squelettiques. Par exemple certains adipokines, tels que la leptine et l’adiponectine, participent au contrôle de la balance énergétique. Les cytokines TNFα, TGFβ et IL-6 sécrétées par le TA sont impliquées dans la régulation de l’inflammation. In fine, la sécrétion de ces adipokines et de ces cytokines modulent l’homéostasie de l’organisme en assurant la fonction alimentaire, la réponse immunitaire, le contrôle de la pression sanguine et les fonctions thyroïdiennes (Deng et Scherer 2010).
Au cours du développement de l’obésité, les adipocytes sont soumis à une hypertrophie pour répondre à l’excès de substrats énergétiques. Comme évoqué précédemment, les adipocytes par phénomène adaptatif grossissent jusqu’à leur limite structurelle pour stocker cette surcharge d’énergie. Un second phénomène adaptatif se met en place, l’hyperplasie, où les adipocytes pour répondre à cet excès
énergétique vont se multiplier dans le TA. Ce processus est régi par les préadipocytes pour fournir une ressource de stockage plus importante. Arrivés à leur limite de stockage, ces phénomènes induisent un stress mécanique et métabolique du TA ainsi qu’à des dépôts ectopiques conduisant à une inflammation systémique de bas-grade (figure 2). Les adipokines, en partie, vont favoriser la production de cytokines pro-inflammatoires et réduire celles anti-pro-inflammatoires au niveau périphérique (Sun, Kusminski, et Scherer 2011).
La leptine, outre son action anorexigène, induit une sécrétion de cytokine IFNγ pro-inflammatoire et inhibe celle d’IL-4 anti-pro-inflammatoire dans le contexte d’obésité. Qui plus est l’inflammation liée à l’obésité augmente l’expression de la leptine dans le TA et sa concentration plasmatique. Ces mécanismes soulignent que les interactions adipokines-inflammation sont bidirectionnelles (Lord et al. 1998) et alimentent l’inflammation systémique de bas-grade. A fortiori, l’inflammation va contribuer aux dérèglements métaboliques et fonctionnels des autres organes entraînant ainsi un cercle vicieux (Monteiro et Azevedo 2010).
1.4 INFLAMMATION CHRONIQUE DE BAS-GRADE
Le défaut de stockage de l’excès énergétique engendre des dépôts ectopiques de lipides et génère une inflammation dite de bas-grade. Elle est caractérisée dans la pathogenèse de l’obésité par des concentrations de marqueurs inflammatoires dans la circulation sanguine et dans certains organes tels que le foie, les muscles squelettiques et le cœur. La concentration en protéine c-réactive (CRP) est augmentée au cours de l’obésité (Visser 1999). En plus de la CRP, des cytokines inflammatoires, IL-6 et TNFα, sont augmentées et directement corrélées avec la sévérité de l’obésité (Hansen et al. 2010). La corrélation des mesures d’adiposité avec les marqueurs inflammatoires circulants est plus marquée pour l’adiposité androïde. Au niveau moléculaire, elle est liée à l’infiltration et à la prolifération des cellules immunitaires pro-inflammatoires et une réduction de celles anti-inflammatoires dans le TA puis systémique. Il en découle l’apparition de dysfonctionnements métaboliques à l’instar de la promotion de l’insulinorésistance. Les cytokines pro-inflammatoires sécrétées par les cellules immunitaires, au long cours, activent des voies de signalisations inflammatoires et vice versa (Li Chen et al. 2015). Ces voies sont principalement cJun N-terminal Kinase (JNK), Nuclear Factor kappa-light-chain-enhancer of activated B cells (NF-κB) et IκB-Kinase (IKK). Elles interfèrent avec la voie canonique de l’insuline en inhibant la phosphorylation du résidus tyrosine au niveau du substrat du récepteur de l’insuline (IRS1). L’état inflammatoire se manifeste dans le TA puis au niveau systémique et s’accompagne d’une altération de la réponse immunitaire (figure 3).
Figure 3 : Lien étroit entre l’immunité et l’inflammation chronique de bas-grade : Une origine aux comorbidités liées à l’obésité. Légende : L’obésité est une pathologie multifactorielle. Elle conduit à une augmentation du tissu adipeux (TA). Ces mécanismes d’adaptations (i.e., hypertrophie et hyperplasie) arrivent à saturation étant favorisé par les phases d’oscillations des régimes et les lipides sont stockés anormalement dans les tissus périphériques. Parallèlement, les adipokines et les cellules immunitaires de la fraction stroma vasculaire (FSV), spécifiquement dans le TA viscéral (i.e., androïde), sécrètent des cytokines pro-inflammatoires contribuant à l’installation de l’inflammation de bas-grade. Les dépôts ectopiques de lipides engendrent une lipotoxicité dans les organes périphériques (i.e., muscles, foie, cœur et pancréas) ce qui alimentent cette inflammation due aux cytokines pro-inflammatoires sécrétées par les cellules immunitaires situées dans ces organes. L’état d’inflammation chronique de bas-grade connexe à l’obésité promeut les comorbidités telles que le diabète de type 2, les maladies cardio-vasculaires, la NAFLD…
La plupart des personnes en situation d’obésité entreprend des régimes conduisant à des pertes de poids, par conséquent, à des fluctuations pondérales appelées la phase d’oscillation. Cette phase est associée aux principaux risques de morbi-mortalités. L’obésité androïde viscérale induit un risque de morbi-mortalité plus accru que l’obésité gynoïde. Les adipocytes du tissu adipeux viscéral atteignent leur limite de stockage conduisant à une inflammation systémique de bas-grade. Les adipokines
2 SYSTÈME IMMUNITAIRE ET OBÉSITÉ
2.1 LE SYSTÈME IMMUNITAIRE : inné et adaptatif
La fonction physiologique du système immunitaire est de prévenir les infections et d’éradiquer les infections déclarées. Les mécanismes de défense de l’hôte se composent d’une immunité innée et de l’immunité adaptative. Cette première est responsable de la protection initiale contre les infections. La seconde se développe plus lentement et met en œuvre une défense tardive et plus efficace contre les infections selon le phénomène de mémoire immunologique. Toutefois, le système immunitaire adaptatif utilise souvent les mécanismes de l’immunité innée pour éradiquer les infections. Il existe ainsi un échange bidirectionnel constant entre ces 2 mécanismes immunitaires (Immunologie 7e Edition, J. Kuby).
2.1.1 Immunité innée
Ce système est composé d’épithéliums, de cellules dendritiques, de lymphocytes Natural Killer (NKT), de granulocytes, et de monocytes. Ces deux derniers sont issus de la lignée myéloïde.
Ce processus immunitaire est représenté par la phagocytose, la réaction inflammatoire non spécifique (i.e., vasodilatation et œdème local) et par la diapédèse, définie par l’ensemble des mécanismes permettant à des cellules immunocompétentes de pénétrer les tissus en traversant la barrière endothéliale. L’immunité innée est la première ligne de défense face à une agression physique, chimique et infectieuse. La réponse à ces agressions est non spécifique, autrement dit, elle est indépendante de la nature de l’antigène.
2.1.2 Immunité adaptative
Ce système issu de la lignée lymphoïde se compose des lymphocytes T et B (LT et LB) y compris de leurs produits, notamment les anticorps. Ces cellules reconnaissent spécifiquement les antigènes en possédant à leur surface des récepteurs spécialisés dans la reconnaissance des antigènes qui leurs sont spécifiques (B cell receptor, BCR, et T cell receptor, TCR).
Les réponses immunitaires adaptatives sont déclenchées lorsque les récepteurs d’antigènes des lymphocytes, BCR et TCR, reconnaissent les antigènes. Les lymphocytes B et T diffèrent quant aux types d’antigènes qu’ils sont en mesure de reconnaître et les moyens mis en œuvre pour reconnaître l’antigène afin d’activer la réponse immunitaire.
L’immunité adaptative se subdivise en deux :
• Immunité humorale : s’exerce par l’intermédiaire de protéines, les anticorps, produites par les LB. La principale fonction des anticorps est de se diriger contre les éléments pathogènes microbiens en reconnaissant spécifiquement leurs antigènes afin de les éradiquer. Suite à leur maturation dans la moëlle osseuse et à leur reconnaissance de l’antigène au niveau du BCR, les LB sont activés puis se différencient en plasmocytes voire en LB mémoires où ils peuvent servir de cellules présentatrices d’antigènes (APC).
• Immunité cellulaire : contrairement à l’immunité humorale, les LT requièrent la coopération des cellules de l’immunité innée pour présenter l’antigène, les APC, tels que les cellules dendritiques et les monocytes. Les TCR des LT reconnaissent seulement les fragments antigéniques liés aux molécules du complexe majeur d’histocompatibilité (CMH) situées à la surface des APC. Ce processus de restriction par le CMH englobe 2 signaux indispensables à l’activation et à la prolifération des LT. Le 1er signal est défini par la reconnaissance de l’antigène peptidique associé au CMH par le TCR et le corécepteur (CD4 ou CD8) spécifique au CMH. Le 2nd signal est la costimulation de molécules (CD28 et CD40L) à la surface des LT avec des récepteurs exprimés sur les APC (CD40 et CD80/86). Un 3ème signal intervient pour la polarisation et il dépend de l’environnement cytokinique pour induire la différenciation des sous-populations des LT.
Les LT sont divisés en deux grandes sous-catégories. Les CMH de classe I sont spécifiques aux LT possédant le corécepteur CD8 (dits cytotoxiques) et les CMH de
Figure 4 adaptée de Van Herk et al. 2019): Activations, différenciations et fonctions immunitaires des sous-population des lymphocytes T. Abréviation : TA, tissu adipeux ; TH, lymphocyte T helper ; Treg, lymphocyte T régulateur.
Cytokines polarisantes Sous-types de lymphocytes T : Récepteurs membranaires Facteur de transcription clé Fonction effectrice : cytokine sécrétée
Effet sur l’inflammation liée à l’obésité IL-12 IL-2 IFN� TNF� � � � � � � � � � � � � CD3 CD CD3 CD3 CD3 CD3 CD3 8 CD 4 CD4 CD 4 CD4 CD 4
EOMES T-bet GATA3 ROR� t AHR FoxP3
IL-18 IFN� TNF� IFN� IL-2 CMH I CMH II CMH II CMH II CMH II CMH II IL-2 IL-4 IL-4 IL-5 IL-10 IL-13 Granzyme IL-1� TNF� IL-6 TGF� TGF� TGF� IL-23 IL-23 IL-22 IL-17 IL-6 TNF� IL-22 IL-2 IL-10
T CD8+
TH1
TH2
TH17
TH22
Treg
Prévalence dans le TA viscéral : cas de l’obésité2.2 RÉGULATION DE L’INFLAMMATION DE BAS-GRADE : rôle de l’immunité adaptative
L’immunité innée joue clairement un rôle dans la régulation de l’inflammation liée à l’obésité ne serait-ce que par la fonction indispensable des macrophages comme APC ou dans leur rôle direct sur l’inflammation du tissu adipeux (McNelis et Olefsky 2014).
La suite de ce chapitre expose l’implication prépondérante de l’immunité adaptative cellulaire, les LT CD4+ et CD8+, dans l’inflammation chronique de bas-grade. En réponse à ce stress lié à l’inflammation, l’immunité met en place une réponse immunitaire dite para-inflammatoire, décrite par Medzhitov en 2008, déclenchant une activité immunitaire chronique inadaptée. Ce processus dérègle in fine l’homéostasie énergétique (Dalmas, s. d.).
2.2.1 Lymphocytes T CD8+
Après maturation dans le thymus et activation spécifique par un antigène pathogène dans le tissu agressé, les LT CD8+ ont une action cytotoxique pour éliminer les cellules infectées. Dans un contexte d’obésité, le pourcentage de LT CD8+ au niveau du TA est augmenté. Ces cellules induisent une inflammation et une résistance à l’insuline comme il a été démontré dans des souris transgéniques CD8-/- ayant amélioré leurs états inflammatoire et métabolique. Cette infiltration précède l’accumulation et la polarisation des monocytes en macrophages classiques pro-inflammatoires (M1) (Nishimura et al. 2009). Les LT CD8+ jouent un rôle précoce dans la modulation de l’inflammation du tissu adipeux.
Cependant chez des souris Rag1 -/- (i.e., dépourvues en lymphocytes B et T) soumises à un régime riche en graisse (High fat diet, HFD), l’injection de LT CD8+ n’a pas conduit à une aggravation de l’état inflammation et de l’insulinorésistance (Winer et al. 2009). Cette observation témoigne de l’implication d’autres cellules immunitaires dans le développement de l’inflammation chronique de bas-grade.
des sous-populations des LT CD4+ est capitale. Effectivement, certaines de ces cellules sont pro-inflammatoires et d’autres anti-inflammatoires, ainsi, elles vont contribuer de façon différente à l’installation de l’inflammation de bas-grade.
2.2.2 Lymphocytes T CD4+
Comme illustré précédemment (figure 4), les LT CD4+ sont constitués de cinq principales sous-populations toutes impliquées à différents niveaux dans l’inflammation associée à l’obésité.
Les LT CD4+ helper 1 (Th1) effectuent leur maturation et leur polarisation
à partir des LT CD4+ naïfs en présence d’IL-2 et d’IFN-γ dans le thymus et en exprimant le facteur de transcription T-bet. Les Th1 sont pro-inflammatoires en sécrétant des cytokines telles que TNF-α et IFN-γ. Au cours de l’obésité chez des souris HFD, il a été montré une augmentation accrue du nombre de Th1 en comparaison à des souris contrôles normopondérées. De plus, une déficience globale en IFN-γ a conduit à une réduction de l’expression des gènes inflammatoires, MCP-1 et TNF-α, des LT pro-inflammatoires et une amélioration de la tolérance au glucose des souris obèses (Rocha et al. 2008). Autrement dit, l’IFN-γ semble être un paramètre primordial dans l’inflammation chronique. Chez l’humain obèse, l’accumulation des Th1 et d’IFN-γ dans le TA est exacerbée (McLaughlin et al. 2014) et peut entraîner une polarisation des macrophages M1. Ces-derniers sécrètent des cytokines IL-12 favorisant la différenciation Th1 et alimentent ainsi l’environnement cellulaire inflammatoire (Zhu et Paul 2008).
Les LT CD4+ helper 2 (Th2) se développent dans le thymus à partir des LT
CD4+ naïfs en présence d’IL-2, d’IL-4 et du facteur de transcription GATA3 qu’ils expriment spécifiquement. Ils sécrètent majoritairement des cytokines anti-inflammatoires comme IL-4, IL-10 et IL-13. La proportion de Th2 diminue particulièrement dans la TA viscéral (TAV) avec la pathogenèse de l’obésité (Winer et al. 2009). Chez l’humain, les résultats sont seulement basés sur le niveau d’expression génique et sont contradictoires. En effet, dans une étude GATA3 est diminué dans le TAV des individus obèses (J. Deiuliis et al. 2011) et au contraire augmenté dans une autre (Zeyda et al. 2011).
Les LT CD4+ helper 17 (Th17) ont été caractérisés à partir de leur
production d’IL-17, IL-21 et IL-22 reflétant leur signature cytokinique pro-inflammatoire. Ils expriment le facteur de transcription RORγt. La prévalence de Th17 dans le TAV des souris HFD est significativement augmentée en comparaison à des souris contrôles (Bertola et al. 2012).
Chez l’Homme, le pourcentage de Th17 dans le TA des patients obèses est positivement corrélé au niveau de l’hémoglobine glyquée A1c (HbA1c) et leur prévalence réduite suite à une perte de poids induite par une opération de chirurgie bariatrique (Dalmas et al. 2014).
Les LT CD4+ helper 22 (Th22) expriment le facteur de transcription AHR et
sécrètent IL-22 ayant des propriétés pro-inflammatoires. Les Th22 sont moins étudiés. Toutefois il a été démontré, chez les personnes obèses, une augmentation de leur pourcentage au niveau circulant avec une élévation de l’expression d’IL-22 (Zhao et al. 2014).
Les LT CD4+ régulateurs (Tregs) sont le centre de réflexion de cette thèse,
par conséquent, leurs mécanismes seront plus détaillés.
Suite à une expérience chirurgicale en 1969, la découverte des Tregs a eu lieu lors d’une ablation du thymus chez le modèle murin. Auparavant, ces cellules étaient appelées « Suppressor T cells » de par leur action immunosuppressive sur les LT effecteurs pendant une inflammation. La fonction immunosuppressive des Tregs est indispensable pour le maintien de la tolérance immunitaire du « soi ». Les connaissances plus approfondies sur les Tregs sont apparues suite aux observations de Sakaguchi et al., en 1995. Les Tregs proviennent principalement de deux origines. D’une part, les Tregs naturels (nTregs) sont produits au cours de la maturation thymique des LT. D’autre part, les Tregs périphériques (pTregs) générés à partir de la polarisation des LT CD4+ naïfs en présence d’IL-2 et TGF-β comme leur nom l’indique au niveau périphérique (figure 5). Une autre nomenclature existe pour les Tregs induits in vitro, les iTregs, et les Tregs issus des tissus lymphoïdes associés aux
Figure 5 issue de E. Shevach et T. Davidson dans Nature Reviews : Lymphocyte T régulateur différencié au niveau thymique ou périphérique
Les Tregs expriment spécifiquement le facteur de transcription FoxP3 (Forkhead box Protein 3) et sécrètent des cytokines anti-inflammatoires comme IL-10 et TGF-β (Fontenot, Gavin, et Rudensky 2003; Zhu et Paul 2008). Plusieurs facteurs de transcription interviennent dans le mécanisme d’expression de FoxP3. Principalement, l’expression génique de FoxP3 est régulée par la famille des NFAT (Nuclear Factor of Activated T-cells), AP-1 (Activator Protein-1) et FOXO (Forkhead box O protein). Les protéines AP-1 et NFAT forment un complexe protéique et bloquent le domaine Forkhead du gène FoxP3. Il s’ensuit une action répressive de FoxP3 sur ses gènes cibles codant normalement les cytokines CTLA-4 et CD25 (Y. Wu et al. 2006). Cependant, l’activité transcriptionnelle de FoxP3 est double. Comme nous venons de le voir, elle peut soit induire une répression génique, soit être un activateur transcriptionnel (figure 6). Cette étape est possible grâce à la présence de NFAT sans interaction avec AP-1, d’IL-2, de TGF-β et un changement métabolique (cf. 2.3).
Les cytokines, quant à elles, maintiennent une stabilité du gène FoxP3 indispensable à sa transcription et in fine à son activité immunosuppressive (Pereira et al. 2017; Shi et Chi 2019).
Figure 6 adaptée de Pereira et al. 2017 et Shi 2019 : Signalisation cellulaire de Forkhead box Protein 3 (FoxP3). Explication : L’induction de FoxP3 est initiée par la présentation de l’antigène par l’APC en passant par l’interaction TCR-MHC II. Les cytokines IL-2 et TGF-β stimulent l’expression de FoxP3. Les facteurs de transcriptions (FT) NFAT, NF-κB et AP-1 entraînent une réduction de l’expression de FoxP3 et ipso facto l’absence de l’expression des gènes cibles de FoxP3, tels que : CTLA-4 et CD25. A contrario FoxP3 inhibe l’activité répressive de ces FT grâce au changement métabolique (i.e., inhibition mTOR et activation de la FAO) et par le biais des facteurs de remodelage de la chromatine TIP60 et HDAC7, ils favorisent la stabilité du gène FoxP3 pour sa transcription.
Les quatre principaux mécanismes jouant un rôle dans le mode d’action mTOR PI3K/AKT Foxp3 NF-kB TIP60 HDAC7 IL-2 TGFβ CTLA-4 CD25
• Suppression par cytolyse où les Tregs humaines activées expriment les granzymes A et B. Chez l’animal, les Tregs déficientes en Granzyme-B ont une activité suppressive réduite in vitro ;
• Suppression par compétition avec les cellules effectrices qui dépendent également de facteurs de croissances en particulier d’IL-2. La déprivation en IL-2 pousse les Tregs à l’apoptose en passant par la voie Bcl-2/BIM ;
• Suppression par modulation des cellules dendritiques (CD) où les Tregs pourraient moduler la maturation et la fonction des CD nécessaires à l'activation des lymphocytes Th pro-inflammatoires. Les Tregs interagissent avec les CD in vivo à travers CTLA-4 dont ils expriment à leur surface et induisent une atténuation de l'activation des cellules T effectrices par les CD. Les Tregs induisent leurs activités immunosuppressives au travers de deux principaux mécanismes pour supprimer l’effet pro-inflammatoire des Th1 et Th17 :
• Celui ciblant les LT (cytokines suppressives, cytolyse via la sécrétion d'IL-2) ; • Celui ciblant principalement les APC (e.g., présentation d’antigène réduite).
Figure 7 issue de Pereira et al. 2017 : Les mécanismes d’action des lymphocytes T régulateurs.
CYTOKINES INHIBITRICES
CYTOLYSE PAR GRANZYMES
M O D U L A T IO N D E S A P C APC C O M PÉ TI T IO N : IL -2 d ép en da nt e
Chez des souris normopondérées la prévalence en Tregs dans le TAV représente approximativement 40% des LT CD4+ du compartiment de la FSV. Cependant, les souris HFD diminuent drastiquement ce pourcentage, d’autant plus chez les souris ob/ob, en atteignant que 15% des LT CD4+, mais uniquement au niveau du TAV (Feuerer et al. 2009). Cette réduction en Tregs serait corrélée à la présence en M1 exprimant CD11+ (J. Deiuliis et al. 2011). Le transfert de Tregs dans du TAV de souris HFD induit une augmentation des cytokines immunosuppressives (IL-10 et TGF-β) et a posteriori une correction de l’insulinémie. Par ailleurs dans les organes lymphoïdes secondaires et le TA sous-cutané, il existe des contradictions avec certaines études qui ont montré aucun changement (Feuerer et al. 2009), d’autres une réduction (Winer et al. 2009; Van Herck et al. 2019) ou une augmentation dans le TA sous-cutané (Vonghia et al. 2015). Une étude a aussi mis en évidence que l’induction des Tregs, par l’administration d’anticorps αCD3 plus du β-glucosylcéramide, conduit à la diminution des macrophages et du TNF-α dans le TA accompagnée de l’amélioration de la résistance à l’insuline chez des souris HFD (Ilan et al. 2010). A contrario, l’équipe de Van der Weerd a montré une augmentation du nombre de LT CD4+ accompagnée d’une augmentation des sous-populations Tregs et Th2 chez les sujets obèses morbides par rapport aux sujets contrôles normopondérés alors que les prévalences de Th1 et Th17 ne sont pas modifiées. Mais ces études pourraient se placer à différents temps de la pathogenèse de l’obésité et ainsi expliquer la présence ou l’épuisement en Tregs dans l’environnement inflammatoire.
Les Tregs ont une signature génique propre à leur localisation tissulaire. En effet, l’existence de différents types de Tregs dépendant de leur localisation témoigne d’une remarquable plasticité de ces cellules orchestrée par le microenvironnement cellulaire. Notamment, il a été décrit la présence de Tregs spécifiques au TAV. De par son activité endocrine, le TAV est un territoire propice à l’hétérogénéité cellulaire. Des LT CD4+ naïfs résident dans le TAV. Selon le microenvironnement cellulaire et la sécrétion cytokinique, la prolifération des Tregs diffère. Par exemple avec l’obésité, la présence majoritaire en Th1 et Th17 est associée à une production de cytokines
pro-La prévalence de Tregs dans le TAV est positivement corrélée à l’augmentation de l’activité transcriptionnelle de PPARγ (Cipolletta et al. 2012). Sur le plan mécanistique, les Tregs expriment de nombreux gènes intervenant dans le métabolisme oxydolipidique ainsi que le facteur de transcription adipogénique PPARγ. Ainsi, le métabolisme cellulaire contrôle le devenir des LT en modulant leur prolifération, leur différenciation et leur fonction immunitaire. En somme, il orchestre leur plasticité et leur hétérogénéité de manière tissus-spécifiques.
En conclusion, les LT ont une capacité d’adapter rapidement leur métabolisme aux changements de leur microenvironnement. Cette plasticité métabolique leur est conférée pour riposter de façon adéquate aux agents pathogènes et de répondre ainsi immédiatement pour préserver l’intégrité de l’organisme de toutes défaillances auto-immunes (Pearce et Pearce 2013; Buck, O’Sullivan, et Pearce 2015).
Les LT sont divisés en deux grandes sous-catégories. Les CMH I sont spécifiques aux LT exprimant CD8 et les CMH II le sont pour les LT avec CD4 étant subdivisés en quatre principales sous-populations : Th1, Th2, Th17 et Tregs. Les Th1 et Th17 sont pro-inflammatoires en sécrétant TNF-α, IFN-γ et IL-17. Le nombre de Th1 est augmenté chez les souris HFD en comparaison aux souris contrôles normopondérées. La proportion de Th2 diminue notamment dans le TAV avec la pathogenèse de l’obésité. La prévalence de Th17 dans le TAV des souris HFD est significativement augmentée en comparaison à des souris contrôles. Les Tregs expriment spécifiquement FoxP3 et sécrètent des cytokines anti-inflammatoires, IL-10 et TGF-β. Chez des souris normopondérées, la prévalence en Tregs dans le TAV compte approximativement 50% des LT CD4+ du compartiment de la FSV. Cependant, ce pourcentage est drastiquement diminué chez les souris HFD, avec une réduction de 75%, mais uniquement au niveau du TAV. Les Tregs ont une signature génique propre à leur localisation tissulaire et témoignent une remarquable plasticité. Une étude a aussi mis en évidence que l’induction des Tregs conduit à la diminution des macrophages type M1 et du TNF-α dans le TA accompagnée de l’amélioration du métabolisme avec une correction de l’insulinorésistance des souris HFD. L’obésité conduit à une présence majoritaire en Th1 et Th17 associée à une production de cytokines pro-inflammatoires et une réduction des Tregs particulièrement dans le TAV.
2.3 IMMUNOMÉTABOLISME : interface entre l’immunité et le métabolisme Les systèmes métabolique et immunitaire font parties des structures fondamentales des êtres vivants. La réponse immunitaire et la régulation métabolique (i.e., tant au niveau systémique que cellulaire) sont étroitement intriquées. Cette interface, appelée l’immunométabolisme, est un mécanisme central pour l’homéostasie de l’organisme. Cette interface est altérée au cours d’un excès alimentaire chronique aboutissant à un ensemble de complications métaboliques et inflammatoires chroniques à l’instar de l’obésité.
L’immunométabolisme étudie les différentes fonctions des cellules immunitaires étant soumises à des configurations métaboliques distinctes :
• Le métabolisme cellulaire des LT au repos utilisent des processus énergétiquement efficaces tel que le tricarboxylique cycle acide (TCA) lié à la génération d'ATP par la phosphorylation oxydative (OXPHOS) (Pearce et Pearce 2013). L’activation des LT par l'antigène passe rapidement en glycolyse aérobie, tandis que le 3ème signal (cf. 2.1.2) caractérisé par la présence des cytokines IL-4 et TGF-β induit les Tregs qui dépendent préférentiellement de l’oxydation lipidique (Michalek et al. 2011).
Le statut métabolique des cellules immunitaires peut subir une reprogrammation, dit autrement, une nouvelle orientation de leur métabolisme préférentiel et ainsi entraîner des changements de la sécrétion cytokinique de ces cellules. Quand la glycolyse et la synthèse d’AG de novo sont inhibées en modulant respectivement les voies mTORC1 et ACC, les Th17 endossent un phénotype tel que celui des Tregs en sécrétant IL-10 ou les LT CD4+ orientent préférentiellement leur différenciation en Tregs au détriment des Th17 (Ma et al. 2017). Cette plasticité présente un intérêt particulier en ouvrant la voie à la reprogrammation métabolique des cellules immunitaires ayant un profil pro-inflammatoire en un phénotype anti-inflammatoire.
Plus succinctement l’immunométabolisme suggère une analyse bidirectionnelle (Norata et al. 2015), en considérant le métabolisme systémique et celui au niveau cellulaire (figure 8) :
• Le rôle des cellules immunitaires sur le métabolisme des organes puis la répercussion sur l’homéostasie énergétique global ;
• L’effet des voies métaboliques sur les cellules immunitaires a fortiori sur leurs sécrétions cytokiniques étant leur signature pro/anti-inflammatoire.
Figure 8 adaptée de Norata et al. 2015 : La communication bidirectionnelle de l’immunométabolisme
2.3.1 Voies métaboliques énergétiques
Le cycle de Krebs ou tricarboxyle acids (TCA) a été mis en évidence par Hans Krebs en 1937. L’étape finale du catabolisme oxydatif des carbohydrates, des acides gras et des acides aminés assure la plus grande part des besoins énergétiques de la cellule grâce à la formation de coenzymes réduits (NADH et FADH2) qui seront réoxydés dans la chaîne respiratoire mitochondriale. La chaîne de transport d'électrons (ETC, chaîne de transports des électrons) est constituée de quatre complexes protéiques (figure 9) :
-
Complexe I : NADH-coenzyme Q oxydoréductase ;-
Complexe II : succinate-coenzyme Q oxydoréductase ;-
Complexe III : coenzyme Q-cytochrome c oxydoréductase ;-
Complexe IV : cytochrome c oxydase.Figure 9 issue de Lodish et al. "Electron Transport and Oxidative Phosphorylation." molecular cell biology. 4th edition., 2000, www.ncbi.nlm.nih.gov/books/NBK21528/.
Une grande partie de l'énergie produite dans les voies cataboliques se retrouve contenue dans les cofacteurs NADH et le FADH2. Ces cofacteurs réduits cèdent leurs deux électrons à un système de transporteurs. Au cours de ce transfert d’électrons, il y a formation d’un gradient de protons, la membrane interne étant relativement
Le NADH, formé dans la matrice, cède ses équivalents réducteurs à la NADH déshydogénase (complexe I). Ces électrons vont cheminer du complexe I jusqu'à l'oxygène. L'oxygène, accepteur final des électrons, sera réduit en H2O.
Le FADH2, produit dans la matrice, cède, quant à lui, ses équivalents
réducteurs au complexe II. Le cheminement des électrons est ensuite identique à celui suivi par les électrons fournis par le NADH.
La glycolyse est constituée d’une série de réactions catalysées par des enzymes. Elles dégradent une molécule de glucose (6 carbones) en deux molécules de pyruvate (3 carbones) au niveau du cytosol des cellules eucaryotes. Cette réaction métabolique nécessite l’entrée du glucose dans la cellule étant dépendante de co-transporteur ou de co-transporteur, respectivement, SGLT (Sodium-Glucose Transporter) et GLUT (Glucose Transporter). La glycolyse se déroule en dix étapes succinctes décomposées en deux phases. La phase préparatoire où le glucose est transformé avec consommation d'énergie, suivie de la phase de remboursement où l’énergie est produite sous forme de 2 ATP et deux molécules de pyruvate qui sont synthétisées (Berg 2002, Biochemistry 5th Edition « Glycolysis Is an Energy-Conversion Pathway in Many Organisms »). Le pyruvate est soit converti en Acétyl-CoA qui entrera dans le TCA, soit en lactate pouvant être de nouveau converti en pyruvate. La voie de décarboxylation oxydative du pyruvate en Acétyl-CoA entraîne dans le TCA une production de cofacteurs réduits NADH qui fournira la chaîne respiratoire. Le bilan énergétique d’une molécule de glucose en aérobie est variable entre 36 et 38 ATP soit 20 fois supérieur à la glycolyse anaérobie (2 ATP pour la fermentation lactique).
La β-oxydation est la voie métabolique oxydative de dégradation des acides gras opérant à la production d’Acétyl-CoA et des cofacteurs réduits NADH et FADH2. Avant cette oxydation, les acides gras libres (AGL) sont activés en acyl-CoA par des acyl-CoA synthétases de la membrane mitochondriale externe, étape requérant de l’énergie (figure 10). Selon la nature des AGL, le transfert à travers la membrane mitochondriale diffère et pour les AGL à chaîne courte (<5 carbones) et à chaîne moyenne (6 à 12 carbones) le passage se fait de manière passive. En revanche, les AGL à chaîne longue (>12-14 carbones) ont recourt à un système navette de la carnitine.
Par l’action de la Carnitine Palmitoyl Transferase 1 (CPT1), l’acyl-CoA de l’AGL à chaîne longue se fixe à la carnitine en formant le complexe acyl-carnitine. Ce-dernier est transporté dans la matrice mitochondriale par une translocase où il est dissocié en deux molécules, carnitine et acyl-CoA (étape catalysée par la CPT2). La carnitine ressort de la matrice pour être réutilisée et l’acyl-CoA situé dans la matrice est soumis aux différentes réactions de la β-oxydation.
Figure 10 issue des Ressources Numériques en Biologie : mécanismes d’oxydation des acides gras libres par β-oxydation
L'oxydation des acides gras se déroule dans la matrice par cycles répétés (hélice de Lynen). Un cycle d’oxydation permet la formation d’une molécule d’Acétyl-CoA qui sera utilisée par le TCA, d’une molécule de FADH2 et de NADH, qui participeront à la production de l’ATP par OXPHOS et d’un acyl-CoA raccourci de 2 carbones. Le bilan
AGL ATP + CoASH AMP + PPi Acyl-CoA Carnitine Complexe Acyl-carnitine Carnitin e CoAS H Complexe acyl-carnitine Acyl-CoA Acyl-CoA synthétases Carnitine Palmitoyl Transférase I Carnitine Palmitoyl Transférase II Carnitine-Acylcarnitine Translocase Matrice mitochondriale Membrane mitochondriale interne Membrane mitochondriale externe
Figure 11 issue des Ressources Numériques en Biologie : Vue d’ensemble des principales voies métaboliques
2.3.2 Métabolisme des lymphocytes T
Dès leur activation, les LT subissent un changement métabolique ayant une répercussion cellulaire majeure par l’engagement d’une voie métabolique spécifique. Ils passent d’un état de quiescence avec un profil métabolique bas à un état métabolique hautement actif au cours de leur activation puis prolifération. Ce changement métabolique est marqué par le passage à une glycolyse aérobie, c’est-à-dire, à une fermentation d’acide lactique malgré la présence d’oxygène dans le cytosol pour permettre aux LT d’augmenter rapidement leurs biomasses (effet Warburg). Cette étape requiert l’expression de GLUT1 et l’activation des voies de signalisations Akt-PI3K (Phosphoinositide 3-Kinase) et mTOR (mammalian Target Of Rapamycin), étant impliquées dans la glycolyse.
Les LT naïfs arrivent ensuite à maturité et sortent du thymus en s'appuyant sur le processus OXPHOS pour leurs besoins métaboliques, bien qu'ils augmentent le métabolisme glycolytique pendant les périodes de prolifération en suivant l’expression du gène TCR. Dans les organes lymphoïdes secondaires, l’expression du TCR, la costimulation et les signaux du microenvironnement induisent une expansion clonale et une reprogrammation métabolique des LT. Cette conversion des LT naïfs en LT effecteurs (Th1, Th2, Th17 et Th22) et régulateurs (Tregs) est marquée par l'engagement de la glycolyse aérobie et l’augmentation de l'activité OXPHOS (Pearce et Pearce 2013; Buck et al. 2017).