1
ANNEE: 200 THESE N°:
La coelioscopie dans le traitement
de la pathologie du haut appareil urinaire
( expérience préliminaire)THESE
Présentée et soutenue publiquement le :………..
PAR
Mr. Ahmed Imad Eddine EL FILALI
Né le 13 Juin 1983 à Oujda
De L’Ecole Royale du Service de Santé Militaire - Rabat
Pour l'Obtention du Doctorat en
Médecine
MOTS CLES Coelioscopie – rein – Morbidité - Néphrectomie.
JURY
Mr. M. HACHIMI PRESIDENT
Professeur d'Urologie
Mr. T. KARMOUNI RAPPORTEUR
Professeur Agrégé d'Urologie
Mr. Y. NOUINI
Professeur d'Urologie
Mr. A. AMEUR
Professeur Agrégé d'Urologie
Mr. A. EL HIJRI
Sommaire
INTRODUCTION ... 1 HISTORIQUE ... 3 ... RAPPELS ANATOMIQUES ... 6 I. Anatomie Descriptive ... 7 1. Forme ... 7 2. Dimension ... 7 ... ... 3. Architecture et structure du rein ... 9II. Anatomie Topographique ... 11
... 1. Généralités ... 11
2. La loge rénale ... 11
3. Rapport Du Rein : ... 13
III. vascularisation et innervation du rein : ... 17
1. vascularisation arterielle : ... 17
2. vascularisation veineuse : ... 18
3. vascularisation lymphatique : ... 20
4. l’innervation : ... 22
RAPPELANESTHESIQUE ... 23
2. l’optique : ... 27
3. la camera : ... 28
4. le moniteur : ... 28
5. l’enregistreur vidéo : ... 29
II. L’insufflateur : ... 29
III. Système d’irrigation aspiration : ... 30
IV. Matériel de coagulation : ... 30
V. L’aiguille de veress :... 31
VI. Les trocarts : ... 31
VII. Les instruments : ... 32
VOIES D’ABORDS ET TECHNIQUES CHIRURGICALES ... 33
I la voie transpéritonèale : ... 34
1. Préparation préopératoire : ... 34
2. Installation du patient : ... 34
3. Instrumentations : ... 35
4. L’intervention : ... 35
II. la voie retro peritoneal : ... 43
1. Installation du patient : ... 43
2. Instrumentation : ... 43
3. Etapes de l’intervention : ... 44
4. Soins postopératoire : ... 49
COMPLICATIONS DE LA CHIRURGIE LAPAROSCOPIQUE ... 50
3. le risque thrombo-embolique : ... 53
4. les complications parietales : ... 53
5. les complications post-opératoires spécifiques: ... 54
II. les complications techniques : ... 55
1. plaies vasculaires : ... 55
2. les plaies viscérales : ... 56
NOTRE ETUDE ... 57
MATERIELS ET METHODES : ... 58
I. Données epidemiologiques : ... 58
II. Données cliniques : ... 59
III. Données étiologiques : ... 60
IV. Matériels : ... 60
V. Méthodes : ... 69
RESULTATS : ... 77
DISCUSSION... 79
I. les accidents operatoires: ... 82
II. conversion (49, 50), complications et pertes sanguines : ... 84
III comparaison entre la chirurgie a ciel ouvert et la chirurgie laparoscopique : ... 88
IV les avantages de la coeliochirurgie : ... 89
CONCLUSION ... 90
RESUMES ... 92
La coeliochirurgie est une technique chirurgicale min invasive, qui a été adoptée par plusieurs spécialités y compris l’urologie.
En urologie, de nombreuses interventions laparoscopiques ont été décrites et pratiquées avec un succès variable.
En 1991, Clayman a rapporté le premier cas de néphrectomie par laparoscopie, il a choisi la voie trans-péritonéale pour réaliser une néphrectomie droite (1,2), et au cours de la même année Ferry a pratiqué par la même voie une néphrectomie gauche (3,5).
En 1993 Gaur a proposé la voie rétro-péritonéale pour réaliser une néphrectomie laparoscopique (4,5).
Depuis, la néphrectomie laparoscopique a connu un développement important qu’elle soit pratiquée par voie rétro ou trans-péritonéale. En effet les suites opératoires de cette technique simple et reproductible sont des moins douloureuses et la convalescence est aussi plus courte que la chirurgie à ciel ouvert (5).
Notre travail est une étude rétrospective de l’expérience du service d’urologie B du CHU Ibn Sina de Rabat, en matière de chirurgie laparoscopique dans le traitement de la pathologie du haut appareil urinaire.
Le but de notre travail est d’évaluer la faisabilité et la fiabilité de la chirurgie laparoscopique et de discuter les résultats, les avantages, les inconvénients de cette technique.
En urologie, la 1er utilisation de l’endoscopie a été effectuée en 1806 par un urologue allemand BOZZINI, qui a publié sa technique de cystoscopie chez la femme.
Après la 2éme guerre mondiale, la chirurgie endoscopique s’est progressivement développée. Ainsi, la résection des tumeurs de la vessie, de la prostate, l’urétéroscopie et la chirurgie percutanée sont maintenant des interventions de routine (6).
Malgré cette maîtrise des techniques endoscopiques, il est assez surprenant que les urologues aient ignoré la chirurgie laparoscopique jusqu’aux années 90 (6).
La laparoscopie urologique date de la fin des années 80, mais les interventions étaient limitées à de rares indications tels le curage ganglionnaire, la cure de varicocèle, et le traitement des testicules cryptorchidies.
C’est en 1991 que Clayman a rapporté le premier cas de néphrectomie élargie droite sous cœlioscopie par voie trans-péritonéale, au cours de la même année Ferry a pratiqué une néphrectomie gauche simple par la même voie, 2 ans plus tard Gaur a été le premier à proposer la voie rétro péritonéale pour la réalisation d’une néphrectomie gauche (2, 3, 4,5).
Depuis la laparoscopie en urologie a connu un développement important, qu’elle soit pratiquée par voie rétro ou trans-péritonéale (5).
Cette nouvelle technique a connue trois épisodes importants :
- De 1991 à 1994, des publications apparaissent sous forme de petites séries comportant un taux de complication élevée lié à la courbe d’apprentissage et surtout à des techniques encore aléatoire (7). - Depuis 1994, des progrès considérable ont été réalisés et les
techniques sont mieux standardisées (7).
- A partir de 1998, la coeliochirurgie s’est imposée comme une technique utilisable et fiable en urologie (7).
ANATOMIE DU REIN ET DE LA LOGE RENALE.
Le rein est un organe paire, situé dans le rétropéritoine de part et d’autre de la colonne vertébrale et des grands vaisseaux dans la fosse lombaire.
I.ANATOMIE DESCRIPTIVE
1. Forme
Le rein a la forme d'un haricot, il présente donc deux faces, ventrale et dorsale et deux bords.
Sa face antérieure est discrètement convexe tandis que la face postérieure est plane.
Il a deux bords, un bord externe convexe et un bord interne échancré à sa partie moyenne par le hile où cheminent les vaisseaux rénaux et le bassinet qui se poursuit vers le bas par l’uretère (Fig. n°1).
2. Dimension
Ses dimensions chez l’adulte sont : 12cm en hauteur, 6cm en largeur, 3cm en épaisseur, avec un poids moyen de 120g.
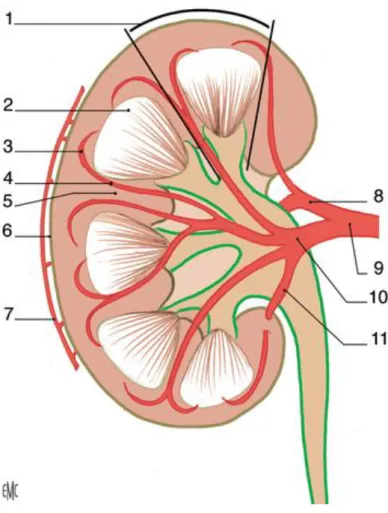
Figure n°1 : coupe frontale montrant l'architecture du rein (8). 1. Colonne rénale. 2. capsule rénale. 3. papille rénale. 4. fornix. 5. calice mineur. 6. calice majeur. 7. pelvis rénal. 8. jonction pyélo-urétérale. 9. uretère.
3. Architecture et structure du rein (fig 1)
a. La capsule fibreuse
Une capsule fibreuse entoure le rein et se réfléchit sur les lèvres du hile. Blanchâtre et relativement résistante, on peut la détacher assez facilement du parenchyme rénal (néphrectomie sous capsulaire)
b. le parenchyme rénal
Le rein est constitué de 2 zones de structure différente: la médullaire et le cortex (Fig n°2).
le cortex :
C’est la zone de filtration glomérulaire il est de couleur rougeâtre et de consistance friable mesurant 1cm d’épaisseurs entre la base des pyramides rénales et la capsule .Il comporte les glomérules les tubes contournés proximaux et distaux et les tubes collecteurs.
La médullaire :
Elle est composée des pyramides de Malpighi qui comportent les tubes droits proximaux et distaux ainsi que l’anse de Henlé et les canaux de Bellini. Entre ces pyramides, on trouve les colonnes de Bertin.
c. Le sinus rénal
Il comporte les ramifications du pédicule rénal (artère et veine rénale) et les voies excrétrices supérieurs intra rénale ou intra sinusale (8)
d. les voies excrétrices
Les voies excrétrices recueillent l'urine qui sort des papilles. Elles sont formées des calices mineurs, des calices majeurs nés de la confluence des calices mineurs et du bassinet né de la confluence de calices majeurs. (Fig. n°1)
Figure n°2: Morphologie interne du rein (8). 1. Lobule rénal. 2. pyramide rénale. 3. Artère arquée. 4. Artère interlobaire. 5. colonne rénale. 6. capsule rénale.
7. cercle artériel exorénal. 8. Artère rétropyélique. 9.Artère rénale / 10. Artère prépyélique.
II. ANATOMIE TOPOGRAPHIQUE
1. Généralités
Elle est importante à connaître tant pour l'examen clinique, que pour l'interprétation de l'imagerie et l'abord percutané, endoscopique ou chirurgical du rein. Dans la fosse lombaire, les reins s'inscrivent dans un cadre osseux formé par la colonne vertébrale, les dernières cotes et l'aile iliaques. Ils sont orientés en arrière et en dehors. Le rein droit est plus bas situé, il se trouve entre la partie supérieure de D12 et la partie moyenne de L3.Le rein gauche a son pôle supérieur qui se situe à la hauteur de la 11éme cote, et son pôle inférieur à la partie supérieure de L2.
2. La loge rénale :(fig 3)
Chaque rein est situé au sein d'une loge fibreuse. Cette loge résulte de la condensation du tissu conjonctif extra-péritonéal. Elle présente un feuillet pré-rénal relativement mince et un feuillet retro-pré-rénal relativement dense et résistant (fascia de Zuckerkandl). En haut, ces feuillets fusionnent au niveau du diaphragme après avoir englobé la surrénale. En bas, les deux feuillets se prolongent sans s'unir constituant une gaine à la voie urinaire.
Médialement, ils se replient sur le pédicule vasculaire.
Au sein de cette loge, le rein est entouré de la graisse dite péri-rénale. Le feuillet ventral de la loge adhère au péritoine pariétal postérieur. Le feuillet dorsal est par contre séparé des plans postérieurs par la graisse para-rénale de Gérota. Cette face dorsale est facilement clivable de la paroi musculo-aponévrotique (plan de la néphrectomie totale élargie).
Figure 3: Loge rénale et région lombaire, vue de face (8).
1. Fascia rénal. 2. feuillet rétrorénal. 3. muscle grand psoas. 4. feuillet intersurrénalorénal. 5. feuillet prérénal.
6. capsule adipeuse. 7. graisse pararénale.
3. Rapport Du Rein :
a. Rapports antérieurs :
Rein droit :
En haut : le rein est en contact avec la face postérieure du foie, il y a un cul de sac de la cavité péritonéale entre le foie et le rein, nommé l’espace hépato rénale (ou Morrison).
Au milieu : le rein est en rapport avec la seconde portion du duodénum qui se place devant le bord interne du rein.
En bas : les rapports se font avec la racine du méso colon et l’angle colique droit.
Rein gauche :
En haut : la rate se place devant le rein et recouvre sa partie antérieure l’angle splénique se place en dehors du rein, le pancréas passe devant le rein pour se diriger vers la rate et le colon transverse passe devant le pole inférieure du rein.
En avant : le rein est en rapport avec l’estomac.
b. Rapports postérieures :
Dans sa partie thoracique le rein est en contact avec (Figure n°4, 5) : Le diaphragme et le cul de sac pleuro-costo diaphragmatique. La 11éme, la 12éme cote et l’espace intercostal.
Le ligament arqué latéral
Dans sa partie abdominale on trouve : b) En dedans le muscle psoas.
En dehors le muscle carré des lombes.
c. Rapports supérieurs :
La glande surrénalienne coiffe le rein dont elle est séparée par le feuillet inter-surréno-rénal.
d. Rapports inférieurs :
Le rein est en rapport avec le corps de la troisième vertèbre lombaire (9)
e. Rapports internes :
A droite : on trouve la veine cave inférieure dont le rein est séparé par les vaisseaux génitaux.
A gauche : on trouve l’aorte dont il est séparé par les vaisseaux génitaux, et une partie du muscle psoas.
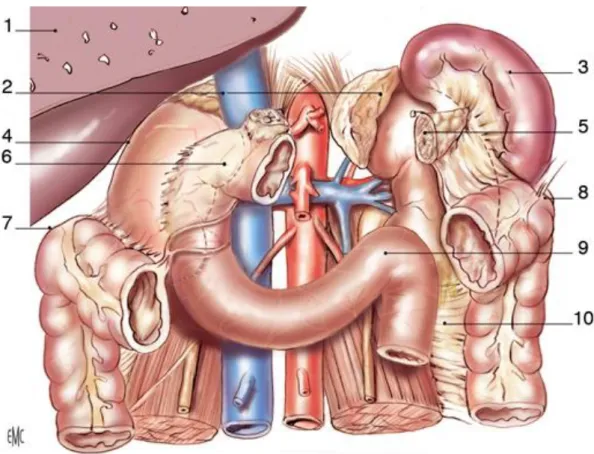
Figure n°4 : Rapports avec les viscères rétro- et intra péritonéaux, vue de face (8).
1. Foie (sectionné). 2. glandes surrénales. 3. rate.
4. récessus hépatorénal.
5. queue du pancréas sectionnée. 6. 2 e duodénums.
7. angle colique droit. 8. angle colique gauche. 9. angle duodénojéjunal. 10. mésocôlon descendant.
Figure 5: Rapports avec la paroi abdominale, vue de face (8).
1. 12ème cote. 2. nerf sous-costal. 3. nerf iliohypogastrique. 4. nerf ilio-inguinal. 5. muscle carré des lombes. 6. muscle grand psoas. 7. nerf cutané fémoral latéral. 8. nerf génitofémoral.
9. promontoire.
10. centre tendineux du diaphragme. 11. ligament arqué médian.
12. ligament arqué médial. 13. ligament arqué latéral. 14. muscle transverse.
III. VASCULARISATION ET INNERVATION DU REIN :
(Figure n°6).
1. vascularisation artérielle :
Les deux artères rénales ont pour origine la face latérale de l’aorte. Elles naissent au tiers inférieur de L1, permettant la vascularisation du rein, le segment initial de l’uretère et une partie de la surrénale (8).
L’artère rénale droite est la plus longue mesurant 7cm de longueur et 7mm de diamètre elle chemine derrière la veine cave inférieure et la veine rénale droite et elle est oblique en bas et en dedans.
L’artère rénale gauche est plus courte mesurant 5cm de longueur et 7mm de diamètre, elle se trouve derrière la veine rénale gauche, le corps du pancréas et les vaisseaux spléniques (9).
A l’intérieure du parenchyme rénale la distribution artérielle est de type terminal chaque artère rénale se divise au hile en deux branches terminales principales un rameau antérieur dit pré pyélique qui donne des branches qui vascularisent la partie ventrale du rein et qui donne l’artère polaire inférieure et un rameau postérieur dit rétro pyélique qui donne des branches qui vascularisent la partie dorsale du rein et qui donne l’artère polaire supérieure également ces rameaux donnent les artères inter- papillaires puis les artères inter-pyramidales et les artères radiées et les artères glomérulaires (8).
Enfin les collatérales de l’artère rénale sont : L’artère surrénalienne inférieure.
2. Vascularisation veineuse :
La veine rénale provient de la réunion des troncs prépyélique et rétro pyélique au niveau du bord médial du sinus rénal et en avant des artères rénales. La veine rénale droite est courte mesurant 3cm de longueur et horizontale. La veine rénale gauche est plus longue mesurant 7cm de longueur passe en avant de l’aorte juste distalement à l’artère mésentérique supérieure, avant de se jeter dans la veine cave inférieure.
Les veines rénales se terminent à la hauteur des bords latéraux de L1, un peu plus haut à gauche qu’à droite.
En conclusion le système veineux rénal comporte plusieurs grosses anastomoses de sorte que la ligature d’une veine accessoire est sans conséquences, parmi ces veines accessoires on trouve : Les veines urétérique supérieurs, les veines surrénalienne inférieures, avec en plus des veines gonadiques (9).
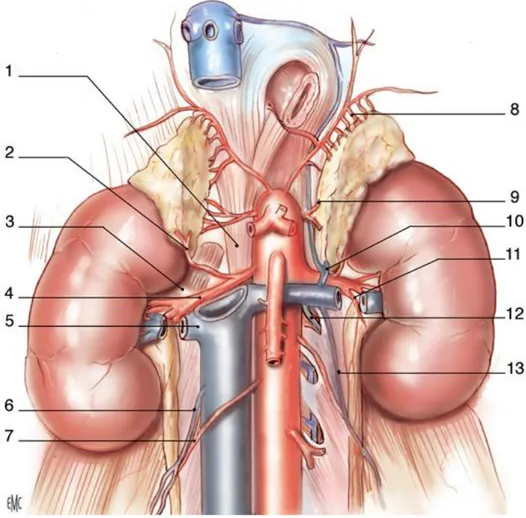
Figure 6: Vue de face montrant la Vascularisation rénale (8).
1. Pilier droit du diaphragme. 2. artère surrénale inférieure droite. 3. muscle grand psoas.
4. artère rénale droite. 5. veine rénale droite. 6. veine gonadique droite. 7. artère gonadique droite.
8. artère surrénale supérieure gauche. 9. artère surrénale moyenne gauche. 10. veine surrénale inférieure gauche. 11. rameau urétéral.
12. arc réno-azygo-lombaire. 13. veine gonadique gauche.
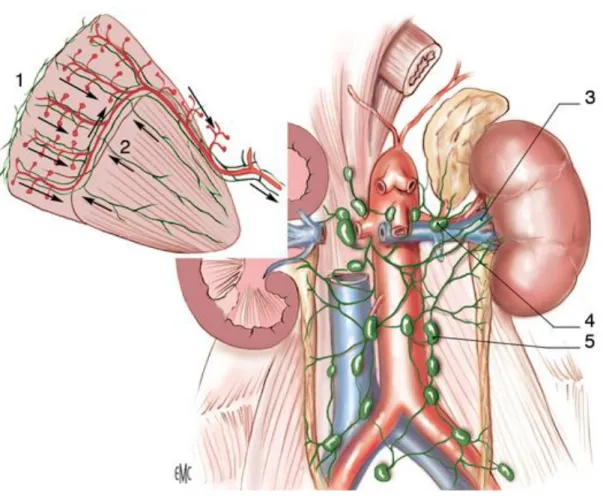
3. vascularisation lymphatique :
Les lymphatiques suivent dans le parenchyme le trajet des vaisseaux sanguins puis ils se regroupent en trois plans : antérieur, postérieur, et inférieurs par rapport au pédicule rénal.
Les ganglions se situent entre les veines et les artères, ils se drainent dans les noeuds latéro-aortiques, inter-aortico-caves et latéro-caves. (Figure n°7).
Figure 7: Vue de face montrant la Vascularisation lymphatique du rein (8).
1. Réseau cortical subscapulaire ; 2. réseau profond ;
3. collecteurs préartériels ;
4. lymphonoeuds rénaux pédiculaires ; 5. lymphonoeuds latéroaortiques.
4. L’innervation :
L’innervation rénale appartient au système sympathique et parasympathique.
Les afférences sympathiques du plexus rénal proviennent des ganglions du tronc sympathique de T10 à L1, du plexus cœliaque, par ailleurs les afférences parasympathiques proviennent des nerfs vagues.
Le réseau nerveux autonome pénètre dans le parenchyme rénal en logeant les axes vasculaires et VES, et se distribue dans le parenchyme et la capsule rénale, il est essentiellement péri-vasculaire et forme un riche plexus autour des artères interlobulaires et les artères afférentes, dont il va contrôler la vasoconstriction (8).
L’anesthésie pour cœliochirurgie nécessite une curarisation et une intubation oro trachéale avec ventilation mécanique. La curarisation est indispensable lors de la l'incision et doit être monitorée jusqu'à l'extubation. La mise en place d’une sonde gastrique permet de vider l'estomac et donc d'améliorer la visibilité du chirurgien. La pose d'une sonde urinaire avant l'incision permet de surveiller la diurèse per opératoire et donc une meilleure prise en charge hémodynamique du patient.
La capnie et les pressions d'insufflation doivent être monitorées en continu car le pneumopéritoine induit des modifications ventilatoires et une augmentation de la capnie. L'antibioprophylaxie est administrée avant l'incision chirurgicale et doit être conforme aux recommandations. En cas d'infection, une antibiothérapie sera débutée, le plus souvent à base de bêta –lactamines et quinolones. Elle doit être adaptée à l'écologie du patient et des éventuels résultats bactériologiques. Par ailleurs en cas de rein détruit avec infection l’antibiothérapie parentérale doit être commencée 5jours avant l’intervention en fonction des données de l’antibiogramme (10).
La néphrectomie par cœliochirurgie comprend plusieurs étapes. La première étape consiste en la création d’un pneumopéritoine en insufflant du CO2 dans la cavité péritonéale afin crée un espace de travail. Cette insufflation entraîne un certain nombre de modifications sur les plans respiratoire et hémodynamique.
Modifications respiratoires :
La création et le maintien du pneumopéritoine s’accompagnent augmentation de la pression intra abdominale. Celle-ci peut être responsable d'une diminution du volume minute par augmentation des pression d'insufflation et diminution du volume courant, et secondairement une augmentation de la capnie, voire une diminution de la saturation en oxygène. Ces paramètres doivent donc être surveillés et éventuellement modifiés, par augmentation de la fréquence respiratoire et du volume courant (11, 12).
Modifications cardiovasculaires :
L’augmentation de la pression intra abdominale entraîne une compression de la veine cave inférieure, et donc une diminution du retour veineux et par conséquent du débit cardiaque. La diminution de la pression artérielle n'est habituellement pas importante sauf en cas d 'hypovolémie. (11,12).
Modifications rénales :
L’augmentation de la pression exercée sur la veine cave inférieure s’accompagne d’une diminution de la diurèse préopératoire. Il a également été démontré une augmentation de l’excrétion urinaire de la N-acétyl-D-glucosamidase, marqueur de la souffrance rénale. Néanmoins, aucune conséquence clinique n’a été observée (11,12).
En conclusion, la coeliochirurgie n’est pas un geste banal, elle peut avoir des répercutions ventilatoires et hémodynamique ce qui impose un monitorage strict de ces patients.
Materiels De Chirurgie
Laparoscopique
La chirurgie laparoscopique nécessite un équipement complexe et spécifique.
I. LA CHAINE DE L'IMAGE
Elle est constituée par une source de lumière, une optique, une caméra, un ou des moniteurs et éventuellement un enregistreur.
1. La source lumineuse et le cable de lumière :
La source de lumière doit avoir une puissance minimale de 350 watts. Il
s'agit le plus souvent de source de lumière blanche munie d’une lampe au xénon. Certaine sources de lumière sont munis de lampes à mercure ou halogène. L’intensité lumineuse est réglée automatiquement par un système couplé à la caméra afin d'éviter une sous ou sur-exposition
Une lampe de rechange doit être en permanence disponible.
La lumière est conduite jusqu’à l’optique par un câble constitué de fibres optiques muni de raccords mécaniques spécifiques à la source de lumière et à l’optique.
L’état des fibres doit être vérifié régulièrement par inspection visuelle de l’extrémité distale (13).
2. L’optique :
Il permet de voir à l'intérieur de la cavité abdominale. Il est disponible en différents diamètres. Le plus couramment utilisé est le 10 mm. La résolution et la clarté de l’image sont d’autant plus grandes que le diamètre de l’optique est important. De même l’angle de vision par rapport à l’axe de l’appareil est variable : 0°, 5°, 30° et 70°, les deux premiers modèles sont les plus employés (13).
3. La caméra :
Elle est indispensable à la pratique de la cœlioscopie. Elle est raccordé à l'optique et permet la transmission de l'image sur l'écran. Elle peut être stérilisée par immersion, mais il est recommandé pour une plus grande longévité d’employer plutôt une housse stérile. Actuellement, il existe de caméra autoclavable.
Afin d'être parfaitement orienté au cours de l'intervention il est essentiel de maintenir la caméra à la verticale tout au long du l'intervention.
Les caméras dont on dispose actuellement sont des mono CCD ou des Tri-CCD. Afin d'améliorer la vision et en particulier de diminuer le problème de la profondeur (vision en deux dimension d'un espace trois-D) il est préférable d'utiliser une caméra tri-CCD qui donne une image de de plus grande qualité. (13). Actuellement, certaine camera 3D (système 3Di endosite visual systeme) donne un très bonne vision du relief qui pourrait concurrencer la vision du système intuitive de Da Vinci.
L’unité électronique qui traite l’image en provenance du capteur permet d’équilibrer les couleurs et la luminosité en début d’intervention (13).
4. Le moniteur :
C’est le dernier maillon de cette chaine de la vision. Il est important de disposer d’un appareil de bonne dimension et de bonne qualité, limitant les distorsions inévitables dans la restitution de l’image. Certaines interventions requièrent l’utilisation de deux moniteurs, afin que tous les participants à l’intervention aient une bonne vision du champ opératoire (13).
5. L’enregistreur vidéo :
Il permet la réalisation de films d’enseignement, ou éventuellement de revoir des procédures afin d’en analyser les qualités et les défauts.
Idéalement ils doivent être munis d’une télécommande et leur fonctionnement ne doit pas interférer avec celui des moniteurs. Il convient donc d’être particulièrement attentif lors des branchements des différents appareils en sortie de caméra ou de moniteur (13).
II. L’INSUFFLATEUR :
L’insufflateur permet l’introduction du dioxyde de carbone dans l’espace de travail laparoscopique à flux et à pression contrôlés. Après détente du gaz contenu dans la bouteille, ces paramètres sont contrôlés électroniquement.
L’insufflateur est muni de cadrans qui indiquent : - la pression intra-abdominale en mm de mercure - le flux de CO2 en litres/minute
- le volume total insufflé en litres
- la quantité de gaz restant dans la bouteille
L’élément essentiel de l’insufflateur est le régulateur d’insufflation, qui arrête celle-ci dès que la pression intra-abdominale atteint un seuil prédéterminé et réglable. Celui-ci se situe selon les chirurgiens et selon les procédures entre 10 et 15mm Hg. Par ailleurs la vitesse d’insufflation est réglable, soit de manière continue, soit par paliers, généralement entre 0,5 et 10 L/mn (13).
III. SYSTEME D’IRRIGATION ASPIRATION :
Il permet le lavage et l’aspiration au moment de l’intervention.
IV. MATERIEL DE COAGULATION :
Le bistouri électrique
Indispensable pour réaliser une cœlioscopie. Le générateur doit disposer des fonctions section et coagulation. Ou encore mieux de la fonction thermofusion qui permet de faire une véritable « soudure » des vaisseaux.
Il faut s’assurer de la bonne protection du matériel (prise de terre) afin que les courants de section et de coagulation ne parasite pas l’image. L'inconvénient de ce type de générateur est la production de fumée qu'il faudra aspirer et le risque de diffusion de courant avec risque de lésion d'un organe de voisinage.
Afin de remédier à ces inconvénients, certains fabricants de matériels ont mis au point des bistouris à ultrason (bistouri harmonique).Le principe de fonctionnement de ces bistouris repose sur la création d’ondes ultrasoniques (entre 40 et 60 kHz) de forte puissance grâce à un transducteur qui transforme une énergie électromagnétique en énergie mécanique. Cette friction entre les lames de la pièce à main et les tissus va générer une augmentation de température responsable de la dénaturation des protéines et par conséquence de la coagulation. Ces générateurs qui ne produisent pas de fumée et ne présentent pas de risque de lésions d'organe de voisinage, permettent de réaliser une dissection avec un minimum de saignement et plus de sécurité. Tout ceci
V. L’aiguille de veress :
Cette aiguille, disponible en matériel réutilisable comme en matériel à usage unique, permet la ponction de la cavité abdominale. Elle est munie d’une gaine mousse protégeant son extrémité pointue. Lors de la traversée des tissus, la gaine est rétractée et laisse apparaître la pointe, mais dès que celle-ci est en péritoine libre, un ressort ramène la gaine en place et rend ainsi l’aiguille mousse. Un témoin sur la poignée de l’aiguille indique la position de la gaine. Ce système ne protège en rien les viscères qui adhèrent à la paroi, car dans ce cas la gaine ne peut revenir en position de sécurité (13).
VI. LES TROCARTS :
Ils sont aujourd’hui disponibles sous de multiples formes. Ils sont soit réutilisables, soit à usage unique, soit encore mixtes, certaines pièces (notamment les valves) devant être changées à chaque intervention.
Ils sont métalliques, en bakélite, ou en matière plastique, et disponible par gammes de diamètre différent, généralement de 5 à15mm, mais des trocarts de 2mm sont maintenant disponibles. Certaines gammes offrent une grande modularité concernant les systèmes de valve la présence ou non d’un robinet d’insufflation, l’aspect du corps du trocart (lisse ou fileté) ou encore le mandrin adaptable (mandrin de sécurité, mandrin acéré ou mousse). Afin de permettre l’utilisation d’instruments de 5mm de diamètre dans des trocarts de diamètre supérieur. Différents types de réducteurs sont disponibles (13).
VII. LES INSTRUMENTS :
Ils sont résumés dans ce tableau en fonction de leurs rôles (13).
Nature du geste instrument aspect
Couper Ciseaux
Bistouri Crochets
droits, courbes, à corps angulable. mousses ou pointus, en serpette. à lame fixe ou rétractable.
pour électro-dissection. monopolaire.
prendre Pinces
Dissecteur
avec ou sans dents. fenêtrées ou pleines.
permettant ou non la coagulation. droits, courbes, angulés
suturer Porte aiguille fixes ou articulés.
manipuler Ecarteurs en éventail, en losange. gainés ou non.
coaguler Pince à coaguler
Bistouri à ultra-sons Bistouri à flux d’argon
Mono ou bipolaire.
clipper Pinces à clips A un coup ou à chargeur.
Aspirer-laver Aspirateur-irrigateur Avec ou sans pompe combiné avec un crochet.
Divers Sac d’extraction Epuisette ou souple.
Voies D’abords Et
I. LA VOIE TRANSPERITONEALE :
Cette technique est proposée dans la néphrectomie pour un rein non fonctionnel. Nous rapporterons les aspects techniques de cette intervention.
1. préparation préopératoire :
Le patient doit être admis à l’hôpital un jour avant l’opération, donné au patient 3litres de polyéthylène glycol la veille de l’intervention pour lavage des structures digestives. Il faut également mettre en place un protocole de thromboprophilaxie à base d’héparine à bas poids moléculaire à raison d’une seule injection de 40 mg en sous cutanée par jour débuté la veille de l’intervention, éventuellement associé au port de bas de contention, pendant la durée d’hospitalisation.
Ce traitement doit être maintenue jusqu’à déambulation active et complète du malade.
L’antibioprophylaxie peut être administré en préopératoire en une seule dose de céphalosporines de 2éme génération en intraveineuse (15).
2. Installation du patient :
Sous anesthésie générale avec curarisation, intubation et ventilation contrôlée. Le patient est installé en décubitus latéral (position de lombotomie). Cette position permet d’obtenir un écartement des structures digestives par déclivité et une angulation faible des trocarts par rapport à l’horizontale avec une meilleure ergonomie (15). Les champs opératoires sont disposés de façon à permettre l’introduction des trocarts ainsi que la réalisation d’une incision
Une table de conversion doit être prête à être utilisée en cas de complications. Les compresses et les aiguilles doivent être comptées en début d’intervention. Le moniteur vidéo est en face du chirurgien (10).
3. Instrumentations :
Deux trocarts de 10mm pour l’optique, la pince bipolaire, et la pince à clip.
Deux trocarts de 5mm pour les ciseaux, le dispositif d’aspirations, et le rétracteur du foie.
Ciseaux monopolaires, pince bipolaire, un dispositif d’aspiration, une pince a clips de 10mm, une aiguille guide, rétracteur du foie, aiguille de veress… (15).
4. l’intervention :
la création d’un pneumopéritoine :
Elle peut se faire par ponction à l’aiguille de Palmer ou Veress au niveau de l’hypocondre. Au niveau de l’hypocondre, on perçoit trois ressauts correspondant aux plans aponévrotiques antérieur et postérieur et au péritoine (16). L’insufflation de CO2 est réalisée avec un débit de 2 L/min et une pression de 13 mm Hg au maximum.
Par cette technique, il existe un risque de perforer un organe creux, de blesser le foie ou la rate (10).
Afin d'éviter ces complications certaines équipes sont d'ardent défenseur de l'open cœlioscopie qui consiste à faire une incision pariétale jusqu'à ouvrir le péritoine. Le premier trocart est ensuite introduit à travers cette incision puis l'aponévrose est refermée pour assurer l'étanchéité. La philosophie de cette technique est de remplacer deux gestes effectués à l’aveugle par un abord chirurgical à minima sous contrôle visuel.
C’est une alternative surtout en cas d’antécédents de laparotomie, ou encore si l’opérateur n’a pas l’expérience de la ponction à l’aiguille.
La mise en place des trocarts opérateur :(Photo n°1)
Après insufflation complète à l’aiguille, un trocart de 10 mm est placé à 3-4 travers de doigts de l’ombilic avec un angle d’introduction oblique en haut et en arrière. Cette angulation doit être d’autant plus horizontale que le patient est maigre. L’introduction immédiate de l’optique permet d’inspecter la cavité abdominale et de vérifier l’absence de plaie (15). Ce premier trocart permet également de choisir l'emplacement des trocarts suivant (en respectant la règle de triangulation et en évitant les zones d’adhérences).la règle de triangulation consiste à laisser quatre doigts entre l’optique et le trocart du travail et cinq doigts entre les deux trocarts du travail.
Les deuxième (trocart de 5mm, ciseaux monopolaire), le troisième (trocart de 10mm, la pince bipolaire) et le quatrième port (trocart de 5mm et le dispositif d’aspiration) sont placé en respectant la règle de triangulation (15).
Le cinquième port (trocart de 5mm et le rétracteur du foie) : est placé à deux travers de doigts sous le 2ème port quand le foie gêne la dissection du pédicule rénal droit (15).
Le décollement colique homolatéral :
À droite, le décollement est réalisé en incisant le péritoine pariétal
postérieur dans la gouttière pariétocolique, il permet d’atteindre rapidement le bord droit de la veine cave inférieure après bascule interne du deuxième duodénum.
À gauche, le décollement colique est réalisé de la même manière. La
dissection de l’angle gauche doit être menée avec prudence afin de ne pas blesser la rate.
Dans tous les cas, il faut éviter de mener la dissection dans le plan postérieur de la loge rénale afin que le rein reste collé à la paroi (10).
Dissection veineuse :
À droite, elle doit être menée à partir du bord droit de la veine cave inférieure. Après avoir ouvert la gaine vasculaire, on dissèque la face antérieure de la veine rénale sur 1 à 2cm en restant au contact. On dissèque les bords inférieurs et supérieur en saisissant la veine avec une pince fenêtrée et en effectuant des mouvements de bascule vers le haut et vers le bas. La face postérieure de la veine constitue la zone de danger du fait de l’existence de veines lombaires.
L’exposition de la face postérieure est plus facile et plus sûre après dissection des bords supérieur et inférieur et de la face antérieure
Du côté gauche, la veine génitale est le fil d'ariane pour remonter jusqu'à la veine rénale. La dissection de la face antérieure de la veine rénale est menée en aval de l’abouchement de la veine génitale. Une dissection complémentaire peut
éventuellement être menée vers le hile. En effet, si du côté droit la dissection de la veine est réalisée sur le tronc principal au contact de la veine cave inférieure, du côté gauche le risque est de réaliser la dissection intra hilaire d’une branche ne correspondant pas au tronc principal tout en méconnaissant une ou plusieurs branches d’amont. La dissection des bords inférieur et supérieur et de la face postérieure de la veine sera menée avec la même prudence qu’à droite. Le principal danger de la dissection du bord supérieur est la veine surrénalienne inférieure gauche. La dissection du pédicule vasculaire loin du hile prend tout son intérêt lors de l’ablation de reins aux antécédents d’infections multiple. Il est ainsi possible de s’éloigner de la fibrose péri rénale et l’infiltration résiduelle du tissu lymphatique pédiculaire. La ligature de la veine se fera après ligature de l'artère (10).
Dissection artérielle :
Dans un premier temps, l’artère est disséquée sur toutes ses faces puis clipée et sectionnée aux ciseaux. La section se fera partiellement afin de vérifier que l'artère est bien clipée.
Deux clips au moins sont nécessaires au niveau du moignon d’amont. Les clips avec système de verrouillage apportent une sécurité supplémentaire. En cas de difficulté d’exposition, il est possible de placer un seul clip sur l’artère puis sectionner la veine pour revenir à l’artère.
La ligature de la veine:
Le contrôle veineux avec une pince endo-GIA est rapide et sûr. Si les vaisseaux sont de petit calibre, un agrafage simultané de l’artère et de la veine peut être réalisé en laissant un espace entre les deux. Après agrafage et section,
et avant d’ouvrir l’endo-GIA, il faut saisir le moignon artériel ou veineux situé du côté des gros vaisseaux avec une pince fenêtrée en prévision d’un éventuel saignement. Le vaisseau peut être ainsi plus facilement accessible en cas d’agrafage insuffisant et un deuxième agrafage ou la pose d’un clip peuvent se faire immédiatement (10).
Du côté gauche, en cas de conservation de la surrénale, il faut clipper la veine surrénalienne inférieure (10).
L'utilisation de clip avec système autoverrouillable type hémolock ou opsolock permet un bon contrôle de la veine.
En l'absence de clip ou d'endo-GIA, on peut ligaturer les vaisseaux par des nœuds endocorporels.
Dissection du rein :
Comme pour toute néphrectomie, la dissection qui suit le contrôle pédiculaire doit être prudente en raison du risque de rencontrer des vaisseaux surnuméraires, surtout en cas de rein dystrophique (10).
La poursuite de la néphrectomie est fonction de l’état local et doit être menée initialement dans les zones les plus faciles à disséquer (10).
Trois options sont possibles :
Une dissection du bord interne de la loge par traction antérieure du moignon vasculaire rénal de façon à repérer le plan du psoas ; la dissection est alors poursuivie vers le bas puis vers le haut en s’éloignant des gros vaisseaux (10).
Une dissection du pôle inférieur de la loge avec section urétérale entre deux clips en retirant une éventuelle sonde JJ ; le moignon urétéral et la graisse sont utilisés pour tracter la pièce en avant en suivant ainsi le plan du psoas. Si la dissection a été menée à partir du pédicule rénal, le pôle inférieur de la loge est disséqué comme décrit précédemment. Le plan du psoas est suivi vers le haut en étant prudent au bord interne de la loge s’il n’a pas été disséqué en premier (10). En cas de dissection aisée entre le rein et sa graisse, le plan de clivage au contact capsulaire peut être suivi après contrôle pédiculaire qui reste le premier temps obligatoire (10).
Dissection du pole supérieur :
Lors du passage dans le plan de la néphrectomie élargie, le plan de dissection inter réno surrénalien peut être difficile à mettre en évidence. La section de la graisse est effectuée aux ciseaux avec courant de coagulation. L'utilisation d'un bistouri harmonique facilite grandement cette dissection. Cette dissection comporte un risque lié aux artères et veines surrénaliennes difficilement individualisables dans le tissu graisseux. On termine ainsi de libérer complètement la pièce. La dissection peut aussi être menée au contact de la capsule rénale si ce plan est facilement clivable (10).
Extraction de la pièce :
Elle peut être réalisée par l’orifice ombilical ou du trocart de 12 mm en cas de petit rein. L’alternative est de réaliser une incision sus pubienne ou transrectale, surtout chez l’obèse. On utilise un extracteur à poche plastique (10) l'extraction par le vagin a également été décrite.
Fin d’intervention :
Après fermeture de l’orifice d’extraction de la pièce, le pneumopéritoine est recréé et le contrôle d’hémostase est réalisé. Une toilette est réalisée à l’aide de l’aspiro-laveur, surtout en cas de rein infecté. Le côlon est repositionné par déclivité ou à l’aide d’un point résorbable. Si un drain aspiratif est nécessaire, il est mis en place par l’orifice d’un trocart de 5mm. Les trocarts sont retirés sous contrôle de la vue pour ne pas méconnaître un saignement pariétal. Les orifices aponévrotiques les plus larges (10 et 12mm) sont refermés par un point en X résorbable (10).
II. LA VOIE RETRO PERITONEAL :
Cette technique a l’avantage de la simplicité. Elle permet de faire l’intervention avec un seul aide, qui peut manipuler l’instrument ou la caméra d’une main et instrumenter ou manipuler le réducteur de l’autre main (17).
1. Installation du patient :
Le patient est placé en position de lombotomie, la colonne technique en face de l’abdomen, l’opérateur et son aide en arrière. Il est capital de vérifier soigneusement et de protéger les points d’étirement ou de compression, et ce d’autant plus que l’intervention peut être longue. Il est également important d’éloigner la dernière côte de la crête iliaque par un billot et/ou une flexion de la table, afin de disposer d’une aire plus grande pour placer les trocarts. Pour cette intervention comme pour beaucoup d’autres, l’installation est un temps capital qui conditionne en grande partie la facilité de l’intervention et mérite donc une attention particulière. Une table pont au niveau des membres inférieurs permet de disposer le matériel de façon accessible et pratique (17).
2. Instrumentation : Une pince de Kelly.
Un trocart de 10/12 mm pour l’optique.
Un trocart de 10/12 mm pour les gros instruments. Un réducteur 12/5 mm.
Un trocart de 5mm.
Une optique 0° de 10mm.
Une paire de pince à préhension atraumatique. Une pince pour coagulation bipolaire.
Un aspirateur-irrigateur.
Une pince à clips de 10mm de long au moins.
Une agrafeuse coupante automatique rechargeable à agrafes vasculaires (pas toujours nécessaire).
Un sac à extraction à ouverture autostatique. Boîte de « paroi ».
Boîte de néphrectomie avec clamps vasculaires prête en salle. Pince type hemo-lock.
3. Etapes de l’intervention :
Ponction initiale et insufflation et position des trocarts :
Après badigeonnage et drapage, l’intervention débute par une incision cutanée longue d’environ 10mm, située 2cm sous la dernière côte et 2cm en dehors des muscles érecteurs du rachis, destinée au premier trocart (de 10mm, pour l’optique). Par cette incision, on ponctionne la fosse lombaire avec une pince mousse (par exemple une pince de Kelly) inclinée à 45°, sur environ 5 à 7cm de profondeur. Une étude anatomoradiologique a montré que ce site et cette direction de ponction permettaient constamment d’accéder dans la loge rénale et d’éviter le péritoine (18). La seule aponévrose offrant une résistance à ce niveau est celle du muscle grand dorsal. Une fois l’extrémité de la pince en place, celle-ci oscelle-cille avec la respiration.
La pince est remplacée, dans son trajet, par le premier trocart muni d’un mandrin mousse ou, s’il s’agit d’un trocart à usage unique, muni du mandrin désarmé et donc protégé. On peut immédiatement vérifier la position du trocart dans la graisse péri rénale par l’introduction de l’optique et commencer aussitôt le pneumo dissection, à une pression d’insufflation maximale de 12mm Hg. Sous l’effet du dioxyde de carbone, le tissu graisseux péri rénal se décolle progressivement du plan postérieur, le premier repère est le muscle psoas, très facilement identifiable dans la partie inférieure du champ de la caméra (17).
La pneumo dissection permet un décollement progressif de la graisse péri rénale au sein de laquelle on commence à identifier la capsule rénale, et surtout elle repousse le péritoine et son contenu vers l’avant. On peut s’aider, lors de ce temps, de mouvements de l’optique pour faciliter les décollements. La transillumination permet de vérifier la limite antérieure du décollement péritonéal. On obtient ainsi un volume de travail d’environ 3 ou 4L. L’optique reste généralement placée dans ce trocart pendant toute la durée de l’intervention (17).
Mise en place des deux autres trocarts :
Le deuxième trocart, habituellement de 5mm, est placé sur la ligne axillaire antérieure, à la limite antérieure du décollement péritonéal, et à l’extrémité de la « lombotomie virtuelle » qui serait nécessaire en cas de conversion. La transillumination pariétale permet de vérifier la qualité du décollement péritonéal et l’absence de vaisseau pariétal sur le trajet de ponction. Le trocart est placé sous contrôle visuel endoscopique (17).
Le troisième trocart, habituellement de 12mm pour permettre l’utilisation éventuelle de l’agrafeuse automatique ou d'une pince a clip, est placé sur la ligne axillaire postérieure, au niveau du quadrilatère de Grynfelt. Il est important de laisser quelques centimètres au-dessus de la crête iliaque afin de permettre une bonne mobilité du trocart et des instruments. Il est placé avec les mêmes précautions que le précédent (17) ; (Photo n°2).
Photo n°2: .Sites d’insertion des trocarts
Dissection du pédicule :
On accède à celui-ci dans l’angle entre la face antérieure du psoas et la face postérieure du rein. La dissection est facilitée par la mise en tension du pédicule par une pince qui soulève le parenchyme. L’artère est au premier plan, facilement repérée par ses battements. L’anatomie est variable. Pour les petits reins détruits (néphrectomie simple), la rétraction parenchymateuse amène souvent à disséquer de fait dans le hile, en aval de la bifurcation, et il y a souvent plusieurs artères à contrôler. Dans le cas de la néphrectomie élargie, il
faut contrôler les vaisseaux le plus bas possible. Il est généralement simple de faire le tour des artères, qui sont au premier
Plan du pédicule par cette voie. On dissèque quelques lymphatiques et un tissu fibreux que l’on coagule au fur et à mesure. Il faut éviter de blesser la veine juste en arrière. L’artère est obturée par deux clips en amont et un clip en aval, puis sectionnée (17).
Certain auteur utilise une pince rechargeable par chargeurs de huit clips, de 10mm de diamètre, qui a l’avantage de pouvoir être manœuvrée en ouverture-fermeture avant d’y faire descendre le clip.
On peut donc s’en servir pour la dissection des vaisseaux et ne présenter le clip qu’au dernier moment. Il faut utiliser des clips de 10mm. Mais il est également possible de lier l’artère au fil, en passant un brin libre d’environ 10cm autour du vaisseau et en le liant en endocorporelle au moyen de deux portes aiguilles (17).
L’agrafage par pince automatique n’est généralement pas nécessaire, mais il est bien entendu possible, en veillant, comme pour la veine, à utiliser des agrafes de type « vasculaire », plus courtes, afin d’assurer une occlusion complète du vaisseau. Cette méthode a toutefois comme inconvénient son coût. Une fois le plan artériel traité, la veine est très facilement identifiable. La dissection douce permet d’en faire le tour. Selon sa taille et sa disposition anatomique, elle peut être obturée par des clips ou par application d’agrafes vasculaires à l’aide d’une agrafeuse automatique coupante. Selon l’anatomie et le côté, il faudra lier et couper la veine génitale. Si l’on envisage de respecter la
glande surrénale, il faudra lier et couper le pédicule surrénalien inférieur, en particulier à gauche (17).
Dans les reins détruits, la rétraction du parenchyme sur le hile permet le plus souvent de bien voir les branches de la veine rénale, qui peuvent éventuellement être liées séparément. Pour la veine comme pour l’artère, une ligature endocorporelle au fil est possible, à condition de bien en maîtriser le geste, car la paroi vasculaire est plus fragile que celle de l’artère. Il est de toute façon hautement recommandé de doubler ces ligatures (17).
Libération du rein et de l’uretère :
Pour la néphrectomie totale, le rein est disséqué en bloc avec la graisse. Si l’on enlève également la glande surrénale, il faut alors disséquer, clipper et couper les pédicules de cette glande. À droite, la dissection de la veine surrénalienne moyenne peut être délicate (17).
En revanche, le pédicule supérieur est le plus souvent grêle et peut généralement être électrocoagulé à la pince bipolaire. La section de l’uretère ne pose généralement pas de problème, après en avoir clipée les deux tranches de section. Il est pratique de réséquer une bonne longueur d’uretère, qui permet une préhension et une manipulation facile du rein (17).
Une fois totalement libéré, le rein est extrait par l’orifice de trocart inférieur. À cet effet, on introduit par ce trocart un sac d’extraction à usage unique muni d’un système d’ouverture rigide et autostatique, et le rein est introduit dans le sac à l’aide d’une pince à préhension placée dans le trocart antérieur, sous le contrôle de la caméra placée dans le premier trocart (postéro
4. Soins postopératoire : La douleur :
Le but de cette technique mini invasive est, entre autres, de réduire les douleurs postopératoires. On constate effectivement, dès le lendemain de l’intervention, une réduction des demandes en analgésiques, et les antalgiques non-opiacés sont le plus souvent suffisants. En revanche, il ne faut pas sous-estimer les douleurs postopératoires immédiates, qui peuvent nécessiter l’emploi de morphinique. Il est important de s’adapter à la demande du patient, car la qualité de l’analgésie initiale influe certainement sur la qualité des suites ultérieures (17).
Reprise de l’alimentation :
En l’absence de nausées, le patient peut boire dès le soir de l’intervention et recommencer à s’alimenter le lendemain. Quand une brèche ou une diffusion de gaz a entraîné un pneumopéritoine, il peut y avoir quelques troubles digestifs transitoires rapidement régressifs. Si le diagnostic est fait en cours d’intervention, il faut s’efforcer, lors de l’exsufflation de la loge, d’évacuer le gaz intra-péritonéal, ce qui n’est pas toujours facile (17).
Lever et prophylaxie de la thrombose :
Le lever précoce et indolore est un des avantages majeurs de cette technique, et les patients y sont autorisés dès le lendemain de l’intervention. La prescription et la durée d’un traitement prophylactique de la thrombose veineuse sont fonction du terrain, de la mobilité du patient, mais aussi de la durée de l’intervention (17, 18).
Soins locaux :
Ils se résument à une surveillance des orifices de trocart, les fils étant enlevés entre 5 et 7 jours. (17).
Complications de la
chirurgie laparoscopique
La chirurgie laparoscopique est dite minimale invasive, mais comme toute chirurgie a des avantages et des inconvénients.
On distingue deux types de complications médicales et techniques.
I. LES COMPLICATIONS MEDICALES
1. l'embolie gazeuse :
La plupart des laparoscopies utilisent le dioxyde de carbone (CO2) comme gaz d'insufflation. En effet, sa solubilité dans le sang lui permet d’être éliminé par les poumons.
L’embolie gazeuse est le plus souvent due à une insufflation intra-vasculaire directe, plus rarement après la pénétration du CO2 dans la veine. Ce gaz qui a pénétré dans la circulation veineuse crée un obstacle vasculaire dans le ventricule droit puis dans le réseau artériel pulmonaire, responsable d’une défaillance cardiaque droite puis gauche aiguë (19).
La capnographie montre une baisse brutale du CO2 télé expiratoire, l’auscultation cardiaque met en évidence le classique « bruit de rouet ». Une diminution de la saturation en oxygène et une hypotension surviennent rapidement (19).
Un réglage adéquat (12mmHg) de la pression d’insufflation prévient en partie ce phénomène. La décurarisation du patient peut entraîner une augmentation importante de la pression intra cavitaire indépendamment de la pression d’insufflation, ce qui peut favoriser la survenue d'une embolie gazeuse (19).
Le traitement spécifique comprend l’arrêt de l’insufflation et l’exsufflation, et la mise du patient en décubitus latéral gauche et en Trendelembourg afin de déplacer la bulle intra cardiaque de CO 2. Si un cathéter de pression veineuse centrale est en place, on peut tenter l’aspiration du gaz en mobilisant le cathéter (19).
2. Les perturbations métaboliques :
On distingue deux complications métaboliques essentiellement l’hypoxie et l’hypercapnie.
L’hypoxie est due à une inadéquation entre la ventilation et la perfusion, essentiellement la diminution de la course diaphragmatique par le pneumopéritoine. Cette anomalie est généralement facile à contrôler par une adaptation du respirateur.
L’hypercapnie est secondaire à la réabsorption du dioxyde de carbone par le système vasculaire en raison du gradient de pression et parfois à la diminution du volume minute (fréquence respiratoire multipliée par le volume courant, pouvant être diminué par l'augmentation de la pression intra abdominale). Elle peut entraîner une tachycardie ou une hypertension artérielle. La prévention de l’hypercapnie repose sur la surveillance continue par la capnographie (19), et on traite la modification des paramètres ventilatoires si besoin.
Le CO2 télé expiratoire doit être maintenu entre 30 et 45mm Hg, ce qui assure généralement une PaCO2 à 50mm Hg.
En cas d’hypercapnie, il faut parfois associer à l’augmentation de la fréquence respiratoire une exsufflation temporaire (19).
3. Le risque thrombo-embolique :
La plus part des complications thromboemboliques sont de révélation tardive (20).La durée de la cœlioscopie supérieure à 2 heures serait un facteur favorisant les thromboses veineuses (20, 21).
Actuellement, il n y a pas de consensus concernant les mesures prophylactiques du risque thromboembolique au cours de la chirurgie laparoscopique, mais certains auteurs recommandent une prophylaxie par les héparines de bas poids moléculaire, si possible la poursuivre après la sortie du patient, et l’emploi pré-opératoire de bas pneumatiques de compression intermittente (22).
4. Les complications pariétales :
L’apparition d’un emphysème sous cutané n’est pas rare, et plus fréquent chez les sujets maigre et en cas de fuite au niveau des orifices de trocarts (23).Pour éviter cette emphysème il convient d'éviter de faire des bourses autour des trocards.
Les métastases sur le site du trocart est une complication spécifique de la
voie d’abord(24,25), et le seul cas référencé intéressent les interventions de type néphro-urétéroctomie pour les tumeurs urothéliales ou de type néphrectomie pour les tumeurs urothéliales méconnues(24,26). Ce risque peut être considérer comme nul dans les néphrectomies élargies (24, 26, 27).
L’hématome de la paroi est rare, dans une série de 21 patients qui ont
subies une néphrectomie par voie laparoscopique un seul hématome de la paroi à été décrit (28).
Les hernies et les éventrations sont nettement plus rares qu’avec la
chirurgie ouverte, elles existent toutefois quel que soit le type de la voie d’abord, mais avec un taux inférieur a 1% (264, 29, 30, 31).
La prévention repose sur la fermeture des orifices de trocarts. 5. Les complications post-opératoires spécifiques:
Les douleurs scapulaires sont une complication postopératoire fréquente, ces douleurs, spécifiques de l’abord trans-péritonéal, sont dues à la mise sous tension du ligament rond (23).
Reidel est le premier qui a décrit cette douleur : elle est posturale, elle est exacerbée quand le patient s’assoie ou se met debout (32).
Ces douleurs scapulaires peuvent également survenir après une laparoscopie rétro péritonéale. Elles sont prévenues par une exsufflation la plus complète possible.
Des cas de pneumothorax ou de pneumomédiastin ont également été rapportés (33).
Par ailleurs, des compressions et des étirements neuro vasculaires peuvent survenir, deux cas ont été rapportés dans une série de 125 patients obèses, d’où l’importance d’une installation soigneuse des patients (34).
II. LES COMPLICATIONS TECHNIQUES :
Il existe deux types de complications techniques les plaies vasculaires et viscérales.
1. plaies vasculaires :
Les plaies vasculaires sont des incidents fréquents, notamment en début d’expérience, elles sont à l’origine d’un pourcentage important de conversion, et souvent responsable de transfusions sanguines (23).
Leurs diagnostics sont souvent évidents, et le mécanisme le plus fréquent étant une section direct involontaire ou après ligature ou clipage défectueux.
Les vaisseaux les plus fréquemment concernés sont l’artère rénale droite et l’artère iliaque externe, ou leurs branches, mais une section de l’artère mésentérique supérieure a été décrite (35).
Le vaisseau responsable doit être pincé le plus rapidement possible, car l’hémorragie et le caillotage rendent le champ opératoire méconnaissable. Une fois le vaisseau identifié et pincé, une suture ou la pose d un clip par laparoscopie peut être envisagée.
En revanche, si le contrôle du saignement est difficile, que la durée de réparation risque d'être longue ou qu'il existe un risque de reprise hémorragique, il semble plus sage de convertir.
L’hémorragie d’origine cave est liée à l’arrachement d'une petite collatérale ou à une plaie de la terminaison de la veine génitale à droite. Il faut comprimer et tenter une réparation. Si la compression est inefficace, la conversion s'impose.
Les plaies veineuses peuvent occasionner des problèmes immédiats ou retardés. En effet, la pression exercée par le pneumopéritoine équilibre la pression veineuse. Il arrive qu’une section franche de la veine rénale par exemple ne saigne pas car la pression pneumatique comprime le vaisseau. C'est pour cette raison qu'il faut vérifier la qualité des hémostases veineuses lors de l'exsufflation ou de la baisse de la pression du pneumopéritoine.
2. Les plaies viscérales :
Les mécanismes sont soit la section direct, soit le traumatisme par un écarteur, soit encore une plaie retardée par traumatisme électrique qui représente environ 50% des étiologies (36).C'est pour cette raison qu'il convient de vérifier l'intégrité des isolants recouvrant les instruments.
Ces plaies peuvent être méconnues en per-opératoire. Elles peuvent toucher les viscères creux, essentiellement l’intestin (36, 37, 38), mais aussi l’arbre urinaire (23) ou encore des viscères pleins tels que rate, rein, foie, pancréas (35, 37, 38).
Quand elles sont reconnues, la réparation peut être envisagée par voie laparoscopique ou par en chirurgie conventionnelle.
MATERIELS ET METHODES :
Il s'agit d'une étude rétrospective effectuées au service d’urologie B du CHU Ibn Sina de rabat, durant une période qui s’étend du 01/09/2006 au 01/11/2008. Tous les patients ont eu une évaluation clinique et radiologique (échographie et U.I.V) en pré-opératoire.
Caractéristiques de nos patients:
I. DONNEES EPIDEMIOLOGIQUES :
1. Age :
L’âge moyen de nos patients est de 45ans, avec des valeurs extrêmes allant de 24 à 54ans.
2. Sexe :
On note une prédominance du sexe féminin, le sexe ration F/H est de 4,5 avec 9 femmes (82%) et 2 hommes (18%).
3. Coté opéré :
Chez tous nos patients l’atteinte est unilatérale, dont 6 à droites et 5 à gauches.
II. DONNEES CLINIQUES :
Symptomatologie :Nos patients était tous symptomatiques, le tableau clinique se caractérise par la présence des lombalgies dans tous les cas (100%), ces lombalgies sont isolées dans 06 cas (54,5%) et associées à des signes d’irritation vésicale dans 02 cas (18%), à une hématurie terminale dans 01 cas (9%), à des épisodes de colique néphrétique dans 01 cas (9%), et des signes neurosensoriel d’hypertension artérielle dans 01 cas (9%), (Tableau n°1).
Le début des symptômes remonte de 4 mois à 6 ans avant l’admission, soit une moyenne de 2,8 ans.
Symptômes Nombre de cas Fréquence en %
Lombalgies 11 100%
Lombalgies isolées 06 54,5%
Lombalgies avec signes d’irritation
vésicale 02 18%
Lombalgies avec hématurie
terminale 01 9%
Lombalgies avec des épisodes de
colique néphrétique 01 9%
Lombalgies avec des signes neurosensoriel d’hypertension artérielle
01 9%
III. DONNEES ETIOLOGIQUES :
La pyélonéphrite chronique est l’étiologie la plus fréquente, on la trouve dans 08 cas dont 06 sont associées a une maladie lithiasique , 01 à une urétérohydronéphrose sans obstacle et le dernier cas associés à un kyste rénale calcifié .
Pour les trois autres cas il 'agissait d'un kyste rénale simple dans 02 cas, et d'un syndrome de jonction pyélo-urétérale dans un seul cas ; (Tableau n°2).
Etiologies Nombre de cas Fréquence en %
Pyélonéphrite chronique
lithiasique 06
54,5%
Pyélonéphrite chronique non
lithiasique 02 18%
Kyste simple du du rein
02 18%
Syndrome de jonction
pyélo-urétérale 01 9%
IV. MATERIELS :
L’équipement
laparoscopique
utilisé est le suivant : 1. Une source lumineuse :La lumière est conduit jusqu’à l’optique par un câble afin d’éclairer le champ opératoire (Photo n°3).
Photo n° 3 : La source lumineuse
2. Une caméra :
Elle permet au chirurgien d’avoir une vision nette du champ opératoire, une compresse est placée dans une housse stérile dans le bot d’essuyer les lentilles au cours de l’intervention.
3. Un insufflateur :
Il est nécessaire pour crée le pneumopéritoine, le maintenir pendant l’intervention. Il permet également de renouveler le gaz périodiquement en contrôlant son flux et sa pression.
Le gaz utilisé est le dioxyde de carbone, sa pression intra-abdominale doit être de 12 à 15mmHg (Photo n°4).
Photo n°4 : L’insufflateur
4. Un moniteur :
C’est un écran qui permet la restitution de l’image captée par la caméra (Photo n°5).
Photo n°5: Un moniteur
5. Les instruments :
Un système d’irrigation-aspiration (Photo n°6).
Un bistouri électrique pour la section et la coagulation. Les trocarts opérateurs de 5mm et de 10mm (Photo n°7). Une aiguille de veress (Photo n°8).
Un clamp vasculaire type hémo-o-lock avec deux clips.
D’autres instruments à savoir : une pince bipolaire (photo n°9), ciseaux, porte aiguille (photo n°10), une pince fenêtrée, une pince à clips (Photo n°11), l’optique (photo n°12).
Une boite d’instruments utilisés dans la chirurgie a ciel ouvert en cas d’une éventuelle conversion.
Photo n°8: .L’aiguille de veress
Photo n° 10: Porte aiguille