1
INTRODUCTION
Le développement d’une candidose invasive est une complication hospitalière particulièrement redoutée en raison de sa mortalité élevée, comparable à celle du choc septique (40 %–60 %). La candidémie survient chez 0,05 % des patients hospitalisés, mais touche près de 1 % de ceux séjournant en réanimation.
Bien qu’une proportion élevée de patients hospitalisés soient colonisés par des levures du genre Candida, seule une minorité développe une candidose sévère. Celle-ci est toutefois difficile à diagnostiquer : les signes évocateurs d’une dissémination ne surviennent habituellement que tardivement. Un traitement empirique précoce ou préemptif pourrait améliorer le pronostic, mais pour des raisons tant épidémiologiques qu’économiques, un tel traitement ne peut être appliqué à tous les patients à risque de développer une candidose sévère.
Chez les patients présentant des facteurs de risque, une surveillance systématique permet de déceler le développement d’une colonisation et d’en quantifier le degré, de manière à ne débuter un traitement préemptif que lorsque l’index de colonisation dépasse un seuil critique prédictif d’infection disséminée. Ces éléments physiopathologiques et la mise à disposition des dérivés triazolés moins toxiques que l’amphotéricine B ont permis l’application de traitements prophylactiques.
2 Pour les patients de réanimation, une stricte limitation aux groupes soigneusement identifiés comme étant à risque élevé et chez lesquels l’efficacité de la prophylaxie a pu être démontrée doit contribuer à limiter cet impact épidémiologique défavorable [27].
Le diagnostic biologique se heurte à de nombreuses difficultés vu le manque de sensibilité et/ou de spécificité des techniques utilisées, d’où le retard du diagnostic aggravant le pronostic de la maladie. Pour cela, de grands efforts sont effectués pour la mise au point d’une méthode de diagnostic rapide et spécifique [5].
C’est la raison pour laquelle nous avons entrepris une étude prospective dans les services de réanimation médicale et chirurgicale de l’Hôpital Militaire d’Instruction Mohammed V de Rabat.
Notre travail s’articule ainsi autour de deux parties. La première partie est une revue de la littérature sur les aspects épidémiologiques et diagnostiques. Dans la deuxième partie nous exposerons et discuterons les résultats de notre étude prospective.
3
CHAPITRE I : Epidémiologie des candidoses systémiques
L’épidémiologie des candidoses systémiques a connu au cours du dernier quart de siècle de profondes mutations.
Ceci est en grande partie dû à d’importantes modifications des pratiques médicales : recours de plus en plus fréquent à des antibiotiques à spectre large, à des techniques diagnostiques ou thérapeutiques de plus en plus invasives, à des chimiothérapies cytotoxiques, aux greffes d’organe, et aux traitements immunosuppresseurs. Ces modifications des pratiques médicales et ces progrès thérapeutiques, ainsi que le vieillissement de la population et l’amélioration des résultats de la réanimation, ont d’une part amélioré la survie de cette population et d’autre part augmenté le nombre de sujets à risque (en particulier dans les unités de soins intensifs) [37].
I-1. Données épidémiologique
Les infections fongiques ont représenté 17 % des infections nosocomiales acquises en réanimation détectées au cours de l’étude européenne de prévalence des infections nosocomiales (EPIC), qui portait sur 10 038 patients issus de 1417 unités de réanimation européennes [107]. Les données de 115 hôpitaux américains du programme NNIS (National Nosocomial Infections Surveillance) disponibles pour la période 1992 à 1997 indiquent que près de 12% des infections nosocomiales sont d’origine fongique, occupant le quatrième rang, et précédées par les entérocoques, Staphylococcus aureus et les staphylocoques à coagulase négative [89].
4 L’incidence globale des candidémies est de huit épisodes pour 100 000 habitants [47]. Elle est influencée par l’âge, variant entre quatre épisodes pour 100 000 pour les sujets âgés de 20 à 44 ans, dix pour 100 000 de 45 à 64 ans, 26 pour 100 000 au-delà de 65 ans et 75 pour 100 000 pour les nouveau-nés. Elle augmente considérablement en présence d’une infection à VIH (71/100 000) ou d’un cancer (72/100 000).
Les candidoses systémiques se situent au quatrième rang des infections nosocomiales avec un pourcentage de 10 à 15 % [25,119]. Elles se rencontrent dans les unités de soins intensifs de réanimation chirurgicale digestive et cardiovasculaire, de brûlés et de réanimation médicale, dans les unités de greffes d’organes, dans les services d’oncohématologie et dans les services de néonatologie [80,119].
L’étude prospective réalisée par la Confédération européenne de Mycologie Médicale de Septembre 1997 à Décembre 1999 dans 7 pays de l’union européenne a montré que 40,2% des candidémies surviennent chez les patients hospitalisés en réanimation [40].
La mortalité globale des candidoses invasives est supérieure à 50% dans la plupart des séries et ces taux sont stables depuis plusieurs décennies [6, 87, 115]. La mortalité attribuable à cette infection, définie comme la proportion de décès directement dus à l’épisode infectieux, est de 25 à 40% [72, 73, 115].
5
I-2. Infections à Candida : particularités cliniques en
réanimation
Les levures du genre Candida font partie de la flore commensale humaine. L’état de colonisation par Candida est souvent difficile à distinguer de celui d’infection d’organe, ou même de candidose systémique. Le spectre clinique des infections à levures du genre Candida est très large ; en effet, pratiquement tous les organes peuvent être le site de croissance de ces levures et le siège d’une infection clinique, symptomatique ou non. Parmi les infections sévères, on distingue habituellement les infections hématogènes des infections non hématogènes, elles-mêmes séparées en infections superficielles ou profondes
(tableau I).
En cas d’infection sévère, le patient peut présenter un syndrome clinique de choc septique avec hypotension et insuffisance(s) organique(s) dont la présentation clinique et métabolique n’est pas différente de conditions similaires en cas de bactériémies à Gram négatif ou à Gram positif. Cependant, il n’est pas rare qu’un patient ayant une candidémie prolongée demeure asymptomatique
6
Tableau I : Types d’infections à levures du genre Candida
[25,77].Infections hématogènes
Infections non hématogènes
- Candidémie
infections superficielles
: - endophtalmie - candidose cutanée- endocardite - candidose oro-pharyngée - arthrite - vulvo-vaginite
- ostéomyélite
- spondylodiscite/méningite
infection profonde
: - pyélonéphrite - candidose œsophagienne - candidose pulmonaire - cystite à Candida- candidose hépatosplénique - candidose péritonéale - candidose pulmonaire
7 Les signes cliniques de candidémie ou de candidose systémique sont identiques à ceux qui caractérisent les épisodes de bactériémie ou de sepsis clinique, et ne sont donc absolument pas spécifiques [8]. En réanimation, certaines candidoses présentent des particularités cliniques :
Endophtalmie :
La présence de larges exsudats blancs d’aspect cotonneux à l’examen du fond d’œil est un signe évocateur d’une candidose systémique, dont elle peut être la seule manifestation. L’examen du fond d’œil doit être systématiquement effectué. Le développement d’une véritable endophtalmie pathognomonique n’est toutefois rencontré que chez 8 à 25 % des patients inclus dans les séries où une telle atteinte a été systématiquement recherchée [21].
Pneumopathie à Candida :
La colonisation des voies aériennes supérieures par Candida (trachée et bronches jusqu’au niveau segmentaire) est fréquente chez les patients sous ventilation mécanique [86]. Cependant, l’invasion des voies respiratoires inférieures est une complication qui est mise en doute par de nombreux experts
[24]. Une dissémination hématogène peut néanmoins être responsable d’une
pneumopathie à Candida qui se présente alors sous la forme d’abcès multiples
[30,86].
Candidose intra-abdominale :
Le développement d’une candidose intra-abdominale après une intervention chirurgicale est une complication sérieuse, dont la mortalité se situe entre 22 et 77 % [11, 96,102].
Bien que certains auteurs considèrent que tout Candida isolé de prélèvements abdominaux est pathogène, il ne s’agit que d’un contaminant dans
8 la grande majorité des cas [88,96]. Dans une série rapportée par Calandra et al., c’est la présence initiale d’une forte quantité de levures, ou leur augmentation progressive au cours de cultures séquentielles, qui a permis de prédire l’évolution vers une candidose [11].
Candiduries :
L’incidence de candiduries chez les patients sondés est élevée, mais leur signification en terme de prédiction de développement d’une candidose sévère reste controversée [43]. Dans un groupe de patients en réanimation chez lesquels une candidurie était mise en évidence, Neumann et al. ont observé une mortalité globale de 50 % comparée à 19 % seulement pour le reste du collectif [65].
Il n’y a cependant dans cette étude aucun élément permettant d’attribuer directement cet excès de mortalité à la candidurie.
Dans une étude récente portant sur 861 épisodes de candidurie, la mortalité globale des patients candiduriques est de 20 %, alors qu’une candidémie ne s’était développée que chez sept d’entre eux (1,4 %) et que deux seulement en sont directement décédés (0,4 %) [108]. Dans ce collectif, 90 % des patients présentaient des co-morbidités, suggérant que celles-ci soient responsables de l’essentiel de la mortalité. La candidurie a disparu chez 288 patients (33 %), sans traitement antifongique dans 117 cas (41 %), alors que le retrait de la sonde était suffisant dans 41 cas (14%) [101].
9
I-3. Emergence de souches de Candida non-Albicans
C. albicans est l’espèce la plus fréquemment incriminée (60 %), suivi de C. glabrata (20 %) dont l’incidence a augmenté ces dernières années sous la
pression des antifongiques azolés, puis de C. tropicalis (10 %) et de C. parapsilosis (5 %)[25,41]. Il faut aussi citer : C. krusei dont l’émergence est
attribuée à sa résistance primaire au fluconazole [5].
D’une façon générale, Candida albicans est l’espèce isolée dans 60 à 80 % des cas. Mais dans les dix dernières années, il est apparu une émergence de souches de Candida non albicans [23, 27,70]. Dans certains services, Candida non albicans peut représenter jusqu’à 70 % des souches isolées. L’émergence des souches de Candida non albicans varie en fonction du type de population étudiée, mais également en fonction de facteurs géographiques [6].
Dans certaines structures européennes les souches de Candida non albicans sont en nette augmentation, voire majoritaires [27,109]. Il faut également noter l’existence d’une augmentation de l’incidence des candidoses polymicrobiennes associant plusieurs types de Candida [37].
Une nouvelle espèce de Candida ayant des caractéristiques phénotypiques similaires à celles de C. albicans a été identifiée en 1995 et a été nommée C. dubliniensis [5]. La majorité des isolats de C. dubliniensis a été découverte au niveau de la cavité buccale des sujets infectés par le virus VIH. Cependant, cette espèce a été isolée récemment au niveau d’autres sites incluant le poumon, le vagin, le sang… aussi bien chez des sujets infectés par le virus VIH que des sujets non infectés par ce virus [32].
10
CHAPITRE II : Pathogénie, virulence et facteurs de risque
II-1. Pathogénie des infections à Candida
Au plan physiopathologique, les levures du genre Candida appartiennent à la flore commensale du tractus digestif et de la sphère oro-pharyngée. Les modifications de l’écologie de la microflore résidente, comme celles induites par l’administration d’antibiotiques, favorisent la croissance des Candida qui colonisent alors les surfaces muqueuses. Lorsque l’intégrité de ces dernières est compromise, une infection localement invasive se développe et une dissémination hématogène secondaire peut alors survenir à l’occasion d’une baisse transitoire de l’immunité [82].
Plusieurs études dans lesquelles l’origine des souches était déterminée par analyse du DNA fongique confirment qu’une grande partie des candidoses systémiques se développe à partir de souches endogènes dont le patient est porteur à l’admission [85].
Bien que ce mécanisme soit probablement à l’origine de la majorité des épisodes de candidose invasive, il faut insister sur le fait que la transmission nosocomiale, qui peut se faire par manuportage est également connue et fréquente [27].
Le modèle le mieux établi est celui de la candidose déterminée par C. albicans. Il comprend une séquence de quatre étapes [25,27]. (figure 1).
11
12
II-1-1 Colonisation
C. albicans est le pathogène le plus fréquemment hébergé par l’Homme et il colonise les muqueuses digestives et vaginales. Sa transmission s’opère par contact direct (transmission mère enfants lors de la naissance, mains, salive, rapports sexuels) [16].Contrairement aux différentes espèces de bactéries qui ont généralement un site de prédilection, on trouve C. albicans dans tous les segments du tube digestif, depuis la bouche jusqu’à l’anus. Cette levure adhère ainsi à de très nombreux types cellulaires différents, s’adapte à des pH très variés de multiples sécrétions (lysozymes, IgA sécrétoires, salive, mucus), et entre en compétition avec d’innombrables espèces bactériennes [25].
Dès les années 1970 on a pu montrer une augmentation de la colonisation chez les patients hospitalisés, ce qui a été confirmé à de nombreuses reprises tant en ce qui concerne le nombre de sites colonisés (bouche, anus, trachée, urine…) qu’en ce qui concerne le nombre de levures par site.
II-1-2. Invasion tissulaire
Elle est rapide, intra- ou extracellulaire, et s’opère vraisemblablement au niveau de l’intestin. Elle serait mécaniquement favorisée par les mucites liées à la chimiothérapie, par les chocs endotoxiniques, etc. Elle requiert de la part de C. albicans l’aptitude à digérer les tissus, la présence d’adhésines pour les cellules des sous muqueuses et les matrices intercellulaires, et l’aptitude à résister aux effecteurs de l’immunité naturelle ou acquise, cellulaire ou humorale
13
II-1-3. Dissémination hématogène
L’accès aux vaisseaux permet à C. albicans de disséminer, vraisemblablement sous forme de levure. Pour des raisons obscures, il est très difficile, à ce stade, de mettre en évidence C. albicans dans les hémocultures, ce qui contribue aux difficultés de diagnostic. Des études ont montré que chez des patients décédés de candidoses prouvées par analyse anatomopathologique de prélèvements nécropsiques, les hémocultures pratiquées quotidiennement n’avaient été positives que chez 40% d’entre eux [80].Chez ces derniers, les méthodes de typage moléculaire ont permis d’établir l’identité entre la souche colonisant le tube digestif et la souche isolée de ces hémocultures, ce qui fournit la preuve de l’origine endogène de l’infection.
II-1-4. Phase chronique
Il existe de très nombreux organes cibles dans lesquels C. albicans se réinstalle à la suite de la phase septicémique. Les plus fréquents chez les patients neutropéniques sont la rate et le foie. Cette candidose destructive dite « candidose chronique disséminée », est observée en sortie d’aplasie [80].
Chez les patients de réanimation et de chirurgie, un des organes cibles les plus fréquents est le rein où la végétation est intense, des pyélonéphrites peuvent révéler une candidémie passée inaperçue avec les hémocultures [16].
Des manifestations ostéoarticulaires se développent également à plus bas bruit et peuvent se révéler alors que le patient a quitté l’hôpital. Les choriorétinites conduisant fréquemment à une cécité sont également pathognomoniques de candidoses systémiques. Elles résultent du développement
14 de C. albicans sur la rétine (figure 2), objectivé par un fond d’œil. C’est sur cet examen que reposait il y’a seulement une dizaine d’années le diagnostic de certitude d’une candidose systémique [16].
Figure 2 : Fond d’œil en cas d’endophtalmie à levures du genre Candida [77].
15
II-2. Virulence et dimorphisme de Candida albicans
Les facteurs de virulence de C. albicans sont multiples, comprenant les adhésines servant à la reconnaissance de l’hôte, la sécrétion de phospholipases et d’aspartyl protéases et une variation de la morphologie (dimorphisme) [12].
II-2-1. L’adhérence à l’hôte
L’adhérence à des substrats de l’hôte est essentielle à toute colonisation par un pathogène. Dans le cas de C. albicans, cette étape essentielle est accomplie par une combinaison de mécanismes d’adhésion spécifiques (impliquant une réaction ligand-récepteur) et non spécifiques (charges électrostatiques, forces de Van der Waals). Ces mécanismes permettent tant l’adhésion à des tissus que l’adhésion à des surfaces inertes (cathéters, sonde…) [17]. Des adhésions ont été notées avec des molécules de surface de cellules bactériennes ou épithéliales et des protéines de la matrice extracellulaire [14].
Les adhésines de C. albicans sont des protéines qui se retrouvent à la surface des cellules. L’expression des différentes adhésines à la surface de la paroi cellulaire varie selon le milieu dans lequel se trouve le pathogène. L’adhérence bactérienne par les adhésines a été bien étudiée, mais les adhésines fongiques sont beaucoup moins connues [14].Quelques adhésines ont été étudiées, mais les fonctions des différents domaines de ces protéines restent à étudier.
Les recherches sur les adhésines ont pour but de trouver une façon de les inactiver, ce qui compromettrait la pathogénicité de C. albicans [17].
16
II-2-2. La sécrétion de phospholipases et d’aspartyl protéase
L’activité protéolytique de C. albicans jouerait un rôle important dans la virulence de cet organisme, même si le rôle de ce mécanisme dans l’infection humaine est encore mal connu [44].
Les études in vitro, chez l’animal et chez l’humain auraient toutefois démontré de sept façons, selon Naglik et al. [64], que l’activité protéolytique serait impliquée dans la virulence de C. albicans: corrélation entre la production d’aspartyl protéinases sécrétées (Sap), dégradation de protéines humaines par les Sap, association de la production de Sap et des autres facteurs de virulence de C. albicans, production de Sap et réponse immune de l’hôte face aux Sap lors de l’infection humaine et animale par C. albicans, expression des gènes de Sap pendant l’infection, la modulation de la virulence de C. albicans par des inhibiteurs des Sap et l’utilisation de mutants de C. albicans délétants pour les Sap et vérification de leur virulence. Les rôles attribués aux Sap dans l’infection par C. albicans pourraient aller de la simple digestion permettant l’absorption de substances nutritives, jusqu’à la digestion des cellules de l’hôte ou des immunoglobulines de l’hôte afin de résister au système immunitaire [54,64].
III-2-3. Le dimorphisme
Parmi les facteurs de virulences proposés pour C. albicans, c’est probablement le dimorphisme qui est le plus intriguant. Le dimorphisme est la capacité du champignon à changer de morphologie selon son état physiologique ou son environnement. Deux formes principales peuvent être observées, soit la forme levure ou mycélienne (Figure 3).
17 Traditionnellement, la forme mycélienne est considérée comme pathogène, celle-ci étant observée dans les tissus infectés. De plus, il a été démontré que de nombreux mutants incapables de croître sous forme mycélienne sont non virulents lorsqu’ils sont testés sur des modèles animaux [93].
Le dimorphisme faciliterait la pénétration en profondeur de C. albicans dans les tissus [67]. Cette association entre la virulence et le dimorphisme est d’ailleurs retrouvée chez plusieurs champignons pathogènes (100). Toutefois, le lien liant la morphogenèse à la virulence demeure quelque peu controversé, une baisse de virulence étant parfois notée sans changement remarqué dans la capacité au dimorphisme [105].
Une nouvelle voie de recherche s’ouvre d’ailleurs pour évaluer le rôle de l’hôte dans le dimorphisme. Par exemple, la phagocytose du C. albicans par une cellule de l’immunité pourrait provoquer sa morphogenèse en hyphe [66]. Les mécanismes qui permettraient aux hyphes de devenir pathogènes sont multiples. Par exemple, les hyphes interfèreraient avec la différenciation des monocytes en les empêchant de devenir des cellules dendritiques, ce qui serait un mécanisme pour déjouer les défenses de l’hôte [54].
Plusieurs conditions peuvent induire le changement de forme de C.albicans, comme, par exemple, la présence de sérum, d’AMPc, de N-acétyl glucosamine ou de proline dans le milieu. Une augmentation du pH du milieu (de pH4.5 à pH7.0) peut aussi amener une transition de la forme levure vers la forme mycélienne [66]. Les réactions au pH de C. albicans seraient importantes dans sa virulence, cet organisme étant capable de proliférer et de causer des pathologies dans des milieux de pH différents, comme le vagin et le tractus digestif.
18 La voie métabolique RIM101/pacC régulerait les réactions au pH, le dimorphisme et la virulence de C. albicans [54]. La régulation du dimorphisme se ferait aussi par des voies métaboliques communes au croisement et au changement phénotypique. Trois de ces voies métaboliques connues pour réguler le dimorphisme seraient une protéine kinase activée par la mitose (MAP) par le biais de la protéine Cph1, la voie dépendante de l’AMP cyclique par la protéine Rfg1 et une répression médiée par Tup1 par les protéines Rfg1 et Nrg1. La régulation du dimorphisme est très complexe et l’ensemble des gènes régulant cette fonction métabolique n’est pas connu. Cependant, certains gènes ont pu être identifiés, comme par exemple Sap1, Sap3 et Sap4 (présentées à la section précédente) qui, lorsque leur transcription est bloquée, une diminution de la capacité de C. albicans à former des hyphes est notée. Cela entraîne une diminution de la virulence [51].
19
Figure 3 : Les morphologies impliquées dans le dimorphisme cellulaire de C. albicans.
(A) la forme levure et (B) la forme mycélienne [54]. A :
B :
20
II-3. Facteurs de risque
Les facteurs de risque généraux qui prédisposent au développement d’une infection nosocomiale le sont également pour l’acquisition d’une candidose sévère (facteurs mineurs), mais certains d’entre eux apparaissent plus spécifiques (facteurs majeurs) [25,107] (tableau II).
II-3-1. Conditions sous-jacentes
De nombreux facteurs ont été associés à une augmentation du risque d’infection nosocomiale en général, ainsi que du risque infectieux à Candida plus particulièrement [36, 76,106]. L’incidence d’infections à levures du genre Candida étant élevée en réanimation, on comprend que les facteurs généraux tels que les âges extrêmes (vieillard, prématuré), une maladie sous-jacente débilitante, la présence de comorbidités nombreuses, la convalescence d’une opération chirurgicale majeure, la présence de dysfonction(s) organique(s) ou d’un score de sévérité de la maladie témoignant de perturbations physiologiques importantes, soient considérés et déterminés dans la plupart des études comme des facteurs de risque de l’infection à levure du genre Candida.
Un séjour prolongé en réanimation a été associé de manière spécifique à un risque augmenté d’infection à levures du genre Candida dans plusieurs séries
[74, 75,114]. Les facteurs de risque plus spécifiquement associés aux infections
à Candida ont été identifiés chez des patients ayant acquis des candidémies nosocomiales [29,77].
21
Fact
eurs
mineurs
 g e (n o u v eau -n és e t vi ei ll ard s) Co -m o rb id it é ( d iab èt e ; i n su ff is an ce ré n al e) In terv en ti o n ch ir u rg ic al e p réa la b le So n d e u ri n ai re A ccè s i n tra v as cu la ir es m u lt ip les Séj o u r p ro lo n g é en ré an ima ti o n ( > 7 j o u rs ) Can d id u ri e > 1 0 5 u fc ·mL –1 e n p ré sen ce d e son d e u ri n ai reFact
eurs
ma
jeurs
A n ti b io th éra p ie pr éal ab le o u c o n co m it an te Immu n o su p p res si o n humor al e o u cel lu la ir e N eu tr o p én ie Brû lu res é te n d u es (> 5 0 % ) Perfo rat io n d ig es ti v e Ch iru rg ie a b d o m in al e maje u re T rau ma ti sme maj eu r (ISS > 2 0 ) A lt éra ti o n s d u tra n si t (d iarr h ée o u i lé u s) N u tr it io n p are n téra le H ém o d ia ly se Ta bl ea u II : Fac te u rs d e r is q u e p réd is p o san t a u d év el op peme nt d ’i nf ect io ns fo ng iq ues s év ère s. [2 6 ].22 En particulier, l’exposition de patients de réanimation à l’administration d’une nutrition parentérale semble être associée à une augmentation du risque infectieux par Candida ; cependant, celui-ci n’a jamais été démontré comme indépendant dans le contexte d’analyses multivariées comparant les facteurs de risque. En revanche, l’hémodialyse ou l’ultrafiltration rénale à des fins de support de fonction, les brûlures étendues ou l’exposition à de multiples antibiotiques, en particulier à large spectre, ainsi qu’à des manœuvres invasives et des accès vasculaires multiples, l’ont été [77].
II-3-2. Antibiothérapie à large spectre
Une exposition préalable ou concomitante à une antibiothérapie à large spectre constitue un facteur de risque indéniable d’infection à Candida, et en particulier de candidémie. Plus le spectre est élargi et la durée d’antibiothérapie est prolongée, plus le risque d’infection fongique est important (33,74). Le nombre d’antibiotiques différents utilisés était le facteur de risque prédictif le plus important pour le développement d’une candidémie dans l’étude de Wey et al [77].
Dans l’étude de Fraser et al [33], 94% des patients développant une candidémie avaient été exposés au préalable à des antibiotiques et 62 % avaient reçu plus de quatre agents différents avant de développer la candidémie. Tout antibiotique à large spectre, par son effet de destruction de la flore intestinale autorisant la croissance de levures du genre Candida, peut être associé à une augmentation du risque d’infection sévère secondaire. L’effet est d’autant plus important que des antibiotiques efficaces contre les germes anaérobies sont utilisés [68]. De même, l’impact de certaines céphalosporines est plus marquant que celui d’autres antibiotiques [94,95].
23
II-3-3. Réanimation
Les patients admis en réanimation sont à risque élevé d’infections à levures du genre Candida, compte tenu du fait qu’ils cumulent souvent plusieurs facteurs de risque. Les anomalies de la fonction immunitaire compliquant les perturbations physiologiques contribuent à accroître le risque infectieux. La transplantation d’organe associant l’intervention chirurgicale majeure et des traitements immunosuppresseurs évitant le rejet, placent le patient à un niveau de risque infectieux élevé, en particulier en cas d’exposition prolongée à des antibiotiques à large spectre, d’accès intravasculaires et de drainages multiples, de fuites des anastomoses digestives, biliaires ou pancréatiques et de colonisation précoce par Candida [36,106].
Le recours à de multiples accès vasculaires, souvent nécessaire au support des fonctions vitales, constitue un facteur de risque prédominant chez le patient colonisé par des levures du genre Candida ; entre 60 et 80 % des épisodes de candidémie sont secondaires à des infections d’accès vasculaires [36,75].
II-3-4. Colonisation fongique
La colonisation par des levures du genre Candida, est un facteur de risque majeur, aussi bien chez les patients ayant subi une intervention chirurgicale abdominale qu’au cours d’un épisode de neutropénie [10, 91,114].
La colonisation secondaire d’autres sites à partir de la cavité abdominale précède souvent le développement d’une candidémie [83,102].
24 Calandra et collaborateurs ont montré que la colonisation du péritoine par une quantité croissante de levures du genre Candida après chirurgie avec ouverture du tractus digestif ou en présence d’une pancréatite était fréquemment associée à la survenue d’une candidose sévère [11].
Chez des patients admis en réanimation chirurgicale, il a été montré que le degré de colonisation et un score APACHE II supérieur à 20, étaient des facteurs indépendamment prédictifs du développement d’une infection sévère [74].
Dans la même étude, l’index de colonisation (défini comme le rapport du nombre de sites colonisés par Candida divisé par le nombre total de sites testés) était significativement plus élevé chez les patients qui allaient développer une candidose hématogène (en moyenne 0,70), comparé aux patients qui demeuraient colonisés sans développer d’infection (en moyenne 0,47).
La sensibilité de cet index, qui est utilisé par de nombreux réanimateurs, était de 100% et sa valeur positive prédictive de 66%. Le concept d’une colonisation préalable nécessaire au développement ultérieur d’une infection invasive repose sur ces éléments (figure 4) [24,99].
Les accès intravasculaires, souvent indispensables à la surveillance hémodynamique et au maintien des fonctions vitales en réanimation, représentent un facteur de risque majeur; entre 60 et 80% des épisodes de candidémie sont secondaires à la colonisation de l’un d’entre eux [1, 113,114].
25
Figure 4 : Index de colonisation par des levures du genre Candida.
D’après Pitet [25].
Comparaison des index de colonisation par levures du genre Candida chez deux groupes de patients séjournant en réanimation chirurgicale et ayant (cercles pleins), ou non (cercles vides), développés une infection sévère à Candida (Pittet et collaborateur).
26
CHAPITRE III : Stratégie diagnostique des candidoses
systémiques
III-1. Définition et classification des infections à Candida
Les auteurs utilisent fréquemment et de manière indifférente les termes de candidose systémique, profonde, viscérale, invasive, ou disséminée [37].
De ce fait il serait opportun d’utiliser une terminologie précise est standardisée :
Candidose systémique : candidose qui atteint au moins un parenchyme profond. Le plus souvent, elle est accompagnée d'au moins un épisode de fongémie au cours de son évolution, ce qui a pour corollaire la tendance à la dissémination hématogène (cette expression ne doit pas être utilisée pour désigner une infection muqueuse même profonde et invasive) [25,77].
Nous pouvons cependant distinguer :
Candidémie : définit une condition au cours de laquelle une levure du genre Candida a été identifiée par une hémoculture au moins [77].
Candidose profonde : atteinte d’un seul organe profond (par exemple une infection urinaire haute ou péritonite) [37].
Candidose disséminée : se réfère à une condition dans laquelle une levure du genre Candida a été identifiée par des moyens directs (cultures) ou indirects dans plusieurs tissus non contigus et impliquant une dissémination hématogène
27 Candidose chronique disséminée : « candidose hépatosplénique », est décrite chez des patients victimes d’une neutropénie sévère et prolongée, révélée le plus souvent au sortir d’un épisode de neutropénie, mais n’a jamais été décrite chez des patients en l’absence de neutropénie [77].
L’association des Professeurs de Pathologies Infectieuses et tropicales (APPIT ; 2000) classe les candidoses systémiques en quatre groupes [62] :
Les candidémie : ≥ à une hémoculture positive pour Candida.
Les formes monoviscérales : un seul site positif (candidose osseuse, méningites, péritonites).
Les candidoses disséminées aigues : infection prouvée par biopsie de deux organes non contigus ou atteinte oculaire + un organe biopsié ou formes métastatiques cutanées diffuses chez un malade leucémique granulopénique.
Les candidoses disséminées chroniques : candidose hépatospléniques.
Avant d’établir une démarche diagnostique des candidoses systémiques, nous allons définir les moyens de leur diagnostic et de leur suivi.
28
III-2. Moyens de diagnostic et de suivi des candidoses
Systémiques
Il y a une multitude d’examens et de kits commercialisés pour l’identification de ces levures, cependant, nous nous limiterons dans notre travail à la démarche diagnostique adoptée au laboratoire de Parasitologie Mycologie de l’hôpital Militaire d’Instruction Mohammed V de Rabat, démarche qui suit par ailleurs les recommandations des différentes conférences de consensus dans le diagnostic et la prise en charge des infections fongiques invasives.
III-2-1. Diagnostic mycologique
III-2-1-1. Prélèvement
Le prélèvement est une étape cruciale dans le diagnostic des candidoses systémiques, car de sa qualité dépend la fiabilité des résultats. Il doit être réalisé avant tout traitement antifongique et en quantité suffisante.
III-2-1-2. Examen direct
Il se fait directement entre lame et lamelle et observé au microscope optique.
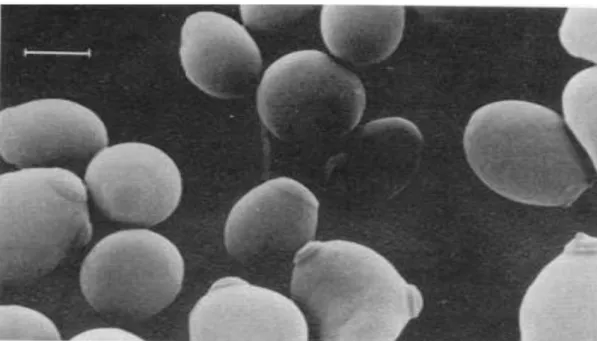
L’espèce Candida apparaît sous forme de petites levures à paroi mince, arrondies ou ovales, bourgeonnantes, de 1 à 10 µm, non capsulées (différence avec le Cryptocoque), accompagnées ou non de pseudofilaments ou filaments mycéliens. La détection de pseudofilaments à l’examen direct est un signe de pathogénicité (figures 5 et 6).
29
Figure 5 . Examen direct : aspect de blastospores, grossissement x 40
[Photo du service de Parasitologie Mycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]
Figure 6. Examen direct : aspect de blastospores et filaments mycéliens, grossissement x 40
30 III-2-1-3. Culture
Elle est indispensable puisqu’elle permet :
● l’augmentation de la sensibilité de l’examen direct ; ● l’identification de la levure en cause ;
● la numération des levures nécessaire à l’interprétation des résultats ; ● la réalisation de l’antifongigramme.
L’ensemencement se fait habituellement sur milieu Sabouraud chloramphénicol–actidione, en plus du milieu Sabouraud– chloramphénicol.
L’incubation se fait à 37 °C. La lecture se fait au bout de 24 à 48 heures
[15,79]. L’examen macroscopique des cultures montrera des colonies blanches
et humides (figure 7). Leur examen microscopique mettra en évidence des levures bourgeonnantes.
Figure 7. Aspect des colonies de C. albicans sur milieu Sabouraud [Photo du service de Parasitologie Mycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]
31 L’hémoculture qui est un examen clé dans le diagnostic des candidoses systémiques reste de sensibilité faible (40 à 60 %) malgré le développement des systèmes récents pour améliorer la sensibilité des hémocultures (système Isolator [lyse–centrifugation], automates). Ceci implique qu’une hémoculture négative n’élimine pas le diagnostic d’une candidose systémique. Cependant, une seule hémoculture positive confirme le diagnostic [57, 60,119].
Par ailleurs, la supériorité des automates d’hémoculture sur les systèmes manuels n’est plus à démontrer. On distingue les automates Bactec system (Becton-Dickinson) et BacT/Alert system (BioMérieux).
De nombreuses études ont évalué ces automates en utilisant différents milieux : BacT/Alert FanAerobic, Plus Aerobic/F, Mycosis IC/F [53,58].
Les résultats montrent une supériorité des milieux BacT/Alert sur les milieux Plus Aerobic/F.
Mycosis IC/F qui est un milieu spécifique pour les champignons est plus efficace que les deux milieux précédents. En effet, Il est plus sensible et plus précoce pour le diagnostic des candidoses systémiques, particulièrement quand il s’agit des espèces C. albicans et C. glabrata qui représentent 70 % des espèces incriminées et quand il y a présence concomitante des levures et des bactéries. Cette association est commune représentant 18 à 21 % des fongémies
32 III-2-1-4. Culture sur milieu sélectif
Les milieux chromogéniques fournissent des résultats plus précis et plus rapides. Ils permettent le diagnostic sélectif des colonies de Candida albicans, Candida tropicalis, Candida krusei et Candida glabrata directement sans avoir recours à des galeries d’identification, ces espèces étant les plus incriminées dans les candidoses systémiques. Ils permettent également la mise en évidence des associations d’espèces ce qui est impossible avec le milieu de Sabouraud.
Ces milieux chromogéniques contiennent des nutriments permettant la croissance des levures, des antibiotiques afin d’inhiber la pousse des bactéries et des substrats chromogéniques permettant la mise en évidence d’enzymes spécifiques à certaines levures. La différenciation est basée sur l’apparition de coloration spécifique de chaque espèce après hydrolyse de l’enzyme correspondante. Ces milieux permettent ainsi l’identification présomptive de C.albicans, C.tropicalis, C.glabrata et C.krusei.
Différents kits sont commercialisés notamment le Candi Select4®, le Chromagar Candida® et l’Albicans ID®. Le kit utilisé au laboratoire de Parasitologie de l’Hôpital Militaire Mohammed V est le Candi Select4®.
Après ensemencement des milieux de cultures, les boites de pétri sont incubées à 35°C pendant 48 heures [15, 79].
33 III-2-1-5. Identification
L’identification sur le milieu Candi Select4® est aisée, c’est un test qui permet de faire le diagnostic de C.albicans dont les colonies apparaissent roses à violettes. Pour les autres espèces, l’identification est présomptive. Le C.tropicalis apparaît sous forme de colonies de couleur turquoise très intense, à contours réguliers et à morphologie lisse. Les colonies de C.glabrata sont turquoises brillantes, plates, à contours réguliers et à morphologie lisse. Les colonies de C.krusei sont turquoises, d’aspect sec, à contour réguliers et à morphologie rugueuse. Les autres espèces de Candida sont de couleurs blanchâtres et à morphologie lisse, elles nécessitent une identification par galeries biochimiques.
L’identification dans certains cas repose également sur les caractères physiologiques et immunologiques.
34
Figure 8. Milieu Candi Select4® : [Photo du service de Parasitologie Mycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]
- Colonies violettes : C.albicans, ne pas faire de galerie d’identification.
- Colonies turquoises intenses, bombées, contour régulier : C.tropicalis, ne pas faire de galerie d’identification.
- Colonies turquoises, plates, contour régulier : C.glabrata, ne pas faire de galerie d’identification, confirmer par le RTT Glabrata. (figure 9)
- Colonies turquoises, aspect sec, contour irrégulier : C.krusei, ne pas faire de galerie d’identification, confirmer par le krusei-color (figure 10)
35
RTT glabrata® [5]
L’hydrolyse du tréhalose en glucose par C.glabrata est un caractère biochimique qui est exploité dans ce test. La révélation de cette production de glucose permet alors l’identification de la levure. Un test positif est caractérisé par une coloration marron orange, un test négatif est caractérisé par l’absence de coloration. Seul C.glabrata donne un résultat tréhalase positif et maltase négatif.
Figure 9 : RTT Glabrata® ; principe du test: [Photo du service de ParasitologieMycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]
+ -
Ininterprétable Non C.glabrata
36
Krusei color Fumouze® [38,97].
Ce test repose sur l’agglutination de particules de latex rouge, sensibilisées par un anticorps monoclonal permettant de détecter spécifiquement un antigène de surface de Candida krusei. Les agglutinats sont rouges.
Une réaction positive est visible à l’œil nu sous forme d’agglutinats rouges. Une réaction négative est reconnue par une absence d’agglutination, la suspension reste homogène.
Figure 10. Kit Krusei-Color® : [Photo du service de Parasitologie Mycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]
37
Galerie API 20C AUX® [13,116].
Cette galerie permet d’identifier les levures couramment rencontrées grâce à des tests d’assimilation standardisés et miniaturisés. Cette galerie offre la possibilité d’effectuer 19 tests d’assimilation. Les levures à identifier sont mises dans un milieu synthétique semi-solide à incuber pendant 24à 48h. La croissance se traduit par un trouble. L’identification se fait grâce à des tables analytiques selon le profil numérique de chaque levure.
Figure 11. API 20C AUX® : [Photo du service de Parasitologie Mycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]
38 III-2-1-6. Interprétation
Seuls les prélèvements tissulaires ou de sites normalement stériles permettent d’affirmer l’infection fongique et son caractère invasif (hémocultures, liquide céphalorachidien, liquide pleural, etc.…)
Pour les autres sites, l’interprétation est plus complexe, notamment pour les voies aériennes :
Pas de valeur diagnostique de l’isolement et la numération de Candida sp. sur tous les types de prélèvements respiratoires, protégés ou non, dirigés ou non.
Seul l’examen histologique permet le diagnostic.
L’isolement de Candida sp à partir d’un prélèvement respiratoire peut être le témoin :
D’une vraie pneumonie au cours d’une candidémie.
D’une simple colonisation trachéo-bronchique.
La figure 12 nous présente l’arbre décisionnel d’une candidose à partir de prélèvements pulmonaires positifs à candida sp [30,88].
39
Figure 12 : Arbre décisionnel d’une candidose à partir de prélèvements
40
III-2-2. Diagnostic immunologique
Durant les dix dernières années de nombreuses techniques de diagnostic immunologique ont été développées. Celles-ci consistent à mettre en évidence la présence soit des anticorps anti Candida ou des antigènes mannanes circulants. La détection par ELISA du mannane est le test le plus utilisé dans cette catégorie. Sa combinaison à la recherche d'anticorps anti-mannane rend sa sensibilité meilleure et augmente son intérêt dans la prise en charge précoce de candidoses invasives [5, 50, 90].
III-2-2-1. Détection d’anticorps
La recherche d’anticorps spécifiques se heurte à une difficulté d’interprétation. En effet, la distinction entre colonisation et invasion est difficile vu la fréquence d’une sérologie positive chez des porteurs asymptomatiques même à des taux élevés.
Par ailleurs, la sérologie est souvent faiblement négative chez les patients neutropéniques. Cela donne toute la valeur à l’étude de la cinétique des anticorps. En effet, une séroconversion ou une ascension significative, entre deux ou plusieurs prélèvements du taux d’anticorps quelque soit la méthode utilisée, ont une valeur diagnostique beaucoup plus importante qu’un titre isolé
[5].
Plusieurs méthodes sérologiques ont été décrites pour le diagnostic des candidoses systémiques. Chacune d’entre elles réalise un compromis plus ou moins réussi entre sensibilité, spécificité, rapidité et coût.
41 III-2-2-2. Détection d’antigènes circulants
III-2-2-2-1. La recherche des mannanes
Les tests permettant de détecter l’antigène mannane pariétal qui est un composant majeur de la paroi cellulaire sont :
● Pastorex Candida : Il est fondé sur le principe d’agglutination des particules de latex sensibilisées par un anticorps monoclonal antimannane pariétal de C. albicans. Il nécessite un traitement préalable du sérum à 100 °C pour dissocier les immuns complexes évitant ainsi les faux négatifs. Il est d’excellente spécificité variant de 95 à 100 %. Cependant, sa sensibilité est faible (20 %). Cela est dû au caractère transitoire de l’antigènemie [61,116] ;
● Platelia Candida : C’est un test Elisa qui utilise un anticorps monoclonal EB-CA1 qui reconnaît le mannane. Son seuil de détection est de 0,25 ng/ml. Sa sensibilité est de 40 % et sa spécificité est de 98 % [92,98].
III-2-2-2-2. La recherche d’énolase
L’énolase est un antigène cytoplasmique de Candida sp de 48 kDa. Il est détecté par la méthode western blot qui met en évidence la bande 48 kDa. Sa sensibilité varie de 71,8 à 75 % et sa spécificité est comprise entre 96 et 100 %. Cependant, son coût est très élevé [20,90].
42
III-3. Démarche diagnostique d’une levure du genre Candida
au laboratoire de Parasitologie Mycologie de l’Hôpital
Militaire Mohammed V
j0 : Prélèvement (buccal, urine, rectal, auriculaire, nasal, PDP, …)
1. Examen direct : si examen direct (ED) positif → résultat au clinicien. 2. Mise en culture sur milieu sélectif: Candi Select4®.
3. Numération sur cellule de Malassez si ED positif pour les urines.
J1 : Lecture rapide des milieux sélectifs
J2 : Lecture des milieux sélectifs
1. Si C.albicans → résultat.
2. Si C.glabrata, confirmer par le RTT Glabrata® → résultat. 3. Si C.krusei, confirmer par krusei-color® → résultat.
4. Si C.tropicalis → résultat
5. Si présence d'autres levures (colonies blanches), faire galerie API 20 C AUX® → résultat.
6. Si absence de levures → résultat.
7. Réalisation d’un antifongigramme E-test® sur les souches isolées.
J4 à J6 : Lecture des galeries d'identification et des antifongigrammes →
43
I. INTRODUCTION
Les candidoses systémiques sont des affections provoquées par des levures appartenant au genre Candida. La colonisation à Candida est fréquente en réanimation mais les infections sont rares. L’origine est endogène à partir du tube digestif, la transmission croisée étant exceptionnelle. De nombreux éléments liés à l’hôte et au Candida lui-même influencent la colonisation.
Un certain nombre de facteurs de risque de colonisation et d’infection en réanimation ont été décrits, mais aucun d’entre eux n’est suffisamment puissant pris isolément pour prédire la survenue d’une infection.
Tout patient de réanimation ayant un séjour prolongé a au moins un facteur de risque de candidose systémique.
II. Objectifs, type et lieu de l’étude
Il s’agit des résultats d’une étude prospective, descriptive et analytique, étalée sur 24 mois, menée au service de Parasitologie Mycologie et aux services de Réanimation (Chirurgicale, et Médicale) de l’Hôpital Militaire d’Instruction Mohamed V
Les objectifs sont :
Evaluer la fréquence des candidoses systémiques en Réanimation. Evaluer la répartition des espèces de levure rencontrées.
Analyser les facteurs de risque de survenue des candidoses systémiques.
Evaluer l’intérêt de l’index de colonisation dans la survenue d’une candidose disséminée.
44
III. PATIENT ET METHODES
III-1. Population étudiée
Etude prospective incluant tous les patients hospitalisés en réanimation (médicale et chirurgicale) avec au moins un facteur de risque de colonisation fongique.
Dans le but d’avoir tous les renseignements nécessaires pour notre étude et pour chaque patient, nous avons préparé un questionnaire qui est rempli au cours de l’hospitalisation (fiche de renseignements)
III-2. Etude mycologique
III-2-1. Prélèvement mycologique
Les prélèvents sont réalisés 2 fois par semaine (le premier étant réalisé à l’admission). Il s’agit de prélèvement buccal, rectal ou selle, d’urines, nasal et auriculaire mais également d’autres sites en fonction de l’état clinique du patient (sonde gastrique, PDP, vaginal…..). Les hémocultures sont envoyées en Bactériologie et en cas de pousse, les souches sont envoyées en mycologie pour identification.
Chaque prélèvement a fait l’objet d’un examen direct et une mise en culture
45
III-2-2. Examen direct
Pour les écouvillons, un examen au microscope a été effectué pour chaque prélèvement en présence d’une goutte du sérum physiologique.
Cet examen a permis de mettre en évidence la présence ou l’absence de levures bourgeonnantes, accompagnées ou non de filaments mycéliens. Des colorations au Giemsa sont également réalisées
III-2-3. Culture et identification
Chaque échantillon a été ensemencé sur milieu chromogène Candiselect 4® et incubé à 37°C pendant 48 heures. Il a permis :
La détection spécifique de 4 espèces de Candida (C .tropicalis, C.albicans, C. krusei, C. glabrata) en donnant des
colonies de couleurs différentes.
La mise en évidence des autres levures : colonies blanches dont l’identification a été réalisée avec les galeries Api 20c Aux®, la lecture a été faite au bout de 48 heurs d’incubation à 29°c.
En ce qui concerne les hémocultures, elles sont incubées dans des automates type Bactec 9240
III-2-4. Calcul de l’index de colonisation
L’index de colonisation est calculé comme présenté par Pittet : rapport entre le nombre de sites positifs et le nombre total de sites prélevés [41,74].
46
III-3. Analyse statistique
L’analyse statistique des résultats a utilisé le logiciel SPSS 10, nous avons utilisé le test de Student pour les variables quantitatives et le test lu Khi 2 pour les variables qualitatives, le risque d’erreur α est fixé à 5%.
IV. RESULTATS
Durant la période d’études, 84 patient sont inclus, 142 séries de prélèvement réalisées (urine, rectal, buccal, nasal, auriculaire), soit 685 prélèvements et 84 hémocultures.
Sexe : Notre population d’étude (84 patients) est constituée de65 hommes (77,4%) et 19 femmes (22,6%) soit un sexe ratio H/F = 3,4
Tableau III : Répartition de la population d’étude selon le sexe
Nombre
Pourcentage
HOMMES
FEMMES
65
19
77,4%
22,6%
47
Age : l’âge moyen des patients est de 53,9 ans, la médiane est de 56 ans. L’âge minimum : 14 ans
L’âge maximum : 85 ans
Figure 13 : Répartition des patients par tranche d’âge.
0% 5% 10% 15% 20% 25% 30%
48
Facteurs de risque : Sur les 84 patients : - 78 ont une sonde urinaire (92,9%)
- 72 sont sous antibiothérapie à large spectre (85,7%) - 54 ont un cathéter veineux central (64,3%).
- 40 ont un cathéter artériel (47,6%). - 37 ont un drains (44%).
- 30 ont une sonde d’intubation (35,7%). - 28 ont subis une chirurgie récente (33,3%). - 28 sont diabétiques (33,3%).
- 18 sont sous corticothérapie (21,4%). - 9 ont une trachéotomie (10,7%). - 7 sont dialysés (8,3%).
- 5 ont un cancer ou une hémopathie (6%). - 3 sont sous immunosuppresseurs (3,6%).
49 Figure 14 : fréquence des facteurs de risque en réanimation durant la période
d’étude . 92,9% 85,7% 64,3% 47,6% 44,0% 35,7% 33,3% 33,3% 21,4% 10,7% 8,3% 6,0% 3,6%
50 Pour la corrélation entre les facteurs de risque est les candidoses systémiques prouvées, nous avons utilisé le TEST du Khi-2, les facteurs avec une signification exacte (soit p < 0,05) sont :
L’antibiothérapie à large spectre. La trachéotomie.
Les immunosuppresseurs. La corticothérapie à long cours. Cancers ou hémopathies.
51
Fréquence des différentes espèces Candida dans les cultures
positives.
Dans un total de 685 prélèvements réalisés, 199 cultures positives sont retrouvées :
- Les cultures sont monomorphes (isolement d’une seule espèce au sein d’une culture) dans 72,3% des cas (144/199).
- Elles sont polymorphes (isolement de plusieurs espèces au sein d’une même culture) dans 27,6% des cas (55/199).
Figure 15 : Fréquences des cultures polymorphes dans l'ensemble des cultures positives cultures monomorphes 72,4% cultures polymorphes 27,6%
Fréquences des cultures polymorphes dans
l'ensemble des cultures positives
52 Les cultures monomorphes :
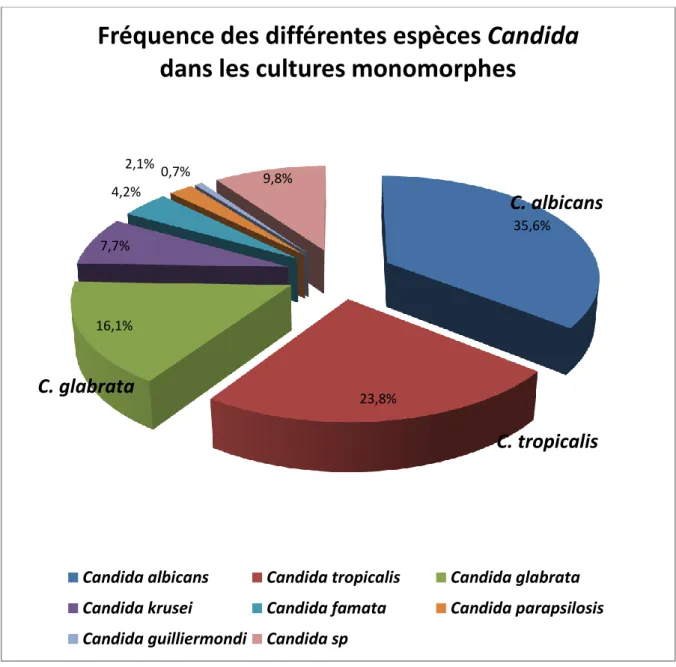
Candida albicans est l’espèce prédominante puisqu’isolée avec une fréquence de 35,4% (51/144). Les autres espèces sont retrouvées dans l’ordre suivant : - Candida tropicalis : 23,6% (34/144) - Candida glabrata : 16% (23/144) - Candida krusei : 7,6% (11/144) - Candida famata : 4,2% (6/144) - Candida parapsilosis : 2,1% (3/144) - Candida guilliermondi : 0,7% (2/144) - Candida sp : 9,7% (14/144)
53
Figure 16 : Fréquence des différentes espèces Candida dans les cultures
monomorphes 35,6% 23,8% 16,1% 7,7% 4,2% 2,1% 0,7% 9,8%
Fréquence des différentes espèces Candida
dans les cultures monomorphes
Candida albicans Candida tropicalis Candida glabrata
Candida krusei Candida famata Candida parapsilosis
Candida guilliermondi Candida sp
C. albicans
C. tropicalis
54 Les cultures polymorphes :
Si l’on considère les cultures polymorphes :
- 91% des cas : association de deux espèces (50/55). - 9% des cas : association de trois espèces (5/55).
Candida albicans est représenté avec une fréquence de 80% sur les cultures polymorphes.
Les associations les plus fréquentes dans les cultures polymorphes sont : - C. albicans + C. tropicalis : 38,2% (21/55)
- C. albicans + C. glabrata : 21,8% (12/55) - C. glabrata + C. tropicalis : 11% (6/55)
Les autres associations sont données dans le tableau IV
Tableau IV : fréquence et pourcentage des associations de Candida
Association
Fréquence
Pourcentage
C. albicans + C. tropicalis 21/55 38,2% C. albicans + C. glabrata 12/55 21,8% C. glabrata + C. tropicalis 6/55 11% C. albicans + C. krusei 5/55 9% C. glabrata + C. krusei 3/55 5,5% C. albicans + Candida sp 1/55 1,8% C. tropicalis + C. parapsilosis 1/55 1,8% C. tropicalis + Candida sp 1/55 1,8%
55
Figure 17 : Fréquence des différentes associations de Candida dans les
cultures polymorphes. 21,8% 38,2% 9,0% 1,8% 11,0% 5,5% 1,8% 1,8% 9,0%
Fréquence des différentes associations de
Candida dans les cultures polymorphes
C.albicans,C. glabrata C.albicans,C. tropicalis
C.albicans,C. krusei C.albicans,Candida sp
C. glabrata,C. tropicalis C. glabrata,C. krusei
C. tropicalis,C. parapsilosis C. tropicalis,Candida sp
C.albicans,C. glabrata,C. tropicalis
C. albicans + C. glabrata
56 Dans l’ensemble des cultures positives (monomorphes et polymorphes) C. albicans est l‘espèce la plus fréquente 25,6% (51/199), avec l’émergence de C. tropicalis 17% (34/199) et C. glabrata 11,5% (23/199).
Le tableau X et la figure X indiquent pour chaque espèce de Candida, le nombre de cas et la fréquence dans l’ensemble des cultures positives :
Tableau V : Fréquence des différentes espèces de Candida
Espèce Nombre de cas Pourcentage
Candida albicans 51 25,6% Candida tropicalis 34 17% Candida glabrata 23 11,5% Candida krusei 11 5,5% Candida famata 6 3% Candida parapsilosis 3 1,5% Candida guilliermondi 2 1% Candida sp 14 7% Association C. albicans + C. tropicalis C. albicans + C. glabrata C. albicans + C. krusei C. albicans + Candida sp C. glabrata + C. tropicalis C. glabrata + C. krusei C. tropicalis + C. parapsilosis C. tropicalis + Candida sp
C. albicans + C. glabrata + C. tropicalis
55 21 12 5 1 6 3 1 1 5 27,6% Total 199 100%
57
Figure 18 : Fréquence des différentes espèces Candida dans l'ensemble
des sites prélevés.
25,7% 11,5% 17,1% 5,5% 3,0% 1,5% 1,0% 7,0% 27,7%
Fréquence des différentes espèces Candida
dans l'ensemble des sites prélevés
C. albicans C. glabrata C. tropicalis
C. krusei C. famata C. parapsilosis
58
Sites corporels prélevés :
Les sites corporels prélevés sont : la bouche, le nez, l’anus, les urines, et l’oreille.
Le tableau et la figure indiquent pour chaque site, le nombre de prélèvements positifs.
Tableau VI : Nombre et pourcentage de positifs selon le site prélevé
Prélèvements positifs Pourcentage d’échantillons positifs
Urines 61 46%
Bouche 58 42%
Nez 43 31%
Anus 30 22%
Oreille 7 5%
Figure 19: Pourcentage d’échantillons positifs en fonction du site corporel
Urines Bouche Nez Anus Oreille
46%
42%
31%
22%
59
Fréquence des différentes espèces dans les différents sites Au niveau des urines
Tableau VII: fréquence des différentes espèces de Candida au niveau des
urines
Espèces
Nombre de cas Pourcentage
Candida albicans 9 14,7% Candida tropicalis 12 19,7% Candida glabrata 7 11,5% Candida krusei 5 8,2% Candida guilliermondi 1 1,6% Candida sp 7 11,5% Association C. albicans + C. tropicalis C. albicans + C. glabrata C. albicans + C. krusei C. albicans + Candida sp C. glabrata + C. tropicalis C. glabrata + C. krusei C. tropicalis + Candida sp
C. albicans + C. glabrata + C. tropicalis
20 7 3 1 1 2 1 1 4 32,8% Total 61 100%
60 Figure 20: fréquence des différentes espèces Candida au niveau des urines
14,7% 11,5% 19,7% 8,2% 1,6% 11,5% 32,8%
Fréquence des différentes espèces Candida au
niveau des urines
C. albicans C. glabrata C. tropicalis C. krusei
C. guilliermondi Candida sp Associations
C. albicans
C. tropicalis
61 Au niveau de la muqueuse buccale
Tableau VIII: Fréquence des différentes espèces Candida au niveau de
la muqueuse buccale
Espèces
Nombre de cas Pourcentage
Candida albicans 15 25,8% Candida glabrata 11 19% Candida tropicalis 7 12% Candida krusei 5 8,6% Candida famata 2 3,5% Candida sp 2 3,5% Associations C. albicans + C. tropicalis C. albicans + C. glabrata C. albicans + C. krusei C. glabrata + C. tropicalis C. glabrata + C. krusei C. tropicalis + C. parapsilosis 16 6 4 2 2 1 1 27,6%
Total
58
100%
62
Figure 21: fréquence des différentes espèces Candida au niveau de la muqueuse buccale 25,8% 19,0% 12,0% 8,6% 3,5% 3,5% 27,6%
Fréquence des différentes espèces Candida au
niveau de la muqueuse buccale
C. albicans C. glabrata C. tropicalis C. krusei
C. famata Candida sp Associations
C. glabrata C. albicans
63 Au niveau de la muqueuse nasale
Tableau IX: Fréquence des différentes espèces Candida au niveau de la
muqueuse nasale
Espèces
Nombre de cas
Pourcentage
C. albicans 15 34,8% C. glabrata 2 4,6% C. tropicalis 7 16,3% C. krusei 1 2,3% C. famata 2 4,6% Candida sp 3 7% Associations C. albicans + C. tropicalis C. albicans + C. glabrata C. albicans + C. krusei C. glabrata + C. tropicalis C. glabrata + C. krusei 13 4 4 2 2 1 30%
Total
43
100%
64
Figure 22 : fréquence des différentes espèces Candida au niveau de la
muqueuse nasale 34,9% 4,6% 16,4% 2,3% 4,6% 7,0% 30,1%
Fréquence des différentes espèces de Candida
au niveau de la muqueuse nasale
C. albicans C. glabrata C. tropicalis C. krusei
![Tableau I : Types d’infections à levures du genre Candida [25,77].](https://thumb-eu.123doks.com/thumbv2/123doknet/15052446.695606/6.892.102.785.183.940/tableau-types-infections-levures-genre-candida.webp)
![Figure 6 . Examen direct : aspect de blastospores et filaments mycéliens, grossissement x 40 [Photo du service de Parasitologie Mycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]](https://thumb-eu.123doks.com/thumbv2/123doknet/15052446.695606/29.892.234.678.570.909/blastospores-filaments-mycéliens-grossissement-parasitologie-mycologie-militaire-instruction.webp)
![Figure 7 . Aspect des colonies de C. albicans sur milieu Sabouraud [Photo du service de Parasitologie Mycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]](https://thumb-eu.123doks.com/thumbv2/123doknet/15052446.695606/30.892.335.640.585.951/colonies-sabouraud-parasitologie-mycologie-hôpital-militaire-instruction-mohammed.webp)
![Figure 8 . Milieu Candi Select4® : [Photo du service de Parasitologie Mycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]](https://thumb-eu.123doks.com/thumbv2/123doknet/15052446.695606/34.892.178.720.102.445/figure-milieu-parasitologie-mycologie-hôpital-militaire-instruction-mohammed.webp)
![Figure 9 : RTT Glabrata® ; principe du test: [Photo du service de ParasitologieMycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]](https://thumb-eu.123doks.com/thumbv2/123doknet/15052446.695606/35.892.108.785.338.976/figure-glabrata-principe-parasitologiemycologie-hôpital-militaire-instruction-mohammed.webp)
![Figure 10 . Kit Krusei-Color® : [Photo du service de Parasitologie Mycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]](https://thumb-eu.123doks.com/thumbv2/123doknet/15052446.695606/36.892.110.782.448.774/figure-krusei-parasitologie-mycologie-hôpital-militaire-instruction-mohammed.webp)
![Figure 11 . API 20C AUX® : [Photo du service de Parasitologie Mycologie, Hôpital Militaire d’Instruction Mohammed V, Rabat]](https://thumb-eu.123doks.com/thumbv2/123doknet/15052446.695606/37.892.121.772.441.648/figure-service-parasitologie-mycologie-hôpital-militaire-instruction-mohammed.webp)
![Figure 12 : Arbre décisionnel d’une candidose à partir de prélèvements pulmonaires positifs à candida sp [30,88]](https://thumb-eu.123doks.com/thumbv2/123doknet/15052446.695606/39.892.135.753.241.726/figure-arbre-décisionnel-candidose-prélèvements-pulmonaires-positifs-candida.webp)