BENJAMIN BRISSON-GAUTHIER
RELATION ENTRE L'EXPOSITION A
L'ACRYLAMIDE PAR L'ALIMENTATION, LES
MARQUEURS DE DOSE INTERNE ET LES
CASSURES À L'ADN LYMPHOCYTAIRE CHEZ DES
ADOLESCENTS MONTRÉALAIS
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de maîtrise en médecine expérimentale
pour l'obtention du grade de Maître es sciences (M.Sc.)
FACULTE DE MEDECINE UNIVERSITÉ LAVAL
QUÉBEC
Résumé
L'acrylamide (AA) est une substance cancérigène formée lors de la cuisson à haute température d'aliments à forte teneur en amidon comme les frites et croustilles. Les objectifs de cette étude étaient d'établir une relation entre l'apport alimentaire en AA et les biomarqueurs de dose interne, ainsi qu'entre ces derniers et les cassures à l'ADN lymphocytaire, un biomarqueur d'effet génotoxique précoce, chez des adolescents montréalais. Deux cent adolescents âgés de 10 à 17 ans habitant Montréal, au Canada, ont été recrutés. Leurs caractéristiques sociodémographiques et leurs habitudes de vie ont été documentées par questionnaire. Les concentrations d'AA et de ses metabolites ont été mesurées dans 195 échantillons d'urine (collectés sur une période de 12 h) à l'aide d'un chromatographe en phase liquide couplé à un spectromètre de masse en tandem (LC-MS/MS). Les niveaux d'adduits à l'hémoglobine ont aussi été mesurés par LC-MS/MS dans 165 échantillons sanguins. Les cassures à l'ADN lymphocytaire ont été mesurées par le test des comètes en conditions alcalines à partir de 130 échantillons. Les deux principaux metabolites urinaires étaient le N-acétyl-cystéine-S-propionamide (NACP) et le NACP-sulfoxyde (NACP-S), avec des concentrations moyennes respectives de 31,2 et 14,2 umol/mol de creatinine (moyennes géométriques). Les concentrations moyennes de AAVal (adduit de l'acrylamide avec la valine) et GAVal (adduit du glycidamide, un metabolite de l'AA, avec la valine) étaient respectivement de 45,4 et 45,6 pmol/ g de globine. Ces deux adduits ont été détectés dans tous les échantillons à des niveaux similaires à ceux mesurés chez des Américains du même groupe d'âge. Les analyses multivariées ont révélées que la somme des concentrations urinaires de NACP et NACP-S est associée avec l'apport alimentaire moyen de AA durant les deux jours précédent les prélèvements (p < 0,0001) tandis que la somme des niveaux d'adduits AAVal et GAVal est associée à l'apport alimentaire journalier moyen durant le mois précédent les prélèvements (p < 0,0001) ainsi qu'au tabagisme passif (p < 0,05). Les biomarqueurs d'exposition n'étaient pas corrélés aux cassures à l'ADN lymphocytaire. Les concentrations urinaires de NACP et de NACP-S reflètent l'exposition récente à l'acrylamide, alors que niveaux des adduits AAVal et GAVal reflètent une exposition à plus long terme. L'exposition à l'AA chez ce groupe d'adolescents ne semble pas suffisamment élevée pour induire des dommages à l'ADN lymphocytaire.
Abstract
Acrylamide (AA) is a probable carcinogen found in several foods, in particular starched-based goods processed at high temperatures (French fries, potato chips, etc.). Few studies have investigated the relation between dietary AA intake and biomarkers of exposure to this compound. We investigated the relation between dietary AA intake and levels of AA-derived urinary metabolites and hemoglobin adducts in teenagers from a large Canadian urban center. We also studied the relation between these biomarkers of exposure and DNA strand breaks in lymphocytes from the participants. Teenagers may represent a high-risk subgroup due to preference for AA-rich foods and greater food intake per kilogram of body weight. We recruited 200 teenagers aged 10-17 yrs living in Montreal (Canada) and documented their sociodemographic characteristics, lifestyle and dietary habits using self-administered questionnaires. AA and its metabolites were quantified in 195 12-h urine samples by liquid chromatography-tandem mass spectrometry (LC-MS/MS). Globin was isolated from 165 blood samples and analyzed by LC-MS/MS to quantify AA-derived hemoglobin adducts levels. DNA strand breaks in lymphocytes were analyzed using the alkaline comet assay in 130 samples. The most prevalent urinary metabolites were N-acetyl cysteine-S-propionamide (NACP) and NACP-sulfoxide (NACP-S), with respective geometric mean concentrations of 31.2 and 14.2 umol/mol creatinine. Hemoglobin adducts were detected in all participants; geometric mean concentrations of AAVal and GAVal [adducts of AA and its metabolite glycidamide (GA) with valine] were respectively 45.4 and 45.6 pmol/g globin. Hemoglobin adducts levels were similar to those of Americans in the same age group. In multivariate analyses, AA intake during the two days prior to urine collection was a significant predictor of NACP + NACP-S urinary concentration (p < 0.0001), whereas the mean AA intake during the month prior to blood collection (p < 0.0001) and passive smoke exposure (p < 0.05) were associated with hemoglobin adducts (AAVal + GAVal) levels. Biomarkers of exposure were not related to lymphocyte DNA strand breaks. Urinary AA metabolite concentrations are related to short term dietary AA intake, whereas the levels of AA-derived hemoglobin adducts reflect AA intake over a longer period of time. AA exposure in our study group is similar to that previously assessed in American adolescents. AA exposure may be too low to induce DNA strand breaks in lymphocytes.
Avant-Propos
Je tiens d'abord à remercier mon directeur de recherche, le Docteur Pierre Ayotte, pour m'avoir fait confiance et m'avoir si généreusement accepté dans son laboratoire. Je le remercie aussi pour la bourse qu'il m'a octroyée, pour le temps qu'il m'a accordé, pour les opportunités qu'il m'a apportées et pour avoir revu et corrigé ce mémoire. Merci également à Michèle Bouchard pour son soutien et pour avoir fourni réponses à mes nombreuses questions.
Je remercie aussi Christian Larochelle. Ton aide a été déterminante pour l'avancement de ce projet et tes conseils m'ont été très utiles. Ce fut un plaisir de travailler avec toi pendant ma maîtrise.
Je tiens aussi à remercier mes collègues du laboratoire des biomarqueurs. Merci Nathalie Ouellet pour m'avoir si bien accueilli au laboratoire, pour tes nombreux conseils et ton écoute. Merci Pierre-Yves Tremblay pour tes judicieux conseils et ta générosité. Merci aussi à Yannick Audet-Delage pour ton soutien et ton aide autant au laboratoire que pendant mes cours. Merci à Corinne Zinflou pour ta patience et ta générosité et pour m'avoir transmis tout ton savoir, ce qui m'a permis de bien démarrer mon projet de maîtrise.
Merci à Marilène Courteau pour avoir réalisé les analyses statistiques, pour ta patience, ton aide et tes nombreux conseils.
Merci aux chimistes du Centre de Toxicologie de l'INSPQ, Jean-François Bienvenu pour avoir mis au point la technique et superviser l'analyse des metabolites urinaires. Merci aussi aux technologistes de l'INSPQ pour leur travail.
Merci à l'équipe du laboratoire du Docteur Timothy Fennell pour avoir produit les analyses des adduits à l'hémoglobine.
Merci enfin à ma famille et mes amis pour leur soutien et leurs encouragements tout au long de mon cheminement. Mon expérience à l'INSPQ a été pour moi très enrichissante.
Le mémoire comprend un article scientifique, lequel est basé en partie sur le rapport soumis à Santé Canada dans le cadre du projet intitulé : «Importance de l'exposition à l'acrylamide par l'alimentation chez des adolescents montréalais». Les travaux que j'ai réalisés sur la mesure des cassures à l'ADN lymphocytaire sont présentés en annexe. Ce projet a nécessité la participation de plusieurs chercheurs œuvrant dans différents organismes : INSPQ, RTI, Santé Canada et Université de Montréal. Ma contribution à ce projet concerne principalement la mesure des cassures à l'ADN lymphocytaire, l'analyse des résultats ainsi que la rédaction de l'article découlant de l'étude.
Je dédicace ce mémoire à mes parents, Michel Brisson et France Gauthier
Table des matières
Résumé ii
Avant-Propos i w
Table des matières yiivi»
Liste des tableaux viiii*
Liste des figures ix*
Chapitre 1 : Introduction générale 1
1.1 Toxicologie alimentaire 1
1.2 L'acrylamide et ses metabolites
24-1.2.1 Généralités 2
1.2.2 Formation de l'acrylamide 2
1.2.3 Exposition chez l'humain 3
1.2.4 Les metabolites de l'acrylamide 6
1.3 Toxicocinétique 7
1.4 Toxicodynamie 9
1.4.1 Génotoxicité 9
1.4.2 Carcinogénicité 11
1.4.3 Autres effets toxiques 12
1.5 Biosurveillance de l'acrylamide 12
1.5.1 Généralités 12
1.5.2 Adduits à l'hémoglobine 13
1.5.3 Analyse des metabolites urinaires 14
1.5.4 Test des comètes 14
1.6 Contexte de la recherche et objectifs 15
1.6.1 Contexte de la recherche 15
1.6.2 Objectifs de recherche 17
Chapitre 2: Article 18
Chapitre 3 : Essai comète 47
3.1 Introduction 47
3.2 Matériel et méthodes 48
3.2.1 Isolation des lymphocytes 48
3.2.2 Test des comètes alcalin 494&
3.2.3 Test des comètes alcalin avec FPG 51
3.3 Résultats 51
Chapitre 4 : Discussion générale et conclusion 55
4.1 Discussion 55
4.2 Conclusion 58
Liste des tableaux
Chapitre 1Tableau 1 : Résumé des concentrations d'acrylamide dans différents aliments
Chapitre 2
Table 2: Characteristics of participants
Table 3: Daily acrylamide intake of participants based on the food diary and the food frequency questionnaire.
Table 4: AA-derived urinary metabolites, hemoglobin adducts and urinary cotinine levels in Canadian teenagers
Table 5: Correlations (Spearman's r) between daily acrylamide intake (ug/kg bw -day) and biomarkers of exposure in Canadians teenagers
Table 6: Multivariate analysis of associations between acrylamide intake (ug/kg bw/day) during the month prior to blood sampling and the sum of AAVal and GAVal globin adducts (log pmol/g globin) in Canadian teenagers, with passive smoking as a potential explanatory variable
Supplementary material, Table 7: Elements of performance for LC-MS/MS method for the analysis of acrylamide and its metabolites in urine
Chapitre 3
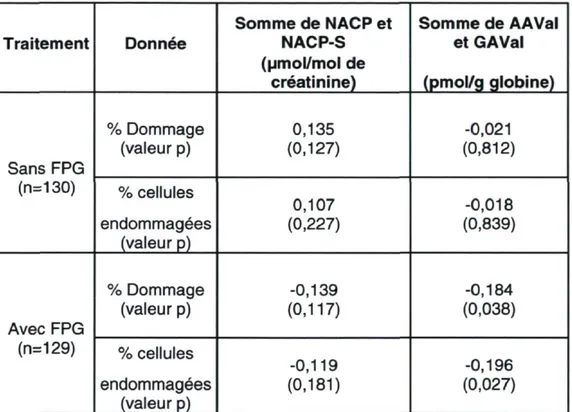
Tableau 8: Dommage à l'ADN lymphocytaire mesuré par le test des comètes
Tableau 9 : Corrélations de Spearman entre le dommage à l'ADN et les biomarqueurs d'exposition à l'acrylamide
Liste des figures
Chapitre 1Figure 1 : Structure moléculaire de l'acrylamide (AM) et de ses metabolites
Figure 2: Biotransformation de l'acrylamide chez l'humain
Figure 3: Structure des principaux adduits glycidamide-ADN
Figure 4: Structure des adduits à l'hémoglobine AAVal et GAVal
Chapitre 2
Supplementary material, Figure 5: Correlations between NACP-S (A) and NACP (B) concentrations measured by both toxicology laboratories in 56 urine samples.
Chapitre 3
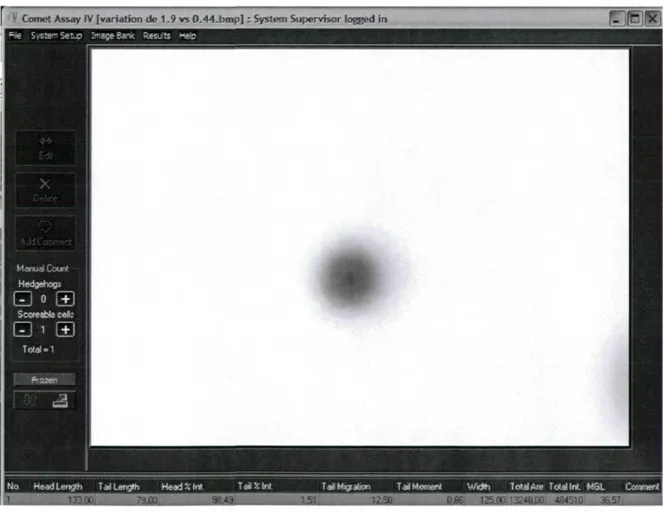
Figure 6: Exemple d'une comète mesurée à l'aide du logiciel Comet Assay IV (couleurs inversées)
Chapitre 1 : Introduction générale
1.1 Toxicologie alimentaire
La notion de toxicité est connue depuis les temps les plus reculés de l'espèce humaine. Les différentes sociétés ayant peuplé la Terre ont appris à se méfier de certaines substances d'origine végétale, animale ou minérale, qui causaient des effets indésirables lorsqu'elles étaient consommées ou manipulées, et ultérieurement à s'en servir à différentes fins (comme armes ou moyens de défense notamment). De nos jours, la toxicologie moderne se décline en différentes branches, dont la toxicologie alimentaire qui s'intéresse aux toxines et substances toxiques présentes dans les aliments. On peut classer les substances d'intérêt en toxicologie alimentaire en trois grandes catégories, à savoir les toxines naturelles, les contaminants et les additifs alimentaires.
La première catégorie englobe des molécules qui sont produites naturellement ou se retrouvent de façon naturelle dans certains organismes comestibles (fruits, légumes, champignons et fruits de mer entre autres). Parmi les plus connues de ces molécules, on peut mentionner les alcaloïdes, les cyanogènes, les tannins et les inhibiteurs de proteases. La deuxième catégorie, celle des contaminants, regroupe les substances indésirables se trouvant dans la nourriture avant, pendant ou après le traitement des aliments et qui peuvent être incorporées au moment de la production, de la préparation, du transport, de la manutention ou suite à une contamination de l'environnement. Mentionnons les antibiotiques, les pesticides, les métaux, les nitrites et les mycotoxines. La dernière catégorie, les additifs alimentaires, englobe toutes les substances ajoutées intentionnellement à la nourriture afin d'en améliorer ses qualités ou ses propriétés. Avant d'être utilisées, ces substances doivent être approuvées par les autorités en la matière afin de s'assurer qu'elles ne comportent aucun risque pour la santé des consommateurs à la concentration utilisée. Il existe une multitude de classes fonctionnelles en ce qui a trait aux additifs alimentaires. Parmi les mieux connues, on trouve les acidifiants, les colorants, les agents de conservation et les édulcorants (Altug, 2003).
1.2 L'acrylamide et ses metabolites
1.2.1 Généralités
Parmi les substances toxiques naturelles, certaines sont de plus en plus étudiées de nos jours en raison de leur potentiel carcinogène et de la nature des aliments dans lequel on les trouve. Parmi celles-ci, on retrouve les produits de réaction de Maillard, qui sont formés lors de la cuisson d'un aliment et sont responsables de la couleur, de l'odeur et du goût particulier des aliments cuits (viandes et produits de boulangerie surtout). Parmi la multitude de produits issus de cette réaction et connus à ce jour, on retrouve l'acrylamide (AA) ou 2-propénamide, un composé vinylique transparent, inodore et soluble dans l'eau pouvant facilement s'assembler en polymères (polyacrylamide) et qui est largement utilisé en génie chimique. On l'emploie pour le traitement des eaux, pour la construction de barrages, de tunnels, de routes ou de réservoirs. On l'utilise également dans l'industrie des pâtes et papiers, la fabrication de cosmétiques et en chimie analytique (chromatographie, électrophorèse) (Besarantinia et al., 2007). En 2002 des chercheurs suédois ont identifié cette molécule dans la nourriture, ce qui a entraîné une intensification de la recherche sur l'acrylamide, étant donné l'exposition généralisée à cette substance dans la population.
1.2.2 Formation de l'acrylamide
La réaction qui est à la base de l'apparition de l'acrylamide dans la nourriture est la réaction de Maillard. Celle-ci, découverte en 1912 par le chimiste français Louis-Camille Maillard, est une réaction spontanée au cours de laquelle un acide aminé se condense avec un aldose pour former un produit de Maillard. Cette réaction constitue une voie importante dans le processus du développement de la couleur et de la saveur typique aux aliments cuits (Kawamura, 1983; Moussard, 2006). Selon l'acide aminé et le sucre réducteur initialement impliqués, on peut obtenir différents produits de Maillard. Pour ce qui est de l'acrylamide, la réaction débute avec l'asparagine (principalement) et un sucre réducteur (ribose, glucose, fructose, galactose, etc.) lors de la cuisson à température élevée (120-180 °C) (Besarantinia et al., 2007). Ensuite, le groupement carbonyle du sucre réagit avec le groupement a-amino de l'acide aminé et, suite à la perte d'une molécule d'eau, on obtient une base de Schiff. Lorsque chauffée, celle-ci est
décarboxylée peut réagir de deux façons pour produire de l'acrylamide. Premièrement, son hydrolyse donne le 3-aminopropanamide qui, lorsque chauffé, devient de l'acrylamide suite à la perte de son groupement ammonium. Deuxièmement, par tautomérisme, la base décarboxylée conduira à un produit d'Amadori décarboxylé, qui donnera de l'acrylamide via la B-élimination (Zyzak et al., 2003; Mottram et al., 2006). Dans ce cas-ci, ce n'est pas la voie classique de la réaction de Maillard (via le réarrangement d'Amadori) qui est la voie principale, mais plutôt la voie de decarboxylation de la base de Schiff puisque la première est désavantagée énergétiquement. Cependant, un grand nombre de produits de Maillard sont effectivement formés via le schéma classique de la réaction de Maillard (Mottram et al., 2006).
L'humidité joue un rôle important dans la formation de l'acrylamide au cours de la cuisson. Pendant la première partie de la cuisson, alors que le taux d'humidité du produit n'a pas encore été affecté substantiellement par la chaleur, il y a équilibre entre la formation et la dégradation de l'acrylamide. Plus la cuisson progresse, plus le taux d'humidité diminue et plus la formation devient importante par rapport à l'élimination. C'est donc vers la fin de la cuisson que l'acrylamide s'accumule dans les produits alimentaires, à l'exception du café où les concentrations diminuent considérablement en fin de torréfaction (FAO/WHO, 2005). L'acrylamide contenue dans la nourriture semble stable à travers le temps excepté encore une fois pour le café moulu. Les concentrations en acrylamide dans celui-ci ont tendance à diminuer après plusieurs mois d'entreposage. La quantité d'acrylamide formée dans un produit alimentaire dépend de plusieurs facteurs : pH et taux d'humidité de l'aliment, composition de départ (en particulier en asparagine, sucres réducteurs, autres acides aminés et protéines), temps et température de cuisson (FAO/WHO, 2005).
1.2.3 Exposition chez l'humain
L'exposition à l'acrylamide peut avoir lieu de trois façons principalement. Premièrement, comme l'acrylamide est utilisée de façon industrielle, il peut y avoir exposition professionnelle ou accidentelle. Cependant, comme l'acrylamide est rapidement dégradé dans l'environnement, ce type d'exposition est peu important dans la population en général. Deuxièmement, la fumée de cigarette contient, entre autres substances, de l'acrylamide. Son inhalation constitue une source d'exposition non négligeable (Gouvernement du Canada, 2009). Troisièmement, la source la plus importante
d'exposition à l'acrylamide dans la population générale est celle traitée dans cet ouvrage, soit l'exposition via l'alimentation. Parmi les aliments ayant les plus grandes concentrations d'acrylamide, on retrouve les pommes de terres frites et en croustilles, certains produits à bases de céréales ainsi que les substituts de café et produits dérivés de celui-ci. Cependant, pratiquement toutes les catégories de produits alimentaires contiennent des concentrations d'acrylamide détectables (1 ug/kg) (FAO/OMS, 2005). Le tableau 1 présente un résumé des concentrations d'acrylamide dans les aliments de consommation courante.
Tableau 1. Résumé des concentrations d'acrylamide mesurées dans divers aliments Concentration Concentration Nb. moyenne C V " maximum Aliments d'échantillons*
(ug/kg)
(%) rapportée (ug/kg)Céréales et produits céréaliers 3 304(12 346) 343 156 7 834
Céréales et pâtes, crues
bouillies 113(372) 15 71 47
Céréales et pâtes cuites
(rôties, frites, grillées) 200 (634) 123 110 820 Produits céréaliers, tous 2 991 (11 327) 366 151 7 834
Pain 1 294 (5 145) 446 130 3 436
Pâtisseries et biscuits 1 270 (4 980) 350 162 7 834
Céréales à déjeuner 369(1 130) 96 131 1 346
Pizza 58 (85) 33 270 763
Poisson et fruits de mer 52(107) 25 180 233
Viande et abats 138 (325) 19 174 313
Produits laitiers 62(147) 5,8 119 36
Noix et huiles de graines 81 (203) 84 233 1 925
Légumineuses 44 (93) 51 137 320
Racines et tubercules 2 068(10 077) 477 108 5 312
Pommes de terre en purée,
bouillies 33 (66) 16 92 69
Pommes de terre rôties 22 (99) 169 150 1 270
Croustilles de pommes de
Pommes de terre frites 1 097 (6 309) 334 128 5312 Croquettes de pommes de
terre 42 (48) 110 145 750
Stimulants et analogues 459 (1 455) 509 120 7 300
Café (infusé) prêt-à-boire 93(101) 13 100 116
Café (moulu, instante ou
torréfié, non infusé) 205 (709) 288 51 1 291
Extraits de café 20(119) 1 100 93 4 948
Café décafféiné 26 (34) 668 169 5 399
Substituts de café 73(368) 845 90 7 300
Produits du cacao 23 (23) 220 111 909
Thé vert 29(101) 306 67 660
Sucres et miel (principalement
le chocolat) 58(133) 24 87
112
Légumes
Crus, bouillis, en conserve Transformés (rôtis, cuits au four, frits, grillés)
Fruits frais
Fruits séchés, frits, transformés
84(193) 17 206 202
45(146) 4,2 103 25
39 (47) 59 109 202
11(57) < 1 188 10
37 (49) 131 125 770
Alcool (bière, gin, vin)
66 (99)
6,6143
46Sauces et condiments
Préparations pour nourrissons Nourriture pour bébé (en pot ou en conserve)
Nourriture pour bébé (en poudre) Nourriture pour bébé (biscuits, biscottes, etc.)
19(22)
82(117)96 (226)
24 (34)
32 (58)71
<5
22
16
181
345 8282
125
106
1 168
15
121
73
1 217
Nourriture déshydratée13(13)
121 2661 184
Données provenant du Summary and conclusions of the sixty-fourth meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA), FAO/WHO.2005
* Nombre de résultats analytiques pour des échantillons individuels et des échantillons composites. Entre parenthèses, nombre total d'échantillons individuels, comprenant les échantillons inclus dans des échantillons composites.
Le comité mixte FAO/OMS a estimé les doses moyennes d'exposition chez l'humain entre 0,3 et 0,8 ug par kg de poids corporel par jour (FAO/OMS, 2002). Pour sa part, Santé Canada (2007) a estimé que les Canadiens étaient exposés à une dose moyenne de 0,3 à 0,4 ug par kg de poids corporel par jour via l'alimentation, ce qui correspond aux doses calculées dans les autres pays.
1.2.4 Les metabolites de l'acrylamide
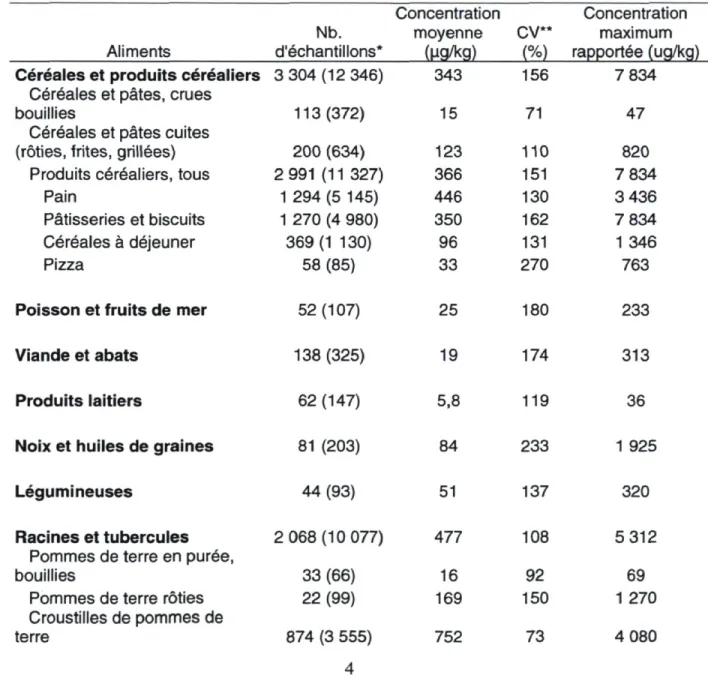
Une fois absorbé dans l'organisme, une partie de l'acrylamide est transformée en différents metabolites : glycidamide (GA), cystéine-S-propionamide (CP), N-acétyl cystéine-S-propionamide (NACP), NACP sulfoxyde (NACP-S), N-acétyl-S-(1-carbamoyl-2-hydroxyéthyl) cysteine (GAMA2) et N-acétyl-S-(3-amino-2-hydroxy-3-oxopropyl) cysteine (GAMA3) (Fennell et al., 2006). Le metabolite le plus toxique de l'acrylamide est le glycidamide. Celui-ci réagit avec l'ADN, plus particulièrement avec les guanines et les adenines, et forme des adduits, ce qui cause des mutations (Baum et al., 2008). La toxicité in vivo de l'acrylamide serait en grande partie due au glycidamide (Hansen et al., 2010). La figure 1 montre la structure moléculaire de l'acrylamide et de ses différents metabolites.
AM
NH;
R'
R'
NACP
I I i I O ♦ il,S
o
NH-NH;
GA
2J.
NH-R
tOH
.S^X/NH
20
GAMA3
Glyceramide
O
* HO y NH
2OH
NH
2CH
2OH
GAMA2
NACP Sulfoxide
Figure 1. Structure moléculaire de l'acrylamide (AM) et de ses metabolites
Tiré de Fennell et al. (2006)
1.3 Toxicocinétique
Selon les études, l'acrylamide a une demi-vie dans l'organisme allant de 2,2 à 7 heures
(Fuhr et al., 2006; Sôrgel et al., 2002). La biodisponiblité orale de l'acrylamide varie selon
le véhicule et l'espèce. En général l'acrylamide administré via l'eau de boisson est mieux
absorbé que celui contenu dans la nourriture. Chez la souris B6C3F1, la biodisponibilité
de l'acrylamide dans la nourriture est d'environ 40 % (Doerge et al. 2005A) alors que chez
le rat Fischer 344 elle passe à 60-80% (Doerge et al., 2005B). Les études chez l'humain
(Fennell et al., 2005; Boettcher et al., 2006) tendent à démontrer que l'acrylamide
administré par la voie orale est presque complètement absorbé par la paroi intestinale
(Fuhr et al., 2006). Outre la voie orale, l'acrylamide peut aussi être absorbé par inhalation
et par la peau (Gouvernement du Canada, 2009; Fennell et al., 2005). L'acrylamide est
distribué dans la plupart des tissus (foie, poumons, cerveau et muscle, testicules, glandes mammaires) (Doerge et al., 2005a, 2005b). En outre, l'acrylamide peut traverser les barrières placentaire et hémato-encéphalique et se retrouve aussi dans le lait maternel. L'exposition à l'acrylamide chez le foetus et le nouveau-né via le placenta a été démontrée par la détection d'adduits avec l'hémoglobine (Hb) dans le sang de la femme enceinte de même que dans le sang du cordon ombilical prélevé à la naissance du bébé (Sôrgel et al., 2002).
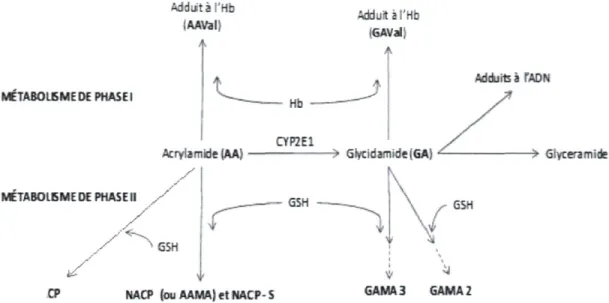
La biotransformation de l'acrylamide se fait soit par époxydation via la voie du cytochrome P450 2E1, soit par conjugaison au glutathion. La première voie produit le glycidamide. Les autres metabolites sont engendrés par conjugaison au glutathion à partir de l'acrylamide ou du glycidamide (Sumner et al., 1992). L'acrylamide est donc métabolisé soit en glycidamide, en CP, en NACP ou en NACP-S. Quand au glycidamide, il peut être métabolisé en GAMA2 et GAMA3 (Fennell et al., 2006), ou hydrolyse en glycéramide (Fennell et al., 2005a). À partir des études réalisées chez les animaux, on a pu constater que la detoxification de l'acrylamide par la conjugaison au glutathion était beaucoup moins efficace chez la souris que chez le rat. Chez ce dernier, la biotransformation de l'acrylamide en glycidamide est cependant beaucoup moins efficace (Sumner et al., 1997). En outre, les recherches ont permis d'établir que la souris et le rat ont respectivement un taux de conversion de l'acrylamide en glycidamide de deux et quatre fois supérieur à celui de l'humain (Fuhr et al, 2006; Boettcher et al., 2006). Chez ce dernier, environ 60% de l'acrylamide est excrété dans l'urine (Fuhr et al., 2006; Boettcher et al., 2006) dont plus ou moins 86% conjugué au glutathion (Fennell et al., 2005). L'acrylamide sous forme inchangée dans l'urine compte pour un peu plus de 4% de la dose initiale reçue. Le rapport glycidamide / autres metabolites dans l'urine est de 0,1 environ, ce qui se traduit par seulement des traces lors du dosage des metabolites urinaires (Fuhr et al, 2006; Boettcher et al., 2006). Quant au 40% restant de la dose initiale, on ne sait pas très bien encore comment il est éliminé. On suppose qu'une partie forme des adduits avec les macromolécules (ADN et protéines). Le reste pourrait être excrété par la bile ou être converti en metabolites n'ayant pas encore été identifiés. La figure 2 présente le schéma
METABOUSME DE PHASE I METABOLISME DE PHASE II Adduit à l'Hb f AAVal) / Adduit à l'Hb GAVal CYP2E1
Acrylamide (AA) > Glycidamide |GA)
QSH CP GSH NACP (ouAAMA)etNACP-S Adduits à TADN GSH GAMA3 GAMA2 -> Glycéramide
Figure 2. Biotransformation de l'acrylamide chez l'humain
Tiré de Fennell et al. (2005b), Fennell et al. (2006), Fuhr et al. (2006) et U.S. EPA (2010)
1.4 Toxicodynamie
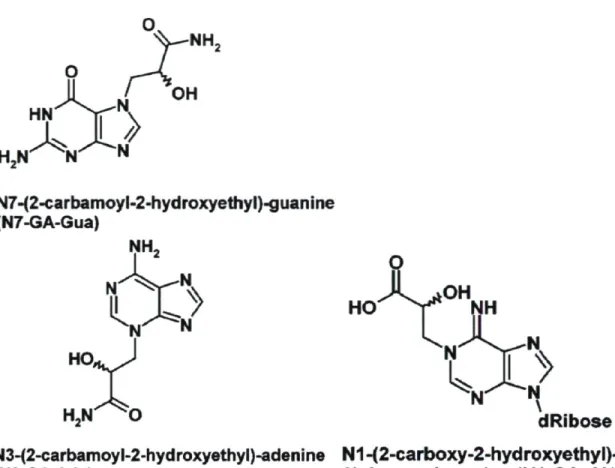
1.4.1 GénotoxicitéEn général, la formation d'adduits directement entre l'acrylamide et l'ADN est très limitée en raison de la faible réactivité de l'acrylamide pour les bases azotées (Doerge et al., 2005a; Solomon et al., 1985). L'ADN forme plutôt des adduits avec le glycidamide comme l'ont démontré les recherches de Gamboa da Costa et al. (2003) et de Segerbàck et al. (1995). Le principal adduit formé est le 7-(2-carbamoyl-2-hydroxyethyl)-guanine (N7-GA-Gua). On remarque une distribution uniforme de cet adduit parmi les organes chez le rat et la souris (Gamboa da Costa et al., 2003; Segerbàck et al., 1995). D'autres adduits entre le glycidamide et l'ADN ont aussi été identifiés en concentrations inférieures :
3-(2-carbamoyl-2-hydroxyethyl)-adenine, 1-(2-carboxy-2-hydroxyethyl)-2'-deoxyadenosine (Gamboa da Costa et al., 2003). La figure 3 présente les trois principaux adduits du glycidamide à l'ADN.
N7-(2-carbamoyl-2-hydroxyethyl)-guanine (N7-GA-Gua)
dRibose N3-(2-carbamoy l-2-hyd roxyethy I )-adenine N1 -( 2-carboxy-2-hyd roxyethy I)-(N3-GA-Ade) 2*-deoxyadenosine (N1-GA-dA)
Figure 3. Structure des principaux adduits glycidamide-ADN Tiré de Gamboa da Costa et al. 2003
A ce jour, aucun consensus n'existe quant à la mutagénicité de l'acrylamide. Suite au test d'Ames, qui permet de déterminer le potentiel mutagène d'un composé, l'acrylamide s'est révélé non-mutagène. Celui-ci a également été trouvé non-mutagène lors de tests avec Salmonella typhimurium, avec ou sans système d'activation exogène. Le glycidamide a quant à lui été identifié comme mutagène suite aux mêmes tests, et ce même en l'absence d'un système d'activation exogène (Hashimoto et al., 1985). Par contre, l'acrylamide a été identifié comme mutagène sur le locus de l'hypoxantine guanine phosphoribosyl transferase dans des cellules ovariennes d'hamster chinois ainsi que sur le locus de la thymidine kinase dans des cellules de lymphome de souris, avec ou sans système d'activation exogène (Dearfield et al., 1988). D'autres études ont également obtenu des résultats suggérant que l'acrylamide serait un composé mutagène
(Manjanatha et al, 2006; Russell et al., 1991; Neuhàuser-Klaus et al., 1989; Hoom et al., 1993).
1.4.2 Carcinogénicité
L'acrylamide a été identifié comme agent tumorigène chez la souris et le rat avec une spécificité pour certains sites propres à chaque espèce. Les études sur la carcinogénicité à moyen et long terme ont montré, suite à une administration d'acrylamide par différentes voies, un risque accru de cancer de la peau et du poumon chez la souris, ainsi que l'apparition de tumeurs en de nombreux sites (scrotum, glandes thyroïdes et mammaires, clitoris, utérus et système nerveux central) chez le rat (Dearfield et al., 1988 et 1995; Friedman, 2003). Jin et al. (2008) ont procédé à une étude chez la souris afin de vérifier une possible association entre l'acrylamide et le risque de cancer de la thyroïde, mais les résultats n'ont pu démontrer une telle relation.
Chez l'humain, Hogervorst et al. (2007) ont rapporté une augmentation du risque de cancer de l'endomètre et de l'ovaire, mais pas de cancer du sein, associée à la consommation alimentaire d'acrylamide dans une cohorte de 2589 femmes âgées de 55 à 69 ans. Wilson et al. (2010) en sont arrivés aux mêmes conclusions en ce qui a trait à l'association entre l'exposition alimentaire à l'acrylamide et le risque de cancer de l'endomètre, de l'ovaire et du sein. L'étude d'Olesen et al. (2008) a permis d'observer une association positive entre les concentrations d'acrylamide dans l'organisme (et plus particulièrement dans le sang grâce à la mesure des niveaux d'adduits à l'hémoglobine) et le risque de cancer du sein, si on ajuste pour le tabagisme. Deux autres études de cohorte ont été réalisées par Mucci et al. (2005 et 2006) afin de vérifier les associations entre l'acrylamide et les risques des cancers du sein et colorectal, mais aucune association n'a pu être mise en évidence. D'autres études ayant pour sujet l'acrylamide et le risque de cancer chez l'homme n'ont pu révéler une association significative (Mucci et al. 2003 et 2004; Pelucchietal., 2006).
L'acrylamide a été classée « probablement carcinogène chez l'humain » par le CIRC. Cet organisme considère donc que la preuve est suffisante à l'effet que le composé est cancérigène chez l'animal, mais que les données épidémiologiques sont inadéquates
(CIRC 1994 et 2011). L'EPA classe également l'acrylamide comme un carcinogène probable pour l'humain (U.S. EPA, 1994)
À ce jour, le mode d'action de la carcinogénicité de l'acrylamide soulève encore des questions. D'après les recherches in vitro et in vivo, on croit que la génotoxicité (due au glycidamide) en serait à l'origine. Il est possible aussi qu'une modification au niveau endocrinien puisse être impliquée dans l'apparition de tumeurs dues à l'acrylamide (Lafferty et al., 2004). Aucune étude n'est cependant venue étayer cette hypothèse à ce jour.
1.4.3 Autres effets toxiques
L'acrylamide est connu pour être un agent neurotoxique ayant des effets tels l'ataxie, une faiblesse au niveau des muscles squelettiques et des troubles de cognition. Chez les animaux de laboratoire, cette neurotoxicité s'accompagne de dommages aux axones distaux et aux terminaisons nerveuses. Bien qu'il ne soit pas tout à fait expliqué à ce jour, le mécanisme de neurotoxicité de l'acrylamide semble dû à une inhibition de la voie de signalisation présynaptique du NO. Cette perte de fonction du NO entraînerait une perte de fonction des synapses et éventuellement une dégénération de celles-ci (LoPachin et Gavin, 2008; LoPachin et al., 2008). Cependant, aux doses qui sont normalement attribuables à l'exposition alimentaire, il est fort peu probable que des effets toxiques de cette nature se produisent.
1.5 Biosurveillance de l'acrylamide
1.5.1 GénéralitésLa biosurveillance se fait généralement par la mesure d'un biomarqueur dans le but d'évaluer les risques pour la santé occasionnés par un produit particulier. Un biomarqueur est un paramètre chimique ou biologique pouvant être mesuré dans un échantillon biologique et qui donne de l'information sur l'exposition à une molécule, son effet ou la susceptibilité d'apparition de divers troubles de santé. On classe généralement les biomarqueurs en deux catégories, soit les biomarqueurs chimiques (concentration d'un produit et/ou de ses metabolites dans les tissus, le sang, l'urine ou l'air expiré, ainsi que les adduits avec l'ADN ou les protéines) et biologiques (mutations somatiques, cassures à
l'ADN, changements cytogéniques, micronoyaux et aberrations chromosomiques entre autres). Les biomarqueurs de la première catégorie sont normalement utilisés pour mesurer l'exposition, alors que ceux de la deuxième le sont généralement pour mesurer l'effet. En ce qui a trait à la biosurveillance de l'acrylamide, puisque c'est l'exposition à celui-ci qui nous intéresse particulièrement, on utilise des biomarqueurs chimiques, en l'occurrence les niveaux d'acrylamide et de glycidamide dans le sang, les adduits avec l'ADN et l'Hb ainsi que l'acrylamide et ses metabolites dans l'urine (Tôrnqvist et al., 2006). Les trois sous-sections suivantes concernent les biomarqueurs de l'acrylamide ayant été utilisés dans mon projet de recherche.
1.5.2 Adduits à l'hémoglobine
Environ 12% de l'acrylamide qui se retrouve dans l'organisme se lierait à l'Hb dans les globules rouges (Hashimoto et Alridge, 1970). Des méthodes d'analyse ont donc été mises au point afin de mesurer les quantités d'adduits formés. En modifiant une méthode de chromatographie à phase gazeuse couplée à la spectrométrie de masse (GC-MS) développée par Bailey et al. (1986), Calleman et al. (1990) ont identifié le S-(2-hydroxy-2-carboxyéthyl) cysteine, un adduit entre le glycidamide et un résidu cysteine de l'Hb. Une méthode permettant de mesurer à la fois les adduits de l'acrylamide et du glycidamide avec la cysteine a été mise au point en 1991 (Bergmark et al., 1991). Des adduits peuvent aussi se former entre l'acrylamide et un résidu valine (AAVal) ainsi qu'entre le glycidamide et ce même résidu (GAVal). La structure chimique de ces deux adduits est présentée dans la figure 4. Une méthode de chromatographie en phase liquide couplée à un spectromètre de masse en tandem (LC-MS/MS) a été mise au point par Fennell et al. dans le but de mesurer ces deux adduits à l'Hb et leur quantification a été faite dans différents situations, tant chez l'animal que chez l'humain (Fennell et al., 2003; Fennell et al., 2005; Ghanayem et al., 2005). Mesurer la quantité d'adduits AAVal et GAVal dans les globules rouges permet de caractériser l'exposition à long terme à l'acrylamide et au glycidamide puisque ces adduits s'accumulent sur une période correspondant à la durée de vie des globules rouges (environ 120 jours) (FAO/OMS, 2002). En calculant le ratio AAVal / GAVal, on peut aussi connaître le taux de conversion de l'acrylamide en glycidamide (FAO/OMS, 2002).
fi H
globHK
|s|.X
N^ N ^ ^ ^ O
NH, AAVal N2-(2-carbamoyl-ethyl)-valin OHglobin^A^N^X^O
HX NH
2 GAVal N2-(2-carbamoyl-2-hydroxyethyl)-valinFigure 4. Structure des adduits à l'hémoglobine AAVal et GAVal Tiré de Hartmann et al. 2008
1.5.3 Analyse des metabolites urinaires
L'analyse des metabolites urinaires comme biomarqueur d'exposition a débuté à la même période que la mesure des adduits, lors d'études de neurotoxicité chez les travailleurs exposés à l'acrylamide. Fennell et al. (2005) ont développé une méthode d'analyse des metabolites par résonance magnétique nucléaire du carbone 13 (C-NMR). Cette méthode a permis la quantification des metabolites urinaires totaux pour des administrations de doses orales élevées, mais elle manquait de sensibilité pour des doses orales plus faibles ou dans le cas d'administration par la voie cutanée. Cette même équipe a donc développé une méthode par LC-MS/MS avec une sensibilité accrue (Fennell et al., 2006). Parmi les metabolites de l'acrylamide, le NACP serait celui qui représente le meilleur biomarqueur d'exposition du fait de sa vitesse d'excrétion peu élevée et de sa prédominance en regard des autres metabolites (Boettcher et al., 2006; Fennell et al., 2006)
1.5.4 Test des comètes
Le test des comètes est une mesure de biomarqueur d'effet. Développé initialement dans les années 1970 par l'équipe de Peter Cook (Cook et al., 1976), puis par Ôstling et Johanson (1984), il a été amélioré jusqu'à sa forme actuelle par Singh et al. (1988) et Olive et al. (1990). Ce test permet de mesurer différents types de dommages à l'ADN causés par différents agents génotoxiques sur des cellules individuelles dont les bris simple et double brin, le dommage oxydatif ainsi que les sites apuriniques (Collins, 2004). Le test peut être réalisé en conditions neutres ou basiques selon le type de dommage que l'on souhaite observer. Des enzymes produisant des lésions spécifiques peuvent aussi
être ajoutées au test afin de mettre en évidence le dommage oxydatif. Par exemple, la formamidopyrimidine glycosylase (FPG) est une enzyme qui, lorsqu'ajoutée lors du test des comètes, convertit le dommage oxydatif en cassures à l'ADN pouvant être mesurées. Le test des comètes peut aussi être utilisé pour des essais de réparation de l'ADN sur des cellules endommagées par traitement UV ou par un composé chimique (peroxyde d'hydrogène par exemple). Chez l'humain, le test est le plus souvent réalisé avec des lymphocytes isolés à partir d'échantillons de sang (Collins et al., 2004). Parmi les effets appréhendés de l'exposition à l'acrylamide, les effets génotoxiques sont les plus préoccupants et peuvent être mesurés par le test des comètes. C'est pourquoi ce dernier a été choisi comme biomarqueur d'effet.
1.6 Contexte de la recherche et objectifs
1.6.1 Contexte de la rechercheCes travaux s'inscrivent dans le cadre du projet de recherche intitulé : « Importance de l'exposition à l'acrylamide par l'alimentation chez des adolescents montréalais » présenté à Santé Canada et réalisé conjointement par l'Université de Montréal et l'Institut National de Santé Publique du Québec. Partant des données recueillies sur les niveaux d'exposition à l'acrylamide dans la population, les enfants et les adolescents ont été identifiés comme groupe à risque en raison de leur grande exposition à l'acrylamide par l'alimentation comparativement au reste de la population (FAO/OMS, 2002). Cette différence réside dans le fait que les enfants et les adolescents consomment une quantité de nourriture moyenne plus élevée par kilogramme de poids corporel que les adultes (Dybing et al., 2005). Selon l'OMS (FAO/OMS, 2002), l'apport alimentaire des enfants et adolescents serait deux à trois fois supérieur à celui des adultes. Les enfants et les adolescents sont également de grands consommateurs d'aliments susceptibles de contenir des concentrations élevées d'acrylamide (Dybing et al., 2005). Heudorf et al. (2009) ont produit une estimation de l'apport en acrylamide chez un groupe de 110 enfants allemands âgés de 5 et 6 ans en quantifiant les metabolites urinaires de l'acrylamide. Une association significative a été observée entre la consommation de pommes de terre frites et les niveaux de metabolites urinaires. Peu d'études ont été réalisées chez les adolescents, qui pourtant constituent eux aussi un groupe à risque. Selon nos connaissances, seuls Hartmann et al. (2008) ont mesuré à la fois les
metabolites urinaires et les adduits à l'Hb chez des adolescents de 11 à 18 ans. Cependant, étant donné la taille très restreinte de leur échantillon (11 adolescents), des études plus poussées devraient être réalisées afin de mieux caractériser l'exposition à l'acrylamide et ses risques pour la santé des adolescents.
La population à l'étude est constituée d'adolescents des deux sexes âgés de 10 à 17 ans habitant Montréal. Ce territoire a été choisi parce qu'il constitue la plus grande agglomération de la Province de Québec au Canada. Les fumeurs ainsi que les participants atteints de cancer ou d'une pathologie du foie ou du rein étaient exclus de l'étude. D'une part, l'acrylamide est présente dans la fumée de tabac (Smith et al., 2000); de l'autre, les personnes souffrant d'une pathologie hépatique ou rénale peuvent présenter un métabolisme altéré de l'acrylamide. Au total, ce sont donc 200 adolescents qui ont été recrutés pour le projet.
Un questionnaire alimentaire auto-administré a également été remis aux participants. Celui-ci devait être rempli pendant les deux jours précédant la collecte urinaire et était divisé en trois sections : journal alimentaire, questions sur l'alimentation habituelle et questions sur les habitudes de vie. Des modèles alimentaires de portions ont été fournis aux participants afin de les aider à compléter avec précision leur journal alimentaire.
Suite au questionnaire alimentaire, un plan d'échantillonnage des aliments et marques les plus fréquemment consommés et susceptibles de contribuer à l'apport alimentaire en acrylamide a été dressé. Les aliments ont été préparés selon les instructions du fabricant puis envoyés pour analyse au laboratoire de la Direction générale des produits de santé et des aliments de Santé Canada. La concentration d'acrylamide a été mesurée dans ces produits et l'évaluation de l'exposition alimentaire à l'acrylamide a pu été faite à l'aide de ces données et des portions alimentaires consignées dans le journal alimentaire des participants. Les participants ont fourni des échantillons d'urine pour l'analyse des metabolites urinaires et de la cotinine urinaire. La plupart ont également fourni un échantillon sanguin pour les mesures d'adduits à l'Hb et le test des comètes. La partie du projet concernant le questionnaire alimentaire et la mesure de l'acrylamide dans les aliments est traitée dans l'article de Normandin et al. (2012).
1.6.2 Objectifs de recherche
Le projet de recherche faisant l'objet du présent mémoire a pour objectif général de caractériser l'exposition à l'acrylamide chez un groupe d'adolescents montréalais et de vérifier si cette exposition est associée à un effet génotoxique chez ces derniers. Les objectifs spécifiques sont l'analyse de biomarqueurs d'exposition dans le but d'établir une association avec l'apport alimentaire en acrylamide et d'étudier les liens potentiels entre les concentrations de ceux-ci et un biomarqueur d'effet précoce, le dommage à l'ADN lymphocytaire.
Chapitre 2: Article
*Article soumis pour publication dans la revue Journal of exposure science and environmental epidemiology.
Relation between dietary acrylamide exposure and biomarkers of internal dose in Canadian teenagers
Résumé
Introduction: L'Acrylamide (AA) un carcinogène probable, se retrouve dans plusieurs aliments, en particulier ceux à base d'amidon chauffés à haute température (frites cuites dans l'huile, croustilles de pommes de terre). Peu d'études ont examiné la relation entre l'exposition alimentaire à l'AA et les biomarqueurs d'exposition de cette substance.
Objectifs : Nous avons étudié la relation entre l'apport alimentaire en AA et les biomarqueurs d'exposition à l'AA (metabolites urinaires et adduits à l'hémoglobine) chez un groupe d'adolescents habitant un grand centre urbain canadien. Ce groupe d'âge serait particulièrement à risque étant donné leur forte consommation de nourriture par kilogramme de poids corporel et leur préférence pour les aliments riches en AA.
Méthodes : Nous avons recruté 200 adolescents âgés entre 10 et 17 ans et habitant Montréal, au Canada. Les concentrations d'AA et de ses metabolites dans 195 échantillons d'urine prélevés sur une période de 12 h ont été mesurées à l'aide d'un chromatographe en phase liquide couplé à un spectromètre de masse en tandem (LC-MS/MS). Nous avons obtenu 165 échantillons sanguins qui ont été analysés pour déterminer leurs teneurs en adduits à l'hémoglobine par LC-MS/MS. Les caractéristiques sociodémographiques et les habitudes de vie des participants ont été obtenues par questionnaires. L'apport alimentaire en AA de nos participants a été rapporté par Normandin et al. (2012).
Résultats : Les deux principaux metabolites urinaires étaient le N-acétyl-cystéine-S-propionamide (NACP) et le NACP-sulfoxyde (NACP-S), avec des concentrations
moyennes respectives de 31,2 et 14,2 umol/mol de creatinine (moyennes géométriques). Les adduits à l'hémoglobine ont été détectés chez tous les participants; les concentrations moyennes de AAVal (adduits de l'acrylamide avec la valine) et GAVal (adduit du glycidamide, un metabolite de l'AA, avec la valine) étaient respectivement de 45,4 et 45,6 pmol/ g de globine. Les niveaux d'adduits étaient similaires à ceux d'Américains du même groupe d'âge. En analyse multivariée, l'apport alimentaire moyen en AA deux jours avant la collecte d'urine est associée aux concentrations de NACP + NACP-S (p < 0.0001). L'apport journalier moyen en AA dans le mois précédent la prise de sang (p < 0.0001) et le tabagisme passif (p < 0.05) étaient associés au niveau d'adduits à l'hémoglobine (AAVal + GAVal).
Conclusion : Les concentrations de metabolites urinaires de l'AA sont reliées à l'apport alimentaire récent en AA tandis que les niveaux d'adduits à l'hémoglobine reflètent l'apport en AA sur une plus longue période de temps. Cet apport est semblable à celui rapporté chez des adolescents américains.
Relation between dietary acrylamide exposure and biomarkers of internal dose in Canadian teenagers
Benjamin Brisson, M.Sc1,2, Pierre Ayotte, Ph.D1,2, Louise Normandin, Ph.D.1, Éric
Gaudreau, M.Sc.1, Jean-François Bienvenu, M.Sc.1, Timothy R. Fennell, Ph.D.3, Carole
Blanchet, M.Sc.1, Denise Phaneuf, M.Sc.1, Caroline Lapointe, M.Sc.4, Yvette Bonvalot,
Ph.D.4, Michelle Gagné, M.Sc.1, Marilène Courteau, M.Sc.1, Rodney W. Snyder, Ph.D.3,
Michèle Bouchard, Ph.D5*
11nstitut national de santé publique du Québec, Québec, Canada; 2Université Laval,
Québec, Canada; 3RTI International, Research Triangle Park, NC, USA, 4Santé Canada,
Longueuil, Canada, 5Département de santé environnementale et santé au travail, Chaire
d'analyse et de gestion des risques toxicologiques, Institut de recherche en santé publique, Université de Montréal, Montréal, Canada
Running title: Biomarkers of acrylamide exposure in Canadian teenagers
*To whom correspondence should be addressed at: Michèle Bouchard, Ph.D
Department of Environmental and Occupational Health Faculty of Medicine
University of Montreal
P. O. Box 6128, Main Station Montreal (Quebec) H3C 3J7 Phone : (514) 343-6111 ext. 1640 Fax. : (514) 343-2200
ABSTRACT
Acrylamide (AA) is a probable human carcinogen found in several foods, but little information is available of absorption in potentially more exposed groups of the population. We investigated the relationship between dietary AA intake and levels of biomarkers of exposure (urinary metabolites and hemoglobin adducts) in 196 non-smoking teenagers of Montreal Island aged 10-17 years old. Dietary habits and personal characteristics were documented by questionnaire. AA and its metabolites were quantified in 195 12-h urine samples by LC-MS/MS. Hemoglobin adducts from 165 blood samples were analyzed by LC-MS/MS. Most prevalent urinary metabolites were NACP and NACP-S, with respective geometric mean concentrations of 31.2 and 14.2 umol/mol creatinine. Geometric mean concentrations of AAVal and GAVal [adducts of AA and glycidamide (GA) metabolite with valine] were respectively 45.4 and 45.6 pmol/g globin. AA intake during the two days prior to urine collection was a significant predictor of NACP + NACP-S urinary concentrations (p < 0.0001). Mean AA intake during the month prior to blood collection (p < 0.0001) and passive smoking (p<0.05) were associated with adducts levels. Overall, urinary AA metabolite concentrations were related to short term AA intake, whereas levels of hemoglobin adducts reflected intake over a longer time period.
Keywords: acrylamide, urinary metabolites, biomarkers of exposure, Canadian teenagers, hemoglobin adducts, LC-MS/MS
INTRODUCTION
Acrylamide (AA), or 2-propenamide, is a colorless and odourless vinylic compound, which can be easily polymerized to polyacrylamide.1 This polymer is used in many
chemical technologies as a binding, thickening, coagulating or flocculating agent. Individuals may be exposed to AA in the workplace but also in the general environment through the diet mainly as well as tobacco smoke.2 Concerns for widespread exposure
emerged when Swedish scientists found detectable concentrations of AA in several heated foods, particularly in fried, roasted or baked starch-based goods.3 Subsequent
studies identified the mechanism of formation of AA, a reaction between asparagine and reducing sugar in food processed at high temperature (120-180°C).4,5
The neurotoxic potential of AA has been known for over 40 years following studies in occupationally-exposed workers.6 Subsequently, experiments in rodents treated with AA
revealed the carcinogenic potential of this chemical.7,8 Several epidemiologic studies
have investigated the possible link between dietary acrylamide intake and increased cancer risk, but results have been inconsistent. Initial cohort studies conducted by Mucci et al.9,10,11,12 and Pelucchi et al.13 did not reveal any association between AA exposure
and cancer risk. However, Hogervorst et al.14 reported an elevated risk of endometrial
and ovarian cancer, but not breast cancer, associated with dietary AA intake in a prospective study of postmenopausal women. Similar associations were observed in a study involving younger women aged 30-55 years old.15 Olesen et al.16 noted a positive
association between hemoglobin adducts levels and breast cancer risk in a case-control study of postmenopausal women. Biomarkers of AA exposure were only measured in the study of Olesen et al.16; dietary questionnaires were used in the other studies, which
may have led to exposure misclassification.
Dietary AA exposure is not evenly distributed in the general population. Children and teenagers exhibit a 2- to 3-fold higher AA intake than adults,17 firstly because of their
higher food consumption per kilogram of body weight and secondly, because they are considered to consume more AA-rich foods (e.g., French fries and potato chips) than other population subgroups.18 Heudorf et al.19 reported a positive association between
children. Vesper et al.20 did not observed any significant difference in adduct levels
between teenagers and adults, whereas Hartmann et al.21 observed higher biomarker
levels (urine metabolites and hemoglobin adducts) in a teenager subgroup compared to adults. To our knowledge, only one small study involving eleven teenagers aged 11-18 yrs used both urinary and blood biomarkers to characterize AA exposure.21 Hence, there
is still a need to better characterize dietary AA exposure in teenagers using different biomarkers of internal dose.
This study aimed at documenting exposure to AA in non-smoking teenagers living in Montreal, Canada, using urinary biomarker and hemoglobin adduct measurements. We also tested correlations between exposure biomarker levels and both short term (last 48 h) or long term (last month) dietary AA intakes reported in Normandin et al.22
METHODS
Study Population and Recruitment of Participants
Recruitment and data collection took place between October 2009 and February 2010. Adolescents were randomly recruited either by Email or by phone from a list of names, addresses and phone numbers of residents of the Island of Montreal (Province of Quebec, Canada). For phone recruitment, agents contacted parents who were residents of Montreal for a preliminary assessment of the eligibility of their teenagers and to explain the research project. If one teenager was deemed eligible, the parental authority was asked to provide preliminary consent for the potential enrolment of his or her teenager(s) and for permission to speak to them. Up to two teenagers could participate per household and the adolescents whose birthday was closest to the date of telephone contact were first solicited. After explaining the project to the teenagers and upon consent to participate, they were asked to complete a telephone survey designed to further verify their eligibility, collect sociodemographic data including gender, ethnicity, education, school (public or private), language spoken at home and language spoken with friends. For Email recruitment, parents interested in having their adolescent participate in the study were invited to complete the same questionnaire but online to verify eligibility and sociodemographic data, with their teenager. Smokers (n= 11) and participants previously diagnosed with cancer (n=1) or liver/kidney diseases (n = 2) were excluded from the study. A total of 200 adolescents aged 10 to 17 years old were recruited in our study. Four participants were excluded because urinary cotinine analysis revealed a level higher than 150 ug/l, indicative of active smoking23 One participant did
not provide a urine sample.
Data Collection and Biological Sample Collection, Processing and Storage
A research nurse met with each participant accompanied by one parent in their home to 1 ) explain the project in details; 2) obtain written consents from the participant and the parent; 3) provide a bottle and instructions for urine collection; 4) collect blood samples; and 5) provide and explain how to fill the food diary (with the help of food models of standardized portions) and self-administered questionnaires.
Participants collected their urine over a «12-h-period, hence from 6 pm to at least 6 am the next day, including the first void of the day. A 1500-ml polyethylene Nalgene® bottle was provided to each participant for urine collection and temporary storage in the home refrigerator. They were picked up within 24 h by a staff member and brought to the laboratory of the University of Montreal for aliquoting. Aliquots for urinary cotinine analysis were sent to the Institute for Work and Health in Lausanne, Switzerland, whereas the aliquots for urinary metabolite determination were sent to the toxicology laboratory of the Institut National de santé publique du Québec (INSPQ, Quebec, QC, Canada).
Blood samples were collected in 10-ml plastic Vacutainers® containing potassium EDTA as the anticoagulant (Becton Dickinson Inc., Oakville, ON, Canada). Samples were kept at 4°C in coolers, shipped to the laboratory of the University of Montreal and centrifuged within 24 h at 670xg during 20 min at 4°C. The plasma was removed with a pasteur pipette under vacuum and the red blood cells washed twice with 0.9% saline. The resulting red blood cell pellets were stored frozen at -20°C in the original Vacutainer® tube until shipped on dried ice to RTI International (Research Triangle Park, NC, USA) for analysis of hemoglobin adducts. Once at RTI International, they were kept at -70°C until analysis.
Chemicals
AA (99.9% pure) was either obtained from Alfa Aesar (Ward Hill, MA, USA) or from Sigma (St. Louis, MO, USA). 13C3AA (99%) was purchased from Cambridge Isotope
Laboratories Inc. (Andover, MA, USA). G A (98%) and 13C3GA (98%) were obtained from
Toronto Research Chemicals (Toronto, ON, Canada). CP (100%), 13C3,15N-CP (100%),
GAMA2 (88.4%), GAMA3 (87.0%), NACP (95.0%), 13C3,15N-NACP (97.4%), NACP-S
(97.1%) and 13C3,15N-NACP-S (97.4%) were synthesized by the Organic Synthesis
Service at CHUQ Research Center (Quebec City, QC, Canada). AAValPTH-13C5 and
GAValPTH-13C5 were synthesized at RTI (Research Triangle Park, NC, USA) according
to the method described by Fennell et al.24
Analysis of Acrylamide and Metabolites in Urine Samples
AA and its main metabolites, glycidamide (GA), cysteine-S-propionamide (CP), N-acetyl cysteine-S-propionamide (NACP), N-acetyl-S-(1-carbamoyl-2-hydroxyethyl) cysteine
(GAMA2), N-acetyl-S-(3-amino-2-hydroxy-3-oxopropyl)cysteine (GAMA3) and N-acetyl cysteine-S-propionamide sulfoxide (NACP-S) were quantified in urine samples by LC-MS/MS following the method developed by Fennell et al.25,26 with modifications. Briefly,
samples were thawed in the refrigerator and 100 pi were used for the analysis. Ten pi of the internal standard solution (13CaAA 1 pg/ml, 13C3GA 5 pg/ml, 13C3,15N-CP 0.5 pg/ml, 13C3,15N-NACP 1 pg/ml, 13C3,15N-NACP-S 2 pg/ml) were added to each urine sample.
The samples were then vortexed and centrifuged at 21 OOOxg for five minutes at 4°C using a Beckman Coulter Allegra 25R centrifuge. Twenty pi of the supernatants were mixed with 80 pi of 0.08 % acetic acid solution, vortexed and centrifuged. The supernatants were transferred into low volume inserts for LC-MS/MS analysis.
Analysis was conducted using a Waters Acquity UPLC system coupled to a Waters Xevo TQ MS/MS. Chromatography was performed on a Waters Atlantis dC18 column (100 mm x 4.6 mm, 3 pM) and compounds were eluted with a gradient constituted of 0.08% acetic acid in water (solvent A) and acetonitrile (solvent B) at a flow rate of 500 pL/min, over a 15-min period. The gradient started with 100% mobile phase A for 7 minutes, lowered to 9 1 % A for 4 minutes. A 1 minute wash was performed by increasing acetonitrile to 99 %, before returning to the original conditions. The MS/MS was operated in positive polarity mode. Quantification of AA and its metabolites was conducted with a calibration curve using the analyte to internal standard surface ratio. Data were integrated using MassLynx 4.1 (Waters, Milford, MA, USA) and data treatment was performed with the Starlims software (Abbott Laboratories, Abbott Park, IL, USA). Home-made reference materials (RM) were used for quality control. These RM were prepared with a combination of internal standards of known concentrations (for the low level RM: AA 120 pg/l, CP 40 pg/l, GA 600 pg/l, GAMA2 320 pg/l, GAMA3 80 pg/l, NACP 200 pg/l and NACP-S 400 pg/l; for the high-level RM, four times the concentrations of the low RM). We inserted either a low- or high-RM after each analytical batch comprising 10 unknown samples in alternance. Table S1 of Supplementary material lists the elements of performance for this LC-MS/MS method.
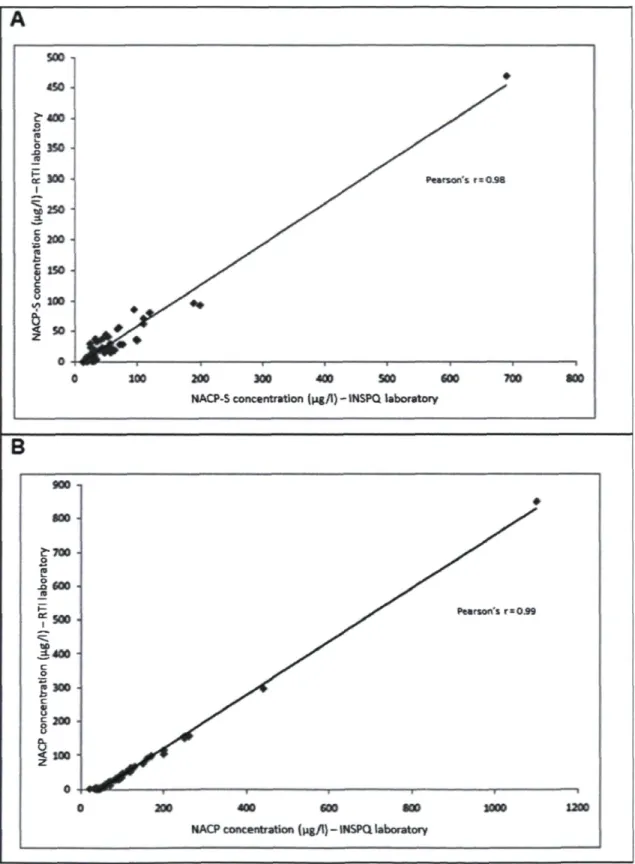
Interlaboratory Comparison of Urinary Metabolite Concentrations
Because of the lack of reference materials for laboratory performance evaluation, a series of urine samples (n = 56) were analyzed both at the INSPQ toxicology laboratory and at RTI International. In the latter laboratory, the analysis was conducted according to
the method described in Fennell et al.26 with some modifications using an Agilent 1100
HPLC system coupled to a AB Sciex API 4000 MS/MS with a Turboionspray interface. Only two internal standards, 13C3-AA and d4-NACP were used at RTI laboratory, each at
a concentration of 2 pg/ml. Very good correlations were obtained between results from the two laboratories for NACP and NACP-S (see Figure S1 in Supplementary materials).
Analysis of Hemoglobin Adducts
Globin was isolated from washed red cells as described by Mowrer et al.27 In short, lysed
red blood cells were mixed with 50 mM HCI in 2-propanol to precipitate heme. After centrifugation at 3000xg, the supernatant was mixed with ethyl acetate and the resulting precipitate washed with n-pentane. Globin was dried under vacuum, weighed into aliquots, and stored at -20 °C until analysis. Globin samples were processed as described by Fennell et al.25 Samples were derivatized with phenylisothiocyanate in
formamide to form adduct phenylthiohydantoin derivatives. Internal standards AAValPTH-13C5 and GAValPTH-13C5 were added and the samples were extracted using
a Waters Oasis HLB 3 cc (60 mg) extraction cartridge (Milford, MA, USA). The samples were eluted with methanol, dried, and reconstituted in 100 pL of 50:50 MeOH:H20
(containing 0.1% formic acid). Analysis was conducted using an Agilent 1200 HPLC system coupled to a PE Sciex API 5000 LC-MS/MS with a Turboionspray interface. Chromatography was performed on a Phenomenex Luna Phenyl-Hexyl Column (50 mm x 2 mm, 3 pM) eluted with 0.1% acetic acid in water and methanol at a flow rate of 400 pL/min, with a gradient of 40-70% methanol in 3 minutes. Methanol was held at 70% for 2 minutes before returning to original conditions. Quantitation of AAVal and GAVal was conducted using the ratio of analyte to internal standard surface, with a calibration curve generated using AAVal-leu-anilide, or GAVal-leu-anilide.
Urinary cotinine analysis
Cotinine concentration in urine samples was measured at Institute for Work and Health (Lausanne, Switzerland) using a standard validated liquid chromatography coupled to tandem mass spectrometry (LC-MS/MS) method.
Assessment of dietary acrylamide intake
The method used to estimate recent and long-term dietary acrylamide intakes is described in Normandin et al.22 Briefly, a food diary was filled by each participant to
document the amounts of acrylamide in foods consumed over a 2-day period preceding urine collection (breakfast cereals, toasted bread, deep-fried French fries, oven-baked French fries, potato chips, corn chips, popcorn, pretzels, roasted almonds, crackers, cookies, chocolate chips, black olives, brewed coffee and prune juice). Participants also completed a pretested food frequency questionnaire (FFQ) to document the consumption of the same food items over the last month. Models of standardized portions were provided to help in estimating the weight of foods and volume of drinks consumed. An extensive database was assembled that comprised acrylamide concentrations measured by LC-MS/MS28 in samples of the most frequent foods
consumed by our participants. If a specific food item was not analyzed, we used concentrations measured by the same laboratory during previous Canadian surveys and in some cases US data.29,30 The mean daily amount of each food item consumed over
the 2-day period was multiplied by its acrylamide concentration, the contributions from all foods were summed and the resulting intake was divided by the body weight (bw) of the participant to yield an acrylamide dose expressed in pg/kg bw-day. A similar calculation was performed to yield a daily acrylamide dose over the last month, based on average daily amounts of food items consumed during the last month documented from the FFQ.
Lifestyle Questionnaire
Participants completed a short questionnaire on their lifestyle habits, which covered second hand smoke exposure, alcohol consumption and the use of personal hygiene products, which are potential sources of acrylamide exposure. The participants were also asked to provide their current body weight.
Statistical Analysis
Normality of distributions was tested with the Shapiro-Wilk test. Distributions of all urinary metabolites and hemoglobin adducts were log-normal. Descriptive statistics for these analytes included the geometric mean and 95% confidence interval, min, max and percentiles. Concentrations below the limit of detection (LOD) of the analytical method were replaced by a value equal to half of the LOD. Spearman correlations were carried out to test the relation between dietary AA intakes (pg/kg bw-day) and biomarker concentrations. Pearson correlations were used to test the correlations among biomarkers of exposure (log-transformed values). Multivariate linear regression analyses were conducted to control for possible confounding factors of the relationship between
dietary AA intake and biomarkers of exposure. For the urinary biomarkers analysis, the dependent variable was the sum of concentrations of the two main metabolites, NACP and NACP-S (pmol/l). The independent variable was the mean dietary AA (pg/kg bw-day) during the two days or during the month preceding urine sampling. For hemoglobin adducts analysis, the dependent variable was the sum of AAVal and GAVal adduct levels (pmol/g globin), and the independent variable was average daily AA dietary intake during the month preceding blood sampling. Potential confounding factors were age (continuous), gender, second-hand smoke (none, low or high exposure), alcohol intake in the last month (yes or no), parents education (elementary or high school, college, university), country of origin (Canada or other) and school (public or private). Prior to multivariate analyses, bivariate analyses were conducted to evaluate associations between potentially confounding factors and exposure biomarkers. Factors associated with a p value < 0.20 were first selected. Then, the factor with the weakest p value was inserted in the multivariate linear regression model and was kept if it caused the beta coefficient of the relation between AA intake and the biomarker of exposure to vary by more than 10%. The same procedure was applied for all factors initially selected. Urinary creatinine concentration was forced in all urinary biomarker models. Final multivariate models were checked for multicollinearity problems and for normality of residuals. The SAS software version 9 of the SAS system for Windows (Copyright (c) 2002-2008 by SAS Institute Inc., Cary, NC, USA) was used to perform statistical analyses. The statistical significance level for the multivariate analysis was set at 0.05.
Ethics and Confidentiality
The research project was approved by research human ethics committee of the Faculty of Medicine of Université de Montréal (CERFM) and Health Canada.
RESULTS
Characteristics of Teenagers
Table 1 shows the characteristics of our 196 participants. Most of them attended a public high school, were born in Canada and were French speaking. For the parental authority, 80.1% had a college diploma or higher and about half had a household income higher than 60 000$ CAN per year.
Acrylamide Intake
Table 2 shows the AA average daily intake during the 48-h period before biological sample collection and the average daily intake over the last month. Daily AA intakes based on the 2-day food diary were higher than those estimated from the FFQ over the month prior to biological sampling. Detailed results on foods contributing mostly to acrylamide intake in this teenagers group can be found in Normandin et al.22
Urinary Biomarker Concentrations
Concentrations of urinary biomarkers are shown in Table 3. The LC-MS/MS method was sensitive enough to detect CP, NACP, NACP-S and GAMA3 in almost all urine samples. AA was detectable in 20% of samples, GA in 2.6% and GAMA 2 was not detected in any sample. The main metabolites detected were NACP and NACP-S with respective geometric mean concentrations of 81.7 and 39.7 pg/l (31.2 and 14.2 pmol/mol creatinine). Values ranged from 12.0 to 1100.0 pg/l (8.5 - 354.1 pmol/mol creatinine) for NACP and from 11.0 to 690.0 pg/l (4.8 - 207.9 pg/g creatinine) for NACP-S. Other metabolites concentrations were in decreasing order: GAMA 3 > CP = AA ~ GA.
Hemoglobin Adducts with AA and GA
Concentrations of AAVal and GAVal adducts are presented in Table 3. These two adducts were detected in blood samples from all participants in similar concentrations. The geometric mean concentration for AAVal was 45.4 pmol/g globin with a range of 20.7 - 113.5 pmol/g globin. Mean concentration for GAVal was 45.6 pmol/g globin with a range of 12.4 - 132.7 pmol/g globin.
Secondary Smoke Exposure
The distribution of urinary cotinine concentrations (in ng/ml) is shown in Table 3. Cotinine was detected in 67% of urine samples. Among the 195 participants who provided a urine sample, 125 had no secondary smoke exposure (< 6 ng/ml), 56 had a low exposure (> 6 and < 30 ng/ml) and 14 had a relatively high exposure (> 30 ng/ml).
Correlation Between Biomarkers of Exposure
Statistically significant correlations were noted among biomarkers of exposure to AA. The strongest significant correlation was between NACP and NACP-S in urine (r = 0.840; p < 0.0001). AAVal and GAVal adducts were moderately correlated (r = 0.718; p < 0.0001). GAMA3, NACP and NACP-S in urine were also significantly correlated to hemoglobin adducts of AAVal (p < 0.0001) and GAVal (p < 0.05).
Correlation Between AA Intake and Biomarkers of Exposure
The mean daily AA intake during the two days prior to urine sampling was significantly correlated (p < 0.05) to the urinary metabolites CP, NACP, NACP-S and GAMA 3, but not to hemoglobin adducts (AAVal and GAVal), while the mean AA daily intake during the month prior to blood sampling was significantly correlated (p < 0.001) to NACP, NACP-S, GAMA3, AAVal and GAVal, but not to CP (Table 4).
Multivariate Analyses of Associations Between Dietary AA Intake and Biomarkers of Exposure to AA
Multivariate linear regression analyses of the association between dietary AA intake (based on the two-day food diary) and urinary biomarkers of exposure to AA were conducted. Among potentially confounding factors identified in bivariate analyses, only age and parental education level were significantly associated with the sum of urinary NACP and NACP-S concentrations (p < 0.20). However, none was confounding when included in the multivariate models. Urinary creatinine concentration was forced in the model and was significantly associated with the sum of NACP and NACP-S (p < 0.0001). In the final model, the beta coefficient of the relation between AA intake during the two days prior to the biological sampling (log pg/kg bw-day) and the sum of NACP and