Expression de la protéase tissulaire HtrA1 et le
pronostic des femmes atteintes de cancer épithélial de
l’ovaire
Mémoire
Andréanne Gagné
Maîtrise en médecine expérimentale
Maître ès sciences (M.Sc.)
Québec, Canada
Résumé
Introduction : La protéase High Temperature Requirement Factor A1 (HtrA1) pourrait être associée au pronostic du cancer de l’ovaire (CO).
Objectif : Évaluer l’effet de l’expression de HtrA1 dans des tissus tumoraux sur le pronostic des femmes avec un CO séreux.
Méthodes : Une étude de cohorte a été menée chez 122 femmes ayant un CO séreux traitées au CHU de Québec entre 1993-2006. Par immunohistochimie, l’expression de HtrA1 a été mesurée de façon visuelle et informatisée (% noyaux positifs). Des risques relatifs (HR) de progression et de décès ont été estimés avec le modèle de Cox multivarié.
Résultats: Un faible pourcentage de noyaux marqués par HtrA1 était associé à une diminution des risques de progression (visuel HR=0,66, p=0,04, informatique HR=0,63, p=0,03) et de décès (visuel HR=0,69, p=0,09, informatique HR=0,56, p=0,01).
Conclusion : La sous-expression de HtrA1 était associée à un meilleur pronostic des femmes avec un CO séreux.
Abstract
Background: The protease High Temperature Requirement Factor A1 (HtrA1) might be associated with prognosis in ovarian cancer (OC).
Objective: To evaluate the effect of HtrA1 expression in tumoral tissues on prognosis of women with serous OC.
Methods: A cohort study was conducted among 122 women with a serous OC treated at the CHU de Québec between 1993-2006. Tissue microarrays were immunostained for HtrA1. HtrA1 expression was assessed visually and by digital image analysis (% of positive nuclei). Cox regression multivariate models taking into account standard prognostic factors were used to estimate adjusted hazard ratios (HR) of progression and death.
Results: Low percentage of HtrA1 marked nuclei was associated with lower risks of progression (visual HR=0.66, p=0.04, digital HR=0.63, p=0.03) and death (visual HR=0.69, p=0.09, digital HR=0.56, p=0.01). Conclusion: Nuclear downregulation of HtrA1 was associated with a better prognosis in women with serous OC.
Table des matières
Résumé ... III
Abstract ... V
Table des matières ... VII
Liste des tableaux ... IX
Liste des figures ... XI
Liste des abréviations et des sigles ... XIII
Remerciements ... XV
Dédicaces... XVII
Introduction ... 1
1. Importance du cancer de l’ovaire ... 1
Revue de la littérature ... 3
1. Cancer de l’ovaire ... 3
1.1 Épidémiologie du cancer de l’ovaire ... 3
1.2 Cancers épithéliaux de l’ovaire ... 4
1.3 Diagnostic du cancer de l’ovaire ... 7
1.4 Prise en charge et traitement du cancer de l’ovaire ... 7
1.5 Pronostic et facteurs pronostiques standards du cancer de l’ovaire ... 10
1.6 Issues cliniques ... 14
2. Biomarqueur tissulaire : High temperature requirement factor A1 (HtrA1) ... 16
2.1 Généralités sur HtrA1 ... 16
2.2 HtrA1 et le cancer de l’ovaire ... 17
2.3 HtrA1 et le cancer de l’endomètre... 21
2.4 HtrA1 et d’autres cancers ... 22
Objectifs ... 29
1. Objectif principal ... 29
2. Objectif secondaire ... 29
Matériel et méthodes ... 31
1. Devis et population de l’étude ... 31
2. Collecte des données ... 32
2.1 Issues cliniques : Progression et décès ... 32
2.2 Facteurs pronostiques standards du cancer de l’ovaire ... 32
2.3 Expression de la protéase HtrA1 ... 32
3. Définition des variables ... 38
3.2 Variables potentiellement confondantes : facteurs pronostiques standards ... 38
3.3 Variable explicative : expression de la protéase HtrA1 ... 39
4. Analyses statistiques ... 41
4.1 Analyses descriptives ... 41
4.2 Association entre HtrA1 et les facteurs pronostiques standards ... 41
4.3 Association entre HtrA1 et le pronostic des patientes ... 41
4.4 Concordance entre la lecture visuelle et informatisée ... 42
Résultats ... 43
1. Population de l’étude ... 43
2. Lecture visuelle du marquage de HtrA1 ... 45
2.1. Pourcentages de noyaux et de cytoplasmes tumoraux marqués par HtrA1 ... 45
2.2 Intensité des noyaux et des cytoplasmes tumoraux ... 49
2.3 Pourcentages de noyaux marqués par HtrA1 dans le stroma tumoral ... 52
2.4 Intensité du marquage par HtrA1 dans les noyaux du stroma tumoral ... 52
3. Lecture informatisée ... 54
3.1 Pourcentages de noyaux et de cytoplasmes tumoraux marqués par HtrA1 ... 54
3.2 Intensité du marquage par HtrA1 des noyaux et des cytoplasmes tumoraux ... 57
4. Résumé des résultats ... 61
5. Comparatif entre la lecture visuelle et informatisée ... 62
Discussion... 63
1. Rappel des résultats principaux ... 63
2. Forces et faiblesses de l’étude ... 64
3. Plausibilité biologique d’une l’association entre HtrA1 et le pronostic des femmes avec un cancer de l’ovaire ... 66
3.1 Les mécanismes d’action de HtrA1 ... 66
3.2 L’expression différentielle de HtrA1 dans le tissu normal et néoplasique... 66
4. Comparaisons avec les autres études épidémiologiques ... 67
5. Potentielles explications à nos résultats ... 69
5.1 Marquage de HtrA1 selon les compartiments cellulaires tumoraux et du stroma ... 69
5.2 Différentes formes de HtrA1 ... 69
5.3 Réponse à la chimiothérapie en fonction de l’expression de HtrA1 ... 70
Conclusion ... 73
Bibliographie ... 75
Annexe 1 – Méthode informatisée ... 83
Annexe 2 - Résultats ... 85
1. Analyses multivariées chez les patientes avec une tumeur séreuse de haut grade ... 85
1.1 Analyses visuelles ... 85
1.2 Analyses informatisées ... 86
Liste des tableaux
Tableau 1 : Classification histologique des tumeurs primaires épithéliales malignes de l’ovaire selon l’OMS .... 5
Tableau 2 : Modèle dualiste de l’origine des néoplasies ovariennes ... 6
Tableau 3 : Stades du cancer de l’ovaire selon la classification de la FIGO et TNM ... 8
Tableau 4 : Système de gradation tumorale de Silverberg ... 11
Tableau 5 : Définition de la progression après une thérapie de première ligne dans le cancer de l’ovaire selon le GCIG ... 15
Tableau 6 : Résumé du protocole d’immunohistochimie ... 33
Tableau 7 : Distribution des caractéristiques cliniques dans la population d’étude ... 44
Tableau 8 : Distribution du marquage nucléaire et cytoplasmique selon la lecture visuelle (pourcentage) ... 45
Tableau 9 : Association entre le pourcentage de noyaux ou de cytoplasmes marqués et les facteurs pronostiques standards du cancer de l’ovaire selon la lecture visuelle ... 46
Tableau 10 : Association entre l’expression de HtrA1 en pourcentage et le pronostic des femmes selon la lecture visuelle ... 48
Tableau 11 : Distribution du marquage nucléaire et cytoplasmique selon la lecture visuelle (intensité) ... 49
Tableau 12 : Association entre l’intensité du marquage des noyaux ou des cytoplasmes et les facteurs pronostiques standards du cancer de l’ovaire selon la lecture visuelle ... 49
Tableau 13 : Association entre l’intensité du marquage de HtrA1 et le pronostic des femmes selon la lecture visuelle ... 51
Tableau 14 : Distribution du marquage nucléaire dans le stroma (pourcentage) ... 52
Tableau 15 : Distribution du marquage nucléaire dans le stroma (intensité) ... 52
Tableau 16 : Distribution du marquage nucléaire et cytoplasmique par lecture informatisée (pourcentage) .... 54
Tableau 17 : Association entre le pourcentage de noyaux ou de cytoplasmes marqués et les facteurs pronostiques standards du cancer de l’ovaire selon la lecture informatisée ... 54
Tableau 18 : Association entre l’expression en pourcentage de HtrA1 et le pronostic des femmes selon la lecture informatisée ... 57
Tableau 19 : Distribution du marquage nucléaire et cytoplasmique par lecture informatisée (Score H) ... 58
Tableau 20 : Association entre le score H mesuré dans les noyaux ou les cytoplasmes marqués et les facteurs pronostiques standards du cancer de l’ovaire selon la lecture informatisée ... 58
Tableau 21 : Association entre le score H de HtrA1 et le pronostic des femmes selon la lecture informatisée 60 Tableau 22 : Résumé des mesures d’association entre le pourcentage de compartiments cellulaires tumoraux ou de noyaux du stroma marqués par HtrA1 et le pronostic ... 61
Tableau 23 : Résumé des mesures d’association entre l’intensité ou le score H du marquage par HtrA1 dans les compartiments cellulaires tumoraux ou les noyaux du stroma marqués et le pronostic ... 61
Tableau 24 : Association entre le pourcentage de noyaux ou de cytoplasmes marqués par HtrA1 et le pronostic des femmes avec une tumeur de haut grade selon la lecture visuelle ... 85
Tableau 25 : Association entre l’intensité du marquage nucléaire ou cytoplasmique marqués par HtrA1 et le pronostic des femmes avec une tumeur de haut grade selon la lecture visuelle ... 85
Tableau 26 : Association entre le pourcentage de noyaux ou de cytoplasmes marqués par HtrA1 et le pronostic des femmes avec une tumeur de haut grade selon la lecture informatisée ... 86
Tableau 27 : Association entre le score H mesuré dans les noyaux ou les cytoplasmes marqués et le pronostic des femmes avec une tumeur de haut grade selon la lecture informatisée ... 86 Tableau 28 : Association entre le pourcentage de noyaux du stroma marqués par HtrA1 et le pronostic des
femmes ... 87 Tableau 29 : Association entre l’intensité des noyaux du stroma marqués par HtrA1 et le pronostic des
Liste des figures
Figure 1 : Recommandations du NCCN sur le traitement du cancer de l’ovaire ... 9
Figure 2 : Échelle de l’intensité du marquage dans les noyaux tumoraux. ... 34
Figure 3 : Échelle de l’intensité du marquage dans les cytoplasmes tumoraux. ... 35
Figure 4 : Échelle de l’intensité du marquage dans les noyaux du stroma. ... 35
Figure 5 : Organigramme représentant la population de l’étude ... 43
Figure 6A: Survie sans progression des femmes avec un cancer de l’ovaire séreux selon l’expression nucléaire de HtrA1 en pourcentage évaluée par lecture visuelle ... 47
Figure 6B : Survie globale des femmes avec un cancer de l’ovaire séreux selon l’expression nucléaire de HtrA1 en pourcentage évaluée par lecture visuelle ... 47
Figure 7A: Survie sans progression des femmes avec un cancer de l’ovaire séreux selon l’intensité du marquage nucléaire par HtrA1 évaluée par lecture visuelle ... 50
Figure 7B : Survie globale des femmes avec un cancer de l’ovaire séreux selon l’intensité du marquage nucléaire par HtrA1 évaluée par lecture visuelle ... 50
Figure 8A: Survie sans progression des femmes avec un cancer de l’ovaire séreux selon l’expression nucléaire de HtrA1 en pourcentage évaluée par lecture informatisée ... 55
Figure 8B : Survie globale des femmes avec un cancer de l’ovaire séreux selon l’expression nucléaire de HtrA1 en pourcentage évaluée par lecture informatisée ... 56
Figure 9A: Survie sans progression des femmes avec un cancer de l’ovaire séreux selon l’expression nucléaire de HtrA1 mesurée avec le score H évaluée par lecture informatisée ... 59
Figure 9B: Survie globale des femmes avec un cancer de l’ovaire séreux selon l’expression nucléaire de HtrA1 mesurée avec le score H évaluée par lecture informatisée ... 59
Figure 10 : Enseignement des motifs associés aux différentes composantes tumorales. ... 83
Liste des abréviations et des sigles
ARNm Acide RiboNucléique messagerCHU de Québec Centre Hospitalier Universitaire de Québec CT scan Computed Tomography scan
EGFR Epidermal Growth Factor Receptor
FIGO International Federation of Gynecology and Obstetrics GCIG Gynecologic Cancer InterGroup
HDQ Hôtel-Dieu de Québec
HR Hazard Ratio
HtrA1 High Temperature Requirement Factor A1 IC 95% Intervalle de confiance à 95%
IHC Immunohistochimie
kDa Kilodalton
MSSS Ministère de la Santé et des Services Sociaux du Québec NCCN National Comprehensive Cancer Network
OMS Organisation Mondiale de la Santé PCR Polymerase Chain Reaction
RECIST Response Evaluation Criteria In Solid Tumors shRNA Short hairpin RNA
TGF-β1 Transforming Growth Factor Beta 1 TMA Tissue MicroArray
TNM Classification selon l’extension anatomique Tumor, Node, Metastasis XIAP X-linked Inhibitor of Apoptosis Protein
Remerciements
Je tiens d’abord à remercier ma directrice de recherche, Dr Isabelle Bairati, ainsi que mon co-directeur, Dr Bernard Têtu, pour tout le temps qu’ils ont consacré à m’aider à réaliser ce projet. Je les remercie d’avoir cru en moi, alors que je n’étais qu’une jeune étudiante en médecine avec, peut être, un peu trop d’ambition. Leur passion pour la recherche est contagieuse et je suis reconnaissante de la rigueur, de la persévérance et de la patience qu’ils m’ont transmises. Je les remercie surtout de m’avoir donné la chance de comprendre qu’il est possible de conjuguer mes deux passions : la médecine et la recherche. Ils demeureront, pour moi, des mentors exceptionnels.
Un merci tout spécial à Michèle Orain, pour son implication au plan technique et sa grande disponibilité. Je la remercie aussi pour son support. Elle est devenue, avec le temps, plus qu’une collègue, mais une amie qui a su toujours écouter mes inquiétudes et trouver le bon mot. J’espère pouvoir la côtoyer encore longtemps. Je désire aussi souligner l’implication de Dr Dominique Trudel. Je la remercie de m’avoir enseigné les rudiments de la lecture des immunohistochimies, de m’avoir épaulée dans cette lecture, mais surtout de m’avoir transmis une partie de sa passion pour la pathologie.
Merci au Dr Patrice Desmeules, pour le partage de ses expériences en lecture informatisée. Merci aussi à Stéphane Turcotte qui a réalisé les analyses statistiques. Leur bonne humeur et leur patience ont été plus que précieuses. Merci aussi à Marie Plante, Jean Grégoire et Dimcho Bachvarov qui ont travaillé à la mise en œuvre du projet.
Un gros merci à la Faculté de Médecine de l’Université Laval pour leur soutien financier en m’accordant la bourse Coup de Cœur pour l’admission à la maîtrise. Merci aussi à la Société de recherche sur le cancer qui a fourni les fonds qui ont servi à la mise en œuvre de ce projet.
Je veux aussi remercier mes parents, Sylvie et Claude, qui m’ont encouragé à persévérer et à croire qu’il est important de faire ce que l’on aime. Mais surtout, merci à Alexis, qui en plus de m’accompagner dans la vie, m’a offert support autant moral que dans mes choix personnels.
Mais le plus grand des mercis, je le dois aux femmes qui ont accepté de participer à cette étude, ainsi qu’à celles que j’ai eu la chance de côtoyer lors de mes stages d’externe en médecine. Les savoir et les voir fortes m’a donné la motivation de terminer ce projet. J’espère qu’un jour, nous arriverons à dire qu’un diagnostic de cancer de l’ovaire n’est plus une fatalité comme ça l’est encore aujourd’hui.
Dédicaces
À Alexis et à la chouette petite vie que l’on mène ensemble.
Introduction
1. Importance du cancer de l’ovaire
Environ 2700 femmes canadiennes en 2014 recevront un diagnostic de cancer de l’ovaire, ce qui représente environ 2,9% des nouveaux cas de cancers chez la femme(1). Cela en fait le 8e cancer le plus fréquent chez
la femme et le 2e parmi les cancers gynécologiques. Malgré sa faible incidence, le cancer de l’ovaire est un
problème de santé important, car son taux de mortalité est élevé. La Société canadienne du cancer estime le nombre de décès liés au cancer de l’ovaire à 1750 en 2014, soit 4,7% de tous les décès par cancer. Ainsi, le cancer de l’ovaire est le néoplasme d’origine gynécologique le plus fatal. Ce taux de mortalité élevé s’explique, d’une part, par le fait qu’environ 80% des femmes reçoivent leur diagnostic à des stades avancés et, d’autre part, parce que le traitement n’occasionne une rémission complète que dans 50% des cas chez les femmes avec un cancer de stade avancé(2-4). La survie à 5 ans est d’environ 45% pour l’ensemble des patientes, stades et types histologiques confondus(5).
Une des stratégies en vue d’améliorer la survie des femmes atteintes du cancer de l’ovaire est l’amélioration de la prédiction du pronostic par rapport à celui obtenu grâce aux facteurs pronostiques déjà connus. Ces facteurs pronostiques standards sont l’âge, le stade TNM ou FIGO, le type histologique, le grade tumoral, le CA-125 sérique, et la présence de tumeur résiduelle(6). Une meilleure connaissance du pronostic permettrait d’offrir un suivi plus personnalisé aux femmes, en fonction de leur risque de progression et de décès(7). Par ailleurs, certains marqueurs pronostiques pourraient aussi avoir une valeur prédictive. Une meilleure connaissance des marqueurs prédictifs permettrait de mieux sélectionner les femmes qui ne répondront pas à la chimiothérapie standard afin de leur offrir d’autres modalités de prise en charge(8). De plus, de nouveaux marqueurs pronostiques peuvent mener à une meilleure compréhension de la biologie du cancer de l’ovaire, pour l’instant fort méconnue(7).
La recherche de facteurs pronostiques a généré de nombreux travaux et beaucoup de marqueurs biologiques ont été identifiés comme potentiellement prometteurs(8). Or, depuis la découverte du CA-125, aucun marqueur n’a franchi l’étape de l’utilisation en clinique. Plusieurs études suggèrent que la protéase High-Temperature Requirement Factor A1 (HtrA1) pourrait être un facteur pronostique prometteur.
Revue de la littérature
1. Cancer de l’ovaire
1.1 Épidémiologie du cancer de l’ovaire
Au Canada, on estime que le cancer de l’ovaire affectera 2700 femmes en 2014, dont 690 au Québec(1). Cela représente un taux d’incidence normalisé pour l’âge de 10,8 cas par 100 000 personnes au pays. Ce taux a légèrement diminué dans les dernières années. Effectivement, entre 2001 et 2010, la variation annuelle du pourcentage du taux d’incidence du cancer de l’ovaire a diminué de 1,1% et cette différence est statistiquement significative. Le cancer de l’ovaire représentera 2,9% des nouveaux cas de cancers féminins en 2014. Cela en fait le 8e cancer le plus fréquent chez la femme, mais le 2e parmi les cancers
gynécologiques, derrière le cancer du corps de l’utérus. Dans le monde, 224 747 femmes atteintes d’un cancer de l’ovaire ont été recensées en 2008, correspondant à une incidence de 6,3 cas par 100 000 personnes(9). Le taux d’incidence de ce néoplasme varie en fonction de la région d’origine dans le monde. Il est plus bas au sud-est de l’Asie et en Afrique et plus élevé au nord-ouest européen(10).
Malgré la faible incidence du cancer de l’ovaire, cette maladie demeure un problème de santé préoccupant puisque le taux de mortalité est élevé(1). On estime que 1750 femmes canadiennes décèderont de la maladie en 2014, dont 400 au Québec, ce qui équivaut à un taux de mortalité normalisé pour l’âge de 6,4 pour 100 000 habitantes. Ce taux normalisé a diminué de manière significative durant les vingt dernières années, passant de 8,4 à 6,4 pour 100 000 habitantes. Toujours en 2014, au Canada, on estime que le cancer de l’ovaire sera responsable de 4,7% des décès par cancer, ce qui en fait le néoplasme d’origine gynécologique le plus fatal. À l’échelle mondiale, 140 163 femmes sont décédées en 2008 de la maladie(9).
Le taux de mortalité élevé du cancer de l’ovaire s’explique, entre autres, par le fait que 80% des femmes reçoivent leur diagnostic à des stades plus avancés (II, III et IV) où la tumeur n’est plus limitée à l’ovaire(2). À ces stades, le traitement n’occasionne une rémission complète que dans 50% des cas(3). La survie à 5 ans est environ de 45%, tous stades confondus(5). Bien qu’il existe des algorithmes qui combinent les valeurs de divers marqueurs biologiques, très peu de tests ou d’examens diagnostiques reconnus en pratique clinique sont utilisés pour diagnostiquer la maladie à un stade précoce(11).
1.2 Cancers épithéliaux de l’ovaire
1.2.1 Ovaire normalLes ovaires sont des organes situés dans le pelvis, de chaque côté et légèrement en postérieur de l’utérus, derrière le ligament large de l’utérus mais devant le rectum(12). Organes du système reproducteur féminin, ils sont le site de maturation des ovocytes jusqu’à l’ovulation et ont une fonction endocrine via la production d’estrogènes et de progestérone. Ils sont régulés par l’hypophyse par le biais des hormones lutéinisante et folliculostimulante de façon synchrone avec l’endomètre. D’un point de vue histologique, l’ovaire normal est composé d’un mésothélium, généralement nommé épithélium, d’un stroma qui permet la croissance et la maturation des ovocytes et d’une membrane basale séparant les deux structures(13). Le stroma contient des cellules stromales semblables à des fibroblastes dans une matrice de substance fondamentale et de fibres de collagène. Le stroma est composé, de la périphérie vers le centre, de la tunica albuginea fibreuse, du cortex contenant les follicules à divers stades de maturation et de la médulla très vascularisée où convergent des branches de l’artère utérine. L’épithélium ovarien est composé d’une couche de cellules mésothéliales cuboïdes ou pavimenteuses et forme une couche continue avec les cellules mésothéliales du péritoine.
1.2.1 Généralités sur le cancer de l’ovaire
Plusieurs types de masses peuvent être retrouvés sur l’ovaire. Chez les femmes plus jeunes, généralement entre 20 et 45 ans, la majorité des masses ovariennes s’avèrent être bénignes, soit environ 80%(14). Les tumeurs malignes, quant à elles, sont plus rares chez les patientes jeunes mais le taux d’incidence de ces néoplasmes augmente avec l’âge. En effet, environ 80% de tous les cancers épithéliaux malins de l’ovaire surviennent chez les femmes âgées de plus de 45 ans(15).
Les tumeurs malignes de l’ovaire peuvent se développer à partir des tissus normaux de quatre structures de l’ovaire: les cellules germinales, les cordons sexuels, l’épithélium ou le stroma(14). Les métastases provenant d’un cancer primaire non-ovarien, les tumeurs de Krukenberg, constituent une catégorie à part tout comme les tumeurs non classifiées. Les néoplasmes épithéliaux représentent la proportion la plus importante des tumeurs malignes soit environ 90% de celles-ci. Le reste du travail portera sur ce type de tumeurs.
1.2.2 Types histologiques des néoplasmes épithéliaux
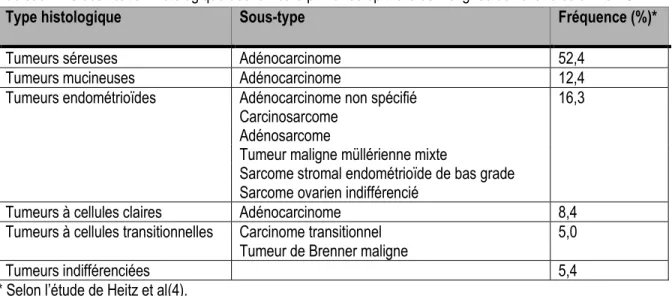
L’Organisation Mondiale de la Santé (OMS) classe les tumeurs primaires épithéliales malignes de la manière suivante(10) :
Tableau 1 : Classification histologique des tumeurs primaires épithéliales malignes de l’ovaire selon l’OMS
Type histologique Sous-type Fréquence (%)*
Tumeurs séreuses Adénocarcinome 52,4
Tumeurs mucineuses Adénocarcinome 12,4
Tumeurs endométrioïdes Adénocarcinome non spécifié 16,3
Carcinosarcome Adénosarcome
Tumeur maligne müllérienne mixte
Sarcome stromal endométrioïde de bas grade Sarcome ovarien indifférencié
Tumeurs à cellules claires Adénocarcinome 8,4
Tumeurs à cellules transitionnelles Carcinome transitionnel 5,0 Tumeur de Brenner maligne
Tumeurs indifférenciées 5,4
* Selon l’étude de Heitz et al(4).
Cette classification se base essentiellement sur des caractéristiques histologiques et ne tient pas compte de l’origine et du développement tumoral du cancer de l’ovaire. Elle présuppose que les néoplasmes ovariens des différents types histologiques sont tous d’origine épithéliale. Or, de récentes études suggèrent que le cancer de l’ovaire devrait être considéré comme des néoplasmes de différentes origines. En effet, on observe des différences majeures en ce qui concerne le pronostic, la présentation clinique, la réponse à la chimiothérapie et l’expression génique entre les différents types histologiques(16, 17).
1.2.2.1 Origine des néoplasmes ovariens
L’hypothèse concernant la carcinogenèse qui a longtemps prévalu implique une origine épithéliale au cancer de l’ovaire. Après l’ovulation, il arriverait que quelques cellules épithéliales se retrouvent enclavées dans le stroma pour former des kystes d’inclusion(18). Ces cellules seraient stimulées par les hormones sexuelles ou par l’inflammation causée par la formation du kyste pour évoluer vers une lésion bénigne, puis une lésion borderline et ensuite maligne. Cette théorie est difficile à prouver puisque les patientes se présentent majoritairement à des stades avancés où les lésions précancéreuses sont difficiles à identifier. Par contre, si les lésions évoluaient selon le continuum suggéré, une tumeur borderline et une tumeur maligne pourraient être observées simultanément chez une même patiente, mais cette trouvaille est très rare en réalité(19). Les recherches concernant les lésions d’origine du cancer de l’ovaire ont mené à de nouvelles théories de la carcinogenèse ovarienne. Selon ces théories, des origines différentes au cancer de l’ovaire sont attribuées en fonction du type histologique. D’abord, le carcinome séreux de haut grade proviendrait de l’implantation de cellules de carcinome séreux de la trompe de Fallope sur l’ovaire (16, 19, 20). En effet, les carcinomes localisés dans les fimbriae des trompes de Fallope ont une apparence histologique très semblable à celle des
carcinomes ovariens séreux de haut grade. Par ailleurs, ces deux carcinomes présentent la même mutation du gène TP53, ce qui laisse croire à une relation clonale entre les deux néoplasmes(19). De plus, le profil d’expression des gènes des tumeurs séreuses ovariennes de haut grade est plus près de celui de l’épithélium de la trompe de Fallope que de celui de l’épithélium ovarien. Par contre, cette théorie ne peut expliquer l’apparition de tous les cas de carcinome séreux puisque ces derniers ne sont associés que dans 50% des cas à des carcinomes séreux de la trompe de Fallope (16, 19). Quant aux carcinomes à cellules claires et endométrioïdes, ils proviendraient de lésions d’endométriose. En effet, les kystes d’endométriose ont des anomalies moléculaires qui activent des voies oncogéniques. En ce qui a trait aux tumeurs mucineuses, leur ressemblance avec les cellules gastro-intestinales permet de supposer qu’elles se développeraient à partir des cellules épithéliales transitionnelles localisées à la jonction tubo-péritonéale.
Plus récemment, Kurman et Shih ont proposé une nouvelle classification qui regroupe les tumeurs ovariennes en deux types(21). Ce modèle « dualiste » ou à « deux tiers », tel que nommé par les auteurs, est présenté dans le tableau ci-dessous. Il regroupe les tumeurs en tenant compte à la fois des théories précédemment discutées concernant les lésions précancéreuses, mais aussi des caractéristiques génétiques et cliniques. Tableau 2 : Modèle dualiste de l’origine des néoplasies ovariennes
Caractéristique Type 1 Type 2
Type histologique Tumeurs séreuses de bas grade
Tumeurs endométrioïdes de bas grade
Tumeurs à cellules claires Tumeurs mucineuses
Tumeurs séreuses de haut grade
Tumeurs endométrioïdes de haut grade
Carcinosarcomes Carcinomes indifférenciés
Origine Tumeurs borderline
Lésions d’endométriose
Carcinomes de la trompe de Fallope Présentation clinique Masses larges et impliquant un ovaire
Présentation à un stade précoce Indolentes et à bon pronostic Moins fréquentes que type 2
Présentation à un stade avancé Croissance rapide
Agressives de mauvais pronostic Plus fréquentes que type 1 (75%)
Génétique Génétiquement stable
Multiples mutations (KRAS, BRAF, PTEN, PIK3CA, CTNNB1, ARID1A, PPP2R1A)
Rare mutation de TP53
Génétiquement instable Mutation TP53 (95% des cas) Inactivation BRCA fréquente
Taux de survie sans progression à 2 ans* (Type 1 vs type 2, p=0,003)
59,8% (46,1-73,4%) 44.9% (39,6-50,5%)
Taux de survie à 5 ans* (Type 1 vs type 2, p=0,021)
56,3% (38,3-84,0%) 39,3% (32,6-46,0%)
1.3 Diagnostic du cancer de l’ovaire
La présentation clinique des femmes avec un néoplasme ovarien est peu spécifique. Les symptômes les plus fréquents sont la distension de l’abdomen, l’inconfort abdominal, la dyspepsie, la satiété précoce, la pollakiurie et une perte de poids(3, 23). Ces symptômes se présentent de manière insidieuse des mois avant le diagnostic et sont, le plus souvent, trop peu spécifiques pour qu’un clinicien ne considère d’emblée le diagnostic de cancer de l’ovaire. C’est souvent lorsque la distension abdominale s’accentue, en lien avec la production d’ascite et l’extension importante de la maladie, que la démarche diagnostique d’un néoplasme ovarien est entreprise. Ces femmes auront une évaluation échographique ou par Computed Tomography Scan (CT scan) et une image de kyste complexe sera hautement suspecte d’une masse cancéreuse(3). La mesure du taux sérique de CA-125 chez ces femmes est élevée chez environ 80% d’entre elles. Le diagnostic final ne se fait qu’après la chirurgie par l’évaluation histopathologique de la masse.
1.4 Prise en charge et traitement du cancer de l’ovaire
La prise en charge d’une patiente avec une forte suspicion de cancer de l’ovaire se fait en deux étapes. D’abord, la chirurgie de réduction tumorale permet de réaliser le bilan d’extension de la maladie afin d’établir le stade et le diagnostic pathologique(23). Ensuite, le meilleur choix de traitement se fait en tenant compte de certains autres facteurs cliniques dont le type histologique et le stade. Au final, le traitement standard comprend une chirurgie cytoréductrice, faite au moment du bilan d’extension, ainsi qu’une chimiothérapie adjuvante à base de platine, tout dépendamment du stade.
1.4.1 Stade du cancer de l’ovaire
L’établissement du stade de la maladie se fait de manière chirurgicale par laparoscopie ou laparotomie(24). Comme le cancer de l’ovaire se dissémine habituellement de manière intrapéritonéale et par voie lymphatique, le bilan d’extension de la maladie doit nécessairement comprendre une évaluation attentive du péritoine et des ganglions(23-25). Une biopsie doit être nécessairement prise de toute lésion suspecte sur l’épiploon, du mésentère, du foie, du diaphragme, du pelvis et des ganglions para-aortiques(24, 25). L’aspiration du liquide péritonéal ou des lavages intrapéritonéaux en l’absence d’ascite sont faits pour déterminer s’il y a une dissémination en cytologie. Une investigation des poumons comprenant une radiographie et une ponction du liquide pleural peut être faite au besoin(24).
Le stade est ensuite déterminé suivant la classification de la Fédération Internationale de Gynécologie et d’Obstérique (FIGO)(24) :
Tableau 3 : Stades du cancer de l’ovaire selon la classification de la FIGO et TNM
FIGO Description TNM
Tumeur primaire ne peut être évaluée. TX
Pas d’évidence de la présence d’une tumeur primaire. T0
I Tumeur limitée aux ovaires. T1
IA Tumeur limitée à un ovaire; capsule intacte, pas de tumeur sur la surface ovarienne, pas de cellules malignes dans l’ascite ou les lavements péritonéaux.
T1a IB Tumeur limitée aux deux ovaires; capsule intacte, pas de tumeur sur la surface
ovarienne, pas de cellules malignes dans l’ascite ou les lavements péritonéaux.
T1b IC Tumeur limitée à un ou deux ovaires avec une des caractéristiques suivantes :
rupture de la capsule ovarienne, tumeur sur la surface ovarienne, cellules malignes dans l’ascite ou dans les lavements péritonéaux.
T1c
II Tumeur incluant un ou deux ovaires avec extension pelvienne. T2 IIA Extension et/ou implants sur l’utérus et/ou les trompes de Fallope, pas de cellules
malignes dans l’ascite ou les lavements péritonéaux.
T2a IIB Extension à d’autres tissus pelviens, pas de cellules malignes dans l’ascite ou les
lavements péritonéaux.
T2b IIC Extension pelvienne comme T2a ou T2b avec cellules malignes dans l’ascite ou les
lavements péritonéaux.
T2c III Tumeur incluant un ou deux ovaires avec une métastase péritonéale, en dehors du
pelvis et/ou une métastase dans les ganglions lymphatiques régionaux. Confirmation microscopique nécessaire.
T3 et/ou N1 IIIA Métastase péritonéale microscopique au-delà du pelvis. T3a IIIB Métastase péritonéale macroscopique au-delà du pelvis de 2 cm ou moins dans sa
dimension la plus grande.
T3b IIIC Métastase péritonéale au-delà du pelvis de plus de 2 cm dans sa plus grande
dimension et/ou une métastase dans les ganglions lymphatiques régionaux.
T3c et/ou N1 IV Métastase à distance (excluant les métastases péritonéales) M1
1.4.2 Chirurgie de réduction tumorale
La chirurgie de réduction tumorale a pour but de laisser le moins possible de tumeur résiduelle en retirant toutes les lésions opérables et la plus grande partie des tumeurs non complètement résécables. Elle inclut donc la résection de la masse ovarienne ainsi qu’une hystérectomie et une salpingo-ovariectomie bilatérale(23-25). De plus, toute lésion sur le mésentère, le foie, le diaphragme, le pelvis et les ganglions para-aortiques est réséquée si possible. L’épiploon est, quant à lui, presque systématiquement retiré puisque des lésions non visibles macroscopiquement y sont souvent trouvées. Cette chirurgie se fait de façon simultanée à l’établissement du stade de la maladie.
1.4.3 Chimiothérapie adjuvante
Deux revues systématiques Cochrane ont étudié les différentes possibilités de traitement chez les patientes à différents stades du cancer de l’ovaire. La première concerne les cancers de stade précoce (I et II) et conclut à la nécessité d’une chimiothérapie adjuvante à base de platine chez toutes ces patientes sauf celles ayant une tumeur de stade 1A ou 1B avec un grade de Silverberg de 1(26). Quant à la seconde revue systématique qui concerne les patientes ayant un stade plus avancé (II, III et IV), elle montre que la chimiothérapie adjuvante avec un agent à base de platine augmente sensiblement la survie (HR=0,88, Intervalle de confiance [IC 95%]=0,79-0,98) par rapport à la même chimiothérapie sans platine(27). Quant au choix de l’agent à base de platine, il n’y avait pas de différence significative sur la survie entre l’utilisation de la cisplatine ou de la carboplatine. Ces résultats ont été pris en compte dans les recommandations du National Comprehensive Cancer Network (NCCN), un regroupement de 23 centres experts mondiaux qui publie des guides de médecine factuelle(28). Selon le NCCN, la majorité des femmes atteintes d’un cancer de l’ovaire devrait recevoir un traitement de chimiothérapie intraveineuse à base de taxane et de carboplatine après la chirurgie, sauf celles qui ont un cancer de stade IA ou 1B avec un grade 1 de Silverberg. Un traitement de chimiothérapie intrapéritonéale devrait être considéré pour les femmes de stade plus avancé (II, III et IV). Le schéma suivant, tiré intégralement des recommandations du NCCN, résume les lignes du traitement du cancer de l’ovaire après la chirurgie initiale(28):
Figure 1 : Recommandations du NCCN sur le traitement du cancer de l’ovaire Stade IA ou IB
Stade IC
Stade II, III et IV
Grade 1 Grade 2 Grade 3 ou cellules claires Grade 1, 2 ou 3 Observation
Observation ou chimiothérapie intraveineuse (taxane/carboplatine) pour 3-6 cycles Chimiothérapie intraveineuse (taxane/carboplatine) pour 3-6 cycles Chimiothérapie intraveineuse (taxane/carboplatine) pour 3-6 cycles Chimiothérapie:
- Stade II et III avec tumeur résiduelle < 1 cm : intrapéritonéale
- Autres: chimiothérapie intraveineuse (6-8 cycles) Complétion de la chirurgie lorsqu’indiqué par la réponse tumorale et le potentiel de résécabilité Grade 1, 2 ou 3
Le Gynecologic Cancer Intergroup (GCIG), quant à lui, émet des directives pour la tenue d’essais cliniques. Il considère aussi que le traitement standard à utiliser dans un groupe de comparaison dans les essais cliniques doit être, pour les tumeurs de stade avancé, la chimiothérapie à base de taxane et de platinum administrée à toutes les trois semaines pour 6 cycles(29).
1.5 Pronostic et facteurs pronostiques standards du cancer de l’ovaire
Le pronostic des femmes avec un cancer de l’ovaire demeure plutôt sombre, et ce, même si la survie à 5 ans s’est légèrement améliorée dans les dernières années. La survie à 5 ans est passée de 30,1% entre 1969 et 1972 à 49,7% entre 1999 et 2001, tous stades confondus dans la cohorte mondiale de Heitz et al.(4). Cette progression était moins marquée dans la cohorte de 1540 femmes danoises de Grann et al. où la survie à 5 ans est passée de 37% entre 2000 et 2002 à 39% entre 2009 et 2011(30). Différents facteurs liés à la patiente et aux caractéristiques de la maladie influent sur l’issue clinique des femmes atteintes d’un cancer de l’ovaire.
1.5.1 Facteurs pronostiques liés au cancer de l’ovaire
1.5.1.1 Stade FIGO
Le stade est la variable la plus importante pour le choix du traitement selon l’algorithme de la section précédente. Cela découle du fait que le stade est le facteur pronostique le plus important dans le cancer de l’ovaire. Effectivement, la survie varie de façon inverse avec le stade comme l’illustre les données de l’étude de Heintz et al. comprenant 4825 patientes(4). Comparées à la survie à 5 ans des patientes de stade Ia, les patientes de stade IIa, IIIa et IV avaient un rapport de risque (hazard ratio) de décès respectivement de 1,8 (IC 95%=1,1-3,0), 4,0 (IC 95%=2,9-5,4) et 8,9 (IC 95%=7,2-11,0). Tingulstad et al. sur 571 femmes suivies pendant 10 ans ont montré que le stade demeurait un facteur pronostique dans un modèle multivarié contenant l’âge et la tumeur résiduelle(31). En référence aux femmes avec une tumeur de stade I, les femmes de stade II, III et IV avaient respectivement un rapport de risque (hazard ratio) de décès de 4,25 (IC 95%=2,51-7,20), 8,03 (IC 95%=5,04-12,77) et 11,75 (IC 95%=6,99-19,76).
1.5.1.2 Type histologique
Le type histologique est généralement considéré comme un facteur pronostique même si son effet sur l’issue clinique des patientes n’est pas retrouvé dans les études de manière constante(32). Dans les travaux de Hosono et al. sur 294 femmes avec une tumeur de stade III ou IV, les patientes avec une tumeur séreuse
(n=220) survivaient significativement plus longtemps que celles avec une tumeur d’un autre type histologique, soit mucineux, endométrioïde ou à cellules claires (taux de survie à 5 ans chez les séreux de 37,0% versus 8,5% chez les non-séreux, p<0,001). Au contraire, Heintz et al. ont montré que le taux de survie à 5 ans était plus faible chez les femmes avec une tumeur séreuse ou indifférenciée (41,0 et 36,3%) que chez celles avec une tumeur mixte épithéliale, à cellules claires, endométrioïde ou mucineuse (respectivement 55,6%, 63,6%, 64,8% et 65,4%)(4). Dans la même étude, lorsque ces données prenaient en compte l’âge et le stade tumoral, les différences sur la survie entre les divers types histologiques s’estompaient. En effet, lorsque l’on comparait avec les femmes ayant une tumeur séreuse, les seules femmes qui avaient un risque de décès plus élevé étaient celles avec une tumeur à cellules claires ou indifférenciées. Elles survivaient significativement légèrement moins bien à cinq ans avec des rapports de risque (hazard ratio) de décès respectivement de 1,4 (IC 95%=1,2-1,7) et 1,3 (IC 95%=1,1-1,5).
1.5.1.3 Grade tumoral
Le système de gradation tumorale dans le cancer de l’ovaire le plus utilisé est celui proposé par Silverberg(33). Trois caractéristiques tumorales sont considérées dans ce système. D’abord, l’organisation architecturale du néoplasme est déterminée selon le motif tumoral prédominant. Ensuite, le pléomorphisme est déterminé selon la régularité de la taille du noyau, le ratio noyau/cytoplasme et la présence d’une chromatine agglutinée ou d’un nucléole proéminent. Il est mesuré dans une zone avec le plus haut degré d’atypie nucléaire. Puis, l’activité mitotique est obtenue par le décompte des cellules en métaphase, anaphase ou en télophase dans un minimum de 30 champs en ne retenant que les 10 champs avec le plus grand nombre de cellules en mitose. Le tableau suivant est utilisé pour le calcul final du grade :
Tableau 4 : Système de gradation tumorale de Silverberg
Score Organisation architecturale Pléomorphisme Nombre de cellules en mitose / 10 champs
1 Glandulaire Peu 0-9
2 Papillaire Modéré 10-24
3 Solide Marqué ≥ 25
L’addition du score pour chaque caractéristique donne un résultat de 3 à 9. Un score de 3 à 5 équivaut à une tumeur de grade 1, un score de 6 ou 7 à un grade 2 et un score de 8 et 9 à un grade 3.
Silverberg a testé son échelle de gradation sur une série de 461 femmes et a trouvé que le grade était un facteur pronostic pour tous les types histologiques de cancer épithélial de l’ovaire sauf pour le carcinome à cellules claires(33, 34). Lors d’analyses multivariées, menées avec des tumeurs de stade III et IV, incluant le statut de performance, la tumeur résiduelle, la réponse à la chimiothérapie, le grade de Silverberg demeurait un facteur pronostique. Sato et al. ont aussi trouvé que le grade était un facteur pronostique chez 70 femmes,
ayant des tumeurs de type séreux, mucineux, endométrioïde et à cellules claires(35). Le taux de survie à 5 ans était de 91% pour les grades 1, de 65% pour les grades 2 et de 36% pour les grades 3. Les analyses multivariées réalisées comprenant le stade FIGO et le type histologique ont montré que le grade demeurait un facteur pronostique (HR=1,00 pour les grades 1, HR=2,64 pour les grade 2 et HR=8,06 pour les grades 3, p<0,001).
Par contre, la valeur pronostique du grade tumoral n’a pas été trouvée dans toutes les études. Malpica et al. n’avaient pas pu trouver d’association avec le pronostic dans leur cohorte de 100 tumeurs séreuses(36). Kommoss et al. n’avaient pas non plus réussi à montrer que le grade était lié à la survie dans leur cohorte de 302 patientes atteintes d’un cancer épithélial de l’ovaire de type séreux, mucineux, endométrioïde, à cellules claires, indifférenciés ou à cellules transitionnelles (taux de survie à 5 ans : 36,7% pour les grade 1, 31,9% pour les grade 2, 29,7%, pour les grade 3 p=0,92)(37).
1.5.1.4 Tumeur résiduelle
La taille de la tumeur résiduelle après la chirurgie de réduction tumorale est un facteur pronostique à considérer. Ce facteur serait encore plus important chez les femmes dont le stade est avancé(38). Il est reconnu que la taille de la tumeur résiduelle est inversement proportionnelle à la survie(39). Actuellement, le Gynecologic Oncology Group définit la tumeur résiduelle optimale lorsque cette dernière comprend des nodules de 1 cm de diamètre ou moins(40). Une publication Cochrane sans méta-analyse, ne comprenant qu’une seule étude de cohorte sur 194 femmes de tout stade de cancer de l’ovaire, a montré que les femmes n’ayant qu’une tumeur résiduelle microscopique n’avaient pas un avantage significatif sur leur survie par rapport aux femmes ayant une tumeur résiduelle de moins de 1 cm (HR brut=0,72, IC 95%=0,51-1,02) et cette association demeurait similaire lorsque les facteurs pronostiques standards étaient pris en compte (HR=0,64, IC 95%=0,40-1,04)(41). Dans une méta-analyse Cochrane, ne retenant que des études menées chez des femmes avec un cancer de stade III ou IV, le risque de décès des femmes qui avaient eu une chirurgie sous-optimale avec une tumeur résiduelle de plus de 1 cm était significativement augmenté par rapport à celles qui avaient une tumeur résiduelle de moins de 1 cm (HR=1,36, IC 95%=1,10-1,68)(40). De plus, les femmes qui avaient une tumeur résiduelle visible de moins de 1 cm avaient un risque de décès significativement plus élevé que celui des femmes avec une tumeur résiduelle microscopique (HR=2,20, IC 95%=1,90-2,54), contrairement à la première publication Cochrane.
1.5.1.5 CA-125
Le CA-125 est une glycoprotéine sécrétée par les cellules cancéreuses ovariennes(42). Il est le seul marqueur sérique actuellement utilisé de routine pour la prise en charge du cancer de l’ovaire(43). Sa valeur est proportionnelle au volume de la lésion. Il est utilisé, entre autres, pour le suivi de la présence des lésions résiduelles suite à la chirurgie cytoréductrice et de celles trop petites pour être visualisées par les techniques d’imagerie courantes. C’est pourquoi on utilise le CA-125 surtout pour évaluer la réponse de la tumeur à la chimiothérapie (43, 44). D’autre part, les mesures répétées de ce marqueur au cours du suivi des patientes permettent d’observer les augmentations de la valeur du CA-125 qui sont corrélées avec une progression de la maladie dans 90% des cas. Par ailleurs, la persistance d’un taux élevé de CA-125 en post-opératoire est associée à une maladie de nature néoplasique persistante. De ce fait, le GCIG inclut la valeur du CA-125 dans ses critères pour l’évaluation de la réponse au traitement et de la progression de la maladie (voir section 1.6 sur les issues cliniques)(45)
Par contre, la mesure du CA-125 n’est pas parfaite. La normalisation de la valeur du CA-125 n’équivaut pas dans tous les cas à l’absence de maladie résiduelle après la chimiothérapie(46). De plus, une élévation du CA-125 lors du suivi, surtout si la valeur du marqueur avant l’élévation est faible, ne signifie pas toujours une récidive(46). Certaines tumeurs ovariennes n’expriment même pas le CA-125 à des taux sériques mesurables(44). De plus, d’autres conditions peuvent élever la valeur du CA-125 et compliquer l’interprétation des résultats telles que des conditions bénignes de l’ovaire et d’autres cancers comme celui de l’endomètre, du poumon, du sein, du pancréas et du côlon.
Bien que le CA-125 soit surtout utilisé pour interpréter la réponse tumorale au traitement, la valeur de ce marqueur en post-opératoire peut aussi être utilisée comme facteur pronostique. De façon générale, une diminution majeure du CA-125 après la chirurgie, tous types histologiques confondus, est associée à une plus longue survie, tout comme une régression durant le traitement de chimiothérapie ou suite à la chimiothérapie (42, 43). L’association entre une faible valeur du CA-125 après la chimiothérapie et un meilleur pronostic a aussi été trouvée chez les patientes avec des tumeurs ovariennes de type histologique plus rare, soit les tumeurs mucineuses et à cellules claires(47). Quant à la mesure du CA-125 en préopératoire, elle n’est pas toujours associée au pronostic (32, 43). Dans les cohortes de femmes de stade plus précoce (stade I), Hogdall rapporte que plusieurs études semblent montrer que la valeur du CA-125 en préopératoire est un facteur pronostique indépendant(43). Par contre, cela semble moins clair dans les cohortes de femmes de tous stades. Suite à des analyses multivariées, Cooper et al. ont trouvé que la valeur du CA-125 en préopératoire était un facteur pronostique indépendant dans leur cohorte de 142 patientes(48). Par contre, Hogdall et al.
n’ont pas trouvé d’association, dans leur cohorte de 240 patientes, entre la valeur du marqueur en préopréatoire dichotomisée à la médiane et le pronostic après des analyses multivariées.(49)
1.5.2 Facteurs pronostiques liés à la patiente
1.5.2.1 Âge
L’âge est aussi un facteur pronostique classique du cancer de l’ovaire. En effet, plus l’âge de la patiente est élevé au moment du diagnostic, moins bon est le pronostic. Dans l’étude de Heintz et al. menée sur 4933 patientes, la survie à 5 ans des patientes ayant entre 30 et 39 ans était de 67,3%, entre 40 et 49 ans, de 62,1%, entre 50 et 59 ans, de 53,2%, entre 60 et 69 ans, de 44,0%(4). Quant aux femmes ayant entre 70 et 79 ans, leur survie à 5 ans était de 33,3% et celle des femmes âgées de plus de 80 ans était de 23,0%.
1.6 Issues cliniques
Deux issues cliniques sont classiquement utilisées pour étudier le pronostic : la progression du cancer et le décès. Ce sont ces deux issues cliniques qui seront considérées dans cette étude.
Les critères du GCIG concernant la progression du cancer prennent en compte à la fois la valeur du CA-125 et les critères du Response Evaluation Criteria In Solid Tumors (RECIST)(50, 51). Ils sont présentés dans le tableau 5, tiré intégralement des recommandations du GCIG(51) :
Tableau 5 : Définition de la progression après une thérapie de première ligne dans le cancer de l’ovaire selon le GCIG Groupe de patientes* A B C Maladie mesurable ou non mesurable
Augmentation de 20% de la somme des diamètres les plus longs de la tumeur par rapport à la mesure de base
Ou
Toute nouvelle lésion (mesurable ou non mesurable)
N.B. La date de progression de la maladie est la date de documentation de l’augmentation de la taille de la maladie existante ou celle de la visualisation de nouvelles lésions
Et/ou
A B C
CA-125 CA-125 ≥ 2x la limite normale supérieure. Mesure
doit être prise 2 fois. N.B. La date de progression de la maladie est la date de première mesure du CA-125
≥ 2x la limite normale.
CA-125 ≥ 2x la valeur nadir. Mesure doit être prise 2 fois. N.B. La date de progression de la maladie est la date de première mesure du CA-125
≥ 2x la valeur nadir.
Comme pour A
* A : Patientes avec une mesure élevée du CA-125 en pré-traitement et normalisation de la mesure en post-traitement (environ 60% des nouvelles patientes)
* B : Patientes avec une mesure élevée de CA-125 en pré-traitement et qui ne se normalise jamais (environ 30% des nouvelles patientes)
* C : Patientes avec une mesure normale de CA-125 en pré-traitement (environ 10% des nouvelles patientes) ** La répétition des mesures de CA-125 peut se faire n’importe quand, mais pas moins d’une semaine après la première mesure élevée. Les mesures du CA-125 qui ont été prises dans les 4 semaines suivant soit la chirurgie, soit une paracentèse ou soit une administration d’anticorps de souris ne devraient pas être prises en compte.
2. Biomarqueur tissulaire : High temperature requirement factor
A1 (HtrA1)
2.1 Généralités sur HtrA1
La famille de protéase HtrA a été initialement trouvée dans la bactérie Escherichia Coli(52). Chez cette bactérie et chez tous les autres procaryotes, les HtrA ont deux rôles dans le maintien de l’homéostasie des protéines. D’abord, elles ont une activité de chaperon qui sert à la stabilisation de protéines spécifiques en présence de températures élevées(52), d’un pH élevé et d’un stress osmotique ou oxydatif(53). Ensuite, elles ont une activité protéase qui sert à la dégradation des protéines mal repliées ou non fonctionnelles(54). Chez l’humain, HtrA1 a été initialement identifié dans des fibroblastes transformés SV40(52). Le gène codant pour la protéase se trouve sur le chromosome 10, plus précisément à la région 10q26.2 (55). Il y a trois autres protéases dans la même famille : HtrA2, HtrA3 et HtrA4. HtrA1 est une protéase à sérine de la famille des trypsines. La protéase est exprimée dans une grande majorité de tissus sains du corps humain tels que la peau, divers organes du système digestif (œsophage, estomac, intestin, côlon, mais surtout foie et pancréas), le rein, les muscles, le cœur, le sein et le système reproducteur (endomètre, trompes de Fallope, placenta) dont l’ovaire(56).
Plusieurs fonctions reliées à HtrA1 ont été identifiées chez l’humain. Lorsque la protéase est sécrétée dans l’espace extracellulaire, elle aurait un rôle dans la dégénérescence des composantes de la matrice extracellulaire. En effet, la protéase semble cibler diverses protéines de la matrice extracellulaire telles que le collagène de type III, la fibronectine et diverses composantes du cartilage (52, 54, 55). Quelques données semblent montrer qu’il y aurait une implication de HtrA1 avec divers facteurs de croissance. HtrA1 pourrait inhiber le facteur Transforming Growth Factor-β1 (TGF-β1) qui régule la croissance et la division cellulaire(55, 57). De plus, HtrA1 agirait aussi sur Insulin-like Growth Factor Binding Protein 5, protéine qui sert au transport des Insulin-like Growth Factors impliqués dans la croissance cellulaire(53, 58, 59). La présence de HtrA1 dans le cytoplasme a aussi été identifiée. La protéase s’associerait aux microtubules et semblerait jouer un rôle dans la migration cellulaire(60). Deux autres études ont montré la présence de HtrA1 dans le noyau de cellules du cancer du col et de l’ovaire, mais sa fonction dans ce compartiment cellulaire n’a été que peu explorée(61, 62). Par contre, He et al. ont remarqué que la présence de HtrA1 dans le noyau était associée au facteur Epidermal Growth Factor Receptor (EGFR), gène fréquemment lié à la carcinogenèse(62).
Plusieurs formes actives de HtrA1 ont été identifiées : une forme à l’état natif d’une masse de 50 kDa, une forme produite par réaction autocatalytique d’une masse d’environ 36 kDa et une autre mal connue
correspondant à une masse d’environ 29 kDa(61, 63). La présence de la forme à 29 kDa serait plus importante dans le noyau et celle à 36 kDa, dans le cytoplasme(61). À notre connaissance, aucune étude ne mentionne spécifiquement la localisation de la forme de 50 kDa. La fonction des différentes formes de HtrA1 n’est pas connue.
HtrA1 a été impliquée dans diverses maladies. Dans l’arthrite, il a été montré que la surexpression de la protéase inhiberait TGF-β1, permettant ainsi la différenciation finale des chondrocytes et le remplacement du cartilage articulaire par de l’os(55, 58). De plus, HtrA1 pourrait accélérer la destruction du cartilage en ciblant les diverses protéines de la matrice extracellulaire. Dans la dégénérescence maculaire liée à l’âge, un polymorphisme nucléotidique dans le promoteur du gène HtrA1 a été identifié comme un facteur de risque de la maladie, mais son rôle exact n’est pas clair(64). Ensuite, dans la maladie d’Alzheimer, l’expression de HtrA1 permettrait la dégradation des peptides bêta-amyloïdes, composants majeurs des plaques amyloïdes impliquées dans cette maladie(55, 65). Finalement, plusieurs études ont été publiées sur l’expression de la protéase dans divers cancers, dont celui de l’ovaire.
2.2 HtrA1 et le cancer de l’ovaire
2.2.1 Études in vitro : HtrA1 et la carcinogenèse
Quelques recherches ont été menées pour évaluer le rôle de HtrA1 dans la carcinogenèse du cancer de l’ovaire. Chien et al. ont montré que la perte d’hétérozygotie était associée à une sous-expression de la protéase(66). De plus, la protéase semble être impliquée dans la régulation de l’anoïkose, une forme d’apoptose induite lorsque les intégrines de la cellule ne sont plus en contact avec la matrice extracellulaire du tissu d’où elles proviennent(67). Échapper à l’anoïkose est une étape essentielle vers la malignité pour une cellule, un des pôles essentiels de la carcinogenèse(68). La cellule peut alors survivre et croître sans ancrage à la matrice extracellulaire et envahir les tissus adjacents. He et al. ont montré que l’expression de HtrA1 était naturellement augmentée dans les cellules cancéreuses ovariennes en anoïkose par rapport à celles qui ne sont pas en mort cellulaire(62). De la même manière, l’induction de l’expression de HtrA1 était liée à une augmentation de la mort cellulaire dans des cellules cancéreuses qui n’exprimaient pas naturellement la protéase(66). À l’inverse, la suppression de l’expression de la protéase dans des lignées de cellules de cancer de l’ovaire exprimant fortement HtrA1 a rendu les cellules résistantes à l’anoïkose (62, 66).
La protéine HtrA1 semble aussi être impliquée dans la migration cellulaire. En effet, la suppression de l’expression de la protéase dans une lignée cellulaire de cancer de l’ovaire a entraîné une augmentation de la
vitesse de remplissage de la griffure par des cellules lors d’un scratch assay (60). Les auteurs avancent l’hypothèse que cette association entre HtrA1 et la migration cellulaire serait due à l’association de la protéase aux microtubules du cytoplasme dans des lignées cellulaires de cancer de l’ovaire. Par contre, dans cette même étude, l’expression de HtrA1 n’était pas associée significativement à un changement de la prolifération cellulaire.
La sous-expression de la protéase a aussi été trouvée associée à la résistance à la chimiothérapie(63). Après un traitement de 24h dans une solution de cisplatine, les cellules d’une lignée cellulaire de cancer de l’ovaire sous-exprimant HtrA1 ont formé significativement plus de colonies (p<0,01 à 15μM de cisplatine) que les cellules exprimant fortement HtrA1. Le pourcentage de cellules sous-exprimant HtrA1 qui étaient en apoptose était statistiquement plus faible que le pourcentage de cellules contrôles en apoptose (12% vs 31% à 20 μM de cisplatine, p<0,001). Inversement, l’induction de l’expression de HtrA1 était associée à une diminution significative du nombre de colonies (p<0,0001 à 16 μM de cisplatine), ainsi qu’à une augmentation significative du nombre de cellules en apoptose (35% vs 10% de cellules en apoptose, p<0,0001 à 20 μM à 24h).
Le mécanisme par lequel les tumeurs qui sous-expriment HtrA1 pourraient être résistantes à la chimiothérapie est en partie expliqué par son rôle dans la régulation de l’apoptose. D’abord, il a été observé que le traitement au cisplatine induisait la production de HtrA1 dans les cellules cancéreuses ovariennes in vitro et que, par conséquent, cette augmentation accroîtrait la mort cellulaire(63, 69). Par ailleurs, HtrA1 avait la capacité de former un complexe avec une protéine inhibitrice de l’apoptose bien connue pour son rôle dans la chimiorésistance, X-linked inhibitor of apoptosis protein (XIAP), et HtrA1 la dégraderait via son activité protéase(69). La destruction de XIAP induirait la production des caspases 3 et 7 qui sont utilisées par la caspase 9 dans la voie intrinsèque de l’apoptose(63, 69, 70). Ainsi, la sous-expression de HtrA1 ne permettrait pas la dégradation de XIAP et la mort cellulaire serait inhibée.
Un autre mécanisme par lequel la protéine HtrA1 pourrait être impliquée dans l’anoïkose a été suggéré par He et al. dans leur étude sur des lignées cellulaires de cancer de l’ovaire(62). Par immunoprécipitation, ils ont montré que HtrA1 interagissait avec le facteur EGFR, facteur classiquement associé à la carcinogenèse. Ils ont aussi montré que la sous-expression de HtrA1 augmentait l’expression de EGFR, diminuant du même coup le nombre de cellules en anoïkose. L’expérience contraire, en induisant la surexpression de la protéase, a montré une diminution de l’expression de EGFR tout comme une augmentation de la mort cellulaire. Les auteurs suggèrent que la protéase pourrait promouvoir l’anoïkose par l’atténuation de la voie EGFR/AKT.
2.2.2 Études in vivo : HtrA1, croissance tumorale et métastases chez la souris
Des cellules de cancer de l’ovaire luminescentes dont l’expression de HtrA1 a été supprimée par shRNA ont été injectées dans un modèle de souris immunodéficientes et elles se sont avérées plus agressives que les cellules contrôles n’ayant pas eu de modification de l’expression de la protéase(62). En effet, après 1 semaine, la mesure de la bioluminescence dans l’abdomen des souris était 2,4 fois plus élevée dans le groupe ayant reçu les cellules sous-exprimant HtrA1 que dans l’abdomen de celles du groupe contrôle (p<0,01). Au décès des animaux, le nombre de métastases était significativement plus élevé dans le groupe sous-exprimant HtrA1 que dans le groupe contrôle (moyenne de 14 métastases vs. 3, p<0,01).
2.2.3 Études chez l’humain
2.2.3.1 Expression en ARN messager et en protéine de HtrA1 dans des tissus de cancer
de l’ovaire
L’ARN messager (ARNm) et la protéine HtrA1 sont présents dans l’épithélium ovarien normal (66, 71). Une altération de l’expression de HtrA1 dans les tissus cancéreux par rapport à l’épithélium ovarien normal pourrait être un indice appuyant la thèse que la protéase joue un rôle dans le cancer de l’ovaire, bien que l’épithélium ovarien normal semble ne pas être le tissu d’origine du cancer, tel que mentionné précédemment. En travaillant sur des lignées de cancer de l’ovaire humain, Shridhar et al. ont montré que l’expression en ARNm de HtrA1 était diminuée ou carrément supprimée dans les cellules cancéreuses par rapport à l’épithélium ovarien normal (72). Chien et al. ont corroboré ces observations par la mesure d’ARNm et de protéines sur des lignées cellulaires d’épithélium ovarien normal et de cancer de l’ovaire(66). En comparant les tissus de 20 tumeurs bénignes de l’ovaire, de 44 carcinomes ovariens primaires et de 19 tissus ovariens normaux, Narkiewicz et al. ont aussi montré que l’expression en ARNm de HtrA1 était statistiquement diminuée dans les tumeurs ovariennes par rapport aux tissus normaux (p<0,001), ainsi que dans les tissus de carcinomes en comparaison aux tissus de tumeurs bénignes (p<0,001) (73). Cependant, aucune différence significative de l’expression protéique de la protéase n’a été trouvée entre les groupes.
2.2.3.2 Associations entre HtrA1 et les facteurs pronostiques standards du cancer de
l’ovaire
Les facteurs pronostiques standards du cancer de l’ovaire sont l’âge, le grade tumoral, le type histologique, le CA-125, le stade TNM ou FIGO et la présence de tumeur résiduelle après la chirurgie(74). Peu de recherches ont été menées pour étudier le lien entre l’expression en ARNm ou en protéine d’HtrA1 et les facteurs pronostiques standards chez les femmes atteintes d’un cancer de l’ovaire. Narkiewicz et al. ont mesuré
l’expression d’ARNm et de protéine de HtrA1 dans des tissus ovariens normaux et dans des tissus néoplasiques(73). Aucune association significative n’a été trouvée entre la mesure d’ARNm de HtrA1 et le grade tumoral (p=0,13), le stade TNM (p=0,23) ou le type histologique (p=0.59). Par contre, il y avait une association significative positive entre le niveau de la protéine HtrA1 et le stade TNM (p=0,04).
2.2.3.3 Associations entre HtrA1 et le pronostic des femmes atteintes d’un cancer de
l’ovaire
Selon nos connaissances, il n’y a pas d’étude évaluant le lien entre HtrA1 et le risque de progression et de décès des femmes atteintes d’un cancer de l’ovaire. Par contre, Chien et al. ont étudié l’association entre l’expression de HtrA1 tissulaire et la réponse au traitement de chimiothérapie au cisplatin chez 60 femmes atteintes d’un cancer de l’ovaire(63). La mesure de l’expression de HtrA1 a été réalisée par immunohistochimie (IHC) en estimant l’intensité (0, 1 ou 2) des cellules positives, sans égard à la structure intracellulaire marquée. Comparées aux femmes qui surexprimaient la protéase (intensité de marquage 2), les patientes avec des tumeurs qui sous-exprimaient HtrA1 (intensité 0 et 1) avaient un taux de réponse à la chimiothérapie significativement plus faible. Au total, 19/30 patientes (63%) sous-exprimant HtrA1 ont répondu au traitement contre 27/30 patientes (90%) surexprimant HtrA1 (p=0,0146).
2.2.3.4 Associations entre HtrA1 exprimé dans le stroma et le pronostic des femmes
avec un cancer de l’ovaire
Notre équipe de recherche a mené une étude exploratoire comparant par DNA microarray la différence d’expression de la protéase HtrA1 dans le tissu tumoral et le stroma chez 10 femmes avec un cancer séreux de l’ovaire présentant une récidive précoce (n=5) ou tardive (n=5)(75). Toutes les femmes devaient avoir un cancer de haut grade, reçu une chimiothérapie adjuvante et avoir eu une réponse complète suite à la première ligne de traitement. Une sous-expression de HtrA1 a été observée seulement dans le stroma des tumeurs des femmes avec récidive précoce par rapport à celles avec une récidive tardive (expression différentielle de 0,58). Comme cette étude était de taille limitée, elle ne pouvait pas prendre en compte l’effet des facteurs pronostiques standards. Ces résultats devraient donc être confirmés dans une large cohorte de femmes atteintes d’un cancer de l’ovaire.
Cette association entre l’expression de HtrA1 et la récidive est intéressante car elle a été trouvée dans le stroma des tumeurs. Très peu d’études concernant des marqueurs pronostiques dans le stroma ont été réalisées. Le stroma est un tissu qui donne une structure à la tumeur(76). Les fibroblastes contenus dans le stroma réagissent à la présence de la tumeur et cette réaction dite desmoplasique finit par promouvoir la croissance, l’expansion et la dissémination des cellules cancéreuses(77).
2.3 HtrA1 et le cancer de l’endomètre
Peu de données sont disponibles concernant HtrA1 dans le cancer de l’ovaire. Une revue de littérature détaillée du lien entre la protéase et un autre cancer d’origine gynécologique, soit le cancer de l’endomètre, a donc été faite.
2.3.1 Études in vitro : HtrA1 et la carcinogenèse
Dans l’étude de Mullany et al. menée avec des lignées cellulaires de cancer de l’endomètre Hec1A et Hec1B, la sous-expression de HtrA1 n’a pas changé la capacité de migration cellulaire de façon significative mais a augmenté de 4 fois la capacité d’invasion cellulaire(78). Au contraire, l’induction de l’expression de HtrA1 a inhibé la capacité de migration des cellules et a diminué de 60% la capacité de prolifération des cellules.
2.3.2 Études in vivo : HtrA1, croissance tumorale et métastases chez la souris
Des cellules de cancer de l’endomètre qui n’exprimaient pas HtrA1 ont été injectées dans des souris (n=11) et ces dernières ont eu significativement plus de métastases pulmonaires que les souris contrôles (n=11) injectées avec des cellules exprimant fortement la protéase (7/11 vs 1/11, p=0,0237) (78).
2.3.3 Études chez les humains
2.3.3.1 Expression en ARN messager et en protéine de HtrA1 dans le cancer de
l’endomètre
Narkiewicz et al. ont montré que HtrA1 était exprimé dans l’endomètre normal(57). De plus, l’expression de HtrA1, lors de la mesure de l’ARNm et de la protéine, était statistiquement plus faible dans le cancer de l’endomètre que dans l’endomètre normal (p<0,001 pour la mesure en ARNm et en protéine), tout type histologique confondu. Des résultats similaires ont été obtenus dans l’étude de Bowden et al. par la seule mesure de l’ARNm(79). En comparaison avec l’endomètre normal (n=5), les niveaux d’ARNm étaient statistiquement plus faibles dans les tumeurs de grade 1 (n=5, p<0,001), de grade 2 (n=5, p<0,05) et de grade 3 (n=5, p<0,001).