ROYAUME DEMAROC UNIVERSITÉ MOHAMED V
FACULTÉ DE MÉDECINE ET DE PHARMACIE DE RABAT
CENTRE D’ETUDES DOCTORALES DES SCIENCES DE LA VIE ET DE LA SANTE Formation doctorale : Epidémiologie clinique et sciences médicochirurgicales
THÈSE DE DOCTORAT N° : 21/17 CSVS Présentée par :
Asmaa Dibi
Pour l’obtention du grade de DOCTORAT NATIONAL Sous le thème :
Soutenue publiquement le10/04/2018, à la Faculté de Médecine et de Pharmacie, devant le jury :
Pr. Abdelilah BENTAHILA Président
Faculté de Médecine et de Pharmacie, RabatPr. Nezha MOUANE
Directeur de thèse
Faculté de Médecine et de Pharmacie, Rabat
Pr. Moustafa HIDA
Rapporteur
Faculté de Médecine et de Pharmacie, Fès
Pr. Amina BARKAT
Rapporteur
Faculté de Médecine et de Pharmacie, Rabat
Pr. Rachida DAFIRI
Rapporteur
Faculté de Médecine et de Pharmacie, Rabat
Pr. Fatima JABOURIK
Examinateur
Faculté de Médecine et de Pharmacie, Rabat
Pr. Ilham RATBI
Examinateur
Faculté de Médecine et de Pharmacie, Rabat2018
ETUDE SUR LES CALCIFICATIONS VASCULAIRES CHEZ
L’ENFANT ET IMPLICATION GÉNÉTIQUE
DÉDICACES
A mes parents, aux êtres les plus chers à mon cœur, tous les mots qui existent,
ne sauraient exprimer ce que je ressens en vous dédiant ce travail, pour votre
amour, votre soutien infaillible au cours de mes études et des épreuves de la vie,
pour les valeurs que vous m’avez inculqué. Merci d’avoir cru en moi et de
m’avoir permis de devenir celle que je suis aujourd’hui. Votre fierté est ma plus
belle récompense.
A ma chère MÈRE,
Tu es l’exemple de la bonne mère qui fait passer le bien être de ses enfants avant
le sien. Toujours à mes côtés, prête à me soutenir et à me réconforter,
m’apportant ton amour et ta vision optimiste des choses. Je ne cesserai de te dire
merci pour ta patience, et tes sacrifices. Que dieu te protège.
A mon cher PÈRE,
Non seulement tu as été un bon père, me procurant ta tendresse et ta
bienveillance, mais tu as été pour moi l’exemple à suivre. Mille fois merci pour
tes efforts pour que je puisse accomplir mon but. Que dieu te garde.
A mes chères sœurs et à mes chers frères
Quelle chance d’avoir de tels frères et sœurs ! Merci pour tous ces moments de
complicité partagés et ceux à venir! Votre présence à mes côtés m’est très
précieuse.
A ma grande famille,
Merci pour toutes ces années passées ensemble, pour vos encouragements, et
pour toutes les années futures.
A toutes mes amies,
Je vous remercie pour votre présence, votre aide et pour tous vos
encouragements pour mener à terme ce travail.
REMERCIEMENT
A notre Président du thèse,
Monsieur le Professeur A. BENTAHILA
Professeur de l’enseignement supérieur
Chef de service de Pédiatrie IV-Hôpital d’Enfants de Rabat- CHU Ibn Sina
Nous vous remercions de nous faire l’honneur de présider ce jury de thèse et
d’avoir dirigé ce travail tout au long de son déroulement. Nous tenons également
à vous remercier pour votre encadrement et votre encouragement. Veuillez
trouver ici notre sincère gratitude et l’expression de notre profond respect.
A notre Directeur de thèse,
Madame le Professeur N. MOUANE
Professeur de l’enseignement supérieur
Chef de service de Pédiatrie III-Hôpital d’Enfants de Rabat-CHU Ibn Sina
Directeur de l’unité de recherche en nutrition et maladies métaboliques.
Nous sommes très honorées et vivement reconnaissant de votre participation à
ce travail. Merci infiniment pour votre accueil chaleureux et votre aide
précieuse dans la réalisation ce projet. Veuillez trouver ici l’expression de notre
profond respect et notre sincère gratitude.
Au Membres du jury,
A Monsieur le Professeur M. HIDA
Professeur de l’enseignement supérieur
Chef de département de Pédiatrie-Hôpital Mère Enfant-CHU Hassan
II-Fès
Nous sommes très reconnaissantes de la confiance que vous nous avez accordée
en acceptant de juger notre thèse. Veuillez trouver ici l’expression de nos
sincères remerciements et notre profond respect.
A Madame la Professeur BARKAT
Professeur de l’enseignement supérieur
Chef de service de Néonatologie-Hôpital d’Enfants de Rabat-CHU Ibn Sina
Nous sommes très honorées de l’intérêt que vous avez bien voulu porter à notre
travail. Merci infiniment pour votre gentillesse et disponibilité.
Puissiez trouver
ici l’expression, de notre profond respect, de notre respectueuse reconnaissance
et nos sincères remerciements pour tous vos précieux conseils.
A Madame la Professeur DAFIRI
Professeur de l’enseignement supérieur
Chef de service de Radiologie-Hôpital d’Enfants de Rabat-CHU Ibn Sina
Vous nous faites l’honneur de siéger dans notre jury de thèse. Merci infiniment
d’avoir accepter de juger ce travail, pour l’intérêt que vous avez porté à notre
thèse en dépit de la charge de travail. Soyez assuré de notre profonde
reconnaissance et de notre profond respect.
Madame le professeur A. JABOURIKE,
Professeur de l’enseignement supérieur
Service de Pédiatrie IV-Hôpital d’Enfants de Rabat- CHU Ibn Sina
Nous vous remercions du grand honneur que vous nous avez fait en acceptant de
siéger parmi les juges. Vous nous avez toujours impressionnés par vos
nombreuses qualités tant humaines que professionnelles. Vous êtes un modèle
de dynamisme et de conscience professionnelle. Nous vous remercions pour tout
votre soutien, votre encouragement et votre attention. Nous vous remercions de
votre disponibilité, votre accueil chaleureux, votre écoute et votre grand cœur.
Veuillez trouver ici toute notre gratitude, et notre profond respect. Votre aide
nous a été très précieuse et nous vous serons toujours reconnaissante.
Madame le Professeur I. RATBI,
Professeur agrégé.
Institut national d’hygiène.
Nous vous remercions professeur de l’honneur que vous nous faites en acceptant
de faire partie de ce jury. Veuillez trouver ici l’expression de ma profonde
estime.
Monsieur le Professeur EL. EL FAHIME
Laboratoire de biologie moléculaire au Centre National pour la Recherche
Scientifique et Technique-Rabat
Vous nous avez été d’une grande aide et vous avez sacrifié de votre précieux
temps pour la réalisation de l’étude génétique, nous vous remercions pour votre
disponibilité et pour votre amabilité. Veuillez trouver ici l’expression de ma
profonde gratitude et reconnaissante.
Je remercie vivement tous ceux qui ont contribué de près ou de loin à
l’élaboration de ce travail.
Nous remercions le Professeur Frank Rutsch et toute l’équipe de « Klinik für
Kinder-und Jugendmedizin Universitätsklinikum Münster », pour avoir
participer à l’exploration génétique de nos patients.
Nos remerciements vont :
A toute l’équipe du laboratoire de biologie moléculaire pour l’aide que vous
m’avez fournie dans la réalisation de mon travail. Je vous suis très
reconnaissante.
A tous les infirmières et infirmiers du service de Pédiatrie IV pour tous vos
efforts dans la réalisation des prélèvements sanguins au patients.
Au patients et leurs parents, Merci infiniment pour votre participation à cette
étude.
TABLE DES MATIÈRES
LISTE DE FIGURES ET GRAPHIQUES………...………....11
LISTE DES TABLEAUX………...15
LISTE DE ANNEXES………..16
LISTE DES ABRÉVIATIONS………...17
INTRODUCTION………19
CHAPITRE 1 : SYNTHÈSE BIBLIOGRAPHIQUE………...23
I- RAPPEL EMBRYOLOGIQUE………....24
A- Émergence des cellules endothéliales, notion d’hémangioblaste………..….24
B- Remodelage et identité artérielle et veineuse………..27
C- Développement du réseaux vasculaire………...….28
II- RAPPEL HISTOLOGIQUE…...……….………30
A- Les trois tuniques concentriques………. …...30
1- L’intima………..30
2- La média……….30
3- L’adventice……….30
B- Structure de l’intima……….………..31
1- Les cellules endothéliales……….…..31
2- La lame basale………...….33
3- Le tissu conjonctif sous-endothélial………...33
C- Les artères………33
1- Les artères élastiques………..34
a- L’intima……….34
b- La média………....35
c- L’adventice………...….35
2- Les artères musculaires……….. 36
a- L’intima……….36 b- La média………...……….36 c- L’adventice………36 3- Les artérioles………...37 a- L’intima……….37 b- La média………...……….37 c- L’adventice………38 D- Les capillaires………..38
1- Les différents types histologiques de capillaires……….38
a- Les capillaires sinusoïdes………. .39
b- Le réseau capillaire………...….39 c- Anastomoses artério-veineuse………...………39 d- Le capillaire de jonction………...……….40 e- Le réseau capillaire………41 f- les veinules………...………..41 E- Les veines………42
1- Structures histologique des veines………..42
a- L’intima………...………..42
b- La média………...……….42
c- L’adventice………...…….43
III- PHYSIOPATHOLOGIE………44
B- Développement des calcifications artérielles par perte des inhibiteurs physiologiques45
C- Un rôle clé pour pyrophosphate (PPi) dans les CV rares………...47
IV- GENETIQUE……….49
A- ATP BINDING CASSETTE SUB-FAMILY C MEMBER 6 (ABCC6)………...…49
1- Localisation chromosomique……….49
2- Le gène ABCC6………...…..50
3- La Protéine ABCC6………...…………51
4- Mutation sur l’ABCC6………..…………51
5- Fonction de la protéine ABCC6………52
6- Action des mutations de l’ABCC6 sur l’enzyme « gamma-glutamyl-carboxylase..53
B- Le gène Ectonuleotide Pyrophosphates/Phosphodiestérase (ENPP1)……….53
1- Structure du gène ENPP1………..53
2- Lieu de l’expression de l’ENPP1………..54
3- La protéine NPP1……….…….54
a- Structure de la protéine ENPP1………...………….54
b- Fonctionnement de la prtéine NPP1………....55
4- Le pyrophosphate inorganique………..55
5- Conséquences des mutations touchant le gène ENPP1……….56
- Elastopathie calcifiante artérielle diffuse……….………...57
CHAPITRE 2 : MATÉRIEL ET METHODES………...……….58
A- Stratégie de l’étude………..………59
B- Recrutement des patients………...………..59
1. Explications du déroulement et recueil du consentement………..…….59
2. Recueil des données cliniques……….60
2.1. Données anamnestiques………..………59
2.2. Examen clinque………..……….59
3. Prélèvements et dosage……….……..60
4. Recueil des données d’imagerie………..…60
4.1. Echographie abdominale et cervicale………..……60
4.2. Echocardiographie………...………61
4.3. Examen ophtalmologique………61
5. Enquête familiale………...……….61
6. Etude génétique………...………61
6.1. Les échantillons………..…….62
6.2. Les techniques de Biologie Moléculaire………..62
a- Extraction d’ADN génomique………..………..62
b- Dosage des acides nucléiques……….63
c- Design des amorces………...………..64
d- Amplification de l’ADN génomique par PCR………...……….64
e- Electrophorèse d’ADN sur gel D’Agarose………..………...66
f- Séquençage……….….67
g- Analyse bioinformatique………..…………..68
CHAPITRE 3 : RESULTATS………..69
PARTIE 1 : DONNÉES ÉPIDÉMIOLOGIQUES, CLINIQUES, BIOLOGIQUES ET RADIOLOGIQUE………...……70
I-SYNTHÈSE DES RÉSULTATS………...……71
1- Données épidémiologiques et cliniques………...…71
2- Données radiologiques………..…..71
II- OBSERVATIONS……… …... . …………..…….74 Observation 1 ……….………...…...74 Observation 2 ……….………...……...77 Observation 3 ………...81 Observation 4 ………. .84 Observation 5 ……….. 86 Observation 6 ……… ..88 Observation 7 ……….………..90 Observation 8 ………. .92 III- DISCUSSION………...………..94
1- Caractéristiques épidémiologiques de PXE……….94
1.1. Fréquences………..……….94 1.2. Mode de transmission……….……….95 1.3. Age………...……95 1.4. Sexe……….…….95 2- Manifestation clinique………...96 2.1. Manifestations vasculaires………...………97 2.2. Manifestations cutanées………..……….99 2.3. Manifestations oculaires………..……99 2.4. Manifestations digestives………...101 3- Confrontation anatomo-clinique………....102
PARTIE 2 : PRÉSENTATIONS DES RÉSULTATS GÉNÉTIQUES ET IMPLICATION PRATIQUE………...….103
I-SYNTHESE DES RESULTATS………...……..104
1- Résultats de l’étude génétique………...………..104
2- Implication génétique………....…..104
3- Mutations retrouvées………..105
II- DISCUSSION………...………...……….107
CHAPITRE 4 : DISCUSSION GÉNÉRALE……….108
1- Formes sévères inaugurale du PXE………...109
2- Les calcifications vasculaires dans le PXE………111
2.1. Calcifications viscérales………..………111
2.2. Hypertension artérielle………...…….111
2.3. Atteinte vasculaires cérébrale……….…111
3- Le diagnostic moléculaire en pratique………...…112
4- Corrélation génotype-phénotype………...……113
5- Prise en charge du PXE……….…115
CONCLUSION………..…….121
RESUMÉ………123
RÉFÉRENCES BIBLIOGRAPHIQUE...………...…………126
PRODUCTIONS SCIENTIFIQUES………..136
LISTE DES FIGURES ET GRAPHIQUES
Figure 1: Cartographie du mésoderme. Le mésoderme se développe entre l’ectoderme et l’endoderme au cours du processus de gastrulation. Il se différencie en une structure axiale, la notochorde (N) sous le tube nerveux(TN), une structure paraxiale, le somite, dorsalment aux aortes (Ao) et en un mésoderme latéral. Lors de la formation du coelome (Coe), le mésoderme latéral se scinde en un feuillet dorsal, le mésoderme somatopleural (MSo), et un feuillet ventral, le mésoderme splanchnopleural (MSp). L’association mésoderme splanchnopleural-endoderme forme la splanchnopleure (Sp)………..24 Figure 2: Hétérogénéïté moléculaire du mésoderme latéral. Coupe transversale d’un embryon de poulet à jour 2 hybridée avec une sonde spécifique du proto-oncogène c-ets1. Au niveau du mésoderme, les ARNm c-ets1 sont abondamment transcrits dans le feuillet splanchnopleural (flèches) alors que, seuls quelques spots c-ets1+ sont détectés dans le feuillet somatopleural (têtes de flèche) (x 110). So : som atopleure ; Sp : splanchnopleure ; TN : tube nerveux22 ………26 Figure 3: Différente couche de la paroi artérielle ………...34 Figure 4: Schéma des différentes couches de la paroi d’une artère musculaire de petit calibre ………..37 Figure 5 : Schéma d’un lit capillaire au niveau de l’anastomose artério-veineuse …………40
Figure 6 : Schéma des différentes couches de la paroi d’une veine ………...42 Figure 7: Mécanisme supposé conduisant aux calcifications artérielles impliquant la voie du métabolisme extracellulaire de l’ATP. A la surface des cellules, ENPP1 (ectonucléotide pyrophosphatase-phosphodiestérase 1) convertit l’ATP en AMP et pyrophosphate inorganique (PPi), et CD73 transforme l’AMP en adénosine et phosphate inorganique (Pi). La déficience de CD73 aboutit à un déficit en adénosine et en l’absence d’inhibition de TNAP (Tissue non- specific alkaline phosphatase). Il en résulte un excès de dégradation du PPi qui est un puissant inhibiteur de la formation des cristaux d’hydroxyapatite. ………...47 Figure 8: Localisation in vivo de ABCC6 humain et ses mutants (basés sur Le Saux et al.,
2011). ………...49 Figure 9: La structure exon-intron du gène ABCC6………50
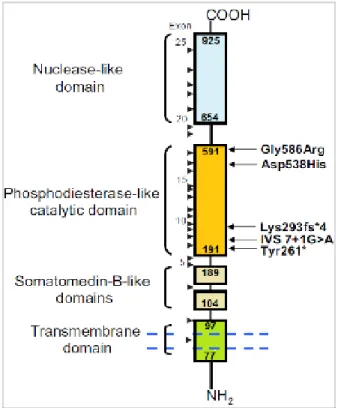
Figure 10: Les principales mutations retrouvées dans l’ABCC6, causant le PXE…………..51 Figure 11: Représentation schématique de l’organisation du gène ENPP1 chez l’être humain (Ruf et al, 2004 ; Ensembl, ENSG00000197594). ………...53 Figure 12: Caractéristiques structurelles générales de la protéine NPP1 …...55
Figure 13: Schéma représentant les voies du métabolisme du PPi dans le muscle vasculaire lisse: (1) Le PPi est synthétisé par la NPP1 et la NPP3 à partir de l’ATP extracellulaire, (2) ou encore à partir de l’A TP transporté par l’ANK ou l’ABCC6 (Albright et al, 2015) à travers la membrane plasmique. (3) Le PPi est hydrolysé par la TNAP et la NPP3 en Pi. (4) La NTPD est très active dans le muscle vasculaire lisse, elle hydrolyse l’ATP en Pi, ce qui peut limiter la disponibilité de l’ATP nécessaire pour la synthèse de PPi. (5) L'analogue de l'ATP, le α, β-méthylène- ATP (meATP) est un inhibiteur compétitif de la réaction de production de PPi par la NPP1 dans la paroi vasculaire (Villa-Bellosta et al, 2011). ………...56 Figure 14: Cartographie des mutations causant le GACI et le rachitisme Hypophosphatémique sur la structure primaire de la NPP1 humaine. TM : Domaine transmembranaire, SO : somatomédine B-Like Domaine (Lorenz- Depiereux et al, 2010 ; Kato et al, 2012). ………...56 Figure 15: Représentation schématique des mutations de l’ENPP1 identifiées chez des patients GACI présentant des symptômes de PXE (Nitschke et al, 2012). ………...57 Figure 16: Le profil typique d’un spectre des acides nucléique………..64 Figure 17: Les étapes de l’amplification PCR………...65 Figure 18: Dosage de l’ADN extrait sans hémolyse par le spectrophotomètre «NanoDrop 8000 » de Thermo Scientific. ………...67 Figure 19: Profiles électrophorétiques des exons (9, 10 et 15) du gène ENPP1 amplifiés
visualisés à l’aide du « Gbox de Syngene ». Les bandes uniques migrent et se localisent à la
taille exceptée pour chaque amplicon………...68
Figure 20: Discrètes lésions cutanées au niveau de la face latérale du cou…...75
Figure 21: Calcifications cérébrales et image ischémiques hypodenses diffuses………78
Figure 22: Les papules cutanées jaunâtres avec excès de peau au niveau du tronc………..79
Figure 23: Calcification linéaires au niveau rénale……….82
Figure 24: Calcifications pancréatique sur l’échographie abdominale………82
Figure 25: Calcification linéaires spléniques………...85
Figure 26: Calcifications linéaires spléniques sur l’échographie abdominale………87
Figure 27 : Calcifications linéaires du rein droit sur l’échographie abdominale……….89
Figure 28: Calcifications linéaires et diffuses du rein gauche sur l’échographie abdominale 91 Figure 29: Calcifications diffuses sur le thymus à l’échographie………..93
Figure 30: Répartition des cas connus du PXE dans le monde en 2015 (PXE International, 2015). ………...94
Graphique 1: Répartition de nos patients avec PXE en fonction du sexe………...96
Graphique 2: Répartition de nos patients avec PXE en fonction des manifestations cliniques………97
Figure 31: Calcification de l’arbre artériel. (vonBeckerath et al. Circulation 2008) ………..…………..98
Figure 32: Aspect de peau d’orange rétinienne……….101
Figure 33: fond d’œil retrouvant des stries angioïdes, lignes grises radiaires s’étendant autour de la papille et reliées par des lignes circonférentielles. D’après Clinical Ophthalmology, Jack J Kanski, 6th edition, 2007, Elsevier………. 101
Graphique 3 : Répartition des patients en fonction du nombre de mutation du gène ABCC6 retrouvée………...105
Figure 34: Méta-analyse résumant le risque de cardiopathie ischémique par le génotype R1141X. Les lignes horizontales correspondent à des intervalles de confiance de 95%. ……….110 Figure 34: Localisation des mutations du gène ABCC6 causant le PXE…………..………114
LISTE DES TABLEAUX
Tableau 1: Maladies héréditaires avec calcifications ectopiques et leurs gènes mutants………..50 Tableau 2 : La répartition des échantillons pour chaque famille. Le (+) représente la présence de l’échantillon. ………63 Tableau 3: Paramètres épidémiologiques et cliniques de nos patients………91
Tableau 4: Répartition des patients en fonction de la localisation des calcifications vasculaires………...92 Tableau 5: Les paramètres épidémiologiques et cliniques de nos patients avec PXE………...92 Tableau 6: Résultat de l’étude génétique sur le gène ABCC6 chez les patients et leurs familles………102
Tableau 7: Les différentes mutations retrouvées chez nos patients………...103
Tableau 8: L’ensemble des caractéristiques cliniques et génétiques de nos patients………104 Tableau 9: Critères diagnostiques du Pseudoxanthome élastique ………113
Tableau 10: Critères diagnostiques de PXE (d’après Plomp et al. Am J Med Genet Part A 2010. 152A :1049-1058)……….114
LISTE DES ANNEXES
Annexe 1 : Formulaire de consentement pour l'analyse génétique………149
Annexe 2: Formulaire de consentement pour l'analyse génétique (les parents)……..…….150
Annexe 3: Fiche exploitation……….151
Annexe 4: les étapes d’extraction par ISOLATE II Blood DNA Kit Bioline………159
Annexe 5 : Tableau des résultats d’extraction après lyse………...160
Annexe 6 : Listes des amorces utilisées pour l’amplification du gène ENPP1………..161
Annexe 7 : Les quantités d’ADN utilisées pour la réalisation de PCR………..162
Annexe 8 : Tableau détaillant les mesures de qualité et de quantité de l’ADN extraite de tous les échantillons par les deux méthodes d’extraction………...163
LISTE DES ABRÉVIATIONS
ABCC6 : ATP Binding Cassette Sub-Family C Member 6 ABCs : ATP Binding Cassettes
ACDC : Calcification Artérielle Due Au Anomalies Du CD73 ATP : Adénosine-TriphosPhate
AMP : Adénosine monophosphate
ADN : Acide Désoxyribonucléique AVC : Accident Vasculaire Cérébral AINS : Anti Inflammatoire Non Stéroidien BET : Bromure d’Ethidium
CE: Cellules Endothéliales CRP : Protéine C réactive
CCMH : Concentration Corpusculaire Moyenne en Hémoglobine dNTP : Désoxyribonucléosides Triphosphates
EDHF: Facteur Hyperpolarisant Endothélial EDTA: Acide Ethylène Diamine Tétra-Acétique ECBU : Examen Cytobactériologique Des Urines
ENPP1: Ecto-Nucleotide Pyrophosphatase / Phospho Diestérase 1 FGF2 : Fibroblast Growth Factor 2
GACI : Elastopathie Calcifiante Artérielle De L'enfance GAG : Glycosaminoglycanes Sulfatés
GGCX : Gamma-Glutamyl-Carboxylase Dépendant De La Vitamine K GGT : Gamma-Glutamyl Transférase
HA : Dépôt D’hydroxyapatite HDL : Lipoprotéine De Haute Densité HGPS : Syndrome de progeria
HTA : Hypertension Artérielle ICL: Intra Cellular Loop
IRM : Imagerie Par Résonance Magnétique KTLS : Syndrome Keutel
LTC4 : Leucotriènes C4
MEC : Matrice Extracellulaire Collagénique MV : Matrice Des Vésicules
NCBI : National Center for Biotechnology Information NEM-GS: la N-Ethylmaleimide S-Glutathion
NO : Oxyde D’azote
NPPs : Nanoporous Polymer Particles OPN : Sialoprotéine Ostéopontine Osseuse
PDGF: Facteur De Croissance Dérivé Des Plaquettes PXE : Pseudoxanthome Elastique
Pi : Phosphate Inorganique PPi: Pyrophosphate
PIT-1: Sodium-Dépendant Pi De Type III Co-Transporteur-1 PHOSPHO1 : Phosphoéthanolamine / Phosphocholine Phosphatase PCR : Réaction En Chaîne Par Polymérase
SGOT : Glutamate Oxaloacétique Transaminase SGPT : Glutamate Pyruvate Transaminase TCA : Temps De Céphaline Activée
TNAP: Tissus De Phosphatases Non Spécifique Phosphatase Alcaline TP : Temps De Prothrombine
VEGF : Vascular Endothelial Growth Factor VGM : Volume Globulaire Moyen
La calcification vasculaire est un phénomène physiopathologique responsable d’une modification de l’élasticité artérielle qui perturbe l’hémodynamique vasculaire, provoquant ainsi de nombreuses dysfonctions cellulaires. Ainsi depuis plus d’un demi-siècle ce phénomène est corrélé à un pronostic sombre attribué à une morbidité et une mortalité cardiovasculaire précoces Ceci survient majoritairement chez les patients âgés et peut laisser à penser que les calcifications représentent un marqueur de vieillissement mais n’ont pas de morbidité propre. Bien au contraire, les calcifications sont reconnues comme un facteur de morbidité cardiovasculaire propre et gagne un intérêt croissant en tant que marqueur indépendant des maladies cardiovasculaires (CV).
Bien que tous les tissus ont le potentiel de se calcifier, plusieurs tissus ont une plus forte propension à se calcifier y compris la peau, les reins, les vaisseaux sanguins et les valves cardiaques [1].
Il existe plusieurs mécanismes par lesquels la calcification vasculaire peut progresser, mais ces mécanismes ne sont pas exclusifs et de multiples pathologies peuvent entrainer des calcifications ectopiques. Les causes courantes de la calcification vasculaire chez l’adulte comprennent le vieillissement, ainsi que des maladies telles que l'athérosclérose, l’insuffisance rénale chronique et le diabète de type II.
Le rôle de la génétique dans le processus de calcification est susceptible de prendre une place importante puisque plus de 40% de la variante du phénotype de la calcification aortique et coronaire pourrait être sous le contrôle des gènes. Les rôles des gènes ont été déchiffrés dans diverses maladies monogéniques mais également dans la population générale. Une calcification artérielle a également été rapportée chez des patients jeunes présentant une série de maladies monogéniques héréditaires en raison d'une altération de la régulation de la calcification des tissus mous telles que l’élastopathie calcifiante diffuse de l’enfance (GACI), le pseudoxanthome élastique (PXE), Hutchinson-Gilford syndrome de progeria (HGPS), la calcification artérielle due à une carence de CD73 (ACDC) et le syndrome Keutel (KTLS) [2]. Malgré la rareté des cas, ces maladies donnent un aperçu significatif dans les processus biologiques complexes des calcifications vasculaires.
Les mutations des gènes responsables des maladies héréditaires monogéniques rares ont permis l'identification de mécanismes spécifiques et le développement de modèles animaux
pour étudier davantage le processus de calcification. En outre, les données des patients et des modèles animaux ont donné lieu à l'élucidation des voies impliquées tant dans la promotion et l'inhibition de la calcification vasculaire.
Notre travail de thèse s’inscrit dans un projet d’étude des calcifications vasculaires chez l’enfant dont l’origine vient d’une observation clinique: ces calcifications vasculaires ont été découvertes devant différents tableaux cliniques et de sévérité très variables allant de cas asymptomatiques avec une découverte fortuite de ces calcifications, à des cas très sévères avec des séquelles graves.
Partant de cette observation, notre projet d’étude est né et a pour objectif principal de confirmer l’origine génétique de ces calcifications vasculaires chez l’enfant et d’essayer d’expliquer cette variabilité phénotypique, mais aussi pour apporter des éléments descriptifs des différents tableaux cliniques existant dans notre population en l’intégrant dans une maladie monogénique .
Pour répondre à ces objectifs nous avons inclus des enfants porteurs de calcifications vasculaires en se basant sur une comparaison somatique et génétique.
Par référence aux données de la littérature et les différents tableaux cliniques de nos patients, notre choix s'est porté sur deux gènes connus responsable de calcifications vasculaires dans deux maladies génétiques : le pseudoxanthome élastique (PXE) et l’élastopathie calcifiante diffuse de l’enfance (GACI), ces deux gènes sont ABCC6 et ENPP1.
L’étude a consisté à :
- Recueil des patients et leurs données anamnestiques, cliniques, biologiques et radiologiques.
- Réaliser une enquête familiale clinique et échographique.
- Effectuer une étude génétique pour les patients et leurs familles (parents et fratrie) à la recherche des mutations des gènes ABCC6 et ENPP1.
- Collecter les résultats et réaliser une analyse avec une approche comparative à fin de répondre à nos objectifs.
Dans ce travail nous allons commencer par des rappels fondamentaux, embryologiques, physiopathologiques et génétiques, nécessaires pour la compréhension. Par la suite, la présentation des résultats se fera en deux parties :
1- Partie 1: Présentation des données épidémiologiques, cliniques, biologiques et radiologiques et les comparant au données de la littérature.
2- Partie 2: Présentation des résultats génétiques et implication pratique.
A la fin, une discussion générale pour répondre à nos objectif et comparer nos résultats avec les données de la littérature.
CHAPITRE 1 :
1- RAPPEL EMBRYOLOGIQUE
Le système cardiovasculaire est le premier organe fonctionnel à se mettre en place chez l’embryon. En effet, le bon développement des tissus dépend d’un apport adéquat d’oxygène via le cœur et les vaisseaux sanguins. La dissection fine des mécanismes cellulaires et moléculaires qui interviennent dans la différenciation du réseau endothélial constitue un défi, mais aussi une nécessité dans la perspective d’une modulation de l’angiogenèse dans un but thérapeutique, particulièrement dans le domaine de la recherche cardiovasculaire.
L’étude de la mise en place du réseau endothélial chez l’embryon revêt un intérêt majeur compte tenu de la très probable similitude des mécanismes contrôlant l’ontogenèse endothéliale et le processus d’angiogenèse pathologique.
A- Émergence des cellules endothéliales, notion d’hémangioblaste
Les cellules endothéliales (CE) naissent dans le mésoderme, le feuillet intermédiaire de l’embryon qui ségrège lors du processus de la gastrulation (figure 1). Ce feuillet évolue rapidement pour donner une structure paraxiale, le somite, et à la périphérie le mésoderme latéral. Lors de la formation du cœlome, le mésoderme latéral se différencie en deux feuillets: un feuillet dorsal, le mésoderme somatopleural, en étroit contact avec l’ectoderme, et un feuillet ventral, le mésoderme splanchnopleural, en étroit contact avec l’endoderme. L’association mésoderme somatopleural-ectoderme forme la somatopleure qui constituera la paroi et les membres, tandis que l’association mésoderme splanchnopleural-endoderme forme la splanchnopleure à l’origine des viscères.
Figure 1: Cartographie du mésoderme. Le mésoderme se développe entre l’ectoderme et l’endoderme au cours du processus de gastrulation. Il se différencie en une structure axiale, la notochorde (N) sous le tube
nerveux(TN), une structure paraxiale, le somite, dorsalment aux aortes (Ao) et en un mésoderme latéral. Lors de la formation du coelome (Coe), le mésoderme latéral se scinde en un feuillet dorsal, le mésoderme somatopleural (MSo), et un feuillet ventral, le mésoderme splanchnopleural (MSp). L’association mésoderme splanchnopleural-endoderme forme la splanchnopleure (Sp).
L’émergence des précurseurs vasculaires est sous le contrôle de nombreuses molécules: citons parmi elles le facteur de croissance VEGF (vascular endothelial growth factor) et deux de ses récepteurs, VEGF-R1 et VEGF-R2. Le VEGF, qui agit sous forme soluble, a une double action sur les cellules endothéliales: il est mitogène et augmente la perméabilité des vaisseaux. Parmi les récepteurs qui relayent les effets biologiques du VEGF, VEGF-R2 apparaît comme le marqueur le plus précoce du lignage endothélial.
D’autres facteurs qui conditionnent la spécification endothéliale d’une cellule, ont été identifiés (Ets1, Hex, Vezf1, des gènes Hox, des membres de la famille GATA...) mais les mécanismes moléculaires à l’œuvre restent flous. Les molécules responsables des interactions CE-CE et CE- matrice extracellulaire telles que la VE-cadhérine, la fibronectine ou les intégrines sont, quant à elles, importantes pour la différenciation de l’arbre vasculaire précoce [1].
Dans l’embryon proprement dit, le premier signe de la différenciation endothéliale est l’apparition, dans le mésoderme non encore scindé, d’angioblastes isolés qui vont s’associer les uns aux autres pour former un plexus vasculaire : chez l’embryon, il n’y a donc pas d’îlots sanguins. La mise en place de l’arbre endothélial primitif qui résulte de l’interconnection des réseaux endothéliaux vitellin et intraembryonnaire et qui aboutit à la différenciation de l’endocarde et des deux aortes dorsales est un processus rapide puisque observé après trente heures chez l’oiseau [2], huit jours chez la souris [3] et trois semaines chez l’homme [4]. Par comparaison avec les hémangioblastes qui émergent précocément dans le sac vitellin, il existe, dans l’embryon, des cellules bipotentes qui ont une destinée endothéliale et hématopoïétique. Enfin, récemment, l’identification d’hémangioblastes/ angioblastes circulants, originaires de la moelle osseuse, a été rapportée chez l’adulte [1]. Ces précurseurs, peu nombreux au demeurant, laissent entrevoir l’espoir d’une utilisation thérapeutique. Une hétérogénéïté du mésoderme latéral quant à l’émergence de cellules endothéliales s’installe rapidement au cours du processus de gastrulation : l’analyse de l’expression de marqueurs spécifiques des CE tels que VEGF-R2 ou les facteurs de transcription c-ets1
(figure 2) et SCL/ TAL montre que, si tout le feuillet mésodermique transcrit ces gènes au
début de la gastrulation, les ARNm se restreignent ensuite à la partie ventrale du mésoderme latéral. Lorsque le cœlome se forme, ces transcrits ne sont exprimés que dans le feuillet splanchnopleural, au niveau des vaisseaux sanguins, tandis que dans le mésoderme somatopleural ces gènes ne sont transcrits que dans les rares CE [5-6].
Figure 2: Hétérogénéïté moléculaire du mésoderme latéral. Coupe transversale d’un embryon de poulet à jour 2 hybridée avec une sonde spécifique du proto-oncogène c-ets1. Au niveau du mésoderme, les ARNm c-ets1 sont abon- damment transcrits dans le feuillet splanchnopleural (flèches) alors que, seuls quelques spots c-ets1+ sont détectés dans le feuillet somatopleural (têtes de flèche) (x 110). So : som atopleure ; Sp : splanchnopleure ; TN : tube nerveux.
Ainsi, deux territoires mésodermiques distincts participent à la vascularisation de l’embryon, un territoire dorsal, le mésoderme paraxial, qui ne produit que des CE; un territoire ventral, le mésoderme splanchnopleural, où se différencient des CE seules capables de gagner l’endothélium aortique ventral et de participer à la formation des bourgeonnements hématopoïétiques. Ces expériences ont permis de définir un potentiel angiopoïétique au sein du mésoderme paraxial et un potentiel hémangiopoïétique au sein du mésoderme splanchnopleural. De plus, il apparaît que l’endothélium de l’aorte a une double origine, somitique, dorsalement et splanchnopleurale, ventralement.
B- Remodelage et identité artérielle et veineuse
Il a longtemps été admis que l’identité artérielle ou veineuse d’un vaisseau était principalement assujettie aux forces hémodynamiques résultant de l’établissement de la circulation. Cependant, le développement de tous les vaisseaux majeurs ne dépend pas des forces mécaniques engendrées par la circulation : le tube cardiaque, les arcs aortiques, l’aorte dorsale et les veines cardinales ont déjà acquis un grand diamètre alors que la circulation n’est pas établie et les forces hémodynamiques inexistantes. Les forces de cisaillement induites par les contraintes hémodynamiques sont impliquées dans l’étape de remodelage correspondant à la mise en place du mur vasculaire autour des tubes endothéliaux. Des séquences nucléotidiques spécifiques (shear stress responsive elements) sont ainsi intégrées au promoteur de certains gènes tel que celui codant pour le facteur de croissance dérivé des plaquettes (PDGF). La transcription du PDGF est induite dans l’endothélium vasculaire en réponse aux forces de cisaillement [7]. Cette molécule est un chimioattractant pour les cellules de muscle lisse qui sont ainsi recrutées pour former le mur vasculaire. La différenciation du mur est contrôlée par un couple ligands- récepteur, les angiopoïétines (Ang1 et Ang2) et leur récepteur Tie2, qui affecte la croissance et le maintien des vaisseaux sanguins en stabilisant l’interaction des cellules murales avec les néovaisseaux ou en promouvant les branchements et l’angiogenèse[3]. Ultérieurement, le système angiotensine et les facteurs vasoconstricteurs et vaso- dilatateurs interviennent dans le contrôle physiologique du tonus vasculaire.
En ce qui concerne l’identité artérielle ou veineuse d’un vaisseau, hormis les différences histologiques au niveau de la composition de la paroi et la présence de valvules dans certaines veines, des arguments moléculaires récents permettent l’identification de tubes artériels ou veineux. Des expériences de délétion des gènes de l’éphrine B2 et d’EphB4, un couple ligand-récepteur initialement caractérisé dans le système nerveux, montrent que ces deux molécules ont un rôle clé dans le développement vasculaire. L’éphrine B2 et l’EphB4 ont des patrons de distribution réciproques, l’éphrine B2 marquant l’endothélium des artères, l’EphB4 celui des veines. La distribution complémentaire de ces deux gènes suggère qu’ils sont impliqués très tôt dans l’établissement de l’identité artéro-veineuse, en assurant peut-être la fusion des tubes artériels et veineux à leurs jonctions.
contrôlant les interactions entre les CE et les cellules musculaires lisses recrutées pour former le mur vasculaire [8]. Chez l’adulte, les processus d’angiogenèse physiologique ou tumorale conduisent à la formation de néovaisseaux qui expriment à nouveau le gène de l’éphrine B2 : ce constat aboutit à reconsidérer le dogme bien établi selon lequel l’angiogenèse adulte conduit à la formation de vaisseaux non différenciés ou de veines et suggère que l’éphrine B2 doit jouer un rôle important dans ces sites d’angiogenèse [8].
C- Développement du Réseaux vasculaires :
Ils sont intra et extra-embryonnaires. L’ensemble des 2 réseaux se développe au niveau du mésoderme représenté par la splanchnopleure extra et intra-embryonnaire.
Les 3 sites d’apparition :
Du côté extra-embryonnaire, les vaisseaux apparaissent au niveau de : - la paroi de la vésicule vitelline
- le mésenchyme du pédicule de fixation (futur cordon ombilicaux) : vaisseaux ombilico-allantoïdiens
- la lame choriale qui donne naissance aux villosités choriales. Du côté intra-embryonnaire, les vaisseaux apparaissent au niveau de :
- La splanchnopleure intra-embryonnaire - Le mésoderme para-axial
- Mésoderme céphalique (aire cardiaque)
La connexion des vaisseaux avec le tube cardiaque (21ème jour) suite à la prolifération et au remodelage vasculaire et veineux.
Réseaux vasculaires extra-embryonnaires :
Ils sont représentés par 2 types d’artères :
- 2 artères vitellines qui irriguent la paroi de la vésicule vitelline et apparaissent à ce niveau. Elles évoluent en direction du corps de l’embryon et participent à l’irrigation de l’intestin primitif. Ils vont s’anastomoser par la suite avec les vaisseaux intra-embryonnaires qui proviennent de l’aorte dorsale pour mettre en place le tronc coeliaque et les artères mésentériques supérieure et inférieure.
- 2 artères ombilicales (branches de l’aorte dorsale) qui vont irriguer les villosités choriales au cœur foetal.
Réseaux vasculaires intra-embryonnaires :
On a la mise en place de :
- 2 aortes dorsales qui s’étendent parallèlement au grand axe de l’embryon. Ces vaisseaux irriguent les grandes structures qui se mettent en place en premier à savoir le tube neural. Ces aortes vont donner des artères segmentaires qui irriguent le tube neural, des artères ventrales pour l’intestin primitif et, et 2 artères pour le corps de WOLFF. Au cours de la délimitation de l’embryon, ces 2 aortes dorsales s’incurvent ventralement et mettent en place le 1er arc aortique. L’ensemble des artères segmentaires, ventrales et les artères qui irriguent le corps de Wolff sont appelés les artères intersegmentaires.
- Les arcs aortiques : chaque arc aortique apparaît à mesure qu’un arc branchial se constitue mettent en place 6 paires d’arcs mais elles involuent au cours du développement. Les 2 premières paires régressent, la 5ème paire est rudimentaire. Les 3ème, 4ème, 6ème évoluent mais deviennent asymétriques.
La 3ème paire forme les artères carotides primitives.
La 4ème paire participe à la mise en place la crosse de l’aorte uniquement (le reste est formé par le cono-troncus) du côté gauche.
La 6ème paire forme l’artère pulmonaire gauche, le canal artériel et une structure qui fait communiquer l’artère pulmonaire avec l’artère descendante.
Le système veineux :
Il est représenté par 3 réseaux symétriques :
- réseau cardinal : + 2 veines antérieures qui drainent la partie céphalique + 2 veines postérieures drainant la partie caudale
- réseau vitellin : draine le tube digestif - réseau ombilical ramène le sang au placent
2-
RAPPEL HISTOLOGIQUE
A- LES TROIS TUNIQUES CONCENTRIQUES
Dans les différents segments de l’arbre vasculaire, ainsi que dans les vaisseaux lymphatiques, il est classique d’individualiser trois zones ou tuniques disposées concentriquement autour de la lumière et constituant la paroi :
1- L’intima
Au contact direct du sang. Elle se compose d’un endothélium variété d’épithélium pavimenteux, fait de cellules aplaties plus ou moins jointives selon les territoires, reposant comme tous les épithéliums sur une lame basale et un tissu conjonctif. On verra que loin d’être une frontière passive entre le sang et la paroi vasculaire, cette intima joue un rôle physiologique majeur.
2- La média
Elle est séparée dans de nombreux territoires de l’intima par une limitante élastique interne, faite d’une seule lame élastique (c’est à dire un agglomérat de fibres élastiques) disposée concentriquement autour de la lumière. Cette média assure les fonctions propres à la paroi dans la région considérée (élasticité, modification de calibre...), ce qui explique que sa composition varie selon les territoires (proportion variable de lames élastiques et de fibres musculaires lisses...).
3- L’adventice
Structure essentiellement conjonctive, parfois séparée de la média par une lame limitante externe de même structure que la limitante élastique interne, qui va faire le lien avec les structures de voisinage et contenir, pour les plus gros vaisseaux, les vaisseaux et les nerfs destinés à la paroi vasculaire (vasa et nervi vasorum).
Ces trois tuniques se retrouvent tout au long de l’arbre vasculaire, cœur compris, à l’exception des capillaires, où la structure est réduite au minimum, et se résume à un endothélium, une lame basale et une fine couche de conjonctif sous-endothélial.
La structure et les fonctions de la média et de l’adventice changent selon le segment de l’arbre vasculaire considéré. Celles de l’intima, même s’il y a des particularités plus ou moins prononcées selon les types de vaisseau, sont par contre pour l’essentiel communes à l’ensemble de l’appareil. Nous allons donc les détailler maintenant.
B- STRUCTURE DE L'INTIMA
La structure de base de l’intima est celle de tout épithélium.
1- Les cellules endothéliales
La surface est formée de cellules endothéliales, qui dérivent du mésoderme.
L’aspect typique est celui d’épithélium pavimenteux, c’est à dire fait de cellules très aplaties, dont le cytoplasme n’a pas plus de 1 à 2 μ d’épaisseur, sauf dans la zone où se situe le noyau, unique, qui bombe dans la lumière. Les cellules sont jointives, grâce à des dispositifs de jonction de type adhaerens. Des aspects légèrement différents peuvent se voir dans certains territoires. C’est ainsi que l’endothélium des vaisseaux cérébraux est fait de cellules hautement jointives, plus étroitement imbriquées que les cellules endothéliales habituelles. A l’inverse, certains capillaires sont au contraire limités par des cellules pratiquement indépendantes les unes des autres. Dans d’autres régions (veinules post-capillaires), les cellules endothéliales peuvent, sous l’influence de certains médiateurs, prendre un aspect turgescent, fait de cellules cubiques, suffisamment peu reliées à leur voisines pour permettre le passage de cellules sanguines du sang vers le compartiment interstitiel ou vice versa. Les cellules endothéliales sont loin d’être des éléments passifs et remplissent au contraire de nombreuses fonctions capitales :
- Fonction de barrière : d’abord. Cette fonction est d’autant plus nette que la cohésion cellulaire est grande. Dans le système nerveux, la forte cohésion des cellules endothéliales contribue à la constitution de la barrière hémato-encéphalique:
- Fonction de transport: La structure même des cellules endothéliales oriente vers une importante fonction de passage. La faible épaisseur du cytoplasme facilite les échanges. De plus, lorsqu’on regarde la cellule en microscopie électronique apparaissent des signes morphologiques de transport, notamment présence d’images de pinocytose avec traversée du
cytoplasme par des vésicules de transport. Celui-ci peut être facilité par la présence de pores membranaires, comme nous le verrons dans certains capillaires.
- Fonction de maintien du sang à l’état liquide: Le sang est un milieu complexe, correspondant à une suspension de cellules ou de fragments de cytoplasme cellulaire (les plaquettes) dans un liquide amorphe, le plasma. Le glycocalix des cellules endothéliales est riche en protéoglycanes très électronégatifs et repoussant donc les plaquettes qui sont, elles aussi chargées négativement. Le sang lui-même n’est pas un milieu stable. Le sang recueilli dans un tube ne reste pas spontanément à l’état liquide : les plaquettes s’activent et s’agrègent les unes aux autres ; une cascade de réactions biochimiques se produit, qui aboutit à la transformation du fibrinogène, soluble, en réseau de fibrine, insoluble (ce qui constitue la coagulation à proprement parler). Il en irait de même dans les vaisseaux, sans les cellules endothéliales. Celles-ci produisent en permanence des substances inhibant l’activation plaquettaire (tel la prostacycline), ainsi que le phénomène de coagulation (thrombomoduline par exemple). On comprend que toute altération des cellules endothéliales, tout blocage de la sécrétion de ces substances inhibitrices aura pour résultat la constitution d’un caillot dans la région considérée. C’est ce qui s’observe lorsque l’endothélium est détruit, ou se trouve en anoxie. Toute lésion endothéliale expose au risque de thrombose.
Les choses sont en réalité plus complexes. Ces phénomènes étant très finement régulés : la cellule endothéliale ne se contente pas d’inhiber la coagulation, elle libère aussi des substances activant celle-ci (thromboplastine ou facteur tissulaire), mais dans un rapport qui reste en faveur d’un blocage de la formation de fibrine. La cellule endothéliale sécrète en outre des activateurs de la fibrinolyse, c’est à dire du phénomène physiologique de lyse du caillot, qui suit toujours le phénomène de coagulation.
- Fonction de régulation du tonus de la paroi et du calibre vasculaire : La cellule endothéliale sécrète en permanence des médiateurs inhibant la contraction des fibres musculaires lisses présentes dans la paroi vasculaire : prostacycline, oxyde d’azote (NO), facteur hyperpolarisant endothélial (EDHF). Ces substances ont donc un effet vasodilatateur. Elles inhibent aussi l’agrégation plaquettaire. La cellule endothéliale peut capter et dégrader les amines vasopressives, ce qui contribue à un effet vasodilatateur. Comme pour la coagulation étudiée plus haut, il existe une balance permanente avec des médiateurs à effet opposé, c’est à dire vasoconstricteur, certains
sécrétés aussi par les plaquettes (thromboxane A2, sérotonine...), d’autres par la cellule endothéliale seule (endothéline)...
2- La lame basale
La lame basale se trouve au contact du pôle basal. Elle a la structure habituelle de toutes les lames basales: elle contient une forte proportion de collagène de type IV, de protéoglycanes, de laminine et de nidogène, ainsi que de fibronectine.
3- Le tissu conjonctif sous-endothélial
Le tissu conjonctif sous-endothélial a une épaisseur variable selon les segments vasculaires. Il est fait d’une matrice extra-cellulaire élaborée principalement par les cellules endothéliales (comprenant des fibres de collagène, des fibres élastiques et une substance fondamentale), de fibroblastes, de macrophages et, dans les zones ou ce conjonctif sous-endothélial est assez épais, de quelques fibres musculaires lisses. Ce tissu conjonctif joue un rôle mécanique de glissement de l’endothélium sur les couches sous-jacentes, un rôle nutritif et de transit, il peut enfin être le siège de manifestations pathologiques (réactions inflammatoires, formation de dépôts lipidiques plus ou moins calcifiés ou athérome, se compliquant d’une prolifération fibroblastique, formant de nombreuses fibres de collagène ce qui aboutit à l’athérosclérose). Voyons maintenant la structure histologique détaillée des différents segments vasculaires.
C- LES ARTERES
Elles font suite au cœur. Sont appelées artères les vaisseaux convoyant le sang du cœur jusqu’aux vaisseaux capillaires. Les artères de la grande circulation contiennent du sang artériel, c’est à dire oxygéné, alors que les artères pulmonaires contiennent du sang veineux. La terminaison des artères peut se faire sur un mode terminal (chaque branche étant indépendante des voisines, ce qui aura des conséquences graves en cas d’obstruction : infarctus myocardique, rénal, cérébral) ou anastomotique (auquel cas des suppléances pourront se faire en cas d’obstruction, c’est le cas de la majorité des organes).
La structure histologique des artères répond à la structure de base décrite plus haut, avec l’emboîtement des trois tuniques, intima, média et adventice. Il exits cependant des variations
importantes selon le segment considéré, qui correspondent à des fonctions et à une problématique différentes. Il est classique de distinguer trois types d’artères, en partant du cœur : les artères élastiques, les artères musculaires et les artérioles.
Figure 3 :
Différente couche de la paroi artérielle1- Les artères élastiques
Elles correspondent aux plus gros vaisseaux (aorte, artères pulmonaires, carotides, sous-clavières). Leur rôle essentiel est d’amortir l’ondée systolique, et de transformer le débit cardiaque discontinu en courant sanguin semi-continu. Ceci impose à la paroi d’emmagasiner une partie de l’énergie mécanique communiquée par le cœur à l’ondée systolique pour la restituer lors de la diastole. Il faut donc que la paroi soit riche en structures élastiques.
Ces artères ont des caractéristiques macroscopiques communes, qui les rendent faciles à identifier : il s’agit de vaisseaux de gros calibre, à lumière ronde, et dont la paroi est relativement peu épaisse si on la rapporte au diamètre du vaisseau.
a- L’intima
L'intima a la structure vue plus haut, est épaisse, avec un conjonctif sous endothélial abondant, contenant des fibroblastes et des fibres musculaires lisses.
b- La média
La média comprend environ 80 lames élastiques, disposées concentriquement autour de la lumière. Ces lames concentriques sont reliées d’une couche à l’autre par des lames obliques. Ces lames élastiques ont un aspect ondulé facilement reconnaissable dès le faible grossissement. L’espace laissé libre entre les lames est occupé par de la substance fondamentale, des branches de petits vaisseaux venant de l’adventice, par quelques fibroblastes et surtout par des cellules musculaires lisses, qui du fait de leur forme prennent le nom de cellules rameuses, et qui s’attachent aux lames élastiques voisines. Ces cellules rameuses jouent un rôle de régulation de la tension moyenne des lames. On peut voir dans des situations pathologiques des déformations de cette média, sous forme de resserrement ou sténose, ou de dilatation, aboutissant alors à la formation d’anévrysmes, qui sont des zones de moindre résistance, où risque de se produire une rupture.
La limitante élastique interne est peu visible, car la média est elle-même principalement constituée de lames élastiques. La limitante élastique externe est aussi peu visible que l’interne.
c- L'adventice
L’adventice a une structure de base conjonctive, avec des fibres de collagène et des fibres élastiques disposées dans deux directions : perpendiculairement à l’axe du vaisseau, elles permettent l’accrochage de l’artère aux structures de voisinage; parallèlement à l’axe du vaisseau, elles forment des trousseaux fibreux qui augmentent la solidité de la structure dans le sens de la longueur.
Cette adventice contient aussi des vaisseaux «propres», ou vasa vasorum, destinés à la vascularisation de la paroi. On admet que le tiers interne, luminal, de la paroi se nourrit directement à partir du sang contenu dans la lumière et que le tiers externe, adventiciel, est irrigué par ces vasa vasorum. La zone moyenne dépendrait des deux mécanismes, mais serait en fait la plus fragile, ce qui expliquerait que les dégénérescences (principalement les dilatations) se produirait dans cette zone. L’adventice contient aussi des fibres nerveuses, appartenant au système végétatif, motrice pour l’innervation des fibres musculaires lisses et sensitives. La signification de ces dernières découlent directement des propriétés élastiques de la média : la déformation des lames élastiques y est fonction de la pression artérielle régnant
dans la lumière. Ces fibres sensitives, sensibles à la déformation de la paroi, sont donc en fait des baro-récepteurs. Elles sont particulièrement abondantes dans certaines zones (crosse de l’aorte, glomus carotidien).
2- Les artères musculaires
Elles font suite aux précédentes. Elles jouent un rôle différent : il ne s’agit plus de transformer un flux sanguin discontinu en flux semi-continu, mais de distribuer le sang aux différents territoires et d’adapter le débit aux besoins métaboliques de la région. Ces artères devront donc pouvoir modifier leur calibre, ce qui va logiquement se traduire par la présence dans la média d’un grand nombre de fibres musculaires lisses disposées concentriquement. La transition entre artère élastique et artère musculaire n’est pas abrupte, mais on observe un passage progressif de l’un à l’autre type. D’un point de vue macroscopique, ces artères musculaires ont un calibre moindre, une lumière arrondie en coupe, et une paroi relativement épaisse par rapport au diamètre.
a- L’intima
L'intima a la même structure que ce qui a été vu précédemment, mais son épaisseur et sa cellularité sont moindres.
b - La média
Elle est faite de nombreuses couches concentriques de fibres musculaires lisses. On les distingue assez facilement de l’empilement des lames élastiques présentes dans les artères élastiques par le fait que ces structures allongées contiennent un ou deux noyaux aplatis disposés longitudinalement.
La limitante élastique interne est bien visible. Elle est faite d’une seule lame élastique disposée autour de la lumière. Elle peut par place se dédoubler transitoirement. Elle empêche l’occlusion complète du vaisseau, même lorsque les fibres lisses de la média sont contractées au maximum. C’est ce qui explique la gravité des plaies artérielles, qui sont potentiellement mortelles si elles ne sont pas traitées rapidement par suture ou par pose (transitoire) d’un garrot : le sang continue de jaillir en saccade (car le flux sanguin n’est pas constant même au sortir de la zone des artères élastiques) inexorablement. La limitante élastique externe est bien
visible.
c- L'adventice
L’adventice a grossièrement la même structure que ce qui a été vu pour les artères élastiques. L’innervation est très nette. Les vasa vasorum sont présents sauf dans les artères les plus fines.
3- Les artérioles
Disposées distalement, à la suite des artères musculaires, les artérioles ont un calibre fin et leur structure histologique est considérablement simplifiée.
Il est classique de distinguer les métartérioles, qui encore une limitante élastique interne et où la média contient plusieurs assises de fibres lisses et les artérioles proprement dites, que l’on peut décrire ainsi :
Figure 4 :
Schéma des différentes couches de la paroi d’une artère musculaire de petit calibre.a- L’intima
Elle comprend l’endothélium et la lame basale. Le conjonctif sous-endothélial est réduit à sa plus simple expression. Il n’y a pas de limitante élastique interne ni externe.
b- La média
Elle est constituée d’une seule assise de fibres musculaires lisses disposées concentriquement autour de la lumière.
Elle est de faible épaisseur et ne contient pas de vasa vasorum.
Chaque artériole débouche sur un réseau capillaire. Il existe généralement des renforcements focaux des fibres lisses constituant les sphincters pré-capillaires.
D- LES CAPILLAIRES
Ce sont les vaisseaux les plus fins de l’organisme (leur nom évoque les cheveux). Ils sont disposés en réseau enchevêtré au sein même des organes. C’est à leur niveau que se produisent les échanges entre le sang et le compartiment interstitiel. On estime à 700 m2 environ la surface totale d’échange chez un sujet adulte normal. Le débit dans un capillaire donné peut subir d’importantes variations pour s’adapter aux besoins.
1- Les différents types histologiques de capillaires
On distingue histologiquement trois types de capillaires : les capillaires typiques non fenêtrés (les plus nombreux), les capillaires typiques fenêtrés et les capillaires sinusoïdes.
- Les capillaires typiques non fenêtrés : Ils sont présents dans la plupart des territoires de l’organisme. Ils ont une structure extrêmement simple, où on ne retrouve pas d’organisation en trois tuniques. Ils se limitent à un endothélium, doublé d’une lame basale sur laquelle s’implante vers l’extérieur un fin grillage de fibres de réticuline, constituant le lit capillaire. Vu en trois dimensions à faible grossissement, le capillaire apparaît ainsi comme un tube limité, selon la finesse du capillaire, par 1 à 3 cellules endothéliales sur une section donnée. Ces cellules endothéliales sont doublées d’une lame basale plus ou moins épaisses selon les régions. Sur cette basale s’implante un fin grillage de fibres de réticuline : c’est le lit capillaire. Il n’y a pas de média ni d’adventice : le capillaire baigne dans le liquide interstitiel. - Les capillaires typiques fenêtrés : Ils s’observent dans des organes où les échanges sont intenses (glomérule rénal, glandes endocrines...). La structure histologique est comparable à celle qui vient d’être décrite, mais il existe dans l’épaisseur des cellules endothéliales des pores, bien visibles en microscopie électronique. Ces pores sont souvent, au moins partiellement, « diaphragmés », c’est à dire qu’ils ne constituent pas de véritables trous, mais sont des zones où la membrane plasmique limitant la lumière s’accole à la membrane plasmique qui repose sur la lame basale. Il y cependant des capillaires fenêtrés avec de vrais
pores.
a- Les capillaires sinusoïdes
Ils se rencontrent essentiellement dans trois organes : le foie, la rate et la moelle osseuse. Il s’agit des trois organes où, au cours de la vie, se déroule l’hématopoïèse, à un moment ou à un autre (foie et rate chez l’embryon et en partie chez le fœtus, moelle à partir de la fin de la vie fœtale). Leur structure est encore plus simple : ils sont formés de cellules endothéliales disjointes, doublées de façon non constante d’une lame basale (qui n’existe pas dans le foie). Ces capillaires sinusoïdes sont en perpétuel remaniement : des cellules endothéliales peuvent partir dans la circulation, d’autres arrivent. A proximité des cellules endothéliales on trouve de nombreux macrophages, qui peuvent même parfois limiter eux-mêmes la lumière vasculaire. Ces macrophages sont généralement sur le versant extra-vasculaire dans la moelle et la rate, endovasculaire dans le foie (cellules de Küpffer). Ces capillaires sinusoïdes permettent un passage très facile non seulement du plasma mais aussi des cellules : rien d’étonnant à ce qu’on les rencontre dans les organes hématopoïétiques.
b- Le réseau capillaire
Les capillaires n’existent pas à l’état isolé mais forment un réseau organisé, qui s’intercale habituellement entre une artériole et une veinule. Il existe des exceptions : réseau capillaire qui s’articule entre deux artérioles (glomérule rénal) ou entre deux veinules (drainage du sang venu de la veine porte dans le foie). Cette organisation (réseau capillaire compris entre deux vaisseaux de même nature) porte le nom de réseau admirable. Il n’y a pas de réseau capillaire dans la cornée, et pratiquement pas dans les tendons.
Figure 5:
Schéma d’un lit capillaire au niveau de l’anastomose artério-veineuseEn amont, une anastomose artério-veineuse : celle-ci met directement en communication une artériole et une veinule. A ce niveau, l’artériole est particulièrement riche en fibres musculaires lisses, permettant de contrôler le débit : plus celui-ci sera important, plus faible sera la quantité de sang passant dans le réseau capillaire. Ces shunts sont particulièrement abondants dans la peau et participent à la thermorégulation. Une variété particulière d’anastomose artério-veineuse est représentée par les glomus, qui sont notamment abondant au niveau du lit unguéal. Les shunt prend un aspect enroulé, les fibres musculaires lisses y sont très abondantes et l’ensemble de la structure est enfermée dans un sac fibreux inextensible et richement innervé. La contraction maximale de ce glomus unguéal aboutit à l’ « onglet », phénomène douloureux se produisant au froid.
d- Le capillaire de jonction
Le réseau capillaire est centré sur un capillaire principal ou capillaire de jonction, de 200 μm environ de diamètre. Celui-ci, à la différence des capillaires ordinaires contient dans sa paroi des péricytes, cellules contractiles non musculaires (comme les sont les myofibroblastes). Le capillaire de jonction ne peut se fermer complètement.