HAL Id: tel-02324611
https://tel.archives-ouvertes.fr/tel-02324611
Submitted on 22 Oct 2019
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Etude du rôle de VGLUT3, un transporteur vésiculaire
du glutamate atypique, dans l’amygdale cérébrale dans
le contexte de peur acquise
Nida Chabbah
To cite this version:
Nida Chabbah. Etude du rôle de VGLUT3, un transporteur vésiculaire du glutamate atypique, dans l’amygdale cérébrale dans le contexte de peur acquise. Neurosciences [q-bio.NC]. Université Pierre et Marie Curie - Paris VI, 2017. Français. �NNT : 2017PA066280�. �tel-02324611�
Université Pierre et Marie Curie
Ecole doctorale 3C : Cerveau, Cognition, Comportement
Neuroscience Paris Seine / Systèmes Glutamatergiques Normaux et Pathologiques
Etude du rôle de VGLUT3, un transporteur vésiculaire du
glutamate atypique, dans l’amygdale cérébrale dans le
contexte de peur acquise.
Par Nida CHABBAH
Thèse de doctorat de Neurosciences
Dirigée par les Drs. Salah El MESTIKAWY et Stéphanie DAUMAS
Présentée et soutenue publiquement le 20 Octobre 2017
Devant un jury composé de :
Dr. Aline DESMEDT Rapporteur
Dr. Laurence LANFUMEY Rapporteur
Pr. Rachel SHERRARD Examinateur
Dr. Dominique HASBOUN Examinateur
Dr. Giovanni MARSICANO Examinateur
Dr. Salah El MESTIKAWY Directeur de thèse
« The only thing we have to fear is fear itself »
Franklin D. Roosevelt, 1933
« L’eau qui ne court pas fait un marais, l’esprit qui ne travaille pas fait un sot. »
« Au fond, Dieu veut que l’homme désobéisse. Désobéir, c’est chercher. »
REMERCIEMENTS
Je tiens tout d’abord à remercier les Drs. Aline Desmedt et Laurence Lanfumey d’avoir accepté d’être les rapporteurs de cette thèse, ainsi que les Drs. Dominique Hasboun et Giovanni Marsicano, et le Pr. Rachel Sherrard d’avoir pris le temps de lire ce mémoire, et de juger et discuter de mes travaux de recherche.Je souhaite, ensuite, remercier Salah. Merci de m’avoir accueillie dans ton équipe exclusivement féminine. Les discussions scientifiques que j’ai partagées avec toi m’ont beaucoup appris et ouvert l’esprit sur d’autres aspects de mon travail. Merci d’avoir été présent quand je me trouvais face à des impasses, de m’avoir prodigué d’excellents conseils et récompensée à base de glaces Berthillon.
Mes remerciements s’adressent ensuite à toi, Stéphanie. Quand je t’ai rencontrée, j’étais encore une de tes étudiantes de licence et je ne me voyais pas faire une thèse avec une autre personne que toi. La communication a tout de suite été facile entre nous, ce qui nous a permis d’avancer, d’échanger et de réflechir assez librement. Merci pour la confiance que tu m’as accordée, pour la grande liberté de travail que tu m’as laissée, et pour tous les conseils que tu m’as donnés. Travailler à tes côtés pendant ces trois années m’a énormément enrichie tant sur le plan professionnel qu’humain. Steph, je pense que je peux dire que l’on s’est bien choisi !
Je voudrais également remercier les personnes qui m’ont aidée dans mes travaux : les membres de la plateforme d’imagerie du B7, et particulièrement Susanne Bolte, Richard Schwartzmann et Jean-François Gilles,
mais aussi Sylvie Dumas, sans qui la réalisation des FISHs aurait été très compliquée pour moi. Je tiens également à remercier les animaliers du B7 et du B8, Fabrice et Goran. Merci Goran pour l’excellent travail que tu as réalisé pour la gestion de nos nombreuses lignées. Tu nous as beaucoup aidées.
Merci à tous les membres de mon équipe : Véro. B, Véro. F, Odile, Fiona et Nina d’avoir partagé cette expérience avec moi.
Odile, merci pour tout le soutien logistique que tu gères et ta bonne humeur ! Tu as un rôle essentiel au sein de notre équique.
Véro. B et Véro. F, merci pour les échanges scientifiques que nous avons eus.
Un grand merci aux locataires du bureau des doctorants du B4, porte 422 passés et présents qui ont su rendre cette expérience exceptionnelle et agréable.
Merci à vous, Lauriane, Diana et Elsa, les « grandes sœurs », de m’avoir transmis ce que vous saviez avant votre départ du labo.
J’en viens à présent aux membres du « Girls Band » du bureau : Sara, Raphaële, Fiona et Nina. Merci les filles d’avoir été là quand ça n’allait pas (parce que beaucoup de mauvaises
péripéties nous avons eues ensemble) et quand ça allait aussi, pour votre soutien indéfectible et pour les nombreuses réflexions phylosophiques que nous avons partagées sur la vie.
Sara, tu as été la médiatrice, la voix de la sagesse qui as su tamponner les frictions entre nous (presque jusqu’à la fin !). Merci de m’avoir prodigué les premiers secours quand j’avais un coup de moins bien tant psychologiquement que physiquement.
Raph, nos traditionnelles pauses potins-cl*** ont grandement participé à l’amélioration de ma psyché, malgré qu’elles m’aient exposée à un tabagisme passif certain. C’était le prix à payer !
Fiona, merci d’avoir apporter ta joie de vivre et ta gentillesse au bureau.
Nina, on a commencé en même temps notre thèse et on va la terminer presque au même moment également. Malgré qu’on ne se soit pas toujours bien entendu, on a toujours pû compter l’une sur l’autre en cas de besoin au labo. Merci d’avoir été là.
Bonne chance à Sara et Nina, qui soutiennent leur thèse dans peu de temps, et bon courage à Raph et Fiona pour la suite de la thèse ! Vous allez y arriver !!
Je voudrais également remercier les autres personnes du B4 pour leur accueil. Merci à Steph DG, Vincent, Victor, Franck, Barbara et Sophie pour les échanges que nous avons eus au niveau scientifique ou autre.
Merci Steph DG pour tes conseils et pour toutes les histoires que tu m’as racontées et qui ont participées à l’amélioration de mon humeur.
J’aimerais à présent remercier mes proches.
A mes parents, pour leur soutien sans faille au cours de ces trois années, pour toujours m’avoir poussée à donner le meilleur de moi-même et pour n’avoir jamais cessé de m’encourager, je vous remercie du fond du cœur. Merci à mes frères et sœurs : Staf, tu as réussi à me supporter pendant la rédaction en gardant ton calme ! Chapeau !, Sbe, ta contribution à mon ravitaillement a été essentielle !, Zazou, merci de m’avoir permis de me changer les idées avec tes anecdotes.
Merci à mes amis Adeline, A’dem, Thomas, Sami, Raphaëlle et Nathalie, qui pour certains d’entre eux, ont vécu une expérience similaire à la mienne (n’est-ce-pas les futurs docteurs Bokhari et Ayari ?). Merci d’avoir été là, pour votre soutien, pour tous les moments que l’on a partagés ensemble, pour l’annuel bal des pompiers grâce au « Caporal Artis » et votre amitié.
J’en arrive maintenant à la personne qui a su me faire découvrir et aimer un monde qui était inconnu pour moi, celui des Arts Martiaux. Merci à toi, Sifu Didier Beddar de me permettre d’apprendre à tes côtés le Wing Chun et de profiter de tes enseignements et de tes larges connaissances dans les autres pratiques martiales. J’ai commencé mes travaux de recherche en même temps que mon apprentissage martial, qui m’a beaucoup aidé à gêrer différement certaines situations tant au labo que dans la vie quotidienne. J’ai beaucoup appris avec toi pendant c’est trois ans, et ce n’est pas fini !
Merci à mes frères et sœurs d’armes de l’Académie : Nelly, Josse, Brice, Jacky et Medy, d’avoir été présents, de m’avoir soutenue, et parfois de m’avoir plus ou moins énervée (hein, Medy !) et pour les bons moments que l’on a passés ensemble, qui, j’en suis sûre, ne seront pas les seuls.
Josse, merci d’avoir veillé sur moi, même après ton départ à Bordeaux. Tu portes incontestablement bien l’attribut de « Bienveillant ». Et merci pour ta participation à cette thèse, tes corrections ont été les premières que j’ai reçues !
Nelly, tu as été l’oreille attentive à mes histoires de labo mais pas que, pendant ces trois ans. On a partagé trop de choses pour tout résumer en une phrase, alors je le ferai en un mot : Merci !
Enfin, je voudrais remercier un acteur important dans cette expérience qu’a été la thèse, l’Université de Jussieu. Des sous-sols au toît, du banc des amphithéâtres à la fonction d’enseignant, de TV Jussieu aux soirées étudiantes, des apéros sur les quais à ceux du « potager », du CPM à la DVE, … (j’en ai encore d’autres, mais je vais m’arrêter là), je pense avoir fait le tour de ce qui est possible de vivre à l’intérieur de tes murs. Après 7 ans d’études, je finis par te quitter. Merci pour toutes les superbes aventures que tu m’as permis de vivre. Merci à tous ceux que j’aurai pu oublier,
Et merci à vous, lecteurs de cette thèse.
SOMMAIRE
LISTE DES ABRÉVIATIONS ... 10
INTRODUCTION GÉNÉRALE 13
I/ GÉNÉRALITÉS SUR LA NEUROTRANSMISSION ... 14
II/ LE SYSTÈME GLUTAMATERGIQUE ... 16
II.1/LEGLUTAMATE ... 16
II.1.a) À la découverte du glutamate … ... 16
II.1.b) Un acteur clé du métabolisme... 17
II.1.c) La fonction particulière de NT... 18
II.2/LASYNAPSEGLUTAMATERGIQUE... 20
II.2.a) Organisation structurelle de la synapse glutamatergique ... 20
II.2.b) La neurotransmission glutamatergique ... 21
II.2.c) Les acteurs majeurs de la transmission glutamatergique ... 24
II.3/LESTRANSPORTEURSVÉSICULAIRESDUGLUTAMATE ... 29
II.3.a) Les différentes familles de transporteurs vésiculaires ... 29
II.3.b) La découverte des VGLUTs ... 32
II.3.c) La structure des VGLUTs ... 33
II.3.d) Propriétés biochimiques et pharmacologiques des VGLUTs ... 35
II.3.e) Distribution anatomique de VGLUT1 et VGLUT2... 37
III/ LE TRANSPORTEUR VÉSICULAIRE DU GLUTAMATE 3 : VGLUT3 ... 44
III.1/DISTRIBUTIONDEVGLUT3 ... 44
III.2/VGLUT3DANSLESNEURONESNON-GLUTAMATERGIQUES ... 47
III.2.a) VGLUT3 dans les neurones sérotoninergiques ... 47
III.2.b) VGLUT3 dans les neurones GABAergiques ... 50
III.2.c) VGLUT3 dans les neurones cholinergiques ... 53
III.3/LASYNERGIEVÉSICULAIRE ... 56
III.4/ AUTREDISTRIBUTIONDEVGLUT3 ... 59
III.4.a) VGLUT3 dans le reste du système nerveux ... 59
III.4.b) VGLUT3 dans les organes sensoriels ... 60
III.4.c) VGLUT3 dans les organes périphériques ... 64
IV/ L’AMYGDALE ET LES MÉMOIRE AVERSIVES ... 66
IV.1/STRUCTUREDUCOMPLEXEAMYGDALIEN ... 66
IV.1.a) Organisation morphologique et structurelle ... 66
IV.1.b) Organisation cellulaire ... 69
IV.2/FONCTIONSASSOCIÉESÀL’AMYGDALE ... 72
IV.2.a) La découverte du rôle de l’amygdale dans la peur ... 72
IV.2.b) L’amygdale dans les processus d’apprentissage et de mémoires de peur ... 74
IV.2.c) Autres fonctions ... 77
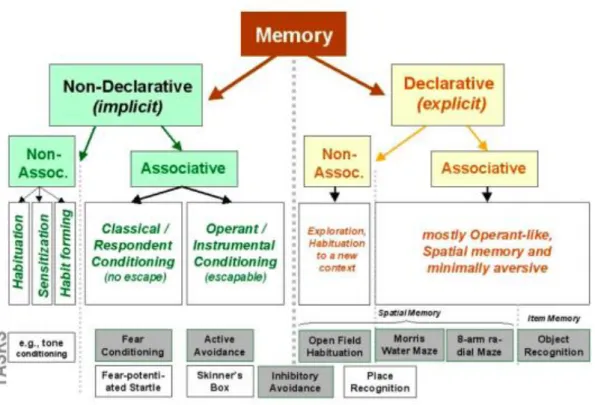
IV.3/APPRENTISSAGEETMÉMOIRESÉMOTIONNELS ... 78
IV.3.a) Différents types d’apprentissage et de mémoire ... 78
IV.3.b) Les mémoires aversives par le conditionnement de peur ... 80
IV.4/LERÉSEAUAMYGDALIENDANSL’APPRENTISSAGEASSOCIATIFAVERSIF ... 82
IV.4.a) Les connexions extra-amygdale ... 83
IV.4.b) Les connexions intra-amygdale ... 87
IV.4.c) Autres régions impliquées dans le réseau amygdalien ... 96
V/ LE TROUBLE DE STRESS POST-TRAUMATIQUE (TSPT) ... 103
V.2/LETSPTDANSLERÉSEAUAMYGDALIEN ... 104
V.3/LESTRAITEMENTSDUTSPT ... 108
PROBLÉMATIQUE 112
MATÉRIEL ET MÉTHODES GÉNÉRALES 115
I/ ANIMAUX ... 116
II/ LES DIFFÉRENTES LIGNÉES GÉNÉTIQUES ... 116
II.1/LALIGNÉEVGLUT3-/- ... 116
II.2/LALIGNÉEVGLUT3 FLOX/FLOX ... 117
II.3/LESDOUBLESMUTANTS :LESLIGNÉESVGLUT3FLOX-VIAATCRE,VGLUT3FLOX-SERTCRE ET VGLUT3 FLOX-CHATCRE ... 117
III/ TECHNIQUES ANATOMIQUES ... 118
III.1/HYBRIDATIONINSITUFLUORESCENTE(FISH) ... 118
III.2/IMMUNOFLUORESCENCE ... 120
III.3/IMMUNO-AUTORADIOGRAPHIE-IAR ... 122
IV/ CHIRURGIE STÉRÉOTAXIQUE ... 122
V/ TESTS COMPORTEMENTAUX ... 123
V.1/ACTIVITÉLOCOMOTRICE–TESTD’ACTIMÉTRIE ... 123
V.2/TESTDEL’OPENFIELD(OF) ... 124
V.3/TESTDULABYRINTHEENCROIXSURELEVÉ–EPM(ELEVATED PLUS MAZE) ... 124
V.4/SENSIBILITÉAUXCHOCSÉLECTRIQUES... 125
V.5/TESTDUCONDITIONNEMENTDEPEUR–FC(FEAR CONDITIONING) ... 125
V.6/TESTD’EXTINCTIONDECONDITIONNEMENTDEPEUR ... 126
VI/ STATISTIQUES ... 128
RÉSULTATS 129
ÉTUDE I : CARACTÉRISATION ANATOMIQUE DE VGLUT3 DANS L'AMYGDALE BASOLATÉRALE CHAPITRE I :NATURE DES NEURONES VGLUT3 POSITIFS DE L’AMYGDALE BASOLATERALE .... 130
I/ INTRODUCTION ... 131
II/ MATERIEL ET METHODES ... 132
II.1/ANIMAUX ... 132
II.2/DOUBLE HYBRIDATION IN SITU FLUORESCENTE ... 132
III/ RESULTATS... 132
III.1/CARACTERISATION DE LA NATURE DES NEURONES VGLUT3 POSITIFS DE L’AMYGDALE BASOLATERALE ... 132
III.2/QUANTIFICATION DES NEURONES VGLUT3 POSITIFS DE L’AMYGDALE BASOLATERALE ... 133
IV/ DISCUSSION ... 134
CHAPITRE II : NATURE DES TERMINAISONS VGLUT3 POSITIVES DE L’AMYGDALE BASOLATERALE ... 136
I/ INTRODUCTION ... 137
II.1/ANIMAUX ... 138
II.2/IMMUNOFLUORESCENCE ET QUANTIFICATION ... 138
III/ RESULTATS... 138
III.1/IMMUNOFLUORESCENCES VGLUT3 ET VIAAT,VACHT, OU VMAT2 ... 138
III.2/IMMUNOFLUORESCENCES VGLUT3 ET PV OU CCK ... 140
IV/ DISCUSSION ... 142
POINTSIMPORTANTSDEL'ÉTUDEI………145
ÉTUDE II : CARACTÉRISATION COMPORTEMENTALE DE VGLUT3 DANS L'AMYGDALE BASOLATÉRALE CHAPITRE I : LE ROLE DE VGLUT3 DANS LES MEMOIRES AVERSIVES A TRAVERS L'ETUDE DES SOURIS VGLUT3-/- ………..146
I/ INTRODUCTION ... 147
II/ MATERIEL ET METHODES ... 148
II.1/PROTOCOLE DE SENSIBILITE A LA DOULEUR ... 148
II.2/TEST DU CONDITIONNEMENT DE PEUR (FC) ET D’EXTINCTION ... 149
III/ RESULTATS... 149
III.1/SENSIBILITE A LA DOULEUR ... 149
III.2/TEST DU CONDITIONNEMENT DE PEUR -FC... 150
III.3/TEST D’EXTINCTION DE CONDITIONNEMENT DE PEUR ... 153
IV/ DISCUSSION ... 155
CHAPITRE II: LE ROLE DES DIFFERENTS SOUS-SYSTEMES VGLUT3 POSITIFS DANS LES MEMOIRES AVERSIVES… 160 I/ INTRODUCTION ... 161
II/ MATERIEL ET METHODES ... 163
II.1/ANIMAUX ... 163
III.2/TESTS COMPORTEMENTAUX ... 164
III/ RESULTATS... 164
III.1/VALIDATION ANATOMIQUE DES DIFFERENTES LIGNEES GENETIQUES ... 164
III.2/LES SOURIS VGLUT3FLOX-SERTCRE ... 167
III.2.a) Activité locomotrice ... 167
III.2.b) Anxiété ... 167
III.2.c) Test du conditionnement de peur - FC ... 169
III.2.d) Test d’Extinction de conditionnement de peur ... 170
III.3/LES SOURIS VGLUT3FLOX-VIAATCRE ... 172
III.3.a) Activité locomotrice ... 172
III.3.b) Anxiété ... 173
III.3.c) Test du conditionnement de peur - FC ... 174
III.3.d) Test d’Extinction de conditionnement de peur ... 175
III.4/LES SOURIS VGLUT3FLOX-CHATCRE ... 177
III.4.a) Activité locomotrice ... 177
III.4.b) Anxiété ... 177
III.4.d) Test d’Extinction de conditionnement de peur ... 179
IV/ DISCUSSION ... 181
CHAPITRE III : LE ROLE DE POPULATIONS GABAERGIQUES ET CHOLINERGIQUES VGLUT3 POSITIVES SPECIFIQUE DANS LES MEMOIRES AVERSIVES ………188
I/ INTRODUCTION ... 189
II/ MATERIEL ET METHODES ... 190
II.1/ANIMAUX ... 190
II.2/ETUDES COMPORTEMENTALES ... 191
III/ RESULTATS... 191
III.1/INVALIDATION DE VGLUT3 DANS LES INTERNEURONES GABAERGIQUES DE L’AMYGDALE BASOLATERALE... 191
III.1.a) Validation des injections ... 191
III.1.b) Activité locomotrice ... 192
III.1.c) Anxiété ... 192
III.1.d) Test du conditionnement de peur - FC ... 195
III.1.e) Test d’Extinction de conditionnement de peur ... 197
III.2/INVALIDATION SPECIFIQUE DE POUR VGLUT3 DANS LES NEURONES CHOLINERGIQUES DU BASAL FOREBRAIN ... 199
III.2.a) Validation des injections ... 199
III.2.b) Activité locomotrice ... 199
III.2.c) Anxiété ... 200
III.2.d) Test du conditionnement de peur - FC ... 201
III.2.e) Test d’Extinction de conditionnement de peur ... 203
IV/ DISCUSSION ... 205
POINTSIMPORTANTSDEL'ÉTUDEII………..210
DISCUSSION ET CONCLUSION GÉNÉRALES 211
RÉFÉRENCES ………220
TABLE DES ILLUSTRATIONS ………..266
LISTE DES ABRÉVIATIONS
AAV Adeno-associated virusAC Adénylate Cyclase
ACh Acétylcholine
ALAT ALanine AminoTransferase
AMPA Acide alpha-amino-3-hydroxy-5-Methyl-4-isoxazole Propionique AMPc Adénosine MonoPhosphate cyclique
APC Amino acid/Polyamine/organocation
AP-5 Acide 2-amino-5-Phosphonovalérique
ARNm Acide ribonucléique messager ASAT ASpartate AminoTransferase ATP Adénosine Tri-Phosphate
BA Noyau Basal de l’amygdale
BDNF Brain-Derived Neurotrophic Factor
BLA Complexe/Amygdale Basolatérale
BF Basal Forebrain
BNPI Brain-specific Na+-dependent inorganic Phosphate co-transporter
BNST Bed Nucleus of Stria Terminalis
BMA Noyau Basomédial de l’amygdale
Ca2+ Ion Calcium
Calb/CB Calbindine
CB1 Récepteur aux cannabinoides de type 1 CCCP Carbonyl Cyanide M-Chloro-Phényldrazone CCK Cholécystokinine
CeA Noyau Central de l’amygdale
CeL Région latérale du Noyau Central de l’amygdale CeM Région médiale du Noyau Médial de l’amygdale ChAT Choline Acetyl Transferase
Cl- Ion Chlore
CPF Cortex PréFrontal
CPFm Cortex PréFrontal médian CPFmd Cortex PréFrontal médio-dorsal
DA Dopamine
dACC Dorsal Anterior Cingulate Cortex
DAG DiAcylGlycérol
DGL DiacylGlycerol Lipase
DIDS 4,4’-diiothiocyanatostilbène-2,2’-disulfonique
DNPI Differentiation-associated Na+-dependent Inorganic Phosphate co-transporter
DNQX 6,7-DiNitroQuinoXaline-2,3-dione
DVC Dorsal Vagal Complex
EAAC1 Excitatory Amino Acid Carrier 1
EAAT Excitatory Amino Acid Transporter
EPSP Excitatory PostSynaptic Potentiel
GABA Acide gamma-aminobutyrique GAD Glutamate Décarboxylase GDH Glutamate DeHydrogenase
GLAST-1 Glutamate Aspartate Transporter-1
Gln Glutamine
GlpT Glycerol-3-phosphate Transporter
GLS1/PAG Phosphate-Activated Glutaminase
GLT1 Glutamate Transporter 1 Glu Glutamate GRP Gastrine GS Glutamine Synthétase HPCD Hippocampe Dorsal HPCV Hippocampe Ventral
ICM Intercalated Cell Masses
ICML Cellules Intercalées latérales
ICMMD Cellules intercalées médio-dorsales
ICMMV Cellules Intercalées médio-ventrales
iGluR Ionotropic Glutamate Receptor
IL Région InfraLimbique du cortex préfrontal
IPF Insulin Promoter Factor
IP3 Inositol-3-Phosphate
K+ Ion Potassium
KO KnockOut
LA Noyau Latéral de l’amygdale
LAD Région dorsale du Noyau Latéral de l’amygdale
LAV Région ventrale du Noyau Latéral de l’amygdale
LTP Long-Term Potentiation
MFS Major Facilitator Super Families
Mg2+ Ion Magnésium
MGE Medial Ganglionic Eminence
mGluR Metabotropic Glutamate Receptor
mIPSC Miniature Inhibitory PostSynaptic current
MSN Medium Spiny Neuron
Na+ Ion Sodium
NBM Noyau Basal de Meynert
NE Noradrénaline
NEM N-éthylmaléimide NMDA N-Methyl-D-Aspartate
nNOS Neuronal Nitric Oxide Synthase
NO Oxide nitrique
NPY Neuropeptide Y
NPT Na+-dependent Phosphate Transporter
PA Potentiel d’Action PAG PeriAqueductal Grey
Pi Phosphate inorganique
PIP2 Phosphatidylinositol-4,5-diphosphate PKA Protéine Kinase A
PKC Protéine Kinase C
PL Région PréLimbique du cortex préfrontal PLC Phospholipase C PSD Postsynaptic Density PV Paravalbumine RD Raphé Dorsal RM Raphé médian SC Stimulus Conditionné
SERT Serotonin transporter
SI Stimulus Inconditionné SLC Solute Carrier family
SN Stimulus Neutre
SNC Système nerveux central SNP Système nerveux périphérique
SOM Somatostatine
SSRI Selective Serotonin Reuptake Inhibitor
synCAM Synaptic Vesicle Precursor
TANs Tonically Active Neurons
TrkB Tropomyosin receptor kinase B
TSPT Trouble de Stress Post-Traumatique
TTX Tétrodotoxine
VAChT Vesicular Acetylchololine Transporter
VEAAT Vesicular Excitatory Amino Acid Transporter
VIAAT Vesicular inhibitory amino acid Transporter
VGAT Vesicular GABA Transporter
VGLUT Vesicular Glutamate Transporter
VMAT Vesicular Monoamine Transporter
VNUT Vesicular Nucleotide Transporter
VS Vésicule Synaptique ZA Zone active H+ Gradient électrochimique pH Gradient de pH Gradient électrique 2-AG 2-Arachidonoylglycerol 5-HT Sérotonine
I/ GÉNÉRALITÉS SUR LA NEUROTRANSMISSION
Dans le système nerveux central (SNC), il existe différents types de populations cellulaires. Parmis les cellules cérébrales, on trouve des cellules capables de transmettre des signaux électrochimiques appelées neurones.
Les neurones sont constitués d’un corps cellulaire (ou soma) duquel se détachent des dendrites, et d’un axone. Les neurones sont des cellules spécialisées dans la communication. Cette communication entre neurones peut se faire de façon chimique ou électrique. La transmission chimique a lieu au niveau de jonctions spécialisées entre la terminaison d’un axone et le dendrite d’un autre neurone formant ce que l’on appelle une synapse. Entre ces deux éléments pré et post synaptiques se trouve la fente synaptique (Figure 1).
La transmission électrique existe du fait que des courants électriques se propagent et parcourent les neurones du corps cellulaire à l’axone entraînant des modifications des propriétés électriques de la membrane plasmique.
La transmission chimique d’information passe par la libération d’un composé chimique dans la fente synaptique appelé neurotransmetteur (NT). Celui-ci, une fois libéré par le neurone, va se fixer à ses récepteurs sur le neurone cible entraînant une cascade d’évènements au sein de ce neurone receveur.
Autour de ces neurones et de la fente synaptique, les astrocytes appartenant à la famille des cellules gliales, jouent de nombreux rôles et en particulier, celui de tampon des effets de ces NT notamment par leur recapture.
Le glutamate (Glu) est un des acteurs clés de la neurotransmission. En effet, il s’agit du neurotransmetteur excitateur principal du SNC qui provoque une réponse excitatrice sous forme de potentiel électrique chez le neurone cible.
Figure 1: Schéma de l’organisation structurale d’un neurone faisant
synapse.
L’influx nerveux parcourt le neurone du corps cellulaire à la terminaison de l’axone où il fait synapse au niveau des dendrites du neurone cible. Les astrocytes environnant s’assurent de la qualité de la transmission nerveuse. (D’après Regenerative Medicine, Department of Health and
Human Services, August 2006. Image par Terese Winslow)
Astrocyte Influx nerveux
II/ LE SYSTÈME GLUTAMATERGIQUE
II.1/ LE GLUTAMATE
II.1.a) À la découverte du glutamate …
Le glutamate (forme anionique de l’acide glutamique) est un acide aminé composé de deux groupes carboxyles –COOH et d’une fonction amine -NH2 (Figure 2).
Bien qu’étant un acide aminé non essentiel pour l’Homme car il peut être fabriqué par l’organisme via d’autres précurseurs endogènes, le glutamate est l’acide aminé le plus présent dans l’alimentation humaine.
En effet, en 1908 le scientifique japonais Ikeda a cherché à identifier le composé présent dans les algues (famille des Laminariaceae) donnant ce goût si particulier aux soupes japonaises. De ces algues, il isola le glutamate à qui il attribua le nom de saveur « umami » (savoureux). Aujourd’hui, cette saveur est reconnue comme étant le cinquième goût.
Figure 2: Structure chimique de la forme anionique de l’acide
glutamique (glutamate).
Figure 3: Le glutamate dans la distribution alimentaire de nos jours.
Sac de 450g de glutamate monosodique commerciale (à gauche). Le glutamate comme additif alimentaire, présent dans de nombreux produits de consommation quotidiens (à droite).
Le glutamate est largement utilisé comme exhausteur de goût dans les préparations alimentaires sous le code E620. Cet additif alimentaire peut également être abondamment trouvé sous la forme de glutamate monosodique (E621) (Figure 3).
Ce dernier a été synthétisé chimiquement par Ikeda et Suzuki à des fins industrielles et commerciales. De nos jours, la production mondiale de glutamate est estimée à 2 millions de tonnes par an (Figure 3) (Sano, 2009).
II.1.b) Un acteur clé du métabolisme
Le glutamate est largement répandu dans l’organisme où il est présent à des concentrations différentes selon les compartiments cellulaires. En effet, sa concentration plasmatique est comprise entre 30 et 100 M. Dans les organes périphériques, on le retrouve à
une concentration de 5000 M dans les muscles squelettiques, tandis que dans le cytoplasme
des érythrocytes, sa concentration est de 500 M.Dans le cerveau, sa concentration globale est de 10 mM. La présence de glutamate circulant dans le liquide céphalorachidien est relativement faible (< 1 M) par rapport à sa concentration dans les vésicules synaptiques (VS) à hauteur de
100 mM (Filho et al., 1999; Meldrum, 2000; Small and Tauskela, 2005).
A travers sa distribution, le glutamate est impliqué dans différentes voies fonctionnelles (Figure 4) et joue notamment un rôle central dans le métabolisme cellulaire (Krebs, 1935; Owen et al., 2002). En effet, il participe à plusieurs réactions métaboliques comme la synthèse des protéines, la détoxification de l’ammoniaque et le cycle de l’urée (Frigerio et al., 2008; Nissim, 1999; Owen et al., 2002; Weil-Malherbe, 1950).
Le glutamate apparaît aussi comme un précurseur majeur du cycle de Krebs (Owen et al., 2002). En effet, dans les muscles squelettiques par exemple, il est utilisé comme précurseur anaplérotique afin d’augmenter l’efficacité du métabolisme oxydatif dans le cycle de Krebs (Owen et al., 2002; Rennie et al., 2001). Il agit également comme précurseur pour permettre la formation de petite molécule telle que le glutathion (Meister et al., 1979).
De plus, le glutamate peut intervenir en tant que messager intracellulaire dans les organes et tissus périphériques. En effet, dans les cellules pancréatiques, le glutamate agit dans la régulation de la sécrétion d’insuline suite à une augmentation de glucose (Maechler and
Wollheim, 1999). Il peut également inhiber la synthèse de mélatonine dans l’épiphyse suite à la réception d’un signal cholinergique (Moriyama et al., 2000).
Figure 4 : Schéma des principales voies fonctionnelles impliquant le glutamate.
Le glutamate est au centre de nombreuses réactions métaboliques. Différents enzymes participent à la synthèse et à la dégradation du glutamate comme la glutamate dehydrogenase (GDH), l’alanine aminotransferase (ALAT) et l’aspartate aminotransferase (ASAT). (D’après Frigerio et al., 2008).
Dans le SNC, deux fonctions additionnelles majeures sont associées au glutamate. Celui-ci joue le rôle de NT excitateur dans le SNC chez les mammifères (Schwartz, 2000; Fonnum, 1984; Hackett and Ueda, 2015). D’autre part, il sert d’intermédiaire métabolique de l’acide gamma-aminobutyrique (GABA) qui est le principal NT inhibiteur (Roberts and Frankel, 1950).
II.1.c) La fonction particulière de NT
Le rôle excitateur du glutamate a tout d’abord été découvert à travers son aspect excitotoxique dans les années 1950 par le scientifique Hayashi. En effet, il a observé que des injections à forte concentration de glutamate de sodium dans la matière grise du cortex moteur entraînaient des convulsions de type épileptique chez le chien, le singe et l’homme (Hayashi, 1954).
Aujourd’hui, on sait qu’un excès de glutamate dans le milieu extracellulaire entraîne une hyperstimulation des neurones induisant leur mort (Meldrum, 2000; Meldrum and
Garthwaite, 1990). Cet excès est impliqué dans certaines pathologies comme l’épilepsie, la sclérose amyotrophique latérale, les accidents vasculaires cérébraux et des formes d’amnésie (Meldrum, 2000). C’est pourquoi il est important de maintenir une concentration extracellulaire du glutamate sous le seuil d’excitotoxicité afin de préserver l’homéostasie du cerveau. La concentration intracellulaire de glutamate est particulièrement élevée (1-10 mM) par rapport à la concentration en glutamate dans la fente synaptique (1 M). Des processus de régulation interviennent donc suite à la libération du glutamate dans la fente synaptique comme sa recapture rapide par les astrocytes (Meldrum, 2000). Des propriétés protectrices comme l’imperméabilité de la barrière hémato-encéphalique au passage du glutamate de la circulation générale au cerveau permettent aussi la préservation du bon fonctionnement cérébral (Smith, 2000).
À la suite de ces travaux, Curtis et ses collaborateurs ont mis en évidence que le glutamate a un effet excitateur et dépolarisant sur les neurones de la moelle épinière. Ils découvrent ainsi que le glutamate présente des caractéristiques communes avec celles définissant les NT excitateurs (Curtis et al., 1960).
Trente ans plus tard, le rôle du glutamate en tant que principal NT excitateur est confirmé car il remplit les différents critères qui s’y rapportent (Schwartz, 2000; Fonnum, 1984; Hackett and Ueda, 2015) :
- Il est synthétisé dans des neurones spécifiques car il ne franchit pas la barrière hémato-encéphalique
- Il est stocké au niveau des terminaisons présynaptiques dans les VS
- Il est libéré dans la fente synaptique en réponse à des stimuli physiologiques sous forme de potentiel d’action (PA) présynaptique de façon dépendante des ions calciums et en quantité suffisante pour induire une réponse de l’élément postsynaptique
- Il existe des récepteurs spécifiques reconnaissant le glutamate à la synapse
- Le glutamate libéré est rapidement éliminé de la fente synaptique à l’aide de mécanismes de recapture, et notamment par les transporteurs (EAATs).
Le glutamate est un élément clé de la transmission excitatrice neuronale notamment à travers son rôle au sein de la synapse glutamatergique.
II.2/ LA SYNAPSE GLUTAMATERGIQUE
II.2.a) Organisation structurelle de la synapse glutamatergique
La transmission neuronale des informations chez les mammifères se fait à travers la zone de contact fonctionnelle qui s’établit entre deux neurones que l’on appelle synapse (Figure 5). La synapse est constituée de trois compartiments : le bouton présynaptique, la fente synaptique et l’élément postsynaptique (Gray, 1959; Sheng and Hoogenraad, 2007).
Dans le bouton présynaptique, les VS stockent le glutamate à l’aide de transporteurs vésiculaires du glutamate, les VGLUTs. Une partie de ces vésicules vont être arrimées à la membrane plasmique du bouton présynaptique dans la zone active (ZA). C’est dans cette zone que le processus d’exocytose va avoir lieu aboutissant à la libération du glutamate dans la fente synaptique (Storm-Mathisen and Ottersen, 1990; Südhof and Rizo, 2011).
Une zone dense aux électrons apparaît au niveau de la membrane de l’élément postsynaptique. Cette zone est appelée densité postsynaptique (PSD). Elle caractérise les synapses glutamatergiques. On y retrouve une forte concentration en protéines de signalisation et structurale (Kim and Ryan, 2009; Sheng and Kim, 2011). En effet, de nombreux récepteurs au glutamate s’y trouvent.
Figure 5: Organisation structurelle d’une synapse excitatrice en
microscopie électronique.
Le bouton pré-synaptique contient les VS (SV) stockant les NT. Ces derniers vont être libérés dans la fente synaptique qui sépare l’élément présynaptique du PSD se trouvant au niveau du dendrite du neurone
postsynaptique.
Cette zone dense aux électrons joue un rôle important dans la transduction du signal et la plasticité synaptique. La fente synaptique sépare les éléments pré- et postsynaptiques d’une distance comprise entre 15 et 25 nm. Sa largeur est de 30 nm (Zuber et al., 2005).
L’intégrité de la synapse est préservée à l’aide de molécules d’adhésion synaptique (neuroligines/neurexines, cadhérines, éphrines et récepteurs éphrines et synCAM) qui interagissent avec des protéines d’échafaudage intracellulaires. Ces interactions sont également essentielles pour le fonctionnement de la machinerie synaptique dans la PSD (Chua et al., 2010; Gray, 1969; Hruska and Dalva, 2012).
II.2.b) La neurotransmission glutamatergique
Le fonctionnement de la synapse glutamatergique passe par la transduction successive d’un signal électrique en signal chimique liée à la libération du NT. Dans le neurone postsynaptique, ce signal chimique est converti en signal électrique suite à l’activation des récepteurs postsynaptiques par le glutamate (Kandel et al., 2000)).
En effet, suite à l’arrivée d’un PA entraînant une entrée de calcium dans le neurone présynaptique, les vésicules libèrent leur contenu en glutamate dans la fente synaptique par exocytose au niveau de la ZA. Le glutamate, une fois libéré, va interagir avec ses récepteurs au niveau de l’élément postsynaptique, conduisant à une réponse de ce dernier sous forme de potentiel postsynaptique excitateur (EPSP).
Différents récepteurs du glutamate existent au niveau de l’élément postsynaptique : - Les récepteurs ionotropiques : AMPA, NMDA, Kainate
- Les récepteurs métabotropiques : mGluR1-8.
Pour rétablir une concentration physiologique, le glutamate résiduel présent dans la fente synaptique a deux devenir principaux :
- Il est recapté par diffusion simple dans les synapses (Danbolt, 2001)
- Il est recapté par les Transporteurs des Acides Aminés Excitateurs (EAAT) présents sur les membranes des cellules environnantes (Anderson and Swanson, 2000; Danbolt, 2001; Erecińska and Silver, 1990; Logan and Snyder, 1972).
La recapture du glutamate se fait essentiellement par les astrocytes via les transporteurs EAAT1 et EAAT2. Elle peut également être réalisée par les neurones à l’aide de EAAT3 et EAAT4.
Dans l’astrocyte, le glutamate est converti en alpha-cétoglutarate par la glutamate déshydrogénase ou par une transaminase afin d’intégrer par la suite le cycle de Krebs. Il peut également être transformé en glutamine par la glutamine synthétase ATP-dépendante (GS) (Erecińska and Silver, 1990; Laake et al., 1995; Marcaggi and Coles, 2001). La glutamine est ensuite libérée dans l’espace extracellulaire avant d’être captée par les terminaisons axonales où elle est transformée en glutamate par une enzyme mitochondriale, la glutaminase activée par le phosphate (GLS1 ou PAG pour phosphate-activated glutaminase) (Erecińska and Silver, 1990).
La glutamine est essentielle à la formation du glutamate neuronale et au bon fonctionnement de la synapse glutamatergique. Ce processus est appelé le cycle glutamine-glutamate (Figure 6) (Bak et al., 2006; Van den Berg and Garfinkel, 1971).
Figure 6 : Schéma du cycle glutamine-glutamate.
Le glutamate (Glu) libéré dans la fente synaptique par exocytose et capté par l’astrocyte pour être transformé en glutamine (Gln). La Gln est ensuite libéré par l’astrocyte pour être recapté par le neurone. La Gln va alors être convertit en Glu par la mitochondrie neuronale. Le Glu peut être transformé en alpha-cétoglutarate pour intégrer le cycle de Krebs dans le neurone comme dans l’astrocyte. (D’après Back et al., 2006)
Ainsi, la synapse glutamatergique ne fait pas intervenir seulement les neurones qui se transmettent les informations électriques et chimiques, mais sollicite également les cellules gliales comme les astrocytes afin de maintenir une communication neuronale efficace dans le SNC (Figure 7).
Au sein de cette synapse, une large variété d’acteurs intervient dont notamment des facteurs interagissant directement avec le glutamate comme les récepteurs du glutamate ou encore les transporteurs du glutamate.
Figure 7: Schéma d’une synapse glutamatergique.
Le glutamate synthétisé dans le neurone présynaptique est accumulé dans les VS à l’aide des transporteurs vésiculaires du glutamate (VGLUTs). Une fois libéré dans la fente synaptique, il active ses récepteurs présents sur le neurone post-synaptique. La transmission excitatrice s’achève lorsque le glutamate est recapturé par les astrocytes et les neurones via les transporteurs plasmiques (EAATs).
II.2.c) Les acteurs majeurs de la transmission glutamatergique
II.2.c.i) Les récepteurs du glutamate
La transmission neuronale du signal glutamatergique est possible par la liaison du glutamate sur des récepteurs spécifiques. Il en existe deux catégories :
- Les récepteurs ionotropiques (iGluR) ou récepteurs-canaux qui permettent une transmission synaptique excitatrice rapide
- Les récepteurs métabotropiques (mGluRs) couplés à des protéines G faisant intervenir des seconds messagers. Ces récepteurs permettent au glutamate d’exercer un rôle modulateur, et notamment un effet inhibiteur.
➢ Les récepteurs ionotropiques
Les récepteurs ionotropiques sont des récepteurs-canaux. Ils sont exprimés dans environ 70% des synapses du cerveau des mammifères ce qui en fait les récepteurs les plus abondants du SNC (Bekkers and Stevens, 1989). Quatre sous-groupes de iGluRs ont été définis à partir de la séquence de leurs sous-unités et de leurs affinités pharmacologiques pour des ligands de synthèse. La première classification de ces récepteurs a été réalisée selon leur agoniste le plus sélectif (Tableau 1).
Les récepteurs AMPA sont des hétérotétramères formés de quatre unités. Les sous-unités existantes sont nommées GluR1-4. Les ligands de ces récepteurs sont le glutamate et l’acide alpha-amino-3-hydroxy-5-Methyl-4-isoxazole Propionique connu sous le nom de AMPA. La fixation du glutamate sur les quatre sites de liaison du récepteur AMPA entraîne à elle seule l’activation de ce dernier. Cette activation se traduit par l’ouverture rapide du canal ionique permettant l’entrée de sodium et de potassium, et la dépolarisation de la membrane plasmique (Ozawa et al., 1998; Pinheiro and Mulle, 2008). La désensibilisation du récepteur est également rapide ce qui conduit à une perte d’activité (Armstrong et al., 2006). Les récepteurs AMPA s’activent plus rapidement que les récepteurs NMDA et précèdent généralement l’activation de ces derniers. La présence des récepteurs AMPA à la membrane plasmique au niveau de la PSD est régulée et dépend notamment de leur mobilité. En effet, ces récepteurs sont capables de se déplacer de quelques microns par seconde. Cette propriété s’inscrit au sein d’un mécanisme permettant de moduler l’intensité de la transmission
synaptique (Anggono and Huganir, 2012; Choquet and Triller, 2013; Gielen, 2010; Heine et al., 2008).
Les récepteurs NMDA sont aussi des tétramères, formés de deux sous unités GluN1 et généralement de deux sous unités GluN2. Il existe sept sous-unités différentes permettant de former les récepteurs NMDA. Ces récepteurs sont activés par le L-glutamate, le L-aspartate et le N-méthyl-D-aspartate (NMDA). Toutefois, la simple liaison du ligand au récepteur n’est pas suffisante pour déclencher l’activation du récepteur. En effet, à l’état basal, le magnésium (Mg2+) bloque le passage des cations par sa fixation au milieu du canal ionique. La
dépolarisation de la membrane est nécessaire pour déplacer le Mg2+ et libérer ainsi le canal. De
plus, pour pouvoir être effectif et permettre la transmission de l’influx nerveux, la liaison du glutamate au récepteur doit être associée à celle d’un co-activateur, la glycine sur son propre site sur le récepteur NMDA. Une fois ces conditions respectées, la fixation du glutamate peut alors entraîner une entrée massive de calcium augmentant davantage la dépolarisation de la membrane (Köhr, 2006; Ozawa et al., 1998). La réponse permise par les récepteurs NMDA est lente et cinétiquement plus étendue que celle induite par les récepteurs AMPA. Elle joue un rôle central dans la plasticité synaptique (Casado et al., 2002; Daoudal and Debanne, 2003; Gielen, 2010; Lüscher and Malenka, 2012).
Les récepteurs Kaïnate sont des tétramères qui peuvent être constitués de cinq sous unités différentes (GluK1-5). Ils sont activés par le glutamate et par un composé extrait de l’algue rouge Digenea simplex, le kaïnate. Etant aussi des canaux perméables au sodium et au potassium, l’activation de ces récepteurs entraîne les mêmes évènements que ceux déclenchés par l’activation des récepteurs AMPA (Ozawa et al., 1998). Les récepteurs Kaïnate se trouvent au niveau de la membrane postsynaptique comme les autres récepteurs ionotropiques, mais également au niveau présynaptique où ils jouent le rôle d’autorécepteur régulant positivement la transmission glutamatergique (Gielen, 2010; Rodríguez-Moreno and Sihra, 2007).
Enfin, les récepteurs Delta appartiennent à la famille des iGluRs d’après leur séquence en acides aminés. Ils sont constitués de deux sous-unités différentes appelés delta 1 et delta 2 localisées dans des régions différentes du cerveau.
Delta 1 est exprimé dans les cellules ciliées internes du système auditif, les cellules bipolaires et le ganglion rétinien et dans l’organe vestibulaire (Jakobs et al., 2007; Safieddine and Wenthold, 1997; Schmid and Hollmann, 2008). Il est impliqué dans l’audition des hautes
fréquences et dans le maintien de l’homéostasie ionique dans la cochlée basale. Sa délétion entraîne un comportement émotionnel et social anormal chez la souris (Yadav et al., 2012). Delta 2 quant à lui est essentiellement présent dans les cellules de Purkinje dans le cervelet. La délétion de delta 2 chez les souris engendre une ataxie et une altération de la plasticité synaptique, de la synaptogénèse des cellules de Purkinje, de l’apprentissage moteur et de la coordination (Wang et al., 2003; Yuzaki, 2004). Aucun ligand endogène de ces récepteurs n’est connu à ce jour et les agonistes des autres iGluRs n’activent pas les sous unités Delta.
➢ Les récepteurs métabotropiques
Les récepteurs métabotropiques ou mGluRs appartiennent à la famille des récepteurs à sept domaines transmembranaires couplés aux protéines G (Nicoletti et al., 2011). Huit sous-types de mGluRs sont identifiés et classés en trois groupes selon leurs homologies de séquence (70% d’homologie dans un groupe, 40% d’homologie intergroupe), leurs pharmacologies, et les voies de transductions auxquelles ils sont associés (Conn and Pin, 1997; Nakanishi, 1992). Les trois groupes sont composés de :
- Groupe I : mGluR1 et mGluR5 - Groupe II : mGluR2 et mGluR3
- Groupe III : mGluR4, mGluR6, mGluR7, et mGluR8.
D’un point de vue fonctionnel, l’activation de ces récepteurs induit l’intervention de seconds messagers tel que l’AMP-cyclique (AMPc) ou l’inositol-3-phosphate (IP-3) impliqués dans des voies cellulaires différentes. La cinétique d’activation et de propagation du signal est plus lente chez les mGluRs que chez les iGluRs.
Les récepteurs du groupe I sont couplés à la protéine Gq /G11 entraînant l’activation de la phospholipase C (PLC) qui clive le phosphatidylinositol-4,5-diphosphate (PIP2) en IP3 et en DiAcylGlycérol (DAG). L’IP3 va permettre la libération du calcium du réticulum endoplasmique lisse et le DAG va activer la protéine kinase C (PKC). Les récepteurs des groupes II et III utilisent quant à eux la voie impliquant l’AMPc. En effet, ils sont couplés à la protéine Gi/Go qui inhibe l’adénylate cyclase (AC), enzyme catalysant la réaction d’ATP en AMPc. Ainsi, par cette inhibition, la concentration en AMPc intracellulaire diminue tout comme celle du calcium. (Tableau 1) (Ferraguti and Shigemoto, 2006; Kew and Kemp, 2005).
Tableau 1: Classification, propriétés et voies de signalisations des récepteurs ionotropiques et métabotropiques du glutamate.
Récepteur Sous unités Protéine G Voies impliquées / Propriétés
Recepteurs Ionotropiques : récepteurs-canaux
Activation relativement rapide
AMPA NMDA Kainate Delta GluR1-4 GluN1, 2A-D, GluN3A-B GluK1-5 Delta 1-2 - - - -
ouverture rapide du canal entrée de Na+ et K+
dépolarisation rapide de la membrane
co-activateur glycine
Mg2+ bloque le canal à l‘état basal
entrée massive de calcium
réponse lente et cinétiquement plus étendue
important dans la plasticité synaptique
ouverture rapide du canal entrée de Na+ et K+
dépolarisation rapide de la membrane
Présent dans le SNC et SNP Rôle du canal ionique à déterminer
Récepteurs Métabotropiques : Couplés aux protéines G
Cinétique d’activation plus lente
Groupe I mGluR1 mGluR5 - Gq /G11 Activation de PLC IP3 DAG Ca2+ Activation de PKC Groupe II mGluR2 mGluR3 - Gi/Go Inhibition de AC AMPc Ca2+ Groupe III mGluR4 mGluR6 mGluR7 mGluR8 - Gi/Go Inhibition de AC AMPc Ca2+
II.2.c.ii) Les transporteurs du glutamate
Il existe deux types de transporteurs du glutamate :
- Les transporteurs des Acides Aminés Excitateurs (EAATs) qui sont des transporteurs localisés sur la membrane plasmique. Ils permettent d’éliminer rapidement le glutamate de la fente synaptique afin de réguler son activité et de prévenir son excitotoxicité - Les transporteurs vésiculaires du glutamate (VGLUTs) qui permettent l’accumulation
du glutamate dans les VS.
➢ Les transporteurs des Acides Aminés Excitateurs (EAATs)
Les transporteurs des Acides Aminés Excitateurs ou EAATs appartiennent à la famille des SLC1 (SoLute Carrier). Cinq transporteurs différents ont été identifiés et appelés EAAT1-5. Ils présentent 50 à 60 % d’homologie (Seal and Amara, 1999). Ces transporteurs sont exprimés par les neurones et les cellules gliales et sont des acteurs majeurs de la transmission glutamatergique. En effet, le rôle essentiel de ces transporteurs est l’élimination du glutamate de la fente synaptique qui s’accompagne d’un cotransport d’ions sodium et hydrogène et d’un antiport de potassium (Kanai and Hediger, 2004). A travers la recapture du glutamate, les EAAT contrôlent ainsi la durée et l’étendue du message glutamatergique et permettent de protéger les neurones de l’action excitotoxique du glutamate.
De plus, ces transporteurs ont une localisation différentielle au sein du SNC. Les EAAT1-3 sont les plus abondants. EAAT1 et EAAT2 sont présents dans les astrocytes alors que EAAT3 et EAAT4 sont des transporteurs neuronaux (Furuta et al., 1997; Perego et al., 2000) (Figure 8). On retrouve également les EAAT1-3 et -5 dans les tissus périphériques. EAAT5 est aussi présent au niveau des bâtonnets et des cellules bipolaires de la rétine (Eliasof et al., 1998; Gegelashvili and Schousboe, 1998).
➢ Les transporteurs vésiculaires du glutamate (VGLUTs)
Au sein du neurone, le glutamate est internalisé dans des VS à l’aide de transporteurs particuliers, les transporteurs vésiculaires du glutamate nommés VGLUTs identifiés dans les années 2000. Il existe trois sous types de transporteurs : VGLUT1, VGLUT2 et VGLUT3. VGLUT1 et VGLUT2 définissent les neurones glutamatergiques à l’instar de leur homologue VGLUT3 (El Mestikawy et al., 2011).
Figure 8 : Schéma de la distribution des transporteurs plasmiques du glutamate (EAATs) autour de synapses et proche d’un vaisseau sanguin dans l’hippocampe.
Quatre terminaisons glutamatergiques (T) sont représentées formant des synapses au niveau d’épines dendritiques (S). Les astrocytes (G) sont autour de ces neurones. EAAT1 (bleu) et EAAT2 (rouge) sont exprimés sur les astrocytes, alors que EAAT3 (vert) est présent sur les neurones. (D’après Zhou et al., 2014)
II.3/ LES TRANSPORTEURS VÉSICULAIRES DU GLUTAMATE
II.3.a) Les différentes familles de transporteurs vésiculaires
La transmission chimique nécessite l’accumulation des NT dans les VS. Cette étape est permise par les transporteurs vésiculaires.
Les transporteurs vésiculaires sont membres d’une famille de protéines membranaires de transport appelée Solute Carriers (SLC) composée de 300 protéines organisées en 51 catégories (Hediger et al., 2013). Aujourd’hui, treize transporteurs vésiculaires sont identifiés et classés en trois groupes (SLC17, SLC18, SLC32) d’après leur substrat et leur similarité de séquence (Omote et al., 2011).
Les transporteurs du groupe SLC17 permettent l’accumulation vésiculaire de NT anioniques (Reimer, 2013). Neuf membres ont été identifiés :
- Les gènes SLC17A1-4 codent les transporteurs phosphate sodium-dépendant connus respectivement sous les noms de NPT1, NPT2, NPT3 et NPT4. Ces transporteurs sont
impliqués dans le transport d’anions organiques pour l’élimination rénale des xénobiotiques (Reimer, 2013).
- Le transporteur vésiculaire des acides aminés excitateurs (VEAAT) est codé par le gène SLC17A5 (Miyaji et al., 2008). Il s’agit d’un cotransporteur d’H+ et d’acide sialique lysosomal (Miyaji et al., 2008; Verheijen et al., 1999). Il a été également montré qu’il participait au transport du glutamate et de l’aspartate en tant que NT (Miyaji et al., 2011). Toutefois le rôle de l’aspartate comme NT est encore controversé (Herring et al., 2015).
- Les gènes SLC17A6-8 codent les transporteurs vésiculaires du glutamate, les VGLUT1-3 (El Mestikawy et al., 2011a; Takamori et al., 2000).
- Enfin, le transporteur vésiculaire de nucléotide VNUT codé par le gène SLC17A9 permet l’entrée d’ATP dans les vésicules synaptiques car l’ATP est considérée comme un NT de la signalisation purinergique (Nishida et al., 2014; Sawada et al., 2008).
Les membres du groupe SLC18 interviennent dans le transport de NT cationiques comme les monoamines (sérotonine, dopamine, noradrénaline, adrénaline et histamine) et l’acétylcholine (Reimer, 2013). Il existe trois membres au sein de ce groupe :
- Le transporteur vésiculaire de monoamine de type 1, VMAT1, codé par le gène SLC18A1 permet l’accumulation de monoamines. Il est exprimé dans les cellules endocrines périphériques des glandes surrénales.
- Le transporteur vésiculaire de monoamine de type 2 nommé VMAT2 et codé par le gène SLC18A2 intervient également dans le transport des monoamines. Toutefois, sa distribution diffère de celle de VMAT1. En effet, VMAT2 est retrouvé dans les neurones aminergiques du SNC.
- Enfin, un transporteur vésiculaire de l’acétylcholine appelé VAChT est codé par le gène SLC18A3.
Le dernier groupe répertorié est celui des SLC32 (gène SLC32A1) impliqué dans l’accumulation de composés électriquement neutres comme le GABA ou la glycine (Reimer, 2013). Le seul transporteur connu à l’heure actuelle est identifié sous le nom de transporteur vésiculaire d’amino-acides inhibiteurs (VGAT ou VIAAT) (McIntire et al., 1997; Sagné et al., 1997). L’entrée de GABA ou de glycine nécessite un cotransport d’ions Cl- (Juge et al., 2009).
D’autre part, du fait des forces motrices et des modes de régulation propres à ces trois catégories de transporteurs, une autre classification s’est ajoutée. En effet, les transporteurs
SLC17 et SLC18 appartiennent à la super famille des Major Facilitator Super Families ou MFS. Cette super famille regroupe tous les transporteurs actifs secondaires, soit plus de 3600 protéines et est répandue dans l’ensemble du vivant (Reddy et al., 2012). Quant aux SLC32, ils sont membres de la super famille des Amino acid/Polyamine/organocation ou APC (Wong et al., 2012).
D’un point de vue fonctionnel, les transporteurs vésiculaires sont des transporteurs secondaires. Ces transporteurs sont capables d’accumuler les NT dans les VS en utilisant l’énergie générée par un gradient de proton créé par la pompe ATPase vacuolaire (V-ATPase). L’énergie issue de l’hydrolyse de l’ATP en ADP entraîne l’entrée des ions H+ dans les VS
conduisant à la formation d’un gradient électrochimique (H+). Le gradient électrochimique
créé est composé d’un gradient de pH (pH) dû à l’acidification des VS, et d’un gradient électrique () lié à l’entrée des charges positives dans la vésicule synaptique. L’activité des transporteurs dépend de ce gradient électrochimique qui peut être modulé par la perméabilité aux ions Cl- de la vésicule synaptique (Figure 9).
Les transporteurs vésiculaires sont considérés comme des acteurs déterminant la quantité de NT accumulés dans les VS. Ainsi, la modification du nombre et de l’activité de ces transporteurs joue un rôle essentiel dans la modulation de la neurotransmission (Daniels et al., 2004, 2011; Edwards, 2007; Moechars et al., 2006; Song et al., 1997; Williams, 1997; Wojcik et al., 2004). Cependant, cette affirmation ne semble pas totalement fondée en ce qui concerne les VGLUTs (Ramet et al., 2017).
Figure 9 : Représentation schématique d’une vésicule synaptique glutamatergique.
La pompe V-ATPase va permettre l’entrée de protons H+ grâce à l’hydrolyse de l’ATP en ADP. L’acidification de la vésicule va alors favoriser l’entrée du glutamate dans la vésicule synaptique.
II.3.b) La découverte des VGLUTs
Les transporteurs vésiculaires du glutamate appartiennent à la famille SLC17. Ces transporteurs jouent un rôle primordial dans la transmission de l’information excitatrice (Fonnum, 1984). Trois VGLUTs sont identifiés à l’heure actuelle (El Mestikawy et al., 2011).
La première étude réalisée sur ces transporteurs vésiculaires date de 1994. En effet, Ni et ses collaborateurs ont isolé une protéine localisée spécifiquement dans le cerveau partageant une séquence similaire aux transporteurs de phosphate inorganique dépendant du sodium. Cette protéine fut dans un premier temps appelée BNPI pour brain-specific Na+-dependent inorganic phosphate co-transporter (Ni et al., 1994).
Six ans plus tard, deux études indépendantes ont mis en évidence que le BNPI était en fait un transporteur vésiculaire du glutamate. En effet, la transfection de cette protéine dans des neurones GABAergiques leur conférait la capacité de libérer du glutamate (Takamori et al., 2000). De plus, Bellochio et ses collaborateurs ont rapporté que le BNPI était capable de transporter le glutamate à l’intérieur des VS (Bellocchio et al., 1998, 2000). Ces deux études confirment le rôle de BNPI dans le transport vésiculaire du glutamate et le renomment VGLUT1.
Parallèlement, la même année 2000, un autre transporteur de phosphate inorganique dépendant du sodium a été découvert et appelé DNPI (differentiation-associated Na+ -dependent inorganic phosphate co-transporter) (Aihara et al., 2000). En 2001, cinq groupes de
recherche différents ont mis en évidence que le DNPI contribuait au transport vésiculaire de glutamate. Le DNPI a alors été renommé VGLUT2 (Bai, 2001; Fremeau et al., 2001; Herzog et al., 2001; Takamori et al., 2001; Varoqui et al., 2002).
Un troisième transporteur vésiculaire du glutamate a été identifié en 2002 et nommé VGLUT3. VGLUT3 partage toutes les caractéristiques structurales et fonctionnelles des deux autres sous-types de VGLUTs (Fremeau et al., 2002; Gras et al., 2002; Schäfer et al., 2002; Takamori et al., 2002). Toutefois, sa distribution au sein du cerveau est surprenante. En effet, alors que VGLUT1 et VGLUT2 sont des marqueurs des neurones glutamatergiques, VGLUT3 est exprimé par des neurones qui utilisent un autre NT que le glutamate (Gras et al., 2002). Cette propriété laissait présager un rôle atypique de VGLUT3 (Gras et al., 2002; Herzog et al., 2001).
II.3.c) La structure des VGLUTs
Les trois VGLUTs présentent un fort degré d’identité de leur séquence protéique, proche de 70% au sein d’une même espèce (Gras et al., 2002). Les régions présentant une forte homologie sont les domaines transmembranaires des VGLUTs (environ 90% d’homologie). En revanche, les régions N- et C- terminales présentent une variation de séquence plus importante (respectivement 17% et 2% d’homologie). Ce sont ces régions terminales qui pourraient confèrer aux VGLUTs des propriétés fonctionnelles différentes (Vinatier et al., 2006) (Figure 10).
Figure 10 : Alignement des séquences d’acides aminés de VGLUT1, VGLUT2 et VGLUT3 chez le rat.
Les lettres surlignées en noir indiquent les résidus identiques. Les régions centrales sont hautement conservées par rapport aux régions périphériques présentant plus de varions de séquences. (D’après Gras et al., 2002)
Les gènes codant les VGLUTs serait conservés au cours de l’évolution. En effet, différents isoformes des VGLUTs ont été identifiés dans diverses branches de l’arbre phylogénétique, à savoir chez la drosophile (Daniels et al., 2004), le poisson zèbre (Higashijima et al., 2004a, 2004b), la grenouille (Gleason et al., 2003), ou encore le nématode Caenorhabditis
La structure tridimensionnelle des VGLUTs est à ce jour mal connue. Toutefois, la structure cristallographique du transporteur du glycerol-3-phosphate (GlpT) de la bactérie
Escherichia Coli, un lointain orthologue bactérien des VGLUTs, permettrait d’établir un
modèle prédictif de la structure 3D des VGLUTs (Huang et al., 2003). D’après l’étude d’Almqvist et ses collaborateurs, les VGLUTs seraient composés de 12 domaines transmembranaires.
Les domaines hydrophobes seraient organisés en deux groupes symétriques de six hélices transmembranaires chacun, reliés par une longue boucle cytoplasmique (Almqvist et al., 2007). Ce modèle putatif conférerait une conformation intra-vésiculaire close, alors que la région intra-cytoplasmique serait accessible à l’eau et à d’autres substrats (Figure 12).
Figure 11: Arbre phylogénétique illustrant la conservation du gène codant les VGLUTs au cours de l’évolution.
Figure 12 : Modèle 3D de la structure de VGLUT1 humain obtenue par homologie avec GlpT, un transporteur bactérien.
A) Topologie 2D proposée de VGLUT1 avec 12 domaines transmembranaires (colorés). B) Représentation en 3D des hélices transmembranaires depuis le cytoplasme. Les groupes d’hélices 1 à 6 et 7 à 12 seraient disposés de façon symétrique. C) Le pore (volume gris) est ouvert du coté cytoplasmique.(D’après Almqvist et al., 2007)
II.3.d) Propriétés biochimiques et pharmacologiques des VGLUTs
Les transporteurs vésiculaires du glutamate présentent des caractéristiques spécifiques pour l’accumulation de glutamate dans les VS.
En effet, ces transporteurs ont une affinité pour le glutamate de l’ordre du millimolaire (Km 1 à 5 mM) ce qui est relativement faible par rapport à celle d’autres transporteurs comme les EAATs (Km environ 4-40 M) (Reimer et al., 2001). Malgré cette faible affinité, les VGLUTs transportent spécifiquement le glutamate. Ils sont incapables de transporter le GABA,
la glutamine, l’aspartate ou tout autre NT. Les VGLUTs sont les seuls membres de la famille des SLC17 à présenter une pareille sélectivité pour leurs substrats.
Comme les autres transporteurs vésiculaires, l’activité des VGLUTs dépend de l’existence du gradient de proton. Toutefois, leur dépendance vis à vis du gradient électrochimique porte essentiellement sur la composante électrique contrairement aux transporteurs VMATs et VAChTs dont l’activité dépend davantage de la différence de pH (Maycox et al., 1988; Naito and Ueda, 1985).
Une autre caractéristique importante concernant le transport de glutamate par les VGLUTs est la dépendance biphasique au chlore extra-vésiculaire. Cette propriété a été mise en évidence à l’aide de préparations de VS ou de membranes contenant des VGLUTs hétérologues (Bellocchio et al., 2000; Maycox et al., 1988; Naito and Ueda, 1985; Bai, 2001). En effet, l’activité des VGLUTs est modulée par la concentration en ions chlore à l’extérieur des VS. Il semblerait que le chlore permette une activation allostérique des VGLUTs lorsqu’il est présent à faible concentration (entre 1 et 4 mM). En revanche, à forte concentration (au-dessus de 10 mM), le chlore inhibe les VGLUTs tout comme lorsqu’il est totalement absent (Miyaji et al., 2011).
Lors de leur découverte, les VGLUTs ont été tout d’abord définis comme des transporteurs de phosphate inorganique dépendant du sodium. Ainsi, d’après certains auteurs, il existerait un double transport faisant intervenir des acteurs différents :
- Le transport du glutamate dépendant du gradient électrique et de la concentration extra-vésiculaire de chlore
- Le transport de phosphate inorganique dépendant des ions sodium.
D’autre part, bien qu’ayant un rôle essentiel dans la transmission glutamatergique, très peu d’agents pharmacologiques ciblent efficacement les VGLUTs et aucun de ceux-ci n’est spécifique d’un sous-type de VGLUT. Cependant, le développement de composés pharmacologiques spécifiques des VGLUTs permettrait de mieux comprendre leurs implications fonctionnelles normales et pathologiques. Parmi ces composés agissant sur l’activité des VGLUTs, on trouve :
➢ Les agents inhibant les VGLUTs :
- Des inhibiteurs compétitifs des VGLUTs qui se lierait directement au site de transport: Il existe plusieurs analogues d’aminoacides. Les analogues les plus efficaces sont le (2S,4R)-4-méthylglutamate et le trans-ACPD qui rentrent directement en compétition avec le glutamate, laissant supposer que ces molécules reconnaissent le site de liaison du glutamate sur les VGLUTs (Winter and Ueda, 1993).
Les meilleurs inhibiteurs compétitifs connus des VGLUTs sont des colorants azoïques : le bleu Trypan et le bleu Evans (Fonnum et al., 1998; Roseth et al., 1995). Le Chicago Blue Sky agit de la même façon que le bleu Evans, mais il est moins efficace (Roseth et al., 1995).
Le brillant yellow bloque le transport vésiculaire de glutamate. Il s’agit d’un inhibiteur compétitif puissant spécifique des VGLUTs (Tamura et al., 2014).
- Il existe également un inhibiteur indirect naturel, le facteur protéique IPF qui peut inhiber la recapture du glutamate et du GABA (Tamura et al., 2001).
➢ Les composés agissant sur le gradient de protons :
Au sein des inhibiteurs non compétitifs, on trouve le rose bengale. Ce composé va se lier à des sites qui ne sont pas les sites actifs sur les VGLUTs pour inhiber leur activité de façon dose dépendante (Bole and Ueda, 2005).
Il existe des inhibiteurs des ATPases vacuolaires tel que le N-éthylmaléimide (NEM), ou la bafilomycine (Bowman et al., 1988).
Des ionophores à protons peuvent également moduler le gradient du proton, comme par exemple le Carbonyl Cyanide M-Chloro-Phényldrazone (CCCP).
Enfin, d’autres composés jouent sur l’entrée de chlore dans les VS tel que le 4,4’-diiothiocyanatostilbène-2,2’-disulfonique (DIDS) qui réduit l’activité des VGLUTs (Hartinger and Jahn, 1993).
II.3.e) Distribution anatomique de VGLUT1 et VGLUT2
Les transporteurs vésiculaires du glutamate VGLUT1 et VGLUT2 définissent les neurones glutamatergiques. Ils sont exprimés sur les VS localisées dans les terminaisons synaptiques (Bellocchio et al., 1998; Herzog et al., 2001; Kaneko et al., 2002). Ces deux isoformes ont une distribution quasi complémentaire dans le SNC chez le rongeur. Cependant,